靶向人IRAK1基因的小干扰RNA及其应用的制作方法
本发明涉及生物技术领域,具体地说,是靶向人IRAK1基因的小干扰RNA序列及其应用。
背景技术:
龋病(dental caries)是由口腔中多种因素复合作用所导致的牙体硬组织发生的慢性、进行性病损,其发病率高、人群分布广,是口腔的常见病和多发病之一。传统机械去龋法是目前临床上牙体治疗的主要方法,主要应用金刚砂钻头的切割作用去除龋坏组织,但应用中容易损伤健康牙体组织,并且钻头切割产生的热量和液体降温时对冷刺激容易激惹牙髓组织,造成不良预后。因此,寻找新的替代疗法,对于龋病的治疗具有重要的意义。
IRAK1(interleukin-1 receptor-associated kinase 1)是IRAK家族成员,通过其激酶活性和接头分子的作用,介导包括Toll样受体(Toll like receptor,TLR)信号通路在内的一系列信号转导,最终导致前炎症细胞因子等基因的表达,参与细胞内的信号网络调控和炎症反应。G-菌的LPS等组分通过激活TLR-MyD88-IRAK1活化NF-κB介导下游炎症因子释放,其下游分泌的TNF-α及RANKL为破骨因子,刺激破骨细胞分化、活化,导致骨诱裂的形成,与牙髓炎、牙周炎、龋齿等病理进程密切相关。
RNA干扰(RNA interference,RANi)是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的一种生物学现象,能特异干扰靶基因的表达。其作用机制是:核糖核酸酶III家族的Dicer酶,与dsRNA结合,将其剪切成21-25nt及3’端突出的小干扰RNA(Small interfering RNA,siRNA),随后siRNA与RNA诱导沉默复合物(RNA-induced silencing complex,RISC)结合,解旋成单链,活化的RISC受已成单链的siRNA引导,序列特异性地结合到靶信使RNA(mRNA)上并将其切断,引发靶mRNA的特异性分解,从而抑制相应基因表达。目前已成为一门独立的技术,作用靶点特异性高、对细胞毒性小、相对安全,引起生物医学界所有研究领域的广泛兴趣。
技术实现要素:
本发明的目的在于以最新的IRAK1基因序列为靶点,提供一种治疗龋病的新的特异性抑制人IRAK1基因表达的小干扰RNA序列及其应用。
本发明的第一方面,提供一种靶向人IRAK1基因的小干扰RNA的靶标基因,所述的靶标基因的核苷酸序列为5’-CCGAAGAAAGTGATGAATT-3’,如SEQ ID NO:1所示。
本发明的第二方面,提供一种靶向人IRAK1基因的小干扰RNA,由下述正义链和反义链组成:
正义链:5’-GCCCGAAGAAAGUGAUGAAUU-3’(SEQ ID NO:2);
反义链:5’-AAUUCAUCACUUUCUUCGGGC-3’(SEQ ID NO:3)。
本发明的第三方面,提供上述靶向人IRAK1基因的小干扰RNA的靶标基因在制备治疗龋病药物中的应用。
本发明的第四方面,提供上述靶向人IRAK1基因的小干扰RNA在制备治疗龋病药物中的应用。
所述的靶向人IRAK1基因的小干扰RNA特异性降低IRAK1的蛋白表达,抑制炎症的发展,促进牙髓干细胞的成牙本质分化。
本发明的第五方面,提供一种治疗龋病的药物组合物,所述的药物组合物包括上述靶向人IRAK1基因的小干扰RNA和药学上可接受的载体。
所述的药学上可接受的载体为药学上可接受的赋形剂,悬浮剂,填充剂和/或稀释剂。
本发明优点在于:
本发明获得的小干扰RNA序列未见于以往公开的报道,能在IRAK1基因的转录后进行干扰,从而特异性降低IRAK1的蛋白表达,可降低炎症牙髓干细胞中NF-κB的表达,降低牙髓干细胞炎性因子-肿瘤坏死因子(TNF-α)的生成,抑制炎症的发展,促进牙髓干细胞的成牙本质分化,可为治疗龋病提供新的方案。
附图说明
图1是siRNA对牙髓干细胞IRAK1蛋白的下调作用。(图示为Western blot检测IRAK1蛋白表达量,依次为空白组,对照组和siRNA1、siRNA2、siRNA3、siRNA4组;GD为内参。提示仅siRNA1能显著降低IRAK1蛋白的表达,因此下文中的siRNA若无特殊说明皆指siRNA1)。
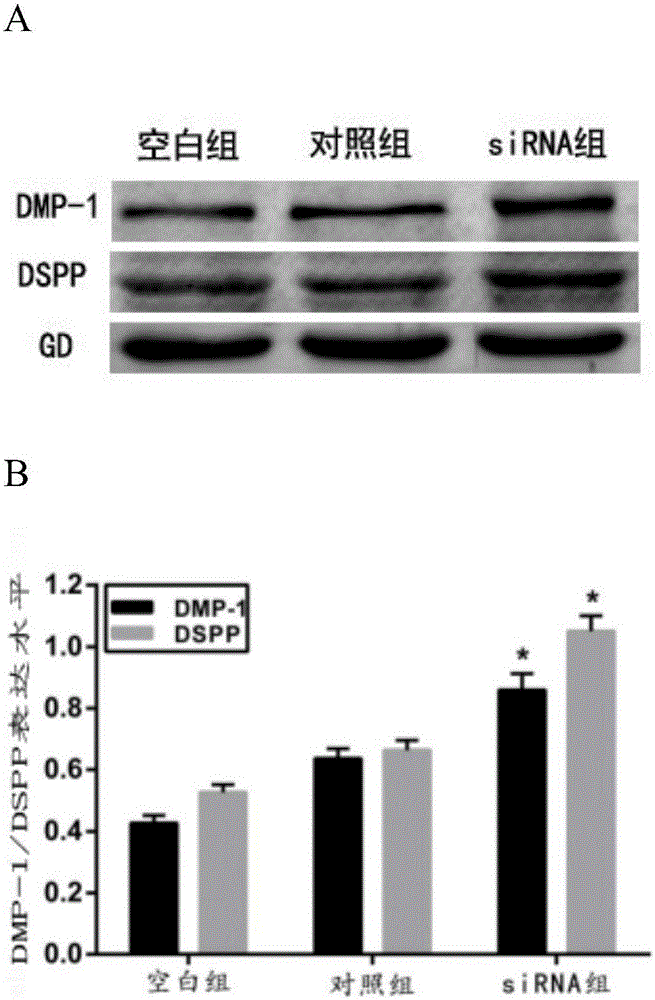
图2是western blot检测siRNA对牙髓干细胞在重度炎症下成牙本质分化的影响。A为牙髓干细胞在50ng/mL TNF-α刺激下成牙本质分化培养14天后成牙本质标记物牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)、牙本质基质蛋白1(dental matrix protein-1,DMP1)的表达。B为统计学结果。结果表明:siRNA能明显提高牙髓干细胞的成牙本质分化能力,特别是在50ng/mL TNF-α刺激下,牙髓干细胞的成牙本质能力明显提高,成牙本质标记物DSPP、DMP1的表达明显增高。提示该siRNA具有促成牙本质分化能力。
图3是ALP染色检测siRNA对牙髓干细胞成牙本质分化能力的影响。A为牙髓干细胞在50ng/mL TNF-α刺激下成牙本质分化培养14天后ALP染色。B为统计学结果,与对照组相比,siRNA在高度炎症下能明显促进牙髓干细胞的成牙本质分化能力。
图4是茜素红染色检测siRNA对牙髓干细胞成牙本质分化能力的影响。A为牙髓干细胞在50ng/mL TNF-α刺激下成牙本质分化培养14天后茜素红染色。B为统计学结果,与对照组相比,siRNA在高度炎症下能明显促进牙髓干细胞的成牙本质分化能力。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
本发明所有方法中未注明具体条件的实验方法,所用试剂如无特殊说明均购自Invitrogen,干扰序列由上海吉玛制药技术有限公司合成。实施例中的实验方法通常按照常规条件,参考分子克隆实验指南(第三版,J.萨姆布鲁克等著,黄培堂等译,科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件进行。
实施例1:靶向人IRAK1基因特异性干扰序列的获得
根据NCBI公开的人IRAK1基因序列(Genbank:NM_001025243)设计siRNA序列,具体设计参考美国Invitrogen公司网站(其网站http://rnaidesigner.invitrogen.com/rnaiexpress/sort.do)提供的RNAi在线设计软件,经过比对筛选获得含19个碱基的靶基因序列:5’-CCGAAGAAAGTGATGAATT-3’(SEQ ID NO:1),对应的siRNA干扰序列由上海吉凯基因化学技术有限公司合成,具体如下:
正义链:5’-GCCCGAAGAAAGUGAUGAAUU-3’(SEQ ID NO:2)
反义链:5’-AAUUCAUCACUUUCUUCGGGC-3’(SEQ ID NO:3)
实施例2:牙髓干细胞培养及Western blot检测siRNA对IRAK1蛋白表达的效果
1)实验过程中的牙髓细胞来源于临床上正常以及龋病的第三磨牙和因正畸需要拔除的第二前磨牙,患者年龄15-25岁,患者全身情况良好。取得入组人员知情同意,并经南通大学附属医院医学伦理委员会批准。将拔除的牙齿立即放入冰袋预冷的基础DMEM培养液中(含100U/mL青霉素/100μg/mL链霉素)。在超净台上用碘伏冲洗牙齿表面后,用无菌生理盐水冲洗牙齿的表面至无血迹,用消毒后的咬骨钳沿釉牙骨质界打开髓腔,镊子取出牙髓,剪去根部的牙髓组织。用3mg/mLⅠ型胶原酶与4mg/mL的分散酶以1:1比例混合,两种酶以1:10的体积与剪碎的牙髓混合消化1小时,将消化后的组织置于离心机中离心,1000rpm/min离心5分钟,弃去上清液,加完全培养基,混匀、吹打,经70μm的细胞金属网过滤,获得的细胞悬浮液接种于10cm培养皿中,加入完全培养液(10%胎牛血清、DMEM、1%谷氨酸、1%青霉素/链霉素)。培养条件:相对湿度100%,5%CO2,37℃。3-4天半量换液,细胞融合达到70%-80%后,室温条件下,0.25%胰蛋白酶消化3分钟,1000rpm/min离心5分钟,弃除上清,吹打沉淀,混匀后以1:3比例传代,每3天换液1次。选3代的细胞进行实验。
2)siRNA转染。实验分为空白组(不含转染试剂的正常细胞培养液)、对照组(阴性对照购买自Santa Cruz,sc-37007)、siRNA1-4组(合成的小干扰RNA序列)。以0.25%胰蛋白酶消化对数生长期的牙髓干细胞制成单细胞悬液(细胞数1×105),接种于6孔板,培养至细胞融合度大于40%。用250uL无血清培养液(Opti-MEM)稀释siRNA(转染细胞的终浓度为33nM),轻轻吹吸混匀。用250uL Opti-MEM稀释5uL Lipofectamine TM2000,轻轻吹吸3-5次混匀,室温下静置10min。混合转染试剂和siRNA稀释液,轻轻吹吸混匀,室温下静置20min。500uL转染复合物与1.5mL无血清DMEM混合后加入到24孔细胞板(100uL/孔),轻摇细胞板混合均匀。置于37℃、5%CO2培养箱。转染24h后换培养液,按常规条件继续培养。
3)Western blot检测IRAK1蛋白表达。牙髓干细胞转染24h后,吸去培养基,PBS清洗细胞1-2次,向细胞中加100uL RIPA裂解液,收集细胞至1.5mL管中,冰上静置30min,离心12000rpm/min,30min取上清,制备成蛋白样品供分析。将制备的蛋白加入上样缓冲液RSB,用100℃煮沸5min后,立即移入冰上冷却,作为电泳的上样样品。用5%浓缩胶和10%分离胶电泳分离,上样量为20ug/泳道,电泳电压,浓缩胶为70V,分离胶为100V,电泳时间约2.5h。内参为GD。
结果显示:仅siRNA1能显著降低IRAK1蛋白的表达(见图1)。
实施例3:Western blot检测siRNA对牙髓干细胞成牙本质分化能力的影响(DPSS、DMP-1蛋白表达)
1)以0.25%胰蛋白酶消化对数生长期的牙髓干细胞制成单细胞悬液(细胞数1×105),接种于6孔板,每孔200uL。37℃、5%CO2培养箱中培养24h后,弃上清,每孔加入400uL血清培养基,转染4h(如前所述实验分为空白组、对照组、siRNA组)。
2)牙髓干细胞转染24h后,吸去培养基,PBS清洗细胞1-2次,向细胞中加100uL RIPA裂解液,收集细胞至1.5mL管中,冰上静置30min,离心12000rpm/min,30min取上清,制备成蛋白样品供分析。将制备的蛋白加入上样缓冲液RSB,用100℃煮沸5min后,立即移入冰上冷却,作为电泳的上样样品。用5%浓缩胶和10%分离胶电泳分离,上样量为20ug/泳道,电泳电压,浓缩胶为70V,分离胶为100V,电泳时间约2.5h。内参为GD。
结果表明:siRNA能明显提高牙髓干细胞的成牙本质分化能力,特别是在50ng/mL TNF-α刺激下,牙髓干细胞的成牙本质能力明显提高,成牙本质标记物DSPP、DMP1的表达明显增高。提示该siRNA具有促成牙本质分化能力(见图2)。
实施例4:ALP染色法检测siRNA对牙髓干细胞成牙本质分化能力的影响
1)以0.25%胰蛋白酶消化对数生长期的牙髓干细胞制成单细胞悬液(细胞数1×105),接种于6孔板,每孔200uL。37℃、5%CO2培养箱中培养24h后,弃上清,每孔加入400uL血清培养基,转染4h(如前所述实验分为空白组、对照组、siRNA组)。
2)染色。弃上清,每孔加入200uL PBS清洗细胞1-2次,避光下用固定A液固定细胞3min,置于37℃烘箱中;吸净固定液,避光下用染色B液染细胞15min,置于37℃烘箱中;吸净B液,再用复染D液染细胞5min,同样置于37℃烘箱中。最后用PBS清洗3-5次。拍照。
结果显示:与对照组相比,siRNA在高度炎症下能明显促进牙髓干细胞的成牙本质分化能力(见图3)。
实施例5:茜素红染色法检测siRNA对牙髓干细胞成牙本质分化能力的影响
1)以0.25%胰蛋白酶消化对数生长期的牙髓干细胞制成单细胞悬液(细胞数1×105),接种于6孔板,每孔200uL。37℃、5%CO2培养箱中培养24h后,弃上清,每孔加入400uL血清培养基,转染4h(如前所述实验分为空白组、对照组、siRNA组)。
2)染色。弃上清,每孔加入200uL PBS清洗细胞1-2次,茜素红染液染细胞2h,置于37℃烘箱中;洗净染液,室温下氯化十六烷吡啶矿化细胞2h。最后用PBS清洗3-5次。拍照。
结果显示:与对照组相比,siRNA在高度炎症下能明显促进牙髓干细胞的成牙本质分化能力(见图4)。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!