一种重组解脂耶氏酵母工程菌株及其构建方法和应用与流程
本发明属于基因工程和微生物代谢工程领域,涉及琥珀酸代谢工程菌的构建以及琥珀酸的生产,尤其涉及一种重组解脂耶氏酵母工程菌株及其构建方法和应用。
背景技术:
进入二十一世纪,人们对燃料及各种化学制品的需求不断增加。过度开发、全球变暖、以及石油基化石资源的匮乏,又对我们仅存的地球资源发起严峻的挑战。因此,研究开发新型可持续的创新技术以满足化工行业的需求势在必行。通过改善现有的工艺过程或者对废物资源重新挖掘再利用、增加产出,成为解决有限资源难题的一条重要出路。生物化工作为可持续发展的一个重要支撑,是解决资源危机、生态环境危机以及改造传统产业的关键所在。而代谢工程已经发展成为最有力的优化微生物代谢途径、提高微生物目标产物生产能力的工具。
琥珀酸(Succinic acid),学名丁二酸,是一种安全的天然有机物和重要的有机合成中间体。琥珀酸作为前体物可用于生产许多高附加值衍生物,广泛应用于食品、制药、离子螯合剂、去污剂、表面活性剂等领域。琥珀酸近年来逐渐攀升为大宗化学品,全球琥珀酸的年产量在3万~5万吨。
目前琥珀酸的生产方法主要有化学合成法和微生物发酵法。传统上,琥珀酸的生产主要是通过丁烷制备顺式丁烯二酸酐再经化学方法加工而成,需要重金属Pd和Ru的催化。由于石油资源的减少和环境污染问题,从长远的角度考虑,石油基的化工生产必须转向生物化工生产过程,以可再生资源为原料的高效环保的琥珀酸发酵法将逐步取代传统的化学合成法。
与化学合成法相比,微生物发酵法具有很多优势:原料来源广,成本低,可再生;反应条件温和,能耗小,环境友好。因此,微生物发酵法生产琥珀酸备受人们的关注。解脂耶氏酵母是一种严格好氧的非传统酵母,属于食品安全级微生物。它的底物谱非常广泛,包括葡萄糖、甘油、乙醇、乙酸以及脂肪酸、脂类等疏水性物质,作为良好的细胞工厂可以生产柠檬酸等许多有价值的化合物。而琥珀酸是解脂酵母的TCA循环中间代谢产物之一,故其产量很低,需要通过基因工程的改造提高其产量;此外,在提高预期产量的同时,提高菌株的发酵性能(生长速率、发酵生物量等)、降低副产物产生(便于目标产物的后续提取纯化),也是本领域技术人员关注的主要问题。
技术实现要素:
本发明以发明人前期研究的工作为基础,以琥珀酸脱氢酶的Sdh5亚基为目标,借助基因组的同源壁替换完成基因的敲除,使TCA循环中的琥珀酸脱氢酶复合体失去活性,琥珀酸无法下一步代谢而得到积累,利用甘油作底物好氧发酵生产琥珀酸。然而TCA循环关键酶的失活,所构建的重组解脂耶氏酵母存在生长速率慢、生物量低、产乙酸过高等问题,为同时调控琥珀酸生产的代谢流和提高微生物菌株的发酵性能,发明人发现,仅通过在敲除解脂耶氏酵母Sdh5基因的基础上进一步敲除乙酰辅酶A水解酶(acetyl-CoA hydrolase)编码基因ach1,不仅可以使得新构建的重组解脂酵母乙酸产量大幅下降,而且重组解脂耶氏酵母的发酵性能获得极大提升,包括生长速率和发酵生物量的提高,同时琥珀酸的产量和产率得到提高。
本发明的目的在于提供一种重组解脂耶氏酵母工程菌株及其构建方法和应用,实现琥珀酸的高产。
为实现上述目的,具体的,本发明涉及以下技术方案:
首先,本发明提供一种重组解脂耶氏酵母工程菌株,所述菌株为sdh5基因和ach1基因缺失和/突变的解脂耶氏酵母,所述重组解脂耶氏酵母工程菌株积累琥珀酸。
sdh5基因和ach1基因缺失和/突变,表示琥珀酸脱氢酶复合体Sdh5亚基和乙酰辅酶A水解酶(acetyl-CoA hydrolase)功能缺失或失活。
优选的,sdh5基因和ach1基因缺失和/突变的解脂耶氏酵母,重组解脂耶氏酵母工程菌株积累琥珀酸,重组解脂耶氏酵母工程菌株以甘油为底物发酵的琥珀酸发酵产量可达10g/L及以上,优选的可达12g/L及以上;或者以甘油为底物发酵的琥珀酸发酵产率可达0.26g g-1甘油及以上,优选的,可达0.28g g-1甘油及以上。
解脂耶氏酵母(Yarrowia lipolytica)是一种非常规酵母,属于半子囊菌纲(Hemiascomycetes)、耶氏酵母菌属,解脂耶氏酵母是一种二型性酵母,即细胞形态可以在酵母型、假菌丝型以及菌丝型之间进行相互转换。
解脂耶氏酵母中琥珀酸脱氢酶复合体由5个亚基组成,包括Sdh1、Sdh2、Sdh3、Sdh4和Sdh5。其中,Sdh1和Sdh2的失活,均会导致解脂耶氏酵母无法单独利用葡萄糖培养存活,而Sdh5是一种高度保守的线粒体蛋白质,它和催化亚基Sdh1相互作用,负责辅因子黄素腺嘌呤二核苷酸(FAD)与Sdh1的共价结合。解脂耶氏酵母sdh5的基因序列可以参见Genbank公布的Sdh5的编码基因序列(Gene ID:2908266)。
乙酰辅酶A水解酶由ach1基因编码,它在乙酰辅酶A过量时催化乙酰辅酶A水解为乙酸,解脂耶氏酵母ach1基因的序列可以参见Genbank公布的Ach1的编码基因序列(Gene ID:2911920)。
一个优选的实施方案中,本发明所述一种重组解脂耶氏酵母工程菌株为在初始解脂耶氏酵母菌株基础上通过基因敲除手段敲除sdh5基因和ach1基因的积累琥珀酸的解脂耶氏酵母。优选的,所述积累琥珀酸的解脂耶氏酵母,以甘油为底物发酵的琥珀酸产量可达10g/L及以上,优选的可达12g/L及以上,或者以甘油为底物发酵的琥珀酸产率可达0.26g g-1甘油及以上,优选的,可达0.28g g-1甘油及以上。
本发明优选的技术方案中,初始解脂耶氏酵母为野生型解脂耶氏酵母。
优选的,初始解脂耶氏酵母为解脂耶氏酵母菌株Y.lipolytica Po1f菌株,其基因型为MatA leu2-270ura3-302xpr2-322axp2-deltaNU49XPR2::SUC2(Catherine Madzak,Brigitte Tréton and Sylvie Blanchin-Roland,Strong Hybrid Promoters and Integrative Expression/Secretion Vectors for Quasi-Constitutive Expression of Heterologous Proteins in the Yeast Yarrowia lipolytica,Journal of Molecular Microbiology and Biotechnology,2000,Vol.2,No.2,207-216,在此该文献一并引入本申请),该菌呈二态性,在丰富培养基中细胞呈椭圆型,当营养贫瘠时则为长的假菌丝,生长温度范围在15~46℃之间,最适生长温度为28℃。
本发明优选的实施方案中,重组解脂耶氏酵母工程菌株为PGC11505。
其次,本发明提供一种重组解脂耶氏酵母工程菌株的构建方法,利用基因敲除的方法使解脂耶氏酵母中琥珀酸脱氢酶复合体与乙酰辅酶A水解酶失去活性。
其中琥珀酸脱氢酶复合体失活为sdh5基因敲除,所述基因敲除方法可以采用本领域已知的同源重组的基因敲除方法。优选的,所述sdh5基因敲除的方法,是利用质粒JMP113提供大小为1.2kb的ylURA3片段,通过PCR扩增获得目的基因sdh5的上下游长同源臂片段,借助Gibson组装获得带有sdh5上下游长同源臂片段和筛选标记ylURA3的重组片断,然后PCR扩增该重组片断,转化解脂耶氏酵母Po1f,重组片断在酵母自身重组酶的作用下与基因组上的目的基因发生重组,从而将原来的目的基因sdh5替换下来。
优选的,所述ach1基因敲除的方法,是利用质粒JMP114提供大小为1.8kb的YlLEU2片段,通过PCR扩增获得目的基因ach1的上下游长同源臂片段,借助Gibson组装获得带有ach1上下游长同源臂片段和筛选标记YlLEU2的重组片断,然后PCR扩增该重组片断,转化解脂耶氏酵母,重组片断在酵母自身重组酶的作用下与基因组上的目的基因发生重组,从而将原来的目的基因achl1替换下来。
具体的,重组解脂耶氏酵母工程菌株的构建方法包括以下步骤:
(1)sdh5基因和ach1基因敲除表达元件的构建;
(2)sdh5基因和ach1基因敲除表达元件转化解脂耶氏酵母;
(3)sdh5基因和ach1基因重组菌株的筛选与验证;
(4)sdh5基因和ach1基因敲除重组菌的发酵与检测。
其中,步骤(1)sdh5基因和ach1基因敲除表达元件的构建过程为:
(1).sdh5基因的敲除:
菌种与质粒:大肠杆菌DH5α感受态细胞,质粒pBluescript SK(-)、JMP113。
所述LB培养基为:蛋白胨1%,酵母粉0.5%,NaCl 1%。
所述氨苄霉素抗性平板为含有100mg/L的氨苄青霉素,1.5%的琼脂粉的LB固体培养基。
a同源重组片断P与T的克隆
根据Genbank公布的Sdh5的编码基因序列(Gene ID:2908266)设计上下游片段P和T的引物对:
P-F:5'-AGGTCGACGGTATCGATAAGCTTGAAGATCTTCCACTCGCTGTTC-3'(SEQ ID NO.1)
P-R:5'-CCTAGGATCCACTAGTTCTAGAGCGGTTCAAAGCTCGGGGTGTGT-3'(SEQ ID NO.2)
T-F:5'-CAGCTTTTGTTCCCTTTAGTGAGGGTGCTTACTGAGGAAGGTTCCT-3'(SEQ ID NO.3)
T-R:5'-ACTAAAGGGAACAAAAGCTGGAGCTCAGTGTTCTGTGAACGCAAG-3'(SEQ ID NO.4)
以解脂耶氏酵母的基因组作为模板进行PCR(聚合酶链式反应)体外扩增,利用引物对P-F和P-R获得Sdh5的上游片段P,利用引物对T-F和T-R获得Sdh5的下游片段T。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸60s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩同源重组片断。
b筛选标记片段ylURA3的克隆
上游引物M-F:5'-CGCTCTAGAACTAGTGGA-3'(SEQ ID NO.5)
下游引物M-R:5'-ACCCTCACTAAAGGGAAC-3'(SEQ ID NO.6)
以质粒JMP113通过PCR(聚合酶链式反应)体外扩增片断。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸90s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩ylURA3片断。
c载体来源片段的克隆
上游引物V-F:5'-AGCTCCAGCTTTTGTTCCCT-3'(SEQ ID NO.7)
下游引物V-R:5'-TCAAGCTTATCGATACCGTC-3'(SEQ ID NO.8)
以质粒pBluescript SK(-)通过PCR(聚合酶链式反应)体外扩增载体片断。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸180s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩线性化载体片断。
d质粒组装
3μl线性化pBluescript II SK(-)片段、4μl上游片段P、4μl下游片段T、4μl的ylURA3克隆片段与15μl组装反应体系混合后,于50℃反应1h,转化大肠杆菌DH5α感受态细胞,涂布氨苄霉素抗性平板。
(2).ach1基因的敲除:方法同(1)
菌种与质粒:大肠杆菌DH5α感受态细胞,质粒pBluescript SK(-)、JMP114。
所述LB培养基为:蛋白胨1%,酵母粉0.5%,NaCl 1%。
所述氨苄霉素抗性平板为含有100mg/L的氨苄青霉素,1.5%的琼脂粉的LB固体培养基。
a同源重组片断P与T的克隆
根据Genbank公布的Ach1的编码基因序列(Gene ID:2911920)设计上下游片段P和T的引物对:
P-F:5'-AGGTCGACGGTATCGATAAGCTTGAACGGTGTACAGTTACGAGC-3'(SEQ ID NO.9)
P-R:5'-CCTAGGATCCACTAGTTCTAGAGCGTAGGCGTCTCTCGATATTGT-3'(SEQ ID NO.10)
T-F:5'-CAGCTTTTGTTCCCTTTAGTGAGGGTGATCTTGAGCTACTTGGACTG-3'(SEQ ID NO.11)
T-R:5'-ACTAAAGGGAACAAAAGCTGGAGCTCGGTTCATACTTAGCTGTTG-3'(SEQ ID NO.12)
以解脂耶氏酵母的基因组作为模板进行PCR(聚合酶链式反应)体外扩增,利用引物对P-F和P-R获得Ach1的上游片段P,利用引物对T-F和T-R获得Ach1的下游片段T。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸60s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩同源重组片断。
b筛选标记片段ylLEU2的克隆
上游引物M-F:5'-CGCTCTAGAACTAGTGGA-3'(SEQ ID NO.5)
下游引物M-R:5'-ACCCTCACTAAAGGGAAC-3'(SEQ ID NO.6)
以质粒JMP114通过PCR(聚合酶链式反应)体外扩增片断。PCR反应条件:97℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸120s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩ylLEU2片断。
c载体来源片段的克隆
上游引物V-F:5'-AGCTCCAGCTTTTGTTCCCT-3'(SEQ ID NO.7)
下游引物V-R:5'-TCAAGCTTATCGATACCGTC-3'(SEQ ID NO.8)
以质粒pBluescript SK(-)通过PCR(聚合酶链式反应)体外扩增载体片断。PCR反应条件:97℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸180s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩线性化载体片断。
d质粒组装
3μl线性化pBluescript II SK(-)片段、4μl上游片段P、4μl下游片段T、4μl的ylLEU2克隆片段与15μl组装反应体系混合后,于50℃反应1h,转化大肠杆菌DH5α感受态细胞,涂布氨苄霉素抗性平板。
其中,步骤(2)、(3)的过程为在敲除sdh5基因的基础上再敲除ach1基因,或者在敲除ach1基因的基础上再敲除sdh5基因。
其中,步骤(4)sdh5基因和ach1基因敲除重组菌的发酵与检测,发酵过程采用甘油为碳源好氧发酵;采用高效液相色谱检测有机酸和甘油浓度。
具体的,发酵液中的残余甘油和有机酸等代谢物采用高压液相色谱仪(HPLC)分析,具体方法为取1ml发酵液室温下12,000rpm离心1min,取上清,然后用孔径为0.22μm的无菌滤膜过滤,用高效液相色谱检测有机酸和甘油浓度。
检测条件为:色谱柱为HPX-87H(BioRad Labs,300mm×7.8mm),检测器为示差折光检测器RID-10A,柱温为65℃,流动相为5mM H2SO4溶液,流速为0.6ml/min。
此外,本发明提供一种发酵制备琥珀酸的方法,其采用上述重组解脂耶氏酵母工程菌株。具体的,将活化后的重组解脂耶氏酵母工程菌株转接到发酵培养基中进行发酵培养,制备琥珀酸。
优选的技术方案中,所述发酵培养基以甘油作为碳源。优选的,发酵培养基组成为:2%蛋白胨,1%酵母粉,2%甘油,其余为水。
优选的技术方案中,重组解脂耶氏酵母工程菌株的发酵培养过程为好氧条件发酵。所述好氧条件优选的维持发酵摇瓶振荡培养的转速为200r/min及以上,在整个发酵过程中不调节发酵液的pH,如28℃,200rpm转速摇瓶(300ml摇瓶中50ml装液量)震荡培养,不控制pH。
优选的技术方案中,重组解脂耶氏酵母工程菌株先在固体平板中活化,再接种到液体种子培养基中,培养24h后以初始OD值为0.1转接至发酵培养基中,于28℃、200r/min振荡培养72h。
优选的,发酵培养过程中,每间隔4~8h取样,然后在600nm波长下检测菌液的光吸收值。即取1ml菌液12,000rpm转速离心1min。弃去上清,用等体积的H2O重悬,稀释至合适倍数后于600nm波长检测其光吸收值。
本发明取得了以下有益效果:
(1)本发明所得解脂耶氏酵母工程菌可利用甘油等廉价的碳源,且解脂耶氏酵母是安全的、适用于食品行业的工业化生产菌株。
(2)本发明的重组解脂酵母发酵琥珀酸后的副产物量低,重组解脂耶氏酵母的发酵性能优良(其生长情况恢复到接近初始菌株状况),包括生长速率和发酵生物量同时较高,琥珀酸的产量达到12.72g/L,产率达到0.28g g-1甘油。
(3)本发明菌株的构建过程,解脂耶氏酵母选用营养缺陷型作为重组菌的筛选标记,避免了抗生素危险人体健康的风险,利用该酵母可构建食品安全级产琥珀酸工程菌株;尤其是在Y.lipolytica PGC11505的代谢途径中,通过sdh5的缺失阻断琥珀酸的进一步代谢,从而实现琥珀酸的初步积累;通过ach1基因的缺失阻断由乙酰辅酶A生成乙酸的途径,从而大幅度降低了乙酸的生成,使得大部分碳流量流向琥珀酸,增加琥珀酸的生成。
本发明所述好氧琥珀酸生产解脂耶氏酵母工程菌株能在好氧环境积累琥珀酸,具有可观的应用价值和前景。
附图说明
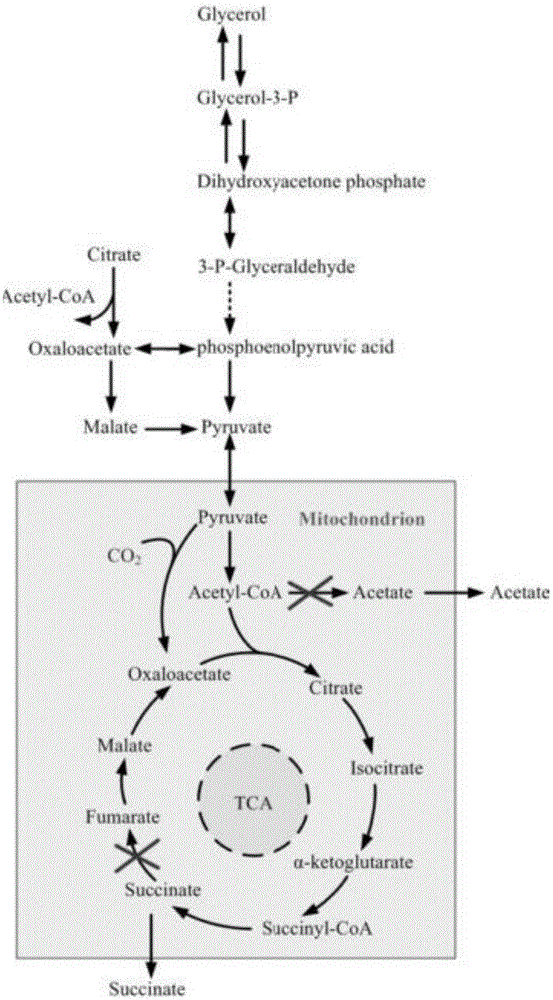
图1为本发明构建的好氧生产琥珀酸途径。
具体实施方式
本发明所用解脂耶氏酵母菌株为Y.lipolytica Po1f;所述质粒pBluescript SK(-)购自Stratagene,质粒JMP113、JMP114为法国Madzak教授所赠(参考文献来源P.Fickers et al,New disruption cassettes for rapid gene disruption and marker rescue in the yeast Yarrowia lipolytica,Journal of Microbiological Methods,Vol.55(2003)727–737)。大肠杆菌E.coli DH5α购自北京全式金生物技术有限公司。
实施例1基因敲除的表达元件的构建
(1).sdh5基因的敲除:
菌种与质粒:大肠杆菌DH5α感受态细胞,质粒pBluescript SK(-)、JMP113。
所述LB培养基为:蛋白胨1%,酵母粉0.5%,NaCl 1%。
所述氨苄霉素抗性平板为含有100mg/L的氨苄青霉素,1.5%的琼脂粉的LB固体培养基。
a同源重组片断P与T的克隆
根据Genbank公布的Sdh5的编码基因序列(Gene ID:2908266)设计上下游片段P和T的引物对:
P-F:5'-AGGTCGACGGTATCGATAAGCTTGAAGATCTTCCACTCGCTGTTC-3'(SEQ ID NO.1)
P-R:5'-CCTAGGATCCACTAGTTCTAGAGCGGTTCAAAGCTCGGGGTGTGT-3'(SEQ ID NO.2)
T-F:5'-CAGCTTTTGTTCCCTTTAGTGAGGGTGCTTACTGAGGAAGGTTCCT-3'(SEQ ID NO.3)
T-R:5'-ACTAAAGGGAACAAAAGCTGGAGCTCAGTGTTCTGTGAACGCAAG-3'(SEQ ID NO.4)
以解脂酵母的基因组作为模板进行PCR(聚合酶链式反应)体外扩增,利用引物对P-F和P-R获得Sdh5的上游片段P,利用引物对T-F和T-R获得Sdh5的下游片段T。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸60s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩同源重组片断。
b筛选标记片段ylURA3的克隆
上游引物M-F:5'-CGCTCTAGAACTAGTGGA-3'(SEQ ID NO.5)
下游引物M-R:5'-ACCCTCACTAAAGGGAAC-3'(SEQ ID NO.6)
以质粒JMP113通过PCR(聚合酶链式反应)体外扩增片断。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸60s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩ylURA3片断。
c载体来源片段的克隆
上游引物V-F:5'-AGCTCCAGCTTTTGTTCCCT-3'(SEQ ID NO.7)
下游引物V-R:5'-TCAAGCTTATCGATACCGTC-3'(SEQ ID NO.8)
以质粒pBluescript II SK(-)通过PCR(聚合酶链式反应)体外扩增载体片断。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸180s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩线性化载体片断。
d质粒组装
3μl线性化pBluescript II SK(-)片段、4μl上游片段P、4μl下游片段T、4μl的ylURA3克隆片段与15μl组装反应体系混合后,于50℃反应1h,转化大肠杆菌DH5α感受态细胞,涂布氨苄霉素抗性平板。
(2).ach1基因的敲除:方法同(1)
菌种与质粒:大肠杆菌DH5α感受态细胞,质粒pBluescript II SK(-)、JMP114。
所述LB培养基为:蛋白胨1%,酵母粉0.5%,NaCl 1%。
所述氨苄霉素抗性平板为含有100mg/L的氨苄青霉素,1.5%的琼脂粉的LB固体培养基。
a同源重组片断P与T的克隆
根据Genbank公布的Ach1的编码基因序列(Gene ID:2911920)设计上下游片段P和T的引物对:
P-F:5'-AGGTCGACGGTATCGATAAGCTTGAACGGTGTACAGTTACGAGC-3'(SEQ ID NO.9)
P-R:5'-CCTAGGATCCACTAGTTCTAGAGCGTAGGCGTCTCTCGATATTGT-3'(SEQ ID NO.10)
T-F:5'-CAGCTTTTGTTCCCTTTAGTGAGGGTGATCTTGAGCTACTTGGACTG-3'(SEQ ID NO.11)
T-R:5'-ACTAAAGGGAACAAAAGCTGGAGCTCGGTTCATACTTAGCTGTTG-3'(SEQ ID NO.12)
以解脂耶氏酵母的基因组作为模板进行PCR(聚合酶链式反应)体外扩增,利用引物对P-F和P-R获得Ach1的上游片段P,利用引物对T-F和T-R获得Ach1的下游片段T。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸60s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩同源重组片断。
b筛选标记片段ylLEU2的克隆
上游引物M-F:5'-CGCTCTAGAACTAGTGGA-3'(SEQ ID NO.5)
下游引物M-R:5'-ACCCTCACTAAAGGGAAC-3'(SEQ ID NO.6)
以质粒JMP114通过PCR(聚合酶链式反应)体外扩增片断。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸120s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩ylLEU2片断。
c载体来源片段的克隆
上游引物V-F:5'-AGCTCCAGCTTTTGTTCCCT-3'(SEQ ID NO.7)
下游引物V-R:5'-TCAAGCTTATCGATACCGTC-3'(SEQ ID NO.8)
以质粒pBluescript II SK(-)通过PCR(聚合酶链式反应)体外扩增载体片断。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸180s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩线性化载体片断。
d质粒组装
3μl线性化pBluescript II SK(-)片段、4μl上游片段P、4μl下游片段T、4μl的ylLEU2克隆片段与15μl组装反应体系混合后,于50℃反应1h,转化大肠杆菌DH5α感受态细胞,涂布氨苄霉素抗性平板。
实施例2工程菌株的构建
(1)醋酸锂法转化解脂耶氏酵母
菌种:解脂耶氏酵母Po1f
所述选择培养基为:1无氨基酵母氮源(YNB)0.67%,酪蛋白水解物0.2%,甘油2.0%,用于Sdh5的敲除。2无氨基酵母氮源(YNB)0.67%,酪蛋白水解物0.2%,甘油2.0%,用于Ach1的敲除。
1)转化DNA片段PUT的准备
利用P-F和T-R引物对PCR(聚合酶链式反应)体外扩增组装片断PUT。PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸180s,30个循环后72℃延伸10min,4℃保存。通过DpnI内切酶消化后,回收纯化浓缩线性化载体片断。
2)感受态细胞的准备
前一天下午从甘油管取50微升菌液,涂布YPG平板,25℃过夜培养Po1f(约15~18h),保证细胞在次日早上的最佳状态,保证细胞不起邹。
1用接种环刮取一环Po1f细胞,悬于1ml TE的EP管
2 10000rpm离心1min,倒掉上清液
3细胞悬于600μl醋酸锂(0.1M pH 6.0),28℃水浴、静止培养1h
4 3000rpm离心2min,倒掉上清液
5用80-120μl醋酸锂(0.1M pH 6.0)轻悬细胞
3)转化
1取40μl感受态细胞,加5μl的DNA(2μl载体DNA加3μl转化片段PUT),28℃水浴培养15min
2加350μl PEG 4000–醋酸锂(0.1M pH 6.0)及16μl 1M DTT(终浓度为40mM),28℃水浴静止培养1h
3加40μl DMSO(终含量为10%),3 9℃热击10min
4加600μl醋酸锂(0.1M pH 6.0)
每管涂步5个平板,每个平板200微升,28℃培养。
(2)重组菌株的筛选与验证
从上述选择培养基中随机挑取20个克隆进行PCR验证。
所述检测引物:
Test-F(Sdh5):5'-ACGACAATGGCATCGGCTCT-3'(SEQ ID NO.13)
Test-R(Sdh5):5'-TCGCTTGGTCTCAGTCTCCT-3'(SEQ ID NO.14)
Test-F(Ach1):5'-GATGATCAACAAGTGTGCC-3'(SEQ ID NO.15)
Test-R(Ach1):5'-CGTGTCTTCGTGTCTGTGAG-3'(SEQ ID NO.16)
PCR反应条件:95℃预变性10min,94℃变性30s,58℃退火30s,72℃延伸180s,30个循环后72℃延伸10min。
所述PCR模板的制备,将所挑取的克隆加到含50μl 20mM的NaOH的ep管中,沸水煮10min,取出迅速冷却,12000rpm离心3min,取上清用于PCR的模板。
经验证成功敲除Sdh5基因的工程菌命名为PGC01003,经验证成功敲除Ach1基因的工程菌命名为PGC11505。
实施例3好氧条件下摇瓶发酵生产琥珀酸的结果分析
(1)工程菌株:解脂耶氏酵母(Yarrowia lipolytica)PGC01003、PGC11505。
冷冻甘油管保存的解脂耶氏酵母PGC01003、PGC11505与对照菌Po1g分别划线接种于YPG平板(2%蛋白胨,1%酵母粉,2%甘油,1.5%琼脂粉),28℃培养16h。
将上述平板上长出的单菌落接入装有50ml的YPG液体培养基(2%蛋白胨,1%酵母粉,2%甘油,1.5%琼脂粉)的300ml三角瓶中,28℃,200rpm震荡培养活化。
好氧培养:取2.5ml活化的培养液转接到装有50ml YPG发酵培养基(甘油浓度为5%)的300ml三角瓶中,28℃,200rpm好氧培养72h,不控制pH。细胞干重(CDW)、细胞生长速率、琥珀酸的产量和对甘油的产率见表一。
表一:解脂耶氏酵母工程菌摇瓶发酵琥珀酸结果(72h)
Comparison of succinic acid fermentation in varied Y.lipolytica strains in shaking flasks.
μmax是最大比生长速率,CDW是细胞干重
比较上述结果表明:在好氧条件下工程菌PGC01003生物量较低,细胞干重为5.6g/L,琥珀酸的产量达到5.51g/L,相比对照菌Po1g提高11.5倍。消耗每克甘油可产生0.24克琥珀酸。同时产生高达5.7g/L乙酸。进一步敲除ach1所得的工程菌PGC11505乙酸产量下降明显,生物生长速率加快,生物量大幅度提高,72h产琥珀酸达到12.72g/L,消耗每克甘油可产生0.28克琥珀酸。
SEQUENCE LISTING
<110> 临沂大学
<120> 一种重组解脂耶氏酵母工程菌株及其构建方法和应用
<130>
<160> 16
<170> PatentIn version 3.5
<210> 1
<211> 45
<212> DNA
<213> 引物
<400> 1
aggtcgacgg tatcgataag cttgaagatc ttccactcgc tgttc 45
<210> 2
<211> 45
<212> DNA
<213> 引物
<400> 2
cctaggatcc actagttcta gagcggttca aagctcgggg tgtgt 45
<210> 3
<211> 46
<212> DNA
<213> 引物
<400> 3
cagcttttgt tccctttagt gagggtgctt actgaggaag gttcct 46
<210> 4
<211> 45
<212> DNA
<213> 引物
<400> 4
actaaaggga acaaaagctg gagctcagtg ttctgtgaac gcaag 45
<210> 5
<211> 18
<212> DNA
<213> 引物
<400> 5
cgctctagaa ctagtgga 18
<210> 6
<211> 18
<212> DNA
<213> 引物
<400> 6
accctcacta aagggaac 18
<210> 7
<211> 20
<212> DNA
<213> 引物
<400> 7
agctccagct tttgttccct 20
<210> 8
<211> 20
<212> DNA
<213> 引物
<400> 8
tcaagcttat cgataccgtc 20
<210> 9
<211> 44
<212> DNA
<213> 引物
<400> 9
aggtcgacgg tatcgataag cttgaacggt gtacagttac gagc 44
<210> 10
<211> 45
<212> DNA
<213> 引物
<400> 10
cctaggatcc actagttcta gagcgtaggc gtctctcgat attgt 45
<210> 11
<211> 47
<212> DNA
<213> 引物
<400> 11
cagcttttgt tccctttagt gagggtgatc ttgagctact tggactg 47
<210> 12
<211> 45
<212> DNA
<213> 引物
<400> 12
actaaaggga acaaaagctg gagctcggtt catacttagc tgttg 45
<210> 13
<211> 20
<212> DNA
<213> 引物
<400> 13
acgacaatgg catcggctct 20
<210> 14
<211> 20
<212> DNA
<213> 引物
<400> 14
tcgcttggtc tcagtctcct 20
<210> 15
<211> 19
<212> DNA
<213> 引物
<400> 15
gatgatcaac aagtgtgcc 19
<210> 16
<211> 20
<212> DNA
<213> 引物
<400> 16
cgtgtcttcg tgtctgtgag 20
- 还没有人留言评论。精彩留言会获得点赞!