一种异黄酮衍生物及其制备方法和用途与流程
本发明涉及一种异黄酮衍生物及其制备方法和用途。
背景技术:
柯萨奇病毒(Coxsachie virus)是一种肠道病毒,分为A型和B型两种,病毒进入人体于咽部和肠粘膜细胞内繁殖后,可侵入血液形成病毒血症,再散布至中枢神经系统、呼吸道、心脏、肌肉、皮肤等处,可引起无菌性脑膜炎、出疹性发热病、急性心肌炎和心包炎、流行性肌痛、上感、疤疹性咽喉炎及婴儿腹泻等。
临床尚无有效治疗柯萨奇病毒的药物,常用病毒唑等抗病毒药物以及干扰素、营养性制剂、中药黄芪参麦注射液等对症保守治疗。
因此,本领域目前迫切需求一种效果更好的抗柯萨奇病毒的药物。
技术实现要素:
为解决上述问题,本发明提供式(I)所示的化合物、或其溶剂合物、或其药学上可接受的盐:
其中,R1~R3分别独立地选自C1~C6的烷基,M表示碱金属或氢。
进一步地,R1选自甲基或乙基。
进一步地,R2选自甲基或乙基。
进一步地,R3选自甲基或乙基。
进一步地,M选自Na或K。
进一步地,所述化合物的结构如下:
本发明还提供了一种制备前述化合物的方法,包括以下步骤:
以式(SM1)所示化合物为原料,制备得到式(SM2)所示化合物,将式(SM2)所示化合物磺酸化后,再与包括碱金属M阳离子的溶液反应,制备得到式(Ⅰ)所示化合物。
本发明还提供了另一种制备前述化合物的方法,包括以下步骤:
以式(SM1)所示化合物为原料,将其磺酸化后,再与包括碱金属M阳离子的溶液反应,制备得到式(SM3)所示化合物,再以式(SM3)所示化合物为原料制备得到式(Ⅰ)所示化合物。
本发明还提供了前述化合物、或其溶剂合物、或其药学上可接受的盐在制备抗柯萨奇病毒药物中的用途。
进一步地,所述柯萨奇病毒为柯萨奇病毒B型。
进一步地,所述柯萨奇病毒B型为柯萨奇病毒B3型。
经实验证明,本发明提供的化合物在试验小鼠体内有抗柯萨奇病毒的作用,其最小有效剂量为0.05g/kg,治疗指数为72.60;其高、中、低剂量抗柯萨奇病毒的作用均优于MJJ和利巴韦林片。因此,本发明的化合物可用于制备抗柯萨奇病毒药物,并且其制备方法简便高效,具有广阔的市场前景。
本发明中,所述C1~C6的烷基是指C1、C2、C3、C4、C5、C6的烷基,即具有1~6个碳原子的直链或支链的烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、仲丁基、戊基、己基等等。
本发明中,“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
本发明中,“盐”是将化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。本发明中所述盐可以是化合物的盐酸盐、硫酸盐、枸橼酸盐、苯磺酸盐、氢溴酸盐、氢氟酸盐、磷酸盐、乙酸盐、丙酸盐、丁二酸盐、草酸盐、苹果酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐或三氟乙酸盐。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
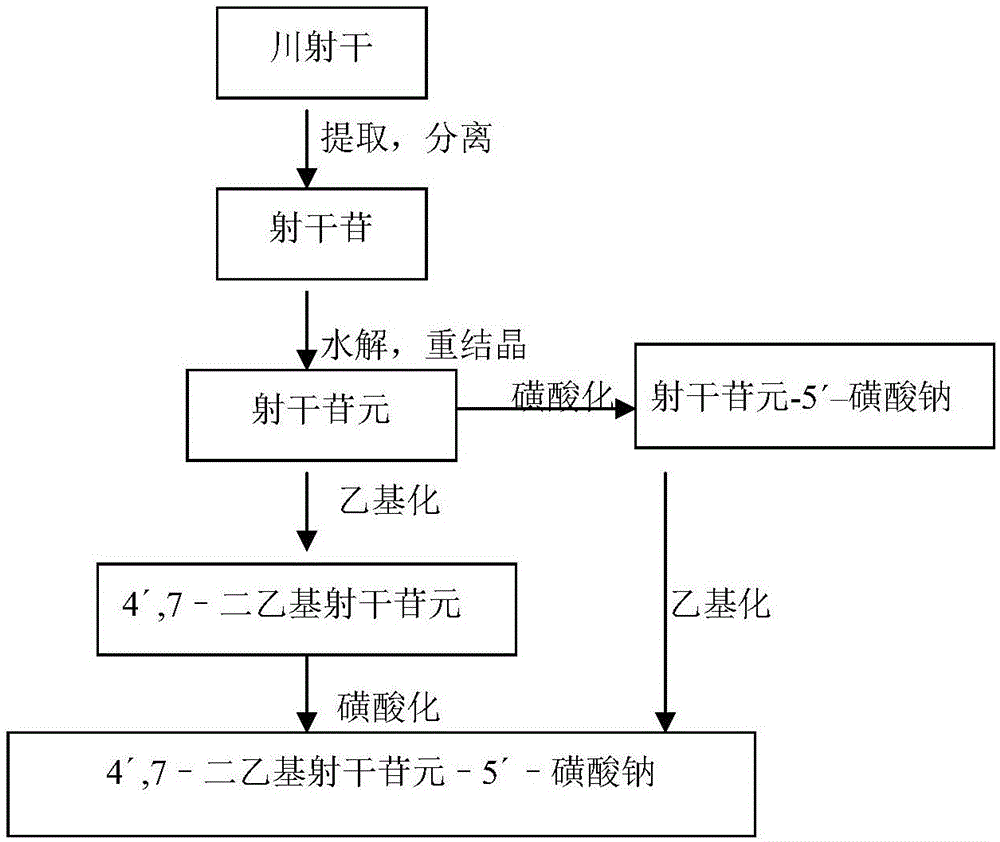
图1为本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备工艺流程图。
图2~5依次为本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的核磁氢谱图、红外光谱图、紫外光谱图以及HPLC色谱图。
具体实施方式
实施例1本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
1.射干苷的提取分离
川射干原生药60℃干燥,粉碎成粗粉过20目筛,置于提取容器内,用95%乙醇加热回流提取3次,每次时间1小时,每次溶媒用量为药材量的4倍(v/w)。趁热过滤,合并滤液,60℃减压回收溶剂,得比重1.2g/mL(60℃测定)的糖浆状物质(棕黄色浸膏),其得率为药材量的49~51%(w/w)。将上述浸膏用氯仿处理后回收溶剂,残留物加95%乙醇(用量为药材量的1/5,v/w)搅拌均匀,抽滤,得射干苷粗品。取射干苷粗品,加95%乙醇加热回流1小时(溶媒用量为射干苷粗品的2倍,v/w),静置过夜,析出淡黄色沉淀,过滤,沉淀再用95%乙醇如上操作重结晶1次,得射干苷精品(无色结晶性粉末,得率为药材量的4.5%,含量>98%,收率为理论量的80%)。
2.射干苷元的制备(射干苷水解、重结晶)
取上述射干苷精品1000g置于10000mL圆底烧瓶中,加50%乙醇5000mL,搅拌均匀,再加浓盐酸500mL,摇匀。加热回流3~5小时,待薄层检查无射干苷斑点存在时停止水解反应。取出,趁热过滤,静置过夜,析出淡黄色细长针晶。过滤,用水洗涤结晶至流出液pH近中性,结晶用2000mL 95%乙醇加热溶解,过滤,滤液趁热倾入4500mL沸水,静置过夜,析晶。过滤,结晶再如上重结晶一次,析出淡黄色细长针晶。过滤,60℃减压干燥,得射干苷元精品(淡黄色细长针晶,得率为药材量的2.5%,含量>98%,收率为理论量的90%)。
3. 4′,7–二乙基射干苷元的制备
取上述方法制得的射干苷元精品500g,加NaOH 100g,混匀,加95%乙醇1500mL于10升圆底烧瓶中,于水浴中加热沸腾5分钟,再加1000mL硫酸二乙酯,反应半小时,取出,立即用盐酸调pH至2~5,加水搅拌放冷。过滤,得无色粉末,用95%乙醇搅拌均匀,过滤,反复洗涤至滤出液近无色,60℃减压干燥,得4′,7–二乙基射干苷元600g(淡黄色结晶性粉末,收率为药材量的3%,含量>98%,水分<2%,收率为理论量的85%)。
4. 4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
取上述方法制得的4′,7–二乙基射干苷元精品500g,加2000mL硫酸,搅拌溶解,反应2小时,倾入20000mL NaCl饱和溶液中,边加边搅拌,析出大量沉淀,放置过夜,过滤,沉淀用水煮沸溶解,趁热过滤,放置,析晶,过滤,沉淀再用水重结晶一次,过滤,60℃减压干燥,得4′,7–二乙基射干苷元–5′–磺酸钠600g(淡黄色结晶性粉末,收率为药材量的3%,含量>98%,水分<2%,收率为理论量的93%)。
4′,7–二乙基射干苷元–5′–磺酸钠的核磁氢谱图、红外光谱图、紫外光谱图以及HPLC色谱图依次如图2~5所示。
实施例2本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
①射干苷元+碳酸二乙酯→4′,7–二乙基射干苷元
取射干苷元100g,加NaOH 20g,混匀,加95%乙醇300mL于2升圆底烧瓶中,于水浴中加热沸腾5分钟,再加200mL碳酸二乙酯,反应半小时,取出,立即用盐酸调pH至2~5,加水搅拌放冷。过滤,得无色粉末,用95%乙醇搅拌均匀,过滤,反复洗涤至滤出液近无色,60℃减压干燥,得4′,7–二乙基射干苷元100g(淡黄色结晶性粉末,收率70%)。磺酸化反应同实施例1。
实施例3本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
取射干苷元100g,碘乙烷100g,K2CO3100g溶解在500mLDMF中,60℃在40HZ超声波作用下,反应6小时,反应完成后,反应物冷却至室温,滤除不溶物后,滤液减压蒸馏得淡黄色固体,氯仿中重结晶得4′,7–二乙基射干苷元100g(淡黄色结晶性粉末,收率70%)。
磺酸化反应同实施例1。
实施例4本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
取射干苷元100g,溴乙烷100g,K2CO3100g溶解在500mLDMF中,60℃在40HZ超声波作用下,反应6小时,反应完成后,反应物冷却至室温,滤除不溶物后,滤液减压蒸馏得淡黄色固体,氯仿中重结晶得4′,7–二乙基射干苷元100g(淡黄色结晶性粉末,收率70%)。
磺酸化反应同实施例1。
实施例5本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
②射干苷元–5′–磺酸钠+硫酸二乙酯→4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)
取射干苷元500g,加2000mL硫酸,搅拌溶解,反应2小时,倾入20000mL NaCl饱和溶液中,边加边搅拌,析出大量沉淀,放置过夜,过滤,沉淀用水煮沸溶解,趁热过滤,放置,析晶,过滤,沉淀再用水重结晶一次,过滤,60℃减压干燥,得射干苷元–5′–磺酸钠600g(淡黄色结晶性粉末,收率为92%)。
取射干苷元–5′–磺酸钠100g,加NaOH 20g,混匀,加95%乙醇300mL于2升圆底烧瓶中,于水浴中加热沸腾5分钟,再加200mL硫酸二乙酯,反应半小时,取出,立即用盐酸调pH至2~5,加水搅拌放冷。过滤,得无色粉末,用95%乙醇搅拌均匀,过滤,反复洗涤至滤出液近无色,60℃减压干燥,得4′,7–二乙基射干苷元–5′–磺酸钠120g(淡黄色结晶性粉末,收率85%)。
实施例6本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
②射干苷元–5′–磺酸钠+碳酸二乙酯→4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)
射干苷元磺酸化同实施例5。
取射干苷元–5′–磺酸钠100g,加NaOH 20g,混匀,加95%乙醇300mL于2升圆底烧瓶中,于水浴中加热沸腾5分钟,再加200mL碳酸二乙酯,反应半小时,取出,立即用盐酸调pH至2~5,加水搅拌放冷。过滤,得无色粉末,用95%乙醇搅拌均匀,过滤,反复洗涤至滤出液近无色,60℃减压干燥,得4′,7–二乙基射干苷元–5′–磺酸钠100g(淡黄色结晶性粉末,收率70%)。
实施例7本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
射干苷元磺酸化同实施例5。
取射干苷元–5′–磺酸钠100g,碘乙烷100g,K2CO3100g溶解在500mLDMF中,60℃在40Hz超声波作用下,反应6小时,反应完成后,反应物冷却至室温,滤除不溶物后,滤液减压蒸馏得淡黄色固体,氯仿中重结晶得4′,7–二乙基射干苷元–5′–磺酸钠100g(淡黄色结晶性粉末,收率70%)。
实施例8本发明化合物4′,7–二乙基射干苷元–5′–磺酸钠(MJJ-S)的制备
射干苷元磺酸化同实施例5。
取射干苷元–5′–磺酸钠100g,溴乙烷100g,K2CO3100g溶解在500mLDMF中,60℃在40Hz超声波作用下,反应6小时,反应完成后,反应物冷却至室温,滤除不溶物后,滤液减压蒸馏得淡黄色固体,氯仿中重结晶得4′,7–二乙基射干苷元–5′–磺酸钠100g(淡黄色结晶性粉末,收率70%)。
以下用试验例的方式说明本发明的有益效果。
试验例本发明化合物的抗柯萨奇病毒作用
1.试验材料
1.1受试药物
MJJ-S药粉、MJJ药粉由四川省中医药科学院研制和提供,批号分别为:20120301、20120402。试验前用生理盐水配制成所需浓度的液体备用。
1.2阳性对照药物
利巴韦林片,由山东鲁北药业有限公司生产,规格为100mg/片。批准文号:国药准字H20023257,生产批号:110601。利巴韦林片为广谱抗病毒药物。临床用量:成人为一日3次,0.15克/次,口服用药。
1.3细胞株
HeLa细胞购自卫生部药品与生物制品检定所,用含10%新生牛血清的完全RPMI-1640培养液、在37℃,5%CO2培养箱中培养,每2~3天传代一次。
1.4病毒株及培养
柯萨奇病毒选用B组3型(CVB3),由四川省人民医院病毒室提供;CVB3的培养是在200mL的细胞培养瓶中,用完全RPMI-1640培养液和HeLa细胞进行。病毒感染性通过半数组织细胞感染剂量(TCID50)测定来反映,详见2.1内容。
1.5主要试剂
RPMI-1640培养基为GibcoBRL公司产品,批号为1465063。优级新生牛血清为中美合资益州民海生物工程有限公司产品,批号为20111022。
1.6主要仪器
CO2培养箱,型号为MCO-15AC,日本三洋公司生产。
细胞培养瓶和96孔细胞培养板,美国Corning公司产品。
生物倒置显微镜,型号为XDS-1B型,重庆光学仪器厂生产;
OLYMPUS倒置显微镜,型号为CKX41,日本奥林巴斯公司生产。
滤器。
移液器。
1.7试验动物
BALB/c雄性断乳小鼠由四川大学华西医学实验动物中心提供,平均体重约为15g/只。使用等级为“小鼠屏障系统”,许可证号为SCXK(川)-09-2006,颁证机构为四川省实验动物管理委员会,颁证时间:2006年2月16日。
2.方法与结果
2.1病毒毒力测定
细胞培养测定法:CVB3病毒的培养同1.4,其毒力测定用连续稀释方法,即以2×105/mL HeLa细胞接种96孔细胞培养板,待细胞长成单层后接种连续10倍稀释度的CVB3,置37℃,5%CO2培养箱中培养,逐日观察试验结果,以50%的细胞发生细胞病变效应(CPE)所需要的最小病毒液浓度判定为CVB3的半数组织细胞感染剂量(TCID50)。经连续多次传代后,CVB3病毒液的TCID50达到10-10以上,符合试验要求的病毒滴度。
动物试验测定法:取TCID50为10-10的CVB3病毒液,按试验要求从10-3起做6个连续10倍稀释的病毒液,经腹腔注射(ip)感染BALB/c雄性断乳小鼠。病毒液的用量为每只小鼠0.3mL,每稀释度用10只小鼠。观察和记录小鼠的发病死亡情况,连续观察14天,再参照REID-MUENCH法,计算出CVB3对BALB/c小鼠的半数致死量(LD50)。试验结果见表1,该批CVB3病毒液的LD50为10-6.3。
表1 CVB3对BALB/c断乳小鼠的LD50测定结果
2.2受试药物配制
根据受试药物毒性试验结果以及双方商定的用量,将本次试验中MJJ-S的用量设定为高剂量组100mg/kg、中剂量组50mg/kg、低剂量25mg/kg。BALB/c断乳小鼠体重平均约为16g,依此计算每只小鼠每次应灌喂MJJ-S的量分别为3.0mg,1.5mg和0.75mg;灌胃体积设定为0.3mL/次.只。据此计算所需药液用量,用生理盐水(NS)配制后各用。
2.3阳性对照药配制
为便于与MJJ-S比较抗CVB3的作用,所以将MJJ及利巴韦林片的用量设定同3.2受试药物配制,即高剂量组100mg/kg、中剂量组50mg/kg、低剂量25mg/kg。每只BALB/c断乳小鼠体重平均以16g计算,灌喂体积为0.3mL/次.只。用生理盐水配制后备用。
2.4试验过程
试验动物与分组:试验动物选用BALB/c雄性断乳小鼠,共分6组,即生理盐水对照组,柯萨奇病毒对照组,MJJ-S组,MJJ组,利巴韦林片组高、中、低剂量组,每组20只小鼠。
试验操作:在试验开始时,MJJ-S,MJJ和利巴韦林片高、中、低剂量组小鼠按设计灌胃相应药物(两对照组灌胃0.3mL NS)2次。在试验的第二天,除NS对照组外,其余5个试验组的小鼠均腹腔注射100个LD50的CVB3病毒液,即将TCID50为10-10的病毒液稀释至10-4.3,每只小鼠ip接种0.3mL。病毒感染24小时后,MJJ-S组、MJJ组、利巴韦林片组的高、中、低剂量组小鼠分别灌胃0.3mL相应药液,NS对照组和柯萨奇病毒对照组小鼠灌胃0.3mL NS,每天1次,连续6天。试验过程中注意观察动物发病情况,记录动物死亡数、生存时间数,至第14天结束试验。
试验重复1次,一共做2次。
2.5结果及统计处理
结果:MJJ-S,MJJ和利巴韦林片高、中、低各剂量组在试验小鼠体内均表现出一定的抗柯萨奇病毒作用,将试验结果的数据进行整理,综合试验数据统计结果见表2。
表2 MJJ-S在BALB/c小鼠体内抗柯萨奇病毒的试验结果
注:
*与病毒对照组比较#与利巴韦林组比较
即:病毒对照组所有试验小鼠均死亡,平均生存天数为7.38天。药物试验组(包括MJJ-S,MJJ和利巴韦林片)的死亡保护率40.00%~70.00%,平均生存天数为10.6~12.75天,延长生命率为55.91%~85.29%。具体为利巴韦林片死亡保护率40.00%~50.00%,平均生存天数为10.60~10.95天,延长生命率为55.91%~65.17%;MJJ死亡保护率50.00%~60.00%,平均生存天数为11.13~11.74天,延长生命率为,68.89%~78.55%;MJJ-S死亡保护率60%~70.00%,平均生存天数为11.93~12.75天,延长生命率为79.83%~85.29%;
统计处理:对死亡保护率数据采用卡方检验处理,各组数据均呈正态性分布;MJJ-S组、MJJ组、利巴韦林片组的高、中、低剂量实验组的死亡保护率均高于病毒对照,差异有统计学意义;三种药物间比较,MJJ-S各剂量组的死亡保护率均大于MJJ组和利巴韦林片组。对平均生存天数的数据用t检验处理,MJJ-S、MJJ、利巴韦林片各剂量组的平均生存天数均高于病毒对照组,差异有统计学意义;三种药物间比较,MJJ-S各剂量组的平均生存天数均大于MJJ组和利巴韦林片组。
动物体内抗柯萨奇抗病毒药效学指标计算:根据表2的试验结果,低剂量MJJ-S抗柯萨奇病毒的死亡保护率和延长生命率的试验结果均为显效,判定其体内抗柯萨奇病毒的最小有效剂量(MTC)为0.05g/kg,,疗指数(TI)为72.60。
试验结论
在本试验条件下,MJJ-S在试验小鼠体内有抗柯萨奇病毒的作用,其最小有效剂量为0.05g/kg,治疗指数为72.60;其高、中、低剂量抗柯萨奇病毒的作用均优于MJJ和利巴韦林片。
- 还没有人留言评论。精彩留言会获得点赞!