取代的吲哚满二酮类化合物在制备预防和/或治疗细菌感染药物中的应用的制作方法
本发明属于生物医药领域,具体涉及取代的吲哚满二酮类化合物在制备预防和/或治疗细菌感染药物中的应用。
背景技术:
近年来由于广谱抗生素的广泛使用导致的病原菌耐药性问题越来越严重,细菌多重耐药性(Multidrug-resistant,MDR)问题也日益普遍。另一方面,新上市的抗生素日益减少,传统的抗生素药物研发策略已不能满足人类对抗病原菌耐药性威胁的需求。因此,针对病原菌与宿主之间互作关系研发新型抗生素药物具有重要意义。
感染类疾病的发生是病原菌与宿主相互作用的过程,一方面,病原菌通过分泌毒力因子侵染宿主组织器官,对宿主造成伤害;另一方面,宿主通过免疫协同调控,宿主免疫系统既可以清除侵染病原菌又可以阻止免疫反应对宿主自身的损害。
2012年,美国Ausbel研究组报道了一种名为RPW-24的化合物,该化合物在体外并不表现对革兰氏阴性菌铜绿假单胞菌(Pseudomonas aeruginosa)的杀菌/抑菌活性,但在体内可以通过丝裂原活化蛋白激酶(MAPK)信号通路介导的免疫调控调节线虫的先天性免疫治愈那些被病原菌感染的线虫。由于RPW-24在抗感染的过程中不以病原菌为靶标产生杀菌作用,因而可以避免病原菌对该化合物产生耐药性。
吲哚满二酮又称二氢吲哚-2,3-二酮或靛红,最早是由法国化学家奥古斯特·罗朗分离出来。吲哚满二酮及其衍生物长期以来一直被用作靛蓝和相关染料以及某些药物的制取原料,是很多药物的合成前体,如治疗老年痴呆药物他克林、局部麻醉药辛可卡因、抗精神失常药齐哌西酮等。但迄今为止,苯甲基和卤素取代的吲哚满二酮类化合物在抗感染领域的活性未见报道。
技术实现要素:
本发明的目的是提供式Ⅰ所示取代的吲哚满二酮类化合物或其药学上可接受的盐的一种药物新用途,
上述式Ⅰ中,X选自下述任意一种:Cl、Br和I。
具体地,上述式Ⅰ所示的取代的吲哚满二酮类化合物为:
本发明所提供的式Ⅰ所示的取代的吲哚满二酮类化合物或其药学上可接受的盐的新用途是其在制备下述产品中的应用:
1)预防和/或治疗细菌感染药物;
2)抑制细菌毒力基因表达药物。
所述细菌可为革兰氏阳性菌,但并不限于革兰氏阳性菌。
所述革兰氏阳性菌可为粪肠球菌和/或金黄色葡萄球菌。
所述粪肠球菌具体为粪肠球菌(E.faecalis MMH594)。
所述金黄色葡萄球菌具体为金黄色葡萄球菌(S.aureus NCTC8325-4)。
所述毒力基因为下述至少一种:psma、RNAIII、agrA和agrC。
上述式Ⅰ所示的化合物购买于Ambinter c/o Greenpharma,纯度>95%。
以上述式Ⅰ所示取代的吲哚满二酮类化合物或其药学上可接受的盐为活性成分制成的药物制剂也属于本发明的保护范围。
所述药物制剂中,上述式Ⅰ所示的苯甲基和卤素取代的吲哚满二酮类化合物或其药学上可接受的盐的质量含量可为0.1-90%。
上述药物制剂可通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其他物质混合或包裹后导入机体。
需要的时候,在上述药物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。
以所述化合物为活性成分制备的药物制剂可以制成注射液、片剂、粉剂、颗粒剂、胶囊、口服液、膏剂、霜剂等多种形式。上述各种剂型的药物制剂均可以按照药学领域的常规方法制备。
药效试验表明,上述式Ⅰ所示的取代的吲哚满二酮类化合物对革兰氏阳性菌的毒力因子具有明显抑制作用,同时对秀丽隐杆线虫的先天性免疫系统具有调剂作用。综上说明,式Ⅰ所示的取代的吲哚满二酮类化合物可能成为一种非常优秀的预防和/或治疗细菌感染的候选药物。
附图说明
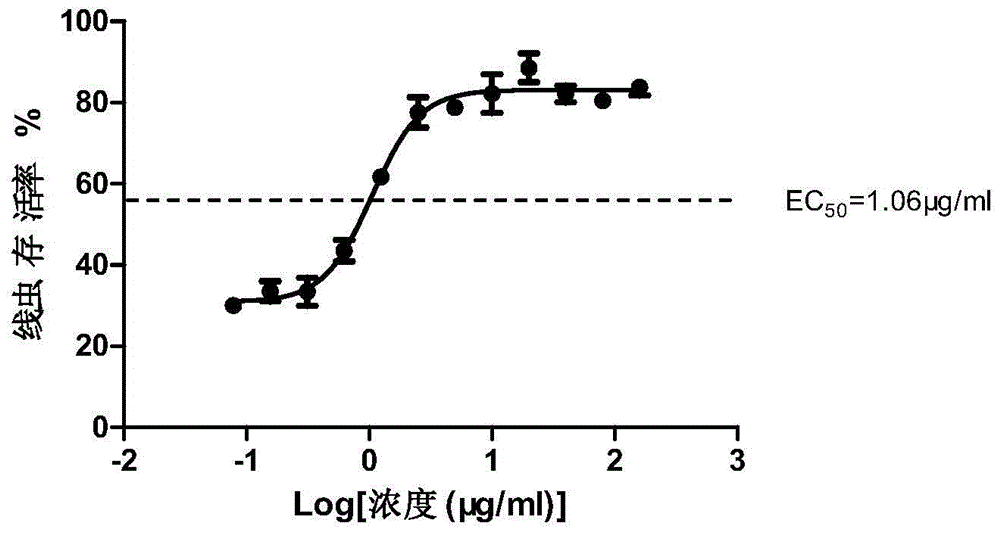
图1为不同浓度式Ⅰ所示化合物作用下的线虫存活率图。
图2为粪肠球菌和金黄色葡萄球菌的毒力基因经式Ⅰ所示化合物处理后的表达差异图。
图3为秀丽隐杆线虫的先天性免疫基因经式Ⅰ所示化合物处理后的表达差异图。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
下述实施例以化合物为例来测试上述式Ⅰ所示的取代的吲哚满二酮类化合物的活性。
所述化合物购自Ambinter c/o Greenpharma,纯度>95%。
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
将所述化合物溶于DMSO,得到浓度为0.001-5mg/ml不等的溶液。后续实施例中的式Ⅰ所示化合物均是以式Ⅰ所示化合物溶液的形式加入的。
实施例1、式Ⅰ所示化合物提高粪肠球菌感染的秀丽隐杆线虫存活率
1、线虫感染前54小时,将-80℃冻存的粪肠球菌(E.faecalis)从冰箱中取出,在固体BHI培养基上划线,37℃培养16个小时获得粪肠球菌单克隆。
2、将步骤1粪肠球菌单克隆接种于5ml BHI液体培养基中,37℃摇床220rpm培养14小时。
3、取100μl步骤2培养的粪肠球菌菌液滴加至BHI固体平板培养基并充分涂布均匀,25℃培养16小时后转15℃培养8小时获得粪肠球菌BHI平板。
4、线虫感染前48小时,将同代时温敏不育型(glp-4:sek-1)秀丽隐杆线虫L1期幼虫置于表面铺有大肠杆菌OP50的固体线虫生长培养基(NGM)上。25℃培养48小时,待线虫幼虫生长至成虫将其从NGM培养基上用M9缓冲液冲洗2-3遍。
5、将步骤4获得的线虫滴加至步骤3准备好的粪肠球菌BHI平板,25℃培养15个小时对线虫实施粪肠球菌侵染。
6、将步骤5被感染线虫用M9缓冲液冲洗3-5遍,弃上清并用M9缓冲液重悬获得线虫悬浮液。
7、将步骤6线虫悬浮液加入96孔板的各孔中,并向孔中加入2μl的式Ⅰ所示化合物溶液和20μl BHI液体培养基。每孔中含有终浓度2%DMSO、20%BHI和78%M9缓冲液和30条粪肠球菌感染线虫。将含有式Ⅰ所示化合物和感染线虫的96孔板置于25℃恒温恒湿培养7天。
8、向步骤7中培养7天过后的96孔板各孔中加入5μl 7μM的Sytox Orange染色,25℃孵育过夜。
9、用荧光显微镜观察96孔板各孔线虫的染色状态,统计各孔中死亡和存活线虫个数,计算线虫存活率。
将DMSO作为式Ⅰ所示化合物的阴性对照,将万古霉素作为式Ⅰ所示化合物的阳性对照(工作浓度为10μg/ml)。
进行三次重复试验,结果取平均值,根据不同浓度式Ⅰ所示化合物作用下线虫存活率,计算式Ⅰ所示化合物作用的EC50值。
图1为不同浓度式Ⅰ所示化合物作用下的线虫存活率图。
结果表明,式Ⅰ所示化合物可以提高粪肠球菌感染的秀丽隐杆线虫存活率。
实施例2、式Ⅰ所示化合物抑制细菌毒力基因表达
1、将-80℃冻存的粪肠球菌(E.faecalis)和金黄色葡萄球菌(S.aureus)从冰箱中取出,分别在固体BHI和TSB培养基上划线,37℃培养16个小时获得粪肠球菌和金黄色葡萄球菌的单克隆。
2、将步骤1粪肠球菌和金黄色葡萄球菌单克隆分别接种于5ml BHI和TSB液体培养基中,37℃摇床220rpm培养14小时。
3、取100μl步骤2培养的粪肠球菌和金黄色葡萄球菌菌液加至10ml BHI和TSB液体培养基中,37℃摇床220rpm培养5-6小时后加入200μl 10mg/ml式Ⅰ所示化合物溶液,继续培养2小时候离心菌体,提取粪肠球菌和金黄色葡萄球菌总RNA。
4、以粪肠球菌和金黄色葡萄球菌毒力基因为测试对象,进行实时定量荧光PCR分析。
5、以DMSO作为式Ⅰ所示化合物的空白对照,以16S rRNA为内参基因,用2-△△Ct法计算粪肠球菌和金黄色葡萄球菌毒力基因经式Ⅰ所示化合物处理后表达差异。
图2为粪肠球菌和金黄色葡萄球菌的毒力基因经式Ⅰ所示化合物处理后的表达差异图。
结果表明式Ⅰ所示化合物能够抑制细菌毒力基因表达。
实施例3、式Ⅰ所示化合物调节粪肠球菌感染的秀丽隐杆线虫的先天性免疫基因表达
1、线虫感染前54小时,将-80℃冻存的粪肠球菌(E.faecalis)从冰箱中取出,在固体BHI培养基上划线,37℃培养16个小时获得粪肠球菌单克隆。
2、将步骤1粪肠球菌单克隆接种于5ml BHI液体培养基中,37℃摇床220rpm培养14小时。
3、取100μl步骤2培养的粪肠球菌菌液滴加至含20μg/ml式Ⅰ所示化合物的BHI固体平板培养基上并充分涂布均匀,25℃培养16小时后转15℃培养8小时获得粪肠球菌BHI平板。
4、线虫感染前48小时,将同代时温敏不育型(glp-4:sek-1)秀丽隐杆线虫L1期幼虫置于表面铺有大肠杆菌OP50含20μg/ml式Ⅰ所示化合物的固体线虫生长培养基(NGM)上。25℃培养48小时,待线虫幼虫生长至成虫将其从NGM培养基上用M9缓冲液冲洗2-3遍。
5、将步骤4获得的线虫滴加至步骤3准备好的粪肠球菌BHI平板,25℃培养15个小时对线虫实施粪肠球菌侵染。
6、将步骤5被感染线虫用M9缓冲液冲洗3-5遍,弃上清获得式Ⅰ所示化合物处理的粪肠球菌感染线虫。提取线虫总RNA。
7、以秀丽隐杆线虫的先天性免疫基因为测试对象,进行实时定量荧光PCR分析。
5、以DMSO作为式Ⅰ所示化合物的空白对照,以snb-1基因作为内参,用2-△△Ct法计算秀丽隐杆线虫先天性免疫基因经式Ⅰ所示化合物处理后的表达差异。
图3为秀丽隐杆线虫的先天性免疫基因经式Ⅰ所示化合物处理后的表达差异图。结果表明:式Ⅰ所示化合物能够调节粪肠球菌感染的秀丽隐杆线虫的先天性免疫基因表达。
- 还没有人留言评论。精彩留言会获得点赞!