一株能共利用木糖和葡萄糖的酿酒酵母基因工程菌及其构建方法与应用与流程
本发明涉及微生物、分子生物学领域,具体涉及一株利用木糖酿酒酵母菌株及其构建方法与应用。
背景技术:
目前,乙醇的生产主要通过淀粉或者一些农作物中的蔗糖,比如玉米、甘蔗和甜菜。出于经济和环境方面的考虑,利用农业废物和其他一些低成本的碳水化合物原料进行生物乙醇的生产得到广泛关注,包括玉米秸秆、甘蔗渣、麦秸、不可回收利用纸张以及柳枝稷。木质纤维素生物质主要由纤维素、半纤维素、果胶和木质素组成,主要的糖成分是葡萄糖,但是含有20%的戊糖,比如D-木糖和L-阿拉伯糖。
用木质纤维素原料生产生物乙醇近年来获得了广泛关注,因为和以淀粉和蔗糖为主的原料相比,这种原料量多且便宜。酿酒酵母,是工业上利用己糖生产生物乙醇的首选微生物,但是它本身不能利用D-木糖(木质纤维素水解液的第二大成分)。在过去的20年里,学者们对酿酒酵母利用木糖产乙醇进行了大量研究,主要集中在对细菌和真菌木糖利用基因的功能表达和对PP途径的操作上,来加强酿酒酵母对木糖的利用和发酵。
微生物中木糖代谢的途径有三条,但是目前仅有两条被引入酿酒酵母中。细菌通过木糖异构酶途径(XI)将木糖直接转化为5-木酮糖。尽管XI途径不需要吡啶核酸辅因子,但是许多原核生物的XI(由xylA编码)在酿酒酵母中表达后都没有活性。这可以归因于许多原因,包括蛋白错误折叠、翻译后修饰错误、不正确的二硫键形成、不良的内部pH和特定金属离子的缺失。
丝状真菌和一些酵母通过一个包含两步反应的氧化还原途径来代谢木糖。首先,由XYL1编码的NAD(P)H依赖型木糖还原酶(XR)将木糖还原成木糖醇;然后,由XYL2编码的NAD+依赖型木糖醇脱氢酶将木糖醇氧化成5-木酮糖。尽管在酿酒酵母中发现了编码XR和XDH的同源基因,但是酿酒酵母不能单独利用木糖生长。过表达酿酒酵母自身的醛糖还原酶和木糖醇脱氢酶,虽然菌体能以木糖生长,但是生长速率非常低。在这一内源木糖代谢途径被发现之前,人们就已经开始在酿酒酵母中引入能够利用木糖的酵母中的木糖代谢途径。树干毕赤酵母的XR/XDH途径在木糖发酵酿酒酵母的改造中是应用最为广泛的,尽管它有一个很严重的问题,XR偏好NADPH,XDH严格依赖NAD+。辅因子的不平衡导致木糖醇的分泌,使得工程菌碳利用和乙醇产量减少。为此学者们进行了很多尝试,用了很多方法来缓解辅因子不平衡的问题。
技术实现要素:
本发明要解决的技术问题时提供一株共利用木糖和葡萄糖的的酿酒酵母重组菌,以提高酿酒酵母发酵过程中木糖利用率。
本发明还要解决的技术问题是提供上述酿酒酵母的构建方法。
本发明最后要解决的技术问题是提供上述酿酒酵母在发酵中的应用。
一株能共利用木糖和葡萄糖的酿酒酵母基因工程菌,在酿酒酵母菌中导入了来源于热带假丝酵母的木糖还原酶XR和木糖醇脱氢酶XDH。
其中,所述的酿酒酵母菌为S.cerevisiae BY4741(MATa;ura3;his3;leu2;met15)。
其中,所述的木糖还原酶XR,其核苷酸序列如SEQ ID NO.:1所示,所述的木糖醇脱氢酶XDH其核苷酸序列如SEQ ID NO.:2所示。
其中,所述的木糖还原酶XR和木糖醇脱氢酶XDH的基因的启动子为TEF1或PGK1;
所述TEF1启动子的核苷酸序列如SEQ ID NO.:3所示;
所述PGK1启动子的核苷酸序列如SEQ ID NO.:4所示;
优选木糖还原酶XR的启动子为TEF1启动子,XDH的启动子为PGK1启动子。
其中,所述木糖还原酶XR基因和木糖醇脱氢酶XDH的基因的3’端克隆有终止子,所述终止子的核苷酸序列如SEQ ID NO.:5所示。
上述能共利用木糖和葡萄糖的酿酒酵母基因工程菌的构建方法,其特征在于,包括如下步骤:
用overlap PCR得到包含启动子、目的基因、终止子的DNA片段,将该DNA片段克隆到pYX212质粒上,得到重组质粒;
(2)将步骤(1)得到的重组质粒转化酿酒酵母菌。
上述能共利用木糖和葡萄糖的酿酒酵母基因工程菌在发酵中的应用。
其中,发酵培养基中,木糖与葡萄糖的质量比例为1:5~5:1,优选质量比为2:1
其中,发酵前,种子培养培养条件如下:培养温度为30℃,培养时间为20-24h,转速为200rpm,种子培养基的包括:葡萄糖20g/L,酵母粉10g/L,蛋白胨20g/L,初始pH5.2,溶剂为水;
发酵时,发酵培养条件如下:培养温度为30~32℃,培养时间为40~108h,转速为200rpm,发酵培养基的组分包括:葡萄糖10~50g/L,木糖10~50g/L,酵母粉10~20g/L,蛋白胨20~30g/L,初始pH5.2~5.5
具体的培养方法如下:用接种环或枪头从-80℃保藏的30%甘油管中的单菌落挑取适量接种于5mlYPD液体培养基中,30℃,200rpm培养20~24h,此培养物为一级种子。
一级种子培养结束后,转接于装有100ml YPD液体培养基的500ml锥形瓶中,接种量5~10%,30℃,200rpm培养20~24h,此培养物为二级种子。
二级种子培养结束后,进行发酵培养基的接种。转接于装有100ml液体发酵培养基的500ml锥形瓶中,接种量5~10%。30~32℃,200rpm条件下进行发酵。发酵条件为好氧培养,控制方法为发酵过程中在500ml锥形瓶瓶口包扎八层纱布。
培养基成分:
种子培养基的组分为:葡萄糖20g/L,酵母粉10g/L,蛋白胨20g/L,初始pH5.2。发酵培养基的组分为:葡萄糖10-50g/L,木糖10-50g/L,酵母粉10g/L,蛋白胨20g/L,初始pH5.2。
培养基灭菌条件:115℃,20min。
有益效果:
与现有技术相比,本发明在单倍体酿酒酵母菌株BY4741(MATa;ura3;his3;leu2;met15)中用酿酒酵母内源启动子TEF1、PGK1p以表达载体组成型高拷贝质粒pYX212过表达来源于热带假丝酵母的木糖还原酶XR(由XYL1编码)和木糖醇脱氢酶XDH(由XYL2编码),得到能木糖利用菌株XR-pXDH。该方法应用常用组成型高拷贝质粒pYX212在酿酒酵母菌株中过表达木糖还原酶XR和木糖醇脱氢酶XDH,能够实现在混糖发酵过程中提高木糖、葡萄糖共利用过程中木糖的消耗速率。本发明分子操作简单,无需经过长期的进化过程,是解决木糖利用重组酿酒酵母中普遍存在的木糖消耗速率低下问题的一种尝试。
附图说明
图1以启动子TEF1p分别过表达XR和XDH质粒载体图谱;其中,XR的启动子为TPI1p,终止子为CYCt,XDH的启动子为TPI1p,终止子为CYCt,所用表达质粒为组成型高拷贝质粒pYX212。
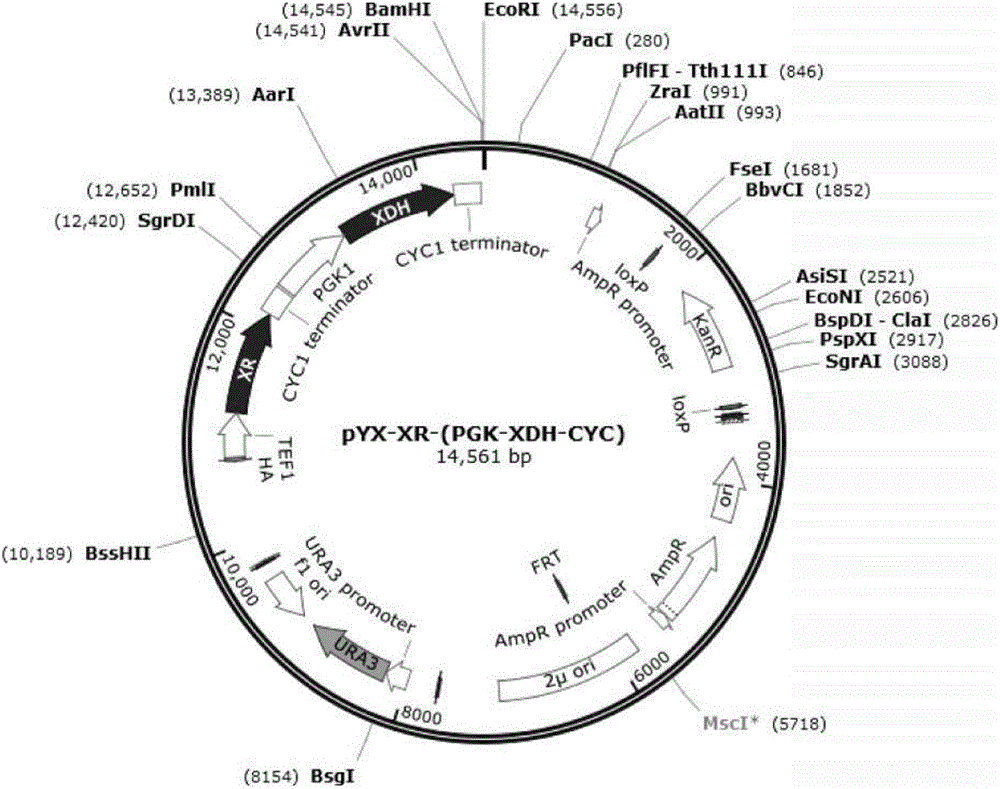
图2以启动子TEF1p过表达XR,以启动子PGK1p过表达XDH质粒载体图谱;其中,其中,XR的启动子为TPI1p,终止子为CYCt,XDH的启动子为TPI1p,XDH的启动子为PGK1p,终止子为CYCt,所用表达质粒为组成型高拷贝质粒pYX212。
图3 CON,Ctp与XR-XDH以葡萄糖为碳源时葡萄糖消耗(A)、菌体生长(B)、乙醇产生(C)情况。
图4 CON,Ctp与XR-XDH以葡萄糖、木糖混合糖为碳源时葡萄糖、木糖消耗(A)、菌体生长(B)、木糖醇积累(C)、乙醇产生(D)情况。
图5 XR-XDH与RH-TAL,RH-XK以葡萄糖为碳源时葡萄糖消耗(A)、菌体生长(B)、乙醇产生(C)情况。
图6 XR-XDH与RH-TAL,RH-XK以葡萄糖、木糖混合糖为碳源时葡萄糖、木糖消耗(A)、菌体生长(B)、木糖醇积累(C)情况。
图7对照菌株CON、XR-XDH与XR-pXDH以葡萄糖为碳源时葡萄糖消耗(A)、菌体生长(B)、乙醇产生(C)情况。
图8示对照菌株CON、XR-XDH与XR-pXDH以葡萄糖、木糖混合糖为碳源时葡萄糖、木糖消耗(A)、菌体生长(B)、木糖醇积累(C)情况。
图9示XR-pXDH在不同木糖、葡萄糖比例下的木糖消耗(A)、菌体生长(B)、木糖醇积累(C)、乙酸积累(D)情况。
具体实施方式
本发明公开了一种菌株、其制备方法及应用,以及该菌株的发酵方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明以木糖利用酿酒酵母菌株BY4741(MATa;ura3;his3;leu2;met15)为出发菌株,以表达载体组成型高拷贝质粒pYX212过表达以TEF1p为启动子的XR和以PGK1p为启动子的XDH(图2),得到菌株XR-pXDH。用该菌株做葡萄糖单糖,木糖、葡萄糖混糖好氧培养发酵,发酵过程中用高效液相色谱HPLC测定培养基中的葡萄糖、木糖、木糖醇含量,用气相色谱测定乙醇含量。
种子培养基为YPD,发酵培养基为YP(D+X)。所述所选启动子为以TEF1p为启动子的XR和以PGK1p为启动子的XDH,在本发明的另一些实施例中,以TEF1p为XDH的启动子。
用接种环或枪头从-80℃保藏的30%甘油管中的单菌落挑取适量接种于5ml YPD液体培养基中,30℃,200rpm培养20~24h,此培养物为一级种子。
一级种子培养结束后,转接于装有100ml YPD液体培养基的500ml锥形瓶中,接种量5~10%,30℃,200rpm培养20~24h,此培养物为二级种子。
二级种子培养结束后,进行发酵培养基的接种。转接于装有100ml液体发酵培养基的500ml锥形瓶中,接种量5~10%。30~32℃,200rpm条件下进行发酵。发酵条件为好氧培养,控制方法为发酵过程中在500ml锥形瓶瓶口包扎八层纱布。
发酵过程中每24h进行取样分析,HPLC条件:Bio-Rad Aminex HPX–87H色谱柱,柱温55℃,流动相为5mmol H2SO4,流速0.4ml/min,每个样品运行25min。
结果表明,发酵培养基中葡萄糖浓度为20g/L,木糖浓度为40g/L时,木糖消耗、菌体生长、木糖醇积累等综合情况最优。本发明提供的菌株、其制备方法及应用,以及该菌株的发酵方法中所用原料及试剂均可由市场购得。其中,所用宿主菌株为酿酒酵母BY4741(MATa;ura3;his3;leu2;met15)。所用表达载体为组成型高拷贝质粒pYX212。XR的启动子为TEF1p,XDH的启动子为PGK1p。
本专利所用的对照菌株,获得方式为:在BY4741中表达空质粒pYX212,命名为“CON”。
实施例1:
以木糖利用酿酒酵母菌株BY4741(MATa;ura3;his3;leu2;met15)为出发菌株,以表达载体组成型高拷贝质粒pYX212过表达以TEF1p为启动子的XR和XDH,得到重组菌株XR-XDH;含有空质粒的酒酵母菌株BY4741(MATa;ura3;his3;leu2;met15)为对照菌CON;XR和XDH的来源菌株热带假丝酵母Candida tropicalis 121也作为对照菌(以下简写为Ctp菌株)。
用上述三株菌做葡萄糖好氧发酵实验:
种子培养基为合成培养基YPD,发酵培养基为初糖浓度为100g/L的YPD培养基。用接种环或枪头从-80℃保藏的30%甘油管中的单菌落挑取适量接种于5ml YPD液体培养基中,30℃,200rpm培养20~24h,此培养物为一级种子。
一级种子培养结束后,转接于装有100ml YPD液体培养基的500ml锥形瓶中,接种量5~10%,30℃,200rpm培养20~24h,此培养物为二级种子。
二级种子培养结束后,进行发酵培养基的接种。转接于装有100ml液体发酵培养基的500ml锥形瓶中,接种量5~10%。30~32℃,200rpm条件下进行发酵。发酵条件为好氧培养,控制方法为发酵过程中在500ml锥形瓶瓶口包扎八层纱布。
发酵过程中每24h进行取样分析,HPLC条件:Bio-Rad Aminex HPX–87H色谱柱,柱温55℃,流动相为5mmol H2SO4,流速0.4ml/min,每个样品运行25min。气相色谱配有火焰离子化检测器和30-m毛细管柱(Equity 1TM;30m×0.32mm×1.0μm film thickness;Supelco Co,Bellefonate,PA,USA)。
实验结果图3所示,图3中酿酒酵母对照菌株CON,对照菌株热带假丝酵母Ctp,过表达以TEF1为启动子的XR、XDH的酿酒酵母菌株XR-XDH。
结果显示,XR、XDH的亲代菌株Ctp利用葡萄糖的能力十分优越,24h就能把100g/L的葡萄糖耗完,乙醇产量达到最大,菌体生长非常迅速,12h就能达到最大值。和CON相比,虽然在以葡萄糖为碳源时,XR和XDH不需要发挥作用,但是XR-XDH菌株的葡萄糖消耗、菌体生长、乙醇产量均优于CON。
实施例2:
对实施例1中的三株菌进行葡萄糖、木糖混合糖发酵实验。种子培养方法同实施例1。发酵培养基为20g/L葡萄糖,40g/L葡萄糖,10g/L酵母粉,20g/L蛋白胨。检测方法同实施例1。
实验结果如图4所示,图4酿酒酵母对照菌株CON,热带假丝酵母Ctp,过表达以TEF1为启动子的XR、XDH的酿酒酵母菌株XR-XDH,葡萄糖、木糖混合糖发酵实验。
结果表明,Ctp菌株3天就能将木糖耗完,但是CON和XR-XDH菌株几乎不能利用木糖,菌体生长和乙醇产生也只限于葡萄糖利用阶段,葡萄糖耗尽后,转而利用乙醇作为碳源维持生长。
实施例3:
在XR-XDH菌株中进一步过表达来源于热带假丝酵母的木酮糖激酶XK,转醛醇酶TAL,得到菌株RH-TAL,RH-XK,进行葡萄糖发酵。培养及检测方法同实施例1。
实验结果如图5所示,图5以TEF1为启动子的XR、XDH的菌株XR-XDH,进一步过表达来源于热带假丝酵母的转醛醇酶的菌株RH-TAL,进一步过表达来源于热带假丝酵母的木酮糖激酶XK的菌株RH-XK的葡萄糖发酵实验。
结果表明,过表达PPP途径非氧化部分的关键酶木酮糖激酶XK,能够显著提高葡萄糖消耗速率(RH-XK 28h vs.RH 48h),菌体生长明显加快,但是乙醇产量有所减少,分析原因可能是因为过表达XK加大了PPP途径的通量,促进了生物质合成,但是相对减少了糖酵解途径通量,导致乙醇产量降低。而过表达转醛醇酶对葡萄糖消耗、菌体生长及乙醇产生都没有益处。
实施例4:
对实施例3中的三种菌株进行葡萄糖、木糖混合糖发酵。培养及检测方法同实施例2。
实验结果如图6所示,图6以TEF1为启动子的XR、XDH的菌株XR-XDH,进一步过表达来源于热带假丝酵母的转醛醇酶的菌株RH-TAL,进一步过表达来源于热带假丝酵母的木酮糖激酶XK的菌株RH-XK的葡萄糖(20g/L)、木糖(40g/L)混合糖发酵实验。
结果表明,和XR-XDH相比,RH-XK虽然能在提高木糖消耗的同时减少木糖醇积累,但是木糖消耗速率依然非常低,无法满足应用需求。
实施例5:
发酵过程中木糖醇的积累可能是因为木糖醇到木酮糖的反应为限速步骤。将XDH的启动子由TEF1换成PGK1,得到菌株XR-pXDH,对CON,XR-XDH,XR-pXDH进行葡萄糖发酵实验。培养及检测方法同实施例1。
实验结果如图7所示,对照菌株CON,以TEF1为启动子的XDH的菌株XR-XDH,以PGK1为启动子的XDH的菌株XR-pXDH的葡萄糖发酵实验。
结果表明,以葡萄糖为碳源时,和XR-XDH相比,更换XDH启动子后的菌株能在不影响乙醇产量的情况下提高葡萄糖消耗速率和菌体生长速率。
实施例6:
对实施例5中的三种菌株进行葡萄糖、木糖混合糖发酵。培养及检测方法同实施例2。
实验结果如图8所示,对照菌株CON,以TEF1为启动子的XDH的菌株XR-XDH,以PGK1为启动子的XDH的菌株XR-pXDH的葡萄糖(20g/L)、木糖(40g/L)混合糖发酵实验。
结果表明,和XR-XDH相比,更换XDH启动子后的菌株能有效利用木糖,该菌株菌体生长在葡萄糖耗尽之后经历一个稳定期,继而利用木糖继续生长。产物主要为木糖醇。
实施例7:
对XR-pXDH菌株进行木糖、葡萄糖不同比例实验。总糖浓度控制在60g/L。培养及检测条件同实施例2。
实验结果如图9所示,XR-pXDH菌株木糖、葡萄糖不同比例实验。
结果表明,当木糖:葡萄糖=4:2时,即木糖40g/L、葡萄糖20g/L时,菌株的木糖消耗、菌体生长都比较好,副产物乙酸积累量少。木糖比例更高时,木糖消耗速率很慢。以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
SEQUENCE LISTING
<110> 南京工业大学
<120> 一株能共利用木糖和葡萄糖的酿酒酵母基因工程菌及其构建方法与应用
<130> SG20161027001
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 975
<212> DNA
<213> 木糖还原酶XR核苷酸序列
<400> 1
atgtctacta ctcctactat tcctaccatt aaattaaact ctggttatga aatgccatta 60
gttggtttcg gatgttggaa agtcaataat gaaactgctg ctgaccaaat ctacaatgct 120
atcaaaactg gttacagatt atttgatggt gctgaagatt acggtaatga aaaagaagtt 180
ggtgaaggta ttaacagagc cattaaagaa ggattagtta aaagagaaga attattcatc 240
acttctaaat tatggaacaa tttccatgat ccaaagaatg ttgaaactgc tttaaacaaa 300
actttaagtg acttgaactt ggactatgtt gatttattct tgattcattt tccaattgct 360
tttaaatttg ttccaattga agaaaaatac ccacctggtt tctactgtgg tgatggtgat 420
aacttccact atgaagatgt tccattatta gatacttgga aagctttgga aaaattggtt 480
gaagctggta agatcaaatc tattggtatt tccaatttta ctggtgcttt gatttacgat 540
ttgatcagag gtgctactat caaaccagct gttttacaaa ttgaacatca cccatacttg 600
caacaaccaa aattgattga atatgttcaa aaagctggta ttgccattac tggttactct 660
tcatttggtc cacaatcatt cttggaattg gaatccaaga gagctttgaa taccccaact 720
ttatttgaac atgaaactat taaatcaatt gctgataaac atggtaaatc cccagctcaa 780
gttttgttaa gatgggctac tcaaagaaac attgctgtta ttccaaaatc aaacagtcca 840
gaaagattag ctcaaaactt gtctgttgtt gactttgact tgactcaaga agatttggac 900
aatattgcta aattggacat tggtttgaga ttcaatgatc catgggactg ggacaacatt 960
ccaatctttg tttaa 975
<210> 2
<211> 1095
<212> DNA
<213> 木糖醇脱氢酶XDH核苷酸序列
<400> 2
atgactgcaa acccatcatt agttcttaac aaagttgacg atatttcctt tgaagaatac 60
gaagctccaa aactcgaatc accaagagat gtcattgttg aagttaagaa aactggtatc 120
tgtggatcag atatccatta ctatgcccat ggttcaattg gtccatttat tttaagaaaa 180
ccaatggttt taggtcacga atcagcaggt gttgtttctg ctgtcggaag tgaagttacc 240
aacttgaagg ttggtgatag agttgccatt gaacctggtg taccttcaag atttagtgat 300
gagaccaaat ctggtcatta tcatttgtgc ccacatatgt cttttgccgc caccccacca 360
gttaacccag atgaaccaaa tcctcaaggt actttatgta aatactacag agtcccatgt 420
gactttttat tcaaattacc agatcatgtt tctttggagt tgggtgctat ggttgaacca 480
ttaactgttg gtgtccacgg ttgtaaattg gctgatttga aatttggtga agacgttgtt 540
gtttttggtg ccggtccagt tggtttgttg accgctgccg ttgctagaac aattggtgct 600
aaaagagtca tggttgttga tatttttgac aacaaattga agatggcaaa agatatgggt 660
gctgccactc atattttcaa ctcaaaaacc ggtggtgatt atcaagattt gatcaagagt 720
tttgatggtg ttcaaccttc agttgttttg gaatgtagtg gtgctcaacc atgtatctat 780
atgggtgtta aaatcttgaa agctggtggt agatttgttc aaattggtaa tgccggtggt 840
gatgtcaatt tcccaattgc tgatttctca accagagaat tggcattata tggttctttc 900
agatatggtt acggtgacta ccaaacttca attgatattt tagacagaaa ctacgtcaat 960
ggtaaagaca aagcaccaat taatttcgaa ttgttgatta ctcacagatt caagtttaaa 1020
gatgccatca aagcctatga tttggtcaga gcaggaaatg gtgctgtcaa atgtttaatt 1080
gatggtccag aatag 1095
<210> 3
<211> 412
<212> DNA
<213> TEF1启动子的核苷酸序列
<400> 3
gatcccccac acaccatagc ttcaaaatgt ttctactcct tttttactct tccagatttt 60
ctcggactcc gcgcatcgcc gtaccacttc aaaacaccca agcacagcat actaaatttt 120
ccctctttct tcctctaggg tgtcgttaat tacccgtact aaaggtttgg aaaagaaaaa 180
agagaccgcc tcgtttcttt ttcttcgtcg aaaaaggcaa taaaaatttt tatcacgttt 240
ctttttcttg aaattttttt ttttagtttt tttctctttc agtgacctcc attgatattt 300
aagttaataa acggtcttca atttctcaag tttcagtttc atttttcttg ttctattaca 360
acttttttta cttcttgttc attagaaaga aagcatagca atctaatcta ag 412
<210> 4
<211> 750
<212> DNA
<213> PGK1启动子的核苷酸序列
<400> 4
acgcacagat attataacat ctgcataata ggcatttgca agaattactc gtgagtaagg 60
aaagagtgag gaactatcgc atacctgcat ttaaagatgc cgatttgggc gcgaatcctt 120
tattttggct tcaccctcat actattatca gggccagaaa aaggaagtgt ttccctcctt 180
cttgaattga tgttaccctc ataaagcacg tggcctctta tcgagaaaga aattaccgtc 240
gctcgtgatt tgtttgcaaa aagaacaaaa ctgaaaaaac ccagacacgc tcgacttcct 300
gtcttcctat tgattgcagc ttccaatttc gtcacacaac aaggtcctag cgacggctca 360
caggttttgt aacaagcaat cgaaggttct ggaatggcgg gaaagggttt agtaccacat 420
gctatgatgc ccactgtgat ctccagagca aagttcgttc gatcgtactg ttactctctc 480
tctttcaaac agaattgtcc gaatcgtgtg acaacaacag cctgttctca cacactcttt 540
tcttctaacc aagggggtgg tttagtttag tagaacctcg tgaaacttac atttacatat 600
atataaactt gcataaattg gtcaatgcaa gaaatacata tttggtcttt tctaattcgt 660
agtttttcaa gttcttagat gctttctttt tctctttttt acagatcatc aaggaagtaa 720
ttatctactt tttacaacaa atataaaaca 750
<210> 5
<211> 248
<212> DNA
<213> 终止子的核苷酸序列
<400> 5
tcatgtaatt agttatgtca cgcttacatt cacgccctcc ccccacatcc gctctaaccg 60
aaaaggaagg agttagacaa cctgaagtct aggtccctat ttattttttt atagttatgt 120
tagtattaag aacgttattt atatttcaaa tttttctttt ttttctgtac agacgcgtgt 180
acgcatgtaa cattatactg aaaaccttgc ttgagaaggt tttgggacgc tcgaaggctt 240
taatttgc 248
- 还没有人留言评论。精彩留言会获得点赞!