一种内源性糖改善米渣蛋白功能特性的方法及其产品与流程
本发明属于食品科学与工程技术领域,具体涉及一种内源性糖改善米渣蛋白功能特性的方法及其产品。
背景技术:
以大米为原料发酵生产乳酸、淀粉糖、柠檬酸及生化药品等的糖化工序会产生大量副产物一米渣。米渣中蛋白质的质量分数高达70%(干基),相当于纯大米中蛋白质含量的5.8倍。大米蛋白具有良好的氨基酸组成配比,消化率极高,其品质被公认为粮食种子蛋白质中的最佳者,是一种优良的植物蛋白。由于米渣蛋白的低过敏性,非常适用于婴幼儿食品。此外大米蛋白还具有重要的保健功能。近年来的研究表明,大米蛋白对抗糖尿病、抗胆固醇和抗癌变等都有一定的作用。
由于经历了长时间的化学和酶解处理,米渣中大米蛋白不再是天然的大米蛋白。溶解度大大降低并失去与之相关的某些功能性质,限制了其在食品中的应用。此外,在实际生产中,不同食品体系对蛋白质功能特性的要求往往不同,如液态乳制品对蛋白乳化性能要求较高;肉制品对蛋白凝胶性能要求较高;而速溶豆奶粉则对分散性和溶解性能要求更高。因此为了扩大米渣的应用范围,获取专用性极强的大米蛋白,必须要对米渣蛋白进行改性。
蛋白质的接枝改性就是通过化学或生物技术对蛋白质的结构进行修饰,在侧链上的活性基团(如-NH2,-OH等)导入一种或多种基团。常用的修饰技术包括对氨基酸残基的酰化、去酰胺、磷酸化、糖基化(利用美拉德反应)、烷基化、水解以及氧化等。
中国专利201410266430.8《一种米渣蛋白的糖基化改性方法》提供了一种米渣蛋白的糖基化改性方法,但该方法依赖于外源性糖的添加。
技术实现要素:
为解决现有技术的不足,提高米渣蛋白的乳化性、溶解性、热稳定性、pH以及盐离子稳定性等功能特性,提高应用范围,获取专用性极强的米渣蛋白,并同时提高米渣的综合利用率,本发明提供了一种内源性糖改善米渣蛋白功能特性的方法及其产品。
本发明所提供的技术方案如下:
一种内源性糖改善米渣蛋白功能特性的方法,包括以下步骤:将米渣酶解得到米渣内源性糖份和米渣蛋白份,再将所述米渣内源性糖份与所述米渣蛋白份进行美拉德反应,得到内源性糖的糖基化米渣蛋白。
进一步的,内源性糖改善米渣蛋白功能特性的方法包括以下步骤:将米渣酶解,得到米渣内源性糖份和米渣蛋白份的混合份,再将所述混合份进行美拉德反应,得到内源性糖的糖基化米渣蛋白。
具体的,酶解过程为:利用高温α-淀粉酶将米渣中的淀粉水解至糊精和低聚糖。
具体的,酶解之后:将米渣内源性糖份和米渣蛋白份置于蒸馏水中配置成均匀的分散液,调节pH=7,冷冻干燥,得到待反应粉末,所述待反应粉末再进行美拉德反应。
具体的,酶解之后:利用纤维素酶去除混合份中的纤维素类多糖再进行美拉德反应。
优选的,内源性糖改善米渣蛋白功能特性的方法包括以下步骤:
1)米渣糊化后利用高温α-淀粉酶将米渣中的淀粉水解至糊精和低聚糖,得到米渣内源性糖份和米渣蛋白份的混合份;
2)将步骤1)得到的混合份利用纤维素酶去除纤维素类多糖,得到待分散混合物;
3)将步骤2)得到的待分散混合物置于蒸馏水得到分散液,搅拌均匀,调pH至7.0,冷冻干燥,得到待反应粉末;
4)将步骤3)得到的待反应粉末置于恒温恒湿培养箱中进行反应,得到内源性糖的糖基化米渣蛋白。
优选的,步骤1)中:糊化时,米渣与水的固液比为1:8~10,米渣的糊化温度为85~90℃,糊化时间为10~12min;酶解时,高温α-淀粉酶的添加量为300~400u/mL,酶解时间为1.5~3h,酶解pH值为5.5~6.0,酶解温度为85~95℃。
优选的,步骤2)中,纤维素酶的添加量为110~120u/g,酶解时间为2.5~3h,酶解pH值为4.0~4.5。
优选的,恒温恒湿培养箱的温度为55~65℃、相对湿度为78~80%、培养时间12~24h。
本发明还提供了根据上述内源性糖改善米渣蛋白功能特性的方法制备得到的内源性糖的糖基化米渣蛋白。
本发明所提供的糖基化蛋白质不仅在乳化性能方面得到改善,在溶解性、热稳定性、pH以及盐离子稳定性等功能特性方面都有不同程度的提高,对外界环境的变化具有较大的抵抗能力。现有技术中,一般将蛋白质与糖按照一定的比例溶解于选定pH值的缓冲溶液中,分散均匀后进行冷冻干燥,在50-60℃和相对湿度(用饱和KBr维持在79%的相对湿度)下进行的非酶糖基化反应,通过降低温度来抑制反应的进行。本发明利用美拉德反应对蛋白质进行糖基化改性,提供了是一种简单快速的方法。本发明所提供的内源性糖改善米渣蛋白功能特性的方法直接将米渣中的淀粉酶解至糖类,得到米渣蛋白和糖类的混合物,进而通过美拉德反应进行糖基化,得到糖基化米渣蛋白,提高米渣的综合利用率,而不用添加外源糖类。该方法工艺简单、无环境污染、适合工业化生产的优势。得到的渣蛋白可作为液态乳制品、肉制品或速溶制品等的原料或添加剂,专用性极强。
附图说明
图1是酶处理法米渣蛋白美拉德反应产物的乳化性与乳化稳定性。
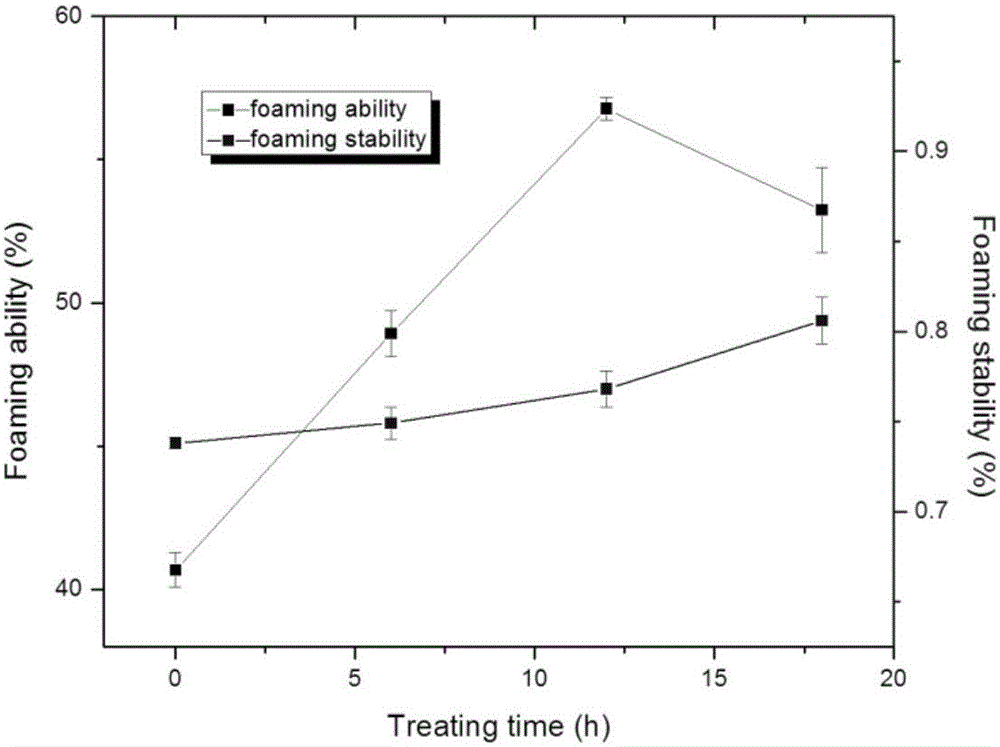
图2是酶处理法米渣蛋白美拉德反应产物的起泡性和起泡稳定性。
图3是酶处理法米渣蛋白美拉德反应产物的分散液溶解性对照图。
图4为米渣蛋白经过淀粉酶处理后美拉德反应产物在不同pH值条件下电位变化图。
图5为米渣蛋白美拉德反应产物电泳图谱。
图6为不同pH下米渣蛋白、酶法米渣蛋白改性产物及米渣蛋白-糖复合物的溶解性图。
图7为米渣蛋白、酶法米渣蛋白改性产物及米渣蛋白糖复合物的红外谱图。
图8为放大倍数为2000倍的米渣蛋白和内源性糖类-米渣蛋白美拉德法改性产物的扫描电镜图。
图9为放大倍数为1000倍的米渣蛋白和内源性糖类-米渣蛋白美拉德法改性产物的扫描电镜图。
图10为放大倍数为500倍的米渣蛋白和内源性糖类-米渣蛋白美拉德法改性产物的扫描电镜图。
具体实施方式
以下对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的范围。
实施例1
将米渣研磨过20目筛,称取米渣固体粉末10g加入80mL蒸馏水,调节pH至6.0,90℃水浴10min,120r/min摇匀,加入2400u高温α-淀粉酶,90℃水浴1.5h。冷却调节pH至4.5加入纤维素酶1100u,55℃水浴2.5h。灭酶,干燥得到混合粉末。将混合粉末分散于蒸馏水,调节体系pH至7.0,冷冻干燥。将冷冻干燥后的粉末平铺在玻璃或塑料培养皿上,迅速置于恒温恒湿培养箱中,调节培养箱温度为60℃,相对湿度为79%,反应12h。本实施例改性米渣蛋白比未改性米渣蛋白相比,乳化性提高了66%,在等电点附近的溶解性提高50%,pH,盐离子以及热稳定性明显改善。
实施例2
将米渣研磨过20目筛,称取米渣固体粉末50g加入500mL蒸馏水,调节pH至6.0,90℃水浴10min,120r/min摇匀,加入15000u高温α-淀粉酶,90℃水浴1.5h。冷却调节pH至4.5加入纤维素酶5500u,55℃水浴2.5h。灭酶,干燥得到混合粉末。将混合粉末分散于蒸馏水,调节体系pH至7.0,冷冻干燥。将冷冻干燥后的粉末平铺在玻璃或塑料培养皿上,迅速置于恒温恒湿培养箱中,调节培养箱温度为60℃,相对湿度为79%,反应12h。本实施例改性米渣蛋白比未改性米渣蛋白相比,乳化性提高了58%,在等电点附近的溶解性提高42%,pH,盐离子以及热稳定性明显改善。
实施例3
将米渣研磨过20目筛,称取米渣固体粉末10g加入80mL蒸馏水,调节pH至5.5,85℃水浴10min,120r/min摇匀,加入2400u高温α-淀粉酶,90℃水浴1.5h。冷却调节pH至4.0加入纤维素酶1100u,55℃水浴2.5h。灭酶,干燥得到混合粉末。将混合粉末分散于蒸馏水,调节体系pH至7.0,冷冻干燥。将冷冻干燥后的粉末平铺在玻璃或塑料培养皿上,迅速置于恒温恒湿培养箱中,调节培养箱温度为55℃,相对湿度为79%,反应12h。本实施例改性米渣蛋白比未改性米渣蛋白相比,乳化性提高了63%,在等电点附近的溶解性提高50%,pH,盐离子以及热稳定性明显改善。
实施例4
将米渣研磨过20目筛,称取米渣固体粉末10g加入80mL蒸馏水,调节pH至6.0,90℃水浴10min,120r/min摇匀,加入2400u高温α-淀粉酶,90℃水浴2.0h。冷却调节pH至4.5加入纤维素酶1100u,55℃水浴3.0h。灭酶,干燥得到混合粉末。将混合粉末分散于蒸馏水,调节体系pH至7.0,冷冻干燥。将冷冻干燥后的粉末平铺在玻璃或塑料培养皿上,迅速置于恒温恒湿培养箱中,调节培养箱温度为60℃,相对湿度为79%,反应15h。本实施例改性米渣蛋白比未改性米渣蛋白相比,乳化性提高了67%,在等电点附近的溶解性提高50%,pH,盐离子以及热稳定性明显改善。
效果例
材料与试剂
米渣(蛋白质70.0%;碳水化合物20.0%;水分9.7%;脂肪3.5%;)碱提米渣蛋白
仪器与设备
试验方法
乳化性的测定
称取一定量的蛋白产品溶于50mL蒸馏水中,调节pH值到一定值,加入50mL大豆色拉油,在高速组织捣碎机中均质(10000~12000r/min)2min,再离心(1500r/min)5min。按下式计算乳化能力:
乳化稳定性的测定
将上述离心管置于80℃水浴中,加热30min后,冷却至室温,再离心(1500r/min)5min,测出此时的乳化层高度,则乳化稳定性为:
起泡性和泡沫稳定性的测定
将一定量的蛋白产品溶解到100mL蒸馏水中,调节pH值到一定值,在DS-1高速组织捣碎机中均质(10000~12000r/min)2min,记下均质停止时泡沫体积,则起泡性为:
均质停止30mim后,记下此时泡沫体积,则泡沫稳定性为:
美拉德法改性米渣蛋白的乳化性和乳化稳定性
将采用淀粉酶提取出来的米渣蛋白经过美拉德反应后,分别测定了美拉德反应产物乳化性和乳化稳定性,如图1所示,0min是指高速分散处理后立即测量的值,10min是指高速分散后放置10min测量的值。从图1的上半部分可以看出,随着美拉德反应时间的增加,其乳化性呈现出不断上升的趋势;图1的下半部分表明,随着美拉德反应时间的增加,其乳化稳定性呈现先降低后升高的趋势,且在反应12小时以后其乳化稳定性迅速提高。这说明采用美拉德法对米渣蛋白质改性后其乳化性和乳化稳定性得到了改善。
由于在进行美拉德反应时,没有添加外源性的羰基物质,而是利用在淀粉酶法提取米渣蛋白时水解出的糖类作为糖源。因此合理地利用了资源,而且操作更为简便。
美拉德法改性米渣蛋白的起泡性和起泡稳定性
将采用淀粉酶提取出来的米渣蛋白经过美拉德反应后,分别测定了美拉德反应产物起泡性和起泡稳定性,如图2所示。从图2可以看出,随着美拉德反应时间的增加,其起泡稳定性呈现出不断上升的趋势;随着美拉德反应时间的增加,其起泡则性呈现先升高后降低的趋势,在反应12小时呈现最大之后数据急剧下降。因此,在美拉德反应12小时后米渣蛋白质的起泡性性和起泡稳定性得到了改善。
美拉德法改性米渣蛋白分散液的稳定性
如图3所示,米渣蛋白的等电点(pI)在5.0左右,此时蛋白由于静电荷为零,静电斥力减弱导致蛋白溶解性最小,从而使蛋白发生聚集,分散系变浑浊,而美拉德反应之后的米渣蛋白-乳糖共聚物分散系在pH 5.0时比未改性的米渣蛋白澄清(图3中B)。这可能因为米渣蛋白在美拉德反应后:(1)糖分子的引入,导致静电作用力增强,足以维持体系的稳定;(2)蛋白质表面多糖的位阻效应对蛋白的聚集有阻碍作用。产物在pH值3-7内保持热稳定,并且其产物在150mmol/L NaCl离子范围内保持澄清。说明美拉德反应之后的米渣蛋白-乳糖共聚物溶液能抗高离子强度及酸碱度的改变。图3中:米渣经过淀粉酶处理后,进行美拉德反应A:0h;B:6h;C:12h;D:18h产物(反应条件:pH 7.0,温度60℃、湿度79%)(蛋白浓度为5mg/mL)分散液溶解性结果样品分别调pH至3.0,5.0,7.0;每张图片从左至右的NaCl浓度为0、10、20、30mmol/L。
美拉德法改性米渣蛋白在不同pH值条件下电位变化如图4所示,从上到下的曲线依次对应0h、6h、12h、18h。
为了研究清楚到底是蛋白质的表面引入糖基的静电作用还是其位阻作用导致美拉德反应产物的溶解性及热稳定性增强,我们对其表面电势进行了研究,结果显示:在pH值小于等电点时,米渣蛋白的电位要高于糖基化后产物的电位,在pH值大于等电点时,米渣蛋白的电位高于改性后米渣蛋白-乳糖的电位,其结果表明糖分子接入米渣蛋白后,赖氨酸含量减少,导致正电荷减少,相对负电荷增加。从而说明溶液热稳定性的增加不是因为静电作用力增强来维持体系的稳定,而是蛋白质表面多糖的位阻效应对蛋白的聚集有阻碍作用。同时,米渣蛋白在美拉德反应改性后,等电点有所减小。这是因为当还原糖分子的还原末端接入米渣蛋白的游离氨基位点时,减少了米渣蛋白所带的正电荷,相对增加了米渣蛋白所带的负电荷,从而导致其等电点向酸性方向偏移。
美拉德法改性米渣蛋白质的电泳特性
图5为米渣蛋白美拉德反应产物电泳图谱;
a:蛋白标准品
1:米渣蛋白空白;
2:淀粉酶处理后0h产物;
3:淀粉酶处理后6h产物;
4:淀粉酶处理后12h产物;
5:淀粉酶处理后18h产物;
6:碱法提取米渣蛋白后,蛋白与葡萄糖比1:1;进行美拉德反应6h产物;
7:碱法提取米渣蛋白后,蛋白与葡萄糖比1:1;进行美拉德反应12h产物;
8:碱法提取米渣蛋白后蛋白与葡萄糖比1:1;进行美拉德反应18h产物;(反应条件:pH7.温度60℃、湿度79%)。
电泳图谱是分析蛋白质组成成分的重要手段,常使用考马斯亮蓝染色来分析糖基化产物中糖链接入后蛋白质分子量的变化。电泳结果如图5所示,条带1代表蛋白标准品特征条带,分子量分布范围为14.4~116ku。
主要原料与试剂
花生油山东鲁花集团有限公司
十二烷基磺酸钠(SDS)美国Sigma公司
溴化钾,凯氏定氮试剂,磷酸氢二钠,磷酸二氢钠等均为分析纯。
主要仪器与设备
pH计FE20 梅特勒—托利多仪器(上海)有限公司
85-2数显恒温磁力搅拌器江苏省金坛市荣华仪器制造有限公司
k9840自动凯式定氮仪济南海能仪器股份有限公司
离心机长沙平凡仪器仪表有限公司
XHF-D高速分散器宁波新芝科技股份有限公司
UV-5500PC紫外可见分光光度计上海元析仪器有限公司
DSC-Q10型差示扫描量热仪美国TA公司
S-3000N扫描电子显微镜日本HITACHI公司
NEXUS 670傅立叶红外光谱仪美国尼高力仪器公司
蛋白水解液氨基酸分析系统日本日立公司
J-810圆二色光谱仪日本Jasco公司
溶解性测定
称取一定量的待测样品溶于去离子水中,浓度为1mg/mL,用1MHCl或1M NaOH调节溶液的pH值(2、4、6、8、10、12),在磁力搅拌器上常温搅拌10min,然后4000r/min高速离心10min,取上清液,采用凯式定氮法测定蛋白质含量。
测定米渣蛋白、外源性糖类-米渣蛋白美拉德法改性产物、内源性糖类-米渣蛋白美拉德法改性产物在pH=2、4、6、8、10、12下的溶解性,结果见图6。
从图6可看出,对应pH下,与米渣蛋白相比,外源性糖类-米渣蛋白美拉德法改性产物、内源性糖类-米渣蛋白美拉德法改性产物的溶解性都有较大提升,特别是从pH 6开始,提升非常明显。三者的溶解性均在pH4时最低,此时比较接近米渣蛋白的等电点。外源性糖类-米渣蛋白美拉德法改性产物、内源性糖类-米渣蛋白美拉德法改性产物在较宽的pH范围内都具有较好的溶解性。外源性糖类-米渣蛋白美拉德法改性产物从pH=8开始变化的趋势更加明显,说明它能够保持较好溶解性的pH范围比米渣蛋白麦芽糊精复合物更窄,而内源性糖类-米渣蛋白美拉德法改性产物的溶解性表现的更为稳定。
对米渣蛋白、内源性糖类-米渣蛋白美拉德法改性产物及外源性糖类-米渣蛋白美拉德法改性产物进行傅里叶红外光谱分析,结果见图7。
当蛋白质和糖分子以共价键结合后,在红外图谱上的典型特征是在3700~3200cm-1范围内和1260~1000cm-1范围内吸收增强,这分别是羟基和碳氧键的伸缩振动引起的。
从图7可看出,3700~3200cm-1范围内的吸收强度,内源性糖类-米渣蛋白美拉德法改性产物>外源性糖类-米渣蛋白美拉德法改性产物>米渣蛋白,说明米渣蛋白通过与糖类发生美拉德反应增加了羟基数量,且米渣蛋白与内源糖类反应增加的羟基数量比与外源糖类反应得多。
在1260~1000cm-1范围内的吸收强度,内源性糖类-米渣蛋白美拉德法改性产物>外源性糖类-米渣蛋白美拉德法改性产物>米渣蛋白,说明米渣蛋白通过与糖类发生美拉德反应引入了更多碳氧键,且米渣蛋白与麦芽糊精反应引入的碳氧键比米渣蛋白与葡萄糖反应的多。
酰胺I带(-NH弯曲振动,1700~1600cm-1)和酰胺III带(C-N伸缩振动和N-H弯曲振动,1300~1450cm-1)的吸收强度,内源性糖类-米渣蛋白美拉德法改性产物>外源性糖类-米渣蛋白美拉德法改性产物>米渣蛋白,说明米渣蛋白通过与葡萄糖、麦芽糊精发生美拉德反应,其中的-NH2基团发生了反应。
从以上结论综合可以得出:内源性糖类对米渣蛋白进行美拉德法改性时,羰氨反应程度更高。
扫描电子显微镜(SEM)分析
对米渣蛋白和内源性糖类-米渣蛋白美拉德法改性产物进行扫描电子显微镜分析,结果见图8、图9、图10。
在图8、图9、图10中,每张图中左右部分依次是米渣蛋白和内源性糖类-米渣蛋白美拉德法改性产物。
从放大倍数2000的扫描电镜图中可看出:米渣蛋白呈螺旋结构有序地缠绕在一起,结构较稀松;米渣蛋白与内源性糖类发生美拉德反应后米渣蛋白充分伸展开来。
从放大倍数1000的扫描电镜图中可看出:米渣蛋白结构有序且稀松;米渣蛋白与内源性糖类发生美拉德反应后米渣蛋白呈片状形态。
从放大倍数500的扫描电镜图中可看出:米渣蛋白以圆条状有序缠绕在一起;米渣蛋白与内源性糖类发生美拉德反应后部分米渣蛋白充分伸展开来,变成片状形态,与没有充分伸展开来的米渣蛋白包围在一起。
综上所述可以得出结论,米渣蛋白与内源性糖类发生美拉德反应后部分米渣蛋白的二级结构遭到破坏,分子充分伸展开来,丧失了原有形态,呈片状形态。
综合以上各部分结论,结果表明:采用内源性糖类对米渣蛋白进行改性时,美拉德反应进行的更为彻底。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!