一种S型的ω‑转氨酶ATA‑W12及其基因和应用的制作方法
本发明涉及生物工程技术领域,更具体地涉及一种S型的ω-转氨酶ATA-W12及其基因和应用。
背景技术:
利用磷酸吡哆醛(PLP)作为辅酶的酶称为PLP酶。根据已知的蛋白序列和空间结构,PLP酶可分为五大类。其中大部分属于第一类,即天冬氨酸转氨酶家族,包括芳香胺转氨酶、甘氨酸乙酰基转移酶。其他几类PLP酶的代表依次为:第二类的色氨酸合成酶β族,第三类的真核生物鸟氨酸脱羧酶,第四类的D-甘氨酸转氨酶,第五类的糖原磷酸化酶。所有的这五类酶都是以同源二聚体或更高级别的寡聚物组成。酶的活性中心位于亚基的表面,并且每个亚基都贡献活性中心的氨基酸残基。在PLP结合区域,这些酶有2个保守区域:一个用来和PLP形成席夫碱的赖氨酸残基和一个用来和辅酶磷酸基团相联系的富含甘氨酸的loop。
转氨酶主要指的是第一类或第四类PLP酶。在转氨反应中,氨基供体首先和PLP共价结合形成磷酸吡多胺(PMP),随后PMP把氨基转移给含有羰基的氨基受体,由此完成转氨反应和辅酶的循环(如图1所示)。根据蛋白质结构和序列的特点,第一类PLP酶又可以分为五大类,即转氨酶总共分为六大类。其中第三类的转氨酶最受人们关注,这些酶的天然氨基供体底物都有一个共同特点:氨基位于羧基的非α位上。这些酶称为ω-转氨酶。ω-转氨酶构成了第三类转氨酶中的绝大部分。
许多具有生物活性的物质或其中间体都是手性胺,例如(R)-2-氨基-4-苯基丁烷是降压药地来洛尔的前体,苯丙胺是强效抗抑郁药的手性砌块,(S)-2-氨基-1-苯基丙基醚是除草剂Outlook的手性砌块。然而,这些手性胺的制备大部分还是传统的化学法,虽然化学法的反应体系明确,但是缺点也很多,其对环境污染严重,反应链冗长,立体选择性差,特别是过渡态金属的使用以及复杂的后期处理过程大幅度增加了生产成本。ω-转氨酶酶法合成因其温和的反应条件,良好的立体选择性,较高的转化率,简单的后期处理等特性能很好的解决上述问题。2010年,Christopher K.Savile等人利用蛋白质工程手段得到的ω-转氨酶突变型ATA-117成功的运用于抗糖尿病新药Januvia的主要成分西他列汀的酶法合成工艺中,这项工艺获得了当年的美国总统绿色化学挑战奖,这也标志着ω-转氨酶在手性胺合成中具有重要的应用前景。
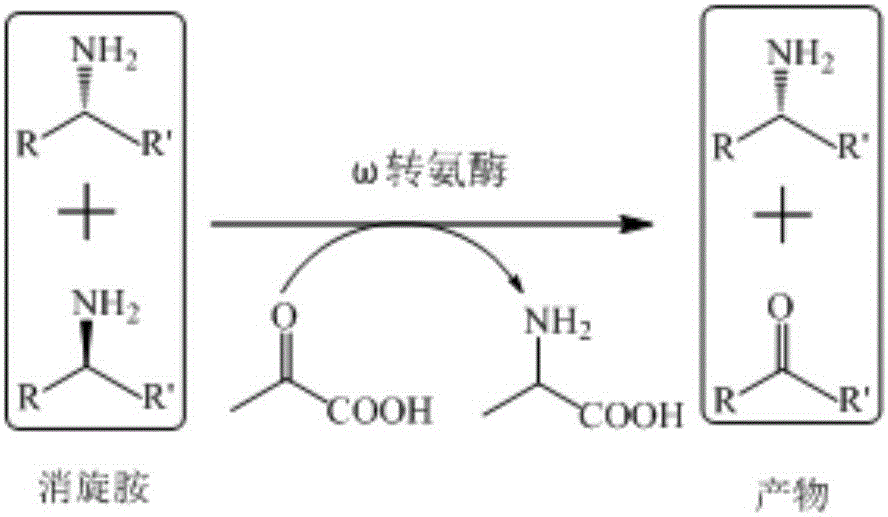
生物催化制备手性胺有2种途径:①酶催化拆分外消旋胺(如图2所示);②酶催化不对称合成手性胺(如图3所示)。第一种手性拆分外消旋胺的方法简单易行,但其最大转化率只能达到50%,而且前体酮的还原胺化增加了生产成本,这无疑限制了它的工业化应用进程。第二种不对称催化合成的方法是目前研究的热点,因其理论产率能够达到100%,但是存在严重的平衡抑制问题。
光学纯的3-氨基哌啶(3APi)是一类非常重要的医药中间体,被用来合成一系列的生物活性药物,例如妥舒沙星、克林沙星和头孢菌素类衍生物。其他含有光学纯3-氨基哌啶基团的化合物被用于治疗肥胖症和Ⅰ型或者Ⅱ型糖尿病,以及用于合成治疗抑郁症和精神分裂症等的精神药物。目前关于合成3-氨基哌啶的文献报道有很多,主要有三种不同的路线:取代,环化,拆分剂拆分。这些方法大多有一个或者更多的缺点:叠氮取代时需要用到昂贵的1-N保护的甲苯磺酸化的乙醇,即使合成也要经过繁杂的步骤。由于取代过程涉及到构型的反转,无立体选择性的SN1取代过程则必须排除,避免产生立体选择性相反的产物。这些文献提供的方法,都没有使用色谱技术去检测产物的光学纯度。至于环化反应,1-N,3-N保护的3-氨基哌啶可以由光学纯的天冬氨酸或谷氨酸环化得到,或者由环化的二酮化合物还原得到的氨基酸再环化生成。然而,所有的环化反应所得到的产率都比较低,光学纯度也很低。例如,由(S)-2,4-二氨基丁酸,经过两步可以得到(S)-3-氨基哌啶,但是产率非常低。环化过程最大的问题是产率只能达到50%,而且后期的处理包括拆分剂的循环利用和对映体的回收费时费力。目前合成3-氨基哌啶的方法主要是化学法,所以生物催化转化法制备(S)-3-氨基哌啶具有良好的应用价值。
技术实现要素:
本发明的目的是提供一种S型的ω-转氨酶ATA-W12及其基因和应用,从而解决现有技术中制备手性胺的生物酶的缺失。
为了解决上述技术问题,本发明采用以下技术方案:
根据本发明的一个方面,提供一种S型的ω-转氨酶ATA-W12,其氨基酸序列如SEQ ID NO:2所示。
所述ω-转氨酶ATA-W12来源于棉花地土壤宏基因组。
根据本发明的另一方面,还提供一种S型的ω-转氨酶基因ata-w12,其碱基序列如SEQ ID NO:1所示。
还提供一种重组质粒,所述重组质粒由所述S型的ω-转氨酶基因ata-w12与表达载体质粒连接构建而成。
优选地,该表达载体质粒为pET-28a,可构建重组质粒ata-w12-pET-28a。
根据本发明的又一方面,提供一种S型的ω-转氨酶ATA-W12基因工程菌株,其所述S型的ω-转氨酶ATA-W12基因工程菌株是将所述重组质粒转化宿主菌获得的基因工程菌株。
本发明还提供一种所述S型的ω-转氨酶ATA-W12以及所述S型的ω-转氨酶ATA-W12基因工程菌株在合成手性胺类产品中的应用。
所述S型的ω-转氨酶ATA-W12的催化温度为20~60℃,最优选为40℃。
所述S型的ω-转氨酶ATA-W12的催化还原pH为8.0~10.0,最优选为8.5。
特别是所述ω-转氨酶ATA-W12以及所述基因工程菌株被用于催化N-Boc-3-哌啶酮生成(S)-N-Boc-3-氨基哌啶的应用。
具体地,本发明还提供了一种将ω-转氨酶ATA-W12基因工程菌株用于催化N-Boc-3-哌啶酮生成(S)-N-Boc-3-氨基哌啶的应用,该应用包括:将S型的ω-转氨酶ATA-W12基因工程菌株培养所得的ATA-W12湿菌体作为催化剂,在以下反应体系中进行催化反应:pH 8.5Tris-HCl、ATA-W12湿菌体、500mM N-Boc-3-哌啶酮、2mL DMSO、1.5M酸化异丙胺、0.2mM PLP于40℃水浴锅中,搅拌,反应结束,反应液用乙酸乙酯萃取,收集萃取相,离心,取有机相减压旋蒸回收乙酸乙酯,得到淡黄色油状液体即为(S)-N-Boc-3-氨基哌啶的粗品。
总之,本发明首次从棉花地土壤宏基因组中扩增得到了一种S型的ω-转氨酶基因ata-w12,并构建了一株含有该S型的ω-转氨酶基因ata-w12的基因工程菌株,从而实现了该S型的ω-转氨酶基因ata-w12的异源表达,所获得的ω-转氨酶ATA-W12具有优良的酶学特性,催化胺化的温度范围为20-60℃,催化胺化pH值为8.0-10.0,在40℃条件下保存164h后酶活不减反增。此外,本发明还提供一种所述ω-转氨酶ATA-W12以及所述基因工程菌株在合成手性胺类产品中的应用,特别是ω-转氨酶ATA-W12以及所述基因工程菌株被用于催化N-Boc-3-哌啶酮生成(S)-N-Boc-3-氨基哌啶的应用。本发明的生物催化法单水相制备手性胺(S)-N-Boc-3-氨基哌啶,产量高达500mM/L(100g/L)。与传统的化学法相比,该ω-转氨酶ATA-W12基因工程菌具有反应速率快、方便、底物浓度高的特点。
附图说明
图1是ω-转氨酶的作用原理图;
图2是酶催化拆分外消旋有机胺的原理图;
图3是酶催化不对称合成手性胺的原理图;
图4是本发明纯化的ω-转氨酶ATA-W12的SDS-PAGE图,其中,M为蛋白Marker,1为纯化后的目的蛋白ω-转氨酶ATA-W12;
图5是本发明的ω-转氨酶ATA-W12的最适反应pH示意图;
图6是本发明的ω-转氨酶ATA-W12的最适反应温度示意图;
图7是本发明的ω-转氨酶ATA-W12的热稳定性示意图;
图8是本发明的ω-转氨酶ATA-W12基因工程菌株催化生成(S)-N-Boc-3-氨基哌啶的示意图。
具体实施方式
以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
1.来源于土壤宏基因组的ω-转氨酶基因ata-w12的扩增
本发明的ω-转氨酶基因ata-w12来源于棉花地土壤宏基因组,该土壤宏基因组就是山东省一般的棉花地采集的土壤样品提取的基因组,然后宏基因组测序所得。基于NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)的同源比对,本申请的发明人发现一个与其相似性最高为89%的来源于Caulobacter sp.K31的ω-转氨酶。
本发明的ω-转氨酶基因ata-w12的核苷酸序列如SEQ ID NO:1所示,大小为1407bp。
根据序列分析结果设计扩增ω-转氨酶基因ata-w12的引物:
ata-w12F:5'AACCGGAATTCATGACCGCCCCCCTCCGCA 3'
ata-w12R:5'AACCCAAGCTTTCAGTCCTCGCCCTCCTTA 3'
以上述棉花地土壤宏基因组为模板,采用上面设计的引物进行PCR扩增,得到ω-转氨酶基因ata-w12。
2.含有ω-转氨酶基因ata-w12的重组质粒(ata-w12-pET-28a)的构建
本发明的含有ω-转氨酶基因ata-w12的重组质粒是通过将ω-转氨酶基因ata-w12与可选的质粒pET-28a(作为表达载体)连接构建而成。该ω-转氨酶基因ata-w12与质粒pET-28a的结合位点是EcoR I和HindIII。以土壤宏基因组为模板,以设计含酶切位点的引物ata-w12F/ata-w12R通过PCR扩增,得到ω-转氨酶基因ata-w12。
PCR扩增体系如下(50μL):2×Taq Plus Master PCR Mix 25μL,引物2μL,模板2μL,加ddH2O补足至25μL。PCR扩增条件:94℃5min;94℃30sec,55℃30sec,72℃3min,30个循环;72℃5min。PCR产物通过琼脂糖凝胶电泳验证大小以及胶回收纯化。具体步骤按照FAVORGEN DNA琼脂糖凝胶回收试剂盒,回收的基因片段和pET-28a质粒37℃下进行双酶切。回收酶切片段并于16℃连接过夜,将连接产物转入大肠杆菌DH5α感受态细胞,均匀涂布在卡那霉素抗性平板上,37℃倒置培养16h,挑取单菌落验证为阳性克隆后经LB培养基培养后提取质粒,获得ω-转氨酶基因ata-w12与质粒pET-28a的重组质粒ata-w12-pET-28a。
3.含有ω-转氨酶基因ata-w12的重组基因工程菌株的构建
将上述实施例2获得的重组质粒ata-w12-pET-28a转入大肠杆菌BL21(DE3)感受态细胞(天根生物有限公司),均匀涂布在卡那霉素抗性平板上,37℃倒置培养16h,挑取单菌落验证为阳性克隆后经LB培养基培养获得重组基因工程菌株。
4.ω-转氨酶ATA-W12蛋白的表达和纯化
4.1将上述构建的重组基因工程菌株接种于含LB(+50μg/mL kanamycin)培养基的试管中,37℃摇床培养12h。
4.2以1%的接种量接种到新鲜的液体LB(+100μg/mL kanamycin)培养基中,200转/分的转速下37℃摇至OD[600]=0.6,加IPTG至100μM/mL,20℃诱导20h。
4.3菌液在4℃、8000rpm/min离心5min,收集菌体。生理盐水(0.85%g/L NaCl)清洗一次,4℃、8000rpm/min离心5min,收集菌体。将菌体用含有0.1mM PLP的Tris-HCL(pH 8.5)重悬,于低温水浴中超声破碎,将破碎后的粗酶液8000rpm离心10min后,吸取上清用Ni NTA Beads(Smart-Lifesciences)纯化,超滤脱盐浓缩,获得目的蛋白,即ω-转氨酶ATA-W12。
4.4对获得的目的蛋白进行SDS-PAGE,结果如图4所示,ω-转氨酶ATA-W12在大肠杆菌中表达,在TPI-250(含0.1mM PLP)洗脱条件下纯化后为单一条带。
该ω-转氨酶ATA-W12的氨基酸序列如SEQ ID NO:2所示,共468个氨基酸,其理论分子量为51kDa。
5.ω-转氨酶ATA-W12的最适反应pH值分析
本发明的重组ω-转氨酶ATA-W12的最适反应pH在6.0-10.5范围内测定。检测的反应体系(200μL)为:不同pH值缓冲溶液,2.5mM丙酮酸和2.5mM(S)-α-甲基苄胺,3.92×10-7g纯蛋白(即重组ω-转氨酶ATA-W12),37℃条件下反应5min,在245nm波长下测定吸收值。测定所使用的缓冲液为:100mM磷酸钠缓冲液(pH 6.0-8.0),100mM Tris-HCl缓冲液(pH 8.0-9.0),100mM甘氨酸-NaOH缓冲液(pH 9.0-10.0)。测定结果如图5所示,表明:重组ω-转氨酶ATA-W12的最适pH为pH 8.5的Tris-HCl缓冲溶液,在pH8.0-10.0范围内均具有较高活性。
6.ω-转氨酶ATA-W12的最适反应温度分析
本发明的重组ω-转氨酶ATA-W12的最适反应温度在4-70℃范围内测定。检测的反应体系(200μL)为:100mMTris-HCl缓冲溶液(pH 8.5),2.5mM丙酮酸和2.5mM(S)-α-甲基苄胺,3.92×10-7g纯蛋白(即重组ω-转氨酶ATA-W12),分别在4、20、30、40、50、60、65、70℃下反应5min,测定结果如图6所示,对ATA-W12最适反应温度分析发现ω-转氨酶ATA-W12的最适反应温度为40℃,40℃和50℃下酶活基本一致,40℃时酶活性不会随着反应时间的改变而降低,而在大于50℃的反应体系中酶活开始下降,70℃时酶几乎失去活性。综上所述,重组ω-转氨酶ATA-W12的最适反应温度为40℃。
7.重组ω-转氨酶ATA-W12的酶学稳定性分析
重组ω-转氨酶ATA-W12的热稳定性在40-70℃范围内测定,检测方法为:将纯化的ω-转氨酶ATA-W12酶液分别保温在40、50、60、70℃条件下,然后间隔同样时间取样测定残余酶活,检测的反应体系(200μl)为:100mMTris-HCl缓冲溶液(pH 8.5),2.5mM丙酮酸和2.5mM(S)-α-甲基苄胺,3.92×10-7g纯蛋白(即重组ω-转氨酶ATA-W12),在245nm波长下测定吸收值,分别在40℃下反应5min,测定结果如图7所示,表明:40℃时,168h酶活不减反增;50℃时,68h酶活下降到34.46%,168h降至5.54%;60℃时3h完全失活,70℃时1h就完全失活。
综上所述,该ω-转氨酶ATA-W12具有优良的酶学性质,催化温度范围为20-60℃,催化还原pH值为8.0-10.0。
8.重组ω-转氨酶ATA-W12的底物谱分析实验
该实验的目的是检测对根据上述实施例4所获得的ω-转氨酶ATA-W12具有活性的底物。检测的反应体系(200μl)为:100mMTris-HCl缓冲溶液(pH8.5),2.5mM氨基受体和2.5mM(S)-α-甲基苄胺,3.92×10-7g纯蛋白(即重组ω-转氨酶ATA-W12),在245nm波长下测定吸收值,分别在40℃下反应5min,测定结果如表1所示,以模式氨基受体丙酮酸的酶活作为100%。重组ω-转氨酶ATA-W12对丙酮酸的活性最高,对酮酯类物质具有较好的活性,其中,对丙酮酸甲酯和丙酮酸乙酯的活力较高,丙酮酸甲酯的相对酶活达到94.6%,丙酮酸乙酯的相对活力高达94.09%,而对芳香酮和脂肪酮类物质活性较低。
表1
9.ω-转氨酶ATA-W12催化生成(S)-N-Boc-3-氨基哌啶
将上述实施例3获得的含有ω-转氨酶基因ata-w12的重组基因工程菌株培养所得湿菌体ATA-W12作为催化剂在100mL的三口烧瓶中进行自动加样,2M异丙胺水溶液控制pH 8.5。反应体系(50mL):pH 8.5Tris-HCl、ATA-W12湿菌体(1g/10mL)、500mM N-Boc-3-哌啶酮、2mL DMSO、1.5M酸化异丙胺、0.2mM PLP于40℃水浴锅中,以300rpm/min的速度搅拌,隔1h取样,取三次平行样,用高效液相色谱检测(ZORBAX Extend-C18柱,4.6×250mm×5μm,流动相:28%乙腈:72%水(0.1%TFA),流速0.8mL/min,柱温37℃,进样量5μL,UV 210nm检测,底物N-Boc-3-哌啶酮出峰时间13min,产物N-Boc-3-氨基哌啶出峰时间3.8min),反应进程曲线如图8所示。500mM N-Boc-3-哌啶酮通过ω-转氨酶ATA-W12催化8h得到(S)-N-Boc-3-氨基哌啶,转化率为100%。反应结束后,取样品用五倍体积的乙酸乙酯萃取两次加无水硫酸钠干燥过夜,后溶于异丙醇中,利用高效液相色谱(Chiralcel AD-H,流动相:正己烷/乙醇=90:10v/v,1mL/min,柱温30℃,UV 210nm检测)测得ee值>99.95%。对映体过量值:ee(%)=(R-S)/(R+S)×100%,其中R、S分别为两种对映体含量。转化率(C)=(产物量/底物量)×100%。反应液用等体积的乙酸乙酯萃取三次,合并萃取相,12000rpm/min离心10min,取有机相30℃减压蒸馏回收乙酸乙酯,得到淡黄色油状液体为(S)-N-Boc-3-氨基哌啶的粗品。
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
序列表
<110> 华东理工大学
<120> 一种S型的ω-转氨酶ATA-W12及其基因和应用
<160> 4
<210> 1
<211> 1407
<212> DNA
<213> 棉花地土壤宏基因组
<220>
<221> gene
<222>
<223> ω-转氨酶ATA-W12基因
<400> 1
atgaccgccc ccctccgcaa ccacgacatc gccgagctca agcgcctgga cctggcccac 60
cacctgccgg cccaggccga tcacaaggtc atcgccgagc agggcggaag ccggatcatc 120
acccgcgccg agggcgtcta catccatgac ggcgagggcc atcagatcct cgacggcatg 180
gccgggctgt ggtgcgtgaa cgtcggctac ggtcgcgagg aactggccaa ggccgcctac 240
gaccagatgc tggagctgcc ctactacaat acgttcttca agaccgcgac gccgccgccg 300
atcgagctgg cggccaagat cgcgcagaag atgggcgggc atctttccca cgtcttctac 360
aattcgtcgg ggtcggaggc gaacgacacg gtcttccgcc tggtgcgcca cttttggaag 420
ttgaaggggg agccaagccg cacggtcttc atcagccgct ggaacgccta tcacggctcg 480
acggtggcgg gcgtcagcct gggcggcatg aagcacatgc acaagcaggg cgacctgccg 540
atcgccggcg tcgagcatgt gatgcagccc taccagttcg gcgacggctt cggcgaggat 600
ccggccgcct tccgcgaccg ggcggtgcag gccatcgagg acaagatcct ggaagtcggg 660
cccgagaacg tcgcggcctt catcggcgag ccggtgcagg gcgcgggcgg ggtgatcatc 720
ccgccggacg gctattggcc ggcggtcgag gccctgtgcc gcaagtacgg catcctgctg 780
gtctgcgacg aggtgatctg cggctttggg cggctgggcc agtggttcgg ccaccagcac 840
tatggcatca agcccgacct gatcgccatg gccaagggcc tgtcgtccgg ctatctgccg 900
atcagcgccg tgggcgtggc cgaccacatc gtcgccgagc tgcgcgagaa gggcggcgac 960
ttcatccacg gctttacgta ctcgggccac ccgacggcgg cggccgtggc gctgaagaac 1020
atcgagatca tggagcgcga gggcctggtc gagcgcaccc gcgacgagac cggcccctat 1080
ctggcgcagg ccctggccag cctcaacgac cacccgctgg tgggtgaagt tcgctcgctg 1140
ggcctgatcg gcgcggtcga gatcgtgcgc gagaagggga ccaaccaccg cttcctcgac 1200
aaggagggcg aggccgggcc gatcgtgcgc gacctgtgca tcaagaacgg cctgatggtt 1260
cgcgccatcc gcgacagcat cgtctgctgc ccgccgctga tcatcaccaa ggcgcagatc 1320
gacgagctgg tcggcatcat ccgaaagtcg ctcgacgaag ccgagccggt gctgcgggcg 1380
ctgaagccta aggagggcga ggactga 1407
<210> 2
<211> 468
<212> PRT
<213> 棉花地土壤宏基因组
<400> 2
MTAPLRNHDIAELKRLDLAHHLPAQADHKVIAEQGGSRIITRAEGVYIHDGEGHQILDGMAGLWCVNVGYGREELAKAAYDQMLELPYYNTFFKTATPPPIELAAKIAQKMGGHLSHVFYNSSGSEANDTVFRLVRHFWKLKGEPSRTVFISRWNAYHGSTVAGVSLGGMKHMHKQGDLPIAGVEHVMQPYQFGDGFGEDPAAFRDRAVQAIEDKILEVGPENVAAFIGEPVQGAGGVIIPPDGYWPAVEALCRKYGILLVCDEVICGFGRLGQWFGHQHYGIKPDLIAMAKGLSSGYLPISAVGVADHIVAELREKGGDFIHGFTYSGHPTAAAVALKNIEIMEREGLVERTRDETGPYLAQALASLNDHPLVGEVRSLGLIGAVEIVREKGTNHRFLDKEGEAGPIVRDLCIKNGLMVRAIRDSIVCCPPLIITKAQIDELVGIIRKSLDEAEPVLRALKPKEGED
<210> 3
<211> 30
<212> DNA
<213> 人工序列
<220>
<223>上海捷瑞生物工程有限公司
<400> 3
aaccggaatt catgaccgcc cccctccgca 30
<210> 4
<211> 30
<212> DNA
<213> 人工序列
<220>
<223>上海捷瑞生物工程有限公司
<400> 4
aacccaagct ttcagtcctc gccctcctta 30
- 还没有人留言评论。精彩留言会获得点赞!