茶树类黄酮3‑o‑半乳糖基转移酶CsF3GalT蛋白及其编码基因和应用的制作方法
技术领域
本发明涉及植物基因工程技术领域,尤其涉及糖基转移酶技术,具体涉及一种茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白及其编码基因和应用。
背景技术:
糖基转移酶是一类广泛存在于动植物体内的大家族修饰酶,能够在次级代谢产物合成终端催化糖分子通过糖苷键的形式连接到类黄酮、甾体生物碱、皂素和花青素等物质上。最常见的作用部位在类黄酮的3-o位点。高等植物中类黄酮的糖苷包括葡萄糖、半乳糖及木糖。催化生成稳定的可溶性产物可被运送至液泡等位置,发挥特定的功能。目前关于类黄酮糖苷的功能还未完全清楚,但其在动植物的生理代谢上具有重要的作用。
技术实现要素:
本发明的目的是提供一种茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白。
本发明的另一目的是提供上述茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白的编码基因。
本发明的另一个目的是提供上述茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白的应用。
本发明的上述目的是通过如下方案予以实现的:
本发明提供一种类黄酮3-o-半乳糖基转移酶蛋白,该蛋白来源于红紫芽茶树,因此称为茶树类黄酮3-o-半乳糖基转移酶蛋白(CsF3GalT),该蛋白是如下1)或2)的蛋白:
1)由序列表中SEQ ID NO:2所示的氨基酸序列组成的蛋白质;
2)将序列表中SEQ ID NO:2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由1)衍生的蛋白质。
上述茶树类黄酮3-o-半乳糖基转移酶蛋白的编码基因序列具有SEQ ID NO:1所示的核苷酸序列,该核苷酸序列长度为1362bp。
本发明还提供上述茶树类黄酮3-o-半乳糖基转移酶蛋白的全长cDNA序列,该全长cDNA序列具有SEQ ID NO:3或SEQ ID NO:4所示的核苷酸序列,所述具有SEQ ID NO:3所示核苷酸序列的全长cDNA序列的长度为1573bp,具有SEQ ID NO:4所示核苷酸序列的全长cDNA序列的长度为1701bp;本发明人用生物软件对SEQ ID NO:3所述核苷酸序列和SEQ ID NO:4所示的核苷酸序列进行分析,所述SEQ ID NO:3所述核苷酸序列和SEQ ID NO:4所示的核苷酸序列存在一致的开放阅读框1362bp(该开放阅读框的核苷酸
序列如SEQ ID NO:1所示),编码454个氨基酸(该氨基酸序列如SEQ ID NO:2所示),且5’端非翻译区长度均为109bp,但3’端非翻译区长度分别为227bp、99bp。
含有上述茶树类黄酮3-o-半乳糖基转移酶蛋白的编码基因序列的重组表达载体,转基因细胞系、表达盒或重组菌均属于本发明的保护范围。
本发明同样保护将茶树CsF3GalT基因的主要结构部分有效地连接上合适的调节序列所形成的嵌合基因,如这种基因可以是天然的或者是嵌合的。例如本发明分离的茶树CsF3GalT DNA片段可置于一个启动子后面,从而调控该DNA片段的表达,该启动子可以是组成型启动子也可以是诱导型启动子。组成型启动子能够在植株不同的发育阶段不同的组织部位调控基因表达,最为常见的为花椰菜花叶病毒35S启动子,诱导型启动子能够在植株不同的发育阶段,不同的组织部位表达,也可受环境诱导表达。
本发明提供的茶树CsF3GalT基因序列具有重要的应用价值。可以将茶树CsF3GalT基因序列连接到体外表达载体,通过体外诱导获得所述基因编码的蛋白,在体外可催化类黄酮与半乳糖反应,获得类黄酮-3-o-半乳糖。本发明的茶树CsF3GalT基因构建到载体中,可以对所述基因或其调控序列适当修饰,也可以在其转录起始密码子前用其他启动子取代所述基因原有启动子。
与现有技术相比,本发明具有如下有益效果:
1.本发明首次从茶树中分离得到类黄酮3-o-半乳糖基转移酶蛋白,并获得该蛋白的编码基因,而且本发明还通过研究发现该基因具有催化半乳糖基转移的功能;
2.本发明的茶树类黄酮3-o-半乳糖基转移酶蛋白可以催化类黄酮和半乳糖反应生成相应的产物,在植物中相应产物可改变其生理代谢;
3. 本发明的茶树类黄酮3-o-半乳糖基转移酶蛋白可以催化类黄酮和半乳糖反应生成类黄酮-半乳糖等物质用于工业、化学等行业。
附图说明
图1是3’RACE PCR扩增产物的琼脂糖电泳图;
其中,M是DNA2000 marker(从上到下其大小分别为2000bp、1000bp、750bp、500bp、250bp和100bp),1是长度为550bp的扩增产物,2是长度为480 bp的扩增产物;
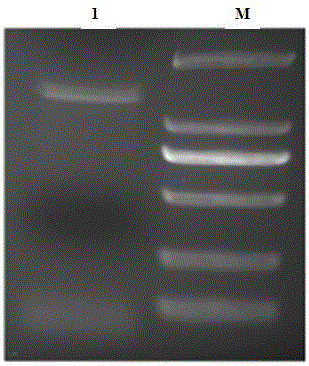
图2是5’RACE PCR扩增产物的琼脂糖电泳图;
其中,M是DNA2000 marker(从上到下其大小分别为2000bp、1000bp、750bp、500bp、250bp和100bp),1是长度为1100bp的扩增产物;
图3是茶树CsF3GalT全长cDNA的 PCR扩增产物的琼脂糖电泳图;
其中,M是DNA2000 marker(从上到下其大小分别为2000bp、1000bp、750bp、500bp、250bp和100bp),1是长度为1573bp的扩增产物,2是长度为1701bp的扩增产物;
图4是含有EcoRⅠ和XhoⅠ酶切位点的茶树CsF3GalT基因的PCR扩增产物琼脂糖电泳图;
其中,M是DNA 2000 marker(从上到下条带大小分别为2000bp、1000bp、750bp、500bp、250bp和100bp),1、2和3是PCR扩增产物;
图5是具有粘性末端的CsF3GalT片段的酶切电泳图;
其中,M是DNA 2000 marker(从上到下条带大小分别为2000bp、1000bp、750bp、500bp、250bp和100bp),1、2和3为双酶切产物;
图6是重组载体pGEX-4T-2-CsF3Gal构建阳性克隆的PCR验证电泳图;
其中,M是DNA 2000 marker(从上到下条带大小分别为2000bp、1000bp、750bp、500bp、250bp和100bp),1-8为PCR扩增产物;
图7是重组载体pGEX-4T-2-CsF3Gal构建阳性克隆的酶切验证电泳图;
其中,1-5是酶切后产物,6是无酶切对照;
图8是原核表达的茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白的SDS-PAGE鉴定电泳图;
其中,M是蛋白marker,1是实施例3的IPTG诱导组,2为实施例3的不诱导组(对照);
图9是杨梅酮标样组的体外酶活实验液相色谱图;
图10是杨梅酮-3-o-半乳糖标样组的体外酶活实验液相色谱图;
图11是杨梅酮+UDP-半乳糖组的体外酶活实验液相色谱图;
图12是杨梅酮+UDP-半乳糖+CsF3GalT蛋白组的体外酶活实验液相色谱图;
图13是杨梅酮+UDP-葡萄糖+CsF3GalT蛋白组的体外酶活实验液相色谱图。
具体实施方式
下面结合具体实施例对本发明做进一步地描述,但具体实施例并不对本发明做任何限定。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1 茶树类黄酮3-o-半乳糖基转移酶蛋白及其编码基因的获得
红紫芽茶树品种 “红叶2号”由广东省农业科学院茶叶研究所提供。
以红紫芽茶树“红叶2号”不同部位的紫叶与绿叶为材料进行高通量测序获得了差异表达谱,以差异基因EST序列(如SEQ ID NO:5所示)为基础进行NCBI BLAST分析,发现与其它物种的类黄酮3-o-半乳糖基转移酶(F3GalT)序列高度同源,因此将其命名为茶树类黄酮3-o-半乳糖基转移酶基因(CsF3GalT)。
为了获取CsF3GalT 基因cDNA全长,根据EST序列,设计了CsF3GalT基因3’RACE特异引物3’RACE-GSP1与3’RACE巢式PCR引物3’RACE-NGSP2;根据EST序列,设计了CsF3GalT基因的5’RACE特异引物5’RACE-GSP1与5’RACE巢式PCR引物5’RACE-NGSP2。
上述特异引物3’RACE-GSP1的核苷酸序列如SEQ ID NO:6所示;上述巢式PCR引物3’RACE-NGSP2的核苷酸序列如SEQ ID NO:7所示;上述特异引物5’RACE-GSP1的核苷酸序列如SEQ ID NO:8所示;上述巢式PCR引物5’RACE-NGSP2的核苷酸序列如SEQ ID NO:9所示。
采集红紫芽茶树品种 “红叶2号”的茶树嫩叶,利用RNA提取试剂盒(Aidlab EASYspin Plus )提取该茶树嫩叶组织的总RNA。
3’ RACE cDNA的合成:往PE管中加入1 µg茶树嫩叶组织的总RNA,15~20 pmol ATP引物含AP引物片段及Oligo(dT),加DEPC-ddH2O至10µl,轻轻混匀,微量离心机短暂离心,置于68℃水浴15min,室温放置退火15 min(或置冰上迅速冷却至室温)后再依次加入5×RT Buffer 4µl、RNase inhibitor (20U/µl)0.5µl、dNTPs(10mmol/L)2µl、DTT(0.1M) 2µl和反转录酶M-MLV Reverse Transcriptase (Promega,200U/µl) 1µl,置于37℃水浴2 h,95℃加热5 min终止反应后保存备用,则制备得到3’ RACE cDNA。
5’ RACE cDNA的合成:5’-cDNA的合成采用SMARTer™ RACE cDNA Amplification Kit,第一步是混合液1的制备是将2.0 µl 5×First-Strand Buffer、1.0µlDTT (20 mM)和1.0µl dNTP Mix (10 mM) 轻轻漩涡混匀,置于室温,备用,混合液2的制备是将2µl茶树嫩叶组织的总RNA、1.0 µl 5'-CDS Primer A和0.75µl DEPC-ddH2O短暂离心混匀后于PCR仪上反应,PCR反应条件是72℃3min,42℃2min,PCR反应结束后短暂离心,再加入1µl SMARTer IIA oligo,将前述制备的混合液1取4.0µl与0.25µlRNase Inhibitor (40U/μl) 、1.0µl SMARTScribe™ Reverse Transcriptase (100 U)以及混合液2混合后,短暂离心收集,再置于PCR仪上反应,PCR反应条件是42℃90min,72℃10min,4℃ 保存,则制备得到5’ RACE cDNA。
所述ATP引物的核苷酸序列如SEQ ID NO:10所示;所述AP引物的核苷酸序列如SEQ ID NO:11所示。
目的基因3’端序列的克隆(3’ RACE法):以3’ RACE cDNA为模板,用特异引物3’RACE-GSP1和引物AP进行第一轮PCR,该PCR反应体系为5.0ml 10×PCR buffer,8ml dNTP mix (10Mm),6ml 3’ RACE cDNA,2ml AP引物,2ml 特异引物3’RACE-GSP1,0.5ml LaTaq (5U/µl),26.5ml ddH2O,PCR反应程序是94℃ 3min,“94℃ 30sec,57℃ 30sec,72℃ 90 sec ”28个循环,72℃ 10min;以第一轮PCR扩增产物为模板,用巢式PCR引物3’RACE-NGSP2和引物AP进行第二轮巢式PCR扩增,该PCR反应体系为5.0ml 10×PCR buffer,8ml dNTP mix (10Mm),1ml第一轮PCR产物,2ml AP引物,2ml 特异引物3’RACE-NGSP2,0.5ml LaTaq (5U/µl),26.5ml ddH2O,PCR反应程序是94℃ 3min,“94℃ 30sec,57℃ 30sec,72℃ 90 sec ”28个循环,72℃ 10min。如图1所示,第二轮巢式PCR扩增得到两条片段,分别为550bp和480 bp左右,将PCR产物经切胶回收并测序,此两段序列与对应的EST序列均有部分重叠区,说明来自同一个基因。
目的基因5’端序列的克隆(5’ RACE法);目的基因5’端序列的克隆采用SMARTer™ RACE cDNA Amplification Kit,以5’ RACE cDNA为模板,用特异引物5’RACE-GSP1和试剂盒提供的通用引物UPM进行第一轮PCR,该PCR反应体系为34.5ml PCR-Grade Water,5.0ml 10×Advantage 2 PCR Buffer ,1.0ml dNTP mix (10Mm),1.0ml 50×Advantage 2 Polymerase Mix,2.5ml 5’ RACE cDNA,5ml UPM引物,1ml 特异引物5’RACE-GSP1,PCR反应程序是“94℃ 30s,68℃ 30s,72℃ 3min” 25循环;以第一轮PCR扩增产物为模板,用巢式PCR引物5’RACE-NGSP2和引物UPM进行第二轮巢式PCR扩增,该巢式PCR反应体系为34.5ml PCR-Grade Water,5.0ml 10×Advantage 2 PCR Buffer ,1.0ml dNTP mix (10Mm),1.0ml 50×Advantage 2 Polymerase Mix,2.5ml 5’ RACE cDNA,5ml UPM引物,1ml巢式PCR引物5’RACE-NGSP2,PCR反应程序为“94℃ 30s,68℃ 30s,72℃ 3min” 25循环;如图2所示,第二轮巢式PCR扩增得到大小为1100bp的产物,将该反应产物以1%琼脂糖凝胶电泳检测,切胶回收目的条带。
将测序所得的 5’RACE和 3’RACE序列进行拼接,得到两个全长cDNA序列,分别为1573bp(命名为茶树CsF3GalT-1,其核苷酸序列如SEQ ID NO:3所示)与 1701bp(命名为茶树CsF3GalT-2,其核苷酸序列如SEQ ID NO:4所示),其CDS编码序列为1362bp(其核苷酸序列如SEQ ID NO:1所示),编码454个氨基酸(其氨基酸序列如SEQ ID NO:2所示)。
根据cDNA序列的3’端非编码区具有多聚腺苷酸加尾信号,初步判断cDNA序列均具有完整性。
为了进一步确认序列的完整性,分别在cDNA序列的两端(不含3’端的多聚腺苷酸)设计一对扩增cDNA全长的特异性引物,以3’cDNA为模板分别对茶树CsF3GalT基因的两个全长cDNA序列进行PCR扩增及测序,该PCR扩增及测序结果如图3所示。从图中可以看出,1号泳道的扩增产物长度约为1500bp左右,2号泳道的扩增产物长度约为1700bp左右,均与预期的大小相一致。
将拼接序列与测序结果进行比对,证明RACE拼接所得的序列具有正确性与完整性,正是茶树CsF3GalT基因的cDNA 全长序列。茶树CsF3GalT基因的两条cDNA序列具有相同的CDS编码序列,这可能与茶树复杂的遗传背景有关。
实施例2 CsF3GalT基因的生物信息学分析
通过RACE技术得到3’及5’端的序列片段,经测序拼接,获得一个1362bp的CDS编码序列。由于3’端非翻译区(UTR)不一致,得到两个全长cDNA序列,分别为1573bp、1701bp。并经全长cDNA序列的再次扩增与测序得以验证,扩增的条带大小与拼接序列一致。经BLAST进行同源性比对,确定RACE所拼接的序列为红紫芽茶树类黄酮3-o-半乳糖基转移酶基因的cDNA全长序列,将其命名为CsF3GalT。用生物软件对基因的全长cDNA序列进行分析,CsF3GalT基因的全长cDNA序列中存在一致的开放阅读框1362bp,编码454个氨基酸,5’端非翻译区(UTR)长度均为109bp,3’UTR长度分别为227bp、99bp。
该基因的3’端非翻译区(UTR)有差异可能与茶树复杂的遗传背景有关。
经 NCBI的CDD在线对CsF3GalT基因的功能结构进行预测及用DNAMAN对所获得的CsF3GalT氨基酸序列与其他物种已知的3GalT及3GT糖基转移酶标签序列(PSPG)氨基酸进行多重序列比对分析,发现该序列C端有一段植物次生代谢产物糖基转移酶的标签序列(PSPG box)。将CsF3GalT氨基酸序列进行BLAST同源性搜索,发现CsF3GalT与猕猴桃(Actinidia chinensis)、龙牙鱼腥草(Aralia cordata)、柿树(Diospyros kaki)植物中的 UDP-半乳糖基转移酶具有较高的同源性。并结合ClustalX软件和MEGA5软件,采用红紫芽茶树及其它物种的UF3GT的氨基酸序列作为分析对象,构建CsF3GalT基因的系统进化树。从CsF3GalT基因的系统进化树可知,CsF3GalT基因与其它已知的3GalT 及3GT基因具有共同的进化起源,这意味着CsF3GalT可能具有UF3GalT蛋白酶的功能。
实施例3 茶树CsF3GalT基因原核表达载体的构建和原核表达
本实施例构建茶树CsF3GalT 原核表达载体,具体步骤如下所示:
根据茶树CsF3GalT基因的全长cDNA序列,设计一对加上EcoRⅠ和XhoⅠ酶切位点的特异性引物 F3GalTN与 F3GalTC;所述引物F3GalTN的核苷酸序列如SEQ ID NO:12所示,所述引物F3GalTC的核苷酸序列如SEQ ID NO:13所示。
将实施例1的红叶2号茶树嫩叶组织的总RNA经PrimeScript RT reagent Kit试剂盒反转录制备得到cDNA,以该cDNA为模板,采用
引物 F3GalTN 与 F3GalTC进行PCR扩增,得到的PCR扩增产物即为含有EcoRⅠ和XhoⅠ酶切位点的茶树CsF3GalT基因,该PCR扩增电泳结果如图4所示;回收PCR扩增产物并用EcoRⅠ和XhoⅠ酶对其进行双酶切获得具有粘性末端的CsF3GalT片段,双酶切结果如图5所示。
将市售的pGEX-4T-2质粒用EcoRⅠ和XhoⅠ进行双酶切后回收酶切产物,将该酶切产物与上述具有粘性末端的CsF3GalT片段在T4DNA连接酶的作用下进行连接,获得重组载体pGEX-4T-2-CsF3Gal,并将该重组载体pGEX-4T-2-CsF3Gal转化大肠杆菌DH5a,挑取单克隆进行PCR验证、酶切验证和测序,PCR验证结果如图6所示,酶切验证结果如图7所示,图6、图7和测序结果说明该重组载体构建成功。
采用Omega质粒提取试剂盒提取pGEX-4T-2-CsF3Gal质粒,将重组质粒pGEX-4T-2-CsF3Gal与空质粒pGEX-4T-2(1ul)转化大肠杆菌BL21(DE3)。
将转化后的重组菌进行划线培养获得单菌落,将单菌落分别接种于2ml含氨苄青霉素的LB培养基中,37℃摇菌过夜,次晨将培养得到的种子液接种于200mL含氨苄青霉素的LB培养基中,37℃培养至OD值为0.6,将培养菌液分成两份,一份加入终浓度为1mmol/L的异丙基硫代半乳糖苷(IPTG)于37℃诱导3h作为IPTG诱导组,一份不加入IPTG作为不诱导组。
将上述两组菌液分别在室温下用1300r/min离心5min,弃上清,加入PBS洗涤沉淀2次,再离心,弃PBS,加20mlPBS重悬菌体沉淀,将沉淀得到的菌体在225W的功率下冰浴超声,每次超声5s,每两次超声中间间隔10s,共超声30min后于4℃以12000r/min离心5min,然后取上清,用0.8um滤膜过滤,取滤液进行SDS-PAGE鉴定,结果如图8所示,本发明的茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白在IPTG的诱导下成功表达。
所述含氨苄青霉素的LB培养基,其制备方法是先将1g胰蛋白胨、0.5g酵母提取物和1gNaCl溶解于去离子水中,用5M NaOH调pH至7.0,然后用去离子水定容至100ml,再加入1.5g琼脂粉,高温灭菌后冷却至55℃,加入50mg/ml氨苄青霉素至终浓度为50μg/ml。
所述pGEX-4T-2质粒、EcoRⅠ酶、XhoⅠ酶、大肠杆菌DH5a和大肠杆菌BL21(DE3)均为市售产品。
实施例4 茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白体外酶活实验
本实施例是针对本发明的茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白进行体外酶活实验,该实验分为以下五个实验组:
(1)杨梅酮标样组。所述杨梅酮标样组的总反应体系为200ul,其中含有杨梅酮0.2uM,溶剂为pH8.0的PBS缓冲液,反应体系中还还加入0.1%(V/V)β-巯基乙醇。
(2)杨梅酮-3-o-半乳糖标样组。所述杨梅酮-3-o-半乳糖标样组的总反应体系为200ul,其中含有杨梅酮-3-o-半乳糖0.2uM,溶剂为pH8.0的PBS缓冲液,反应体系中还还加入0.1%(V/V)β-巯基乙醇。
(3)杨梅酮+UDP-半乳糖组。所述杨梅酮+UDP-半乳糖组的总反应体系为200ul,其中含有杨梅酮0.2uM,UDP-半乳糖,2.5mM溶剂为pH8.0的PBS缓冲液,反应体系中还还加入0.1%(V/V)β-巯基乙醇。
(4)杨梅酮+UDP-半乳糖+CsF3GalT蛋白组。所述杨梅酮+UDP-半乳糖+CsF3GalT蛋白组的总反应体系为200ul,其中含有杨梅酮0.2uM,UDP-半乳糖2.5mM,茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白15ug,溶剂为pH8.0的PBS缓冲液,反应体系中还加入0.1%(V/V)β-巯基乙醇。
(5)杨梅酮+UDP-葡萄糖+CsF3GalT蛋白组。所述杨梅酮+UDP-葡萄糖+CsF3GalT蛋白组的总反应体系为200ul,其中含有杨梅酮0.2uM,UDP-葡萄糖2.5mM,茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白15ug,溶剂为pH8.0的PBS缓冲液,反应体系中还加入0.1%(V/V)β-巯基乙醇。
将上述五个实验组分别在30℃水浴锅中反应30min,同时以无蛋白PBS作为对照。反应停止加入等体积100%甲醇。
将五个实验组的反应产物分别用0.45um的滤头过滤后上高效液相色谱进行检测,采用梯度洗脱程序,洗脱采用的流动相A为色谱级甲醇,流动相B为5%甲酸溶液。梯度洗脱程序如下:0-5min,流动相A体积15%,流动相B体积85%;5-10min,流动相A体积20%,流动相B体积80%;10-25min,流动相A体积25%,流动相B体积75%;25-46min,流动相A体积25%,流动相B体积75%;46-52min,流动相A体积20%,流动相B体积80%;52-65min,流动相A体积15%,流动相B体积85%。流速0.5ml/min。波长:510nm,柱温:常温。
体外酶活实验结果如表1和图9、10、11、12和13所示,本发明的茶树类黄酮3-o-半乳糖基转移酶CsF3GalT蛋白能够催化杨梅酮与半乳糖反应生成相应的杨梅酮-3-o-半乳糖,但不能催化杨梅酮与葡萄糖反应。
表1 体外酶活底物及出峰情况
- 还没有人留言评论。精彩留言会获得点赞!