一种TGF‑β靶向的溶瘤腺病毒在肾癌治疗中的应用的制作方法
本发明涉及生物技术和基因治疗领域,特别是提供了一种TGF-β靶向的溶瘤腺病毒及其制备方法,及其在肾癌细胞中复制、杀伤和表达的验证,以及在肾癌治疗中的应用。
背景技术:
近年来,我国肾癌的发病率呈逐年上升的趋势,仅次于前列腺癌,位居男性泌尿系统肿瘤的第二位。目前,肾癌的主要治疗手段是手术切除治疗,放射治疗和化学治疗的效果并不理想。因此,急需探索一种更加有效的治疗手段。
近年来,溶瘤病毒治疗发展迅速,已有多项溶瘤病毒治疗药物进入临床II-III期研究阶段。2015年10月,美国FDA批准了携带粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimutaing factor,GM-CSF)的单纯疱疹溶瘤病(T-VEC)进入市场,为溶瘤病毒治疗注入了一支强心针。目前,在临床试验中应用最为广泛的是溶瘤腺病毒,溶瘤腺病毒的主要构建策略之一,是用组织特异性启动子替换天然的病毒启动子来控制病毒复制启动基因的表达,得到转录调控型的溶瘤腺病毒。
在理论上,溶瘤腺病毒可以在肿瘤细胞中复制并裂解肿瘤细胞,释放病毒,进一步感染周围的其他肿瘤细胞,进而发挥级联放大作用,最终达到消灭肿瘤的目的。然而,实际上,溶瘤腺病毒的疗效往往受到多种因素的制约,如,人体内普遍存在5型腺病毒抗体,可清除溶瘤溶瘤腺病毒;启动病毒复制的肿瘤特异性启动子效率达不到预想等。近年来,通过多种方式对溶瘤腺病毒进行修饰,能够显著提高溶瘤腺病毒的疗效,如通过携带自杀基因,提高对肿瘤细胞的杀伤效率;通过携带免疫基因,调节机体及肿瘤局部的免疫状态;通过携带抗血管生成基因,阻断肿瘤细胞转移相关信号激活等。因此,将溶瘤腺病毒治疗与基因治疗联合应用,已经成为溶瘤病毒治疗的重要方向和热点。
技术实现要素:
本发明的目的是为了制备一种靶向TGF-β信号的溶瘤腺病毒,并应用于肾癌的治疗,为肾癌的治疗提供一种新的策略。
转化生长因子β(Transforming growth factorβ,TGFβ)作为多功能的细胞因子,在肿瘤骨转移的发生、发展过程中起着重要作用。研究证明,在晚期肾癌病人的肿瘤局部,TGF-β表达显著提升;而在前列腺癌骨转移病人的外周血中可以检测到高水平的TGF-β。TGF-β可以通过多种机制影响肿瘤的发生、发展和转移:如TGFβ通过PI3K/Akt/mTOR通路上调缺氧诱导因子(Hypoxia-Inducible Factors,HIFs)表达,促进肿瘤生长;通过Scr/Fak/Akt通路上调VEGF表达,促进血管生成;通过诱导溶骨相关因子的表达(IL-11,PTHrP、CTGF),促进肿瘤骨转移的发生和发展等。研究表明,在乳腺癌及前列腺癌的骨转移模型中,通过sTGFβRIIFc(融合人Fc的可溶性TGF-β受体II)阻断TGFβ信号,可抑制SMAD2和SMAD3磷酸化,进一步通过抑制骨吸收、促进骨愈合,降低血钙水平等发挥治疗作用。
此外,TGFβ也是重要的免疫调节因子,可通过多种机制抑制肿瘤微环境的抗肿瘤免疫,包括:增强骨髓来源抑制细胞(myeloid-derived suppressor cells,MDSCs)的聚集;诱导CD4+T细胞分化为CD4+Foxp3+调节性T细胞(Regulatory T cells,Tregs);下调NK细胞和CD8+T细胞表面NKG2D受体,进而减弱其细胞毒效应等。研究证实,阻断TGFβ信号,可抑制MDSCs和CD4+Foxp3+Tregs,促进自然杀伤细胞(Natural Killer cells,NK)和细胞毒性T淋巴细胞(Cytotoxic T Lymphocytes,CTLs)的活性,增强干扰素γ(Interferonγ,IFNγ)的表达及分泌,进而激活抗肿瘤免疫反应。然而,TGFβ抑制剂或sTGFβRIIFc蛋白的应用,可能会导致全身免疫抑制等毒副作用。
如上文所述,除手术治疗外,目前对于肾癌仍然缺乏有效的治疗策略,将溶瘤腺病毒与TGF-β信号靶向基因治疗联合应用,可有效结合溶瘤治疗、基因治疗和免疫治疗的优势,有望为肾癌的治疗提供一种更加有效的治疗策略,具有十分重要的理论意义和现实价值。
本发明发现了溶瘤腺病毒与TGF-β信号靶向基因治疗的联合应用,不但能够通过在肿瘤局部的复制,促进目的基因的大量表达,提高疗效;还可以降低全身给药造成的毒副作用。此外,溶瘤病毒介导的肿瘤裂解作用,可以释放大量的肿瘤抗原,促进机体有效抗肿瘤免疫的形成。
在本发明的一个具体实施方式中,本发明采用Adeasy系统,将“端粒酶启动子TERTp调控E1A的表达框,E1B启动子调控E1B-55KDa的表达框,及cmv启动子调控sTGFβRIIFc的表达框”构建到穿梭质粒。使用限制性内切酶PmeI将其线性化,并于BJ5183菌株中与Adeasy-1同源重组。得到的重组腺病毒质粒,经限制性内切酶PacI线性化后,转染HEK293细胞,包装得到溶瘤腺病毒。并在人肾癌细胞、小鼠肾癌细胞中鉴定目的基因sTGFβRIIFc的表达;在体外证实了溶瘤腺病毒的溶瘤作用;在小鼠Renca移植瘤模型中明确其治疗效果和机制。
在进一步优选的实施方式中,本发明采用的方法具体为:
1、溶瘤腺病毒rAd.sTGFβRIIFc的构建及制备:
构建由端粒酶启动子TERTp启动腺病毒复制必需基因E1A表达,由E1B启动子启动E1B55K表达的中间载体TE-TP-E1A;并通过酶切、连接的方法获得功能序列,并克隆到携带sTGFβRIIFc基因的穿梭质粒上;最后,采用Adeasy系统制备重组腺病毒载体pAd.sTGFβRIIFc。于HEK293细胞中包装获得重组腺病毒。
此外在更优选的具体实施方式中,为了进行功能和机制研究,还制备了三种对照病毒:(1)rAd.Null,具有溶瘤功能,不携带目的基因的对照病毒;(2)Ad.sTGFβRIIFc,携带sTGFβRIIFc基因的复制缺陷性腺病毒;(4)Ad.Null,不携带目的基因的复制缺陷性溶瘤腺病毒。
2、溶瘤腺病毒介导的目的基因表达和溶瘤功能评价;
目的基因的有效表达是免疫功能得意发挥的保障。将重组腺病毒感染肾癌细胞后48h,Western-blot和ELISA分别检测sTGFβRIIFc的表达水平。
而溶瘤功能是溶瘤腺病毒的基本特征。在更优选的具体实施方式中,我们采用SRB染色法检测了溶瘤腺病毒对多种肾癌细胞的溶瘤作用,以及溶瘤腺病毒在肾癌细胞中的复制能力。
3、溶瘤腺病毒体内抗肿瘤效应评价
为评价小鼠体内抗肿瘤效应,建立了Renca细胞的小鼠移植瘤模型,通过瘤内给药方式进行治疗后,观察溶瘤腺病毒对移植瘤生长的抑制作用,明确其治疗效果。
4、溶瘤腺病毒体内抗肿瘤机制研究
为明确溶瘤病毒的体内抗肿瘤机制,检测了肿瘤局部TGF-β靶基因相关指标,炎症因子表达,免疫细胞表型等,初步阐明了其作用机制。
本发明的创新点在于将溶瘤腺病毒与TGFβ靶向治疗有效结合。肿瘤局部给药后,首先通过肿瘤细胞内的有效复制,杀灭肿瘤细胞;不断复制的病毒能够持续产生大量的目的蛋白sTGFβRIIFc。局部高浓度的sTGFβRIIFc,可阻断肿瘤细胞内异常激活的TGFβ信号,抑制转移相关蛋白的表达与分泌。同时,sTGFβRIIFc还可减轻TGFβ介导的免疫抑制效应;调节机体抗肿瘤免疫与抗病毒免疫之间的平衡,更加长效地发挥溶瘤病毒的作用。
附图说明
附图1溶瘤腺病毒rAd.sT以及对照病毒rAd.Null、Ad.sT和Ad.Null的基因组结构示意图。
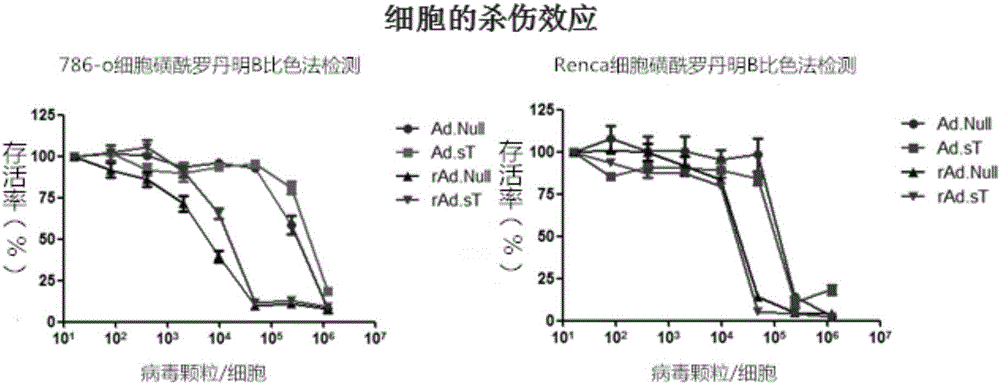
附图2溶瘤腺病毒rAd.sT对肾癌细胞系的杀伤作用:1为对786-O细胞的杀伤作用;3为对Renca细胞的杀伤作用。
附图3溶瘤腺病毒rAd.sT在肾癌细胞系中的复制能力检测结果。
附图4溶瘤腺病毒rAd.sT介导sTGFβRIIFc表达的能力:1为Western-blotting检测结果;2为ELISA检测结果。
附图5溶瘤腺病毒rAd.sT治疗Renca移植瘤的疗效评价:1为肿瘤生长曲线;2为治疗后18天肿瘤体重检测结果。
附图6溶瘤腺病毒rAd.sT治疗后18天,肿瘤组织中转移相关基因表达的实时(real-time)检测结果。
附图7溶瘤腺病毒rAd.sT治疗后,血液中T淋巴细胞亚型的检测结果:1为治疗后7天,2为治疗后第18天。
附图8溶瘤腺病毒rAd.sT治疗后7天,血液细胞中细胞因子表达实时(real-time)检测结果。
附图9溶瘤腺病毒rAd.sT治疗后18天,脾脏中IFN-γ表达的实时(real-time)检测结果。
具体实施方式
实施例1重组腺病毒rAd.sT的构建与制备
方法是基因合成sTGFβRIIFc基因,将其插入到pshuttle-cmv载体中,获得pShuttle-cmv-sTGFβRIIFc(pSh.cmv.sT);使用限制性内切酶MfeI酶切TE-TP-E1A,获取复制相关基因,将其克隆到pSh.cmv.sT的相应位点,获得穿梭质粒pSh.cmv.sT.RE;参照Adeasy系统,获得重组腺病毒质粒pAd.sT.RE;并于HEK293细胞制备获得溶瘤腺病毒rAds.sT。具体为:
(1)pSh.cmv.sT的构建
通过基因合成技术,合成sTGFβRIIFc基因的全序列(如序列表1所示),并在上下游分别加入BglII和KpnI的酶切位点,使用上述两种限制性内切酶将其酶切后,连接到pShuttle-cmv的相应位点,获得pSh.cmv.sT载体。
(2)pSh.cmv.sT.RE的构建
质粒TE-TP-E1A含有TERTp启动子(如SEQ ID NO:3所示)启动E1A表达和E1B启动子调控E1B55K表达的两个表达框,通过MfeI酶切,获得此部分序列,然后将其正向克隆到pSh.cmv.sT的相应位点(MfeI),获得穿梭质粒pSh.cmv.sT.RE。
(3)溶瘤腺病毒rAd.sT的制备
参照Adeasy系统制备重组腺病毒质粒:PmeI酶切穿梭质粒pSh.cmv.sT.RE,电转BJ5183感受态细胞,与Adeasy-1同源重组获得重组腺病毒质粒pAd.sT.RE。PacI酶切重组腺病毒质粒,并将其转染HEK293细胞,制备获得溶瘤腺病毒rAd.sT(附图1所示)。通过测序鉴定正确后,进行扩增、纯化和滴度测定;结果显示,病毒滴度和纯度均符合要求(表1所示)。
(4)对照病毒的构建和制备
按照溶瘤腺病毒rAd.sT构建、制备流程,采用pShuttle-cmv替换pSh.cmv.sT,构建和制备不携带目的基因的溶瘤腺病毒rAd.Null。同时,采用Adeasy系统,制备复制缺陷型对照病毒Ad.sT和Ad.Null。三种对照病毒经测序鉴定正确后,进行扩增、纯化和滴度测定;结果显示,病毒滴度和纯度均符合要求(表1所示)。
表1病毒滴度、纯度检测结果
实施例2溶瘤腺病毒rAd.sT体外功能验证
其方法是,在肾癌细胞中,采用磺酰罗丹明B(SulforhodamineB,SRB)染色法,检测溶瘤病毒的杀伤效应;通过Adeno-X Rapid Titer Kit测定病毒从感染后3h到48h的扩增倍数,明确病毒的复制能力;通过Western-blotting和ELISA检测目的基因sTGFβRIIFc在肾癌细胞中的表达。具体为:
(1)溶瘤腺病毒rAd.sT的杀伤能力检测
将人肾癌癌细胞系786-O、人769-P和小鼠肾癌细胞系Renca分别以1×103细胞/孔接种96孔板。第二天,溶瘤腺病毒rAd.sT和对照病毒rAd.Null,Ad.sT,Ad.Null分别以5倍梯度稀释的方式感染细胞(1.25×106Vps/细胞-80Vps/细胞)。第七天(感染后第六天),采用SRB染色检测每孔中细胞的存活率,明确溶瘤腺病毒的细胞杀伤作用。计算方法为:细胞存活率=相应感染滴度下的OD值/对照孔的OD值。结果显示,溶瘤病毒rAd.sT和rAd.Null不但能够有效地杀伤人肾癌细胞786-O和769-P,还能杀伤小鼠肾癌细胞Renca(如附图2所示)。
(2)溶瘤腺病毒rAd.sT的复制能力检测
将25000VPs/细胞的溶瘤病毒rAd.sT和对照病毒感染肾癌细胞786-O,769-P和Renca以后3h,用PBS洗涤细胞去除病毒。即刻和48h后,收集细胞和上清,反复冻融后,将其感染24孔板中的HEK293细胞(1×105细胞/孔,提前一天接种)。48h后,采用Adeno-X RapidTiter Kit测定病毒滴度,并计算病毒扩增倍数。结果显示,与复制缺陷型腺病毒相比,溶瘤病毒rAd.sT和rAd.Null能够在人肾癌细胞中大量复制;而在小鼠肾癌细胞中没有体现明显的复制能力(如附图3所示)。
(3)溶瘤腺病毒rAd.sT介导目的基因sTGFβRIIFc表达的检测
采用25000VPs/细胞的溶瘤病毒rAd.sT和对照病毒感染肾癌细胞786-O,769-P和Renca以后16h,将细胞培养基替换为无血清培养基。继续培养24h-32h,分别收集上清和细胞,采用ELISA和Western-blotting分别检测目的基因sTGFβRIIFc的表达。结果显示,无论复制缺陷型腺病毒Ad.sT还是溶瘤腺病毒rAd.sT均能在肾癌细胞中高效地表达目的基因(如附图4所示)。
实施例3溶瘤腺病毒rAd.sT治疗小鼠肾癌移植瘤的疗效评价
其方法是,采用小鼠肾癌细胞Renca建立移植瘤模型,通过瘤内给予溶瘤病毒的方式进行治疗,通过对其生长情况的监测,评价溶瘤病毒对小鼠肾癌移植瘤的治疗作用。具体为:
小鼠肾癌细胞单细胞悬液以2×106细胞/小鼠,皮下荷瘤6-8周的Babl/c小鼠,观察肿瘤的生长情况,于荷瘤后7d,检测肿瘤的体积,并按照体积分层随机分组划分为Buffer组、Ad.Null组、Ad.sT组、rAd.Null和rAd.sT组。按照2.5×1010VPs/100μl的剂量,瘤内注射重组腺病毒进行治疗。治疗后,观察小鼠的健康状况、肿瘤的生长体积。待Buffer组肿瘤出现破溃(或者体积大于2000mm3)时,终止实验。处死小鼠后,检测肿瘤的体重。结果显示,rAd.sT可以有效地抑制Renca细胞移植瘤的生长(如附图5所示)。
实施例4溶瘤腺病毒rAd.sT治疗小鼠肾癌移植瘤的机制研究
其方法是通过检测治疗后不同时间点,肿瘤组织中骨转移相关的TGF-β靶基因的表达,明确rAd.sT可以阻断TGF-β信号,从而抑制肿瘤骨转移;通过血液和脾脏中T淋巴细胞亚型的分析,以及各种细胞因子的表达,明确rAd.sT对于免疫的调节作用。具体为:
(1)溶瘤腺病毒rAd.sT对肿瘤骨转移相关指标的影响
治疗后18d,处死小鼠,分离小鼠肿瘤组织,提取RNA。检测TGF-β相关靶基因白介素11(Interleukin 11,IL-11)、结缔组织生长因子(connective tissue growth factor,CTGF)、CXCR4(C-X-Cmotif receptor 4)和PTHrP(Parathyroid hormone related protein)等的表达,明确rAd.sT调节肾癌转移(骨转移)的机制。我们的结果显示,与Ad.Null组相比,Ad.sT治疗可以显著降低肿瘤转移相关的TGF-β靶基因,如IL-11、CTGF、PTHrP、CXCR4等的表达。与复制缺陷型病毒相比,溶瘤腺病毒本身也可下调肿瘤相关转移基因的表达,可能与其对肿瘤细胞的破坏和裂解作用相关(如附图6所示)。
(2)溶瘤腺病毒rAd.sT对机体抗肿瘤免疫的调控作用
免疫调节是TGF-β介导肿瘤免疫逃逸的重要途径,因此,rAd.sT能否通过打破TGF-β介导的免疫抑制,是rAd.sT治疗取得成功的关键。治疗后7d和18d,我们分别通过检测血液和脾脏中T细胞的亚型、骨髓来源抑制细胞(Bone marrow derived suppressor cells,MDSCs)的比例、血细胞及脾脏中细胞因子的表达等,来明确rAd.sT对小鼠免疫的调节作用。我们的结果显示,rAd.sT治疗可以改变CD4+T淋巴细胞和CD8+T淋巴细胞的比例,进而激活机体的抗肿瘤免疫反应。与rAd.Null治疗相比,rAd.sT可以提升CD4+T淋巴细胞的比例。治疗后7d,血液细胞中多种细胞因子,如IL-2、TNF-α等均表达上调;而在治疗后18d,小鼠脾脏中IFN-γ的表达显著提升(如附图7-9所示)。
综上所述,我们成功构建了由端粒酶启动子调控溶瘤(TERTp启动E1A表达)、表达sTGFβRIIFc蛋白的溶瘤腺病毒rAd.sT。我们的研究结果证实,该溶瘤腺病毒能够在体外肾癌细胞系中大量复制并杀伤肾癌细胞,能够介导sTGFβRIIFc在肾癌细胞中的高效表达。在小鼠肾癌细胞Renca的移植瘤模型中,rAd.sT能够有效地抑制肿瘤的生长和进展;同时,明确了rAd.sT可在肿瘤局部通过调节骨转移相关的TGF-β靶基因、EMT相关基因和VEGF等来抑制肿瘤转移的发生和发展。此外,我们明确了rAd.sT可以调节TGF-β介导免疫耐受。
因此,该溶瘤腺病毒不但可以通过溶瘤作用实现局部肿瘤的抑制和清除作用,还能够通过抑制转移相关基因以及调节免疫等方式,抑制肿瘤的转移。
序列表
<110> 中国人民解放军军事医学科学院放射与辐射医学研究所
<120>一种TGF-β靶向的溶瘤腺病毒在肾癌治疗中的应用
<130>
<160>3
<170>PatentIn version 3.2
<210>1
<211>1246
<212>DNA
<213>
<400>1
cgagctcaag cttacctgcc atgggtcggg ggctgctcag gggcctgtgg ccgctgcaca 60
tcgtcctgtg gacgcgtatc gccagcacga tcccaccgca cgttcagaag tcggttaata 120
acgacatgat agtcactgac aacaacggtg cagtcaagtt tccacaactg tgtaaatttt 180
gtgatgtgag attttccacc tgtgacaacc agaaatcctg catgagcaac tgcagcatca 240
cctccatctg tgagaagcca caggaagtct gtgtggctgt atggagaaag aatgacgaga 300
acataacact agagacagtt tgccatgacc ccaagctccc ctaccatgac tttattctgg 360
aagatgctgc ttctccaaag tgcattatga aggaaaaaaa aaagcctggt gagactttct 420
tcatgtgttc ctgtagctct gatgagtgca atgacaacat catcttctca gaagaatata 480
acaccagcaa tcctgacatg gatcccaaat cttgtgacaa aactcacaca tgcccaccgt 540
gcccagcacc tgaactcctg gggggaccgt cagtcttcct cttcccccca aaacccaagg 600
acaccctcat gatctcccgg acccctgagg tcacatgcgt ggtggtggac gtgagccacg 660
aagaccctga ggtcaagttc aactggtacg tggacggcgt ggaggtgcat aatgccaaga 720
caaagccgcg ggaggagcag tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc 780
tgcaccagga ctggctgaat ggcaaggagt acaagtgcaa ggtatccacc aaagccctcc 840
cagcccccat cgagaaaacc atctccaaag ccaaagggca gccccgagaa ccacaggtgt 900
acaccctgcc cccatcccgg gatgagctga ccaagaacca ggtcagcctg acctgcctag 960
tcaaaggctt ctatcccagc gacatcgccg tggagtggga gagcaatggg cagccggaga 1020
acaactacaa ggccacgcct cccgtgctgg actccgacgg ctccttcttc ctctacagca 1080
agctcaccgt ggacaagagc aggtggcagc aggggaacgt cttctcatgc tccgtgatgc 1140
atgaggctct gcacaaccac tacacgcaga agagcctctc cctgtctccg ggtaaataaa 1200
ggcgcgccag tattggatac tagagtcgag catgcatcta gtcgac 1246
<210>2
<211>450
<212>蛋白质
<213>
<400>2
mgrgllrglw plhivlwtri astipphvqk svnndmivtd nngavkfpql ckfcdvrfst 60
cdnqkscmsn csitsicekp qevcvavwrk ndenitletv chdpklpyhd filedaaspk 120
cimkekkkpg etffmcscss decndniifs eeyntsnpdm dpkscdktht cppcpapell 180
ggpsvflfpp kpkdtlmisr tpevtcvvvd vshedpevkf nwyvdgvevh naktkpreeq 240
ynstyrvvsv ltvlhqdwln gkeykckvst kalpapiekt iskakgqpre pqvytlppsr 300
deltknqvsl tclvkgfyps diavewesng qpennykatp pvldsdgsff lyskltvdks 360
rwqqgnvfsc svmhealhnh ytqkslslsp gk
<210>3
<211>455
<212>DNA
<213>
<400>3
tggcccctcc ctcgggttac cccacagctt aggccgattc gacctctctc cgctggggcc 60
ctcgctggcg tccctgcacc ctgggagcgc gagcggcgcg cgggcgggga agcgcggccc 120
agacccccgg gtccgcccgg agcagctgcg ctgtcggggc caggccgggc tcccagtgga 180
ttcgcgggca cagacgccca ggaccgcgct tcccacgtgg cggagggact ggggacccgg 240
gcacccgtcc tgccccttca ccttccagct ccgcctcctc cgcgcggacc ccgccccgtc 300
ccgacccctc ccgggtcccc ggcccagccc cctccgggcc ctcccagccc ctccccttcc 360
tttccgcggc cccgccctct cctcgcggcg cgagtttcag gcagcgctgc gtcctgctgc 420
gcacgtggga agccctggcc ccggccaccc ccgcg 455
- 还没有人留言评论。精彩留言会获得点赞!