β‑胡萝卜素酮化酶突变体、重组表达载体、基因工程菌及其应用的制作方法
本发明属于基因工程与酶工程领域,具体涉及一种通过定向进化手段获得来源于雨生红球藻菌株的β-胡萝卜素酮化酶突变体、编码它的核酸序列、含有该突变体基因的重组表达载体,以及在酿酒酵母中的表达及其在酮基类胡萝卜素合成中的应用。
背景技术:
酮基类胡萝卜素是存在于植物、藻类、海洋细菌和真菌中的一类重要的天然色素,属于C40异戊二烯类化合物,含有许多的共轭双键以及末端六元环上含有不饱和酮基,可以有效的猝灭单线氧,具有很强的抗氧化能力。因此具有多种生理和营养功能,可广泛应用于食品、药品、保健品和化妆品等各行业。目前市场上的这些类胡萝卜素大都是通过化学方法合成,而化学合成过程中会引入其它杂质化合物,降低生物安全性,另外化学合成中一些类胡萝卜素的构型与天然的构型差别大,使生物学活性降低。而从天然产的微生物如雨生红球藻、红发夫酵母中提取含量、成本高,目前很难进行大规模生产。发掘类胡萝卜素合成途径中的基因,并通过生物方法利用这些基因来生产类胡萝卜素既经济又安全。β-胡萝卜素酮化酶是酮基类胡萝卜素(海胆烯酮、角黄素、金盏花黄素、虾青素等)合成途径中的关键酶。在β-胡萝卜素酮化酶的作用下,会将β-胡萝卜素转化成海胆酮和角黄素,也可以将玉米黄质经金盏花黄质生成虾青素。然而植物细菌来源的这些酶底物作用不专一,酶活较低。
(三)
技术实现要素:
本发明的目的是提供一种通过定向进化手段获得的β-胡萝卜素酮化酶突变体以及其在类胡萝卜素合成当中的应用。
本发明的目的还在与提供一种通过定向进化手段获得的β-胡萝卜素酮化酶突变基因编码的酮化酶及其应用。
经密码子优化后在酿酒酵母中表达的β-胡萝卜素酮化酶基因如序列表中SEQ ID NO:15所示,其氨基酸序列如序列表中SEQ ID NO:16所示。本发明提供上述经定向进化获得β-胡萝卜素酮化酶突变体,所述突变基因的核苷酸序列是下列核苷酸序列之一:
(1)序列表中SEQ ID NO:1的核苷酸序列;
(2)序列表中SEQ ID NO:2的核苷酸序列;
(3)序列表中SEQ ID NO:3的核苷酸序列;
(4)序列表中SEQ ID NO:4的核苷酸序列;
(5)序列表中SEQ ID NO:5的核苷酸序列;
(6)序列表中SEQ ID NO:6的核苷酸序列;
(7)序列表中SEQ ID NO:7的核苷酸序列;
由突变基因编码的β-胡萝卜素酮化酶突变体,所述β-胡萝卜素酮化酶突变体的氨基酸序列时下列氨基酸序列之一:
(1)序列表中SEQ ID NO:8的氨基酸序列;
(2)序列表中SEQ ID NO:9的氨基酸序列;
(3)序列表中SEQ ID NO:10的氨基酸序列;
(4)序列表中SEQ ID NO:11的氨基酸序列;
(5)序列表中SEQ ID NO:12的氨基酸序列;
(6)序列表中SEQ ID NO:13的氨基酸序列;
(7)序列表中SEQ ID NO:14的氨基酸序列;
任何对SEQ ID NO:14所示氨基酸序列中氨基酸经过缺失、插入或替换一个或几个氨基酸并与序列SEQ ID NO:14在氨基酸水平具有至少70%同源性的序列,且具有β-胡萝卜素酮化酶活性的,即具有例如将β-胡萝卜素转变成角黄素或者将玉米黄素转变成虾青素活性的,仍属于本发明的保护范围。
其中,序列表中的SEQ ID NO:8的氨基酸序列编码的β-胡萝卜素酮化酶命名为OBKT-M1,相对于野生型SEQ ID NO:16的氨基酸其第165位的组氨酸突变成了精氨酸;序列表中SEQ ID NO:9的氨基酸序列编码的β-胡萝卜素酮化酶命名为OBKT-M2,相对于野生型其第264位的缬氨酸突变成了天冬氨酸;序列表中SEQ ID NO:10的氨基酸序列编码的β-胡萝卜素酮化酶命名为OBKT-M3,相对于野生型其第298位的苯丙氨酸变成了苏氨酸;序列表中SEQ ID NO:11的氨基酸序列编码的β-胡萝卜素酮化酶命名为OBKT-M12,其相对于野生型第165位的组氨酸突变成了精氨酸、第264位的缬氨酸突变成了天冬氨酸;序列表中SEQ ID NO:12的氨基酸序列编码的β-胡萝卜素酮化酶命名为OBKT-M13,其相对于野生型第165位的组氨酸突变成了精氨酸、第298位的苯丙氨酸变成了苏氨酸;序列表中SEQ ID NO:13的氨基酸序列编码的β-胡萝卜素酮化酶命名为OBKT-M23,相对于野生型其第264位的缬氨酸突变成了天冬氨酸、第298位的苯丙氨酸变成了苏氨酸;序列表中SEQ ID NO:13的氨基酸序列编码的β-胡萝卜素酮化酶命名为OBKTM,相对于野生型其第165位的组氨酸突变成了精氨酸、第264位的缬氨酸突变成了天冬氨酸、第298位的苯丙氨酸变成了苏氨酸。
本发明进一步涉及包含本发明的β-胡萝卜素酮化酶基因的酿酒酵母重组表达载体。所述表达载体通过如下方法构建得到:将SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6或者SEQ ID NO:7所示的β-胡萝卜素酮化酶基因ObktM1、ObktM2、ObktM3、ObktM12、ObktM13、ObktM23、ObktM插入到酿酒酵母整合型载体PUMRI-11(NCBI号:KM216413)中,得到包含ObktM1、ObktM2、ObktM3、ObktM12、ObktM13、ObktM23、ObktM基因的酿酒酵母整合型表达质粒PUMRI-11-ObktM1,PUMRI-11-ObktM2,PUMRI-11-ObktM3,PUMRI-11-ObktM12,PUMRI-11-ObktM13,PUMRI-11-ObktM23,PUMRI-11-ObktM.
本发明进一步涉及相应的表达β-胡萝卜素酮化酶基因的工程菌株,将所述酿酒酵母整合质粒转化到酿酒酵母中,使得所述的β-胡萝卜素酮化酶基因在转基因酿酒酵母中表达。
本发明还提供了利用β-胡萝卜素酮化酶来产生酮基化类胡萝卜素的方法。将所述的β-胡萝卜素酮化酶在特定的产β-胡萝卜素的菌株中进行表达。
本发明还涉及到产类胡萝卜素的条件下培养酵母菌株以及抽提产生的类胡萝卜素的步骤。
与现有技术相比,本发明具有以下优点:
本发明以雨生红球藻来源并根据在酿酒酵母中进行密码子优化后的β-胡萝卜素酮化酶OBKT为研究对象,采用易错PCR技术,利用酿酒酵母表达体系,建立了β-胡萝卜素酮化酶突变库,通过高通量筛选方法筛选出对β-胡萝卜素催化活力提高的突变株,并通过基因测序分析,将突变点进行组合突变,进一步提高催化活力,并将筛选到的突变株应用的酿酒酵母酮基化类胡萝卜素的生产中。
附图说明
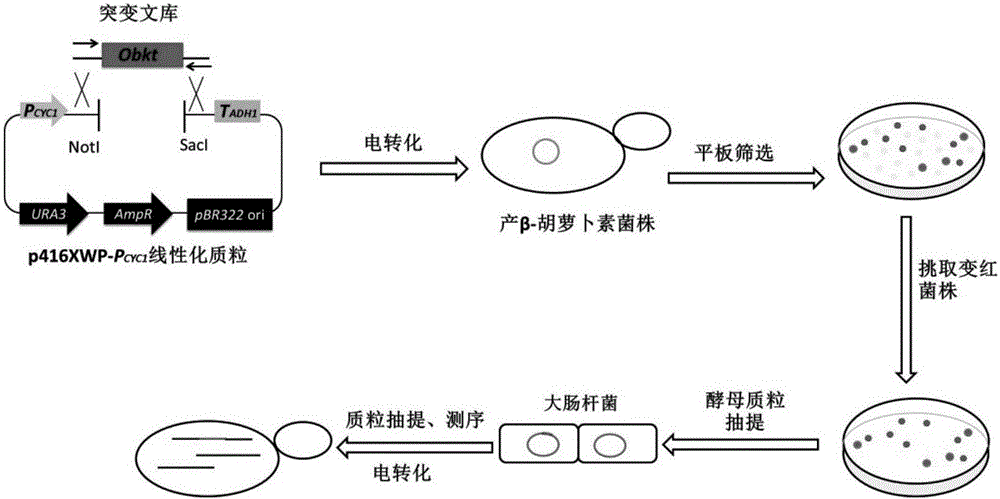
图1为用于定向进化的质粒图谱。
图2为定向进化β-胡萝卜素酮化酶的策略图。
图3为β-胡萝卜素酮化酶突变体与野生型的活性比较图。
图4为含OBTKM与野生型的酿酒酵母菌株类胡萝卜素HPLC分析比较图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1β-胡萝卜素酮化酶突变基因的分子克隆与表达
1.1材料与方法
1.1.1试剂与培养基配方
高保真酶DNA聚合酶Prime STARTM HS DNA polymeras、T4DNA连接酶、DNA限制性内切酶购于Takara公司,Easy Taq DNA聚合酶购于北京全式金生物技术有限公司,DNA marker(1kb DNAL ladder)(Thermo Scientific),PCR产物纯化试剂盒、DNA凝胶纯化试剂盒(Axygen,杭州)等分子生物学试剂盒用于基因克隆等操作;PCR引物合成及测序服务由上海生物工程有限公司或者博尚生物公司提供。
无氨基酵母氮碱(Yeast nitrogen base without amino acids,YNB)(碧迪医疗器械,上海)用于合成培养基的制备;虾青素标准品由浙江新和成有限公司提供,角黄素标准品购自阿拉丁公司,β-胡萝卜素的标准品购自Sigma-Aldrich公司;0.22μm混合纤维素针式滤头购自上海生物工程有限公司;其它未做特殊说明的试剂和药品均为国产分析纯。
100mg/mL氨苄青霉素(Ampicillin):称量1g氨苄青霉素置于15mL离心管中,用灭菌水定容到10mL充分混合溶解后,利用无菌0.22μm的针式过滤器过滤除菌,分装到1.5mL离心管后于-20℃保存。工作浓度为100μg/mL。
50mg/ml卡那霉素:
0.1mol/L CaCl2-MgCl2溶液(含80mmol/L MgCl2,20mmol/L CaCl2):称取MgCl2·6H2O16.26g,CaCl2 2.22g,用去离子水溶解并定容至1L,121℃灭菌15min,冷却后于4℃冰箱保存。
甘油-CaCl2溶液(含0.1mol/L的CaCl2和20%甘油):称取CaCl2 11.1g用20%的甘油溶液溶解并定容到1L,121℃灭菌15min,冷却后于4℃冰箱保存。
1mol/L山梨醇:称量182.17g山梨醇,加去离子水定容到1L,121℃高压灭菌15min,冷却后于4℃冰箱保存。
Luria-Bertani(LB)培养基:NaCl 10g/L,蛋白胨10g/L,酵母提取物5g/L,1mol/L NaOH调节至pH=7.2,固体LB培养基添加2%的琼脂粉,121℃灭菌15min。
Yeast Extract Peptone Dextrose(YPD)培养基:酵母提取物10g/L,蛋白胨20g/L,葡萄糖20g/L,固体YPD培养基添加2%的琼脂粉,115℃灭菌15min。
10×氨基酸储液(10×Dropout Solution,10×DO):称量以下各种氨基酸,混合,溶于灭菌水中,使其终浓度为:L-Adenine hemisulfate salt 200mg/L,L-Arginine HCl 200mg/L,L-Histidine HCl monohydrate 200mg/L,L-Isoleucine 300mg/L,L-Leucine 1000mg/L,L-Lysine HCl 300mg/L,L-Methionine 200mg/L,L-Phenylalanine 500mg/L,L-Threonine 2000mg/L,L-Tryptophan 200mg/L,L-Tyrosine 300mg/L,L-Uracil 200mg/L,L-Valine 1500mg/L。配制上述氨基酸储液时,根据筛选不同选择标记所需要,缺失相应的氨基酸。氨基酸母液利用0.22μm的针式过滤器过滤除菌,于4℃冰箱存放。
10×葡萄糖溶液(20g/L):称取20g葡萄糖,加水定容到1L,115℃灭菌15min,4℃冰箱保存。
10×半乳糖溶液(20g/L):称取20g半乳糖,加水定容到1L,115℃灭菌15min,4℃冰箱保存。
Synthetic Defined培养基:称取YNB 1.7g,无水硫酸氨5g,琼脂粉20g(制作平板时添加),10×DO 100mL,加水定容至900mL,115℃灭菌15min。待冷却到室温后,根据实验需要加入100mL 10×葡萄糖,或者10×半乳糖溶液,配制成相应的SD或者SG培养基。若培养基中缺少DO中相应的营养成分则在其后标注,如SD-URA表示无鸟嘧啶的SD培养基。
1.1.2大肠杆菌DH5α感受态制备
大肠杆菌的MgCl2-CaCl2感受态细胞制作方法及转化参照分子克隆操作手册。若无特别说明,大肠杆菌质粒抽提、DNA凝胶回收、DNA片段的连接、RNA抽提等均按照相应的试剂盒的说明书进行操作。
转化后的大肠杆菌克隆采用菌液PCR的方法进行鉴定。从平板上挑取单个菌落,接种到含有相应抗生素的LB试管中。菌体长到轻微雾花状后,取菌液作为模板,利用Easy Taq DNA聚合酶进行菌液PCR验证。挑选阳性克隆对应试管进行质粒抽提,并对克隆区段进行DNA测序鉴定。
1.1.3酿酒酵母电转化感受态细胞的制备及转化
酵母电转化感受态细胞制作过程如下:
(1)从平板上挑取酵母菌落接种到5mL的YPD培养基中,30℃培养12h。转50μl培养物到50mL YPD培养基中,30℃过夜培养,使菌体浓度到OD600=2左右。
(2)菌液转移到50mL离心管中,3000×g离心5min,去上清。
(3)使用30mL冰上预冷的灭菌水重悬细胞,3000×g离心5min离心去上清。
(4)使用20mL冰上预冷的1M的山梨醇洗涤细胞沉淀,3000×g离心5min,离心去上清。
(5)使用200μl-500μl 1M的山梨醇重悬细胞,并转移到预冷的1.5mL离心管中,即做成酵母感受态细胞。每次酵母电转化应制备新鲜的感受态细胞以保证足够的转化率。
酵母转化步骤如下:
(1)取2-5μl质粒或者线性化片段,加入到预冷的1.5mL离心管中。
(2)若使用2mm的电转杯,往离心管中加入40μl的感受态细胞;若使用1mm的电转杯,加入20μl的感受态细胞。细胞与DNA在离心管中用枪轻轻吹打混匀后转移到电转杯中,冰上预冷5min。
(3)将电转化杯外围的水用吸水纸擦干净,于750V/mm的电击强度下进行电击。
(4)往电击后的电转杯中加入1mL YPD培养基,轻轻悬浮细胞,转移到1.5mL离心管中,于30℃培养箱静置复苏2h。
(5)复苏后的细胞用灭菌水清洗两遍,取适量的细胞涂布到相应的琼脂平板。30℃培养箱培养2-3天至单菌落出现。
1.2通过易错PCR获得β-胡萝卜素突变基因
首先将经密码子优化后合成的Obkt基因(NCBI号:KP866870)克隆到p416XWP-PCYC1质粒上,然后以p416XWP-PCYC1-Obkt t为模板,用PCYC1F2(ACACACACTAAATTAATAGAATTCAAC)和ADH1tR2(CAACCTTGATTGGAGACTTGAC)作为引物,使用Taq DNA聚合酶,通过易错PCR的方法获取Obkt突变体库。由于Mn2+可以增加PCR过程的碱基错配率,在利用Taq酶进行易错PCR时,在体系中加入一定量的MnCl2以增加PCR过程中的基因突变率。易错PCR体系为:
PCR反应条件为:预变性95℃ 3min,然后进入温度循环,变性,95℃ 30s;退火,54℃30s;延伸72℃,1min,共30个循环,最后72℃延伸5min,终止温度为4℃。
将易错PCR产物清洗后与线性化的p416XWP-PCYC1质粒(用NotI和SacI进行双酶切),通过电转的方法共同转入含有tHMG1、crtE、crtYB、crtI基因的产β-胡萝卜素的YXWP-77菌株中,涂布在SD-URA缺陷的平板上,培养3天;然后,通过颜色筛选,挑取颜色变红加深的菌株。用酿酒酵母提取试剂盒提取阳性突变株质粒,将提取的质粒转到大肠杆菌DH5α中扩增,测序。
突变体的序列分析结果如下表1所示
实施例2包含β-胡萝卜素酮化酶突变体的酿酒酵母表达载体的构建及线性化
2.1表达载体构建
将实施例1.2中得到的含有阳性突变株的质粒用NotI和SacI双酶切,得到β-胡萝卜素酮化酶突变基因与同样NotI和SacI双酶切后的PUMRI-11质粒(NCBI号:KM216413)连接做转化。
双酶切体系:总体系20μl
基因/质粒:17μl
10×buffer:2μl
NotI酶:0.5μl
SacI酶:0.5μl
酶切条件:放置37℃,酶切1.5-2个小时
连接体系:
基因:5.5μl,质粒3μl,10×T4DNA ligase buffer 1μl,T4DNA连接酶;0.5μl。
感受态细胞的转化:将10μl的连接产物加入到100μl冰上融化的感受态细胞中,用移液枪轻轻混匀,冰浴20-40min;42℃热击90s,迅速放入冰中,冰浴5min;添加1ml LB培养基,37℃,220rpm震荡培养50min,1200rpm离心1min中,去上清,剩余200μl混匀涂布在卡那抗性的LB平板上,于37℃培养过夜得到的阳性克隆用于质粒抽提。
2.2重组的表达载体线性化
重组载体含有DPP1同源臂,同源臂处含有SfiI位点,通过SfiI酶切方法线性化。
酶切体系:总体系50μl,质粒43.5μl,10×G buffer 5μl,SfiI酶1.5μl。
酶切条件:放置50℃酶切2-3个小时
实施例3将β-胡萝卜素酮化酶突变株整合到产β-胡萝卜素的酿酒酵母的染色上进一步验证
实施例2中得到重组线性化的质粒按照实施例1.1.3中的方法整合到产β-胡萝卜素的酿酒酵母染色体上,涂布在含有G418抗性的YPD平板上。突变体OBKTM1、OBKTM2、OBKTM3显示活性提高,促进β-胡萝卜素向虾青素的转化。与野生型比较的结果如图3所示。
实施例4通过组合突变进一步的提高β-胡萝卜素酮化酶的活力
将实施例1.2得到三个突变点进行组合突变,得到含有两个突变点的突变体OBKTM12(H165R/V264D)、OBKTM13(H165R/F298Y)、OBKTM23(V264D/F298Y)以及含有三个点的突变体OBKTM(H165R/V264D/F298Y),将这几个突变体根据实施例2构建整合型载体,转到产β-胡萝卜素的酿酒酵母中。组合突变的活力比单点突变高,优选的三个点突变体OBKTM活性最高,先比野生型提高了2.5倍,前体β-胡萝卜素转化为海胆烯酮和角黄素,从而β-胡萝卜素的产量下降了50%,具体结果如图3所示。含OBKTM与野生型基因的酿酒酵母菌株各类胡萝卜素成分液相分析如图4所示。用于做定点突变的引物以及用于PCR测序的引物GAL10F和ADH1tR2如表2所示
实施例5将ObktM突变体和β-胡萝卜素羟化酶整合到酿酒酵母中以产虾青素
以PUMRI-11-ObktM为模板用Obkt-F1(BamHI)(CAGGGATCCATGCACGTTGCTTCTGCT)和Obkt-R(SalI)(GGAAGTCGACTTAAGCCAAAGCTGGAACCA为引物扩增含有BamHI和SalI酶切位点的ObktM基因,并将其用BamHI和SalI双酶切,然后与同样用BamHI和SalI双酶切之后的载体PIMRI-11-OcrtZ连接转化做克隆,操作同实施例2将得到的重组质粒pUMRI-11-OcrtZ-ObktM以及之前构建的pUMRI-11-OcrtZ-Obkt(Zhou et al.,2015)用SfiI线性化之后各自转到含有β-胡萝卜素的酿酒酵母中。得到菌株经HPLC分析后发现含有OBKTM突变的虾青素产量比含有野生型的提高了48%。
实施例6从酿酒酵母细胞提取类胡萝卜素并通过HPLC分析类胡萝卜素的产量
将产类胡萝卜素的酿酒酵母工程菌挑取单菌落至5mlYPD试管中,220rpm 30℃进行过夜培养,然后转接到50mlYPD培养基中至终OD为0.05。220rpm 30℃培养84小时。类胡萝卜素的抽提采取热酸法进行,操作方法如下:
(1)取发酵后培养物1mL于15mL离心管中,4000×g离心1min去上清。
(2)细胞沉淀用5mL纯净水悬浮,4000×g离心1min去上清。
(3)用1mL 3M盐酸悬浮细胞,沸水浴中3min进行细胞破碎,然后立即置于冰水浴中冷却3-5min,离心后去上清。
(4)使用5mL纯净水重悬细胞沉淀,4000×g离心1min倒掉上清以除去其中残留的盐酸。
(5)在离心管中加入4mL丙酮,盖紧离心管,漩涡振荡使细胞沉淀彻底分散,萃取其中的类胡萝卜素。
(6)将上述含有提取物的离心管置于超声清洗仪中超声10min,彻底提取其中的类胡萝卜素。
(7)4℃,4000×g离心2min,将上清用0.45μm的有机系针式滤头进行过滤,滤液可用于总类胡萝卜素测定和HPLC分析。
在收集菌液用于抽提类胡萝卜素的同时取2mL菌液到2mL离心管中,12000×g离心1min,去除培养基,加水洗涤一遍,再离心去上清。将带菌体沉淀的离心管放置于90℃烘箱中处理8h左右以得到干菌体。根据抽提得到的类胡萝卜素和菌体的干重计算出类胡萝卜素的单位干重含量(mg/g DCW)。
使用下列条件,通过HPLC检测酿酒酵母中类胡萝卜素组成及含量。液相分析仪器为岛津的LC-20AT,色谱柱为Amethyst C18-H反相柱(4.6×150mm,5μm,Sepax Technologies,Inc)。柱温40℃,检测波长470nm。采用梯度洗脱,流动相为A泵为乙腈和水(90:10),B泵为甲醇和异丙醇(60:40),流速为1mL/min,洗脱条件如下:0-15min,B泵流动相从0升到90%;15-30min保持B泵的流动相90%;30-35min B泵流动相从90%降到0。以下是各种类胡萝卜素保留时间:虾青素,7.6min;角黄素,11.5min;海胆烯酮,17.6min;β-胡萝卜素,24.5min。
- 还没有人留言评论。精彩留言会获得点赞!