对亚硫酸氢根和次氯酸根双响应比率型荧光标记试剂及其合成方法和应用与流程
本发明涉及荧光标记试剂,具体涉及一种对亚硫酸氢根和次氯酸根双响应比率型荧光标记试剂及其合成方法和应用。
背景技术:
近十年来,一些生物小分子因广泛参与生命体内氧化还原反应,调节机体内环境平衡以及潜在的应用于临床医学而备受关注。在这其中,氧化还原平衡活性氧(ROS)和还原硫物种(RSS)在调节生物过程中扮演关键角色,如细胞增殖、分化和凋亡,而其中代表性的物质当属HSO3-和ClO-。虽然近年来,人们都在广泛讨论这些生物小分子的反应路径,生理功能等各种性能,但是,这些物质在生命系统中扮演的作用仍然有许多未知方面。因此,十分有必要建立一种即时的检测方法对这些生物小分子完成区分和检测。
到目前为止,高效液相色谱-质谱、电化学分析、毛细管电泳分析、以及以有机探针和纳米材料为基础的荧光、拉曼等分析法用来检测生物小分子被广泛应用。在这些分析方法中,荧光探针具有超高灵敏性,即时检测以及应用于生命有机体系等独特优势。此外,相比较开关型荧光有机探针,比率型荧光探针大大减少受到来自外界环境、仪器设备等的影响。
最重要的是,当前还没有一种比率型荧光探针可用来同时检测HSO3-和ClO-,因此,本发明所提出的双响应荧光分子探针对于进一步了解HSO3-和ClO-在机体内的作用机理有着深远意义。
技术实现要素:
本发明的目的是一种标记反应迅速、对HSO3-和ClO-选择性高、检测限极低、合成方法简便的对亚硫酸氢根和次氯酸根双响应比率型荧光标记试剂;本发明同时提供其合成方法和应用。
本发明所述的对亚硫酸氢根和次氯酸根双响应比率型荧光标记试剂,是以菲并咪唑为荧光基团,以活化的C=C双键为反应活性基团,其化学名称是:2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈,其化学结构式是:
所述的对亚硫酸氢根和次氯酸根双响应比率型荧光标记试剂的合成方法,包括以下步骤:
(1)将菲醌、对二苯甲醛加入到烧瓶中,再加入乙酸铵和乙酸,加热回流进行反应,反应结束,待溶液冷却到室温,抽滤,用乙酸洗涤得到的固体,抽滤得到的滤液加入到冰水中,搅拌得到黄色固体,将黄色固体与乙酸洗涤后的固体合并,得到中间产物4-苯并咪唑基苯甲醛;
(2)将步骤(1)得到的中间产物4-苯并咪唑基苯甲醛用无水乙腈溶解,加入碳酸钾和氢氧化钾加热回流,降至室温后,加入碘甲烷的无水乙腈溶液,升温回流反应,冷却,过滤,将滤液收集后经旋转蒸馏、纯化得到中间产物4-甲基-苯并咪唑基苯甲醛;
(3)将得到的中间产物4-甲基-苯并咪唑基苯甲醛溶于无水吡啶中,升温并搅拌,加入丙二腈反应,反应完成后,冷却,过滤,得到红色结晶物,即目标产物2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基-苯亚甲基)丙二腈(MPIBA)。
其中:
步骤(1)中,菲醌、对二苯甲醛、乙酸铵、乙酸的摩尔比是1:3:7:10。
步骤(1)中回流反应的时间为50分钟。
步骤(2)中,碳酸钾、氢氧化钾、碘甲烷与中间产物4-苯并咪唑基苯甲醛的摩尔比为1:1:1.2:1。
步骤(2)中,加入碳酸钾和氢氧化钾加热回流30分钟,降至室温后,加入碘甲烷的无水乙腈溶液,升温回流反应30分钟。
步骤(3)中,丙二腈与中间产物4-甲基-苯并咪唑基苯甲醛的摩尔比为1.5:1。
步骤(3)中,升温至70℃并搅拌10分钟,加入丙二腈反应1小时。
所述的对亚硫酸氢根和次氯酸根双响应比率型荧光标记试剂的应用,用于检测细胞外源性HSO3-和ClO-的浓度、检测细胞内源性HSO3-和ClO-的浓度以及荧光成像。
具体包括以下步骤:
一、检测细胞外源性HSO3-和ClO-的浓度:
(1)配制pH=7.40,浓度为10mM的PBS缓冲盐溶液;配制浓度为1mM的HSO3-的乙腈标准溶液、浓度为1mM的ClO-的乙腈标准溶液及浓度为0.05mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液;
(2)分别取0μL、2.5μL、5μL、7.5μL、10μL、12.5μL、15μL、17.5μL、20μL、22.5μL、25μL浓度为1mM的HSO3-和ClO-的乙腈标准溶液共22份,分别加入到荧光比色皿中,分别加入100μL浓度为10mM的PBS缓冲盐溶液,然后再分别加入100μL浓度为0.05mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液,最后分别加入乙腈定容到1mL,混合均匀;
通过荧光分光光度计测试荧光强度,得到荧光强度比值,检测ClO-荧光强度的激发波长为440nm、检测HSO3-荧光强度的激发波长分别为330nm、410nm;
(3)分别以HSO3-和ClO-的浓度为横坐标,以荧光强度比值为纵坐标,得到关于细胞外源性HSO3-和ClO-浓度、荧光强度比值的线性方程;
(4)将待测样品与乙腈按体积比1:4混合后,取900mL,并向其中加入100μL浓度为0.05mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液,根据外源性HSO3-和ClO-浓度、荧光强度比值的线性方程得到HSO3-和ClO-的浓度;
二、用来检测活细胞内源性HSO3-和ClO-的浓度:
(1)配制浓度为1mM的HSO3-的乙腈标准溶液、浓度为1mM的ClO-的乙腈标准溶液、浓度为0.5mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液、浓度为1μg/ml的LPS溶液、浓度为1μg/ml的PMA溶液、浓度为1mM的SO2donor溶液;
(2)将活细胞Hela细胞置入培养基中培育,共分别培养10组,每组培养基中接种量为2×107~9×107个/mL,培育24h,先分别加入10μL浓度为0.5mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液,再分别加入0μL、7.5μL、15μL、22.5μL、30μL浓度为1mM的HSO3-的乙腈标准溶液和ClO-的乙腈标准溶液,于37℃共培育15min,置入共聚焦下观测成像,收集不同颜色光通道的荧光强度,从而进行荧光强度比值,得到关于细胞内源性HSO3-和ClO-的浓度与荧光强度比值的线性方程;
(3)将活细胞Hela细胞置入培养基中培育,共分别培养4组,每组培养基中接种量为2×107~9×107个/mL,培育24h;
向第一组中加入100μL浓度为1μg/ml的LPS溶液、100μL浓度为1μg/ml的PMA溶液用来刺激细胞产生内源性的ClO-,再加入10μL浓度为0.5mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液进行培养,成像,第二组不加LPS和PMA,只加10μL浓度为0.5mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液作为对照;
向第三组中加入100μL浓度为1mM的SO2donor用来刺激细胞产生内源性的HSO3-,再加入10μL浓度为0.5mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液进行培养,成像,第四组不加SO2donor,只加10μL浓度为0.5mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液作为对照;
置入共聚焦下观测成像,收集不同颜色光通道的荧光强度,从而进行荧光强度比值,根据细胞内源性HSO3-和ClO-的浓度与荧光强度比值的线性方程,从而得到细胞内源性HSO3-和ClO-的浓度。
本发明的有益效果如下:
(1)本发明的比率型荧光标记试剂是以菲并咪唑为母体环,以受活化的C=C双键为反应位点,使探针对HSO3-和ClO-有优越的选择性,并且会有明显的荧光信号读出。
(2)本发明的比率型荧光标记试剂响应灵敏,对ClO-的响应时间在数秒内,对HSO3-的响应在40s以内。
(3)本发明的比率型荧光标记试剂检测限低,相比较于商业化的荧光标记试剂,本发明所提出的对HSO3-和ClO-的检测限分别为3.5nm/L和7.5nm/L,远远低于细胞内这两种物质存在的含量。
(4)本发明的比率型荧光标记试剂,相比较开关型荧光标记试剂,以荧光强度的比值为基准,而不是直接荧光强度,会大大减少来自外界环境以及仪器等等的影响。
(5)本发明是目前为止第一种用来同时区分和检测HSO3-和ClO-的有机荧光探针。
(6)由于反应后紫外颜色的变化,可供裸眼检测,方便快捷。
(7)本发明应用于活细胞的检测,进一步推动了生物小分子在生命体中作用的探究。
附图说明
图1是MPIBA的合成路线图;
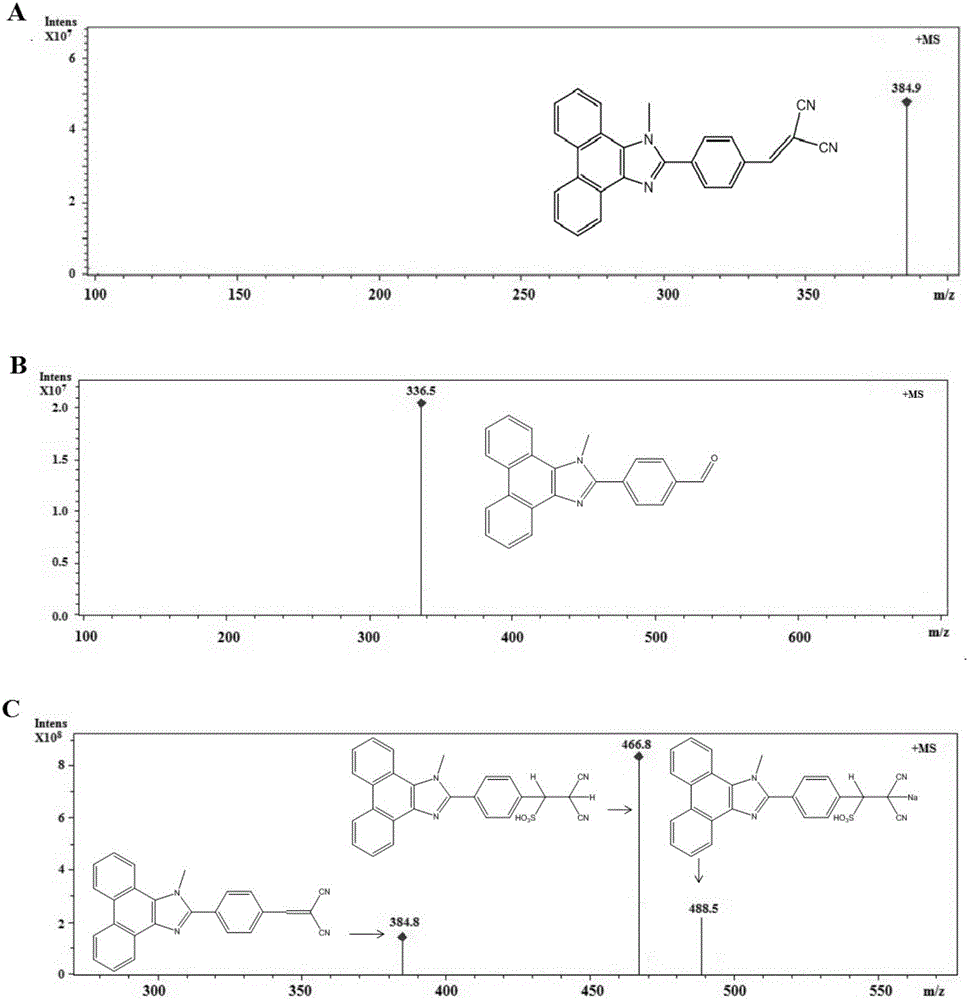
图2是实施例1中的质谱图;
其中:A、MPIBA的质谱图;B、MPIBA与ClO-反应的质谱图;C、MPIBA与HSO3-反应的质谱图;
图3是实施例1中MPIBA的核磁H谱;
图4是实施例1中MPIBA的核磁C谱;
图5是MPIBA对HSO3-的荧光强度及线性方程图;
图6是MPIBA对ClO-的荧光强度及线性方程图;
图7是样品检测的荧光图;
其中:A、检测雨水中HSO3-浓度的荧光图;B、检测自来水中ClO-浓度的荧光图;
图8是MPIBA对HSO3-分子的选择性研究分析及比色图;
其中:A、HSO3-对金属离子;B、HSO3-对阴离子其他还原类硫物种;
图9是MPIBA对ClO-分子的选择性研究分析及比色图;
其中:A、ClO-对金属离子;B、ClO-对阴离子其他活性氧和活性氮;
图10是探究pH值对MPIBA与物质反应效果的影响图;
其中:A、HSO3-;B、ClO-;
图11是探究MPIBA对物质的响应时间图;
其中:A、HSO3-;B、ClO-;
图12是细胞内荧光线性方程图;
其中:A、HSO3-;B、ClO-;
图13是检测内源性相关细胞图;
其中:A、HSO3-;B、ClO-;
图14是细胞存活率柱状图。
具体实施方式
以下结合实施例对本发明做进一步描述。
实施例1
如图1所示,本发明的对HSO3-和ClO-双响应比率型荧光标记试剂合成步骤有3步,以菲醌和对二苯甲醛为原料,具体合成操作如下:
(1)中间体4-苯并咪唑基苯甲醛的合成:
在50ml的圆底烧瓶中加入600mg对二苯甲醛,315mg菲醌和2.15g的乙酸铵,然后加入25ml的冰乙酸,搅拌加热至回流50分钟,冷却到室温,抽滤得到固体,用冰乙酸洗涤得到的固体,抽滤得到的滤液倒入冰水中搅拌,搅拌得到黄色固体,过滤并且合并前面洗涤后的固体,得到中间体4-苯并咪唑基苯甲醛395.5mg,产率为96%。
(2)中间体4-甲基-苯并咪唑基苯甲醛的合成:
在100ml圆底烧瓶中加入30ml无水乙腈,再加入336mg中间体4-苯并咪唑基苯甲醛,56mg KOH,150mg K2CO3,搅拌加热至回流30分钟,降温至室温后用恒压滴液漏斗加入溶有0.1ml CH3I的乙腈溶液,滴加完毕,升温至回流状态反应30分钟,冷却过滤,收集滤液并旋蒸,粗产品进一步纯化,以(v正己烷:v乙酸乙酯=10:1)为洗脱剂,得黄绿色固体4-甲基-苯并咪唑基苯甲醛280mg,产率80.5%。
(3)目标产物2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈(MPIBA)的合成:
取176mg中间产物4-甲基-苯并咪唑基苯甲醛放入25ml圆底烧瓶中,溶于10ml无水吡啶中,升温至70℃并搅拌10分钟,加入丙二腈0.05ml再反应1小时,待稍冷却放入冰箱,待固体析出后,直接过滤得红色针状固体,即为目标产物2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基-苯亚甲基)丙二腈,158mg,产率78.3%。
中间体4-苯并咪唑基苯甲醛表征如下:
1H NMR(DMSO-d6,500MHz),δ(ppm):10.141(s,1H),8.86(d,J=8.5Hz,2H),8.62(d,J=4.5Hz,2H),8.15(q,J=8.5Hz,4H),7.79(q,J=7.5Hz,2H),7.68(d,J=7.0Hz,2H),),2.953(s,N-H,1H).
13C NMR(DMSO-d6,500MHz),δ(ppm):(193.42,151.33,130.75,130.20,127.91,127.71,126.97,126.22,125.98,124.94,124.10,122.35,121.97.MS m/z calcd for 322.37[M+H]+found 323.5.
中间体4-甲基-苯并咪唑基苯甲醛表征如下:
1H NMR(DMSO-d6,500MHz),δ(ppm):4.52(s,3H)7.67(m,2H),7.77(m,2H),8.14(d,J=8.4Hz,2H),8.53(d,J=8.4Hz,2H),8.57(d,J=7.6Hz,1H),8.63(d,J=7.6Hz,1H),8.86(d,J=8.4Hz,1H),8.90(d,J=8.4Hz,1H),10.10(s,1H).
13C NMR(DMSO-d6,500MHz),δ(ppm):(193.37,151.22,130.75,130.19,127.87,127.68,126.16,125.92,124.98,124.14,123.53,122.35,122.01)MS m/z calcd for 336.1[M+H]+found 336.5.
目标产物2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基-苯亚甲基)丙二腈表征如下:
1H NMR(DMSO-d6,500MHz),δ(ppm):9.0(d,J=8.5Hz,H),8.89(d,J=8.5Hz,2H),8.66(d,J=7.5Hz,2H),8.62(d,J=6.5Hz,1H),8.59(d,J=5.5Hz,2H),7.80(d,J=8.0Hz,2H),7.75(d,J=3.0Hz,2H),7.68(d,J=3.0Hz,H),7.40(d,J=3.0Hz,H),4.37(s,3H,N-CH3)
13C NMR(DMSO-d6,500MHz),δ(ppm):(161.01,150.98,137.47,131.24,,130.74,127.90,127.72,126.24,125.00,122.36,122.07,113.74,82.53,36.90.MS m/z calcd for 384.1[M+H]+found 384.8.
将MPIBA进行质谱检测,具体见图2,其中,A是MPIBA的质谱图,B是MPIBA与ClO-反应的质谱图,C是MPIBA与HSO3-反应的质谱图。
将MPIBA进行核磁共振检测,具体见图3-4,其中,图3是MPIBA的核磁H谱,图4是MPIBA的核磁C谱。
实施例2
检测细胞外源性HSO3-和ClO-的浓度:
(1)配制pH=7.40,浓度为10mM的PBS缓冲盐溶液;配制浓度为1mM的HSO3-的乙腈标准溶液、浓度为1mM的ClO-的乙腈标准溶液及浓度为0.05mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液;
(2)分别取0μL、2.5μL、5μL、7.5μL、10μL、12.5μL、15μL、17.5μL、20μL、22.5μL、25μL浓度为1mM的HSO3-和ClO-的乙腈标准溶液共22份,分别加入到荧光比色皿中,分别加入100μL浓度为10mM的PBS缓冲盐溶液,然后再分别加入100μL浓度为0.05mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液,最后分别加入乙腈定容到1mL,混合均匀;
通过荧光分光光度计测试荧光强度,得到荧光强度比值,检测ClO-荧光强度的激发波长为440nm、检测HSO3-荧光强度的激发波长分别为330nm、410nm;
(3)分别以HSO3-和ClO-的浓度为横坐标,以荧光强度比值为纵坐标,得到关于细胞外源性HSO3-和ClO-浓度、荧光强度比值的线性方程;图5是MPIBA对HSO3-的荧光强度及线性方程图,其中,A、B是加入0-22.5μM的HSO3-的荧光图,C是HSO3-荧光线性方程图。图6是MPIBA对ClO-的荧光强度及线性方程图;其中,A是加入0-22.5μM的ClO-的荧光图,B是ClO-荧光线性方程图。
(4)将待测样品与乙腈按体积比1:4混合后,取900mL,并向其中加入100μL浓度为0.05mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液,根据外源性HSO3-和ClO-浓度、荧光强度比值的线性方程得到HSO3-和ClO-的浓度。
实施例3
利用MPIBA检测雨水中的HSO3-和自来水中的ClO-的含量。
将待测雨水样品和无水乙腈按体积比1:4混合,取所得液900mL,并向其中加入100μL浓度为0.05mM的MPIBA,所得溶液在室温下保存1min,根据实施例2荧光强度计算得到雨水样品中含有HSO3-的含量,将所得荧光强度值(从图7A中得到)带入图5C所建立的荧光线性,所得数值为1.9mM,即雨水中的HSO3-含量为10.5mM。
将待测自来水样品和无水乙腈按体积比1:4混合,取所得液900mL,并向其中加入100μL浓度为0.05mM的MPIBA,所得溶液在室温下保存1min,根据实施例2荧光强度判断自来水样品中是否含有ClO-,将所得荧光强度值(从图7B中得到)带入图6B所建立的荧光线性,所得数值为2.3mM,即自来水中的ClO-含量为12.5mM。
图7是样品检测的荧光图。其中,A为检测雨水中HSO3-浓度的荧光图,B为检测自来水中ClO-浓度的荧光图。
实施例4
为探究MPIBA对HSO3-的选择性,一些代表性的阴离子Cl-、Br-、I-、CH3COO-、ClO4-、SO42、H2PO4-、S2O32-、SCN-、还原硫物种HS-、GSH、Cys、Hcy和金属离子Na+、K+、Mg2+、Fe3+、Cd2+、Co2+、Ni2+、Hg2+、Al3+、Mn2+、Ag+、Cu2+、Zn2+加入给予探究。从图8可以看到,数倍HSO3-浓度的离子加入到MPIBA中,造成的影响可以忽略不计。在365nm紫外灯下,当HSO3-加入可以发现红色荧光消失,蓝色荧光出现。图8中,A为金属离子对MPIBA选择性影响,小瓶为在365nm紫外灯下加入干扰性离子溶液的现象,B为一些RSS,常见阴离子对探针选择性研究,小瓶为相应加入干扰离子溶液在365nm紫外灯下的现象。
同样,为了探究MPIBA对ClO-的选择性,除了相同金属离子,活性氧(ROS)、活性氮(RNS),包括H2O2、OH、TBHP、TBO-、KO2、ONOO-、NO2-、NO3-、NO加入到溶液中。从图9可以看出,即使数倍于ClO-浓度的干扰离子加入,造成的影响也可忽略不计。同样在365nm的紫外灯下,当ClO-加入可以发现红色荧光变为绿色荧光。图9中,A为金属离子对探针选择性影响,小瓶为在365nm紫外灯下加入干扰性离子溶液的现象,B为一些ROS、RNS对MPIBA选择性研究,小瓶为相应加入干扰离子溶液在365nm紫外灯下的现象。
为了探究pH值对荧光比率的影响,在加入探针和检测物的物质的量一定的情况下,让反应在pH为4.0-10.0的区间内反应,探究最优的反应环境。正如图10A所显示的荧光比率值在pH为6.0-10.0的环境中维持在一个较高水平,这说明在中性和弱碱性的环境中测量是较优环境,这和HSO3-的pka为7.20是相吻合的。同样如图10B所示,在pH为4.0-6.0间,反应活性比较低,当pH处于6.0-10.0环境中时,反应比率明显升高。
图11是探究MPIBA对物质的响应时间图,其中A为MPIBA加上HSO3-的响应时间图,B为MPIBA加上ClO-的响应时间图。
实施例5
利用MPIBA检测细胞内源性的HSO3-和ClO-的浓度:
(1)细胞培养:本实验选择Hela细胞,将复苏好的细胞进行培养,培养基包含10%牛胚胎血清、1%双抗、89%DMEM、在37℃,5%CO2的环境中培养24h,得到长势良好的细胞待用,共分别培养14组,每组培养基中接种量为2×107~9×107个/mL;
(2)细胞内源性HSO3-和ClO-的浓度与荧光强度比值的线性方程的建立:
①配制浓度为1mM的HSO3-的乙腈标准溶液、浓度为1mM的ClO-的乙腈标准溶液、浓度为0.5mM的MPIBA的乙腈溶液、浓度为1μg/ml的LPS溶液、浓度为1μg/ml的PMA溶液、浓度为1mM的SO2donor溶液;
②取10组培养基,先分别加入10μL浓度为0.5mM的2-(4-(1-甲基-1H菲并[9,10d]咪唑-2基)-苯亚甲基)丙二腈的乙腈溶液,再分别加入0μL、7.5μL、15μL、22.5μL、30μL浓度为1mM的HSO3-的乙腈标准溶液和ClO-的乙腈标准溶液,于37℃共培育15min,置入共聚焦下观测成像,收集不同颜色光通道的荧光强度,从而进行荧光强度比值,得到关于细胞内源性HSO3-和ClO-的浓度与荧光强度比值的线性方程。
图12A为细胞内HSO3-浓度与荧光比率(蓝色荧光强度比红色荧光强度)的线性方程。图12B为细胞内ClO-浓度与荧光强度比率(绿色荧光强度比红色荧光强度)的线性方程。
(3)细胞内源性产生的HSO3-和ClO-的含量的检测:
取4组培养基,向第一组中加入100μL浓度为1μg/ml的LPS溶液、100μL浓度为1μg/ml的PMA溶液用来刺激细胞产生内源性的ClO-,再加入10μL浓度为0.5mM的MPIBA的乙腈溶液进行培养,成像,第二组不加LPS和PMA,只加10μL浓度为0.5mM的MPIBA的乙腈溶液作为对照;图12B即为内源性检测ClO-的相关细胞图。
向第三组中加入100μL浓度为1mM的SO2donor用来刺激细胞产生内源性的HSO3-,再加入10μL浓度为0.5mM的MPIBA的乙腈溶液进行培养,成像,第四组不加SO2donor,只加10μL浓度为0.5mM的MPIBA的乙腈溶液作为对照;图12A即为内源性检测HSO3-相关细胞图。
置入共聚焦下观测成像,收集不同颜色光通道的荧光强度,从而进行荧光强度比值,根据细胞内源性HSO3-和ClO-的浓度与荧光强度比值的线性方程,从而得到细胞内源性HSO3-和ClO-的浓度。
图13A为内源性HSO3-的细胞图,图中从左到右为红色通道,蓝色通道,明场,重叠,比率,图13B为内源性ClO-的细胞图,图中从左到右为绿色通道,红色通道,明场,重叠,比率。
实施例6
细胞存活率实验:
细胞存活率的实验主要验证MPIBA毒性对细胞寿命的影响。细胞培养液中加入不同浓度的MPIBA探针(0M,5M,10M,20M,30M and 50M),在37℃,5%CO2的培养箱中培养24h,接着25μL的4-甲基噻唑基四唑MTT(5mg mL-1)加入到细胞培养液中培养4个小时。结果通过MTT比色皿法来评估细胞存活率。以不加MPIBA的那组细胞存活为100%,不同浓度MPIBA加入的实验组相关数据,绘制相对柱状图14。
本发明实施例中高效液相-质谱分析是利用Agilent 1100质谱系统(Agilent,USA),并配备脱气装置、四元泵、自动进样器,高效液相色谱分离是借助Hypersil GOLD C18柱(2.1mm×50mm,1.8μm i.d.,Agilent,USA)来完成。荧光检测是利用日立Hitachi F-4600荧光光谱仪来进行,对ClO-检测激发波长为420nm,对HSO3-的检测激发分别为330和440nm,激发和发射狭缝宽度均为10.0nm,电压400V,扫描速度2400纳米/分。荧光成像观测是通过Olympus Fluo View FV1000(日本)共聚焦来进行,用40倍物镜观察。化合物的分离纯化是采用薄层色谱硅胶柱实现,其中,填料为300-400目。
- 还没有人留言评论。精彩留言会获得点赞!