一种快速检测室尘中粉尘螨变应原第1组分含量的荧光实时定量PCR的方法与流程
技术领域
本发明涉及过敏原检测技术领域,具体涉及一种快速检测室尘中粉尘螨变应原第1组分含量的荧光实时定量PCR的方法。
背景技术:
目前,我国室内环境尘螨过敏原含量检测普及度不高,临床上主要是对就诊患者通过皮试等体内方法或检测患者血清中特异性IgE抗体等体外方法对其进行诊断,或是利用红外线扫描检测系统对患者进行与病史相关的过敏原检测。但这些手段都只能起到诊断作用,并不能起到一个预防作用。上个世纪80年代以来,国内外学者先后建立了放射性过敏原吸附试验 (Radioallergosorbent Test,RAST)抑制试验、放射免疫测定(Radioimmunoassay,RIA)、ELISA双抗体夹心法用于定量测定室尘中的尘螨过敏原含量。RAST抑制试验测定空气中尘螨过敏原的含量,但RAST抑制试验是对尘螨过敏原总活性的检测,不能分别检测尘螨中各种过敏原组分的浓度,并且它的费用较昂贵和存在环境污染。放射免疫测定(RIA)法测定粉尘螨(Dermatophagoides farina, Der f)和屋尘螨(Dermatophagoides pteronyssinus, Der p)I组过敏原的共有 抗原(抗原P1),实现了对尘螨进行分型,克服了RAST法不能检测尘螨的不同组别的过敏原含量的缺陷,但由于它也同样存在放射性同位素有半衰期及污染环境等缺点。ELISA的双抗体夹心法应用广泛,但其费用昂贵,检测速度慢,多用于科学研究,并不适用于流行病学调查中大量普及检测室尘中的尘螨过敏原含量。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种快速检测室尘中粉尘螨变应原第1组分含量的荧光实时定量PCR的方法,该方法检测速度快、价格低、环保无污染。
为解决现有技术问题,本发明的采取的技术方案为:
一种快速检测室尘中粉尘螨变应原第1组分含量的荧光实时定量PCR的方法,利用Der f 1(粉尘螨变应原第1组分)重组质粒作为标准品,设计Der f 1的实时荧光定量PCR引物、TaqMan探针,采用实时荧光TaqMan探针定量PCR方法,通过构建了Der f 1实时荧光定量PCR标准曲线,实现对室内灰尘中尘螨过敏原Der f 1含量的快速定量检测。
作为优选的是,实时荧光TaqMan探针定量PCR方法的参数为: 95℃预变性1min; 95℃ 变性15s; 60 ℃退火和延伸1min,循环数40。
作为优选的是,Der f 1实时荧光定量PCR标准曲线的相关系数R2=0.98,扩增效率E=1.216, 标准曲线斜率为-2.893,截距为32.677,标准曲线方程为 y=-2.893x+32.677。
有益效果
本发明方法适用方便,快捷,定量监测环境中尘螨过敏原含量,结果准确,可引导人群主动回避过敏原,从而预防尘螨过敏性疾病的发生有极强的实用价值。本发明方法的提出,为实现具有我国自主知识产权的尘螨过敏原定量检测产品标准化、商品化提供了科学依据。
附图说明
图1为Der f 1的实时荧光定量PCR标准曲线。
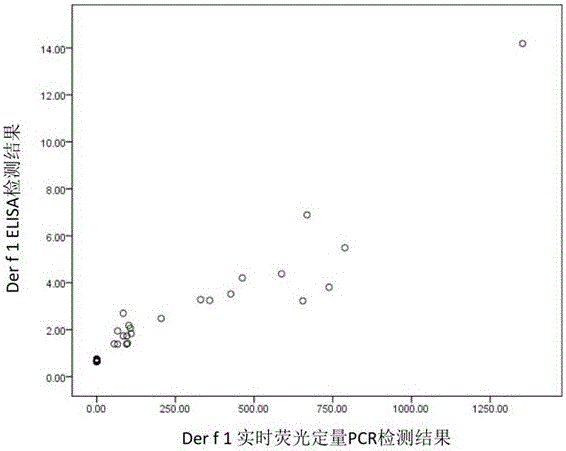
图2为本发明方法和ELISA测定Der f 1的结果对比图。
具体实施步骤
实施例1 Der f 1质粒标准品制备
根据GenBank AB034946公布的粉尘螨变应原第1组分Der f 1核酸序列设计引物,并在加入BamH I/Xho I酶切位点,合成引物上游引物F:5′-GGATCCATGAAATTCGTTTTGGCCATTG-3′(SEQ ID NO:1),下游引物R0:5′-TC GCAAGAGTAGTTGTTTTTAT-3′(SEQ ID NO:2),下游引物R:5′-CTCGAGTCACATGATT ACAACATATGGATATT-3′(SEQ ID NO:3)。解剖镜下挑取粉尘螨约600只,匀浆后用RNAiso Reagent试剂盒提取Total RNA;以Total RNA为模板,用RT-PCR合成cDNA;回收上述PCR产物,加“A”尾、DNA精制后,将目的基因片段与pMD19-T 载体连接后,用 BamH I和Xho I双酶切鉴定pMD19-T-Der f 1重组子,序列测定验证获得的目的基因。用TaKaRa DNA Ligation Kit将目的基因片段和pET28a(+)连接后,转入工程菌 BL21 (DE3),添加IPTG诱导表达,SDS-PAGE和Western blotting鉴定重组蛋白后,采用亲和柱层析法纯化获得重组蛋白。随后进行Der f 1编码基因合成及PCR扩增,取5 ml PCR产物上样电泳,观察目的条带。回收上述PCR产物,加“A”尾、DNA精制后,将目的基因片段与pMD19-T simple连接后,取连接产物转化感受态E.coliJM109,涂布于含氨苄青霉素(100 mg/ml)的LB平板上,37℃培养过夜。从含氨苄青霉素的LB平板上随机挑取16个白色菌落,利用载体上的引物进行PCR扩增后行琼脂糖凝胶电泳,含有目的条带的菌落为阳性克隆菌。取阳性克隆菌置于含氨苄青霉素的TB培养液中,37℃振摇培养过夜。取重组阳性克隆,提取质粒DNA,用 BamH I和XhoI双酶切鉴定pMD19T-Der f 1重组子。用1.0%琼脂糖凝胶电泳检测酶切片段的大小。以重组质粒DNA为模板,序列测定,将测序正确并可以正确表达的重组质粒稀释作为质粒标准品备用。
实施例2 Der f 1的实时荧光定量PCR引物、TaqMan探针设计:
使用Primer Express 2.0 软件和遵循TaqMan探针设计原则,根据GenBank(AB034946)序列设计Der f 1荧光定量PCR引物及 TaqMan 探针。见表1。
表 1 Der f 1引物及探针序列。
实施例3 Der f 1的实时荧光定量PCR标准曲线
将测序鉴定为Der f 1重组阳性质粒的质粒样品在DNA/RNA定量仪上测定样品质粒浓度,根据文献报道的计算公式计算质粒拷贝数。将Der f 1重组阳性质粒做10倍递增稀释,分别以5.0×108-5.0×101 copies/μL8个梯度为模板,在实时荧光定量PCR仪上按照反应体系和反应参数进行反应,绘制标准曲线,并记录标准曲线的决定系数R2、扩增效率E、斜率K,进而建立回归方程。质粒拷贝数(copies/μL)=(重组质粒浓度ng/μL×10-9) ×6.02×1023/(660×重组质粒碱基数)。
实时荧光定量PCR检测程序: 按照一定的顺序,往0.1ml PCR管,依次加入如下组份:10μL 2X Realtime PCR Master Mix 、1μL稀释Der f 1质粒标准品、2μL引物探针MIX( F/ R/ P各10μM)、7μL 0.1% DEPC水,总体系20μL。采用如下程序实施实时荧光定量PCR程序, 95℃预变性1min; 95℃ 变性15s; 60 ℃退火和延伸1min,循环数40。
应用荧光定量PCR仪根据已知拷贝的模板绘制的标准曲线,如图1所示,获得相关系数R2=0.98,扩增效率E=1.216, 标准曲线斜率(Slope)为-2.893,截距为32.677。Der f 1实时荧光定量PCR标准曲线方程为 y=-2.893x+32.677。
实施例4 Der f 1的实时荧光定量PCR重复性及可靠性
Der f 1质粒标准品做10倍倍比稀释, 每个样品重复3个批次(组间重复),每个批次重复3个复孔(组内重复),Der f 2重组质粒浓度为5.0×108copies/μL及无菌水分别进行3次重复检测,分别获得各自的ct值的平均数和变异系数,对标准曲线的重复性和可靠性进行评价。Der f 1标准曲线的重复性试验结果见表2,同一模板不同稀释度组内重复测定时其CV值在0.92%-1.76%之间,组间重复测定时其CV值在0.73%-1.88%之间,均低于2%,表明Der f 1的实时荧光定量PCR重复性好。以Der f 2的阳性质粒和无菌水做为对照,均未扩增出曲线,表明方法结果可靠性高。
表 2 Der f 1实时荧光定量PCR重复性及可靠性试验结果。
实施例5 室尘样品中Der f 1的实时荧光定量PCR与ELISA相关性结果
室尘提取液中 Der f 1的浓度用双抗体夹心ELISA法测定,具体操作步骤按试剂盒说明书进行(Der f 1 ELISA kit (6A8/4C1, EL-DF1, Indoor公司)。对采集室尘样品应用Der f 1的实时荧光定量PCR与ELISA试剂盒分别检测,图2显示,两种方法检测结果相关系数R=0.94, P<0.05,可见两种方法线性关系良好。
从上述结果可以看出,本发明方法检测效果好,结果准确,具有良好的市场前景。
SEQUENCE LISTING
<110> 盐城卫生职业技术学院
<120> 一种快速检测室尘中粉尘螨变应原第1组分含量的荧光实时定量PCR的方法
<130>
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 28
<212> DNA
<213> 人工序列
<400> 1
ggatccatga aattcgtttt ggccattg 28
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
tcgcaagagt agttgttttt at 22
<210> 3
<211> 32
<212> DNA
<213> 人工序列
<400> 3
ctcgagtcac atgattacaa catatggata tt 32
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
tcaattcggt taacgttcca 20
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
cttgcatacg gattggagtg 20
<210> 6
<211> 25
<212> DNA
<213> 人工序列
<400> 6
cgcagtgatc gtaaatccaa ttccg 25
- 还没有人留言评论。精彩留言会获得点赞!