一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的建立方法及其应用与流程
本发明属于生物技术领域,涉及大肠杆菌O157:H7,具体涉及一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的建立方法及其应用。
背景技术:
大肠杆菌O157:H7是一种重要的人兽共患传染病病原菌,该菌主要定居于一些反刍动物的肠道内,通过污染的水源及食物引起人与动物的感染。大肠杆菌O157:H7感染动物和人类后主要引起出血性肠炎、血栓性血小板减少性紫癜和肾溶血性尿毒综合症(HUS),以及其它一些器官系统的损伤甚至导致死亡,病死率为10%,引发HUS后病死率高达30%。由于大肠杆菌O157:H7传播途径广、易于培养、感染性强,其致病因子-致死性志贺毒素还有可能被用于基因武器的构建,因此许多国家把它列为法定报告传染病,美国疾病预防控制中心已将其列为B类生物恐怖病原体严加防范,我国已将大肠杆菌列为21世纪对国人卫生健康有重大影响的12种病原微生物之一。由于抗生素能够造成大肠杆菌O157:H7菌体破坏,导致志贺毒素(Stx)释放,从而促进HUS的发生和症状的加重,临床上对该病的治疗禁止用抗生素,目前对于该菌的感染尚缺乏有效的防治手段。而且迄今有关大肠杆菌O157:H7感染引起的免疫致病机制还不甚了解,难以做到有效控制大肠杆菌O157:H7感染。
大肠杆菌O157:H7的致病性与细菌粘附、毒素等有关。粘附因子粘附靶细胞是大肠杆菌O157:H7致病的关键步骤,病菌侵入宿主肠腔,依靠质粒介导的粘附因子粘附于盲肠和结肠的上皮细胞,并在其他致病因子的协同作用下产生粘附和擦拭性损伤(attaching and effacinglesions,A/E损伤)。细菌定殖到肠上皮细胞表面后造成A/E损伤,并产生志贺毒素,对宿主细胞造成强致病性。
技术实现要素:
本发明为解决大肠杆菌O157:H7(保藏号:ATCC 43895)在体外没有生物黏附模型(肠道黏附和擦拭性损伤模型),供研究大肠杆菌O157:H7与宿主肠道细胞之间的相互作用的技术难题,公开了一种大肠杆菌O157:H7感染猪小肠上皮细胞(IPEC-J2)模型的建立方法及其应用。
为解决上述技术难题,本发明采用以下技术方案:
一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的建立方法,步骤如下:
(1)大肠杆菌O157:H7的活化及培养;
(2)大肠杆菌O157:H7感染猪小肠上皮细胞。
所述步骤(1)的具体操作为:
a.取-70℃保存的大肠杆菌O157:H7标准菌株50μL于5mL的液体LB中,置于37℃水浴恒温振荡器中200~300r/min培养12~14h得到活化的大肠杆菌O157:H7;
b.将活化的大肠杆菌O157:H7在琼脂平板上划线,于37℃温箱中倒置培养12~16h,然后于无菌条件下挑取单个菌落于5mL LB培养基中,37℃水浴振荡培养12~14h;
c.于无菌条件下挑取步骤b中,LB培养基上的单个菌落于5mL液体LB试管中,在37℃恒温培养箱中培养12~14h,获得大肠杆菌O157:H7种子菌液。
所述步骤(2)的具体操作为:
a.将预先高压灭菌处理过的盖玻片放入细胞培养皿中,再将猪小肠上皮细胞以2×105U/孔接种于细胞培养皿内,置37℃5%CO2的培养箱中培养过夜;
b.用无菌D-HanK′s液洗涤细胞三次后加入1mL含10%胎牛血清的1640培养液,第1孔留作空白对照,第2孔加入备用的大肠杆菌O157:H7菌液15μL,置37℃、5%CO2的培养箱中孵育3h,所述大肠杆菌O157:H7菌液的浓度为2×10 9cfu/mL;
c.孵育后,用无菌的D-HanK′s液洗涤细胞三次,洗掉未粘附的细菌,随即在细胞培养皿内加入500μL 70%甲醇固定15min,取出玻片,无水甲醇处理3s,分别用革兰氏染色法和吉姆萨染色法染色,待玻片充分干燥,用二甲苯和树脂进行封片处理,完成大肠杆菌O157:H7感染猪小肠上皮细胞模型的建立。
一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的应用,所述大肠杆菌O157:H7感染猪小肠上皮细胞模型,作为检测大肠杆菌O157:H7感染猪小肠上皮细胞黏附指数的应用。
所述应用步骤如下:
a.猪小肠上皮细胞以2×105个/孔接种于细胞培养皿内,置于37℃5%CO2恒温培养箱中培养过夜;
b.用无菌D-HanK′s洗涤3次,空白细胞做对照,其他培养皿中分别加入备用的大肠杆菌O157:H7菌液15μL,置于37℃5%CO2恒温培养箱中培养,孵育1h后,用无菌D-HanK′s液洗3次,去除未粘附的细菌;
c.向经步骤b处理过的培养皿中,加入500μL 0.25%Triton X-100裂解细胞15min,释放出粘附在细胞表面的活细菌,8000r/min离心5min沉淀细菌,然后用D-HanK′s洗2次得到黏附的活细菌菌液;
d.将活细菌菌液以10倍倍比稀释至10-4,每个稀释度取100μL涂布在固体LB培养板中,每个稀释度涂布三个平板;
e.将LB培养板置于37℃恒温培养箱中培养12h,同时以固体培养基LB平板作为空白对照,选取菌落在30~300之间的平板进行计数,然后求其平均值,其黏附率=黏附于细胞的细菌总数/细菌总数,黏附指数=黏附细菌总数/细胞数。
一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的应用,所述大肠杆菌O157:H7感染猪小肠上皮细胞模型,作为检测被大肠杆菌O157:H7感染后的猪小肠上皮细胞凋亡的应用。
所述检测猪小肠上皮细胞凋亡的应用,采用的检测方法为:Hoechst33258染色法或Annexin V-FITC/PI双标记流式细胞术。
本发明的有益效果在于:
1.本发明公开了建立大肠杆菌O157:H7感染猪小肠上皮细胞模型的方法,首次证实了大肠杆菌O157:H7可以体外粘附猪肠道上皮细胞IPEC-J2,为研究大肠杆菌O157:H7感染引起的肠道A/E损伤过程及其机制奠定了基础。
2.应用大肠杆菌O157:H7感染猪小肠上皮细胞模型,研究大肠杆菌O157:H7体外粘附IPEC-J2细胞的能力,以及诱导IPEC-J2凋亡的能力,为研究大肠杆菌O157:H7与宿主细胞的相互作用关系奠定了基础,也为大肠杆菌O157:H7感染所致疾病的预防和治疗提供新的思路和手段。
附图说明
图1为大肠杆菌O157:H7的生长曲线。
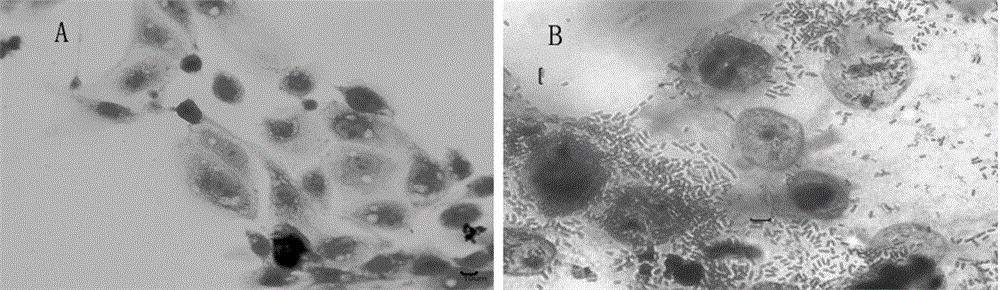
图2为革兰氏染色法检测大肠杆菌O157:H7黏附IPEC-J2细胞显微图;其中A为正常IPEC细胞,B为标准株和IPEC细胞。
图3为吉姆萨染色法检测大肠杆菌O157:H7黏附IPEC-J2细胞显微图;其中A为正常IPEC细胞,B为标准株和IPEC细胞。
图4为Hoechst33258染色结果图;其中A:正常细胞;B:大肠杆菌O157感染引起IPEC细胞凋亡。
图5为Annexin V-FITC/PI法检测大肠杆菌O157:H7诱导IPEC-J2细胞凋亡图,其中A:IPEC-J2空白细胞;B-E:分别是大肠杆菌O157:H7感染IPEC-J2细胞后30min、1h、2h、3h引起的细胞凋亡情况;图中B1:Annexin V-FITC-/PI+损伤区域,B2:Annexin V-FITC+/PI+损伤区域,B3:Annexin V-FITC-/PI-区域,B4:Annexin V-FITC+/PI-区域。
具体实施方式
一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的建立方法,步骤如下:
(1)大肠杆菌O157:H7的活化及培养;
(2)大肠杆菌O157:H7感染猪小肠上皮细胞。
所述步骤(1)的具体操作为:
a.取-70℃保存的大肠杆菌O157:H7标准菌株50μL于5mL的液体LB中,置于37℃水浴恒温振荡器中200~300r/min培养12~14h得到活化的大肠杆菌O157:H7;
b.将活化的大肠杆菌O157:H7在琼脂平板上划线,于37℃温箱中倒置培养12~16h,然后于无菌条件下挑取单个菌落于5mL LB培养基中,37℃水浴振荡培养12~14h;
c.于无菌条件下挑取步骤b中,LB培养基上的单个菌落于5mL液体LB试管中,在37℃恒温培养箱中培养12~14h,获得大肠杆菌O157:H7种子菌液。
所述步骤(2)的具体操作为:
a.将预先高压灭菌处理过的盖玻片放入细胞培养皿中,再将猪小肠上皮细胞以2×105U/孔接种于细胞培养皿内,置37℃5%CO2的培养箱中培养过夜;
b.用无菌D-HanK′s液洗涤细胞三次后加入1mL含10%胎牛血清的1640培养液,第1孔留作空白对照,第2孔加入备用的大肠杆菌O157:H7菌液15μL,置37℃、5%CO2的培养箱中孵育3h,所述大肠杆菌O157:H7菌液的浓度为2×10 9cfu/mL;
c.孵育后,用无菌的D-HanK′s液洗涤细胞三次,洗掉未粘附的细菌,随即在细胞培养皿内加入500μL 70%甲醇固定15min,取出玻片,无水甲醇处理3s,分别用革兰氏染色法和吉姆萨染色法染色,待玻片充分干燥,用二甲苯和树脂进行封片处理,完成大肠杆菌O157:H7感染猪小肠上皮细胞模型的建立。
一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的应用,所述大肠杆菌O157:H7感染猪小肠上皮细胞模型,作为检测大肠杆菌O157:H7感染猪小肠上皮细胞黏附指数的应用。
所述应用步骤如下:
a.猪小肠上皮细胞以2×105个/孔接种于细胞培养皿内,置于37℃5%CO2恒温培养箱中培养过夜;
b.用无菌D-HanK′s洗涤3次,空白细胞做对照,其他培养皿中分别加入备用的大肠杆菌O157:H7菌液15μL,置于37℃5%CO2恒温培养箱中培养,孵育1h后,用无菌D-HanK′s液洗3次,去除未粘附的细菌;
c.向经步骤b处理过的培养皿中,加入500μL 0.25%Triton X-100裂解细胞15min,释放出粘附在细胞表面的活细菌,8000r/min离心5min沉淀细菌,然后用D-HanK′s洗2次得到黏附的活细菌菌液;
d.将活细菌菌液以10倍倍比稀释至10-4,每个稀释度取100μL涂布在固体LB培养板中,每个稀释度涂布三个平板;
e.将LB培养板置于37℃恒温培养箱中培养12h,同时以固体培养基LB平板作为空白对照,选取菌落在30~300之间的平板进行计数,然后求其平均值,其黏附率=黏附于细胞的细菌总数/细菌总数,黏附指数=黏附细菌总数/细胞数。
一种大肠杆菌O157:H7感染猪小肠上皮细胞模型的应用,所述大肠杆菌O157:H7感染猪小肠上皮细胞模型,作为检测被大肠杆菌O157:H7感染后的猪小肠上皮细胞凋亡的应用。
所述检测猪小肠上皮细胞凋亡的应用,采用的检测方法为:Hoechst33258染色法或AnnexinV-FITC/PI双标记流式细胞术。
下面结合具体实施例,对本发明进行进一步的解释说明:
1材料
1.1菌种与细胞
大肠杆菌O157∶H7标准菌株(ATCC 43895)和猪肠道上皮细胞(IPEC-J2)为本实验室保存。
1.2主要试剂
细胞培养所用试1640、血清、胰蛋白酶等均购Hyclone公司;胰蛋白胨和酵母提取物购自英国OXOID有限公司;革兰氏染色液和吉姆萨染色液为Sigma公司产品;细胞培养六孔板为Corning公司产品;20mm×20mm盖玻片购自BOSTER公司;其它分析纯试剂均由本实验室提供。
1.3主要仪器
倒置显微镜(Leica Microsystems Wetzlar GmbH);CO2恒温培养箱(Thermo);754紫外可见分光光度计(上海菁华科技仪器有限公司);常用恒温培养箱(宁波机电工业设计院);超净工作台(苏净集团安泰公司);台式离心机(SIGMA);流式细胞仪(美国BD公司)、荧光显微镜(日本尼康公司)、CFX96Real-Time PCR仪(BioRad公司)等。
2方法
2.1大肠杆菌O157:H7的活化及培养
取-70℃保存的大肠杆菌O157:H7标准菌株50μL于5mL的液体LB中,置于37℃水浴恒温振荡器中200~300r/min培养12~14h。
将活化后的大肠杆菌O157:H7在麦康凯琼脂平板上划线,于37℃温箱中倒置培养12-16h。然后于无菌条件下挑取单个菌落于5mL LB培养基中,37℃水浴振荡培养12-14h。
然后于无菌条件下挑取单个菌落于5mL液体LB试管中,在37℃隔热式恒温培养箱中培养12-14h,获得大肠杆菌O157:H7种子菌液。
2.2大肠杆菌O157:H7生长曲线的测定与绘制
将大肠杆菌O157:H7种子菌液按1%的接种量接种到灭菌的、37℃预热过的150mL LB培养基中,摇匀后分装入42个大试管,每管5mL,37℃水浴恒温振荡器300r/min进行培养,每隔1h取出3管菌(作为3次平行),10倍倍比稀释后,用平板菌落计数法计数,记录每个时间点的三次平均值作为最终结果,并绘制生长曲线。以上述各个测定点的时间为横坐标,测量的细菌数对数为纵坐标,绘制大肠杆菌O157的生长曲线。
2.3细菌黏附发明
将预先高压灭菌过的20mm×20mm的盖玻片放入细胞培养皿中,再将IPEC-J2细胞以2×105/孔接种于细胞培养皿内,置37℃5%CO2的培养箱中培养过夜。用无菌的D-HanK′s液洗涤细胞三次后加入1mL含10%胎牛血清的1640培养液(无双抗),第1孔留作空白对照,第2孔加入备用的大肠杆菌O157:H7菌液15μL(2×10 9cfu/mL),置37℃、5%CO2的培养箱中孵育3h。孵育后,用无菌的D-HanK′s液洗涤细胞三次,洗掉未粘附的细菌。随即在细胞培养皿内加入500μL 70%甲醇固定15min,取出玻片,无水甲醇处理3s,分别用革兰氏染色法和吉姆萨染色法染色,待玻片充分干燥,用二甲苯和树脂进行封片处理。待盖玻片固定后,在MOTIC成像显微镜观察。
2.4黏附指数及粘附率计算
IPEC-J2细胞以2×105个/孔接种于细胞培养皿内,置37℃5%CO2的培养箱中培养过夜。用无菌D-HanK′s洗涤3次,空白细胞做对照,其他培养皿中分别加入备用的3株大肠杆菌O157∶H7菌液15μL,置于37℃5%CO2培养箱中培养,孵育1h后,用无菌D-HanK′s液洗3次,去除未粘附的细菌后,加入500μL 0.25%Triton X-100裂解细胞15min,释放出粘附在细胞表面的活细菌,8000r/min离心5min沉淀细菌,然后用D-HanK′s洗2次,倍比稀释至10-4,将其按不同的稀释度吸取100μL涂布在固体培养基LB中,每个稀释度涂布三个平板。在37℃隔热式电热恒温培养箱中培养12h,同时用一个固体培养基LB平板作为空白对照。选取菌落在30~300之间的平板进行计数,然后求其平均值,计算其黏附率=黏附于细胞的细菌总数/细菌总数,黏附指数=黏附细菌总数/细胞数。
2.5大肠杆菌O157:H7感染后诱导IPEC-J2细胞的凋亡检测
2.5.1Hoechst33258染色法检测IPEC-J2细胞的凋亡情况
在细胞培养皿中接种IPEC-J2细胞(细胞约2×105个/孔),培养至细胞密度大于90%,用无菌D-HanK′s洗涤3次,按1:100的量向细胞培养皿中加入大肠杆菌O157:H7,于37℃5%CO2培养箱中培养。分别取对照组的IPEC-J2细胞和大肠杆菌O157:H7细菌感染3h的IPEC-J2细胞,按照下面的步骤操做:
①弃上清,加入0.5mL的甲醇,固定10分钟;
②去固定液,D-HanK′s洗涤3次,吸尽液体。洗涤时手轻轻晃动数次;
③加入1mL Hoechst 33258染色液,避光染色5分钟。
④用D-HanK′s洗涤3次,每次3分钟。
⑤滴一滴抗荧光淬灭封片液于细胞培养皿内;
⑥在荧光显微镜下观察。
2.5.2Annexin V-FITC/PI双标记流式细胞术检测细胞凋亡情况
将IPEC-J2细胞接种到细胞培养皿中(2×105个/孔),培养至单层,用无菌D-HanK′s洗涤3次,按1:100的量向细胞培养皿中加入大肠杆菌O157:H7,置于37℃5%CO2培养箱中培养。分别于加菌后0、0.5、1、2和3h,用胰酶消化后,收集细胞,3 000r/min离心10min,用D-HanK′s洗涤3次。根据Annexin V-FITC/PI双染试剂盒说明书,加入500μL结合缓冲液重新悬浮细胞,然后各加入5μL的Annexin V-FITC和10μL的PI混匀,室温避光染色15min后,用流式细胞仪分析,Cellquest软件分析结果。
3结果
3.1大肠杆菌O157:H7生长曲线的绘制
以测量的细菌数对数为纵坐标,以时间为横坐标,绘制大肠杆菌O157的生长曲线(图1),从图1中可以看出,最初的2h大肠杆菌O157生长处于延滞期,2h后大肠杆菌O157生长进入对数生长期,5h后大肠杆菌O157生长进入稳定期。
3.2细菌黏附实验结果
大肠杆菌O157:H7与IPEC-J2细胞黏附3h后,通过改良的革兰氏染色法和吉姆萨染色法染色,在MOTIC成像显微镜下观察粘附情况:正常的IPEC-J2细胞间有空隙,可见胞内颗粒杂质,且轮廓清晰,细胞呈多角形或梭状;感染后的细胞周围有大量的阴性杆状细菌黏附(见图2和3)。
3.3大肠杆菌O157:H7对IPEC-J2细胞的黏附率及黏附指数
大肠杆菌O157:H7侵染IPEC-J2细胞后,加入500μL 0.25%Triton X-100裂解细胞15min,释放出粘附在细胞表面及细胞内的活细菌。10倍倍比稀释后吸取100μL均匀涂布于固体LB平板,选取菌落个数在30~300的稀释度进行菌落计数,求出细胞内外活菌总数,并计算出黏附率及黏附指数。结果如表1所示,大肠杆菌O157菌株表现出较强的黏附能力,对IPEC-J2细胞的黏附能力为30.4%,黏附指数为14.8。
表1大肠杆菌O157:H7的粘附率
3.4大肠杆菌O157:H7引起IPEC-J2细胞的凋亡情况
3.4.1 Hoechst33258染色结果
用Hoechst33258对细胞染色后,在荧光显微镜下观察到活细胞核呈弥散、均匀荧光,坏死的细胞不被Hoechst染色,而凋亡的细胞,其细胞核或细胞质内可见浓染致密的颗粒块状蓝色荧光及明显核形态变化,如果见到3个或3个以上的DNA荧光碎片被认为是凋亡细胞。用Hoechst33258对正常的IPEC-J2细胞和感染大肠杆菌O157:H7 3h后的IPEC-J2细胞进行染色,结果如图4所示。对照细胞的核呈弥散均匀荧光,而大肠杆菌O157:H7感染组的部分细胞核内可见浓染致密的颗粒块状荧光出现,说明细胞发生凋亡(图B箭头所示处)。
3.4.2 Annexin V-FITC/PI双染流式细胞仪结果
根据Annexin V-FITC/PI双染试剂盒说明书,在大肠杆菌O157:H7感染后不同时间(0、0.5、1、2和3h)收集IPEC-J2细胞进行染色,用流式细胞仪检测,得到相应时间点的细胞凋亡率,结果见图5(A-E)。图中B4区域表示细胞群的早期凋亡细胞,B2区域表示的为晚期凋亡及坏死细胞,B3区域代表的是正常细胞。晚期凋亡及坏死细胞均经过早期凋亡这一阶段,因此B2和B4的和表示总的凋亡率。由图可知IPEC-J2细胞在大肠杆菌O157:H7感染后半个小时就有细胞凋亡,并且之后的凋亡率逐渐增加。随着感染时间的延长,总的凋亡率也随之增加。
4.讨论
4.1大肠杆菌O157:H7生长曲线的测定
细菌的生长曲线反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。不同来源的细菌有其各自不同的生长规律,同一种细菌不同的表现型也会有不同的生长规律。因此通过测定大肠杆菌O157:H7的生长曲线,可了解大肠杆菌O157:H7的生长规律。本研究中大肠杆菌O157:H7生长曲线的测定结果表明,大肠杆菌O157:H7的迟缓期为2h左右,较早的进入对数生长期;5h后进入稳定期,该数据对下一步进行细胞粘附发明研究有一定指导意义。
4.2细胞粘附发明
深入研究病原菌与宿主细胞的相互作用机制是彻底解决传染病发生的根本所在。大肠杆菌O157:H7虽然是胞外菌,但是可以和肠上皮细胞紧密粘附,产生特征性的粘附和脱落(A/E)损伤。本发明以猪肠道上皮细胞IPEC-J2为体外模型,研究了大肠杆菌O157:H7对猪肠道上皮细胞IPEC-J2的粘附活性,结果表明大量的大肠杆菌O157粘附在IPEC-J2细胞上,且导致部分细胞收缩、连接松散、胞内空泡样变、胞浆突起减少或消失,甚至细胞核裂解。粘附能力强说明该菌侵袭细胞的能力强,细胞更容易受到损伤,对机体而言就是该菌更容易让机体致病而表现出相应的症状,在感染过程中也能观察到部分细胞死亡、细胞形态发生明显的变化。
据报道,大肠杆菌O157:H7可以粘附到Henle 407细胞(来自人小肠)、HEp-2细胞(人喉头癌细胞)、T84(结肠癌细胞)细胞、HCT8(人回肠盲肠)细胞、HEL(人胚胎肺)细胞和HeLa细胞,且其粘附常为局灶型或微菌落型。本发明首次证实了大肠杆菌O157:H7可以体外粘附猪肠道上皮细胞IPEC-J2,为下一步研究大肠杆菌O157:H7的粘附机理,特别是最初的粘附机理奠定一定的基础。
4.3大肠杆菌O157:H7诱导IPEC-J2细胞凋亡
凋亡是指在许多生理和病理条件下,细胞在形态学和生物化学方面发生的程序性死亡。它主要以细胞DNA发生特异性的降解,表现出核固缩、胞膜发泡和凋亡小体的形成为特征。研究报道,许多细菌都能引起细胞凋亡。现已证实,金黄色葡萄球菌、铜绿假单胞菌、沙门氏菌、幽门螺杆菌等均可以诱导宿主细胞发生或加重凋亡。机体受到细菌感染后,一方面致病菌诱导宿主细胞凋亡,有助于细菌的入侵、毒素的释放或杀死巨噬细胞和淋巴细胞;另一方面,宿主细胞发生凋亡也是一种防御反应,可以消灭或限制致病菌的生长。
本发明以Hoechst 33258染色观察细胞形态学改变和Annexin-V FITC/PI双染流式细胞仪分析两种方法,研究大肠杆菌O157:H7对IPEC-J2细胞凋亡的诱导作用。结果表明,大肠杆菌O157:H7可以诱导IPEC-J2细胞发生凋亡,且凋亡细胞形态改变都很明显。Hoechst33258染色与Annexin-V FITC/PI双染这两种方法所得结果一致。大肠杆菌O157:H7感染IPEC-J2细胞后30min就有细胞凋亡,随着大肠杆菌O157:H7刺激时间的延长,凋亡细胞率随着增高。研究发现,大肠杆菌O157:H7的主要致病因子类志贺毒素(STX)的B亚基能够诱导表达Gb3受体的细胞发生凋亡,因此对细胞凋亡与大肠杆菌O157:H7感染关系的进一步研究,将为大肠杆菌O157:H7感染所致疾病的预防和治疗提供新的思路和手段。
- 还没有人留言评论。精彩留言会获得点赞!