大肠癌原代细胞培养试剂盒及其应用方法与流程
本发明涉及医用试剂盒技术领域,特别是涉及一种大肠癌原代细胞培养试剂盒及其应用方法。
背景技术:
大肠癌是严重威胁人类健康的恶性肿瘤,也是我国发病率上升最快的消化道恶性肿瘤,其发病率和死亡率均排在癌症谱的前三位。原代细胞培养技术是建立大肠癌体外研究模型,进而研究大肠癌的有效手段,同时也是分离纯化大肠癌细胞株的必要步骤,因而对于大肠癌的研究具有极为重要的意义。
但是,总体看来,对大肠癌直接进行原代细胞培养的成功率较低,仅为9%-30%。
现有技术中,影响大肠癌原代细胞培养成功率的因素主要包括:
首先,肠道中细菌丰富,大肠癌标本极易污染,需要多种抗生素及消毒剂反复处理,灭菌过程非常繁琐,且效果难以保证。
其次,对于大肠癌标本的处理缺乏简捷、标准的流程,组织细胞的分离与消化过程缺乏有效的方法,导致培养成功率低下。
第三,原代培养基的成分直接决定了成功率的高低,原代细胞培养基需要添加多种激素、细胞因子和其它营养物质,以保证肿瘤细胞的生长增殖。传统的方法要么成分不足,细胞生长缓慢;要么配方复杂,配置过程繁琐。
技术实现要素:
有鉴于此,本发明提供了一种大肠癌原代细胞培养试剂盒及其应用方法,其能够提高大肠癌原代细胞培养的成功率,从而更加适于实用。
为了达到上述第一个目的,本发明提供的大肠癌原代细胞培养试剂盒的技术方案如下:
本发明提供的大肠癌原代细胞培养试剂盒包括第一试剂、第二试剂、第三试剂、第四试剂和第五试剂,
所述第一试剂中的有效成分包括络合碘,其有效碘的质量浓度为5000mg/L;
所述第二试剂中的有效成分及物质的量浓度包括:EDTA,0.5mmol/L;NaCl,137mmol/L;KCl,2.7mmol/L;Na2HPO4·12H2O,10mmol/L;K2HPO4,1.76mmol/L
所述第三试剂中的有效成分包括NaClO,其质量百分含量的取值范围为8%~12%;
所述第四试剂中的有效成分及质量浓度包括:胶原酶I,10mg/mL;胶原酶Ⅱ,10mg/mL;胶原酶IV,5mg/L;
所述第五试剂中的有效成分及含量包括:EGF,5μg;Y27632,1.6mg;氢化可的松,250μg;霍乱毒素,4.2μg;PBS溶液:5mL;
所述第一试剂、第二试剂、第三试剂、第四试剂、第五试剂分别单独封装,其中,所述第一试剂、第二试剂、第三试剂、第四试剂、第五试剂的体积份数比为200mL∶200mL∶20mL∶5mL∶5mL。
本发明提供的大肠癌原代细胞培养试剂盒还可采用以下技术措施进一步实现。
作为优选,所述第一试剂的保存条件包括常温、避光。
作为优选,所述第二试剂的保存条件包括常温。
作为优选,所述第三试剂的保存条件包括常温、避光。
作为优选,所述第四试剂的保存条件包括0℃~4℃温度下保存0.5个月~1.5个月。
作为优选,所述第五试剂的保存条件包括0℃~4℃温度下保存0.5个月~1.5个月。
作为优选,所述大肠癌原代细胞培养试剂盒还包括第一封装容器、第二封装容器、第三封装容器、第四封装容器、第五封装容器和卡盘,
所述第一封装容器用于封装所述第一试剂,所述第二封装容器用于封装所述第二试剂,所述第三封装容器用于封装所述第三试剂,所述第四封装容器用于封装所述第四试剂,所述第五封装容器用于封装所述第五试剂;
所述卡盘包括卡盘本体,所述卡盘本体上至少设有第一通孔、第二通孔、第三通孔、第四通孔和第五通孔;
所述第一封装容器能够穿设于所述第一通孔中,所述第二封装容器能够穿设于所述第二通孔中,所述第三封装容器能够穿设于所述第三通孔中,所述第四封装容器能够穿设于所述第四通孔中,所述第五封装容器能够穿设于所述第五通孔中。
作为优选,
所述第一封装容器与所述第一通孔间隙配合;和/或,
所述第二封装容器与所述第二通孔间隙配合;和/或,
所述第三封装容器与所述第三通孔间隙配合;和/或,
所述第四封装容器与所述第四通孔间隙配合;和/或,
所述第五封装容器与所述第五通孔间隙配合。
作为优选,所述第一封装容器和/或第二封装容器和/或第三封装容器和/或第四封装容器和/或第五封装容器的底面呈圆弧状过渡。
作为优选,所述大肠癌原代细胞培养试剂盒还包括包装盒,所述包装盒包括盒体,所述盒体的横截面形状与所述卡盘的形状相适配。
作为优选,所述包装盒还包括上盖,所述上盖能够覆盖住所述盒体。
作为优选,所述上盖与所述盒体为分体式结构。
作为优选,所述上盖与所述盒体之间铰接。
作为优选,所述盒体上设有一卡扣结构的子端,所述上盖上设有所述卡扣结构的母端,所述子端与所述母端相适配。
作为优选,所述卡盘的形状选自矩形或者圆形。
为了达到上述第二个目的,本发明提供的大肠癌原代细胞培养试剂盒的应用方法的技术方案如下:
本发明提供的大肠癌原代细胞培养试剂盒的应用方法包括以下步骤:
取200mg~500mg大肠癌肿瘤组织,于超净工作台中将所述大肠癌肿瘤组织置入第一离心管,得到第一产物;
于超净工作台中向所述第一产物中加入所述第一试剂,所述第一试剂的加入量的取值范围为10mL~25mL,并混匀,得到第二产物;
于超净工作台吸净所述第一离心管内的第一试剂后,将处于所述第一离心管内的大肠癌肿瘤组织置入第二离心管,得到第三产物;
向所述第三产物中加入所述第二试剂,所述第二试剂的加入量的取值范围为10mL~25mL,并混匀,得到第四产物;
于超净工作台上配置所述第三试剂的PBS稀释液,其中,在稀释时,所述第三试剂与PBS溶液的体积比的取值范围为1∶(6~12);
于超净工作台上取出所述第二离心管中的肿瘤组织置入到第三离心管中,并向所述第三离心管中加入10mL~25mL所述第三试剂的PBS稀释液,混匀后得到第五产物;
于超净工作台上取出所述第三离心管中的大肠癌肿瘤组织置入到第四离心管中,向所述第四离心管中加入10mL~25mL无菌PBS缓冲液,混匀后置于摇床40-60rpm转速下5-10分钟,并重复此步骤;
于超净工作台上吸净所述第四离心管内的PBS缓冲液后,将大肠癌肿瘤组织置入组织冻存管中,得到第六产物;
应用无菌剪刀将所述第六产物剪碎,得到第七产物;
向所述第七产物中加入200μL~500μL所述第四试剂后将其置于37℃孵箱,第一次孵育50-60分钟,使得所述第七产物消化后,得到第八产物;
向300mL~600mL含有8%~15%(wt)胎牛血清及抗生素的RPMI-1640培养基中加入所述第五试剂并混匀,得到孵育培养基;
于超净工作台上将所述第八产物移入培养皿后,向所述培养皿内加入所述孵育培养基,并于37℃条件下在孵箱中进行大肠癌原代细胞培养。
本发明提供的大肠癌原代细胞培养试剂盒的应用方法还可采用以下技术措施进一步实现。
作为优选,所述混匀的方法包括颠倒和/或应用摇床。
作为优选,于超净工作台上将所述第八产物移入培养皿后,还包括静置5min~10min的步骤。
作为优选,应用无菌剪刀将所述第六产物剪碎,得到第七产物过程中,所述第六产物被剪碎的标志是所述第六产物为糊状,且其中无肉眼可见的团块。
本发明提供的大肠癌原代细胞培养试剂盒在应用过程中,应用第一试剂进行了一次消毒,之后,所有的操作都是在无菌的环境下进行操作,相当于提供了一种二步灭菌法,其不仅简化了大肠癌标本的处理流程,还能够减少抗生素的使用,因此,能够基本上实现零污染;并且,该试剂盒在应用过程中应用的消化方法是向第七产物中加入200μL~500μL第四试剂后将其置于37℃孵箱,第一次孵育40-60分钟,使得第七产物消化,与单纯机械分离相比,能够减少大肠癌细胞在这一过程中的损失,并且能够减少操作过程中的污染,并提高消化效率。此外,该试剂盒将大肠癌原代细胞培养过程中应用到的第一试剂、第二试剂、第三试剂、第四试剂和第五试剂分别单独封装,在应用过程中,无需重复配制该各试剂,因此能够使得操作过程得到简化,从而提高大肠癌原代细胞的培养效率。
附图说明
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。而且在整个附图中,用相同的参考符号表示相同的部件。在附图中:
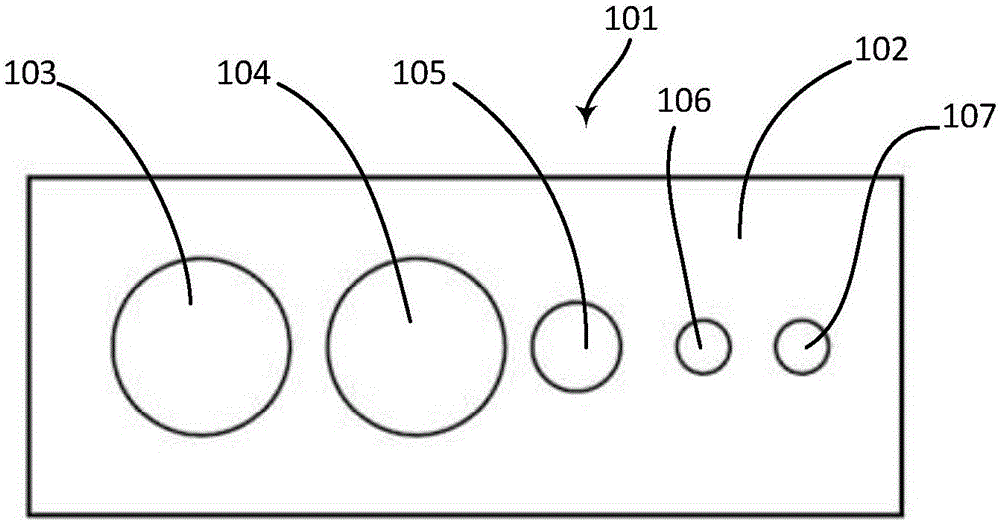
图1为本发明实施例一提供的大肠癌原代细胞培养试剂盒的盒体结构示意图(图中,各试剂未示出);
图2为本发明实施例一提供的大肠癌原代细胞培养试剂盒中应用的卡盘的结构示意图;
图3为本发明实施例二提供的大肠癌原代细胞培养试剂盒的盒体结构示意图(图中,各试剂未示出);
图4为本发明实施例二提供的大肠癌原代细胞培养试剂盒中应用的卡盘的结构示意图;
图5为本发明实施例一或者实施例二提供的大肠癌原代细胞培养试剂盒中应用的第一封装容器和/或第二封装容器和/或第三封装容器和/或第四封装容器和/或第五封装容器的结构示意图;
图6为本发明实施例三提供的大肠癌原代细胞培养试剂盒的应用方法步骤流程图。
具体实施方式
本发明为解决现有技术存在的问题,提供一种大肠癌原代细胞培养试剂盒及其应用方法,其能够提高大肠癌原代细胞培养的成功率,从而更加适于实用。
为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,对依据本发明提出的大肠癌原代细胞试剂盒及其应用方法,其具体实施方式、结构、特征及其功效,详细说明如后。在下述说明中,不同的“一实施例”或“实施例”指的不一定是同一实施例。此外,一或多个实施例中的特定特征、结构、或特点可由任何合适形式组合。
本文中术语“和/或”,仅仅是一种描述关联对象的关联关系,表示可以存在三种关系,例如,A和/或B,具体的理解为:可以同时包含有A与B,可以单独存在A,也可以单独存在B,能够具备上述三种任一种情况。
本发明提供的大肠癌原代细胞培养试剂盒包括第一试剂、第二试剂、第三试剂、第四试剂和第五试剂。
第一试剂中的有效成分包括络合碘,其有效碘的质量浓度为5000mg/L;
第二试剂中的有效成分及物质的量浓度包括:EDTA,0.5mmol/L;NaCl,137mmol/L;KCl,2.7mmol/L;Na2HPO4·12H2O,10mmol/L;K2HPO4,1.76mmol/L
第三试剂中的有效成分包括NaClO,其质量百分含量的取值范围为8%~12%;
第四试剂中的有效成分及质量浓度包括:胶原酶I,10mg/mL;胶原酶Ⅱ,10mg/mL;胶原酶IV,5mg/L;
第五试剂中的有效成分及含量包括:EGF,5μg;Y27632(厂家Abcam;货号:ab120129;批号:GR195774-32),1.6mg;氢化可的松,250μg;霍乱毒素,4.2μg;PBS溶液:5mL;
第一试剂、第二试剂、第三试剂、第四试剂、第五试剂分别单独封装,其中,第一试剂、第二试剂、第三试剂、第四试剂、第五试剂的体积份数比为200mL∶200mL∶20mL∶5mL∶5mL。
其中,第一试剂的保存条件包括常温、避光。
其中,第二试剂的保存条件包括常温。
其中,第三试剂的保存条件包括常温、避光。
其中,第四试剂的保存条件包括0℃~4℃温度下保存0.5个月~2个月。
其中,第五试剂的保存条件包括0℃~4℃温度下保存0.5个月~2个月。
本实施例中,大肠癌原代细胞培养试剂盒还包括第一封装容器(图中未示出)、第二封装容器(图中未示出)、第三封装容器(图中未示出)、第四封装容器(图中未示出)、第五封装容器(图中未示出)和卡盘(附图1和附图2中标号为101,附图3和附图4中标号为201)。第一封装容器(图中未示出)用于封装第一试剂,第二封装容器(图中未示出)用于封装第二试剂,第三封装容器(图中未示出)用于封装第三试剂,第四封装容器(图中未示出)用于封装第四试剂,第五封装容器(图中未示出)用于封装第五试剂。在附图1和附图2所示的实施例一中,卡盘101包括卡盘本体102,卡盘本体102上至少设有第一通孔103、第二通孔104、第三通孔105、第四通孔106和第五通孔107;第一封装容器(图中未示出)能够穿设于第一通孔103中,第二封装容器(图中未示出)能够穿设于第二通孔104中,第三封装容器(图中未示出)能够穿设于第三通孔105中,第四封装容器(图中未示出)能够穿设于第四通孔106中,第五封装容器(图中未示出)能够穿设于第五通孔107中。在附图3和附图4所示的实施例二中,卡盘201包括卡盘本体202,卡盘本体202上至少设有第一通孔203、第二通孔204、第三通孔205、第四通孔206和第五通孔207;第一封装容器(图中未示出)能够穿设于第一通孔203中,第二封装容器(图中未示出)能够穿设于第二通孔204中,第三封装容器(图中未示出)能够穿设于第三通孔205中,第四封装容器(图中未示出)能够穿设于第四通孔206中,第五封装容器(图中未示出)能够穿设于第五通孔207中。
其中,第一封装容器(图中未示出)与第一通孔(实施例一的103,实施例二的203)间隙配合;和/或,第二封装容器(图中未示出)与第二通孔(实施例一的104,实施例二的204)间隙配合;和/或,第三封装容器(图中未示出)与第三通孔(实施例一的105,实施例二的205)间隙配合;和/或,第四封装容器(图中未示出)与第四通孔(实施例一的106,实施例二的206)间隙配合;和/或,第五封装容器(图中未示出)与第五通孔(实施例一的107,实施例二的207)间隙配合。在这种情况下,由于各封装容器(图中未示出)在各通孔中的剩余活动空间较小,能够避免各封装容器(图中未示出)发生倾倒,避免各试剂的损失或者污染。
参见附图5,第一封装容器和/或第二封装容器和/或第三封装容器和/或第四封装容器和/或第五封装容器的底面呈圆弧状过渡,本实施例中,标号301概括表示各封装容器,标号302表示设置于各封装容器底面的圆弧状过渡,在这种情况下,能够避免由于封装容器底部的死角而导致的试剂中容质的沉积,进一步保证各封装容器内的各试剂均一稳定,降低操作误差。
其中,还包括包装盒(实施例一中的108,实施例二中的208),包装盒(实施例一中的108,实施例二中的208)包括盒体(实施例一中的111,实施例二中的211),盒体(实施例一中的111,实施例二中的211)的横截面形状与卡盘(实施例一中的101,实施例二中的201)的形状相适配,在这种情况下,能够保证卡盘(实施例一中的101,实施例二中的201)在盒体(实施例一中的109,实施例二中的209)内与侧壁(实施例一中的111,实施例二中的211)之间不发生倾斜,更进一步避免各封装容器(图中未示出)发生倾倒,避免各试剂的损失或者污染。
其中,包装盒(实施例一中的108,实施例二中的208)还包括上盖(实施例一中的112,实施例二中的212),上盖(实施例一中的112,实施例二中的212)能够覆盖住盒体(实施例一中的109,实施例二中的209),在这种情况下,能够避免本发明提供的大肠癌原代细胞培养试剂盒在运输或者携带过程中,各封装容器(图中未示出)丢失。
其中,参见附图3,在本发明实施例二提供的大肠癌原代细胞培养试剂盒208中,作为上盖212与盒体209之间的一种配合方式,上盖212与盒体209之间可以为分体式结构。在这种前提下,上盖212与盒体209之间还可以采用螺纹连接或者嵌合配合的方式实现配合。
其中,参见附图1,在本发明实施例一提供的大肠癌原代细胞培养试剂盒108中,作为上盖112与盒体109之间的又一种配合方式,上盖112与盒体109之间铰接。本实施例中,上盖112与盒体109通过其侧壁的其中一条边沿116实现铰接,上盖112可以以该边沿116为旋转中心旋转,实现上盖112的开启或者关闭,此时,该盒体的材质可以为纸、塑料等材质;有时,为了使得该铰接更加合理,还可以在该处设置合页等配件。
本实施例中,上盖112的一端还设有盖缘113,此时,当上盖110覆盖住盒体109时,该盖缘113能够附着在盒体109的侧壁111上,能够进一步地保证盒体109被上盖110全面覆盖,从而保证盒体109的封装效果。
其中,盒体(实施例一的109,实施例二的209)上设有一卡扣结构的子端(实施例一的114,实施例二的214),上盖(实施例一的110,实施例二的210)上设有卡扣结构的母端(实施例一的115,实施例二的215),子端(实施例一的114,实施例二的214)与母端(实施例一的115,实施例二的215)相适配。此时,能够避免上盖(实施例一的110,实施例二的210)从盒体(实施例一的109,实施例二的209)上丢失,进一步降低各封装容器(图中未示出)丢失的潜在风险。
其中,卡盘的形状选自矩形(实施例一)或者圆形(实施例二)。
参见附图6,本发明提供的大肠癌原代细胞培养试剂盒的应用方法包括以下步骤:
步骤S1:取200mg~500mg大肠癌肿瘤组织,于超净工作台中将大肠癌肿瘤组织置入第一离心管并混匀,得到第一产物;
步骤S2:向第一产物中加入第一试剂,第一试剂的加入量的取值范围为10mL~25mL,并混匀,得到第二产物,盖紧盖子,室温下置于摇床40rpm~60rpm,15min~20min;
步骤S3:于超净工作台吸净第一离心管内的第一试剂后,将处于第一离心管内的大肠癌肿瘤组织置入第二离心管,得到第三产物;
步骤S4:向第三产物中加入第二试剂,第二试剂的加入量的取值范围为10mL~25mL,并混匀,得到第四产物,盖紧盖子,室温下置于摇床40rpm~60rpm,8min~10min;
步骤S5:于超净工作台上配置第三试剂的PBS稀释液,其中,在稀释时,第三试剂与PBS溶液的体积比的取值范围为1∶(6~12);
步骤S6:于超净工作台上取出第二离心管中的肿瘤组织置入到第三离心管中,并向第三离心管中加入10mL~25mL第三试剂的PBS稀释液,混匀后得到第五产物,盖紧盖子,室温下置于摇床40rpm~60rpm,15min~20min;
步骤S7:于超净工作台上取出第三离心管中的大肠癌肿瘤组织置入到第四离心管中,向第四离心管中加入10mL~25mL无菌PBS缓冲液,混匀后取出,置入第五离心管,并重复此步骤,直至使得大肠癌肿瘤组织置入到第N离心管;
步骤S8:于超净工作台上吸净第N离心管内的PBS缓冲液后,将处于第N离心管内的大肠癌肿瘤组织置入组织冻存管中,得到第六产物;
步骤S9应用无菌剪刀将第六产物剪碎,得到第七产物;
步骤S10:向第七产物中加入200μL~500μL第四试剂后将其置于37℃孵箱,第一次孵育1h以上,使得第七产物消化后,得到第八产物;
步骤S11:向300mL~600mL含有8%~15%(wt)胎牛血清及抗生素的RPMI-1640培养基中加入第五试剂并混匀,得到孵育培养基;
步骤S12:于超净工作台上将第八产物移入培养皿后,向培养皿内加入孵育培养基,并于37℃条件下在孵箱中进行大肠癌原代细胞培养。
其中,混匀的方法包括颠倒和/或应用摇床。
其中,于超净工作台上将第八产物移入培养皿后,还包括静置5min~10min的步骤,从而保证消化后的肿瘤组织均匀地铺满培养皿底部,增强大肠癌原代细胞培养的稳定性。
其中,应用无菌剪刀将第六产物剪碎,得到第七产物过程中,第六产物被剪碎的标志是第六产物为糊状,且其中无肉眼可见的团块。
实施例3~22表1
实施例3~22续表1-2
实施例3~22续表1-3
本发明提供的大肠癌原代细胞培养试剂盒在应用过程中,应用第一试剂进行了一次消毒,之后,所有添加试剂和处理组织的操作都是在无菌的环境下进行,相当于提供了一种二步灭菌法,其不仅简化了大肠癌标本的处理流程,还能够减少抗生素的使用,因此,能够基本上实现零污染;并且,该试剂盒在应用过程中应用的消化方法是向第七产物中加入200μL~500μL第四试剂后将其置于37℃孵箱,第一次孵育1h以上,使得第七产物消化,与机械分离相比,能够减少大肠癌细胞在这一过程中的损失,并且能够减少操作过程中的污染,并提高消化效率。此外,该试剂盒将大肠癌原代细胞培养过程中应用到的第一试剂、第二试剂、第三试剂、第四试剂和第五试剂分别单独封装,在应用过程中,无需重复配制该各试剂,因此能够使得操作过程得到简化,从而提高大肠癌原代细胞的培养效率。此外,从本发明实施例3~22的实验结论,可知,应用本发明提供的大肠癌原代细胞培养试剂盒,能够使得培养成功率达到50%~60%。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!