胀果甘草低聚糖及其制备方法与流程
本发明涉及生物医药技术领域,是一种胀果甘草低聚糖及其制备方法。
背景技术:
甘草(Glycyrrhiza spp.)是传统中药,具有清热解毒、健脾补气、润肺止咳之功效,甘草多糖(Glycyrrhiza polysacchiade,GP)是其中除甘草酸、甘草黄酮之外的又一重要活性物质,甘草的许多生理活性,尤其是免疫调节活性、抗肿瘤活性都与其含有的多糖类成分密切相关。
胀果甘草(Glycyrrhiza inflata Bat.)是新疆具有区域特色的中药资源,产量居全国之首,是新疆商品甘草的主要来源,与乌拉尔甘草(G.uralensis Fisch.)、光果甘草(G.glabra L.)一同被各版中国药典收载,作为传统中药甘草的基源植物。本发明人前期已对胀果甘草多糖进行了较系统的化学结构和生物活性研究,分离纯化得到的组分中含量较高的为鼠李半乳糖醛酸聚糖GiP,具有RG-Ⅰ型果胶多糖的典型结构特征,平均分子量2.0×106Da,而且有较强的免疫促进活性,是胀果甘草中一类重要的免疫活性组分。
果胶多糖在食品工业中被广泛用作增稠剂、胶凝剂、乳化剂和稳定剂,近年来研究发现,果胶多糖也具有抗腹泻、免疫调节、抗肿瘤、降低血糖和胆固醇、治疗糖尿病和心血管硬化及延长抗菌素的作用,在医药工业上也有广泛的用途,通常被用来制造轻泻剂、止血剂、血浆代用品、金属解毒剂等。由果胶多糖降解产生的低聚糖,特别是半乳糖醛酸低聚糖,也是重要的生物信息分子,具有调节肠道菌群、促进双歧杆菌生长,激活植物的自我防卫系统,抗炎、抗肿瘤、免疫调节和促进钙质吸收等多种生物活性。
天然来源的低聚糖数量极其有限,因此需要借助降解多糖或者以合成的手段获得。糖分子的多羟基特性使得低聚糖分子结构复杂,加上合成中的区域选择性、立体选择性以及合成产率等问题,造成低聚糖合成的难度很大。因此,采用适宜的方法将多糖降解,成为获得低聚糖的重要途径。根据果胶多糖的化学结构特征,目前普遍采用化学方法(酸解法、氧化法等)或酶降解,得到不同分子质量或不同酯化度的低聚糖。酸法降解速度快(特别是在加热的条件下),降解比较完全,缺点是降解条件剧烈,产物分子量分布宽、均一性较差;氧化降解法工艺条件复杂,反应的稳定性和重复性较差。酶解法具有条件温和、特异性强,副反应少等优点,可实现多糖的定向和可控性降解,是目前最常采用、也最为理想的降解方法。
胀果甘草多糖分子量大,结构复杂,作为免疫调节剂应用存在着体内难以跨膜转运,生物利用度低的缺点;有关利用胀果甘草多糖来制备低聚糖,在国内外均未见有报道,也未检索到有相关的文献。
技术实现要素:
本发明提供了一种胀果甘草低聚糖及其制备方法,克服了上述现有技术之不足,其能有效解决有关利用胀果甘草多糖来制备低聚糖,在国内外均未见有报道的问题。
本发明的技术方案之一是通过以下措施来实现的:一种胀果甘草低聚糖,按下述方法得到:
第一步,果胶酸的制备,取胀果甘草多糖适量,溶于25倍至50倍胀果甘草多糖体积的1.0mol/L NaOH无水乙醇溶液,冰浴中反应4.5h至5h,反应后在温度为4℃下静置过夜,静置过夜后减压过滤,过滤后沉淀溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀再溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀用体积百分比为50%的乙醇水溶液洗涤2次至3次,洗涤后的沉淀冷冻干燥后,得到果胶酸;
第二步,果胶酸的酶法降解,取果胶酸适量,加入0.1mol/L pH为4.5的醋酸-醋酸钠缓冲溶液充分溶解后得到混合液,然后果胶酸和果胶酶按质量比为200:1,在混合液中加入果胶酶并混合均匀,在温度为35℃至40℃的水浴中反应0.5h至1h,反应后在温度为90℃至100℃的水浴中加热5min至10min使酶失活,然后冷却至室温,离心分离后得到上清液,上清液浓缩至上清液体积的1/2至1/4后,得到浓缩液,浓缩液经阳离子交换树脂脱盐,脱盐后用蒸馏水洗脱,洗脱至蒸馏水洗脱液无糖组分流出,收集蒸馏水洗脱液,然后将蒸馏水洗脱液浓缩至干,得到胀果甘草低聚糖。
下面是对上述发明技术方案之一的进一步优化或/和改进:
上述冰浴温度为0℃至4℃;或/和,静置过夜的时间为12h至24h。
上述调节pH的酸为盐酸;或/和,冷冻干燥的温度为-60℃至-40℃,冷冻干燥的时间为12h至24h。
上述醋酸-醋酸钠缓冲溶液的加入量为果胶酸质量的1%至1.5%;或/和,果胶酶的活力单位1000U至3000U。
上述离心分离的转速为4500r/min至5000r/min,离心时间为10min至15min;或/和,蒸馏水洗脱液的流速为4倍至5倍柱体积/h。
本发明的技术方案之二是通过以下措施来实现的:一种胀果甘草低聚糖的制备方法,按下述步骤进行:
第一步,果胶酸的制备,取胀果甘草多糖适量,溶于25倍至50倍胀果甘草多糖体积的1.0mol/L NaOH无水乙醇溶液,冰浴中反应4.5h至5h,反应后在温度为4℃下静置过夜,静置过夜后减压过滤,过滤后沉淀溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀再溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀用体积百分比为50%的乙醇水溶液洗涤2次至3次,洗涤后的沉淀冷冻干燥后,得到果胶酸;
第二步,果胶酸的酶法降解,取果胶酸适量,加入0.1mol/L pH为4.5的醋酸-醋酸钠缓冲溶液充分溶解后得到混合液,然后果胶酸和果胶酶按质量比为200:1,在混合液中加入果胶酶并混合均匀,在温度为35℃至40℃的水浴中反应0.5h至1h,反应后在温度为90℃至100℃的水浴中加热5min至10min使酶失活,然后冷却至室温,离心分离后得到上清液,上清液浓缩至上清液体积的1/2至1/4后,得到浓缩液,浓缩液经阳离子交换树脂脱盐,脱盐后用蒸馏水洗脱,洗脱至蒸馏水洗脱液无糖组分流出,收集蒸馏水洗脱液,然后将蒸馏水洗脱液浓缩至干,得到胀果甘草低聚糖。
下面是对上述发明技术方案之二的进一步优化或/和改进:
上述冰浴温度为0℃至4℃;或/和,静置过夜的时间为12h至24h。
上述调节pH的酸为盐酸;或/和,冷冻干燥的温度为-60℃至-40℃,冷冻干燥的时间为12h至24h。
上述醋酸-醋酸钠缓冲溶液的加入量为果胶酸质量的1%至1.5%;或/和,果胶酶的活力单位1000U至3000U。
上述离心分离的转速为4500r/min至5000r/min,离心时间为10min至15min;或/和,蒸馏水洗脱液的流速为4倍至5倍柱体积/h。
本发明首次公开了以胀果甘草多糖(GiP)经脱酯化得到果胶酸,以果胶酸为底物进行酶解后,得到本发明胀果甘草低聚糖,本发明胀果甘草低聚糖包含聚合度为1~5的聚半乳糖醛酸低聚糖,本发明胀果甘草低聚糖较原胀果甘草多糖(GiP)具有更强的促进小鼠脾淋巴细胞增殖作用,显示出较好的免疫促进活性,在食品和医药领域具有潜在的应用前景。
附图说明
附图1为对照品和实施例7得到的胀果甘草低聚糖的TLC分析图。
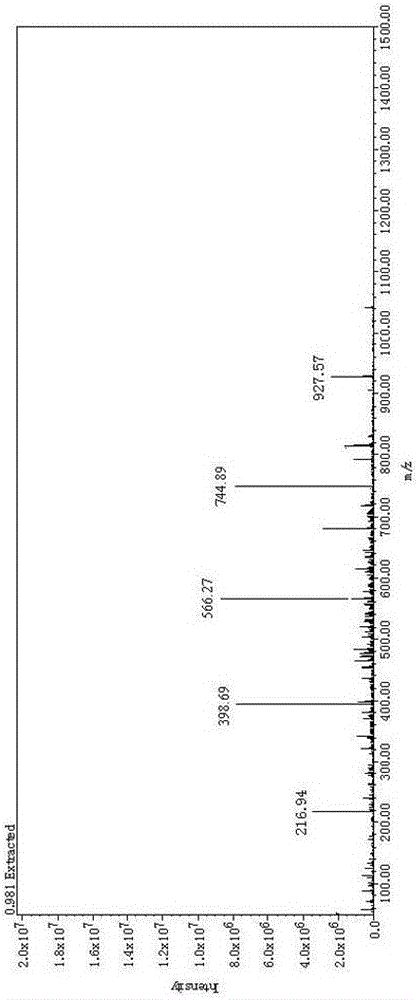
附图2为正离子模式下实施例7得到的胀果甘草低聚糖部分的ESI-MS谱图。
附图3为为负离子模式下实施例7得到的胀果甘草低聚糖部分的ESI-MS谱图。
具体实施方式
本发明不受下述实施例的限制,可根据本发明的技术方案与实际情况来确定具体的实施方式。
实施例1,该胀果甘草低聚糖,按下述制备方法得到:
第一步,果胶酸的制备,取胀果甘草多糖适量,溶于25倍至50倍胀果甘草多糖体积的1.0mol/L NaOH无水乙醇溶液,冰浴中反应4.5h至5h,反应后在温度为4℃下静置过夜,静置过夜后减压过滤,过滤后沉淀溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀再溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀用体积百分比为50%的乙醇水溶液洗涤2次至3次,洗涤后的沉淀冷冻干燥后,得到果胶酸;
第二步,果胶酸的酶法降解,取果胶酸适量,加入0.1mol/L pH为4.5的醋酸-醋酸钠缓冲溶液充分溶解后得到混合液,然后果胶酸和果胶酶按质量比为200:1,在混合液中加入果胶酶并混合均匀,在温度为35℃至40℃的水浴中反应0.5h至1h,反应后在温度为90℃至100℃的水浴中加热5min至10min使酶失活,然后冷却至室温,离心分离后得到上清液,上清液浓缩至上清液体积的1/2至1/4后,得到浓缩液,浓缩液经阳离子交换树脂脱盐,脱盐后用蒸馏水洗脱,洗脱至蒸馏水洗脱液无糖组分流出,收集蒸馏水洗脱液,然后将蒸馏水洗脱液浓缩至干,得到胀果甘草低聚糖。
实施例2,该胀果甘草低聚糖,按下述制备方法得到:
第一步,果胶酸的制备,取胀果甘草多糖适量,溶于25倍至50倍胀果甘草多糖体积的1.0mol/L NaOH无水乙醇溶液,冰浴中反应4.5h至5h,反应后在温度为4℃下静置过夜,静置过夜后减压过滤,过滤后沉淀溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀再溶于体积百分比为50%的乙醇水溶液,用酸调节pH为1.5至2.0后继续反应0.5h至1h,反应后减压过滤,过滤后沉淀用体积百分比为50%的乙醇水溶液洗涤2次至3次,洗涤后的沉淀冷冻干燥后,得到果胶酸;
第二步,果胶酸的酶法降解,取果胶酸适量,加入0.1mol/L pH为4.5的醋酸-醋酸钠缓冲溶液充分溶解后得到混合液,然后果胶酸和果胶酶按质量比为200:1,在混合液中加入果胶酶并混合均匀,在温度为35℃或40℃的水浴中反应0.5h或1h,反应后在温度为90℃或100℃的水浴中加热5min或10min使酶失活,然后冷却至室温,离心分离后得到上清液,上清液浓缩至上清液体积的1/2或1/4后,得到浓缩液,浓缩液经阳离子交换树脂脱盐,脱盐后用蒸馏水洗脱,洗脱至蒸馏水洗脱液无糖组分流出,收集蒸馏水洗脱液,然后将蒸馏水洗脱液浓缩至干,得到胀果甘草低聚糖。
实施例3,作为上述实施例的优化,冰浴温度为0℃至4℃;或/和,静置过夜的时间为12h至24h。
实施例4,作为上述实施例的优化,调节pH的酸为盐酸;或/和,冷冻干燥的温度为-60℃至-40℃,冷冻干燥的时间为12h至24h。
实施例5,作为上述实施例的优化,醋酸-醋酸钠缓冲溶液的加入量为果胶酸质量的1%至1.5%;或/和,果胶酶的活力单位1000U至3000U。
实施例6,作为上述实施例的优化,离心分离的转速为4500r/min至5000r/min,离心时间为10min至15min;或/和,蒸馏水洗脱液的流速为4倍至5倍柱体积/h。
实施例7,该胀果甘草低聚糖,按下述制备方法得到:
第一步,果胶酸的制备,称取胀果甘草多糖(GiP)2.0g,溶于500mL1.0mol/LNaOH的无水乙醇溶液,在温度为0℃至4℃的冰浴中反应5h,反应后在温度为4℃下静置过夜,静置过夜后减压过滤,过滤后沉淀溶于体积百分比为50%的乙醇水溶液,用盐酸调节pH为2.0后继续反应0.5h,反应后减压过滤,过滤后沉淀再溶于体积百分比为50%的乙醇水溶液,用盐酸调节pH为2.0后继续反应0.5h,反应后减压过滤,过滤后沉淀用体积百分比为50%的乙醇水溶液洗涤3次,洗涤后的沉淀在温度为-60℃至-40℃下冷冻干燥12h,冷冻干燥后得到果胶酸;
第二步,果胶酸的酶法降解,称取上述制得的果胶酸500mg,加入0.1mol/L pH为4.5的醋酸-醋酸钠缓冲溶液充分溶解后得到混合液,然后果胶酸和果胶酶按质量比为200:1,在混合液中加入果胶酶并混合均匀,在温度为40℃的水浴中反应1h,反应后在温度为100℃的水浴中加热5min使酶失活,然后冷却至室温,在转速为5000r/min下离心分离15min,离心分离后得到上清液,上清液浓缩至上清液体积的1/2后,得到浓缩液,浓缩液经阳离子交换树脂脱盐,脱盐后用蒸馏水洗脱,洗脱至蒸馏水洗脱液无糖组分流出,收集蒸馏水洗脱液,蒸馏水洗脱液的流速为5倍柱体积/h,然后将蒸馏水洗脱液浓缩至干,得到胀果甘草低聚糖。实施例7中,得到的果胶酸重为1.186g,得率为59.3%;得到的胀果甘草低聚糖重为374mg,得率为74.8%。
本发明上述实施例7得到的胀果甘草低聚糖的研究如下:
一.胀果甘草低聚糖的分析
1.将上述实施例7得到的胀果甘草低聚糖取少量复溶于水,进行TLC分析。水溶后的胀果甘草低聚糖用甲醇稀释,13000r/min离心5min,取上清进行ESI-MS检测分析。
TLC条件:普通硅胶G薄层板,正丁醇:甲酸:水=4:7:1为展开系统,显色剂为苯胺-二苯胺-磷酸(99.5%苯胺4ml,99.0%二苯胺4g和85.0%磷酸20ml溶于200ml丙酮中),110℃加热显色;另取市售低聚糖为对照品,同上述方法进行TLC分析。
ESI-MS检测条件:Waters TQ Detector电喷雾质谱。
样品通过2μL定量环进样。
在负离子检测方式下进行扫描;毛细管电压4.00kV,锥孔电压50V,离子源温度:120℃,脱溶剂气温度250℃,脱溶剂气流速:500L/h,锥孔气流量50L/h,扫描范围:50至2000。
在正离子检测方式下进行扫描,毛细管电压4.90kV,锥孔电压50V,离子源温度:120℃,脱溶剂气温度250℃,脱溶剂气流速:500L/h,锥孔气流量50L/h,扫描范围:50至2000。
2.胀果甘草低聚糖对小鼠脾淋巴细胞增殖的影响
无菌条件下取Balb/c小鼠脾脏,研磨后过200目筛,细胞悬液离心,用双蒸水溶解红细胞,然后用PBS清洗三次,悬于完全培养液中,细胞浓度4×106个/mL,于96孔细胞培养板中,加入100μL上述细胞悬液及3个浓度(25μg/mL,50μg/mL,100μg/mL)胀果甘草多糖及实施例7得到的胀果甘草低聚糖样品,使之总体积为200μL,于37℃,5%CO2培养箱中72h,在培养结束前8h掺3H-TdR,0.2μCi/孔,继续培养8h,细胞收集仪收集细胞于纤维滤膜上,用β-counter计数器测定放射活性。各浓度实验组数据以mean±s.d.表示,与不加药的空白对照组进行T检验。
二.结果
对照品和实施例7得到的胀果甘草低聚糖的TLC分析图,见图1所示,图1中1表示对照品,2表示实施例7得到的胀果甘草低聚糖;从图1可以看出,实施例7得到的胀果甘草低聚糖的TLC的图上出现了4个斑点,表明原料胀果甘草多糖(GiP)经脱酯化得到果胶酸,以果胶酸为底物进行酶解,得到的胀果甘草低聚糖中至少包含四种低聚糖。
水溶后的实施例7得到的胀果甘草低聚糖用甲醇稀释,13000r/min离心5min,取上清进行ESI-MS检测分析,图2为正离子模式下实施例7得到的胀果甘草低聚糖部分的ESI-MS谱图,图3为负离子模式下实施例7得到的胀果甘草低聚糖部分的ESI-MS谱图;从图2可以看出,主要存在[M+Na]+离子峰,其中m/z为216.94、398.69、566.27(569)、744.89、927.57(921)分别是半乳糖醛酸和聚合度为2~5的低聚半乳糖醛酸的[M+Na]+离子峰;从图3可以看出,主要存在[M-H]-离子峰,其中m/z为192.94、368.94、544.92、720.94、897.37分别是半乳糖醛酸和聚合度为2~5的低聚半乳糖醛酸的[M-H]-离子峰。
综合以上TLC及ESI-MS分析结果可知,以胀果甘草多糖(GiP)为原料,经脱酯化得到果胶酸,以果胶酸为底物进行酶解后可获得包括聚合度为1~5的聚半乳糖醛酸等低聚糖。
胀果甘草低聚糖对小鼠脾淋巴细胞增殖的影响
胀果甘草多糖(GiP)和实施例7得到的胀果甘草低聚糖对小鼠脾淋巴细胞的增殖效应见表1所示;从表1可以看出,与空白组比较,不同浓度胀果甘草多糖(GiP)和实施例7得到的胀果甘草低聚糖均可促进小鼠脾淋巴细胞增殖;各浓度实施例7得到的胀果甘草低聚糖促进脾淋巴细胞增殖的作用极其显著(P<0.01),并显示出剂量效应关系,而且实施例7得到的胀果甘草低聚糖促脾淋巴细胞增殖作用均超过了相应浓度组的胀果甘草多糖(GiP);说明由胀果甘草多糖(GiP)得到的本发明胀果甘草低聚糖具有比原多糖更强的促进小鼠脾淋巴细胞增殖作用,具有较好的免疫促进活性。
本发明以分离纯化得到的胀果甘草多糖(GiP)为原料,经脱酯化得到果胶酸,以果胶酸为底物进行酶解,结合TLC、ESI-MS等检测方法对降解产生的胀果甘草低聚糖进行分析,采用氚-胸腺嘧啶核苷(3H-TdR)掺入法外检测胀果甘草多糖(GiP)及其降解所得胀果甘草低聚糖对小鼠脾淋巴细胞增殖的影响,获得利用胀果甘草多糖(GiP)制备胀果甘草低聚糖的方法。
综上所述,本发明首次公开了以胀果甘草多糖(GiP)经脱酯化得到果胶酸,以果胶酸为底物进行酶解后,得到本发明胀果甘草低聚糖,本发明胀果甘草低聚糖包含聚合度为1~5的聚半乳糖醛酸低聚糖,本发明胀果甘草低聚糖较原胀果甘草多糖(GiP)具有更强的促进小鼠脾淋巴细胞增殖作用,显示出较好的免疫促进活性,在食品和医药领域具有潜在的应用前景。
以上技术特征构成了本发明的实施例,其具有较强的适应性和实施效果,可根据实际需要增减非必要的技术特征,来满足不同情况的需求。
表1胀果甘草多糖(GiP)和实施例7得到的胀果甘草低聚糖对小鼠脾淋巴细胞的增殖效应(n=4)
注:*:与空白对照组比较,P<0.05;**:与空白对照组比较,P<0.01。
- 还没有人留言评论。精彩留言会获得点赞!