一种I‑IV型串联登革病毒EDⅢ重组蛋白的构建方法及其应用与流程
本发明属于病毒疫苗研发制造技术领域,具体涉及一种I-IV型串联登革病毒EDⅢ重组蛋白的构建方法及其应用。
背景技术:
登革病毒颗粒含脂蛋白包膜,包括包膜蛋白(Envelope,E)和膜蛋白(Membrene,M),继而形成包膜刺突。其中E蛋白是病毒包膜的主要糖蛋白,分子量约51~60KD,含有多种B细胞和T细胞抗原表位以及属特异、型特异等相关功能决定簇。同时还具有多种生物学功能,如结核靶细胞表面受体、介导膜融合、诱导产生中和抗体、红细胞凝集等。
E蛋白包括三个结构域,以往有研究者将EDⅠ和EDⅡ联合用大肠杆菌表达,并检测证明有良好的免疫原性。但是随着人们对蛋白的深入研究,EDⅢ区相比起其他两个结构域显示出了更大的优势,主要表现在EDⅢ的免疫球蛋白样结构使其具备与细胞结合的功能;EDⅢ独立于E蛋白其他结构域,垂直伸出病毒表面形成突起。这样的结构特征使该结构域可能是病毒与受体结合的主要部位。除此以外,EDⅢ是E蛋白的毒力决定簇之一,其包含能诱导产生特异性中和抗体的型和亚型抗原表位。所以,EDⅢ蛋白的表达可以为以后的实验奠定良好的基础,起着尤为重要的作用。
登革病毒(Dengue virus,DV)分为四种血清型别(DVⅠ/DVⅡ/DVⅢ/DVⅣ),部分感染者感染病毒后会出现登革热(Dengue fever,DF),登革出血热(Dengue hemorrhagic fever,DHF)和登革休克综合征(Dengue shock syndrome,DSS)等临床表现。研究证明,引起登革出血热及登革休克综合征的一个重要的原因可能是抗体依赖增强感染效应(Antibody-dependent enhancement,ADE),即感染某一型的登革病毒后产生的亚中和抗体,经过一段时间后,当病人再感染异型病毒时不但没有中和病毒的效果,还介导病毒的复制扩增过程,最终使病情加重。登革热疫苗的研究已经有70多年的历史,ADE问题一直困扰着研究者们,成为登革热疫苗研究中的一个重要瓶颈。考虑到这一关键问题,本发明将四种血清型的登革病毒EDⅢ串联起来,表达一个亚单位串联重组蛋白,同时具有四种血清型的登革病毒的免疫原性,能为机体同时提供多种登革病毒的保护性,为登革病毒疫苗的开发奠定基础。
技术实现要素:
本发明的目的在于获得一种I-IV型串联登革病毒EDⅢ重组蛋白的构建方法及其应用,能作为有效的登革病毒候选疫苗。其中使用真核表达系统表达人工设计串联及真核表达密码子优化的EDⅢ蛋白,产量更高。另外,与原核表达系统相比,蛋白能得到更完善的翻译后修饰,使重组的EDⅢ保真度更高,免疫原性得到完善保留,不被破坏。
本发明通过下列技术方案实现:一种I-IV型串联登革病毒EDⅢ重组蛋白的构建方法,其特征在于经过下列各步骤:
(1)将I-IV型登革病毒基因序列经SWISS-MODEL预测排列顺序,以柔性短肽基因(SEQ ID No.1)串联,经过酵母偏爱密码子优化得到串联基因序列;
(2)在步骤(1)所得串联基因序列的5’端加入Kozak序列(SEQ ID No.2)以提高蛋白翻译效率,在3’端加入肠激酶基因(SEQ ID No.3)和组氨酸标签序列(SEQ ID No.4),使重组蛋白具有可剪切的纯化标签,在末端引入终止密码子序列(SEQ ID No.5)终止蛋白翻译;然后通过PCR扩增,并在序列两端引入限制性内切酶位点EcoRI/SphI,进行双酶切,将其克隆至质粒pPink-HC,并转化入PichiaPinkTM Expression系统中的毕赤酵母菌株;通过甲醇诱导表达,组氨酸蛋白纯化获得I-IV型串联登革病毒EDⅢ重组蛋白(SEQ ID No.9)。
所述步骤(1)的I-IV型登革病毒基因序列是:Ⅰ型登革病毒标准株EF508198.1、Ⅱ型登革病毒标准株EU249523.1、Ⅲ型登革病毒标准株GU721069.1和Ⅳ型登革病毒标准株EF436282.1。
所述步骤(1)的排列顺序为Ⅱ型-Ⅰ型-Ⅲ型-Ⅳ型。
所述步骤(2)的PCR扩增的引物为:
正向引物X1kozak—5’gcgaattcgccaccatgacaggtaaatt 3’(SEQ ID No.7)
反向引物X2End—5’ggcatgcttattagtggtgatggtggtgatg 3’(SEQ ID No.8)
所得Ⅰ-Ⅳ型登革病毒株的EDⅢ抗原重组蛋白可应用于登革病毒四联疫苗。
所述登革病毒四联疫苗是,以氢氧化铝佐剂为佐剂,将所得I-IV型串联登革病毒EDⅢ重组蛋白和氢氧化铝佐剂按体积比1:1配合。
本发明具备的优点和效果:本发明是基于四种血清型登革病毒包膜蛋白结构域Ⅲ基因序列进行I-IV型串联EDⅢ重组亚单位疫苗的设计及构建。在设计过程中加入了酵母表达密码子优化方案以及特殊设计的间隔串联序列,该方案设计的四种血清型登革病毒(DV-I/DV-II/DV-Ⅲ/DV-IV)包膜蛋白结构域Ⅲ区串联基因在PichiaPinkTM Expression System表达系统获得高效表达,经Ni亲和层析柱纯化获得纯化的重组串联蛋白,经小鼠免疫试验证明该I-IV型重组亚单位融合蛋白具有良好的免疫原性和抗原性。EDⅢ是登革病毒中能引起有机体效免疫,且副作用又小的蛋白区段。本发明是针对登革病毒EDⅢ合成酵母表达系统人工优化的重组蛋白基因,其中同时整合了四种登革病毒血清型的EDⅢ基因,并且人工设计了连接肽基因序列,相应基因表达的重组融合蛋白免疫后将对多型登革病毒具有保护作用,可作为I-IV型登革病毒候选疫苗。
附图说明
图1为SWISS-MODEL预测重组EDⅢ空间结构;
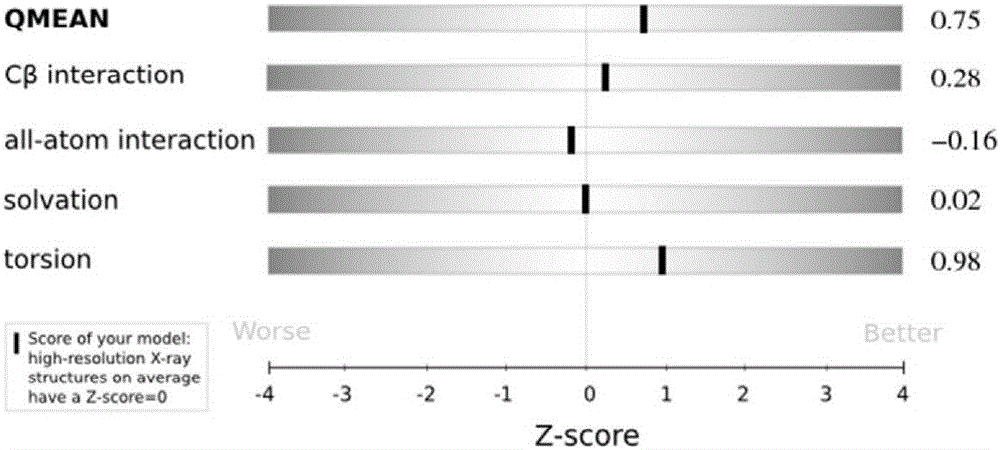
图2为重组EDⅢ序列预测结构时的Z-Score;
图3为PichiaPinkTM Expression strain1MD培养结果;
图4为实施例PCR扩增串联重组EDⅢ基因核酸电泳图,图中maker:DNA ladder;1:引入了EcorI、Kozak序列、肠激酶酶切位点、6*His的重组蛋白EDⅢ序列的基因片段;2:引入了EcorI酶切位点、Kozak序列、肠激酶酶切位点、6*His、终止密码子以及SphI酶切位点的重组蛋白EDⅢ序列的基因片段;
图5为实施例酶切鉴定pPink-HC-EDⅢ,图中maker:DNA ladder;2,3:阳性pPink-HC-EDⅢ质粒,均包括目的条带1311bp及pPink-HC质粒条带7.7kb
图6为实施例电转化成功的PichiaPinkTM Expression strain1;
图7为实施例诱导表达的重组EDⅢ蛋白时菌体总蛋白考马斯亮蓝染色结果,图中make:Protein Ladder;1-1/1-2/1-3:单克隆1号24h、48h、72h时收获菌体蛋白;2-1/2-2/2-3:单克隆2号24h、48h、72h时收获菌体蛋白;3-1/3-2/3-3/3-4:单克隆3号24h、48h、64h、72h时收获菌体蛋白;
图8为实施例筛选高效表达EDⅢ蛋白的表达酵母菌株western-blot免疫印迹检测结果,图中1-1/1-2/1-3:单克隆1号24h、48h、72h时收获菌体蛋白;2-1/2-2/2-3:单克隆2号24h、48h、72h时收获菌体蛋白;3-1/3-2/3-3/3-4:单克隆3号24h、48h、64h、72h时收获菌体蛋白;
图9为实施例SDS-PAGE检测EDⅢ蛋白纯化结果,图中maker:Protein Ladder;1、2、3:纯化蛋白不同时段时收获的蛋白样品;4:未纯化时的菌体总蛋白。
具体实施方式
下面通过实施例对本发明做进一步描述。
实施例1
(1)四型登革病毒串联EDⅢ基因的获得:
a、查询美国国立生物信息中心(NCBI),中国报道的四型登革病毒基因序列各一株,通过NCBI blast确定其中EDⅢ对应的基因序列(位置为907-1185),如下表所示:
表2.1I-IV型登革病毒标准株
b、通过SWISS-MODEL在线预测,确定步骤a的I-IV型登革病毒基因序列的串联排列顺序为Ⅱ-Ⅰ-Ⅲ-Ⅳ,以此保证经过柔性短肽串联后抗原表位不发生遮挡;
c、将四型登革病毒基因序列按步骤b的排列顺序在两两之间加入柔性短肽序列基因(SEQ ID No.1)进行串联,再对所得基因序列经酵母偏爱密码子进行优化,得到串联基因序列;
d、在步骤c所得串联基因序列5’端加入Kozak序列gccaccatgg(SEQ ID No.2),以提高蛋白翻译效率,在3’端加入肠激酶基因gacgaggaggacaag(SEQ ID No.3)和组氨酸标签序列caccaccatcaccaccat(SEQ ID No.4),使重组蛋白具有可剪切的纯化标签;最后,在末端引入终止密码子序列uaauaa(SEQ ID No.5)终止蛋白翻译;得到四型登革病毒串联EDⅢ基因序列,总长1311bp,如下:
5’-gaattcgccaccatgacaggtaaattcaaggtcgttaaagaaatagctgaaactcaacacggtaccattgtcatcagagttcaatatgagggagatggttccccctgtaaaattccctttgagataatggatttggagaaaagacatgttttgggtaggctaatcacggttaacccaattgttactgagaaagattccccagtgaacatcgaggccgaaccaccttttggggattcatacatcattattggtgtcgagccaggacagctaaaactgtcctggtttaaaaagggaggtggttctggtagtggtggtagtgggtctggaggttccgggtcaaccggttcttttaaattggagaaagaggtggctgaaacccagcacggaacagttcttgttcagattaagtacgagggaaccgacgcaccctgtaagatacccttttcaacacaggatgaaaagggtgtcactcaaaacggtagattaatcactgcaaatcctatcgtcactgacaaggaaaaaccagttaacattgaagctgaaccccctttcggagaatcttacattgtgatcggtgccggtgaaaaggcactgaagttatcatggtttaagaaaggcggtgggagtggctctggaggtagtggatcaggagggtccggttcaactttcgtcttgaagaaggaagtttctgaaacgcaacatggcacaattcttattaaagtcgaatacaaaggcgaggatgctccttgcaaaattcctttctccactgaggacggacaaggtaaggctcataacggaagacttattaccgccaacccagttgtcaccaagaaagaagagcctgttaacatagaagctgaacctccattcggagagtctaatatcgtaatcggaattggggacaatgcattaaaaataaattggtacaaaaagggctcctccggtggatcaggttctggtggcagtggaagtggtggttccggatcatctggcaagttttccatagacaaagagatggcagaaacacaacacggaacaactgttgtgaaggtgaaatatgaaggagctggtgctccatgtaaggttcctattgagatccgagatgtaaataaggagaaagtagtgggtcgtattatctcttctactccatttgctgaaaacactaatagtgtcaccaatattgaactggaaccaccctttggcgactcttatattgttattggtgtcggcgatagtgccttgactttgcattggttccgaaagggtgacgacgacgacaagcaccaccatcaccaccattaataagcatgc-3’(SEQ ID No.6)
(2)构建含有EDⅢ基因的pPink-HC表达质粒
a、将步骤(1)所得四型登革病毒串联EDⅢ基因序列通过PCR反应扩增,PCR反应的引物序列为:
正向引物:X1kozak—5’gcgaattcgccaccatgacaggtaaatt 3’(SEQ ID No.7)
反向引物:X2End—5’ggcatgcttattagtggtgatggtggtgatg 3’(SEQ ID No.8)
反应条件如表2所示:
表2PCR反应体系(反应总体积为20μl)
采用的反应程序如下:
b、将步骤(2)a中PCR反应所得的基因片段进行琼脂糖凝胶电泳并通过回收试剂盒回收其中DNA,用于EcoRI/SphI限制性内切酶的双酶切反应,反应条件如下表3:
表3EcoRI/SphI双酶切反应体系(反应总体积为50μl)
37℃,3h;
c、取1ug质粒pPink-HC,进行EcoRI/SphI限制性内切酶的双酶切反应,反应条件如下表4:
表4EcoRI/SphI双酶切反应体系(反应总体积为50μl)
37℃,3h;
d、将(2)b、c步骤酶切产物分别进行琼脂糖凝胶电泳并回收其中的DNA,用于连接反应,反应体系如下表5:
表5质粒构建连接反应体系(反应总体积为10μl)
16℃,3h;
e、将步骤(2)d中反应产物与100ulDH5α感受态细菌混合,冰上放置30min,42℃下60s,冰上60s,向混合物中加入1ml LB培养基,37℃200rpm培养1h,取100ul培养物涂布于含有50ng/ul的LB培养皿中,培养皿放置于37℃培养箱中培养过夜,次日挑选单克隆培养,提取质粒并酶切鉴定是否获得含有EDⅢ的pPink-HC质粒,此后简称为pPink-HC-EDⅢ质粒,酶切体系如下表6:
表6酶切鉴定构建质粒反应体系(反应总体积为50μl)
37℃,3h;
f、制备电转化备用的PichiaPink酵母菌,使用100mlYPD培养基培养PichiaPinkTMExpression系统中包含的四种毕赤酵母菌株(strain1,strain2,strain3,strain4),生长至OD600达到1.3,1500*g离心去上清,50ml预冷无菌水重悬洗涤一次,10ml预冷1M山梨醇重悬洗涤一次,加入300ul预冷1M山梨醇溶液重悬备用(当天使用);
g、制备电转化备用的线性化pPink-HC-EDⅢ质粒,将pPink-HC-EDⅢ质粒使用SpeI酶线性化,酶切反应体系如下表7:
表7质粒线性化反应体系(反应总体积为50μl)
37℃,3h;
h、将pPink-HC-EDⅢ质粒转化进入PichiaPinkTM Expression菌株中,使用琼脂糖凝胶回收试剂盒回收线性化的质粒,将5ug质粒混合500ul电转化备用菌,置于点转杯中,通过电转仪进行电转,电转条件为1500V/250Ω/5ms,向电转杯中加入1mlYPDS后,28℃孵育1h,取电转产物培养于MD平板,三日后挑取白色单克隆PCR鉴定是否获得转入pPink-HC-EDⅢ的毕赤酵母菌株;
i、挑取鉴定结果为阳性的毕赤酵母菌落于10mlBMGY培养一天,培养条件为28℃,280rpm;次日,将培养物转移入125mlBMGY中培养2天,培养条件为28℃,280rpm;
j、1500×g 10min收获菌体,BMMY洗涤两次,用125ml培养基BMMY重悬,连续培养72h,于24h、48h 40%甲醇至终浓度为0.5%;期间于24h、48h、72h取样,通过聚丙烯酰胺凝胶电泳考马斯亮兰染色,Weatern-Blot检测蛋白表达情况;
k、将72h时收获的菌体破碎后,溶解于含20mmol咪唑的磷酸缓冲液中(ph=7.4),4℃4000rpm离心15min后取上清,用Bio-Rad品牌His trap FF预装柱进行纯化:用平衡缓冲液平衡His trap FF预装柱,缓慢加入菌体裂解上清,使带有His的EDⅢ担保与填料结合,用冲洗缓冲液(ph 7.4,50mmol咪唑的磷酸缓冲液)冲洗,去掉非特异结合的杂蛋白,最后将目的蛋白用洗脱缓冲液(ph 7.4,500mmol咪唑的磷酸缓冲液)洗脱下来;上述纯化获得的蛋白取200ul洗脱液进行SDS-page电泳,鉴定纯化蛋白的含量和纯度;
l、用0.01M的PBS作为平衡液透析纯化后的蛋白洗脱液,袋透析蛋白洗脱液,获得纯化的I-IV型串联登革病毒EDⅢ重组蛋白(SEQ ID No.9)。
(3)所得I-IV型串联登革病毒EDⅢ重组蛋白的免疫原性及抗原性检测
a、采用步骤(2)l步骤所得I-IV型串联登革病毒EDⅢ重组蛋白免疫6周龄的Balb/c小鼠,50ug每只;将佐剂与I-IV型串联登革病毒EDⅢ重组蛋白按体积比1:1配合,所用的佐剂为分别采用弗氏佐剂和氢氧化铝佐剂,并以弗氏佐剂作为对照,间隔10天免疫一次,每次免疫后第7天采血测定,共免疫三次,第三次免疫后第7天处死取血,用纯化蛋白以5ug/ml浓度做包被蛋白,用ELISA的方法检测第三次免疫后的血清效价,用病毒中和试验进一步验证重组蛋白的免疫原性;结果显示EDⅢ重组蛋白与免疫DVⅡ、DVⅢ免疫后小鼠血清反应为阳性:
表8EDⅢ重组蛋白免疫原性检测
同时,Balb/c小鼠免疫EDⅢ重组蛋白后,无论是弗氏佐剂组还是氢氧化铝佐剂组都能引起小鼠的特异性免疫反应,弗氏佐剂混重组DV EDIII蛋白组效价为1:9586,氢氧化铝佐剂混重组DV EDIII蛋白组效价为1:4935,弗氏佐剂组引起明显偏高的免疫反应。其中弗氏佐剂组小鼠血清与EDⅢ抗体、6*His抗体的ELISA反应均呈阳性。
弗氏佐剂组是一个阳性对照,但由于弗氏完全佐剂对人体有害,不可用于人身上,对比弗氏完全佐剂组,氢氧化铝佐剂组的效果虽然稍差,但还是有很高的抗体效价,故本发明采用对人体安全的氢氧化铝作为佐剂。
b、病毒中和实验方法:将血清置56℃灭活30min后,分别稀释为1:2、1:4、1:8、1:16、1:32、1:64、1:128、1:256浓度,加入50ul/孔到96孔板中,每个稀释度重复5孔;向4/5孔加入50ul包含100TCID50的病毒稀释液,放置于5%CO2 28℃培养箱中45min,然后向每孔加入100ul 3*105个/ml的C636细胞,未加病毒的孔为血清毒性对照组;将96孔板放在5%CO2 28℃培养箱中培养7天,观察病变情况;四种血清型登革病毒中和实验条件完全一致,96孔板独立不共用,避免病毒交叉污染影响实验结果。实验结果通过Read-Muench法进行统计分析,计算公式如下:
距离比例=(高于50%的保护率-50%)/(高于50%的保护率-低于50%的保护率)
LgPD50=高于50%的保护率血清稀释度的对数+距离比例×稀释度对数的差
将小鼠血清与DVⅠ、DVⅡ、DVⅢ、DVⅣ病毒进行病毒中和试验,显示DVI-DVIV型PD50分别为1/34、1/20、1/45、1/18,即待测血清分别稀释为1:34、1:20、1:45及1:18时能保护50%细胞免于四种血清型登革病毒感染后病变。结果值均大于1:4,表明待测血清能对登革病毒的感染起到有效的保护作用,证明重组四型联合EDIII蛋白具有良好的免疫原性。
以上步骤包括了登革病毒四种血清型联合亚单位重组EDⅢ蛋白的基因序列结构设计、表达质粒得构建、蛋白的诱导表达纯化,以及蛋白的免疫原性和抗原性鉴定。在基因序列结构设计上,经过一系列的生物信息学分析,确定了能完整保留抗原性的序列结构,同时采用(Ⅱ-Ⅰ-Ⅲ-Ⅳ)串联排列顺序,之间以柔性短肽(GGGSGSGGSGSGGSGS)串联,同时进行了真核酵母表达优化的基因序列。通过系列分子生物学实验,成功构建了含有目的基因的pPink-HC质粒。参照PichiaPinkTM Expression说明书,经过培养条件、技术的改进,诱导表达出了四价串联重组蛋白EDⅢ。利用GE品牌His trap FF预装柱,成功纯化出高浓度的EDⅢ蛋白。最后,利用DVⅡ、DVⅢ病毒免疫的小鼠血清检测EDⅢ重组蛋白的免疫原性,结果为阳性。将纯化后的EDⅢ蛋白免疫小鼠采血清做中和实验,结果能有效中和病毒。
SEQUENCE LISTING
<110> 中国医学科学院医学生物学研究所
<120> 一种I-IV型串联登革病毒EDⅢ重组蛋白的构建方法及其应用
<130> 2016
<160> 11
<170> PatentIn version 3.3
<210> 1
<211> 45
<212> DNA
<213> Pichia pastoris
<400> 1
ggcggaagcg gtagcggcgg aagcggtagc ggcggaagcg gtagc 45
<210> 2
<211> 10
<212> DNA
<213> Pichia pastoris
<400> 2
gccaccatgg 10
<210> 3
<211> 15
<212> DNA
<213> Pichia pastoris
<400> 3
gacgaggagg acaag 15
<210> 4
<211> 18
<212> DNA
<213> Pichia pastoris
<400> 4
caccaccatc accaccat 18
<210> 5
<211> 6
<212> RNA
<213> Pichia pastoris
<400> 5
uaauaa 6
<210> 6
<211> 1311
<212> DNA
<213> Dengue virus
<400> 6
gaattcgcca ccatgacagg taaattcaag gtcgttaaag aaatagctga aactcaacac 60
ggtaccattg tcatcagagt tcaatatgag ggagatggtt ccccctgtaa aattcccttt 120
gagataatgg atttggagaa aagacatgtt ttgggtaggc taatcacggt taacccaatt 180
gttactgaga aagattcccc agtgaacatc gaggccgaac caccttttgg ggattcatac 240
atcattattg gtgtcgagcc aggacagcta aaactgtcct ggtttaaaaa gggaggtggt 300
tctggtagtg gtggtagtgg gtctggaggt tccgggtcaa ccggttcttt taaattggag 360
aaagaggtgg ctgaaaccca gcacggaaca gttcttgttc agattaagta cgagggaacc 420
gacgcaccct gtaagatacc cttttcaaca caggatgaaa agggtgtcac tcaaaacggt 480
agattaatca ctgcaaatcc tatcgtcact gacaaggaaa aaccagttaa cattgaagct 540
gaaccccctt tcggagaatc ttacattgtg atcggtgccg gtgaaaaggc actgaagtta 600
tcatggttta agaaaggcgg tgggagtggc tctggaggta gtggatcagg agggtccggt 660
tcaactttcg tcttgaagaa ggaagtttct gaaacgcaac atggcacaat tcttattaaa 720
gtcgaataca aaggcgagga tgctccttgc aaaattcctt tctccactga ggacggacaa 780
ggtaaggctc ataacggaag acttattacc gccaacccag ttgtcaccaa gaaagaagag 840
cctgttaaca tagaagctga acctccattc ggagagtcta atatcgtaat cggaattggg 900
gacaatgcat taaaaataaa ttggtacaaa aagggctcct ccggtggatc aggttctggt 960
ggcagtggaa gtggtggttc cggatcatct ggcaagtttt ccatagacaa agagatggca 1020
gaaacacaac acggaacaac tgttgtgaag gtgaaatatg aaggagctgg tgctccatgt 1080
aaggttccta ttgagatccg agatgtaaat aaggagaaag tagtgggtcg tattatctct 1140
tctactccat ttgctgaaaa cactaatagt gtcaccaata ttgaactgga accacccttt 1200
ggcgactctt atattgttat tggtgtcggc gatagtgcct tgactttgca ttggttccga 1260
aagggtgacg acgacgacaa gcaccaccat caccaccatt aataagcatg c 1311
<210> 7
<211> 28
<212> DNA
<213> Dengue virus
<400> 7
gcgaattcgc caccatgaca ggtaaatt 28
<210> 8
<211> 31
<212> DNA
<213> Dengue virus
<400> 8
ggcatgctta ttagtggtga tggtggtgat g 31
<210> 9
<211> 429
<212> PRT
<213> Dengue virus
<400> 9
Met Thr Gly Lys Phe Lys Val Val Lys Glu Ile Ala Glu Thr Gln His
1 5 10 15
Gly Thr Ile Val Ile Arg Val Gln Tyr Glu Gly Asp Gly Ser Pro Cys
20 25 30
Lys Ile Pro Phe Glu Ile Met Asp Leu Glu Lys Arg His Val Leu Gly
35 40 45
Arg Leu Ile Thr Val Asn Pro Ile Val Thr Glu Lys Asp Ser Pro Val
50 55 60
Asn Ile Glu Ala Glu Pro Pro Phe Gly Asp Ser Tyr Ile Ile Ile Gly
65 70 75 80
Val Glu Pro Gly Gln Leu Lys Leu Ser Trp Phe Lys Lys Gly Gly Gly
85 90 95
Ser Gly Ser Gly Gly Ser Gly Ser Gly Gly Ser Gly Ser Thr Gly Ser
100 105 110
Phe Lys Leu Glu Lys Glu Val Ala Glu Thr Gln His Gly Thr Val Leu
115 120 125
Val Gln Ile Lys Tyr Glu Gly Thr Asp Ala Pro Cys Lys Ile Pro Phe
130 135 140
Ser Thr Gln Asp Glu Lys Gly Val Thr Gln Asn Gly Arg Leu Ile Thr
145 150 155 160
Ala Asn Pro Ile Val Thr Asp Lys Glu Lys Pro Val Asn Ile Glu Ala
165 170 175
Glu Pro Pro Phe Gly Glu Ser Tyr Ile Val Ile Gly Ala Gly Glu Lys
180 185 190
Ala Leu Lys Leu Ser Trp Phe Lys Lys Gly Gly Gly Ser Gly Ser Gly
195 200 205
Gly Ser Gly Ser Gly Gly Ser Gly Ser Thr Phe Val Leu Lys Lys Glu
210 215 220
Val Ser Glu Thr Gln His Gly Thr Ile Leu Ile Lys Val Glu Tyr Lys
225 230 235 240
Gly Glu Asp Ala Pro Cys Lys Ile Pro Phe Ser Thr Glu Asp Gly Gln
245 250 255
Gly Lys Ala His Asn Gly Arg Leu Ile Thr Ala Asn Pro Val Val Thr
260 265 270
Lys Lys Glu Glu Pro Val Asn Ile Glu Ala Glu Pro Pro Phe Gly Glu
275 280 285
Ser Asn Ile Val Ile Gly Ile Gly Asp Asn Ala Leu Lys Ile Asn Trp
290 295 300
Tyr Lys Lys Gly Ser Ser Gly Gly Ser Gly Ser Gly Gly Ser Gly Ser
305 310 315 320
Gly Gly Ser Gly Ser Ser Gly Lys Phe Ser Ile Asp Lys Glu Met Ala
325 330 335
Glu Thr Gln His Gly Thr Thr Val Val Lys Val Lys Tyr Glu Gly Ala
340 345 350
Gly Ala Pro Cys Lys Val Pro Ile Glu Ile Arg Asp Val Asn Lys Glu
355 360 365
Lys Val Val Gly Arg Ile Ile Ser Ser Thr Pro Phe Ala Glu Asn Thr
370 375 380
Asn Ser Val Thr Asn Ile Glu Leu Glu Pro Pro Phe Gly Asp Ser Tyr
385 390 395 400
Ile Val Ile Gly Val Gly Asp Ser Ala Leu Thr Leu His Trp Phe Arg
405 410 415
Lys Gly Asp Asp Asp Asp Lys His His His His His His
420 425
- 还没有人留言评论。精彩留言会获得点赞!