一种评估肉类产品中是否含有抗生素的方法与流程
本发明涉及农产品检测领域,具体涉及一种评估肉类产品中是否含有抗生素的方法。
背景技术:
抗生素在现代养殖业发展中发挥了无可替代的作用,但同时也给动物性食品带来了药物残留,给食品安全和人类健康带来了严重威胁,引起了国际关注和重视。目前研究发现人体长期摄入残留剂量抗菌药物会对肠道菌群产生不利影响,如破坏肠道菌群定植抗力,诱导及促进耐药菌的增长;破坏肠道菌群的屏障作用,导致潜在病原菌过度生长;肠道菌群代谢活性改变;肠道细菌数目和相对比例改变。
我国是猪肉消费大国,年消费量占到肉食消费量的50%左右。无抗猪肉成为市场新宠和养猪业的热点,源于消费者对食品安全的追求。无抗猪肉和普通猪肉相比,在烹制过程肉质更有嚼头,肉香浓郁,随着生活水平的提高,更符合人们对健康的追求,能够满足人们对高品质安全食品的需求。无抗养殖不仅能提高肉的安全性和品质,而且可改善人类健康。从国际大环境来看,目前在生猪饲养过程中不使用抗生素是国际公认的猪肉安全标准,无抗养殖已成为世界养殖业的必然趋势。
目前关于无抗猪肉的定义有很多争议,从字面上看,无抗猪肉即猪肉中不含有抗生素,但由于环境、饮水等有微量的存在,即使养殖过程不使用抗生素,猪肉中仍会有极微量的抗生素检出。
现有的抗生素检测多是针对特定种类的检测,而抗生素本身种类繁多,同时检测费时费力,因此现有的检测方法很容易存在被忽视的种类而无法避免抗生素的残留。为确保无抗肉类产品的安全评估工作顺利开展,有必要建立抗生素残留微生物学安全评估体系,包括评价模型和技术、评估程序等。
技术实现要素:
为克服现有肉类产品在抗生素检测中存在的缺陷,本发明的目的是提供一种评估肉类产品中是否含有抗生素的方法。
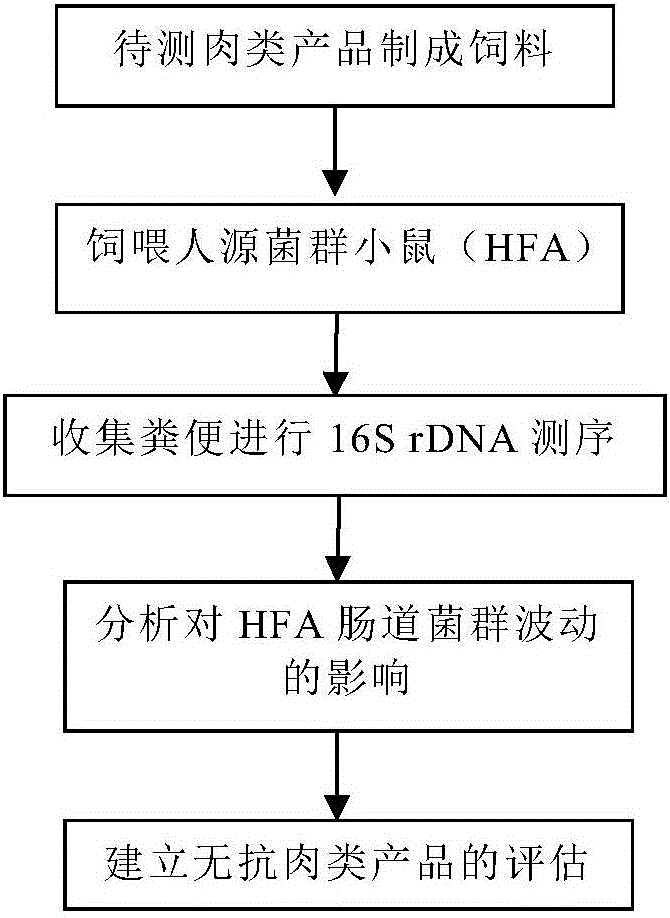
本发明的评估方法包括以下步骤:
S1:构建人源菌群小鼠模型,并饲喂待评估的肉类产品;以及
S2:通过16S rDNA测序方法得出所述人源菌群小鼠在饲喂所述肉类产品时与没有饲喂时的肠道菌群情况,当肠道菌群无波动变化时表明所述肉类产品中不含有抗生素,否则表明所述肉类产品中含有抗生素。
人肠道菌群的稳定性对抗生素非常敏感,抗生素会干扰肠道菌群的生态平衡,从而引起菌群的波动变化,即使微量存在也会引起波动,具体表现在:对肠道菌群多样性指数有一定影响;对肠道中总需氧菌、肠杆菌、肠球菌、拟杆菌、总厌氧菌等菌群数量有一定影响;对人体肠道总需氧和兼性厌氧菌、大肠杆菌等耐药性有一定影响(如氨苄青霉素、金霉素、链霉素会使耐药大肠杆菌数增加;螺旋霉素会使耐药肠杆菌数明显增加;四环素会使耐药肠球菌和脆弱拟杆菌明显增加,耐药肠杆菌数明显增加,停药后作用消失;环丙沙星会使需氧菌总数和肠球菌数明显下降,耐药肠球菌和梭菌百分数增加,耐药脆弱拟杆菌增加)。基于此,饲喂含有抗生素的肉类产品对HFA小鼠肠道菌群多样性参数的影响也将会非常明显,肠道菌群结构和组成会发生紊乱,由此可作为肉类产品中是否含有抗生素的评估指标。
本发明的方法中,所述的肠道菌群的波动变化可表示为肠道菌群丰度的波动变化,不同种类的抗生素会对不同菌种产生影响,无论增加或减少,都会引起其丰度的明显改变,表现出肠道菌群结构的波动,从而反映出是否受到抗生素残留的影响。
本发明的方法中,所述的肠道菌群的波动变化还可表示为肠道菌群多样性的波动变化,一般来说,抗生素会导致肠道菌群多样性明显降低,表现出肠道菌群结构的波动,从而反映出是否受到抗生素残留的影响。
本发明的方法中,所述肠道菌群的波动是指统计学上的差异性,当两组细菌数据比对时,如具备显著差异(P<0.05)或极显著差异(P<0.01),则被视为具有波动。
本发明的方法中,所述步骤S2进一步为:通过16S rDNA测序方法得出所述人源菌群小鼠在饲喂前、饲喂中、停止饲喂后的肠道菌群情况,当肠道菌群无波动变化时表明所述肉类产品中不含有抗生素,否则表明所述肉类产品中含有抗生素。停止饲喂含抗生素肉类产品之后,肠道菌群尽管有所恢复,但相对于饲喂之前,还是存在明显波动,因此,作为优选的技术方案,通过测序方法检测小鼠在饲喂前、饲喂中、停止饲喂后的肠道菌群情况,均无波动则更好地说明待测产品中不含有抗生素。
本发明的方法中,所述人源菌群小鼠模型的构建为将无菌C57BL/6J小鼠灌胃接种人粪便悬液即得。
本发明的方法可适用的肉类产品包括常见的家畜、家禽、水产等肉产品;优选适用于猪肉、牛肉、羊肉等常见肉类产品;最优选适用于无抗猪肉的评估。
本发明的评估方法结合了HFA模型与宏基因组技术,首先构建HFA模型模拟人肠道菌群生态系统,再利用宏基因组技术考察饲喂待检测样品前后的菌群情况,通过肠道菌群的波动评估是否残留有抗生素。该评估方法可不受抗生素种类限制,只要有抗生素残留,都可在肠道菌群上表现出波动,而且,由于宏基因组技术的准确性和灵敏性,即使微量残留也可被检测出,因此,本发明的评估方法提高了抗生素残留检测的可靠性、准确性及灵敏性,为建立更为科学、全面的无抗产品抗生素残留安全性评估体系提供了良好的模型和先进的检测技术。
附图说明
图1为本发明所述评估肉类产品中是否含有抗生素的方法流程图。
具体实施方式
以下通过具体实施例说明本发明,但实施例仅用于说明,并不限制本发明的范围。
定义
1.宏基因组学从技术上看包括16S rDNA高变区测序和全基因组的宏基因组测序两个层次。16S rDNA高变区测序可获得微生物多样性与丰度、种群结构、进化关系等相关信息;而对微生物菌群全基因组进行测序,可进一步对微生物基因功能、各微生物菌群相互协作关系、菌群与环境之间的关系等方面进行深入研究。
2.16S rDNA是指:即16S ribosomal DNA,是原核核糖体30S小亚基的组成部分,相对分子质量约为0.6Mda,长度约为1540nt。
3.无抗猪肉是指:不含抗生素的猪肉。生猪养殖过程中以不含抗生素的饲料为原料,生猪屠宰时也检测不到抗生素,加工后的猪肉和肉制品也不含抗生素,这样的生猪即为“无抗猪”。“无抗猪”屠宰加工后的肉类即为“无抗猪肉”。
4.人源菌群是指:来自健康人粪便的微生物。
5.本发明所利用的动物肠道菌群的表型和/或症状包括:菌群的多样性差异;物种的丰度及均匀度变化。
6.操作分类单位是指:运算分类单元(OTU),用于物种分类及物种相对丰度分析的基本单元。一般情况下,若序列之间,比如不同的16Sr DNA序列的相似性低于98%就可以把它定义为一个OTU,每个OTU对应于一个不同的16S rDNA序列,即每个OTU对应于一个不同的细菌(微生物)种。
7.无菌小鼠是指:不能检出任何活的微生物和寄生虫的动物。例如,无菌C57BL/6J小鼠,将其饲养于无菌隔离器中,饲养环境20~24℃,湿度40%~70%,严格12h光照12h黑暗。饲料来自北京科奥协力饲料有限公司销售的Co60辐照大小鼠生长繁育料,垫料经Co-60γ50kGy射线辐照消毒,鼠笼、饮水和饮水瓶等均采用高温高压灭菌(121℃,60min)。
实施例
1、粪便来源及HFA小鼠模型构建
选取6个月以上未使用抗菌药、无胃肠疾病及饮食规律无异常的健康志愿者4名(男、女各2名,22~28周岁),采集健康志愿者的清晨第1次的新鲜粪便于无菌厌氧袋(氮气85%、氢气5%、二氧化碳10%),加入10%甘油作为抗冻保护剂,旋涡振荡混匀,-80℃保存。
冻存的粪便样品室温下于厌氧环境内放置约1h,缓慢解冻。以1:99(质量体积比)的比例加入预还原TGY稀释液,震荡混匀,所得混悬液即粪便悬液。
预还原TGY稀释液成分:蛋白胨30g,酵母提取物20g,加双蒸水至1000ml,121℃高压蒸汽灭菌15min。用前加入1g葡萄糖和1g L-半胱氨酸。TGY稀释液在使用前放入厌氧包内,充入混合气体(N2:CO2:H2=85:10:5)以保持TGY稀释液于低氧化还原电势。
将4周龄C57BL/6J无菌小鼠灌胃接种健康志愿者粪便悬液0.3ml,人肠道菌群在小鼠肠道内定植3周后获得HFA小鼠模型。
在灌胃接种健康志愿者粪便悬液后3、7、14、21天,采集HFA小鼠(n=6)粪便样品,立即冻存于-80℃,用16S rDNA测序分析接种外源菌群小鼠和人肠道菌群的相似性和多样性。结果显示与人的肠道菌群相似性达到39%,说明构建HFA小鼠模型成功。
2、实验动物饲料配置及饲喂
人源菌群小鼠模型分别饲喂待评估的猪肉粉末(添加量2g/kg)和基础饲料。其中,基础饲料组成如下:
表1人源菌群小鼠基础饲料
3、样品采集与处理
以人源菌群小鼠模型为实验动物,通过16S rDNA方法检测猪肉或猪肉食品对人体肠道菌群波动的影响。
分别于喂养猪肉粉末前、喂养猪肉粉末后、停止喂养猪肉粉末后的若干时间点(可以为3-10个时间点,每个时间点一般间隔一周左右)取实验小鼠的新鲜粪便样品(每一时间点取样3份)并拍照,装于2ml无菌EP管中,冻藏于-80℃待用。
取实验小鼠粪便20mg,参照DNA提取试剂盒(厂家:Qiagen,货号:51504))的说明提取DNA。
4、16S rDNA测序
提取样品总DNA,参照文献(Sun,W.et al.Mechanism and Effect of Temperature on Variations in Antibiotic Resistance Genes during Anaerobic Digestion of Dairy Manure.Sci.Rep.6,30237;doi:10.1038/srep30237(2016).)进行扩增,扩增完成的PCR产物纯化之后进行上机测序。整个测序流程由上海锐翌生物科技有限公司完成,使用Illumina HiSeq PE250进行上机测序。通过对测序结果进行OUT(操作分类单位)聚类分析,反映出肠道菌群群落的物种组成、物种间进化关系及群落多样性。
5、统计学分析
实验数据用平均数±标准差(x±s)表示,采用SPSS 13.0软件进行统计学分析,不同实验组之间的差异分析采用Student-t检验,P<0.05为统计学上有显著差异,P<0.01为统计学上极显著差异。
6、菌群波动评估
(1)猪肉中如没有抗生素残留,加肉粉前后及停肉粉后,小鼠的肠道菌群均无波动变化,即统计学上无显著差异。
(2)猪肉中如有抗生素残留,则对肠道菌群丰度、多样性都有影响,具有明显的波动变化。
以上流程可参照图1所示。
7、对比实验
以含抗生素的猪肉重复前述实验过程,并设置未饲喂猪肉粉末的人源菌群小鼠作为对照组,菌群波动变化结果如表2所示:
表2HFA小鼠粪便细菌数量的变化[log(CFU/g)]
*表示与对照组相比,差异显著(P<0.05),**表示与对照组相比,差异极显著(P<0.01)
由表2结果可以看出,实验组小鼠粪便需氧和兼性厌氧菌数明显低于对照组(P<0.05或P<0.01);实验组小鼠粪便肠球菌和拟杆菌的数量也明显低于对照组(P<0.05或P<0.01)。说明饲喂含抗生素猪肉后的小鼠肠道菌群丰度发生了明显波动。由此说明肠道菌群波动可以反映出抗生素的残留情况,本发明的评估方法可准确评估出肉类产品中的抗生素残留。
虽然为了说明本发明,已经公开了本发明的优选实施方案,但是本领域的技术人员应当理解,在不脱离权利要求书所限定的本发明构思和范围的情况下,可以对本发明做出各种修改、添加和替换。
- 还没有人留言评论。精彩留言会获得点赞!