制备具有高透明度和高耐热性的聚碳酸酯的新方法与流程
本发明涉及一种制备具有优异透明度和高耐热性的聚碳酸酯的新方法。具体涉及一种具有重复单元的生物基聚碳酸酯的制备方法,该重复单元来源于1,4:3,6-双脱水己糖醇、碳酸酯和1,4-环己烷二羧酸酯的反应。
背景技术:
不同于石油化学工业的传统材料,1,4:3,6-双脱水己糖醇是一种源自生物质的生物基材料,即一种以多聚糖作为成份的可再生资源,如玉米、小麦、土豆等。尤其是,由于生物塑料在使用后降解的同时所产生二氧化碳可以再次被生物质的生长环节重复利用,包含生物基材料的生物塑料作为一种减少二氧化碳生成的材料已引起广泛的关注,从而解决全球变暖的世界性问题。
1,4:3,6-双脱水己糖醇具有以下三种立体异构型,由于两个羟基的相对构型不同,这三种立体异构型具有不同的化学性质:异甘露糖醇(如下方化学结构式a,熔点:81-85℃)、异山梨醇(如下方化学结构式b,熔点:61-62℃)以及异艾杜糖醇(如以下的化学结构式c,熔点64℃)。
【化学式a】
【化学式b】
【化学式c】
尤其是,当1,4:3,6-双脱水己糖醇作为单体制备典型的工程塑料聚碳酸酯时,所制备的聚碳酸酯具有良好的热学和光学性能,这归因于1,4:3,6-双脱水己糖醇的分子结构特性,即手性和刚性的饱和杂环结构,以及生物塑料的优点。因此,1,4:3,6-双脱水己糖醇已被广泛用作开发生物塑料的典型原料。
同时,1,4-二甲基-环己烷二羧酸酯(以下简称dmcd)或dmcd的水解产物1,4-环己烷二羧酸(以下简称chda)在其分子中心具有环己烷环结构。因此,如果dmcd或chda被并入到聚合物链中,由于分子结构中柔韧性和硬度的独特组合,不仅可提高聚合物的耐候性以及耐紫外线稳定性,而且可提高聚合物的保光性、耐泛黄性、水解稳定性、耐腐蚀性和耐化学性等特性。
聚(1,4-亚环己基1,4-环己烷二羧酸酯)(以下简称pccd)作为一种dmcd/环己烷二甲醇(以下简称chdm)的均聚酯,就是一个由dmcd制备而成的市售聚合物材料的例子。由于其较好的耐候性、耐化学性、流动性以及低折射率,美国的杜邦公司已将pccd用于制备一种聚碳酸酯/pccd合金(商标名称:xyrex),以提高聚碳酸酯的透明度。
工业上制备聚碳酸酯的方法可分为溶液聚合法和熔融缩聚法。不同于采用光气作为碳酸酯的来源的溶液聚合法,熔融缩聚法中采用碳酸二苯酯(以下简称dpc)。因此,传统的熔融缩聚法中所使用的原料通常包括dpc和双酚a(以下简称bpa)作为二醇,bpa和dpc的酯交换反应生成苯酚作为熔融缩聚反应的副产物。
本发明的发明人已研发一种制备基于异山梨醇的聚碳酸酯的新方法,该基于异山梨醇的聚碳酸酯是由源自dmcd或chda的1,4-二苯基-环己烷二羧酸酯(以下简称dpcp)制备而成。
本发明在制备基于异山梨醇的聚碳酸酯(或碳酸酯)时,采用dpcd作为生成聚合物链中的酯键的材料。因此,生成的聚碳酸酯为一种具有优异透光性和高耐热性的新型生物塑料。该生物塑料的某些使用特性和成型加工性可通过改变dpcd的含量而加以调节。相比2011/0003101号美国专利申请公开和8,399,598号美国专利中所公开的传统生物塑料,本发明的生物基聚碳酸酯具有优异的耐热性、表面硬度以及冲击强度。
技术实现要素:
技术问题
本发明的目的在于提供一种制备具有高耐热性、高透明度以及高聚合度和良好力学性能的聚碳酸酯的新方法。该聚碳酸酯包括刚性聚合物重复单元,不含可能产生环境激素的bpa,并且该聚碳酸酯在汽车玻璃替代物、光学透镜或光学膜、奶瓶、食品容器等多种应用中发挥很大作用。
技术方案
本发明提供一种制备生物基聚碳酸酯的方法,包括如下步骤:
(1)将由化学式2所示的化合物转化为具有可轻易地被分离的功能团的中间反应物,使中间反应物与苯酚发生亲核反应而生成由化学式3所示的化合物;
(2)使在步骤(1)所制备的由化学式3所示的化合物、由化学式4所示的化合物和1,4:3,6-双脱水己糖醇发生聚碳酸酯熔融缩聚反应,从而生成包括由化学式1所示的重复单元的生物基聚碳酸酯;
【化学式1】
【化学式2】
【化学式3】
【化学式4】
其中:
r为甲基或氢;
r1和r2分别为取代或非取代的c1-c18的脂族基团或为取代或非取代的c1-c18的芳族基团;以及
x为满足0<x<1的实数。
本发明的有益效果
与传统的制备方法相比,本发明所述的制备生物基聚碳酸酯的方法中,通过具有可轻易地被分离的功能团的中间反应物与苯酚发生亲核反应,生成了高产率的具有高纯度和高白度的dpcd,从而降低了生产成本。本发明方法所制备的生物基聚碳酸酯具有高透明度和高耐热性,可有效地利用在汽车玻璃替代物、光学透镜或光学膜、奶瓶、食品容器等多种应用中。
附图说明
图1为dpcd的核磁共振氢谱(1hnmr);
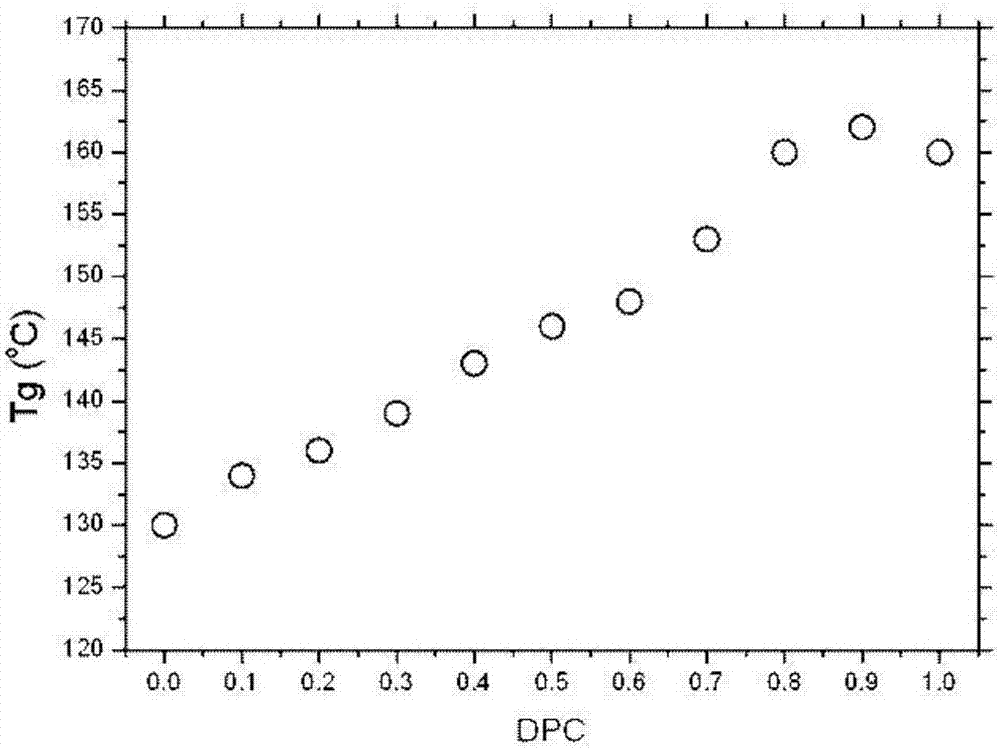
图2为聚合物的玻璃化转变温度(tg)随dpc含量而变化的示意图;
图3为实施例1中所制备的生物基聚碳酸酯的1hnmr图谱;
图4为实施例1中所制备的生物基聚碳酸酯的红外光谱。
具体实施方式
以下将对本发明进行详细描述。
本发明提供一种制备生物基聚碳酸酯的方法,包括如下步骤:
(1)将由化学式2所示的化合物转化为具有可轻易地被分离的功能团的中间反应物,使中间反应物与苯酚发生亲核反应生成由化学式3所示的化合物;以及
(2)使在步骤(1)中所制备的由化学式3所示的化合物、由化学式4所示的化合物和1,4:3,6-双脱水己糖醇发生聚碳酸酯熔融缩聚反应,从而生成包括由化学式1所示的重复单元的生物基聚碳酸酯;
【化学式1】
【化学式2】
【化学式3】
【化学式4】
其中,
r为甲基或氢;
r1和r2分别为取代或非取代的c1-c18的脂族基团或为取代或非取代的c1-c18的芳族基团;
x为满足0<x<1的实数。
在步骤(1)中,由化学式2所示的化合物转化为具有可轻易地被分离的功能团的中间反应物,该中间反应物与苯酚发生亲核反应生成由化学式3所示的化合物,即1,4-二苯基-环己烷二羧酸酯(dpcp).
具体地,在上述步骤(1)中,dmcd(由化学式2所示的化合物,其中r为甲基)或chda(由化学式2所示的化合物,其中r为氢)被转化为具有可轻易地被分离的功能团的中间反应物,然后该中间反应物与苯酚发生亲核反应生成dpcd。dpcd在随后的步骤(2)中与二醇发生酯交换反应,生成苯酚作为副产物。
步骤(1)中的该具有可轻易地被分离的功能团的中间反应物可以是由以下的化学式2a表示的化合物:
【化学式2a】
其中,r3为f、cl或br。
在本发明的实施例中,由化学式2a所示的化合物可以为1,4-环己烷二羰基氯(以下简称为chdc)。
也就是说,在上述步骤(1)中,由化学式2所示的dmcd(其中r为甲基)或chda(其中r为氢)可被转变为中间化合物chdc。chdc可与苯酚发生亲核反应生成dpcd(见下反应流程图1)。
【反应流程图1】
根据所需要的特性以及由化学式2所示的化合物,可采用伯、仲、叔二羧酸酯或二羧酸。由该化学式2所示的化合物为形成本发明聚碳酸酯聚合物链中酯键的原料物质,它们可通过与苯酚发生亲核反应生成由化学式3所示的化合物以外的其他二苯基酯类。这些二苯基酯类与由化学式3所示的化合物一起发生聚碳酸酯熔融缩聚反应。
除由化学式3所示的化合物以外的其他二苯基酯类可以为一种或者两种或两种以上的混合物。
为使本发明的生物基聚碳酸酯具有高耐热性、高透明度、高耐候性和耐紫外线稳定性,不同于化学式2所示的化合物的二羧酸酯或二羧酸可在其分子中心具有单个或融合的饱和同素环或杂环。例如,选自四氢-2,5-二甲基-呋喃二羧酸酯、1,2-二甲基-环己烷二羧酸酯、1,3-二甲基-环己烷二羧酸酯、十氢-2,4-二甲基-萘二甲酸酯、十氢-2,5-二甲基-萘二甲酸酯、十氢-2,6-二甲基-萘二甲酸酯、十氢-2,7-二甲基-萘二甲酸酯、四氢-2,5-呋喃二羧酸、1,2-环己烷二羧酸、1,3-环己烷二羧酸、十氢-2,4-萘二甲酸、十氢-2,5-萘二羧酸、十氢-2,6-萘二甲酸和十氢-2,7-萘二羧酸组成的组中的至少一种二羧酸酯或二羧酸化合物。优选为:十氢-2,6-二甲基-萘二甲酸酯或十氢-2,6-萘二甲酸,以及源于生物基材料的化合物,例如四氢-2,5-二甲基-呋喃二羧酸酯或四氢-2,5-呋喃二羧酸。
步骤(1)中的中间反应物可通过由化学式2所表示的化合物与一种氯化剂反应获得。该氯化剂可包括一种选自光气、三光气、亚硫酰氯、草酰氯、三氯化磷、五氯化磷、五溴化磷和三聚氟氰组成的组中的化合物。优选地,为便于除去反应生成的副产物,该氯化剂可包括一种选自光气、亚硫酰氯和草酰氯中的化合物。更为优选地,从商业角度考虑,该氯化剂可以为光气。
该氯化剂的使用剂量可以为由化学式2所示的化合物总摩尔数的1-4倍,优选为1.02-3倍,更优选为1.05-2.5倍。
另外,反应温度可根据由化学式2所示的化合物以及氯化剂而改变。通常,该反应温度可在-30至150℃之间,优选为15-100℃,更优选为20-80℃。反应时间可以在5分钟至48小时之间,优选为10分钟至24小时。
化学式2所示的化合物与氯化剂的反应中,可使用有机溶剂溶解或分散化学式2所示的化合物。该有机溶剂可包括,例如:苯、甲苯、二甲苯、均三甲基苯、二氯甲烷、二氯乙烷、氯仿、四氯化碳、一氯苯、邻二氯苯、四氢呋喃、二恶烷和乙腈。如果化学式2所示的化合物在以上温度范围内熔解,则反应中可以不用添加有机溶剂。
与此同时,如果该中间反应物在室温下为液体,则中间反应物可作为溶剂,以节省溶剂的费用,因此从商业角度考虑具有优势。
为提高中间反应物的转化率以及反应产率,可以在反应中添加催化剂。该催化剂并没有特殊限定,可以是有机或无机催化剂。有机催化剂可包括,例如,二甲基甲酰胺、二甲基乙酰胺、甲基吡咯烷酮、二甲基咪唑啉酮、四甲基脲、四乙基脲和四丁基脲。无机催化剂可包括,例如氯化铝(alcl3)、氯化铁(fecl3)、氯化铋(bicl3)、氯化镓(gacl3)、五氯化锑(sbcl5)、三氟化硼(bf3)、三氟甲磺酸铋(bi(otf)3)、四氯化钛(ticl4)、四氯化锆(zrcl4)、四溴化钛(tibr4)和四溴化锆(zrbr4)。具体地,该有机催化剂可选自:二甲基甲酰胺、四甲基脲和二甲基咪唑烷酮;该无机催化剂可选自:氯化铝和四氯化钛。更为优选地,从商业角度考虑,该有机催化剂可以为二甲基甲酰胺,该无机催化剂可以为氯化铝。
该催化剂的剂量并没有特殊限定,可以根据由化学式2所示的化合物以及氯化剂的种类调整。该催化剂的使用剂量可以为由化学式2所示的化合物的总摩尔数的0.1-10mol%,优选为0.5-5mol%,更为优选为1-3mol%。当催化剂的剂量小于以上范围,反应速率会变慢。另一方面,当催化剂的剂量超过以上范围时,不仅不会加快反应速率,反而很可能引起反应失控或放热反应。
同时,用于将中间反应物转化为由化学式3所示的化合物的苯酚的使用剂量可以为化学式2所示的化合物的总摩尔数的1-3倍,优选为1.5-2.5倍。当苯酚的使用剂量超出以上范围时,可使由化学式3所示的化合物的最终产率降低。
在步骤(2)中,从步骤1)中所获取的由化学式3所示的化合物、由化学式4所示的化合物以及1,4:3,6-双脱水己糖醇发生聚碳酸酯熔融缩聚反应,生成包含由化学式1所示的重复单元的化合物。
在上述步骤2)中,1,4:3,6-双脱水己糖醇与由化学式4所示的化合物反应生成碳酸酯键(重复单元1),1,4:3,6-双脱水己糖醇与由化学式3所示的化合物反应生成酯键(重复单元2)。含有这些键的重复单元由上述化学式1表示。
如果1,4:3,6-双脱水己糖醇的剂量为1摩尔,由化学式3所示的化合物的剂量为x摩尔,则由化学式4所示的化合物的使用剂量为(1-x)摩尔,如反应流程图2所示。
【反应流程图2】
例如,在不存在由化学式3所示的化合物情况下,1,4:3,6-双脱水己糖醇与由化学式4所示的化合物发生熔融缩聚反应,生成一种1,4:3,6-双脱水己糖醇均聚碳酸酯(tg为160℃)。当由化学式3所示的化合物剂量增加,聚合物链中酯键的量也增加。如果由化学式3所示的化合物的剂量为1,则仅有1,4:3,6-双脱水己糖醇和由化学式3所示的化合物发生熔融缩聚反应,从而生成一种均聚酯类(tg130℃;参考macromolecules,2013,46,2930)。图2显示了聚合物的tg随着由化学式4所示的化合物的比例的变化。
总之,该聚合物链中碳酸酯键与酯键的比例变化取决于所加入的由化学式3所示的化合物的剂量。当碳酸酯键和酯键在聚合物链中共存时,本发明的聚碳酸酯相比2011/0003101号美国专利申请公开和8,399,598号美国专利中所公开的1,4:3,6-双脱水己糖醇聚碳酸酯具有更高的耐热性。通常,聚碳酸酯类相比聚酯类表现为高耐热性和良好的力学性能,但是其耐化学性、残余应力和模塑周期较差。但是,一种在单一链中同时包含碳酸酯键和酯键的聚碳酸酯不仅克服了具有单一的碳酸酯键或酯键的聚合物的不足之处,而且还具备其他优点。
1,4:3,6-双脱水己糖醇可选自:异甘露糖醇、异山梨醇以及异艾杜糖醇。优选为异山梨醇。
另外,为确保所获得的生物基聚碳酸酯的高聚合度,从而使其具有高耐热性、高透明度以及优异的力学性能,在熔融缩聚反应中保持1,4:3,6-双脱水己糖醇的高纯度尤为重要。
1,4:3,6-双脱水己糖醇可以是粉末、薄片状或者为水溶液。但若长时间暴露在空气中,1,4:3,6-双脱水己糖醇很快会被氧化变色,这会导致最终聚合物的颜色和分子质量不满足要求。因此,应尽可能减少1,4:3,6-双脱水己糖醇在空气中的暴露。一旦1,4:3,6-双脱水己糖醇暴露在空气中,最好将其与脱氧剂,如氧吸收剂,存储在一起。另外,如果1,4:3,6-双脱水己糖醇是由多步骤工艺制备的,去除其中的杂质非常重要。具体的,在以蒸馏方式纯化1,4:3,6-双脱水己糖醇时,关键在于去除痕量级的酸性液体成份和碱金属成份,该酸性液体成份可通过初步分离去除,该碱金属成份可通过残渣分离去除。每种酸性液体成份和碱金属成份应保持在10ppm或以下,优选为5ppm或以下,更优选为3ppm或以下。
由化学式4所示的化合物的示例可以为选自碳酸二甲酯、碳酸二乙酯、碳酸二叔丁酯、碳酸二苯酯、碳酸二甲苯酯和取代的碳酸酯组成的组中的至少一种。由于聚碳酸酯熔融缩聚反应在减压条件下进行,由化学式4所示的化合物可具体为碳酸二甲酯,碳酸二乙酯,碳酸二叔丁酯,碳酸二苯酯或碳酸二甲苯酯。更为具体地,该由化学式4所示的化合物为碳酸二苯酯。
在上述步骤(2)中,可进一步使用除1,4:3,6-双脱水己糖醇以外的其它二醇化合物,并且对这类二醇化合物没有特别限定。包括伯、仲、叔二醇化合物在内的多种化合物可与1,4:3,6-双脱水己糖醇一起使用,此时,若不同于1,4:3,6-双脱水己糖醇的其它二醇化合物的剂量为y摩尔,则1,4:3,6-双脱水己糖醇的剂量为(1-y)摩尔。
尤其是,当这些二醇化合物为石油化工类二醇化合物,可以使用该二醇化合物使最终的聚合物中源自1,4:3,6-双脱水己糖醇的生物基含量(astm-d6866)至少为1%摩尔量。此时,y满足0≤y<0.99,即,这些二醇化合物的使用剂量可以为小于99%摩尔量,基于100%摩尔量的1,4:3,6-双脱水己糖醇。
优选地,这些二醇化合物在其分子中心具有单个或融合的饱和同素环或杂环,从而使所制备的聚碳酸酯具备高耐热性、高透明度,以及改进的耐候性和耐紫外线稳定性。同时,通常具有对称结构的羟基基团的二醇的环越大,聚碳酸酯的耐热性越高。但是,其光学性能并不取决于环链的大小以及二醇中羟基基团的位置,而是随原料特性而改变。环链尺寸越大,越难实现该化合物的工业化制备和应用。
这些二醇化合物可选自:可源自生物基材料的1,2-环己烷二甲醇、1,3-环己烷二甲醇、1,4-环己烷二甲醇、三环癸烷二甲醇、3,9-双(1,1-二甲基-2-羟乙基)-2,4,8,10-四氧螺[5.5]十一烷、2,2-双(4-羟基环己基)丙烷和四氢-2,5-呋喃二甲醇。优选为,1,4-环己烷二甲醇、2,2-双(4-羟基环己基)丙烷和四氢-2,5-呋喃二甲醇。
该由化学式3所示的化合物的顺/反异构体的质量比可以是1/99至99/1,优选为10/90至90/10,更优选为20/80至80/20。另外,化学式1的重复单元中的环己烷二羧酸酯的顺/反异构体的质量比可以是1/99至99/1,优选为20/80至80/20,更优选为30/70至70/30。
随着化学式1的重复单元中的顺式环己烷二羧酸酯单元的含量增加,聚碳酸酯的tg升高,从而增加其耐热性而相对降低其透光度。相反,随着反式环己烷二羧酸酯单元的含量降低,聚碳酸酯的tg降低,其耐热性下降而透光度升高。因此,化学式1的重复单元中的环己烷二羧酸酯单元的顺/反异构体的质量比优选为20/80至80/20,更优选为30/70至70/30,从而调整聚碳酸酯的耐热性和透光度。
在步骤(2)中的熔融缩聚反应中,基于1摩尔的1,4:3,6-双脱水己糖醇,化学式3所示的化合物与化学式4所示的化合物的总量为0.7-1.3摩尔,优选为0.9-1.1摩尔,更优选为0.95-1.05摩尔.
该熔融缩聚反应的温度可以以0.1-10℃/分钟的速率上升,该升温速率优选为0.2-5℃/分钟,更优选为0.2-2℃/分钟。反应温度为120-320℃,优选为150-290℃,更优选为180-270℃。反应时间为1-10小时,优选为1.5-8小时。
另外,熔融缩聚反应生成的苯酚副产物应从反应体系中馏出,从而使反应平衡转向生成聚碳酸酯的方向。尤其地,如果升温速率超出以上范围,苯酚可能随原料一起蒸发或者升华。该生物基聚碳酸酯可在分批或连续的工序中制备。
在根据本发明的制备生物基聚碳酸酯的方法中,可进一步使用缩聚催化剂以增强熔融缩聚反应的反应活性。聚碳酸酯熔融缩聚反应中常用的任意传统碱金属和/或碱土金属可作为缩聚催化剂。该催化剂可与碱性氨或胺、碱性磷或碱性硼化合物组合使用,但该催化剂最好是单独使用。示例性的该碱金属催化剂可以是lioh、naoh、koh、csoh、li2co3、na2co3、k2co3、cs2co3、lioac、naoac、koac、csoac及其类似物。例如,该碱土金属可以是ca(oh)2、ba(oh)2、mg(oh)2、sr(oh)2、caco3、baco3、mgco3、srco3、ca(oac)2、ba(oac)2、mg(oac)2、sr(oac)2及其类似物。并且,这些碱金属和/或碱土金属可单独使用或者两种或两种以上组合使用。
用于熔融缩聚反应中的每1摩尔剂量的二醇类(即,1,4:3,6-双脱水己糖醇和其它二醇化合物)对应的缩聚催化剂的使用剂量可以为0.1-30微摩尔,优选为0.5-25微摩尔,更优选为0.5-20微摩尔。该缩聚催化剂在熔融缩聚反应中的任何时候都可以使用,但最好在熔融缩聚反应开始前就加入。对应每摩尔二醇类物质,如果该缩聚催化剂的剂量小于0.1微摩尔,则很难达到目标聚合度。如果该催化剂的用量超过30微摩尔,则会引起副反应,这些副反应会对产物的目标特性造成直接的有害作用,例如降低透明度。
并且,根据本发明的制备生物基聚碳酸酯的方法可采用逐步升温和逐步减压的方式,从而快速去除副产物并促进聚合反应。具体地,步骤(2)中的熔融缩聚反应包括第一反应区和第二反应区。
更具体地,在加入原料后,第一反应区在130-250℃温度下进行,优选为140-240℃,更优选为150-230℃,该反应时间为0.1-10小时,优选为0.5-3小时。当压强在以上温度范围内减小时,该减压为5-700托,优选为10-600托。
第二反应区在210-290℃温度下进行,优选为220-280℃,更优选为230-270℃,该反应时间为0.1-10小时,优选为0.5-3小时。当压强在以上温度范围内减小时,该减压为小于或等于20托,优选为小于或等于10托。
另外,在本发明的制备生物基聚碳酸酯的方法中,必要时可使用各种添加剂。例如,这些添加剂可以包括:抗氧化剂或热稳定剂,如受阻酚、氢醌、亚磷酸酯及其取代的化合物;紫外线吸收剂,如间苯二酚,水杨酸等;护色剂,如亚磷酸盐,亚磷酸氢盐等;和润滑剂,如褐煤酸,硬脂醇等。并且,染料和颜料可用作着色剂;炭黑可用作导电剂、着色剂或成核剂;也可使用阻燃剂,增塑剂,抗静电剂等添加剂。前述添加剂的用量以不影响最终聚合物的特性尤其是响透明度为前提。
根据本发明的聚碳酸酯制备方法所制备的包括化学式1的重复单元的生物基聚碳酸酯的本征粘度(以下简称iv值)为0.3-2.0dl/g。
本发明的实施方式
以下将通过后附实施例对本发明的方法做更为详细的阐述。但是,这些实施例仅仅用以解释本发明,并不用于限定本发明。
制备例1:由chda制备dpcd
将100g(0.58摩尔)具有顺/反异构体质量比为88/12的chda(sk化工)以及200g二氯甲烷加入到1l四颈圆底烧瓶,该四颈圆底烧瓶配有4叶片搅拌器、通入光气和氮气的入口、排放气体的出口以及温度计。在室温下搅拌混合物。在大气压下,向该烧瓶内通入1.28摩尔光气10小时,然后通入氮气2小时以馏出溶解的光气和盐酸气体,获得透明均质的反应溶液。对该反应溶液的气相色谱(gc)分析表明,chdc的质量比为49%,反应收率为86%。
将121g(1.28摩尔)苯酚溶解于121g二氯甲烷中制成苯酚溶液。当上述反应溶液中馏出的二氯甲烷达到其原始供应量的50%质量百分比时,通过滴液漏斗向该反应溶液中滴加苯酚溶液2小时,然后搅拌该混合物1小时。在反应结束时,二氯甲烷已从反应溶液中馏出,获得的粗制dpcd通过在乙醇中重结晶而提纯。该重结晶的dpcd在真空中90℃温度下干燥24小时,得到154gdpcd。所获得的dpcd的1hnmr图谱如图1所示。反应收率为82%,气相色谱分析表明,dpcd的纯度为99.92%。在上述反应条件下,顺/反异构体的质量比变为82/18。
制备例2:由chda制备dpcd
重复制备例1中的步骤以制备dpcd,区别在于:除chda和二氯甲烷外,还加入1.27g(0.017摩尔)二甲基甲酰胺作为有机催化剂。反应收率为82%,dpcd的气相色谱分析表明其纯度为99.9%。在上述反应条件下,顺/反异构体的质量比变为82/18。
制备例3:由chda制备dpcd
将30g(0.17摩尔)具有顺/反异构体质量比为88/12的chda(sk化工)以及300gchdc加入到1l四颈圆底烧瓶,该四颈圆底烧瓶配有4叶片搅拌器、通入光气和氮气的入口、排放气体的出口以及温度计。在室温下搅拌混合物。在大气压下,向该烧瓶内通入0.37摩尔光气5小时,然后通入氮气2小时以馏出溶解的光气和盐酸气体,获得透明均质的反应溶液。对该反应溶液的气相色谱(gc)分析表明,该chdc的质量比为99%,反应收率为94%。
将32g(0.34摩尔)苯酚溶解于32g二氯甲烷中制成苯酚溶液。通过滴液漏斗向该反应溶液中滴加苯酚溶液2小时,然后搅拌该混合物1小时。在反应结束时,chdc和二氯甲烷已从反应溶液中馏出,获得的粗制dpcd通过在乙醇中重结晶而提纯。该重结晶的dpcd在真空中90℃温度下干燥24小时,得到50gdpcd。dpcd的反应收率为88%,气相色谱分析表明,dpcd的纯度为99.96%。在上述反应条件下,顺/反异构体的质量比变为82/18。
制备例4:由dmcd制备dpcd
将100g(0.50摩尔)具有顺/反异构体质量比为77/23的dmcd(sk化工)以及2.0g(0.015摩尔)氯化铝加入到1l四颈圆底烧瓶,该四颈圆底烧瓶配有4叶片搅拌器、通入光气和氮气的入口、排放气体的出口以及温度计。在室温下搅拌混合物。在大气压下,向该烧瓶内通入1.10摩尔光气10小时,然后通入氮气2小时以馏出溶解的光气和甲基氯气,获得透明均质的反应溶液。对该反应溶液的气相色谱(gc)分析表明,该chdc的质量比为98%,反应收率为92%。
将100g(1.06摩尔)苯酚溶解于100g二氯甲烷中制成苯酚溶液。通过滴液漏斗向该反应溶液中滴加苯酚溶液2小时,然后搅拌该混合物1小时。在反应结束时,二氯甲烷已从反应溶液中馏出,获得的粗制dpcd通过在乙醇中重结晶而提纯。该重结晶的dpcd在真空中90℃温度下干燥24小时,得到150gdpcd。dpcd的反应收率为92%,气相色谱分析表明,dpcd的纯度为99.94%。在上述反应条件下,顺/反异构体的质量比变为79/21。
实施例1:生物基聚碳酸酯的制备
在5l台式反应器中加入1,995g(13.7摩尔)异山梨醇(“isb”;roquettefreres)、443g(1.37摩尔)从制备例1中获得的dpcd、2,632g(12.3摩尔)dpc(changfeng)以及6.1×10-4g(1.9×10-3毫摩尔)催化剂碳酸铯(cs2co3)进行缩聚反应。混合物加热到150℃。一旦温度达到150℃,气压下降到400托,然后提高温度在1小时内上升到190℃。在升温过程中,产生了该缩聚反应的副产物苯酚。当温度达到190℃时,气压下降到100托并保持20分钟,然后将温度在20分钟内上升至230℃。一旦温度达到230℃,气压下降到10托,将温度在10分钟内上升到250℃,然后气压在250℃下降低到等于或小于1托,反应持续,直到达到目标搅拌力矩。当达到目标搅拌力矩时,反应终止。聚合产物加压后呈股状形式排出,该股状聚合物在水浴中快速冷却并被切成片状。所获得的终产物聚合链中的环己烷二羧酸酯单元的顺/反异构体的质量比变为70/30。与初始材料dpcd相比,顺式异构体的含量降低,而反式异构体的含量增加。所制备的生物基聚碳酸酯的tg为162℃,iv值为0.62dl/g。终产物的1hnmr图谱以及红外光谱如图3和图4所示。
实施例2-6:生物基聚碳酸酯的制备
重复实施例1中的步骤,区别在于:采用表1中所列的原料制备聚合物。
对比例1:从chdm制备生物基聚碳酸酯
重复实施例1中的步骤以制备生物基聚碳酸酯,区别在于:在加入dpcd和dpc的同时,还加入了10.1g(0.07摩尔)chdm(sk化工)和92.1g(0.63摩尔)异山梨醇(roquettefreres)。所获得的终产物聚合链中的环己烷二羧酸酯单元的顺/反异构体的质量比变为38/62。所制备的生物基聚碳酸酯的tg为129℃,iv值为0.51dl/g。
对比例2:异山梨醇均聚碳酸酯的制备
重复实施例1中的步骤以制备异山梨醇均聚碳酸酯,区别在于:加入150.0g(0.7摩尔)dpc(aldrich),而不加入dpcd。所制备的异山梨醇均聚碳酸酯的tg为160℃,iv值为0.49dl/g。
对比例3:异山梨醇/dpcd均聚酯的制备
重复实施例1中的步骤以制备异山梨醇/dpcd均聚酯,区别在于:加入227.1(0.7摩尔)dpcd,而不加入dpc。所获得的终产物聚合链中的环己烷二羧酸酯单元的顺/反异构体的质量比变为36/64。所制备的生物基聚碳酸酯的tg为130℃,iv值为0.46dl/g。
对比例4:ddda共聚异山梨醇聚碳酸酯的制备
重复实施例1中的步骤以制备十二烷二酸(以下简称ddda,aldrich)共聚异山梨醇聚碳酸酯,区别在于:以32.2g(0.14摩尔)ddda代替dpcd,并加入120.0g(0.56摩尔)dpc(aldrich)。所制备的ddda共聚异山梨醇聚碳酸酯的tg为121℃,iv值为0.34dl/g。
对比例5:顺式异构体含量高的生物基聚碳酸酯的制备
重复实施例1中的步骤以制备生物基聚碳酸酯,区别在于:加入97.3g(0.3摩尔)dpcd,该pdcd的顺/反异构体的比值为90/10。所获得的终产物聚合链中的环己烷二羧酸酯单元的顺/反异构体的质量比变为85/15。所制备的生物基聚碳酸酯的tg为113℃,iv值为0.37dl/g。
<透光率的测定>
根据astmd1003,测定厚度为4mm的挤塑片材的透光率。
<拉伸强度的测定>
根据astmd638测定拉伸强度。
<弯曲强度的测定>
根据astmd790测定弯曲强度。
<冲击强度的测定>
根据astmd256,在室温下对切口样品进行冲击强度测定。
<热变形温度的测定>
根据astmd648,在1.80mpa的载荷下测定热变形温度。
<铅笔硬度的测定>
根据astmd3502,通过铅笔硬度测试仪测定铅笔硬度。
实施例1-6以及对比例1-5中所获得的聚合物样品的组分和特性如表1所示。
表1
如表1所示,根据本发明所述的方法,由化学式3所示的1,4-二苯基-环己烷二羧酸酯(dpcd)所制备的生物基聚碳酸酯具有优于传统的二醇改性的异山梨醇聚碳酸酯的耐热性、表面硬度和冲击强度。
在对比例4中,由于长链脂肪族二羧酸的存在导致光弹性系数的增加,透光率从高透明的聚(甲基丙烯酸甲酯)(简称为pmma)的级别降低到基于bpa的聚碳酸酯商品级别。并且还发现玻璃化转变温度比较低。
尤其是,在对比例5中,由于聚合物链中环己烷二羧酸酯单元的顺式异构体的含量高,其玻璃化转变温度相比例1有显著地下降。另外还注意到,其透光率比较低。
相应地,本发明的制备生物基聚碳酸酯的方法,可根据目标性质,通过调整碳酸酯键和酯键的比例,从而控制生物基聚碳酸酯的性质。另外,本发明方法所制备的生物基聚碳酸酯具有高耐热性和高透明度,因此可以被利用在多种应用中,如:汽车玻璃替代物、光学透镜或光学膜、奶瓶、食品容器等。
- 还没有人留言评论。精彩留言会获得点赞!