固体形式的还原甲萘醌的制作方法
本发明涉及固体形式的还原甲萘醌(menaquinols),其特征在于对于氧化具有特别高的稳定性,从而使其能够真正有效地用于预防与维生素k有关的心血管疾病、骨代谢和炎症过程。
背景技术:
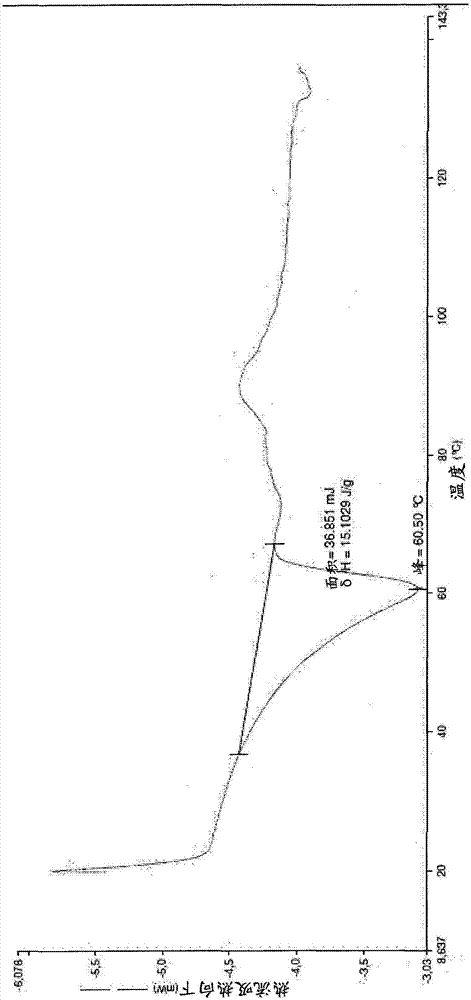
:甲萘醌是一类分子,其作为一个整体构成维生素k2的组成成分。在它们的最常见的氧化形式中,甲萘醌具有下列通式(i):其中n为0或者为1-11的整数。它们在异戊二烯单元(式i的括号中所示的分子的一部分)数目方面不同,其数目范围可以为0-11,但是最常见的形式的范围为4-7,分别涉及甲萘醌-4(mk-4)、mk-5、mk-6和mk-7。甲萘醌mk-4和mk-7是最常见的,是食品市场上可获得的两种。维生素k2的主要食物来源是鸡蛋、乳制品、肝脏和发酵大豆。维生素k的治疗用途,特别是维生素k2的治疗用途,描述于多个专利和科学出版物中,应用范围从心血管领域(m.k.shea等,am.j.clin.nutr.(2009)89:1-9)到骨代谢(m.h.j.knapen等,osteoporosint(2013)24:2499-2507)。维生素k的最新应用涉及炎症领域(m.k.shea等,amjepidemiol.(2008);167(3):313-320)。然而,由于该分子的强亲脂性,无论是在食物中还是作为膳食补充剂,口服摄入后各种形式的维生素k的肠道吸收都不是很高。据认为,还原形式的还原甲萘醌维生素k2(一种更亲水的分子)可以增加维生素的吸收,正如结构相似的分子泛醇(泛醌的还原形式)已经证明的(m.evans等,j.funct.foods(2009)1(2);240)。还原甲萘醌由下列通式(ii)表示:其中n如上所定义。然而,还原甲萘醌高度不稳定,在大气氧或温和氧化剂的作用下,非常迅速地重新氧化成甲萘醌。还原形式的维生素k2的稳定性即使在惰性无氧环境中也难以保证,如在分离的干燥固体的情况下,储存在氮气环境中。含有作为活性成分的式(ii)的还原甲萘醌的药物和营养组合物描述于ep2060256a1中,其中还原甲萘醌通过在有机溶剂中用还原剂水溶液还原甲萘醌的溶液制备,随后分离相并从有机相中回收还原甲萘醌。附图说明图1:甲萘醌还原为还原甲萘醌。图2:实施例1获得的无定形还原形式的维生素k2-(mk7)的dsc热谱图。图3:实施例3、4和5获得的还原形式的维生素k2-(mk7)样品的dsc热谱图。图4:实施例2获得的还原形式的维生素k2-(mk7)样品(高熔点多晶型物)的dsc热谱图。图5:根据实施例6重结晶后获得的还原形式的维生素k2-(mk7)样品(高熔点形式)的dsc热谱图。图6:实施例2或6获得的还原形式的结晶维生素k2-(mk7)样品的ftir图谱。技术实现要素:在第一方面,本发明涉及在标准条件和晶体应力条件下具有令人惊奇的氧化稳定性的还原甲萘醌的固体形式,其使得还原甲萘醌可以有效用于使用维生素k2的最常见配方中有效使用。所述形式可以通过将甲萘醌还原为还原甲萘醌而获得,如图1所示。在本发明第一方面的一个实施方案中,所述固体形式是式(ii)的还原甲萘醌的结晶形式,其通过用连二亚硫酸钠还原式(i)的甲萘醌,然后从水中结晶获得。所述还原在由与水不混溶的溶剂(如乙酸乙酯、乙酸丁酯、甲基-四氢呋喃、二氯甲烷或二氯乙烷,优选乙酸乙酯)和连二亚硫酸钠水溶液组成的双相系统中进行,优选ph范围为3-8。该还原反应在2℃-75℃(优选20℃至25℃)的温度范围内进行。水溶液中的连二亚硫酸钠浓度范围优选为0.5-10%(重量/体积比),而在双相水+溶剂系统中的浓度范围优选为1/10至1/100,所述比例为维生素的重量和总体积(溶剂+水)的比。在还原结束时,通过蒸发除去溶剂,优选通过低压蒸发,得到含有固体的水性悬浮液,其中固体和水之间的比例范围可以为1/5至1/100,还原甲萘醌通过冷却到低于25℃的温度(优选在2℃至8℃之间,最优选在2℃至4℃之间)从水相中结晶。然后通过过滤分离本发明的还原甲萘醌的固体结晶形式,该步骤在与结晶相同的温度下操作。过滤后可以用1-10%的抗坏血酸溶液洗涤固体,在不超过40℃的温度下进行最终干燥。所述结晶过程可以在不存在其它盐的情况下进行,或者在高达1m溶解在水相中的nacl存在下进行。由此获得的还原甲萘醌(ii)的结晶形式可以通过溶解于乙醇中重结晶,通过在低于25℃的温度下加入抗坏血酸水溶液重结晶,该温度优选在2℃和8℃之间,甚至更优选为2℃-4℃之间。在本发明的第一方面的特定实施方案中,还原甲萘醌的结晶形式涉及还原甲萘醌7(其中n=6的式(ii)化合物)和还原甲萘醌4(其中n=3的式(ii)化合物)。特别地是,本发明涉及具有dsc谱的还原甲萘醌7的还原结晶形式,其中吸热峰存在于等于或大于75℃的温度下,如图4所示,ftir谱如图6所示,其中存在典型的吸收带:3340-3350cm-1处的宽峰,在2964、2916、2851处的三个典型带;在1599、1504、1326、1182、1149、1096、1046、980、950和752cm-1处的尖峰。本发明还涉及通过还原甲萘醌7得到的还原甲萘醌7的多晶型物的混合物,其在等于或大于78.4℃的温度下具有吸热峰的dsc谱,在39-45℃的范围内具有第二吸热事件,如图3所示。在本发明第一方面的另一个实施方案中,式(ii)的还原甲萘醌的固体形式可以通过式(i)的甲萘醌的酶还原而获得。芽孢杆菌属(genusbacillus)的微生物的细胞悬浮液可用于此目的;所述微生物特别可以选自:枯草芽孢杆菌(bacillussubtilis)、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)、解淀粉芽孢杆菌(bacillusamyloliquefaciens)、巨大芽孢杆菌(bacillusmegaterium)、短小芽孢杆菌(bacilluspumilus)和地衣芽孢杆菌(bacilluslicheniformis);或假单胞菌属(genuspseudomonas),特别是恶臭假单胞菌(pseudomonasputida);或大肠埃希氏菌属(genusescherichia),特别是大肠杆菌种(speciesescherichiacoli);或肠杆菌属(genusenterobacter),特别是产气肠杆菌(enterobacteraerogenes),其均可以通过常规方法制备。通常,使得微生物的细胞于28-37℃在适当的培养基中生长,例如在补充有浓度为2-6g/l的葡萄糖的lb2×中生长。在生长结束时,将液体培养基离心,用ph7.4的磷酸缓冲液洗涤细胞,然后重新悬浮于加入0.5-2.5g/l的琥珀酸钠和2-6g/l的葡萄糖的ph7.4的磷酸盐缓冲液中,以获得最终浓度为5-15g/l的细胞悬浮液。酶还原通常通过将四体积的如此获得的细胞悬浮液(优选浓度为10g/l)与一体积的在水混溶性溶剂中的甲萘醌(通常浓度为0.6-1.4g/l)混合进行。水混溶性溶剂优选选自乙醇、甲醇、异丙醇、丙酮、thf、甲基-thf、二甲基甲酰胺、二甲基乙酰胺和二甲基亚砜。将如此制备的反应混合物于28-32℃(优选于30℃)在搅拌下温育,使其免受光照,温育时间通常为2至12小时,这取决于所用的细胞浓度。在温育结束时,将含有本发明的固体形式的还原甲萘醌的反应物冻结并冷冻干燥。如此获得的冻干物可以重新悬浮于含有水和至少一种先前描述的与水不混溶的有机溶剂的两相混合物中,过滤,所述滤液通过如前所述并在实施例2中进一步说明的结晶方法回收。或者,可以将含有还原的维生素k2的反应物过滤,在含有水和至少一种先前描述的与水不混溶的有机溶剂的两相混合物中稀释,通过如前所述并在实施例2中说明的结晶方法回收。本发明还涉及含有所述固体形式的药物或营养组合物。本发明还涉及上述固体形式在制备用于治疗和/或预防与维生素k相关的心血管和骨代谢疾病以及炎症状态的药物中的用途。如在单层caco-2细胞上进行的体外吸收实验所示,本发明的通式(ii)的还原固体形式具有比相应的通式(i)的甲萘醌更高的生物利用度。通过以下实施例进一步说明本发明。实施例1(比较):获得还原形式的无定形维生素k2-(mk7)将测定值>97%的0.25g维生素k2-(mk7)在氮气下溶于20ml的thf中。向所述溶液中加入0.26g锌,将保持在氮气下的反应物加热至回流。通过hplc分析溶液,以确保维生素完全还原。23小时后,过滤反应物以除去锌粉,将滤液在真空下原位浓缩至干。该过程得到0.26g淡粉色油状物,其易于随时间变化固化,形成蜡状固体。hplc分析显示还原形式的维生素k2-(mk7)(vitamink2-(mk7)reduced)的色谱纯度为96.5%(氧化形式=3.5%)。相应的稳定性试验如表1所示。表1:维生素k2-(mk7)的低熔点多晶型物样品(无定形样品)的稳定性数据。数据表示为还原形式的初始值的百分比。时间(天)还原形式(t/t0%)0100%34%图2显示了根据本实施例获得的无定形维生素k2-(mk7)样品记录的dsc热谱图。实施例2:获得还原形式的结晶维生素k2-(mk7)将测定值>97%的5g维生素k2-(mk7)溶于250ml乙酸乙酯中。向所述溶液中加入用硫酸调节至ph=4的连二亚硫酸钠水溶液(250ml,4.76g连二亚硫酸钠),保持在氮气环境中并剧烈搅拌。通过hplc分析溶液,以确保维生素完全还原。3小时后反应完成。将反应物于40℃真空浓缩,直至得到水性悬浮液。将所述悬浮液冷却至4℃,然后通过布氏漏斗过滤;用1%抗坏血酸水溶液洗涤滤饼,得到湿的固体,将其于40℃真空(85-10mbar)干燥过夜。干燥后收集4g还原形式的维生素k2-(mk7)。hplc分析显示还原形式的维生素k2-(mk7)的色谱纯度为98.5%(氧化形式=2.5%),kf=5.0%。稳定性试验如表2所示。表2:维生素k2-(mk7)的高熔点结晶多晶型物样品的稳定性数据,表示为还原形式的初始值的百分比包装t=0t=1个月t=2个月t=3个月alu/真空100%95.4%98.9%97.9%实施例3:获得还原形式的维生素k2-(mk7)(多晶型物的混合物)将测定值>97%的1g的维生素k2-(mk7)溶于60ml乙酸乙酯中。向该溶液中加入用硫酸调节至ph=4的连二亚硫酸钠溶液(60ml水,2.4g连二亚硫酸钠)中,保持在氮气环境中并剧烈搅拌。通过hplc分析溶液,以确保维生素完全还原。3小时后反应完成。将反应物质置于分液漏斗中,分离两相,将上相保持在氮气环境中。将所述相转移到旋转蒸发器中并立即置于真空下以除去溶剂直至干燥(40℃,10mbar,直至获得油状残留物)。将100ml抗坏血酸水溶液加至油状残留物中,将混合物保持在氮气环境下并于20-25℃剧烈搅拌5-30分钟。然后将混合物在室温(20-25℃)下通过布氏漏斗过滤;用1%抗坏血酸水溶液洗涤滤饼,得到0.5g还原的维生素k2-(mk7)。hplc分析显示还原形式的维生素k2-(mk7)的色谱纯度为81.6%(氧化形式=18.4%)。dsc分析显示于43.7℃和76.3℃存在两个吸热峰。实施例4:获得还原形式的维生素k2-(mk7)(多晶型物的混合物)将1g的维生素k2-(mk7)通过实施例1中所述方法还原。将100ml水加至油状残留物中,将反应物保持在氮气环境中于20-25℃持续搅拌。然后在氮气环境中过滤形成的悬浮液(深粉红色),获得相应于还原形式的维生素k2-(mk7)的固体(hplc纯度为维生素k2-(mk7)81.6%,氧化形式的为18.4%)。稳定性试验如表3所示。表3:维生素k2-(mk7)的多晶型的混合物样品的稳定性数据时间(天)%还原形式的维生素%氧化形式的维生素081.58%18.41%376.24%23.67%663.16%36.69%1048.27%51.48%1147.04%52.67%1238.44%61.09%dsc分析检测在43.6℃和78.4℃处存在两个吸热峰(图3)。实施例5:获得还原形式的维生素k2-(mk7)(多晶型物的混合物)通过实施例2中所述的方法,还原1g维生素2-(mk7)。完成还原后,将反应物在真空(10mbar残留,内部25℃)下浓缩,然后将形成的乳状悬浮液通过布氏漏斗过滤,用1%抗坏血酸溶液洗涤。将获得的固体在40℃真空干燥过夜(40℃,5mbar),得到0.76g淡粉红色固体。hplc分析显示还原形式的维生素2-(mk7)的色谱纯度为93.7%(氧化形式=6.3%),kf=3.0%。dsc分析检测在43.7℃和79.8℃处存在两个吸热峰。实施例6将根据实施例2中所述方法获得的2g维生素2-(mk7)(还原形式的维生素纯度=96.5%)溶解于2ml无水乙醇中。向该溶液中滴加10%抗坏血酸水溶液(100ml),于2-8℃氮气环境中保持搅拌。因此,维生素e沉淀,然后在氮气环境中过滤形成的悬浮液,得到对应于维生素k2-(mk7)的固体(hplc纯度为维生素2-(mk7)96.3%,氧化形式为4.7%)。实施例7根据实施例2中所述方法还原0.3g维生素k2-(mk7)。在反应结束时,将获得的固体再溶于乙醇(1.5ml)中并冷却至5℃。将沉淀的固体在氮气环境中于5℃保持12小时;然后将沉淀物过滤,于40℃真空干燥,得到0.2g微黄白色固体(纯度:还原形式的维生素为10.7%,氧化形式的为88.7%)。实施例8将枯草芽孢杆菌细胞于30℃、o/n环境中在补充有葡萄糖(3g/l)的lb2×培养基(酪蛋白胰蛋白胨20g/l,酵母提取物10g/l,氯化钠10g/l)中生长。在生长结束时,将液体培养基离心,用50mmph7.4的磷酸盐缓冲液洗涤细胞,并重新悬浮于加入琥珀酸钠(1g/l)和葡萄糖(5g/1)的50mmph7.4的磷酸盐缓冲液中,得到终浓度为10g/l的细胞悬浮液。将8ml该悬浮液与在dmso中制备的2ml维生素k2-mk7溶液(浓度为1g/l)混合。向如此制备的反应混合物中充入惰性氮气,于30℃、搅拌下温育24小时。通过hplc分析检测甲萘醌向还原甲萘醌的还原。在温育4小时后,检测到还原形式的维生素k2-(mk7)达到最大浓度,对应于93%的甲萘醌存在。在温育结束时,将反应物冻结并冷冻干燥。实施例9然后,将含有根据实施例8获得的20mg-act维生素k2-(mk7)的反应物(100ml)通过布氏漏斗过滤以除去生物质(biomass)。滤饼用20ml含有dmso的含水混合物(8/2)洗涤,将其与前述滤液合并。在氮气环境下向合并的滤液中加入10ml乙酸乙酯。将获得的溶液于5-10mbar真空浓缩,得到水性悬浮液,将其冷却至2-8℃。30分钟后,在搅拌下将悬浮液过滤,将获得的固体于40℃真空(10mbar残留)干燥。采用回收的固体(12mg)进行的hplc分析显示还原形式的维生素的纯度为82%,在83.1℃处存在吸热峰(dsc)。实施例10:在体外caco-2细胞的细胞单层上还原形式的或氧化形式的维生素k2-(mk7)的吸收将caco-2人腺癌细胞在插入微孔板的孔中的可渗透性插入物上培养以形成融合单层,其在顶端和基底外侧隔室之间具有屏障功能。通过荧光黄(低渗透性化合物)测试通路的不存在,确定该单层的完美完整性。将维生素k2-(mk7)(或者还原形式(还原甲萘醌)或氧化形式(甲萘醌))的样品溶解在乙醇中并置于顶端隔室,将1%乙醇溶液加至培养缓冲液中。培养孔中的最终溶液固定为100μm的维生素。在温育期结束时,将细胞层从插入物中取出并均质化,将匀浆离心。通过hplc测定上清液中存在的维生素的量。然后将离心沉淀物重新悬浮于1ml水中,向悬浮液中加入1.5ml异丙醇和2.5ml己烷。搅拌后,再次通过hplc分析形成的有机相,测定维生素k2(mk7)的浓度。两个值的总和用于计算由细胞层内在化的维生素的量。如表4所示,以每g匀浆中维生素的μg表示的测定值显示,在采用还原形式的维生素k2(mk7)的情况下,略微但显著较高的摄取。表4:在体外caco-2细胞的细胞单层上还原或氧化的维生素k2-(mk7)的吸收当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1