SET基因在制备诊断和/或治疗胃癌产品中的应用的制作方法
本发明属于生物技术和医学领域,具体涉及一种SET基因在制备诊断和/或治疗胃癌产品中的应用。
背景技术:
胃癌是东亚(包括中国、日本和韩国)和东欧最常见的癌症之一。过去的半个世纪胃癌的发病率和死亡率已大有减少。在发达的国家,但它依然是死亡率最高的癌症之一。在中国,大约三分之二的胃癌患者会发生转移,>50%的患者有治疗后复发风险。转移和复发是患者死亡的重要原因。蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是一种丝氨酸/苏氨酸蛋白磷酸酶,在多种细胞过程中发挥着重要作用,包括蛋白合成,信号转导,周期进程,凋亡,代谢,及应激反应等。作为肿瘤抑制因子,PP2A的活性丧失和多种肿瘤恶性转移及耐药密切相关。在肿瘤细胞中PP2A内源性抑制因子的过表达是PP2A活性丧失的重要原因。PP2A的内源性抑制因子包括CIP2A(cancerous inhibitor of protein phosphatase 2A);蛋白磷酸酶2A抑制剂-1(inhibitor of protein phosphatase2A-1,I1PP2A);蛋白磷酸酶2A抑制剂-2(inhibitor of protein phosphatase2A-2,I2PP2A)三种类型。三种PP2A抑制因子中,CIP2A研究得最为透彻,且其表达升高与多种肿瘤(包括结肺癌、乳腺癌、胃癌、白血病、结直肠癌等)的进展和转移相关。I2PP2A又称SET(patient SE translocation),目前关于其基因和蛋白表达、功能调控的机制研究尚不丰富。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点和不足,提供一种SET基因在制备诊断胃癌产品中的应用。
本发明的另一目的在于提供上述基因在制备治疗胃癌产品中的应用。
本发明的目的通过下述技术方案实现:
一种SET基因在制备诊断胃癌产品中的应用,所述的诊断胃癌产品包括:通过RT-PCR、实时定量PCR、免疫检测、原位杂交或基因芯片诊断胃癌的产品;
所述的通过RT-PCR诊断胃癌的产品包括至少一对特异扩增SET基因的引物;
所述的特异扩增SET基因的引物优选为引物SET-CDS-F和引物SET-CDS-R:
引物SET-CDS-F:5’-ACTTCCCTAACAGCATGGCCCCT-3’;
引物SET-CDS-R:5’-CTCCTTCATCCTCCTCTCCTTCC-3’。
所述的通过实时定量PCR诊断胃癌的产品包括至少一对特异扩增SET基因的引物;
所述的特异扩增SET基因的引物优选为引物SET-F和引物SET-R:
引物SET-F:5’-AAATATAACAAACTCCGCCAACC-3’;
引物SET-R:5’-CAGTGCCTCTTCATCTTCCTC-3’。
所述的通过免疫检测诊断胃癌的产品包括:与胃癌蛋白特异性结合的抗体,包括多克隆抗体和单克隆抗体;
所述的通过原位杂交诊断胃癌的产品包括:与SET基因的核酸序列杂交的探针;
所述的通过基因芯片诊断胃癌的产品包括:与SET基因的核酸序列杂交的探针;
在本发明中,可以使用一系列本领域已知的方法来制备针对SET蛋白特异的抗体。例如,将提纯的人SET基因产物或它的抗原片段注射入动物体内以产生多克隆抗体。同样,表达人SET蛋白或它的抗原片段的细胞也可以用来对动物致免疫而产生抗体。根据本发明制备的抗体也可以是单克隆抗体,这些单克隆抗体可用杂交瘤技术制备。本发明的抗体包括可以阻抑SET功能的抗体,也可以是不影响人SET功能的抗体。每一类抗体都可以通过对人SET基因产物的片段或功能域致免疫而产生,而人SET基因产物及其片段可以用重组方法产生或用多肽合成仪进行合成。与非修饰形式的SET基因产物结合的抗体,可以利用在原核细胞例如E.coli中产生的基因产物来免疫动物而得到。与翻译后修饰形式如糖基化或磷酸化SET蛋白或多肽结合的抗体,可以利用在真核细胞如酵母或昆虫细胞中产生的基因产物来免疫动物而得到。
在本发明中,所述探针可以是DNA、RNA、DNA-RNA嵌合体、PNA或其它衍生物。所述探针的长度没有限制,只要完成特异性杂交、与目的核苷酸序列特异性结合,任何长度都可以。所述探针的长度可短至25、20、15、13或10个碱基长度。同样,所述探针的长度可长至60、80、100、150、300个碱基对或更长,甚至整个基因。由于不同的探针长度对杂交效率、信号特异性有不同的影响,所述探针的长度通常至少是14个碱基对,最长一般不超过30个碱基对,与目的核苷酸序列互补的长度以15~25个碱基对最佳。所述探针自身互补序列最好少于4个碱基对,以免影响杂交效率。
一种SET基因在制备治疗胃癌产品中的应用,所述的治疗胃癌产品包括:通过RNA干扰抑制SET基因表达的双链核糖核酸、基于SET抗原蛋白的肿瘤疫苗和用于抑制SET蛋白活性的化学分子。
所述的通过RNA干扰抑制SET基因表达的双链核糖核酸优选为靶向SET基因的siRNA;所述的靶向SET基因的siRNA靶向序列为siRNA#1或siRNA#2;
所述的siRNA#1的靶向序列为:
siRNA#1:5’-AACCATCCACAAGTGTCTGCA-3’;
所述的siRNA#2的序列为:
siRNA#2:5’-AAGATGAAGAGGCACTGCATT-3’。
在本发明中,所述RNA干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象。使用RNAi技术可以特异性剔除或关闭特定基因的表达,该技术已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的基因治疗领域。以细胞为基础的RNAi筛选在功能基因学研究方面具有许多优势,主要表现在大多数细胞类型都能使用RNAi方法,并且相对较容易下调或沉默任何目的基因的表达。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明实验证明SET在胃癌组织中频繁高表达(81%),SET表达升高与胃癌病人的侵袭表型及更差预后明显相关(P<0.05)。低表达SET显著抑制胃癌细胞的迁移和侵袭。并且通过调节PP2A/Akt信号通路促进胃癌恶性转化。此外,胃癌组织中SET的蛋白水平明显高于癌旁组织。因此SET基因可作为胃癌诊断或预后判断标志物。
(2)本发明SET基因为防治胃癌提供了新的治疗靶点。
附图说明
图1为SET在MKN28、MGC803、BGC823、SGC7901四种胃癌细胞系及正常胃黏膜上皮细胞系(GES-1)中基因及蛋白表达图。
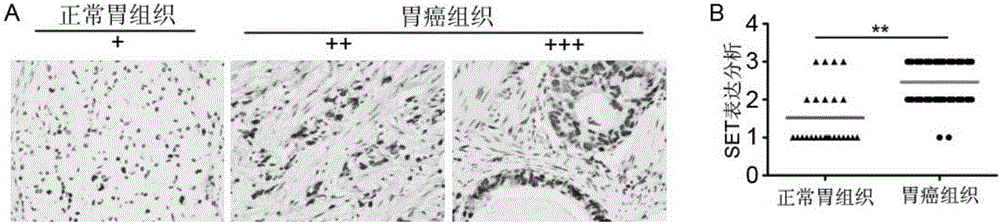
图2为胃癌患者及正常胃组织中SET表达情况分析。其中:图2A是免疫组化染色强度结果分析图;图2B为IHC检测25例正常胃组织和102例胃癌组织中SET的表达水平分析图。
图3为胃癌患者组织中SET中低表达及高表达总体生存时间比较。
图4是实施例4中增殖和侵袭实验结果分析图,NC:瞬转表达NC shRNA的胃癌细胞;shSET:瞬转SET shRNA的胃癌细胞。其中,图4A为Western blot检测胃癌细胞中shRNA对SET的干扰效果;图4B为荧光定量PCR检测胃癌细胞中shRNA对SET的干扰效果;图4C为NC组和shSET组显微镜下侵袭变化;图4D为NC组和shSET组显微镜下迁移变化。
具体实施方式
下文将结合具体附图详细描述本发明具体实施例。应当注意的是,下述实施例中描述的技术特征或者技术特征的组合不应当被认为是孤立的,它们可以被相互组合从而达到更好的技术效果。
实施例1胃癌细胞系中高表达SET
1-1、荧光定量PCR检测SET高表达于胃癌细胞系
荧光定量PCR检测MKN28、MGC803、BGC823、SGC7901四种人胃癌细胞系及正常胃黏膜上皮细胞GES-1细胞中SET基因表达水平,发现2种细胞系BGC823、SGC7901均高表达SET(见图1A)。实验重复三次。其中,荧光定量PCR检测以β-actin为内参基因,荧光定量PCR检测内参基因的PCR引物序列为:
β-actin forward primer 5'-CTCCTCCTGAGCGCAAGTACTC-3';
β-actin reverse primer 5'-TCCTGCTTGCTGATCCACATC-3'。
荧光定量PCR检测SET基因表达水平的引物为:
SET gene forward primer 5’-AAATATAACAAACTCCGCCAACC-3’;
SET gene reverse primer 5’-CAGTGCCTCTTCATCTTCCTC-3’。
1-2、Western blot检测SET高表达于胃癌细胞系
Western blot检测MKN28、MGC803、BGC823、SGC7901四种人胃癌细胞系及正常胃黏膜上皮细胞GES-1细胞中SET蛋白表达水平,发现2种细胞系BGC823、SGC7901均高表达SET(见图1B)。实验重复三次。其中,Western blot检测以β-actin为内参蛋白。*表示与GES-1细胞系相比有显著差异(*,p<0.05;**,p<0.01)。
结果分析:
利用荧光定量PCR及Western blot技术检测了4种胃癌细胞系及一种正常胃黏膜上皮细胞中SET表达水平。结果发现低分化的胃癌细胞系BGC823、SGC7901中SET表达显著高于正常细胞GES-1。
实施例2胃癌组织中SET蛋白水平高表达
免疫组化(Immunohistochemistry,IHC)技术分析及评价:
收集湖北医药学院东风总医院收治的行胃切除术病人的胃癌组织样本及癌旁组织样本为研究对象,全部病例均以电话或来院复查方式进行随访,资料完整生存期的计算是从手术日期起到末次随访日期或死亡日期。胃癌,癌旁及正常组织是在伦理委员会批准以及患者知情同意情况下获取的。所收集的胃癌标本均为病理诊断明确,且具有完整的随访资料、术前没有接受任何局部或全身治疗。结合购买胃癌组织芯片,利用免疫组化或者Western blot,检测102例胃癌及22例正常胃组织上述组织石蜡切片经烤片、梯度水化后用3%过氧化氢室温下阻断内源性过氧化物酶活性15min;10mmol/L枸橼酸盐(pH=6.0)高压热修复3min,然后5%山羊血清室温下封闭30min,抗-SET抗体4℃孵育过夜,PBS代替一抗作为阴性对照;鼠兔通用型二抗室温孵育1h后用二氨基联苯胺(DAB)染色液染色,苏木精复染,脱水,最后封片。显微镜下拍照,用ImagePro Plus(IPP)软件将组织染色强度进行评分。
结果分析:
利用IHC技术检测了102例胃癌样本及25例正常胃组织中SET蛋白表达水平。免疫组化染色强度分为低、中、高三组(图2A),其中,+:正常胃组织低表达,++及+++:分别代表胃癌组织中、高表达。与正常胃组织相比,胃癌中SET水平明显高表达,约46%(47/102)胃癌样本有高的SET染色,52%(53/102)胃癌样本为中度染色,以及2%(2/102)胃癌样本为低染色(图2B),其中,**,P<0.01。与胃癌组织对比,25例正常胃组织65%(16/25)表现为低的免疫组化染色,仅有16%(4/25)表现为高的免疫组化染色。表明SET基因在胃癌中可能作为癌基因发挥作用。
实施例3胃癌中SET高表达与高侵袭及预后不良相关
统计学处理:SPSS软件包进行统计学分析。用相关分析研究实施例2中102例胃癌样本中SET表达与临床病理参数及总体生存期之间的相关关系;Kaplan-Meier法比较上述样本中SET不同表达组之间的预后差异。
结果分析:
用相关分析、Kaplan-Meier法和Cox回归分析检测胃癌病人SET蛋白表达的临床病理和预后意义。高SET蛋白表达水平与高侵袭性肿瘤表型(如病理分级、浸润深度、淋巴结分期等)明显相关(P<0.05,表1);另外,SET高表达组的胃癌患者的总体生存时间显著低于低/中表达组患者(P<0.05,图3)。表1.SET表达水平与胃癌患者临床病理特征之间的关系。
表1 SET表达水平与胃癌患者临床病理特征之间的关系
实施例4 shRNA干扰SET显著抑制细胞增殖,同时显著抑制细胞侵袭及迁移
按照如下方法处理胃癌细胞BGC823、SGC7901及MGC803细胞,使SET低表达:
将细胞在完全培养基(含有10%胎牛血清的RPMI1640或DMEM)中于12孔板培养24小时,然后换为800μl没有血清的培养基。
A:将1μg shRNA,以及2μl P3000,溶于100μl Opti-MEM无血清培养基中,混匀。
B:将2μl lipo3000溶于100μl Opti-MEM无血清培养基中,混匀室温放置5分钟。
C:将A、B两管混合,放置5分钟。
将C管混合液加入12孔板对应孔中,转染48小时以后,用于后续实验。
本次实验使用的shRNA序列如下:
SET shRNA1-sence:
5'-CACCGCCCTTCCTGTCTGAACAAAAATTCAAGAGATTTTTGTTCAGACAGGAAGGGT TTTTTG-3';
SET shRNA1-antisence:
5'-GATCCAAAAAACCCTTCCTGTCTGAACAAAAATCTCTTGAATTTTTGTTCAGACAGGA AGGGC-3';
Negative control(NC)shRNA-sence:
5'-CACCGTTCTCCGAACGTGTCACGTCAAGAGATTACGTGACACGTTCGGAGAATTTTTT G-3'。
(NC)shRNA-antisence:
5'-GATCCAAAAAAGTTCTCCGAACGTGTCACGTAATCTCTTGACGTGACACGTTCGGAG AAC-3'。
4-1 shRNA敲低SET显著抑制细胞增殖
将上述转染了shSET 48小时后的胃癌细胞用RIPA裂解液裂解,提取蛋白,Western blot检测SET蛋白表达,验证干扰效果。图4A结果表明shSET可以显著敲低BGC823、SGC7901及MGC803三种细胞中SET表达。另外,将转染了shSET 48小时后的细胞用胰酶消化细胞,以3000个细胞/90μl的密度将细胞种于96孔板中,37℃培养44小时后,在NC和shSET两组细胞中分别再加入10μl MTT(5mg/ml),继续培养4小时,然后将含有MTT的培养基吸除,加入150μl DMSO,避光室温条件下在脱色摇床上震荡10分钟,然后在570nm下测吸光值,计算shRNA干扰SET对细胞增殖的影响。发现shRNA干扰SET后,细胞增殖明显下调(见图4B)。图中,“shNC”表示对照组,“shSET”表示shRNA干扰了SET表达的细胞。用t-Test进行差异显著性分析,*表示与shNC细胞系相比有显著差异(*,p<0.05;**,p<0.01)。
4-2 shRNA敲低SET显著抑制细胞侵袭和迁移
侵袭实验:将5×105个上述转染了shSET 48小时后的MGC803细胞加入到含有Matrigel的小室,下室培养基含有20%FBS作为趋化吸引。10小时后用棉签轻轻去除非侵袭细胞,侵袭细胞位于小室的下室面,用4%多聚甲醛固定,结晶紫染色,风干并拍照。
迁移实验:将上述转染了shSET 48小时后的MGC803细胞传代于6孔板,融合至95%以上时用200μl枪头划痕,创造出无细胞区,24小时后观察“伤口愈合”程度,并在显微镜在拍照。跟起初的间距相比,细胞迁移覆盖的比例即定义为细胞迁移率。
结果分析:敲低了SET的MGC803细胞其迁移和侵袭能力明显下降(P<0.01,图4C,4D)。
经检测,该基因SET氨基酸序列如SEQ ID NO.1所示
本文虽然已经给出了本发明的一些实施例,但是本领域的技术人员应当理解,在不脱离本发明精神的情况下,可以对本文的实施例进行改变。上述实施例只是示例性的,不应以本文的实施例作为本发明权利范围的限定。
- 还没有人留言评论。精彩留言会获得点赞!