具有对Hg2+和Cys连续选择性的不对称全氟环戊烯化合物及其制备方法和应用与流程
本发明涉及对金属阳离子和氨基酸有连续选择性的新型二芳烯荧光探针;具体地指一种具有对Hg2+和Cys连续选择性的不对称全氟环戊烯化合物及其制备方法和应用。
背景技术:
荧光探针在环境监测、食品分析、生物荧光成像、医疗诊断等领域的潜在应用越来越广泛,基于荧光探针来选择性识别客体已在分子领域获得越来越多的关注和研究。近年来,荧光探针由于其具有操作简单、高选择性和高灵敏等特点,已经被广泛的开发出来监测PH、温度、金属离子和氨基酸等。特别是对人体内的重金属离子和各种氨基酸的含量的定量分析已经迫在眉睫。然而,在这些荧光探针中,基于二芳基乙烯类的荧光分子探针已经越来越被重视。
自1988年,M.Irie等人首次报道了二芳基乙烯后,由于其良好的光致变色性能、热稳定性、抗疲劳性及响应时间快等诸多优点,二芳基乙烯成为最具应用前景的光致变色材料之一。这类化合物在总体性能上接近应用水平,使其在可擦写光存储材料和光控开关材料中具有很好的应用前景而成为研究的热点,极有可能成为新一代光子存储介质一类的光致变色物质。如今,越来越多的研究者对二芳基乙烯末端进行修饰,使其具有识别离子或者氨基酸类的良好性质。
目前,将8-羟基喹啉-2-醛基引入传统型全氟环戊烯分子中,然后对其末端的醛基进行修饰,使其具有检测阴阳离子和氨基酸的光致变色二芳烯荧光探针尚未见任何文献和专利报道。
技术实现要素:
本发明的目的就是要克服现有技术所存在的不足,提供一种具有对Hg2+和Cys连续选择性的不对称全氟环戊烯化合物及其制备方法和应用,它是具有对Hg2+和Cys有连续选择性的“开-关-开”新型二芳烯荧光探针。
为实现上述目的,本发明所设计的具有对Hg2+和Cys连续选择性的不对称全氟环戊烯化合物,其特征在于:[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-苯基)-(2-甲酰基喹啉-8-苯并噻唑基)-3-噻吩基)]全氟环戊烯的结构式如式1所示:
上述的具有对Hg2+和Cys连续选择性的不对称全氟环戊烯化合物的制备方法,按照以下步骤进行:
1)以式2化合物苯并噻吩为原料,首先在氮气及195K丙酮浴条件下,通过碘甲烷取代苯并噻吩上的氢原子得到式3化合物2-甲基苯并噻吩,然后在冰浴条件下溴化得到式4化合物2-甲基-3-溴苯并噻吩,继而在正丁基锂作用下,将2-甲基-3-溴苯并噻吩与全氟环戊烯反应生成式5化合物单取代的全氟环戊烯;
2)以式6化合物2-甲基噻吩为原料,在冰浴条件下溴化,然后通过正丁基锂与硼酸三丁酯反应,生成式8化合物2-甲基-3-溴-5-硼酸基噻吩,以三苯磷钯作催化剂,通过Stuzki偶联反应将末端含醛基苯与噻吩环连接起来得到,然后在甲苯溶剂中,通过加热回流将式9化合物3-溴-2-甲基-5-(4-醛基-苯基)噻吩中的醛基用乙二醇保护得到式10化合物3-溴-2-甲基-5-[4-(1,3-二氧戊环基)-苯基]噻吩;
3)将步骤1)得到的式5化合物与步骤2)得到的式10化合物在正丁基锂的作用下低温反应得到不对称双取代的全氟环戊烯;
4)在丙酮与水的混合溶剂中,将步骤3)中得到的不对称双取代的全氟环戊烯中的缩醛还原成醛基,进一步在四氢呋喃中用硼氢化钠将醛基还原成醇羟基的式12化合物的不对称双取代的全氟环戊烯;
5)在冰水浴下,使用溴化锂和甲磺酰氯与步骤4)得到的式12化合物反应,使全氟环戊烯中的羟基变成式13化合物含亚甲基溴的不对称双取代的全氟环戊烯;
6)在精制乙腈溶剂中,将步骤5)得到的式13化合物与8-羟基喹啉-2-醛基反应生成式14化合物不对称全氟环戊烯中间体;
7)最后在乙醇溶剂中,将步骤6)得到的式14化合物与2-氨基苯硫酚反应,从而得到如式1所示的目标化合物;
其合成路线如下:
本发明的有益效果在于:本发明将8-羟基喹啉-2-醛基引入传统型全氟环戊烯分子中,然后对其末端的醛基进行修饰,使其具有检测阴阳离子和氨基酸的光致变色二芳烯荧光探针。
本发明合成的具有对Hg2+和Cys连续选择性的不对称全氟环戊烯化合物的用途有:作为构建荧光探针的光开关分子骨架;实用于超高密度、可擦写有机光子型信息存储材料;用于制备光控开关元件;用于制备光致变色发光器件,可用于防伪技术等。
本发明合成的不对称全氟环戊烯化合物的优点主要有以下几个方面:
1、选用该类化合物作为构建荧光生物探针的光开关分子骨架,这对于研究生物系统具有重要的价值。
2、这种新型二芳基乙烯类光致变色化合物在溶液中均可保持良好的光致变色性能,并且溶液中的开环态和闭环态均具很好的化学和热稳定性、显著的抗疲劳性、较高的环化量子产率、较强的荧光性能和很好的灵敏度等优越性能。
3、本发明可用于连续检测特定离子和氨基酸,其选择性非常优良,特别是将来可应用于体内定性检测离子和氨基酸。
4、本发明的含8-羟基喹啉基团的不对称全氟环戊烯类二芳烯光致变色材料成功用于高密度全息光存储,其存储属性为可擦写光子型存储。
附图说明
图1为本发明目标化合物的光致变色反应原理示意图。
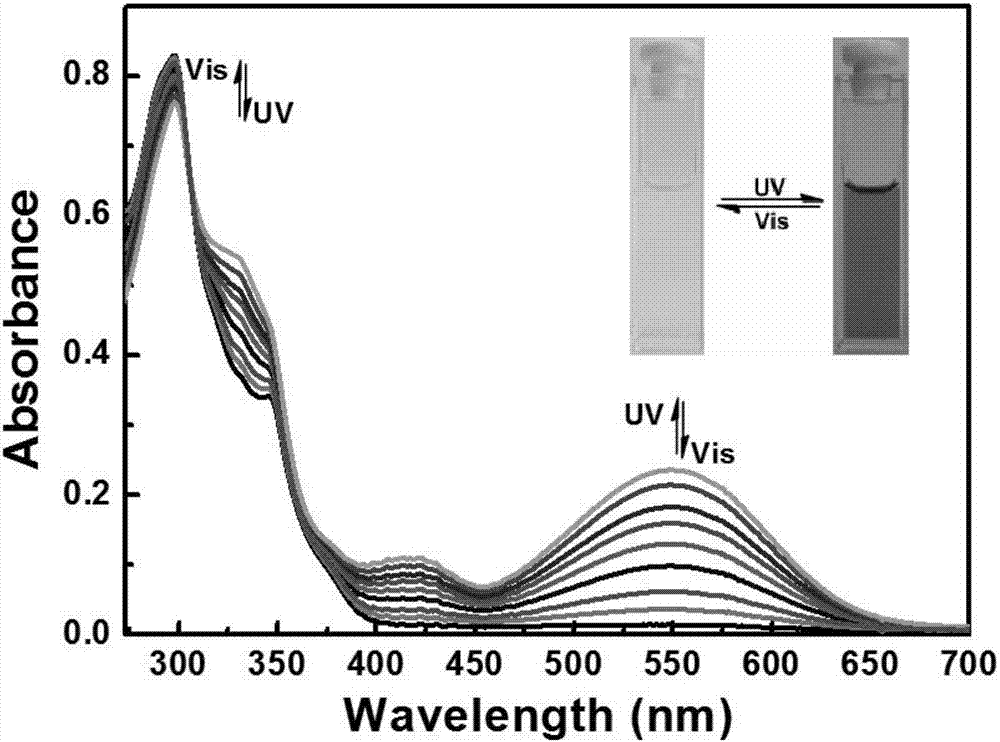
图2为化合物在四氢呋喃中紫外光照射前后的吸收光谱图。
图3为化合物在四氢呋喃中光照前后的荧光光谱图。
图4为化合物在四氢呋喃溶液中对金属离子的识别及其荧光光谱图。
图5为化合物在四氢呋喃溶液中对氨基酸Cys的识别及其荧光光谱图。
具体实施方式
为了更好地解释本发明,以下结合附图和具体实施例对本发明作进一步的详细说明,但它们不对本发明构成限定。
实施例1
本发明具有对Hg2+和Cys连续选择性的不对称全氟环戊烯化合物为:[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-苯基)-(2-甲酰基喹啉-8-苯并噻唑基)-3-噻吩基)]全氟环戊烯,结构式如式1所示:
其合成路线如下:
具体合成步骤如下所述:
1)将式2化合物苯并噻吩(2.68g,20mmol)溶于精制的四氢呋喃中,在氩气及195K条件下搅拌,缓慢注入2.4mol/L的正丁基锂(9.75mL,23mmol),继续低温反应半小时。将碘甲烷(3mL,23mmol)注入到反应瓶中,继续将反应混合物在低温下搅拌一小时,自然升至室温,加入适量水终止反应。分液并用二氯甲烷萃取。合并有机相,旋蒸,去溶剂,干燥。残余物用石油醚硅胶柱色谱分离得到无色固体2.67g,产率:90%。结构鉴定:1H NMR(400MHz,CDCl3,ppm):δ2.59(s,3H),6.97(s,1H),7.24(t,1H,J=7.8Hz),7.29(t,1H,J=7.6Hz),7.65(d,1H,J=8.0Hz),7.74(d,1H,J=8.0Hz)。结构鉴定为式3化合物:2-甲基苯并噻吩。
在冰水浴条件下,以式3化合物(2.67g,18mmol)为原料溶于乙酸中,在搅拌状态下缓慢匀速加入N-溴代丁二酰亚胺(3.20g,18mmol),继续冰浴反应24小时,加水终止反应,分离有机相和水相,水相用氢氧化钠中和后,再用二氯甲烷萃取,合并前后的有机相,再用饱和碳酸钠溶液洗涤3次,无水硫酸钠干燥,用石油醚硅胶柱色谱分离得到白色固体3.52g,产率:86%。结构鉴定:1H NMR(400MHz,CDCl3,ppm):δ2.56(s,3H),7.32(t,1H,J=6.6Hz),7.41(t,1H,J=6.6Hz),7.72(t,2H,J=6.6Hz)。结构鉴定为式4化合物:2-甲基-3-溴苯并噻吩。
在温度控制在195K的低温反应仪中,在氩气保护的环境下,将2-甲基-3-溴苯并噻吩(3.40g,15mmol)溶于精制的四氢呋喃中.在快速搅拌下注入2.4mol/L正丁基锂(7.31mL,17.25mmol),反应0.5h;在高速搅拌下快速注入全氟环戊烯(2.25mL,17.25mmol),继续反应1.0h后自然升至室温,然后加入适量水终止反应。旋掉溶剂,用二氯甲烷萃取,合并有机相,分别用饱和食盐水和蒸馏水洗涤3次,无水硫酸钠干燥过夜。真空旋转蒸发除去溶剂,以石油醚为洗脱液,用硅胶柱分离提纯,得到无色透明固体产物3.83g,产率:75%。结构鉴定:1H NMR(400MHz,CDCl3,ppm):δ2.49(s,3H),7.29(m,2H),7.34(d,1H,J=8.0Hz),7.42(d,1H,J=8.0Hz)。结构鉴定为式5化合物:1-[2-甲基-3-苯并噻吩基]全氟环戊烯。
2)在零度温度下,用120.0mL冰醋酸将式6化合物2-甲基噻吩(24.50g,250.00mmol)溶解后置入250.0mL的单口瓶,快速搅拌下,通过恒压漏斗将30.0mL液溴和30.0mL冰醋酸混合液慢慢加入其中,用5h慢慢滴完,再继续反应12h,反应完毕后加入100.0mL水终止反应,使有机相并水相分开,用氢氧化钠溶液将水相调至pH=7左右,再用乙醚萃取,合并所有的有机相,最后用饱和的碳酸钠分3次洗涤,加入无水干燥12h,通过减压蒸馏的手段得到淡黄色产物54.20g,产率:82%。结构鉴定:1H NMR(400MHz,CDCl3,ppm):δ2.30(s,3H),6.80(s,1H)。结构鉴定为式7化合物:3,5-二溴-2-甲基噻吩。
采用液氮降温技术使温度控制在195K,将3,5-二溴-2-甲基噻吩(19.18g,75.00mmol)加入到精制的乙醚中,快速搅拌下,慢慢注入浓度为2.4mol/L的n-BuLi(32.26mL,84.00mmol),低温反应0.5h后,缓慢滴入硼酸三丁酯(20.2mL,75.00mmol),反应2h后,加入50.0mL的4%盐酸溶液使反应停止,分液,有机相再用4%氢氧化钠溶液萃取3次,合并所有水相后快速加入10%盐酸溶液酸化并剧烈搅拌,直至白色絮状沉淀完全析出,抽滤,白色絮状沉淀物用4%盐酸溶液洗涤,室温完全干燥后,得到淡黄色固体11.23g,产率:66%。产物的结构分析如下:1H NMR(400MHz,CDCl3,ppm):δ2.50(s,3H,-CH3),4.79(s,2H,-OH),7.74(s,1H,thiophene-H)。结构鉴定为式8化合物:2-甲基-3-溴-5-硼酸基噻吩.
Pd(PPh3)4催化剂的制备:在100mL的三颈烧瓶中,将氯化钯(0.15g)和三苯基膦(1.63g)溶于14.7mL二甲基亚砜中,氩气氛围下,温度加热到75℃时就封闭反应体系,然后继续升温至108℃,至瓶内的溶液全部变至澄清后,加入1.5mL的水合肼,冷却到室温后抽滤,再用无水乙醇和乙醚不断冲洗,得到亮黄色的最终产物。
在250.0mL的三颈烧瓶中,氩气氛围下,将4-醛基溴苯(2.23g,12.12mmol)溶于100.0ml四氢呋喃溶液中,加入刚刚准备的0.13g的Pd(PPh3)4催化剂,室温下搅拌大概20min,分别加入式8化合物2-甲基-3-溴-5-硼酸基噻吩(3.10g,13.84mmol)和60.0mL(2.0mol L-1)的碳酸钠水溶液,回流后继续反应约12h,终止反应,悬去溶液,再用二氯甲烷萃取数次,用饱和食盐水和蒸馏水分别洗涤3次所得有机相,用无水硫酸钠干燥12h。以石油醚/乙酸乙酯(v/v=20:1)为洗脱液,通过硅胶柱分离纯化,产物为淡黄色固体8.09g,产率:55%。产物的结构分析如下:1H NMR(400MHz,CDCl3,ppm):δ2.45(s,3H,-CH3),7.27(s,1H,thienyl-H),7.67(d,2H,J=6.4Hz,phenyl-H),7.88(d,2H,J=6.8Hz,phenyl-H),10.00(s,1H,-CHO)。结构鉴定为式9化合物:3-溴-2-甲基-5-(4-醛基-苯基)噻吩。
在250.0mL单口烧瓶中加入式9化合物3-溴-2-甲基-5-(4-醛基-苯基)噻吩(3.37g,12.00mmol)、对甲基苯磺酸(0.553g)和乙二醇(3.7ml),并将它们溶到135.0mL甲苯中,装置连上分水器,快速搅拌,回流反应持续24h,加水终止反应,旋溶剂,用二氯甲烷萃取数次,用饱和的氯化钠溶液洗涤有机相数次,再用无水硫酸钠干燥12h,除去溶剂,以石油醚/乙酸乙酯(v/v=20:1)为洗脱液,通过硅胶柱分离纯化,共得黄色固体3.70g,产率:95%。产物的结构分析如下:1H NMR(400MHz,CDCl3,ppm):δ2.42(s,3H,-CH3),4.05–4.16(m,4H,1,3-dioxolane-H),5.82(s,1H,1,3-dioxolane-H),7.13(s,1H,thiophene-H),7.47–7.54(m,4H,phenyl-H)。结构鉴定为式10化合物:3-溴-2-甲基-5-[4-(1,3-二氧戊环基)-苯基]噻吩。
3)在氩气保护后及液氮丙酮浴条件下,将步骤2)得到的式10化合物3-溴-2-甲基-5-[4-(1,3-二氧戊环基)-苯基]噻吩(1.63g,5.00mmol)溶于40.0mL精制四氢呋喃.搅拌中注射2.4mol/L正丁基锂(2.33ml,5.50mmol),低温反应0.5h后滴加步骤1)得到的式5化合物1-[2-甲基-3-苯并噻吩基]全氟环戊烯(1.70g,5.00mmol),继续低温反应2h,自然升至室温后加入适量水终止反应。旋掉溶剂,用二氯甲烷萃取,合并有机相,再旋蒸除去溶剂,真空干燥后,用硅胶柱色谱石油醚/乙酸乙酯(v/v=10:1)分离提纯,得到黄色液体1.70g,产率:60%,即不对称双取代的全氟环戊烯;
4)将步骤3)中得到的不对称双取代的全氟环戊烯全部溶于50.0mL丙酮,20.0mL水,2.0mL吡啶和0.57g的p-TsOH,搅拌,80℃回流过夜后分液,二氯甲烷萃取,有机相依次用饱和碳酸氢钠溶液和水洗涤,无水硫酸钠干燥。蒸馏除去溶剂,真空干燥。硅胶柱色谱石油醚/乙酸乙酯(v/v=6:1)分离提纯得无色固体1.41g,产率:90%,产物结构鉴定:1H NMR(400MHz,CDCl3):δ1.98(s,3H,-CH3),2.31(s,3H,-CH3),7.26(s,1H,thiophene-H),7.31–7.36(m,2H,benzothiophene-H),7.55–7.57(d,3H,J=8.0Hz,benzene-H),7.73–7.75(d,1H,J=4.0Hz,benzene-H),7.83–7.85(d,2H,J=8.0Hz,benzene-H),9.98(s,1H,-CHO)。结构鉴定为式11化合物:[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-醛基苯基)-3-噻吩基)]全氟环戊烯。
将式11化合物(1.41g,2.7mmol)用四氢呋喃溶于250.0mL单口烧瓶中,加入0.1g的NaBH4,加热回流,TLC点板跟踪至反应结束。二氯甲烷萃取,无水硫酸钠干燥。蒸馏除去溶剂,真空干燥。硅胶柱色谱石油醚/乙酸乙酯(v/v=4:1)分离提纯得白色粉末固体1.20g,产率:85%,结构鉴定:1HNMR(400MHz,CDCl3):δ1.93(s,3H,-CH3),2.30(s,3H,-CH3),4.69(s,2H,-CH2),7.17(s,1H,thiophene-H),7.29-7.35(m,4H,benzene-H),7.48(d,2H,J=8.0Hz,benzothiophene-H),7.57(d,1H,J=8.0Hz,benzene-H),7.74(d,1H,J=8.0Hz,benzene-H)。结构鉴定为式12化合物:[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-羟基苯基)-3-噻吩基)]全氟环戊烯。
5)在冰浴条件下,将步骤4)得到的式12化合物(1.20g,2.30mmol),LiBr(1.20g,13.8mmol)溶于精制的四氢呋喃溶液中,搅拌10min至完全溶解,将用精制的二氯甲烷稀释的三乙胺(0.28g,2.76mmol)、甲磺酰氯(0.21g,1.84mmol)依次注入反应体系,反应半小时后升至室温继续反应12小时。旋干溶剂,用二氯甲烷萃取数次,无水硫酸钠干燥,硅胶柱色谱石油醚/乙酸乙酯(v/v=10:1)分离提纯得白色固体1.22g,产率:90%,结构鉴定:1HNMR(400MHz,CDCl3):δ1.93(s,3H,-CH3),2.29(s,3H,-CH3),4.58(s,2H,-CH2),7.16(s,1H,thiophene-H),7.30-7.39(m,6H,benzene-H,benzothiop hene-H),7.55(d,1H,J=8.0Hz,benzene-H),7.73(d,1H,J=8.0Hz,benzene-H)。结构鉴定为式13化合物:[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-溴苯基)-3-噻吩基)]全氟环戊烯。
6)将步骤5)得到的式13化合物(1.18g,2.00mmol)溶于精制的乙腈溶液中,依次加入8-羟基喹啉-2-醛基(0.35g,2mmol),碳酸钾(0.67g),加热回流12小时。反应结束后,抽虑,旋蒸去溶剂,无水硫酸钠干燥,抽虑,旋蒸去溶剂,硅胶柱色谱石油醚/乙酸乙酯(v/v=6:1)分离提纯得白色粘稠状固体0.61g,产率:45%,结构鉴定:1HNMR(400MHz,CDCl3):δ2.22(s,3H),2.34(s,3H),5.50(s,2H),7.15(d,2H,J=8.0Hz),7.22(d,2H,J=8.0Hz),7.28-7.49(m,3H),7.50-7.63(m,4H),7.75(d,1H,J=8.0Hz),8.11(d,1H,J=8.0Hz),8.29(d,1H,J=8.0Hz),10.35(s,1H)。结构鉴定为式14化合物:[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-苯基)-(2-甲酰基喹啉-8-醛基)-3-噻吩基)]全氟环戊烯。
7)将步骤6)得到的式14化合物(0.34g,0.50mmol)和0.06g的2-氨基苯硫酚溶于乙醇溶液中,加热回流8小时,反应结束后冷却至室温,有浅褐色的粉末固体析出,用乙醇和石油醚多次洗涤得纯物质0.31g,产率:80%。结构鉴定:
1HNMR(400MHz,CDCl3):δ1.93(s,3H),2.31(s,3H),5.46(s,2H),7.13-7.21(m,1H),7.24(s,1H),7.30-7.40(m,3H),7.47-7.51(m,2H),7.53-7.59(m,4H),7.67(d,2H,J=8.0Hz),7.75(d,1H,J=7.7Hz),8.02(d,1H,J=7.7Hz),8.14(d,1H,J=8.1Hz),8.30(d,1H,J=8.5Hz),8.53(d,1H,J=8.6Hz)。13C NMR(CDCl3,100MHz),δ(ppm):14.82,14.89,71.06,112.08,118.73,120.35,120.49,122.06,122.09,122.13,122.18,122.57,123.77,124.51,124.95,125.19,125.58,125.73,125.84,126.27,127.70,127.92,130.36,132.78,136.60,136.97,137.04,138.22,140.45,141.58,141.69,142.49,150.21,154.46.
结构鉴定为如式1所示的目标化合物:[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-苯基)-(2-甲酰基喹啉-8-苯并噻唑基)-3-噻吩基)]全氟环戊烯。
应用例1
本发明所制得的目标化合物的光致变色反应原理示意图如图1所示。当紫外光(λ=297nm)照射[1-[2-甲基-3-苯并噻吩基],2-(2-甲基-5-(4-苯基)-(2-甲酰基喹啉-8-苯并噻唑基)-3-噻吩基)]全氟环戊烯的乙腈溶液时,无色的开环态的式1o化合物可生成紫红色的闭环态的式1c化合物。相反的,当用可见光区波长照射时,闭环态的式1c化合物转变成开环态的式1o化合物。
在室温下,化合物1o在四氢呋喃溶液(2×10-5mol·L-1)中光照前后的紫外光谱和颜色变化如图2所示。1o的开环状态是无色的,光照前,1o的开环吸收峰出现在298nm,这主要是这主要是π-π*跃迁的结果。当紫外光(λ=297nm)照射1o,溶液颜色由无色变成紫红色,并且在548nm可见光区出现了一个强的吸收峰,化合物由开环态1o变成了闭环态1c,这是由于二芳基乙烯在光异构过程中,二芳基乙烯的结构从开环己三烯结构转变成了闭环的环己二烯结构,使得化合物共轭链增长。相反的,当用可见光区波长照射时,1c由紫红色溶液回到了无色,说明闭环态转变为开环态。于此同时548nm处的强吸收峰逐渐降低,297nm的吸收峰升高。由此说明,1o具有良好的光致变色性能。
室温下,化合物1o的四氢呋喃溶液(2×10-5mol·L-1)在光照前后的荧光开关性质如图3所示。当用354nm的光激发,1o在波长为467nm处有发射峰,显示有较强的荧光。当用297nm的紫外光照射时,1o发生关环反应,并且荧光强度逐渐减弱,直至几乎发生淬灭,说明光异构化反应生成了荧光更弱的闭环态。当达到光稳态时,溶液荧光颜色由原来的蓝色变成灰色。同时化合物1o荧光强度淬灭到原来的3%,当用可见光区波长照射时,由于发生了开环反应,闭环态慢慢回到了开环态,同时其荧光强度也相应回到原始强度,说明光能对1o的荧光进行有效的调制。
化合物1o的离子响应性和上面所用的实验条件一样,离子识别过程中的使用离子包括三价离子、二价离子和一价离子。这些离子具体为:Hg2+,Cd2+,Zn2+,Mg2+,Ca2+,Ba2+,Cr3+,Al3+,Ni2+,Mn2+,Co2+,Cu2+,Sr2+,Pb2+,Fe3+,K+,离子浓度皆为0.1mol·L-1。实验结果如图4显示,当溶液中加入Hg2+时荧光出现明显的淬灭伴随着荧光颜色由蓝色变成暗灰色,当加入Fe3+离子,荧光强度稍微有所下降,当加入剩余的其它离子时,荧光强度基本没有变化。
在1o与Hg2+络合的上述溶液中,继续滴加氨基酸(17种天然氨基酸)发现,只有加入Cys的溶液中,荧光强度又恢复到了化合物1o初始的荧光强度,其他氨基酸均没有明显的变化,荧光光谱图和荧光照片如图5所示。
可见,本发明制备所得的化合物为新型二芳基乙烯类光致变色化合物可用于连续检测特定离子和氨基酸,其选择性非常优良,特别是将来可应用于体内定性检测离子和氨基酸。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!