一种131I标记槲皮素的制备方法及其应用与流程
本发明涉及生物医药领域。更具体地,涉及一种131I标记槲皮素的制备方法及其应用。
背景技术:
甲状腺癌是一种常见的内分泌肿瘤,约占整个人体肿瘤的1%,2005年有报道显示,全球甲状腺癌发病率以每年4%的增幅上升,已跃居女性常见肿瘤第8位。分化型甲状腺癌(Differentiated thyroid carcinoma,DTC)包括甲状腺乳头状癌(Papillary thyroid carcinoma,PTC)和甲状腺滤泡状癌(Follicular thyroid carcinoma,FTC),由于肿瘤细胞保留了正常甲状腺细胞的部分功能而具有浓聚碘能力,所以大多数DTC患者经手术切除+放射性核素131I治疗+甲状腺激素代替抑制疗法可治愈,预后良好。但是30%的病人在131I治疗过程中病情呈进展性变化,甲状腺癌及转移灶因失分化逐渐失去摄碘能力。因此,研究寻找减少失分化和使失分化的癌再分化的治疗方法,恢复131I治疗效果,降低甲状腺癌的死亡率,有着重要的意义。
再分化治疗是指抑制肿瘤的生长,使失分化和未分化的甲癌重新获得吸碘的功能的方法,目前对失分化甲癌的治疗现有以下几方面的研究:1、维甲酸(RA)促再分化治疗,2、NIS基因转移治疗,3、NIS去甲基化治疗,4、抗VEGF治疗。但是,以上的几种治疗疗效不佳且有许多的副作用,因此,需要一种安全有效的药物。
任何一种肿瘤治疗方法单独应用,其疗效的提高很难令人满意,各种方法的综合使用可以扬长补短,提高疗效,降低毒副作用,例如临床上广泛采用的放射治疗和化疗的联合应用,放射增敏剂的应用也是综合治疗中的一部分。放射增敏剂是指能提高射线对肿瘤细胞的杀伤力,尤其是肿瘤组织中的乏氧细胞,而对受照射的正常细胞影响不大的一些化学物质。现已发现在肿瘤治疗中,用正常组织可耐受的剂量进行单纯照射治疗,肿瘤的治愈率只能达到40%左右,如果合并使用增敏药物,治愈率可达90%。目前己获得一些增敏效价很高的药物,并试用于临床,如硝基咪唑类化合物等,但由于存在明显的神经毒副作用限制了其在临床上的应用,因而,寻找高效低毒的肿瘤放疗增敏剂是当前肿瘤放疗急需解决的难题,特别是在内放疗增敏研究,国内外很少见研究。
槲皮素(quercetin,QU;3,3′,4′,5,7-5羟基黄酮)及其衍生物是具有多种生物学活性的黄酮类化合物。广泛存在于自然界各种植物的花和果实中。国内外学者研究发现槲皮素有极强的抗肿瘤作用,其机制是通过多途径抑制肿瘤细胞增殖,诱导其凋亡等。有许多试验证实该物质能使许多类型的细胞系得癌细胞再分化。
鉴于目前研究状况,探讨131I标记槲皮素对肿瘤内放射增敏、对失分化和未分化甲状腺癌有再分化治疗的作用,为甲状腺癌的治疗提供方法和对放射免疫治疗的辐射增敏研究提供理论基础。
技术实现要素:
本发明的一个目的在于提供一种131I标记槲皮素的制备方法,该方法简单,标记物稳定,标记率高。
本发明的另一个目的在于提供一种131I标记槲皮素的应用。
为达到上述目的,本发明采用下述技术方案:
一种131I标记槲皮素的制备方法,采用氯胺T法进行放射性碘标记,包括以下步骤:
(1)将槲皮素在pH=6-8的体系中与KI、131I和氯胺-T进行在0-37℃的条件下反应5-30min;
(2)加入过量还原剂终止步骤(1)反应;
(3)纯化,即得。
在本发明的一个优选的实施例中,所述体系的pH=6;
进一步,所述KI与槲皮素的摩尔比为0.25-0.75;优选的为0.25;
进一步,所述131I的用量为1mg槲皮素与1.21-1.693m Ci的131I进行反应;优选的,为1mg槲皮素与1.529mCi的131I进行反应。
本发明对pH、KI的量、反应时间、反应温度等对标记率的影响,以及QU对131I的负载量的影响进行了研究,结果表明pH、KI的量对标记率影响较大,反应时间和温度对标记率的影响较小,最终得到:当pH=6-8,KI与槲皮素的摩尔比为0.25-0.75标记率较高;当pH=6,KI与槲皮素的摩尔比为0.25标记率最高;而QU对131I的负载量也具有重要影响,1mg槲皮素对应与1.21-1.693mCi的131I进行反应时,负载量和标记率达到了较好的结果,既能使得标记率较高,又不造成131I的大量浪费,节约了成本;另外,为了节省时间,所述反应时间优选的为5min。
在本发明优选的实施例中,所述还原剂为偏重亚硫酸钠或硫代硫酸钠;
在本发明优选的实施例中,所述纯化为乙酸乙酯萃取法。
本发明还公开了所述131I标记槲皮素在制备治疗甲状腺癌药物或制剂中的应用。
本发明通过研究131I-QU与甲状腺癌细胞的相互作用表明:与131I相比,甲状腺癌细胞对131I-QU具有高而快速的摄取,滞留时间长;与131I,QU及131I+QU对未分化细胞增殖的抑制情况相比,131I-QU对癌细胞的抑制作用最强;通过荷瘤鼠瘤内注射131I-QU对甲状腺癌的治疗,结果表明131I-QU对甲状腺癌具有很好的治疗效果,且不影响体重。
本发明的有益效果如下:
本发明131I标记槲皮素的制备方法简单,标记物稳定,标记率高,便于进一步开发利用。另外,本发明131I标记槲皮素有效提高了对甲状腺癌细胞的抑制作用,达到较好的治疗效果。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
图1示出pH对131I标记率的影响;
图2示出KI的量对131I标记率的影响;
图3示出反应时间对标记率的影响;
图4示出131I的负载量与标记率的关系;
图5示出碘标记QU的HPLC结果;
图6示出3.63min处的质谱分析;
图7示出5.81min处的质谱分析;
图8示出6.82min处的质谱分析;
图9示出131I-QU在生理盐水及PBS(0.01mol/L,pH=7.4)中的稳定性
图10示出分化型甲状腺癌细胞FTC-133对131I及131I-QU的摄取情况;
图11示出分化型甲状腺癌细胞TT对131I及131I-QU的摄取情况;
图12示出未分化甲状腺癌细胞DRO对131I及131I-QU的摄取情况;
图13示出加入过量的QU时三种甲状腺癌细胞对131I-QU的摄取情况;
图14示出槲皮素在甲状腺癌细胞DRO中的荧光效应,其中,A:细胞的显微照片,B:细胞荧光照片,C:细胞摄取槲皮素后的显微照片,D:细胞摄取槲皮素后的荧光照片,E:细胞摄取槲皮素后显微照片及荧光照片的融合图;
图15示出甲状腺癌细胞DRO中131I-QU的流出情况;
图16示出131I-QU、131I、QU、131I+QU对甲状腺癌细胞DRO生长抑制情况(药物作用时间T=24h);
图17示出131I-QU、131I、QU、131I+QU对甲状腺癌细胞DRO生长抑制情况(药物作用时间T=48h);
图18示出131I-QU、131I、QU、131I+QU对甲状腺癌细胞DRO生长抑制情况(药物作用时间T=72h);
图19示出瘤内注射131I-QU后,荷瘤裸鼠不同时间点的SPECT显像;
图20示出治疗组与对照组荷瘤裸鼠肿瘤体积大小;
图21示出荷瘤裸鼠体重变化。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
试验例1 131I标记槲皮素(QU)条件的选择
本发明研究了在采用氯胺-T法作131I标记QU的过程中,pH、KI的量、反应时间、反应温度等对标记率的影响,以及QU对131I的负载量的影响;
1、pH对标记率的影响
利用1mol/HCl及NaOH调节反应体系的pH,使pH=2-10,研究pH与131I标记率的影响关系,结果如图1所示,结果表明:pH=6时,标记率最高,达82.17%。当pH≤6时,标记率随pH的增加而增加,pH≥6时,标记率随pH的增加而降低。这可能与氯胺-T的活性有关,氯胺-T在中性条件下(pH=6-8)活性最高,氧化效果最好。另外,pH改变,使QU苯环电子云密度发生变化,影响131I的标记率。当QU碱性条件下会以其钠盐的形式存在,从而改变QU的水溶性,影响乙酸乙酯的萃取效率。
2、KI用量对标记率的影响
在QU的量固定为1mg,pH=6的条件下,设置KI/QU(mol/mol)=0,0.25,0.5,0.75,1.0,1.25,1.5,2.0,测定KI与131I标记率的关系。结果如图2所示,结果表明:稳定的KI与QU摩尔比为0.25时,131I的标记率最大,为86.78%;随着KI与QU摩尔比的逐渐增加(由0.25增加到2.0),131I的标记率逐渐降低。这可能是因为KI量增加不利于131I与KI的相互竞争;而当KI的量为0时,其标记率(80.28%)低于KI为0.25时的标记率(86.78%),这可能是由于131I浓度过低所致,适当的添加稳定的KI有利于减少131I的游离,从而增加标记率。
3、反应时间及温度对标记率的影响
0.3μmol的QU,0.075μmol的KI,10μL131I及0.1μmol的氯胺-T在pH=6的条件下分别反应5、10、15、20、30min后,测定131I的标记率结果如图3所示,从图中可以看出反应5、10、15、20、30min后131I的标记率分别为86.78%、85.04%、85.19%、87.29%、85.44%,组间差异无统计学意义(p>0.05),说明反应时间对标记率的影响较小,采用氯胺T法标记碘是一个快速的过程,反应5min即能得到较高的标记率。
本发明还研究了温度对131I标记率的影响,结果表明,在温度为0~37℃区间内,温度对标记率无明显影响。
4、QU对131I的负载量的影响
为了探讨QU对放射性碘的最大负载量,本发明研究了1mg QU在不同131I剂量下的标记率,实验结果如表1和图4所示,从图中可以看出:当131I的剂量为0.219-2.477mCi时,随着131I加入剂量的增加,1mg QU对碘的负载量也随之增加(由0.163mCi/mg增加到1.407mCi/mg),但131I的标记率却呈现出逐渐降低的趋势。说明QU对131I的负载量虽然增加了,但随着标记率的降低,131I的浪费增加。
综合考虑负载量及131I的标记率,本发明认为QU对131I最适合的负载量出现在0.856-1.125mCi之间(如图4,A点处),A点处131I加入量为1.529mCi,131I的负载量约为1.04mCi/mg,标记率约为68%。
表1水相及乙酸乙酯相的放射性计数
试验例2 131I标记QU的质量检测
1、HPLC、MS、LCMS-IT-TOF检测标记物
本发明采用LC-MS分析判定稳定的KI对QU的标记情况,确定I代反应的个数。由图5可知,纯化后的碘标记的QU的产物的HPLC中主要包含1.95、2.79、3.63、5.25、5.81、6.82min处的六个峰,其中3.63、5.81、6.82min处的三个峰在360nm处的吸光度较大,其含量占标记产物的95.44%(如表2)。发明采用MS进一步分析得到:3.63,5.81,6.82min处的分子量分别为302.0347,427.9328,427.9328(如图6,图7,图8)。这与QU的分子量302.02,1I-QU的分子量427.9166一致。且三个时间点产物所占比例分别为78.53%,9.46%,7.45%。5.81,6.82min处分子量相同,为I-QU的两种同分异构体。
表2碘标记QU各组分的积分面积
因此,可认为稳定I的对QU标记后,并通过萃取法纯化的产物主要为QU及I-QU,占95.44%。故认为采用氯胺T法对QU进行碘标记的产物可用于后续的细胞及动物实验的研究。
虽然从QU的分子结构上分析,QU有多个碘的亲电取代位点,但在不同反应条件下,I有不同的亲电取代位点。但由LCMS数据分析可知,仅有一个碘发生了取代反应。碘与QU反应,碘最易取代QU酚羟基的邻对位,由此,本发明中碘标记QU的反应的反应方程式如下:
2、131I标记槲皮素的体外稳定性
本发明中,131I-QU的体外稳定性采用131I-QU在37℃下,在不同介质中孵育不同时间后的放射化学纯度来表示。如图9所示,131I-QU在生理盐水(0.9%的NaCl溶液)及PBS(0.01mol/L,pH=7.4)中于37℃条件下放置1、2、4、8、16、24、48h后,其放射化学纯度呈现缓慢下降的趋势。
131I-QU在生理盐水中1h的放射化学纯度为91.24%±3.25%(means±sd),48h后放射化学纯度仍高达81.62±6.28%,说明131I-QU在生理盐水中具有较好的体外稳定性。131I-QU在PBS(0.01mol/L,pH=7.4)中孵育1h后,其放射化学纯度为82.25%±4.05%,48h后放射化学纯度54.48%±10.07%。与131I-QU在生理盐水中的稳定性相比,131I-QU在PBS中的稳定性不及在生理盐水中的稳定性。
试验例3 131I-QU与甲状腺癌细胞的相互作用
1、甲状腺癌细胞摄取实验
为探究131I-QU能否提高甲状腺癌细胞对放射性的摄取,本发明研究并比较了甲状腺癌分化型细胞(FTC-133、TT)和未分化型细胞(DRO)对131I和131I-QU的摄取能力,结果如图10、图11及图12所示,从图中可以看出:未分化甲癌细胞DRO几乎不具有摄取131I的能力,而分化型甲癌细胞FTC-133、TT具有摄取131I的能力,且对131I的摄取随时间变化表现出先增加后逐渐保持平衡的趋势,其最大摄取量均出现在15min左右。FTC-133与TT的摄取131I能力的差异可能与细胞活性及细胞培养代数有关,且分化型甲状腺癌细胞在长期培养过程中可能逐渐发生失分化,具体表现为摄碘能力的降低。
与131I相比,FTC-133、TT、DRO对131I-QU均有较高的摄取,其中FTC-133对131I-QU的最大摄取量是对131I摄取量的4.2倍,TT对131I-QU的最大摄取量是对131I的13.1倍,DRO对131I-QU的最大摄取量是对131I的17.0倍。并且,三种癌细胞对131I-QU的最大摄取量均出现在5-7min,说明癌细胞对131I-QU的摄取较131I更快速。甲状腺癌细胞对131I-QU的高而快速的摄取,将更有利于131I-QU对癌细胞的生长抑制作用及甲状腺癌的治疗。
为进一步探讨三种甲状腺癌细胞对131I-QU的摄取主要归功于癌细胞对QU的摄取,本发明开展了以下实验,即在研究癌细胞对131I-QU的摄取时,加入过量的QU,测定细胞中的放射性,并比较细胞对131I-QU摄取情况,结果如图13所示。在摄取实验中加入过量的QU后,FTC-133、TT、DRO对131I-QU的摄取明显降低,降低到约原来的1/8。其原因可解释为QU与131I-QU的竞争作用,癌细胞对QU的摄取,降低了其对131I-QU的摄取。
此外,鉴于QU在紫外光照射下,能发出绿色的荧光。本发明通过荧光显微镜研究了甲状腺癌细胞(DRO)与QU共同孵育后,细胞的荧光效应。实验结果如图14所示,细胞与QU共同孵育后,细胞在荧光显微镜下呈绿色,证明细胞确实能摄取QU。
甲状腺癌细胞对131I-QU的摄取实验说明,将131I标记到QU上,可使原来不具有摄碘能力的甲状腺癌细胞DRO摄取放射性碘(131I-QU),从而达到杀死和抑制细胞生长的作用;同时增加具有摄碘能力的癌细胞FTC-133,TT对放射性碘(131I-QU)的摄取能力,增加对其癌细胞的破坏作用。并且QU具有放射性增敏的作用,以及使失分化及未分化的癌细胞再分化的作用,131I与QU的联合使用将有望更快速的杀死癌细胞,避免失分化的发生,并同时使失分化及未分化的癌细胞再分化。
2、细胞流出实验
甲状腺癌细胞摄取131I-QU后,131I-QU能否在细胞内“长期”存在,是影响其对甲状腺癌细胞抑制作用的重要因素。因此,本发明测定了131I-QU在未分化甲状腺癌细胞DRO中的流出情况,实验结果如图15所示。131I-QU在DRO中的半衰期约为10min,说明131I-QU在甲状腺癌细胞内的滞留时间与131I在黑色瘤细胞内的滞留时间相当。
3、细胞生长抑制实验
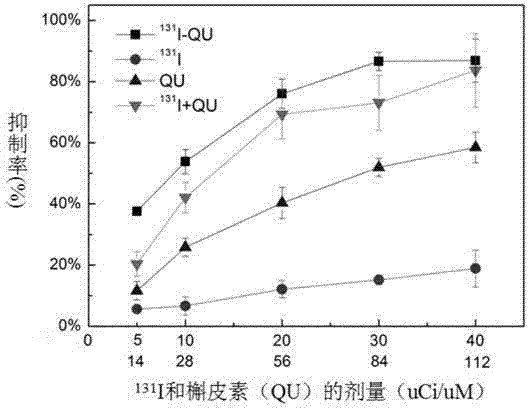
本发明主要采用CCK-8法检验不同药物作用下未分化甲状腺癌细胞DRO存活情况,并同时研究了药物剂量,作用时间的影响。在细胞水平上研究131I-QU,131I,QU及131I+QU对未分化细胞增殖的抑制情况。其中,131I的剂量分别为5、10、20、30、40μCi,QU的浓度分别为14、28、56、84、112μmol/L,药物作用时间分别为24、48、72h,实验结果如图16、图17、图18所示。
在同一药物剂量下,四种药物对DRO增殖的抑制强弱顺序为131I-QU≥131I+QU>QU>131I,且抑制作用与药物剂量及作用时间均成依赖关系。当QU浓度为112μmol/L,131I剂量为40μCi,作用时间为72h时,131I-QU对细胞增殖的抑制率高达86.87±7.15%(mean±SD),131I+QU,QU及131I对细胞的抑制率分别为83.66±12.11%,58.43±5.08%,18.86±6.29%。与相同剂量的131I相比,131I-QU对细胞的抑制作用约提高5倍。其原因可归功于DRO对QU的快速摄取及QU的放射性增敏作用。
QU进入细胞后,能嵌入到DNA双链上,并通过共价或非共价键作用与DNA磷酸基团结合。由于未分化型甲癌细胞DRO不能摄取131I,131I及131I+QU主要通过外照射抑制癌细胞的生长。与131I、131I+QU相比,131I-QU能被癌细胞摄取,并嵌入到DNA双链中,将大大增加药物对细胞核及DNA的损伤,并加速细胞的碎裂。
从对癌细胞生长的抑制情况上看,与131I+QU组相比,131I-QU组对甲状腺癌细胞DRO生长的抑制作用并没有明显优势(86.87±7.15%Vs 83.66±12.11%),但对于实体肿瘤来说,因甲状腺未分化癌细胞不具备摄取131I的能力,131I+QU的治疗方式将较难达到抑制肿瘤生长的作用。
试验例4 131I-QU对甲状腺癌抑制作用及其体内分布
1、131I-QU在荷瘤鼠体内的分布及SPECT显像
本发明利用SPECT显像对131I-QU在肿瘤内的滞留时间及全身分布进行了初步分析。并通过不同时间131I-QU在荷瘤裸鼠各组织的分布情况,研究了131I-QU在动物体内的代谢情况。
SPECT显像结果表明(如图19),通过瘤内注射的放射注射131I-QU后的前4h,131I-QU主要富集在肿瘤内;注射药物8h后,131I-QU开始由肿瘤中心向周围组织扩散,注射药物24h,36h后,131I-QU进一步向周围组织扩散,且肿瘤中心的放射性剂量明显减弱。
荷DRO瘤裸鼠肿瘤及其他各组织器官的放射性生物分布如表3所示。瘤内注射131I-QU 2h后,131I-QU主要集中在肿瘤组织,约占注入量的57.99±5.62%(mean±SD),血液、肝脏等组织未见明显的放射性浓聚;且注射药物8、16、24、48h后,肿瘤内的131I-QU分别占注入量的47.22±3.86%、35.22±5.23%、18.46±4.54%及9.03+1.14%。与骨骼、肌肉等组织相比,肝脏及肾脏具有较高的放射性,进一步说明游离的131I主要通过尿液排出体外,并与QU的代谢产物主要通过CO2和粪尿排出体外的研究结果相符。
表3 131I-QU在瘤裸鼠体内的生物学分布(%ID/g,mean±SD,n=4)
2、131I-槲皮素对甲状腺癌的治疗效果观察
注射药物后,荷DRO瘤裸鼠的肿瘤生长是否受到抑制是判断131I-QU治疗活体肿瘤是否有效的最直接证据。本发明观察了瘤内注射131I-QU及同等量的PBS(pH=7.4,0.01mol/L)0-28天后,治疗组及对照组裸鼠肿瘤的体积变化,其结果如表4及图20所示。
在28天的观察期内,对照组肿瘤体积不断增大,第28天时,肿瘤体积为907.65±189.21mm3(mean±SD)。与对照组相比,注射药物后治疗组肿瘤体积被明显抑制,且从第3天开始,治疗组与对照组肿瘤体积有显著性差异(P<0.05),第28天的抑瘤率约为66.51%。瘤内注射131I-QU后的第7天,治疗组肿瘤体积达到最小(由54.98±5.14mm3缩小至34.93±13.29mm3),随后治疗组肿瘤体积开始逐渐增大。其原因可能是1mCi的131I-QU不足以完全抑制肿瘤的生长或131I-QU在肿瘤内的滞留时间不够长。鉴于此,要完全抑制约50mm3的肿瘤的生长,需增加131I-QU单次给药的剂量或采用多次给药的治疗手段。另外,也可延长药物在肿瘤内的滞留时间以达到更好的治疗效果。
表4治疗组与对照组荷瘤裸鼠肿瘤体积大小(mean±SD,n=5)
此外,在观察131I-QU对甲状腺癌的治疗效果的同时,本发明对裸鼠体重也进行了考察,其结果如图21所示。治疗实验后期对照组及治疗组裸鼠的身体状态与治疗实验前期相比均有所减弱,但从裸鼠体重上看,未见明显的体重下降,且治疗组与对照组裸鼠体重没有显著性差异(P>0.05)。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!