10-羟基喜树碱衍生物、合成方法及其应用与流程
本发明涉及喜树碱类药物领域,具体而言,涉及一种10-羟基喜树碱衍生物、合成方法及其应用。
背景技术:
10-羟基喜树碱(10-Hydroxycamptothecine,10-HCPT)是珙桐科旱莲属落叶植物喜树果实与叶中提取的一种具显著抗癌活性的喜树碱类生物碱,也可由喜树碱合成而得。其抗癌作用相当于喜树碱的30倍。10-HCPT对胰腺癌、前列腺癌、膀胱癌、口腔鳞癌、大肠癌、胃癌、肝癌、非小细胞肺癌等具有明显疗效。对口腔、颈面部癌、头颈部癌、头颈部圆柱型腺癌及皮肤癌也有较好疗效;对恶性葡萄胎,绒毛膜上皮癌、肺癌、急慢性粒细胞、白血病,银屑病,及血吸虫病引起的肝脾肿大等也具有一定的疗效。10-羟基喜树碱与其他常用的抗癌药无交叉耐药。
化疗是肿瘤手术前后的有效疗法,也是主要疗法。由于10-HCPT中的羟基为极性较强的基团,因此10-HCPT极性较高,其跨生物膜速度较慢,给药量大,对正常组织器官产生很大的毒副作用,临床应用受到限制。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种10-羟基喜树碱衍生物,该衍生物将喜树碱10位的羟基替换为酯的结构,大大降低了该衍生物的分子极性,提高其跨生物膜的速度,有助于提高药物进入肿瘤细胞的速度和数量,提高药物利用率,发挥更好的抗肿瘤效果,同时降低毒副作用。
本发明的第二目的在于提供一种上述10-羟基喜树碱衍生物的合成方法,该方法工艺步骤科学合理,采用该合成方法得到的10-羟基喜树碱衍生物具有抗肿瘤效果好和毒副作用低的优点。
本发明的第三目的在于提供一种上述10-羟基喜树碱衍生物在制备治疗肿瘤的药物中的应用,所得药物具有肿瘤治疗效果好的优点。
为了实现本发明的上述目的,特采用以下技术方案:
第一方面,本发明提供了一种10-羟基喜树碱衍生物,所述衍生物是10-羟基喜树碱中10位的羟基经酯化后形成的具有酯的结构的衍生物。
作为进一步优选地技术方案,所述衍生物的结构式如下所示:
其中,R为任选取代的C1-C10的直链烷基或支链烷基,和/或,任选取代的C2-C10的烯基。
作为进一步优选地技术方案,C1-C10的直链烷基或支链烷基为甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基或正癸基中的任意一种或至少两种的组合。
作为进一步优选地技术方案,C2-C10的烯基为乙烯基、烯丙基、丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、2-甲基-1-丁烯基、3-甲基-1-丁烯基、2-甲基-2-丁烯基、1-己烯基、2-己烯基、3-己烯基、2-甲基-1-戊烯基、2-甲基-2-戊烯基、4-甲基-2-戊烯基、4-甲基-1-戊烯基、3-甲基-1-戊烯基、3-甲基-2-戊烯基、2-乙基-1-丁烯基、3,3-二甲基-1-丁烯基、2,3-二甲基-1-丁烯基、2,3-二甲基-2-丁烯、1-庚烯基、1-辛烯基、1-壬烯基或1-癸烯基中的任意一种或至少两种的组合。
作为进一步优选地技术方案,R中的C1-C10的直链烷基或支链烷基或C2-C10的烯基中,一个以上的氢独立地被氧所取代;
优选地,R为4-羰基戊基。
作为进一步优选地技术方案,所述衍生物为下列衍生物中的任意一种:
第二方面,本发明提供了一种10-羟基喜树碱衍生物的合成方法,包括以下步骤:将10-羟基喜树碱与结构为RCOOH的羧酸溶于吡啶中,其中,R为任选取代的C1-C10的直链烷基或支链烷基,和/或,任选取代的C2-C10的烯基;然后加入EDCI,搅拌1-4小时,得到所述10-羟基喜树碱衍生物。
作为进一步优选地技术方案,所述合成方法还包括:待搅拌1-4小时后,加入二氯甲烷和水,搅拌10-50分钟后,分离出有机层,最后将干燥浓缩后的残渣进行纯化并采用体积比为(5-25):1的二氯甲烷和甲醇洗脱,得到所述10-羟基喜树碱衍生物。
作为进一步优选地技术方案,包括以下步骤:将10-羟基喜树碱1-4mmol与5-羰基己酸7-9mmol溶于5-15mL吡啶中,于18-28℃下加入EDCI 8-12mmol,搅拌1-4小时;然后加入40-60mL二氯甲烷和40-60mL水,搅拌10-50分钟后,分离出有机层,然后将减压干燥浓缩后的残渣用硅胶柱进行纯化,最后用体积比为(5-25):1的二氯甲烷和甲醇进行洗脱,得到所述10-羟基喜树碱衍生物。
第三方面,本发明提供了一种10-羟基喜树碱衍生物在制备治疗肿瘤的药物中的应用。
与现有技术相比,本发明的有益效果为:
本发明提供的10-羟基喜树碱衍生物将10-羟基喜树碱10位的羟基经过酯化后替换为酯的结构,大大降低了该衍生物的分子极性,提高其跨生物膜的速度,有助于提高药物进入肿瘤细胞的速度和数量,提高药物利用率,发挥更好的抗肿瘤效果,同时降低毒副作用。
本发明提供的上述10-羟基喜树碱衍生物的合成方法工艺步骤科学合理,采用该方法得到的10-羟基喜树碱衍生物具有抗肿瘤效果好和毒副作用低的优点。
将上述10-羟基喜树碱衍生物应用到制备治疗肿瘤的药物中,所得药物具有肿瘤治疗效果好的优点。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
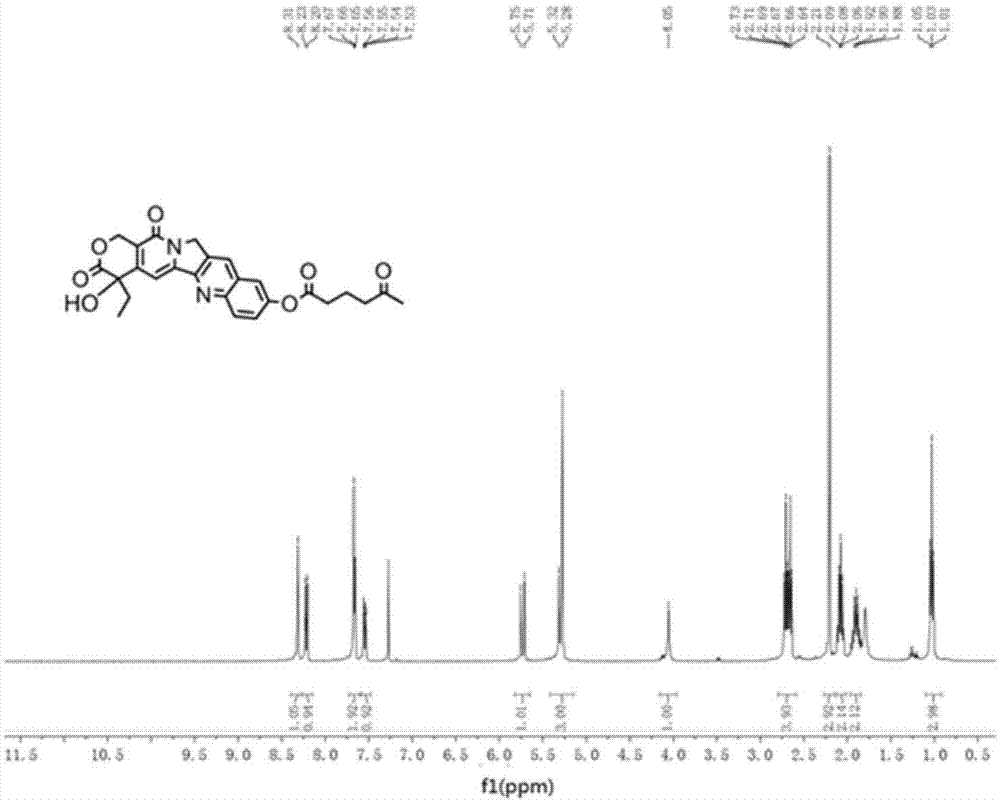
图1是本发明提供的10-羟基喜树碱衍生物1的核磁共振氢谱图;
图2是本发明提供的10-羟基喜树碱衍生物1的碳谱图;
图3是本发明提供的10-羟基喜树碱衍生物1的高分辨质谱图;
图4是本发明提供的10-羟基喜树碱衍生物1的红外光谱图;
图5是10-羟基喜树碱的琼脂糖凝胶电泳图;
图6是本发明提供的10-羟基喜树碱衍生物1的琼脂糖凝胶电泳图;
图7是激光共聚焦实验观察细胞摄取10-羟基喜树碱衍生物1的结果图;
图8是肿瘤生长抑制实验中的肿瘤体积和肿瘤形态图;
图9是荷瘤裸鼠给药后体重变化曲线图;
图10是肿瘤组织H&E染色切片图;
图11是本发明提供的10-羟基喜树碱衍生物的化学结构图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
第一方面,本发明提供了一种10-羟基喜树碱衍生物,所述衍生物是10-羟基喜树碱中10位的羟基经酯化后形成的具有酯的结构的衍生物。
如式(1)和式(2)所示,10-羟基喜树碱由一个吡咯喹啉环、一个共轭吡啶环和一个六元α羟基基内酯环(环E)组成,分子式C20H16N2O5,摩尔质量364.357,是黄色棱柱状一水合物结晶,熔点268~270℃,微溶于少数有机溶剂,不溶于水,在稀碱溶液中变成开环羧酸盐形式溶解,溶液具有蓝色荧光。
鉴于10-羟基喜树碱中10位的羟基具有较强的极性,会影响药物的跨生物膜的速度等,因此,本发明将10位的羟基进行酯化后形成酯的结构,大大降低了该衍生物的分子极性,提高其跨生物膜的速度,有助于提高药物进入肿瘤细胞的速度和数量,提高药物利用率,发挥更好的抗肿瘤效果,同时降低毒副作用。
在一种优选地实施方式中,所述衍生物的结构式如下所示:
其中,R为任选取代的C1-C10的直链烷基或支链烷基,和/或,任选取代的C2-C10的烯基。
以下为本发明提供的10-羟基喜树碱衍生物的典型但非限定性的可选实施方式:C1-C10的直链烷基或支链烷基为C1、C2、C3、C4、C5、C6、C7、C8、C9或C10的直链烷基或支链烷基;具体地,C1-C10的直链烷基或支链烷基为甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、2-甲基丁基、3-甲基丁基、1-甲基丁基、2,2-二甲基丙基、1,2-二甲基丙基、1,1-二甲基丙基、1-乙基丙基、正己基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2,3-二甲基丁基、1,3-二甲基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2-乙基丁基、1-乙基丁基、1-乙基-2-甲基丙基、1,1,2-三甲基丙基、1,2,2-三甲基丙基、1-甲基-1-乙基丙基、正庚基、1-甲基己基、2-甲基己基、3-甲基己基、1,2-甲基戊基、1,3-二甲基戊基、1,4-二甲基戊基、2,3-二甲基戊基、2,4-二甲基戊基、1,1-二甲基戊基、2,2-二甲基戊基、3,3-二甲基戊基、3,4-二甲基戊基、1-乙基戊基、2-乙基戊基、3-乙基戊基、1,2,3-三甲基丁基、1,1,2-三甲基丁基、1,1,3-三甲基丁基、1-乙基2-甲基丁基、1-乙基-3-甲基丁基、2,2,3-三甲基丁基、2-乙基-3-甲基丁基、1,2-二乙基丙基、1,1,2,2-四甲基丙基、正辛基、1-甲基庚基、2-甲基庚基、3-甲基庚基、4-甲基庚基、1,1-二甲基己基、1,2-二甲基己基、1,3-二甲基己基、1,4-二甲基己基、1,5-二甲基己基、1-乙基己基、2-乙基己基、3-乙基己基、1,2,3-三甲基戊基、1,2,4-三甲基戊基、2,3,4-三甲基戊基、1,1,2-三甲基戊基、1,1,3-三甲基戊基、2,2,3-三甲基戊基、1-乙基-2-甲基戊基、1-乙基-3-甲基戊基、2-乙基-3-甲基戊基、1,1,2,2-四甲基丁基、1,2-二乙基丁基、1-乙基-2,2-二甲基丁基、1,1-二甲基-2-乙基丁基、1-丙基-2-甲基丁基、正壬基、1-甲基辛基、2-甲基辛基、3-甲基辛基、4-甲基辛基、5-甲基辛基、1,1-二甲基庚基、1,2-二甲基庚基、1,3-二甲基庚基、1,4-二甲基庚基、1-乙基庚基、2-乙基庚基、3-乙基庚基、4-乙基庚基、1,1,2-三甲基己基、1,1,3-三甲基己基、2,2,3-三甲基己基、1,2,3-三甲基己基、1-乙基-2-甲基己基、1-乙基-3-甲基己基、1-丙基己基、2-丙基己基、3-丙基己基、1-异丙基己基、2-异丙基己基、3-异丙基己基、1,1,2,2-四甲基戊基、1,1,3,3-四甲基戊基、1,2,2,3-四甲基戊基、1,2,3,3-四甲基戊基、1-乙基-2,2-二甲基戊基、1-乙基-2,3-二甲基戊基、1,2-二甲基-1-乙基戊基、1-丙基-2-甲基戊基、1,1,2,2,3-三甲基丁基、3-甲基-1,2-二乙基丁基、正癸基、1-甲基壬基、2-甲基壬基、3-甲基壬基、4-甲基壬基、5-甲基壬基、1,1-二甲基辛基、1,3-二甲基辛基、1,4-二甲基辛基、1,5-二甲基辛基、2,2-二甲基辛基、2,3-二甲基辛基、2,4-二甲基辛基、2,5-二甲基辛基、3,3-二甲基辛基、3,4-二甲基辛基、3,5-二甲基辛基、4,4-二甲基辛基、4,5-二甲基辛基、1-乙基辛基、2-乙基辛基、3-乙基辛基、4-乙基辛基、1,1,2-三甲基庚基、1,1,3-三甲基庚基、1,1,4-三甲基庚基、1-乙基-2-甲基庚基、1-甲基-2-乙基庚基、1-丙基庚基、2-丙基庚基、3-丙基庚基、1-异丙基庚基、2-异丙基庚基、3-异丙基庚基、1,1,2,2-四甲基己基、1,1,3,3-四甲基己基、1,2,2,3-四甲基己基、1,2,3,3-四甲基己基、1-乙基-2,2-二甲基己基、1-乙基-2,3-二甲基己基、1,2-二甲基-1-乙基己基或1-丙基-2-甲基己基中的任意一种或至少两种的组合;
C2-C10的烯基为C2、C3、C4、C5、C6、C7、C8、C9或C10的烯基;具体地,C2-C10的烯基为乙烯基、烯丙基、丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、2-甲基-1-丁烯基、3-甲基-1-丁烯基、2-甲基-2-丁烯基、1-己烯基、2-己烯基、3-己烯基、2-甲基-1-戊烯基、2-甲基-2-戊烯基、4-甲基-2-戊烯基、4-甲基-1-戊烯基、3-甲基-1-戊烯基、3-甲基-2-戊烯基、2-乙基-1-丁烯基、3,3-二甲基-1-丁烯基、2,3-二甲基-1-丁烯基、2,3-二甲基-2-丁烯、1-庚烯基、1-辛烯基、1-壬烯基或1-癸烯基中的任意一种或至少两种的组合。
在一种优选地实施方式中,C1-C10的直链烷基或支链烷基为甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基或正癸基。
在一种优选地实施方式中,C2-C10的烯基为乙烯基、烯丙基、丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、2-甲基-1-丁烯基、3-甲基-1-丁烯基、2-甲基-2-丁烯基、1-己烯基、2-己烯基、3-己烯基、2-甲基-1-戊烯基、2-甲基-2-戊烯基、4-甲基-2-戊烯基、4-甲基-1-戊烯基、3-甲基-1-戊烯基、3-甲基-2-戊烯基、2-乙基-1-丁烯基、3,3-二甲基-1-丁烯基、2,3-二甲基-1-丁烯基、2,3-二甲基-2-丁烯、1-庚烯基、1-辛烯基、1-壬烯基或1-癸烯基。
在一种优选地实施方式中,R中的C1-C10的直链烷基或支链烷基或C2-C10的烯基中,一个以上的氢独立地被氧所取代。
在一种优选地实施方式中,R为4-羰基戊基。
在一种优选地实施方式中,所述衍生物为下列衍生物中的任意一种:
第二方面,本发明提供了一种10-羟基喜树碱衍生物的合成方法,包括以下步骤:将10-羟基喜树碱与结构为RCOOH的羧酸溶于吡啶中,其中,R为任选取代的C1-C10的直链烷基或支链烷基,和/或,任选取代的C2-C10的烯基;然后加入EDCI,搅拌1-4小时,得到所述10-羟基喜树碱衍生物。
其中,EDCI为碳化二亚胺。
在一种优选地实施方式中,所述合成方法还包括:待搅拌1-4小时后,加入二氯甲烷和水,搅拌10-50分钟后,分离出有机层,最后将干燥浓缩后的残渣进行纯化并采用体积比为(5-25):1的二氯甲烷和甲醇洗脱,得到所述10-羟基喜树碱衍生物。
在一种优选地实施方式中,包括以下步骤:将10-羟基喜树碱1-4mmol与5-羰基己酸7-9mmol溶于5-15mL吡啶中,于18-28℃下加入EDCI 8-12mmol,搅拌1-4小时;然后加入40-60mL二氯甲烷和40-60mL水,搅拌10-50分钟后,分离出有机层,然后将减压干燥浓缩后的残渣用硅胶柱进行纯化,最后用体积比为(5-25):1的二氯甲烷和甲醇进行洗脱,得到所述10-羟基喜树碱衍生物;
合成反应如下:
第三方面,本发明提供了一种10-羟基喜树碱衍生物在制备治疗肿瘤的药物中的应用。
如图11所示是本发明提供的10-羟基喜树碱衍生物的化学结构图。
实施例1
一种10-羟基喜树碱衍生物1,结构式如下:
实施例2
实施例1所述的衍生物由以下方法合成:
将10-HCPT(1.00g,2.7mmol)和5-羰基己酸(1.07g,8.1mmol)溶解于10mL吡啶中,于室温下加入EDCI(2.06g,10.8mmol),搅拌3h,薄层色谱法监测反应。向反应体系中加入50mL二氯甲烷和50mL水,搅拌反应30分钟后,分出有机层,减压干燥浓缩得到的残渣用硅胶柱进行纯化,用二氯甲烷和甲醇洗脱,二氯甲烷和甲醇的体积比为10:1,得到黄色的固体化合物,即10-羟基喜树碱衍生物1(1.25g,产率96%)。
合成反应如下:
实施例2得到的10-羟基喜树碱衍生物1的结构和性能测试:
采用核磁共振氢谱、碳谱、高分辨质谱、红外光谱等技术鉴定该衍生物的化学结构,如图1-4所示为各测试谱图。
采用1H NMR,和13C NMR和高分辨质谱法,红外光谱法等对10-羟基喜树碱衍生物1的结构进行鉴定。缩写所代表的多重峰如下:多重峰:s=单峰,d=双峰,t=三峰,q=四重峰,m=多重峰,dd=两个双重峰,dt=两个三重峰。1H NMR谱图和13C NMR谱图用氘代氯仿(CDCl3-d6)做溶剂。以下为核磁信号结果:
1H NMR(400MHz,CDCl3)δ8.31(s,1H),8.22(d,J=9.2Hz,1H),7.72–7.61(m,2H),7.53(dt,J=35.3,17.7Hz,1H),5.71(t,J=17.7Hz,1H),5.30(d,J=15.5Hz,3H),4.17–3.96(m,1H),2.68(dt,J=19.8,7.1Hz,4H),2.22(d,J=9.8Hz,3H),2.08(dt,J=12.0,6.1Hz,2H),2.01–1.85(m,2H),1.03(t,J=7.4Hz,3H)。
13C NMR(101MHz,CDCl3)δ207.82,173.82,171.53,157.58,152.40,150.15,149.56,146.81,146.12,131.24,130.69,129.14,128.44,125.91,118.85,118.68,98.16,72.78,66.30,50.03,42.22,33.37,31.65,30.06,18.70,7.84。
10-羟基喜树碱和10-羟基喜树碱衍生物1的琼脂糖凝胶电泳图分别如图5和6所示,结果表明,产物对DNA拓扑异构酶I的抑制作用和10-HCPT相当。
琼脂糖凝胶电泳图,0泳道为阳性对照,1泳道为阴性对照,2-6泳道为DNA拓扑异构酶Ⅰ+pBR322DNA+100μM、200μM、300μM、400μM、500μM的药物,图5药物为10-HCPT;图6为10-羟基喜树碱衍生物1;R为松弛DNA,Sc为超螺旋DNA。根据图中电泳条带的亮度可见随着浓度的增加,10-HCPT在400μM时完全抑制了TOPO I的活性,松弛型DNA完全转变成螺旋型。10-羟基喜树碱衍生物1对TOPO I活性的抑制与10-HCPT基本相当,在400μM时完全抑制了TOPO I的活性。
10-位衍生物对DNA TOPO I的抑制活性利用激光共聚焦显微镜观察细胞摄取药物的过程,结果如图7所示;采用MTT法检测其对MCF-7、HepG2、SW180细胞的毒性。结果表明:细胞摄取产物的速度较快,1小时后即可观察到细胞内药物的蓝色荧光,2小时后可观察到细胞核内药物的蓝色荧光,4小时荧光强度最大,药物大量进入细胞核,表明药物的细胞内化迅速。本发明产物的IC50比10-HCPT更低。
表1.MTT法测定10-羟基喜树碱衍生物1和10-HCPT的体外肿瘤细胞生长抑制效果
用MCF-7细胞建立腋下荷瘤裸小鼠动物模型,进行药效学研究,结果表明产物在荷瘤裸小鼠体内的抗肿瘤效果优于10-HCPT;
肿瘤模型的建立:
MCF-7细胞培养至对数生长期后,胰酶消化,无菌PBS洗涤,离心后,将细胞重悬于无血清的培养基中,调整细胞浓度至107个/mL,制成单细胞悬液。取0.2ml细胞悬液,皮下注射到裸鼠腋下。每天观察记录裸鼠的腋下肿瘤生长情况,并测定肿瘤体积。
动物分组与给药方案:
接种后,小鼠继续饲养7天,待肿瘤体积达到100mm3左右后进行分组,每组6只,分别采用尾静脉注射给各组制剂。
(1)生理盐水组;(2)市售10-HCPT注射液组;(3)10-羟基喜树碱衍生物1组。各种制剂中10-HCPT的剂量或折合剂量均为5.0mg/kg。
肿瘤生长抑制实验:
实验期间每天用游标卡尺测量裸鼠肿瘤的长和宽。计算肿瘤体积,绘制肿瘤体积-时间变化图,评价各个给药组对肿瘤的治疗效果。于给药后的第14天处死动物,剥离肿瘤称量,瘤重和裸鼠的去瘤体重,照相。肿瘤体积和肿瘤抑制率分别按以下公式计算:
V=1/2×a×b2。其中,V是肿瘤体积,a是肿瘤长径;b是肿瘤短径。
抑制率=(空白组肿瘤重量-给药组肿肿瘤重量)/空白组肿瘤重量×100%
药效学评价采用Student’s t-test进行统计学处理。
肿瘤生长抑制实验:
3组制剂的肿瘤体积和肿瘤形态随时间的变化见图8,其中,(A)为生理盐水组,(B)为10-HCPT组,(C)为10-羟基喜树碱衍生物1组。实验结果表明肿瘤生长抑制率大小顺序为:10-羟基喜树碱衍生物1组>10-HCPT注射液组>生理盐水组。10-羟基喜树碱衍生物1比10-HCPT母体药物体现出了更高的肿瘤生长抑制效率。
各组制剂给药14天后肿瘤大小:
如图9,各给药组的裸鼠体重在药效学研究期间随时间的变化曲线结果可见,生理盐水组裸鼠体重起初变化不大,后期下降迅速,分析可能由于肿瘤的生长,裸鼠的生命状态逐渐恶劣,肿瘤汲取了大量养分,导致裸鼠迅速消瘦。10-HCPT组较生理盐水组体重下降缓慢。分析可能由于药物的治疗作用,肿瘤得到一定程度的遏制,裸鼠获取的养分可维持体重,但是由于药物的毒副作用尤其胃肠道的副反应,体重仍然呈下降趋势。10-羟基喜树碱衍生物1(图中指10位衍生物)较10-HCPT组下降更为缓慢,可能由于疗效的提高,肿瘤的生长得到更好程度的遏制,裸鼠生命状态较好,体重下降缓慢。说明10-HCPT在抗肿瘤治疗过程中具有一定的毒副作用。10-羟基喜树碱衍生物1相比于10-HCPT市售制剂,在一定程度上减少了毒副作用。光疗抗皮下肿瘤的效果较好且毒副作用低。光疗联合化疗治疗的效果很好,且毒副作用很低。
药效实验结束后,处死裸鼠,取出Saline、10-HCPT和10-羟基喜树碱衍生物1组(5mg/kg)各制剂组裸鼠的肿瘤组织用10%福尔马林溶液固定一周后,进行石蜡包埋、切片和H&E染色。将染色好的病理切片置于显微镜下观察,拍照记录,结果如图10所示,其中,(A)为生理盐水组,(B)为10-HCPT组,(C)为10-羟基喜树碱衍生物1组。从肿瘤组织的H&E染色切片可见,生理盐水组肿瘤组织细胞核大量聚集,形态不规则,呈结节状,细胞核染色质增多且分布不均,核深染,颗粒变粗,呈墨水滴样,出现大片坏死细胞碎片;10-HCPT组肿瘤组织特征典型,核大深染,呈结节状,也看到有少量坏死细胞碎片;10-羟基喜树碱衍生物1组肿瘤组织特征典型,坏死较少,相比于10-HCPT组表现更强的肿瘤生长抑制效应。
通过分析给药后实验动物各器官组织病理切片,实验动物体重降低等指标。制剂的初步毒性研究显示:本发明制剂毒性较市售参比制剂更低。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!