用于抗体靶定P因子的组合物和方法与流程
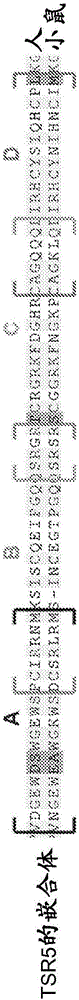
发明背景年龄相关性黄斑变性(AMD)是进行性疾病并且是年龄为65及以上美国老年人中视觉丧失和失明的主要原因。AMD主要影响黄斑;其为视网膜的一部分,负责阅读或开车所需要的高视敏度。大多数AMD患者遭受疾病早期阶段,其特征在于存在称为脉络膜小疣的细胞外视网膜沉积物。脉络膜小疣是细胞碎片、炎症介质和细胞外基质组分的细胞外视网膜沉积物。AMD的晚期阶段表现为干涩形式或湿润形式,两者均与视觉丧失相关。干涩AMD,也称为地图样萎缩,在眼底镜检上呈现为清晰划定的区域,其对应于视网膜色素上皮细胞(RPE)损失的局部区域。湿润AMD与脉络膜的新血管化相关,引起Bruch’s膜完整性的丧失和视网膜中脉管生长,在所述视网膜中可以经常出血。这种渗漏引起对视网膜细胞的永久性损伤,它们相继死亡的,并在中央视觉区产生盲点。人先天性系统由补体途径组成。补体途径作用于防御化脓性细菌感染,桥接先天性和适应性免疫;并去除免疫复合体的产物和炎性损伤。补体是在血浆和细胞表面参与级联反应的多于30种蛋白质的系统。补体系统及其补体组分参与多种免疫过程。例如,补体C5b-9复合体,也称为末端复合体或膜攻击复合体(MAC),通过诱导膜通透性损伤而在细胞死亡中起重要作用。存在三种已知的补体激活途径:经典途径、凝集素途径和备选途径。所有三种途径导致C3被C3转化酶切割,随后C5被C5转化酶切割,释放C3a、C5a和C5b。P因子是补体旁路途径的关键调节因子。提出其在体内具有两种主要的功能。首先,P因子通过结合转化酶的C3b而稳定C3和C5转化酶并由此延长C3转化酶的半衰期。其次,P因子可以通过附着到细胞表面并充当其上可以形成转化酶的模板来决定哪种细胞将被裂解,导致补体旁路途径的激活和细胞的裂解。近期工作已经证明,补体组分C3和C5是AMD患者中脉络膜小疣的主要成分。Mulling,R.F.等(2000)FASEBJ14,835-46。已经推测它们以及膜攻击复合体(MAC)C5b-9和其它急性期反应蛋白在脉络膜小疣上RPF细胞中的存在涉及可激发补体激活和MAC形成的过程。Johnson,L等(2001)ExpEyeRes73,887-896。因此,越来越多的证据表明,补体组分不仅仅是先天性免疫的介体。已经建议营养干预用于抑制干涩AMD发展成湿润AMD。目前,仅FDA批准的湿润AMD的治疗包括光动力学疗法(PDT)、抗VEGF适体,如pegaptanib,和抗VEGF抗体ranibizumab。这些药物或疗法通常向已患有重大视觉丧失的患者施用。仍然需要开发AMD,特别是干涩AMD的有效治疗,来替换或补充目前的治疗。尤其是,需要可以提供早期检测、预防或恢复视觉丧失的治疗。发明概述本发明涉及分离的抗体,或其抗原结合片段,其结合人或猕猴P因子,其中所述抗体结合TSR5结构域(SEQIDNO:406)。例如,本文所述的抗体或抗原结合片段结合包含SEQIDNO:407的序列的TSR5结构域的区域,更特别地所述抗体还结合包含氨基酸序列KSISC(SEQIDNO:408)的P因子TSR5结构域的区域。在某些实施方案中,所述分离的抗体或其抗原结合片段结合包含SEQIDNO:407的氨基酸序列的P因子表位。在其他实施方案中,所述分离的抗体或其抗原结合片段结合包含SEQIDNO:408的氨基酸序列的P因子表位。本文所述的分离的抗体或抗原结合片段以小于或等于1.2nM的KD结合P因子。例如,本文所述的分离的抗体或抗原结合片段可以以小于或等于1.1nM、小于或等于1nM、小于或等于600pM、小于或等于500pM、小于或等于400pM、小于或等于300pM、小于或等于200pM、小于或等于100pM、小于或等于75pM、小于或等于50pM、小于或等于40pM、小于或等于30pM、小于或等于20pM或小于或等于10pM的KD结合人或猕猴P因子。可以通过溶液平衡滴定(SET)确定本文所述的分离的抗体和抗原结合片段的结合亲和力。用于SET的方法为本领域所知并在下文中进一步详细描述。或者,可以通过Biacore测定确定本文所述的分离的抗体或片段的结合亲和力。用于Biacore动力学测定的方法为本领域所知并在下文中进一步详细描述。本文所述的分离的抗体和抗原结合片段可以用于抑制补体旁路途径。例如,如通过体外溶血测定所测定,分离的抗体或其抗原结合片段可以以小于或等于25nm、小于或等于20nM、小于或等于16nM、小于或等于15nM、小于或等于14nM、小于或等于13nM、小于或等于12nM、小于或等于11nM、小于或等于10nM、小于或等于9nM、小于或等于8nM、小于或等于7nM的IC50抑制所述补体旁路途径。更特别地,如通过体外溶血测定所测定,本文所述的分离的抗体或其抗原结合片段可以以小于或等于16nm或小于或等于9nM的IC50抑制所述补体旁路途径。如通过体外C3b沉积测定所测定,本文所述的分离的抗体或其抗原结合片段可以以小于或等于10nm、小于或等于7nM、小于或等于6nM、小于或等于5nM、小于或等于4nM、小于或等于3nM、小于或等于2nM、小于或等于1nM、小于或等于15nM、小于或等于1nM、小于或等于0.5nM、或小于或等于0.1nM的IC50抑制所述补体旁路途径。更特别地,如通过体外C3b沉积测定所测定,本文所述的分离的抗体或其抗原结合片段可以以小于或等于3nm、或小于或等于2nM的IC50抑制所述补体旁路途径。如通过补体膜攻击复合体的沉积测定,本文所述的分离的抗体或其抗原结合片段可以以小于或等于25nm、小于或等于20nM、小于或等于15nM、小于或等于10nM、小于或等于9nM、小于或等于8nM、小于或等于7nM、或小于或等于6nM的IC50抑制所述补体旁路途径。更特别地,如通过补体膜攻击复合体的沉积测定,本文所述的分离的抗体或其片段可以以小于或等于25nM、或小于或等于7.5nM的IC50抑制所述补体旁路途径。如通过C3a的产生测定,本文所述的分离的抗体或其抗原结合片段可以以小于或等于80nM、小于或等于50nM、小于或等于45nM、或小于或等于35nM的IC50抑制所述补体旁路途径。如通过iC3b的产生测定,本文所述的分离的抗体或其抗原结合片段还可以以小于或等于80nM、小于或等于50nM、小于或等于45nM、或小于或等于35nM的IC50抑制所述补体旁路途径。如通过C5a的产生测定,本文所述的分离的抗体或其抗原结合片段还可以以小于或等于80nM、小于或等于50nM、小于或等于45nM、或小于或等于35nM的IC50抑制所述补体旁路途径。如通过C5b的产生测定,本文所述的分离的抗体或其抗原结合片段还可以以小于或等于80nM、小于或等于50nM、小于或等于45nM、或小于或等于35nM的IC50抑制所述补体旁路途径。如通过C3a、C3b、iC3b、C5a和/或C5b的产生的减少测定,本文所述的分离的抗体或其抗原结合片段还可以通过去稳定和/或阻断C3和/或C5转化酶的活性来抑制所述补体旁路途径。本文所述的分离的抗体或其抗原结合片段还可以以小于或等于80nM、小于或等于50nM、小于或等于45nM、或小于或等于35nM的IC50抑制C5a的产生。所述分离的抗体或其抗原结合片段也可以阻断P因子结合C3a和/或防止P因子结合细胞表面或DNA或寡核苷酸。本发明的另一方面包括分离的抗体或其抗原结合片段,其特异地结合人、猕猴、大鼠和/或兔P因子。在其他方面,所述分离的抗体或抗原结合片段与表1中描述的抗体或抗原结合片段竞争结合。本文所述的分离的抗体或其抗原结合片段可以是单克隆抗体、人或人源化抗体、嵌合抗体、单链抗体、Fab片段、Fv片段、F(ab’)2片段、或ScFv片段和/或IgG同种型。本文所述的分离的抗体或其抗原结合片段还可以包括这样的构架,其中氨基酸已经替换成来自各人VH或VL种系序列的抗体构架。本发明的另一方面包括具有表1中描述的Fabs的重链和轻链序列的分离的抗体或其抗原结合片段。例如,分离的抗体或其抗原结合片段可以具有FabNVS962、NVS963、NVS964、NVS965、NVS966、NVS967、NVS962-G、NVS962-S、NVS962-T、NVS962-Q、NVS962-S31A、NVS965-Q、NVS965-S、NVS965-T、NVS804、NVS805、NVS806、NVS807或NVS808的重链和轻链序列。本发明的其他方面包括具有表1中描述的Fabs的重链和轻链可变域序列的分离的抗体或其抗原结合片段。例如,分离的抗体或其抗原结合片段可以具有FabNVS962、NVS963、NVS964、NVS965、NVS966、NVS967、NVS962-G、NVS962-S、NVS962-T、NVS962-Q、NVS962-S31A、NVS965-Q、NVS965-S、NVS965-T、NVS804、NVS805、NVS806、NVS807或NVS808的重链和轻链可变域序列。本发明还涉及分离的抗体或其抗原结合片段,其包括选自SEQIDNOs1、15、29、43、57、71、85、99、113、127、141、155、169、183、197、211、225、239、253和267的重链CDR1;选自SEQIDNOs:2、16、30、44、58、72、86、100、114、128、142、156、170、184、198、212、226、240、254和268的重链CDR2;和选自SEQIDNOs:3、17、31、45、59、73、87、101、115、129、143、157、171、185、199、213、227、241、255和269的重链CDR3,其中所述分离的抗体或其抗原结合片段结合人P因子。在另一方面,所述分离的抗体或其抗原结合片段进一步包括选自SEQIDNOs4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256和270的轻链CDR1;选自SEQIDNOs5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257和271的轻链CDR2;和选自SEQIDNOs6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258和272的轻链CDR3。本发明还涉及分离的抗体或其抗原结合片段,其包括选自SEQIDNOs4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256和270的轻链CDR1;选自SEQIDNOs5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257和271的轻链CDR2;和选自SEQIDNOs6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258和272的轻链CDR3,其中所述分离的抗体或其抗原结合片段结合人P因子。本发明还涉及结合P因子的分离的抗体或其抗原结合片段,其具有HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs:1、2、3,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:4、5、6;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs15、16、17,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:18、19、20;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs29、30、31,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:32、33、34;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs43、44、45,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:46、47、48;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs57、58、59,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:60、61、62;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs71、72、73,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:74、75、76;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs85、86、87,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:88、89、90;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs99、100、101,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:102、103、104;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs113、114、115,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:116、117、118;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs127、128、129,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:130、131、132;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs141、142、143,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:144、145、146;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs155、156、157,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:158、159、160;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs169、170、171,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:172、173、174;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs183、184、185,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:186、187、188;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs197、198、199,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:200、201、202;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs211、212、213,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:214、215、216;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs225、226、227,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:228、229、230;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs239、240、241,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:242、243、244;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs253、254、255,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:256、257、258;或HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,其中HCDR1、HCDR2、HCDR3包含SEQIDNOs267、268、269,并且LCDR1、LCDR2、LCDR3包含SEQIDNOs:270、271、272。在本发明的一个实施方案中,所述分离的抗体或其抗原结合片段包括选自SEQIDNOs:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259和273的重链可变域序列。在另一实施方案中,所述分离的抗体或抗原结合片段进一步包含轻链可变域序列,其中所述重链可变域序列和轻链可变域序列组合形成对P因子的抗原结合位点。在其他实施方案中,所述分离的抗体或抗原结合片段进一步包括选自SEQIDNOs:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的轻链可变域序列,其中所述分离的抗体或其抗原结合片段结合P因子。本发明还涉及分离的抗体或其抗原结合片段,其包括选自SEQIDNOs:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的轻链可变域序列,其中所述分离的抗体或其抗原结合片段结合人P因子。在一个实施方案中,所述分离的抗体或抗原结合片段进一步包含重链可变域序列,其中所述轻链可变域序列和重链可变域序列组合形成对P因子的抗原结合位点。在本发明的另一实施方案中,结合P因子的所述分离的抗体或其抗原结合片段可以具有这样的重链和轻链可变域,其分别包含SEQIDNOs:7和8;21和22;35和36;49和50;63和64;77和78;91和92;104和105;118和119;132和133;146和147;160和161;174和175;188和189;202和203;216和217;230和231;244和245;258和259;或272和273的序列。本发明进一步涉及分离的抗体或其抗原结合片段,其包括与选自SEQIDNOs:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259和273的序列具有至少90%序列同一性的重链可变域,其中所述抗体结合P因子。一方面,所述分离的抗体或其抗原结合片段还包括与选自SEQIDNOs8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的序列具有至少95%序列同一性的轻链可变域。在另一实施方案中,所述分离的抗体或其抗原结合片段可以包括与选自SEQIDNOs8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的序列具有至少90%序列同一性的轻链可变域,其中所述抗体结合P因子。在另一实施方案中,结合P因子的分离的抗体或其抗原结合片段可以具有包含SEQIDNO:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261或275的序列的重链。在其他实施方案中,所述分离的抗体还包括可以这样的轻链,其与重链组合以形成人P因子的抗原结合位点。在其他实施方案中,所述分离的抗体或其抗原结合片段包括这样的轻链,其具有包含SEQIDNO:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262或276的序列。本发明仍然进一步涉及分离的抗体或其抗原结合片段,其包括与选自SEQIDNOs9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261和275的序列具有至少90%序列同一性的重链,其中所述抗体结合P因子。一方面,所述分离的抗体或其抗原结合片段还包括与选自SEQIDNOs10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262和276的序列具有至少95%序列同一性的轻链。本发明仍然进一步涉及分离的抗体或其抗原结合片段,其包括与选自SEQIDNOs9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261和275的序列具有至少90%序列同一性的轻链,其中所述抗体结合P因子。本发明还涉及组合物,其包含本文所述的分离的抗体或其抗原结合片段。以及与药学上可接受的载体组合的抗体组合物。特别地,本发明进一步包括药物组合物,其包含表1的抗体或其抗原结合片段,如例如抗体NVS962、NVS963、NVS964、NVS965、NVS966、NVS967、NVS962-G、NVS962-S、NVS962-T、NVS962-Q、NVS962-S31A、NVS965-Q、NVS965-S、NVS965-T、NVS804、NVS805、NVS806、NVS807或NVS808。本发明还涉及药物组合物,其包含表1的两种或更多种分离的抗体或其抗原结合片段的组合。本发明还涉及包含这样的序列的分离的核酸,所述序列编码包括与选自SEQIDNOs:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259和273的序列具有至少90%序列同一性的重链可变域的多肽。本发明还涉及包含这样的序列的分离的核酸,所述序列编码包括与选自SEQIDNOs8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的序列具有至少90%序列同一性的轻链可变域的多肽。本发明还涉及包括本文所述一个或多个核酸分子的载体。本发明还涉及分离的宿主细胞,其包括编码上述抗体的重链的重组DNA序列,和编码上述抗体的轻链的第二个重组DNA序列,其中所述DNA序列有效连接启动子,并能够在宿主细胞中表达。期望抗体可以是人单克隆抗体。还期望宿主细胞是非人哺乳动物细胞。本发明还涉及抑制补体介导的细胞死亡的方法,其中所述方法包括使所述细胞与有效量的组合物接触的步骤,所述组合物包含本发明所述的分离的抗体或其抗原结合片段。期望细胞是人细胞。进一步期望细胞位于受试者内。仍然进一步期望受试者是人。本发明仍然进一步涉及在细胞中抑制补体旁路途径的方法,其中所述方法包括使所述细胞与有效量的组合物接触的步骤,所述组合物包含本发明所述的分离的抗体或其抗原结合片段。一方面,期望细胞是人细胞。进一步期望细胞位于受试者内。仍然进一步期望受试者是人。本发明还涉及在细胞中抑制膜攻击复合体形成的方法,其中所述方法包括使所述细胞与有效量的组合物接触的步骤,所述组合物包含本发明所述的分离的抗体或其抗原结合片段。期望细胞是人细胞。进一步期望细胞位于受试者内。仍然进一步期望受试者是人。上述分离的抗体或其抗原结合片段中的任一种可以是单克隆抗体或其抗原结合片段。一方面,本发明提供第一种抗体或其抗原结合片段,其结合P因子,和第二种抗体或其抗原结合片段,其结合C5,其中所述组合抑制补体旁路途径。一方面,所述第一种和第二种抗体可以组合为组合物。该组合可以用于抑制眼睛炎症。眼睛炎症可以通过测定视网膜中的嗜中性粒细胞积累和/或巨噬细胞募集来确定。一方面,该组合可以用于抑制视网膜中的嗜中性粒细胞积累,或视网膜中的巨噬细胞募集。一方面,该组合中结合P因子的抗体结合包含SEQIDNO:408的P因子的区域。备选或组合地,该抗体结合包含SEQIDNO:407的P因子的区域。在其他方面,结合P因子和C5的抗体或其结合片段包括选自表1的第一种抗体或抗原结合片段和选自表2的第二种抗体或抗原结合片段。一方面,所述第一种抗体或其抗原结合片段与表1所述的抗体结合相同的表位,并且所述第二种抗体或其抗原结合片段与表2所述的抗体结合相同的表位。一方面,本发明提供第一种抗体或其抗原结合片段,其包含重链CDR1、2、3和轻链CDR1、2、3,其选自a)如SEQIDNOs:1、2和3中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:4、5和6中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;b)如SEQIDNOs:15、16和17中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:18、19和20中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;c)如SEQIDNOs:29、30和31中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:32、33和34中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;d)如SEQIDNOs:43、44和45中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:46、47和48中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;e)如SEQIDNOs:57、58和59中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:60、61和62中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;f)如SEQIDNOs:71、72和73中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:74、75和76中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;g)如SEQIDNOs:85、86和87中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:88、89和90中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;h)如SEQIDNOs:99、100和101中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:102、103和104中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;i)如SEQIDNOs:113、114和115中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:116、117和118中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;j)如SEQIDNOs:127、128和129中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:130、131和132中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;k)如SEQIDNOs:141、142和143中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:144、145和146中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;l)如SEQIDNOs:155、156和157中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:158、159和160中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;m)如SEQIDNOs:169、170和171中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:172、173和174中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;n)如SEQIDNOs:183、184和185中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:186、187和188中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;o)如SEQIDNOs:197、198和199中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:200、201和202中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;p)如SEQIDNOs:211、212和213中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:214、215和216中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;q)如SEQIDNOs:225、226和227中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:228、229和230中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;r)如SEQIDNOs:239、240和241中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:242、243和244中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;s)如SEQIDNOs:253、254和255中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:256、257和258中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;和t)如SEQIDNOs:267、268和269中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:270、271和272中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3,并且其中所述第二种抗体或其抗原结合片段包含重链CDR1、2、3和轻链CDR1、2、3,其选自a)如SEQIDNOs:410、411和412中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:413、414和415中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;b)如SEQIDNOs:426、427和428中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:429、430和431中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;c)如SEQIDNOs:442、443和444中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:445、446和447中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;d)如SEQIDNOs:426、458和428中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:429、430和459中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3;和e)如SEQIDNOs:470、471和472中分别阐明的重链可变区HCDR1、HCDR2和HCDR3,和如SEQIDNOs:473、474和475中分别阐明的轻链可变区LCDR1、LCDR2和LCDR3。一方面,本发明涉及第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中所述第一种抗体或其抗原结合片段包括这样的重链和轻链可变区,其具有分别与SEQIDNOs:7和8;SEQIDNOs:21和22;SEQIDNOs:35和36;SEQIDNOs:49和50;SEQIDNOs:63和64;SEQIDNOs:77和78;SEQIDNOs:91和92;SEQIDNOs:105和106;SEQIDNOs:119和120;SEQIDNOs:133和134;SEQIDNOs:147和148;SEQIDNOs:161和162;SEQIDNOs:175和176;SEQIDNOs:189和190;SEQIDNOs:203和204;SEQIDNOs:217和218;SEQIDNOs:231和232;SEQIDNOs:245和246;SEQIDNOs:259和260;或SEQIDNOs:273和274具有至少90%同一性的氨基酸序列;并且其中所述第二种抗体或其抗原结合片段包括这样的重链和轻链可变区,其具有分别与SEQIDNOs:416和417;SEQIDNOs:432和433;SEQIDNOs:448和449;SEQIDNOs:460和461;或SEQIDNOs:476和477具有至少90%同一性的氨基酸序列。一方面,本发明涉及第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中所述第一种抗体或其抗原结合片段包括这样的重链和轻链可变区,其具有分别选自SEQIDNOs:7和8;SEQIDNOs:21和22;SEQIDNOs:35和36;SEQIDNOs:49和50;SEQIDNOs:63和64;SEQIDNOs:77和78;SEQIDNOs:91和92;SEQIDNOs:105和106;SEQIDNOs:119和120;SEQIDNOs:133和134;SEQIDNOs:147和148;SEQIDNOs:161和162;SEQIDNOs:175和176;SEQIDNOs:189和190;SEQIDNOs:203和204;SEQIDNOs:217和218;SEQIDNOs:231和232;SEQIDNOs:245和246;SEQIDNOs:259和260;或SEQIDNOs:273和274的氨基酸序列;并且其中所述第二种抗体或其抗原结合片段包括这样的重链和轻链可变区,其具有分别选自SEQIDNOs:416和417;SEQIDNOs:432和433;SEQIDNOs:448和449;SEQIDNOs:460和461;或SEQIDNOs:476和477的氨基酸序列。在其他方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中(a)所述第一种抗体或其抗原结合片段包括这样的重链可变区,其包含SEQIDNO:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259或273,并进一步包括轻链可变区,其中所述重链可变区和所述轻链可变区组合形成对P因子的抗原结合位点,并且(b)其中所述第二种抗体或其抗原结合片段包括这样的重链可变区,其包含SEQIDNO:416、432、448、460或476,并进一步包括轻链可变区,其中所述重链可变区和所述轻链可变区组合形成对C5的抗原结合位点。在其他方面,所述第一种抗体或其抗原结合片段包括SEQIDNO:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260或274的轻链可变区序列,并且所述第二种抗体或其抗原结合片段包括SEQIDNO:417、433、449、461或477的轻链可变区序列。在其他方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中(a)所述第一种抗体或其抗原结合片段包括这样的轻链可变域,其包含SEQIDNO:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260或274,并进一步包括重链可变域,其中所述轻链可变域和所述重链可变域组合形成对P因子的抗原结合位点,并且(b)其中所述第二种抗体或其抗原结合片段包括这样的轻链可变域,其包含SEQIDNO:417、433、449、461或477,并进一步包括重链可变域,其中所述轻链可变域和所述重链可变域组合形成对C5的抗原结合位点。一方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中(a)所述第一种抗体或其抗原结合片段包括SEQIDNO:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261或275的重链,并进一步包括轻链,其中所述重链和所述轻链组合形成对P因子的抗原结合位点,并且(b)其中所述第二种抗体或其抗原结合片段包括SEQIDNO:418、434、450、462或478的重链,并进一步包括轻链,其中所述重链和所述轻链组合形成对C5的抗原结合位点。其他方面,所述第一种抗体或其抗原结合片段包括SEQIDNO:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262或276的轻链,并且其中所述第二种抗体或其抗原结合片段包括SEQIDNO:419、435、451、463或479的轻链。一方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中(a)所述第一种抗体或其抗原结合片段包括SEQIDNO:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262或276的轻链,并进一步包括重链,其中所述轻链和所述重链组合形成对P因子的抗原结合位点,并且(b)其中所述第二种抗体或其抗原结合片段包括SEQIDNO:419、435、451、463或479的轻链,并进一步包括重链,其中所述轻链和所述重链组合形成对C5的抗原结合位点。一方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中所述第一种抗体或其抗原结合片段包括这样的重链,其具有与SEQIDNO:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261或275具有至少90%序列同一性的氨基酸序列,并进一步包括这样的轻链,其具有与SEQIDNO:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262或276具有至少90%序列同一性的氨基酸序列,并且其中所述第二种抗体或其抗原结合片段包括这样的重链,其具有与SEQIDNO:418、434、450、462或478具有至少90%序列同一性的氨基酸序列,并进一步包括这样的轻链,其具有与SEQIDNO:419、435、451、463或479具有至少90%序列同一性的氨基酸序列。在其他方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中所述第一种抗体或其抗原结合片段包括这样的重链,其具有选自SEQIDNO:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261或275的氨基酸序列,并进一步包括这样的轻链,其具有选自SEQIDNO:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262或276的氨基酸序列,并且其中所述第二种抗体或其抗原结合片段包括这样的重链,其具有选自SEQIDNO:418、434、450、462或478的氨基酸序列,并进一步包括这样的轻链,其具有选自SEQIDNO:419、435、451、463或479的氨基酸序列。在其他方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中所述第一种抗体或其抗原结合片段包括这样的重链和轻链,其分别具有与SEQIDNO:9和10、23和24、37和38、51和52、65和66、79和80、93和94、107和108、121和122、135和136、149和150、163和164、177和178、191和192、205和206、219和220、233和234、247和248、261和262或275和276具有至少90%序列同一性的氨基酸序列;并且其中所述第二种抗体或其抗原结合片段包括这样的重链和轻链,其分别具有与SEQIDNOs:418和419、434和435;450和451;462和463;或478和479具有至少90%序列同一性的氨基酸序列。在仍然其他方面,本发明包括第一种和第二种抗体或其抗原结合片段(其可以组合为组合物),其中所述第一种抗体或其抗原结合片段包括这样的重链和轻链,其分别具有选自SEQIDNO:9和10、23和24、37和38、51和52、65和66、79和80、93和94、107和108、121和122、135和136、149和150、163和164、177和178、191和192、205和206、219和220、233和234、247和248、261和262或275和276的氨基酸序列;并且其中所述第二种抗体或其抗原结合片段包括这样的重链和轻链,其分别具有选自SEQIDNOs:418和419、434和435;450和451;462和463;或478和479的氨基酸序列。本发明进一步涉及分离的核酸分子,其包含编码本文所述第一种和/或第二种抗体或其抗原结合片段的核苷酸序列。该核酸序列可以包括在载体中,其可以依次包括在宿主细胞中,一方面所述宿主细胞能够表达该核酸序列。本发明进一步涉及在受试者中治疗年龄相关性黄斑变性的方法,其包括向所述受试者单独或组合为组合物施用有效量的第一种和第二种抗体或其抗原结合片段。所述受试者可以是人。本发明进一步涉及在受试者中抑制补体旁路途径的方法,其包括向所述受试者单独或组合为组合物施用有效量的第一种和第二种抗体或其抗原结合片段。所述受试者可以是人。定义除非另有定义,本文所用的所有技术和科学术语具有本发明所属领域中普通技术人员通常理解的相同意思。如本文所用的术语“抗体”表示完整抗体及其任何抗原结合片段(即“抗原结合部分”)或单链。完整抗体是包含通过二硫键相互连接的至少两条重(H)链和两条轻(L)链的糖蛋白。每一重链包含重链可变区(本文缩写为VH)和重链恒定区。所述重链恒定区包含三个结构域,CH1、CH2和CH3。每一轻链包含轻链可变区(本文缩写为VL)和轻链恒定区。所述轻链恒定区包含一个结构域CL。VH和VL区可进一步细分成高变区,称为互补决定区(CDR),它们散布着称为构架区(FR)的更保守的区域。每一VH和VL由以下面顺序从氨基末端到羧基末端排列的三个CDR和四个FR组成:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。重链和轻链的可变区含有与抗原相互作用的结合域。抗体的恒定区可介导免疫球蛋白与宿主组织或因子,包括免疫系统的多种细胞(例如效应细胞)和经典补体系统的第一个组分(Clq)的结合。如本文所用,术语抗体的“抗原结合部分”或“抗原结合片段”指完整抗体的一个或多个片段,其保留与给定抗原(例如P因子)特异性结合的能力。可通过完整抗体的片段进行抗体的抗原结合功能。术语抗体的抗原结合部分或抗原结合片段中包括的结合片段的实例包括Fab片段,其为VL、VH、CL和CH1结构域组成的单价片段;F(ab)2片段,其为包含在铰链区通过二硫键连接的两个Fab片段的二价片段;由VH和CH1结构域组成的Fd片段;由抗体单条臂的VL和VH结构域组成的Fv片段;单结构域抗体(dAb)片段(Ward等,1989Nature341:544-546),其由VH结构域或VL结构域组成;和分离的互补决定区(CDR)。此外,尽管Fv片段的两个结构域VL和VH由单独的基因编码,但可使用重组方法,通过人工肽接头将它们连接,所述人工肽接头使得它们能够制备成单条蛋白质链,其中VL和VH区域配对形成单价分子(称为单链Fv(scFv);参见例如Bird等,1988Science242:423-426;和Huston等,1988Proc.Natl.Acad.Sci.85:5879-5883)。此类单链抗体包括抗体的一个或多个抗原结合部分或片段。使用本领域技术人员已知的常规技术获得这些抗体片段,并筛选所述片段,以与完整抗体相同的方式使用所述片段。抗原结合片段也可掺入到单结构域抗体、巨型抗体(maxibodies)、微型抗体(minibodies)、胞内抗体、双抗体、三抗体、四抗体、v-NAR和bis-scFv(参见例如Hollinger和Hudson,2005,NatureBiotechnology,23,9,1126-1136)。抗体的抗原结合部分可移植到基于多肽如III型纤连蛋白(Fn3)的支架中(参见美国专利号6,703,199,其描述了纤连蛋白多肽单抗体体)。抗原结合片段可掺入到包含一对串联Fv区段(VH-CH1-VH-CH1)的单链分子中,所述串联Fv区段与互补轻链多肽一起形成一对抗原结合区(Zapata等,1995ProteinEng.8(10):1057-1062;和美国专利号5,641,870)。如本文所用,术语“亲和力”指抗体与抗原在单个抗原位点上相互作用的强度。在每一抗原位点中,抗体“臂”的可变区与抗原在许多位点上通过弱的非共价力相互作用;相互作用越多,亲和力越强。如本文所用,术语对IgG抗体或其片段(例如Fab片段)的“高亲和力”指抗体对靶标抗原具有10-8M或更低、10-9M或更低、或10-10M,或10-11M或更低、或10-12M或更低、或10-13M或更低的KD。然而,高亲和力结合对其他抗体同种型可以变化。例如,对IgM同种型的高亲和力结合指抗体具有10-7M或更低、10-8M或更低的KD。术语“氨基酸”指天然发生的和合成的氨基酸,以及与天然发生的氨基酸以相似方式起作用的氨基酸类似物和氨基酸模拟物。天然发生的氨基酸是由遗传密码编码的那些氨基酸,以及稍后被例如羟脯氨酸、γ-羧基谷氨酸和O-磷酸丝氨酸修饰的那些氨基酸。氨基酸类似物指这样的化合物,其与天然发生的氨基酸具有相同的基本化学结构,即与氢结合的α碳、羧基、氨基和R基团,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲锍。此类类似物具有修饰的R基团(例如,正亮氨酸)或修饰的肽骨架,但保留了与天然发生的氨基酸相同的基本化学结构。氨基酸模拟物指具有与氨基酸的一般化学结构不同结构的化合物,但它以与天然发生的氨基酸类似的方式起作用。如本文所用,术语“结合特异性”指各抗体结合位点与仅一个抗原决定簇反应的能力。短语“特异性(或选择性)结合”抗体(例如,P因子结合抗体)指决定近亲抗原(例如人P因子或猕猴P因子)在蛋白质和其它生物产品的异质群体中的存在的结合反应。短语“识别抗原的抗体”和“对抗原特异的抗体”在本文中可与术语“特异性结合抗原的抗体”互换使用。术语“与黄斑变性相关的状况或病症”指许多状况中的任何一种,其中例如由于黄斑细胞的降低生长、黄斑细胞(例如,RPE细胞)的增加死亡或重排、正常生物功能的丧失、或这些事件的组合,视网膜黄斑变性或变得功能失调。黄斑变性导致细胞组织结构的完整性和/或正常黄斑的细胞外基质丧失和/或黄斑细胞的功能丧失。黄斑变性相关病症的实例包括AMD、北卡罗莱纳州的黄斑营养不良、Sorsby's眼底营养不良、隐性黄斑营养不良、模式营养不良、卵黄状黄斑变性、显性脉络膜小疣和malattialeventinese(放射型脉络膜小疣)。所述术语还包括发生于黄斑功能失调和/或变性之前或之后的黄斑外改变。因此,术语“黄斑变性相关的病症”还广泛地包括改变或损害黄斑完整性或功能的任何状况(例如,对RPE或Bruch's膜的损害)。例如,该术语包括视网膜剥离、脉络膜视网膜变性、视网膜变性、光感受器变性、RPE变性、粘多糖增多症、视杆-视椎营养不良、视椎-视杆营养不良和视椎变性。术语“补体组分”、“补体蛋白质”或“补体组分蛋白质”指参与补体系统激活的分子。经典途径组分包括例如,C1q、C1r、C1s、C4、C2、C3、C5、C6、C7、C8、C9和C5b-9复合体(膜攻击复合体:MAC)。备选途径组分包括例如,B因子、D因子、H因子、I因子和备解素。术语“受补体途径调节的细胞活性”包括由C5b-9攻击复合体、血管渗透性改变、平滑肌细胞收缩和迁移、T细胞增殖、免疫粘附、树状突细胞、单核细胞、粒细胞和血小板凝集、嗜中性粒细胞(PMN)和巨噬细胞的吞噬作用、迁移和激活引起的细胞损伤。此外,补体途径的激活导致补体途径内副产物引起的促炎症反应增加。与补体途径激活相关的病症包括肾炎、哮喘、再灌注损伤、血液透析、类风湿性关节炎、全身性红斑狼疮、牛皮癣、多发性硬化症、移植、阿尔茨海默氏病、aHUS、MPGNII或任何其他补体介导的疾病。与黄斑变性相关的病症包括AMD、北卡罗莱纳州的黄斑营养不良、Sorsby's眼底营养不良、隐性黄斑营养不良、模式营养不良、卵黄状黄斑变性、显性脉络膜小疣和malattialeventinese(放射型脉络膜小疣)、黄斑功能失调和/或变性之前或之后的黄斑外改变、视网膜剥离、脉络膜视网膜变性、视网膜变性、光感受器变性、RPE变性、粘多糖增多症、视杆-视椎营养不良、视椎-视杆营养不良和视椎变性。术语“嵌合抗体”是这样的抗体分子,其中(a)恒定区或其部分被改变、替换或交换,使得抗原结合位点(可变区)连接不同种类或改变种类、效应功能和/或物种的恒定区,或赋予嵌合抗体新性质的完全不同的分子,例如酶、毒素、激素、生长因子、药物等;或(b)可变区或其部分被具有不同或改变抗原特异性的可变区改变、替换或交换。例如,可通过来自人免疫球蛋白的恒定区替换小鼠恒定区来修饰小鼠抗体。由于用人恒定区进行替换,嵌合抗体在识别抗原中可保留其特异性,同时与最初的小鼠抗体相比,在人中具有降低的抗原性。术语“P因子蛋白质”或“P因子抗原”或“P因子”可互换使用,并指不同物种中的P因子蛋白质。例如,人P因子具有如表1:SEQIDNO:401中阐明的序列。可从ComplementTech,Tyler,TX获得人P因子。可从猕猴血清中纯化猕猴P因子(从Nakano等,(1986)JImmunolMethods90:77-83改编的方案)。来自其他物种的P因子蛋白质的实例提供于表1、SEQIDNOs:402、403、404或405以及P因子蛋白质结合结构域和片段(例如SEQIDNOs:406、407或408)中。P因子在本领域中也称为“备解素”。术语“保守修饰的变体”应用到氨基酸和核酸序列。对于特定核酸序列,保守修饰的变体指编码相同或基本相同氨基酸序列的那些核酸,或者其中所述核酸不编码氨基酸序列,则指基本相同的序列。因为遗传密码的简并性,大量功能相同的核酸编码任何给定的蛋白质。例如,密码子GCA、GCC、GCG和GCU均编码氨基酸丙氨酸。因此,在每一位置上(其中密码子确定丙氨酸),可将所述密码子改变成任何所述相应的密码子,而不改变所编码的多肽。此类核酸变异是“沉默变异”,其为保守修饰变异的一种。本文编码多肽的每一核酸序列也描述了所述核酸的每一种可能的沉默变异。本领域技术人员将认识到可修饰核酸中的每一密码子(除了AUG,其通常是甲硫氨酸的唯一密码子,和TGG,其通常是色氨酸的唯一密码子),以产生功能上相同的分子。因此,在每一所述序列中暗含了编码多肽的核酸的每一沉默变异。对于多肽序列,“保守修饰的变体”包括对多肽序列的各取代、缺失或添加,其导致对氨基酸用化学上类似的氨基酸进行替换。提供功能上类似的氨基酸的保守替换表为本领域所熟知。此类保守修饰变体除了并且不排斥本发明的多态性变体、种间同源物和等位基因。以下8组含有彼此为保守替换的氨基酸:1)丙氨酸(A)、甘氨酸(G);2)天冬氨酸(D),谷氨酸(E);3)天冬酰胺(N),谷氨酰胺(Q);4)精氨酸(R),赖氨酸(K);5)异亮氨酸(I),亮氨酸(L),甲硫氨酸(M),缬氨酸(V);6)苯丙氨酸(F),酪氨酸(Y),色氨酸(W);7)丝氨酸(S),苏氨酸(T);和8)半胱氨酸(C)、甲硫氨酸(M)(参见例如,Creighton,Proteins(1984))。在一些实施方案中,术语“保守序列修饰”用于指不显著影响或改变含有氨基酸序列的抗体的结合特征的氨基酸修饰。术语“表位”表示能够特异性结合抗体的蛋白质决定簇。表位一般由分子的化学活性表面基团,如氨基酸或糖侧链组成,并一般具有特定的三维结构特征,以及比电荷特征。构象和非构象表位可以区分开,因为在变性溶剂的存在下失去与前者的结合,而不失去与后者的结合。如本文所用,术语“人抗体”旨在包括具有可变区的抗体,在所述可变区中构架和CDR区均来自人来源的序列。此外,如果抗体含有恒定区,所述恒定区也来自此类人序列,例如人种系序列,或突变形式的人种系序列。本发明的人抗体可包括不由人序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。术语“人单克隆抗体”指具有可变区的显示单一结合特异性的抗体,在所述可变区中构架和CDR区均来自人序列。在一个实施方案中,所述人单克隆抗体由杂交瘤产生,所述杂交瘤包括从转基因非人动物,例如转基因小鼠中获得的B细胞,所述转基因非人动物具有融合到无限增殖细胞中的包含人重链转基因和轻链转基因的基因组。“人源化”抗体是保留非人抗体的反应性,而在人中具有更低免疫原性的抗体。例如这可通过保留非人CDR区并用它们的人类对应物替换抗体剩余部分(即,恒定区以及可变区的构架部分)来实现。参见例如,Morrison等,Proc.Natl.Acad.Sci.USA,81:6851-6855,1984;Morrison和Oi,Adv.Immunol.,44:65-92,1988;Verhoeyen等,Science,239:1534-1536,1988;Padlan,Molec.Immun.,28:489-498,1991;和Padlan,Molec.Immun.,31:169-217,1994。人工程化技术的其它实例包括,但不限于在US5,766,886中公开的Xoma技术。在两条或更多核酸或多肽序列的上下文中,术语“相同的”或百分比“同一性”指相同的两条或更多序列或子序列。当使用以下的序列比较算法或通过手工比对和视觉检查测定,比较并比对在比较窗内或指定区域内用于最大对应时,如果两条序列具有特定百分比(即,在特定区域上或当不指定时,在全长序列上60%同一性,任选地65%、70%、75%、80%、85%、90%、95%或99%同一性)的相同氨基酸残基或核苷酸,那么两条序列“基本相同”。任选地,同一性存在于长度至少约50个核苷酸(或10个氨基酸)的区域,或更优选地在长度至少100到500或1000或更多核苷酸(或20、50、200或更多氨基酸)的区域。对于序列比较,通常一条序列作为参考序列,测试序列与其进行比较。当使用序列比较算法时,将测试和参考序列输入计算机,如果需要,指定子序列坐标,并指定序列算法程序参数。可使用默认程序参数,或可指定可选参数。所述序列比较算法然后基于程序参数计算测试序列相对于参考序列的百分比序列同一性。如本文所用,“比较窗口”包括参考选自20到600、一般约50到约200,更一般约100到约150的任何一定数量相邻位置的区段,其中可在两条序列进行最佳比对后将序列与相同数量相邻位置的参考序列进行比较。用于比较的序列比对方法为本领域所熟知。例如通过Smith和Waterman(1970)Adv.Appl.Math.2:482c的局部同源性算法,通过Needleman和Wunsch,J.Mol.Biol.48:443,1970的同源性比对算法,通过搜索Pearson和Lipman,Proc.Nat’l.Acad.Sci.USA85:2444,1988的相似性方法,通过这些算法的计算机化实现(WisconsinGeneticsSoftwarePackage,GeneticsComputerGroup,575ScienceDr.,Madison,WI中的GAP、BESTFIT、FASTA和TFASTA),或通过手工比对和视觉检查(参见,例如Brent等,CurrentProtocolsinMolecularBiology,JohnWiley&Sons,Inc.(Ringbou编辑,2003))进行序列最佳比对用于比较。适合于测定百分比序列同一性和序列相似性的算法的两个实例是BLAST和BLAST2.0算法,其分别描述于Altschul等,Nuc.AcidsRes.25:3389-3402,1977;和Altschul等,J.Mol.Biol.215:403-410,1990中。用于进行BLAST分析的软件通过NationalCenterforBiotechnologyInformation公开获得。该算法包括首先通过鉴定查询序列中长度为W的短字来鉴定高得分序列对(HSPs),当在数据库序列中用相同长度的字比对时,所述短字匹配或满足某一正值阈值得分T。T称为邻近字得分阈值(Altschul等,上文)。这些初始邻近字命中作为起始搜索的种子,以发现含有它们的更长HSPs。只要可增加累积比对得分,则沿每一序列的两个方向延伸字命中。对于核苷酸序列,使用参数M(对一对匹配残基的奖赏得分;总>0)和N(对错配残基的罚分;总<0)计算累积得分。对于氨基酸序列,使用得分矩阵来计算累积得分。当:所述累积比对得分从其最高达到值跌落X量;因一个或更多负得分残基比对累积,所述累积比对得分到达零或以下;或到达任何一条序列的末端时,停止字命中在每一方向上的延伸。BLAST算法参数W、T和X决定了比对的灵敏度和速度。BLASTN程序(对于核苷酸序列)使用默认字长(W)11、期望值(E)10、M=5、N=-4和两条链的比较。对于氨基酸序列,BLASTP程序使用默认字长3,和期望值(E)10和BLOSUM62得分矩阵(参见Henikoff和Henikoff,Proc.Natl.Acad.Sci.USA89:10915,1989)比对(B)50、期望值(E)10、M=5、N=-4和两条链的比较。BLAST算法也进行两条序列之间相似性的统计学分析(参见例如,Karlin和Altschul,Proc.Natl.Acad.Sci.USA90:5873-5787,1993)。BLAST算法提供的一种相似性测量是最小总和概率(P(N)),其提供两条核苷酸或氨基酸序列之间偶然发生匹配的概率的指示。例如,如果测试核酸与参考核酸的比较中最小总和概率低于约0.2,更优选低于约0.01,并最优选低于约0.001,那么认为核酸与参考序列相似。也可使用已经整合到ALIGN算法(版本2.0)的E.Meyers和W.Miller(Comput.Appl.Biosci.,4:11-17,1988)的算法,使用PAM120加权残基表,空位长度罚分12和空位罚分4测定两条氨基酸序列之间的百分比同一性。此外,可使用已经整合到GCG软件包(可在万维网gcg.com上获得)中的GAP程序的Needleman和Wunsch(J.Mol,Biol.48:444-453,1970)算法,使用Blossom62矩阵或PAM250矩阵,以及空位加权16、14、12、10、8、6或4和长度加权1、2、3、4、5或6来测定两条氨基酸序列之间的百分比同一性。除了上文指出的序列同一性的百分比,两条核酸序列或多肽基本相同的另一指示是第一条核酸编码的多肽与针对第二条核酸编码的多肽产生的抗体免疫交叉反应,如下文描述。因此,多肽通常与第二条多肽基本相同,例如,其中两条肽仅因保守替换而不同。两条核酸序列基本相同的另一指示是两个分子或其互补序列在严格条件下彼此杂交,如下文描述。两条核酸序列基本相同的又一指示是可使用相同的引物来扩增所述序列。术语“抑制补体旁路途径”指P因子抗体干扰补体旁路途径激活的能力。特别地,“抑制”指如在细胞或受试者与本文所述的抗P因子抗体或其片段接触后通过本文所述的一种或多种测定法(包括MAC形成、溶血测定法或C3b沉积测定法)所测定,备选补体激活相对于对照在统计学上的显著降低(即,p<0.05)。如本文所用,“抑制补体旁路途径”还可以指在诊断患有下文所述年龄相关性黄斑变性的患者中利用本文所述的抗P因子抗体治疗后视觉功能或视网膜解剖学上的临床相关改善。术语“分离的抗体”指抗体,其基本不含具有不同抗原特异性的其它抗体(例如,特异性结合P因子的分离的抗体基本不含特异性结合除P因子外的抗原的抗体)。然而,特异性结合P因子的分离的抗体可对其它抗原具有交叉反应性。此外,分离的抗体可基本不含其它细胞物质和/或化学品。术语“同种型”指重链恒定区基因提供的抗体种类(例如,IgM、IgE、IgG如IgG1或IgG4)。同种型也包括这些种类中一种的修饰形式,其中已经进行修饰以改变Fc功能,例如来增强或减弱效应功能或与Fc受体的结合。如本文所用,术语“Kassoc”或“Ka”旨在指特定抗体-抗原相互作用的结合速率,而如本文所用,术语“Kdis”或“Kd”旨在指特定抗体-抗原相互作用的解离速率。如本文所用,术语“KD”旨在指解离常数,其获得于Kd与Ka的比值(即Kd/Ka)并表达为摩尔浓度(M)。可使用本领域熟知的方法测定抗体的KD值。用于测定抗体KD的方法包括使用生物传感器系统如系统测定表面等离振子共振,或通过溶液平衡滴定(SET)测定溶液中的亲和力。如本文所用,术语“单克隆抗体”或“单克隆抗体组合物”指单个分子组合物的抗体分子的制剂。单克隆抗体组合物对特定表位显示单一结合特异性和亲和力。术语“核酸”本文与术语“多核苷酸”可互换使用,并指单链或双链形式的脱氧核糖核苷酸或核糖核苷酸及其聚合物。所述术语包括含有已知核苷酸类似物或修饰的骨架残基或键的核酸,其为合成的、天然发生的和非天然发生的,其与参考核酸具有相似的结合性质,并且其以与参考核苷酸相似的方式进行代谢。此类类似物的实例包括,但不限于硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性-甲基膦酸酯、2-O-甲基核糖核苷酸、肽核酸(PNA)。除非另有指出,特定核酸序列也暗中包括其保守修饰的变体(例如简并密码子替换)和互补序列,以及明确指出的序列。尤其是,如下文详细描述,可通过产生这样的序列完成简并密码子替换,其中用混和碱基和/或脱氧肌苷残基替换一个或更多所选(或全部)密码子的第三个位置(Batzer等,NucleicAcidRes.19:5081,1991;Ohtsuka等,J.Biol.Chem.260:2605-2608,1985;和Rossolini等,Mol.Cell.Probes8:91-98,1994)。术语“有效连接”指两个和更多多核苷酸(例如DNA)区段的功能关系。通常,所述术语指转录调节序列与转录序列之间的功能关系。例如,如果启动子或增强子序列刺激或调节编码序列在适当宿主细胞或其它表达系统中的转录,那么该启动子或增强子序列有效连接编码序列。一般地,有效连接转录序列的启动子转录调节序列与转录序列在物理空间上邻近,即它们是顺式作用。然而,一些转录调节序列,如增强子不需要与编码序列(增强子增强其转录)在物理空间上邻近或位于其附近。如本文所用,术语“优化的”表示已经使用生产细胞或生物,一般是真核细胞,例如毕赤酵母细胞、中国仓鼠卵巢细胞(CHO)或人细胞中优选的密码子改变核苷酸序列,以编码氨基酸序列。将优化的核苷酸序列改造以完全或最大可能地保留起始核苷酸序列(其也称为“亲本”序列)最初编码的氨基酸序列。已经改造了本文的优化序列以具有哺乳动物细胞中优选的密码子。然而,本文也考虑其它真核细胞或原核细胞中这些序列的优化表达。优化的核苷酸序列编码的氨基酸序列也称为优化的。术语“多肽”和“蛋白质”本文互换使用来指氨基酸残基的聚合物。所述术语应用到氨基酸聚合物,其中一个或更多氨基酸残基是相应天然发生氨基酸的人工化学模拟物,还应用到天然发生的氨基酸聚合物和非天然发生的氨基酸聚合物。除非另有指出,特定的多肽序列也暗中包括其保守修饰的变体。如本文所用,术语“重组人抗体”包括通过重组方法制备、表达、产生或分离的所有人抗体,如从对人免疫球蛋白基因转基因或转染色体的动物(例如小鼠)或从中制备的杂交瘤中分离的抗体、从经转化以表达人抗体的宿主细胞,例如从转染瘤中分离的抗体、从重组、组合人抗体库文中分离的抗体,和通过任何其它手段制备、表达、产生或分离的抗体,所述手段包括将全部或部分人免疫球蛋白基因、序列剪切成其它DNA序列。此类重组人抗体具有可变区,其中构架和CDR区均来自人种系免疫球蛋白序列。然而在某些实施方案中,此类重组人抗体可进行体外诱变(或者,当使用人Ig序列转基因的动物时,进行体内体细胞诱变),因此重组抗体的VH和VL区的氨基酸序列是当来自并与人种系VH和VL序列相关时可能在体内人抗体种系所有组成成分中不天然存在的序列。术语“重组宿主细胞”(或简单地“宿主细胞”)指已经向其中引入重组表达载体的细胞。应理解此类术语不仅旨在指特定受试者细胞,还指此细胞的后代。因为某些修饰可能因突变或环境影响而在后代中出现,所以该后代实际上可能与亲本细胞不相同,但仍然包括在本文所用术语“宿主细胞”的范围内。术语“受试者”包括人和非人动物。非人动物包括所有的脊椎动物(例如哺乳动物和非哺乳动物),如非人灵长类(例如,猕猴)、绵羊、狗、奶牛、鸡、两栖动物和爬行动物。除了指出时,术语“患者”或“受试者”本文可互换使用。如本文所用,术语“cyno”或“猕猴”指猕猴(Macacafascicularis)。如本文所用,术语任何疾病或病症(即AMD)的“治疗(treating)”或“治疗(treatment)”在一个实施方案中指改善疾病或病症(即,减缓或缓解疾病或减少疾病的发展或其临床症状中的至少一种)。在另一实施方案中,“治疗(treating)”或“治疗(treatment)”指减轻或改善至少一种物理参数,包括患者可能无法辨别的那些。在又一实施方案中,“治疗(treating)”或“治疗(treatment)”指物理上(例如,可辨别症状的稳定)、生理学上(例如身体参数的稳定)或两者上调节疾病或病症。在又一实施方案中,“治疗(treating)”或“治疗(treatment)”指预防或延迟疾病或病症的开始、发展或进展。与AMD相关的“预防”表示如下所述在处于所述恶化危险中的患者中防止或减缓视觉功能、视网膜解剖学和/或AMD疾病参数恶化的任何行动。更特别地,AMD的“治疗”表示导致视觉功能和/或视网膜解剖学改善或预防的任何行动。用于评估疾病治疗和/或预防的方法为本领域所知并描述于下文中。术语“载体”旨在指能够转运已经连接另一多核苷酸的多核苷酸分子。一种类型的载体是“质粒”,其指已经连接额外DNA片段的环形双链DNA环。另一类型的载体是病毒载体,如腺相关病毒载体(AAV或AAV2),其中额外的DNA区段可连接到病毒基因组内。某些载体能够在其中引入载体的宿主细胞中进行自主复制(例如,具有细菌复制起点的细菌载体和游离型哺乳动物载体)。其它载体(例如非游离型哺乳动物载体)可在引入宿主细胞后整合到宿主细胞的基因组中,并由此与所述宿主基因组一起复制。此外,某些载体能够指导它们有效连接的基因的表达。此类载体本文称为“重组表达载体”(或简单地,“表达载体”)。一般而言,在重组DNA技术中有用的表达载体经常是质粒的形式。在本说明书中,“质粒”和“载体”可互换使用,因为质粒是载体的最常用形式。然而,本发明旨在包括此类其它形式的表达载体,如病毒载体(例如,复制缺陷型逆转录病毒、腺病毒和腺伴随病毒),其起等同的功能。附图简述图1描述了P因子结合位点。图1A阐明了P因子的TSR5结构域与TSR5序列片段的相对位置:A、B、C和D。图1B显示了与小鼠序列比对的人TSR5序列。括号表示TSR5的序列片段。图1C阐明了抗体结合TSR5的B区域。图2显示了溶血测定法的结果,其证明在20%人血清中补体旁路途径的抑制。图3显示了使用图2中描述的溶血测定法的数据产生的等效线图解。图4显示了与抗P因子和抗C5抗体单独和组合抑制相比,小鼠聚-IC模型中巨噬细胞浸润的%抑制。图5显示了使用图4中描述的聚-IC结果的数据产生的等效线图解。发明详述本发明部分基于特异性结合人和猕猴P因子的抗体分子的发现。本发明涉及全长IgG格式的抗体及其抗原结合片段,如Fab片段(例如参见抗体NVS965-S、NVS962-S、NVS804和NVS807)。因此,本发明提供特异性结合P因子(例如,人P因子、猕猴P因子、大鼠P因子、兔P因子)的抗体、药物组合物、产生方法,以及使用此类抗体和组合物的方法。P因子抗体&抗原结合片段本发明提供特异性结合P因子的抗体。在一些实施方案中,本发明提供特异性结合人、猕猴、大鼠和/或兔P因子的抗体。本发明的抗体包括,但不限于如实施例所述分离的人单克隆抗体和Fabs。本发明提供特异性结合P因子蛋白(例如,人和/或猕猴P因子)的抗体,其中所述抗体包含具有SEQIDNO:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259或273的氨基酸序列的VH结构域。本发明还提供特异性结合P因子蛋白质的抗体,其中所述抗体包含具有下文表1中列出的VHCDRs任何一个的氨基酸序列的VHCDR。具体而言,本发明提供特异性结合P因子蛋白质(例如,人和/或猕猴P因子)的抗体,其中所述抗体包含(或者,由以下组成)具有下文表1中列出的任何VHCDRs的氨基酸序列的一个、两个、三个或更多个VHCDRs。本发明提供特异性结合P因子蛋白质的抗体,所述抗体包含具有SEQIDNO:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260或274的氨基酸序列的VL结构域。本发明还提供特异性结合P因子蛋白质(例如,人和/或猕猴P因子)的抗体,所述抗体包含具有下文表1中列出的VLCDRs任何一个的氨基酸序列的VLCDR。具体而言,本发明提供特异性结合P因子蛋白质(例如,人和/或猕猴P因子)的抗体,所述抗体包含(或者,由以下组成)具有下文表1中列出的任何VLCDRs的氨基酸序列的一个、两个、三个或更多个VLCDRs。本发明的其他抗体包括这样的氨基酸,其已经被突变,但CDR区与表1中所述的序列中描述的CDR区仍然具有至少60、70、80、85、90或95百分比同一性。在一些实施方案中,其包括突变氨基酸序列,其中当与表1中所述的序列中描述的CDR区相比时,在CDR区中已经突变了不多于1、2、3、4或5个氨基酸。本发明还提供编码抗体的VH、VL、全长重链和全长轻链的核酸序列,所述抗体特异性地结合P因子蛋白质(例如人和/或猕猴P因子)。可以优化该核酸序列用于在哺乳动物细胞中表达(例如,表1显示了本发明抗体重链和轻链的优化核酸序列)。表1P因子抗体、Fabs和P因子蛋白质的实例表2C5抗体、Fabs和C5蛋白质的实例本发明的其它抗体包括其中氨基酸或编码氨基酸的核酸已经被突变,但与表1中描述的序列仍然具有至少60、65、70、75、80、85、90或95百分比同一性的那些抗体。一些实施方案包括突变氨基酸序列,其中当与表1所述序列中描述的序列中的可变区比较时在可变区内不多于1、2、3、4或5个氨基酸已经被突变,但却保留基本相同的抗原结合活性。因为这些抗体中每一抗体均可结合P因子,所以可以“混和并匹配”VH、VL、全长轻链和全长重链序列(氨基酸序列和编码所述氨基酸序列的核苷酸序列),以产生本发明的其它P因子结合抗体。可使用本领域已知的结合测定法(例如,ELISA,和实施例部分中描述的其它测定法)测试此类“混和并匹配的”P因子结合抗体。当这些链进行混合和匹配时,应该用结构相似的VH序列替换来自特定VH/VL配对的VH序列。同样,应该用结构相似的全长重链序列替换来自特定全长重链/全长轻链配对的全长重链序列。同样,应该用结构相似的VL序列替换来自特定VH/VL配对的VL序列。同样,应该用结构相似的全长轻链序列替换来自特定全长重链/全长轻链配对的全长轻链序列。因此,一方面,本发明提供分离的抗体或其抗原结合区,其具有:包含选自SEQIDNOs:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259和273的氨基酸序列的重链可变域;和包含选自SEQIDNOs:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的氨基酸序列的轻链可变域,其中所述抗体特异性结合P因子(例如,人和/或猕猴P因子)。另一方面,本发明提供(i)分离的抗体,其具有:包含选自SEQIDNOs:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261和275的氨基酸序列的全长重链,所述氨基酸序列已经优化用于在哺乳动物细胞中表达;和包含选自SEQIDNOs:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262和276的氨基酸序列的全长轻链,所述氨基酸序列已经优化用于在哺乳动物细胞中表达;或(ii)包含其抗原结合部分的功能蛋白质。如本文所用,术语“互补决定区”和“CDR”指抗体可变区内的氨基酸序列,其赋予抗原特异性和结合亲和力。一般而言,在每一个重链可变区中存在三个CDR(HCDR1、HCDR2、HCDR3),在每一个轻链可变区中存在三个CDR(LCDR1、LCDR2、LCDR3)。可以使用许多众所周知的方案,包括Kabat等(1991),“SequencesofProteinsofImmunologicalInterest,”第5版PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(“Kabat”编号方案),Al-Lazikani等,(1997)JMB273,927-948(“Chothia”编号方案)描述的那些方案中的任何方案容易地确定给定CDR的精确氨基酸序列边界。例如,在Kabat下,重链可变域(VH)中的CDR氨基酸残基编号为31-35(HCDR1)、50-65(HCDR2)和95-102(HCDR3);并且轻链可变域(VL)中的CDR氨基酸残基编号为24-34(LCDR1)、50-56(LCDR2)和89-97(LCDR3)。在Chothia下,VH中的CDR氨基酸编号为26-32(HCDR1)、52-56(HCDR2)和95-102(HCDR3);并且VL中的氨基酸残基编号为26-32(LCDR1)、50-52(LCDR2)和91-96(LCDR3)。通过组合Kabat和Chothia的CDR定义,CDRs由人VH中的氨基酸残基26-35(HCDR1)、50-65(HCDR2)和95-102(HCDR3)和人VL中的氨基酸残基24-34(LCDR1)、50-56(LCDR2)和89-97(LCDR3)组成。另一方面,本发明提供了P因子结合抗体,其包含如表1中所述的重链和轻链CDR1s、CDR2s和CDR3s,或其组合。抗体VHCDR1s的氨基酸序列示于SEQIDNOs:1、15、29、43、57、71、85、99、113、127、141、155、169、183、197、211、225、239、253或267中。抗体VHCDR2s的氨基酸序列示于SEQIDNOs:2、16、30、44、58、72、86、100、114、128、142、156、170、184、198、212、226、240、254或268中。抗体VHCDR3s的氨基酸序列示于SEQIDNOs:3、17、31、45、59、73、87、101、115、129、143、157、171、185、199、213、227、241、255或269中。抗体VLCDR1s的氨基酸序列示于SEQIDNOs:4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256或270中。抗体VLCDR2s的氨基酸序列示于SEQIDNOs:5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257或271中。抗体VLCDR3s的氨基酸序列示于SEQIDNOs:6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258或272中。使用Kabat系统描述这些CDR区域。或者,如使用Chothia系统(Al-Lazikani等,(1997)JMB273,927-948)所定义,抗体VHCDR1s的氨基酸序列示于SEQIDNOs:281、287、293、299、305、311、317、323、329、335、341、347、353、359、365、371、377、383、389或395。抗体VHCDR2s的氨基酸序列示于SEQIDNOs:282、288、294、300、306、312、318、324、330、336、342、348、354、360、366、372、378、384、390或396。抗体VHCDR3s的氨基酸序列示于SEQIDNOs:283、289、295、301、307、313、319、325、331、337、343、349、355、361、367、373、379、385、391或397。抗体VLCDR1s的氨基酸序列示于SEQIDNOs:284、290、296、302、308、314、320、326、332、338、344、350、356、362、368、374、380、386、392或398。抗体VLCDR2s的氨基酸序列示于SEQIDNOs:285、291、297、303、309、315、321、327、333、339、345、351、357、363、369、375、381、387、393或399。抗体VLCDR3s的氨基酸序列示于SEQIDNOs:286、292、298、304、310、316、322、328、334、340、346、352、358、364、370、376、382、388、394或400。如果这些抗体中的每一个均可以结合P因子并且主要由CDR1、2和3区提供抗原结合特异性,那么VHCDR1、2和3序列和VLCDR1、2和3序列就可进行“混和并匹配”(即,可将来自不同抗体的CDRs进行混和并匹配,尽管每一抗体优选含有VHCDR1、2和3以及VLCDR1、2和3,以产生本发明的其它P因子结合分子)。可使用本领域已知的结合测定法和实施例中描述的那些方法(例如ELISA、SET、Biacore)来测试此类“混和并匹配的”P因子结合抗体。当VHCDR序列进行混和并匹配时,应该用结构相似的CDR序列替换来自特定VH序列的CDR1、CDR2和/或CDR3。同样,当VLCDR序列进行混和并匹配时,应该用结构相似的CDR序列替换来自特定VL序列的CDR1、CDR2和/或CDR3序列。对本领域普通技术人员显而易见的是可用来自本文对本发明单克隆抗体所示的CDR序列的结构相似的序列替换一个或多个VH和/或VLCDR区来产生新的VH和VL序列。除了上文所述外,在一个实施方案中,本文所述抗体的抗原结合片段可以包含VHCDR1、2和3,或VLCDR1、2和3,其中所述片段结合P因子作为单个可变域。在本发明的某些实施方案中,抗体或其抗原结合片段可以具有表1中所述的Fabs的重链和轻链序列。更特别地,所述抗体或其抗原结合片段可以具有FabNVS962、NVS963、NVS964、NVS965、NVS966、NVS967、NVS805、NVS806、NVS807、NVS808、NVS809、NVS962-S、NVS962-Q、NVS962-S31A、NVS962-G、NVS962-T、NVS965-S、NVS965-T或NVS965-Q的重链和轻链序列。在本发明的其他实施方案中,特异性结合P因子的抗体或抗原结合片段包含如Kabat所定义的及表1中所述的重链可变区CDR1、重链可变区CDR2、重链可变区CDR3、轻链可变区CDR1、轻链可变区CDR2,和轻链可变区CDR3。在本发明的仍其他实施方案中,特异性结合P因子的抗体或抗原结合片段包含如Chothia所定义的及表1中所述的重链可变区CDR1、重链可变区CDR2、重链可变区CDR3、轻链可变区CDR1、轻链可变区CDR2,和轻链可变区CDR3。在特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:1的重链可变区CDR1;SEQIDNO:2的重链可变区CDR2;SEQIDNO:3的重链可变区CDR3;SEQIDNO:4的轻链可变区CDR1;SEQIDNO:5的轻链可变区CDR2;和SEQIDNO:6的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:15的重链可变区CDR1;SEQIDNO:16的重链可变区CDR2;SEQIDNO:17的重链可变区CDR3;SEQIDNO:18的轻链可变区CDR1;SEQIDNO:19的轻链可变区CDR2;和SEQIDNO:20的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:29的重链可变区CDR1;SEQIDNO:30的重链可变区CDR2;SEQIDNO:31的重链可变区CDR3;SEQIDNO:32的轻链可变区CDR1;SEQIDNO:33的轻链可变区CDR2;和SEQIDNO:34的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:43的重链可变区CDR1;SEQIDNO:44的重链可变区CDR2;SEQIDNO:45的重链可变区CDR3;SEQIDNO:46的轻链可变区CDR1;SEQIDNO:47的轻链可变区CDR2;和SEQIDNO:48的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:57的重链可变区CDR1;SEQIDNO:58的重链可变区CDR2;SEQIDNO:59的重链可变区CDR3;SEQIDNO:60的轻链可变区CDR1;SEQIDNO:61的轻链可变区CDR2;和SEQIDNO:62的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:71的重链可变区CDR1;SEQIDNO:72的重链可变区CDR2;SEQIDNO:73的重链可变区CDR3;SEQIDNO:74的轻链可变区CDR1;SEQIDNO:75的轻链可变区CDR2;和SEQIDNO:76的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:85的重链可变区CDR1;SEQIDNO:86的重链可变区CDR2;SEQIDNO:87的重链可变区CDR3;SEQIDNO:88的轻链可变区CDR1;SEQIDNO:89的轻链可变区CDR2;和SEQIDNO:90的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:99的重链可变区CDR1;SEQIDNO:100的重链可变区CDR2;SEQIDNO:101的重链可变区CDR3;SEQIDNO:102的轻链可变区CDR1;SEQIDNO:103的轻链可变区CDR2;和SEQIDNO:104的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:113的重链可变区CDR1;SEQIDNO:114的重链可变区CDR2;SEQIDNO:115的重链可变区CDR3;SEQIDNO:116的轻链可变区CDR1;SEQIDNO:117的轻链可变区CDR2;和SEQIDNO:118的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:127的重链可变区CDR1;SEQIDNO:128的重链可变区CDR2;SEQIDNO:129的重链可变区CDR3;SEQIDNO:130的轻链可变区CDR1;SEQIDNO:131的轻链可变区CDR2;和SEQIDNO:132的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:141的重链可变区CDR1;SEQIDNO:142的重链可变区CDR2;SEQIDNO:143的重链可变区CDR3;SEQIDNO:144的轻链可变区CDR1;SEQIDNO:145的轻链可变区CDR2;和SEQIDNO:146的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:155的重链可变区CDR1;SEQIDNO:156的重链可变区CDR2;SEQIDNO:157的重链可变区CDR3;SEQIDNO:158的轻链可变区CDR1;SEQIDNO:159的轻链可变区CDR2;和SEQIDNO:160的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:169的重链可变区CDR1;SEQIDNO:170的重链可变区CDR2;SEQIDNO:171的重链可变区CDR3;SEQIDNO:172的轻链可变区CDR1;SEQIDNO:173的轻链可变区CDR2;和SEQIDNO:174的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:183的重链可变区CDR1;SEQIDNO:184的重链可变区CDR2;SEQIDNO:185的重链可变区CDR3;SEQIDNO:186的轻链可变区CDR1;SEQIDNO:187的轻链可变区CDR2;和SEQIDNO:188的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:197的重链可变区CDR1;SEQIDNO:198的重链可变区CDR2;SEQIDNO:199的重链可变区CDR3;SEQIDNO:200的轻链可变区CDR1;SEQIDNO:201的轻链可变区CDR2;和SEQIDNO:202的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:211的重链可变区CDR1;SEQIDNO:212的重链可变区CDR2;SEQIDNO:213的重链可变区CDR3;SEQIDNO:214的轻链可变区CDR1;SEQIDNO:215的轻链可变区CDR2;和SEQIDNO:216的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:225的重链可变区CDR1;SEQIDNO:226的重链可变区CDR2;SEQIDNO:227的重链可变区CDR3;SEQIDNO:228的轻链可变区CDR1;SEQIDNO:229的轻链可变区CDR2;和SEQIDNO:230的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:239的重链可变区CDR1;SEQIDNO:240的重链可变区CDR2;SEQIDNO:241的重链可变区CDR3;SEQIDNO:242的轻链可变区CDR1;SEQIDNO:243的轻链可变区CDR2;和SEQIDNO:244的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:253的重链可变区CDR1;SEQIDNO:254的重链可变区CDR2;SEQIDNO:255的重链可变区CDR3;SEQIDNO:256的轻链可变区CDR1;SEQIDNO:257的轻链可变区CDR2;和SEQIDNO:258的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:267的重链可变区CDR1;SEQIDNO:268的重链可变区CDR2;SEQIDNO:269的重链可变区CDR3;SEQIDNO:270的轻链可变区CDR1;SEQIDNO:271的轻链可变区CDR2;和SEQIDNO:271的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:281的重链可变区CDR1;SEQIDNO:282的重链可变区CDR2;SEQIDNO:283的重链可变区CDR3;SEQIDNO:284的轻链可变区CDR1;SEQIDNO:285的轻链可变区CDR2;和SEQIDNO:286的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:287的重链可变区CDR1;SEQIDNO:288的重链可变区CDR2;SEQIDNO:289的重链可变区CDR3;SEQIDNO:290的轻链可变区CDR1;SEQIDNO:291的轻链可变区CDR2;和SEQIDNO:292的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:293的重链可变区CDR1;SEQIDNO:294的重链可变区CDR2;SEQIDNO:295的重链可变区CDR3;SEQIDNO:296的轻链可变区CDR1;SEQIDNO:297的轻链可变区CDR2;和SEQIDNO:298的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:299的重链可变区CDR1;SEQIDNO:300的重链可变区CDR2;SEQIDNO:301的重链可变区CDR3;SEQIDNO:302的轻链可变区CDR1;SEQIDNO:303的轻链可变区CDR2;和SEQIDNO:304的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:305的重链可变区CDR1;SEQIDNO:306的重链可变区CDR2;SEQIDNO:307的重链可变区CDR3;SEQIDNO:308的轻链可变区CDR1;SEQIDNO:309的轻链可变区CDR2;和SEQIDNO:310的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:311的重链可变区CDR1;SEQIDNO:312的重链可变区CDR2;SEQIDNO:313的重链可变区CDR3;SEQIDNO:314的轻链可变区CDR1;SEQIDNO:315的轻链可变区CDR2;和SEQIDNO:316的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:317的重链可变区CDR1;SEQIDNO:318的重链可变区CDR2;SEQIDNO:319的重链可变区CDR3;SEQIDNO:320的轻链可变区CDR1;SEQIDNO:321的轻链可变区CDR2;和SEQIDNO:322的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:323的重链可变区CDR1;SEQIDNO:324的重链可变区CDR2;SEQIDNO:325的重链可变区CDR3;SEQIDNO:326的轻链可变区CDR1;SEQIDNO:327的轻链可变区CDR2;和SEQIDNO:328的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:329的重链可变区CDR1;SEQIDNO:330的重链可变区CDR2;SEQIDNO:331的重链可变区CDR3;SEQIDNO:332的轻链可变区CDR1;SEQIDNO:333的轻链可变区CDR2;和SEQIDNO:334的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:335的重链可变区CDR1;SEQIDNO:336的重链可变区CDR2;SEQIDNO:337的重链可变区CDR3;SEQIDNO:338的轻链可变区CDR1;SEQIDNO:339的轻链可变区CDR2;和SEQIDNO:340的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:341的重链可变区CDR1;SEQIDNO:342的重链可变区CDR2;SEQIDNO:343的重链可变区CDR3;SEQIDNO:344的轻链可变区CDR1;SEQIDNO:345的轻链可变区CDR2;和SEQIDNO:346的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:347的重链可变区CDR1;SEQIDNO:348的重链可变区CDR2;SEQIDNO:349的重链可变区CDR3;SEQIDNO:350的轻链可变区CDR1;SEQIDNO:351的轻链可变区CDR2;和SEQIDNO:352的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:353的重链可变区CDR1;SEQIDNO:354的重链可变区CDR2;SEQIDNO:355的重链可变区CDR3;SEQIDNO:356的轻链可变区CDR1;SEQIDNO:357的轻链可变区CDR2;和SEQIDNO:358的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:359的重链可变区CDR1;SEQIDNO:360的重链可变区CDR2;SEQIDNO:361的重链可变区CDR3;SEQIDNO:362的轻链可变区CDR1;SEQIDNO:363的轻链可变区CDR2;和SEQIDNO:364的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:365的重链可变区CDR1;SEQIDNO:366的重链可变区CDR2;SEQIDNO:367的重链可变区CDR3;SEQIDNO:368的轻链可变区CDR1;SEQIDNO:369的轻链可变区CDR2;和SEQIDNO:370的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:371的重链可变区CDR1;SEQIDNO:372的重链可变区CDR2;SEQIDNO:373的重链可变区CDR3;SEQIDNO:374的轻链可变区CDR1;SEQIDNO:375的轻链可变区CDR2;和SEQIDNO:376的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:377的重链可变区CDR1;SEQIDNO:378的重链可变区CDR2;SEQIDNO:379的重链可变区CDR3;SEQIDNO:380的轻链可变区CDR1;SEQIDNO:381的轻链可变区CDR2;和SEQIDNO:382的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:383的重链可变区CDR1;SEQIDNO:384的重链可变区CDR2;SEQIDNO:385的重链可变区CDR3;SEQIDNO:386的轻链可变区CDR1;SEQIDNO:387的轻链可变区CDR2;和SEQIDNO:388的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:389的重链可变区CDR1;SEQIDNO:390的重链可变区CDR2;SEQIDNO:391的重链可变区CDR3;SEQIDNO:392的轻链可变区CDR1;SEQIDNO:393的轻链可变区CDR2;和SEQIDNO:394的轻链可变区CDR3。在另一特定实施方案中,本发明包括特异性结合P因子的抗体,其包含SEQIDNO:395的重链可变区CDR1;SEQIDNO:396的重链可变区CDR2;SEQIDNO:397的重链可变区CDR3;SEQIDNO:398的轻链可变区CDR1;SEQIDNO:399的轻链可变区CDR2;和SEQIDNO:400的轻链可变区CDR3。在某些实施方案中,本发明包括特异性结合如表1中所述的P因子的抗体或抗原结合片段。在优选的实施方案中,结合P因子的抗体或抗原结合片段是FabNVS962、NVS963、NVS964、NVS965、NVS966、NVS967、NVS804、NVS805、NVS806、NVS807、NVS808、NVS809、NVS962-S、NVS962-Q、NVS962-G、NVS962-T、NVS962-S31A、NVS965-T、NVS965-Q或NVS965-S。如本文所用,人抗体包含重链或轻链可变区或全长重链或轻链,其“产自”或“来自”特定种系序列,如果抗体的可变区或全长链获自使用人种系免疫球蛋白基因的系统的话。此类系统包括用目的抗原免疫携带人免疫球蛋白基因的转基因小鼠或利用目的抗原筛选在噬菌体上展示的人免疫球蛋白基因文库。例如可通过比较人抗体的氨基酸序列与人种系免疫球蛋白的氨基酸序列并选择与人抗体在序列上最相近(即,最高%同一性)的人种系免疫球蛋白序列来鉴定“产自”或“来自”人种系免疫球蛋白序列的人抗体。“产自”或“来自”特定人种系免疫球蛋白序列的人抗体可含有与种系序列相比例如因天然发生的体细胞突变或刻意引入定点突变的氨基酸差异。然而,在VH或VL构架区,所选人抗体在氨基酸序列上通常与人种系免疫球蛋白基因编码的氨基酸序列具有至少90%的同一性,并含有氨基酸残基,当与其它物种的种系免疫球蛋白氨基酸序列(例如,鼠类种系序列)比较时,所述氨基酸残基将人抗体鉴定为人的。在某些情况下,人抗体在氨基酸序列上与种系免疫球蛋白基因编码的氨基酸序列具有至少60%、70%、80%、90%或至少95%,或甚至至少96%、97%、98%或99%的同一性。通常,重组人抗体与人种系免疫球蛋白基因编码的氨基酸序列在VH或VL构架区具有不超过10个氨基酸的差异。在某些情况下,人抗体与种系免疫球蛋白基因编码的氨基酸序列具有不超过5个,或甚至不超过4、3、2或1个氨基酸的差异。人种系免疫球蛋白基因的实例包括但不限于下文所述的可变域种系片段,以及DP47和DPK9。同源抗体在仍另一实施方案中,本发明提供包含与表1所述序列同源的氨基酸序列的抗体或其抗原结合片段,并且所述抗体结合P因子蛋白质(例如,人和/或猕猴P因子),并保留表1所述那些抗体的期望功能性质。例如,本发明提供包含重链可变域和轻链可变域的分离的抗体,或其功能抗原结合片段,其中所述重链可变域包含与选自SEQIDNOs:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259和273的氨基酸序列具有至少80%、至少90%或至少95%同一性的氨基酸序列;所述轻链可变域包含与选自SEQIDNOs:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的氨基酸序列具有至少80%、至少90%或至少95%同一性的氨基酸序列;并且所述抗体特异性结合P因子(例如,人和/或猕猴P因子)。在其它实施方案中,VH和/或VL氨基酸序列可以与表1中阐明的序列具有50%、60%、70%、80%、90%、95%、96%、97%、98%或99%的同一性。在其它实施方案中,VH和/或VL氨基酸序列可以相同,只是在不超过1、2、3、4或5个氨基酸位置上具有氨基酸取代。可通过诱变(例如定点或PCR介导诱变)分别编码SEQIDNOs:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259或273和SEQIDNOs:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260或274的核酸分子来获得这样的抗体,所述抗体具有与表1所述的那些抗体的VH和VL区具有高(即,80%或更高)同一性的VH和VL区,然后使用本文所述的功能测定法测试所编码的经改变抗体的保留的功能。在其它实施方案中,全长重链和/或全长轻链氨基酸序列与表1中阐明的序列具有50%、60%、70%、80%、90%、95%、96%、97%、98%或99%的同一性。可通过诱变(例如定点或PCR介导的诱变)分别编码此类多肽的核酸分子来获得这样的抗体,其具有与SEQIDNOs:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261或275任何一个的全长重链和SEQIDNOs10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262或276任何一个的全长轻链具有高(即,80%或更高)同一性的全长重链和全长轻链,然后使用本文所述的功能测定法测试编码的经改变抗体的保留的功能。在其它实施方案中,全长重链和/或全长轻链核苷酸序列与表1阐明的序列具有60%、70%、80%、90%、95%、96%、97%、98%或99%的同一性。在其它实施方案中,重链的可变区和/或轻链可变区核苷酸序列与表1阐明的序列具有60%、70%、80%、90%、95%、96%、97%、98%或99%的同一性。如本文所用,两条序列之间的百分比同一性是所述序列共有的相同位置数量的函数(即,%同一性等于相同位置的数量/位置总数x100),其中考虑空位数量和每一空位长度,需要引入所述空位用于两条序列的最佳比对。如下文非限制性实施例所述,可使用数学算法完成两条序列之间序列的比较和百分比同一性的确定。此外或备选地,本发明的蛋白质序列可进一步用作“查询序列”以针对公共数据库进行搜索,例如来鉴定相关序列。例如,可使用Altschul等,1990J.Mol.Biol.215:403-10的BLAST程序(版本2.0)进行此类搜索。具有保守修饰的抗体在某些实施方案中,本发明的抗体具有包含CDR1、CDR2和CDR3序列的重链可变区和包含CDR1、CDR2和CDR3序列的轻链可变区,其中一个或更多这些CDR序列具有基于本文所述抗体的特定氨基酸序列或其保守修饰,并且其中所述抗体保留本发明P因子结合抗体的期望功能性质。因此,本发明提供分离的抗体,或其抗原结合片段,其由包含CDR1、CDR2和CDR3序列的重链可变区和包含CDR1、CDR2和CDR3序列的轻链可变区组成,其中:所述重链可变区CDR1氨基酸序列选自SEQIDNOs:1、15、29、43、57、71、85、99、113、127、141、155、169、183、197、211、225、239、253和267,及其保守修饰;所述重链可变区CDR2氨基酸序列选自SEQIDNOs:2、16、30、44、58、72、86、100、114、128、142、156、170、184、198、212、226、240、254和268,及其保守修饰;所述重链可变区CDR3氨基酸序列选自SEQIDNOs:3、17、31、45、59、73、87、101、115、129、143、157、171、185、199、213、227、241、255和269,及其保守修饰;所述轻链可变区CDR1氨基酸序列选自SEQIDNOs:4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256和270,及其保守修饰;所述轻链可变区CDR2氨基酸序列选自SEQIDNOs:5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257和271,及其保守修饰;所述轻链可变区CDR3氨基酸序列选自SEQIDNOs:6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258和272,及其保守修饰;并且所述抗体或其抗原结合片段特异性结合P因子。在其它实施方案中,优化用于在哺乳动物细胞中表达的本发明的抗体具有全长重链序列和全长轻链序列,其中一个或更多这些序列具有基于本文所述抗体的特定氨基酸序列或其保守修饰,并且其中所述抗体保留本发明P因子结合抗体的期望功能性质。因此,本发明提供优化用于在哺乳动物细胞中表达的分离的抗体,其由全长重链和全长轻链组成,其中所述全长重链具有选自SEQIDNOs:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261和275的氨基酸序列,及其保守修饰;并且所述全长轻链具有选自SEQIDNOs:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262和276的氨基酸序列,及其保守修饰;并且所述抗体特异性结合P因子(例如,人和/或猕猴P因子)。结合相同表位的抗体本发明提供与表1所述P因子结合抗体结合相同表位的抗体。因此可基于它们在P因子结合测定(如在实施例中描述的那些)中与本发明其它抗体竞争(例如以统计学上显著的方式竞争性抑制结合)的能力鉴定额外的抗体。测试抗体抑制本发明抗体与P因子蛋白质结合的能力显示所述测试抗体可与该抗体竞争结合P因子;根据非限制性理论,该抗体和与其竞争的抗体结合P因子蛋白质上相同或相关(例如,结构上相似或空间上接近)的表位。在某一实施方案中,与本发明抗体结合P因子上相同表位的抗体是人单克隆抗体。可如本文所述制备并分离这种人单克隆抗体。如本文所用,当存在等摩尔浓度的竞争抗体,竞争抗体抑制本发明的抗体或抗原结合片段的P因子结合高于50%时,抗体“竞争”结合。在其他实施方案中,本发明的抗体或抗原结合片段结合P因子的血小板反应蛋白类型5重复(TSR5)结构域(SEQIDNO:406)。在其他实施方案中,本发明的抗体或抗原结合片段结合包含SEQIDNO:407的P因子TSR5结构域的区域。仍然在其他实施方案中,所述区域包含SEQIDNO:408。在本发明的其他实施方案中,分离的抗体或抗原结合片段结合包含SEQIDNO:407的表位,并且在其他实施方案中,所述表位包含SEQIDNO:408。在本发明的其他实施方案中,所述抗体或抗原结合片段结合SEQIDNO:407的肽,而在仍然其他实施方案中,所述P因子表位包括SEQIDNO:408。经改造和修饰的抗体还可使用具有一个或更多本文所示VH和/或VL序列的抗体作为起始材料制备本发明的抗体,以改造经修饰的抗体,所述修饰的抗体可以具有从起始抗体改变的性质。可通过修饰一个或两个可变区(即,VH和/或VL),例如一个或更多CDR区和/或一个或更多构架区内的一个或更多残基来改造抗体。此外或备选地,可通过在恒定区内修饰残基来改造抗体,例如来改变所述抗体的效应功能。可以进行的一种类型的可变区改造是CDR移植。抗体主要通过定位在六个重链和轻链互补决定区(CDRs)中的氨基酸残基与靶抗原相互作用。为此,CDRs内的氨基酸序列在各抗体之间比CDRs外的序列更多样化。因为CDR序列负责多数抗体-抗原相互作用,所以通过构建表达载体来表达模拟特定天然发生抗体的性质的重组抗体是可能的,所述表达载体包括移植到具有不同性质的不同抗体的构架序列上的来自特定天然发生抗体的CDR序列(参见例如,Riechmann,L.等,1998Nature332:323-327;Jones,P.等,1986Nature321:522-525;Queen,C.等,1989Proc.Natl.Acad.,U.S.A.86:10029-10033;Winter的美国专利号5,225,539和Queen等的美国专利号5,530,101;5,585,089;5,693,762和6,180,370)。因此,本发明的另一实施方案涉及分离的抗体,或其抗原结合片段,其包含重链可变区,所述重链可变区分别包含具有选自SEQIDNOs:1、15、29、43、57、71、85、99、113、127、141、155、169、183、197、211、225、239、253和267的氨基酸序列的CDR1序列;具有选自SEQIDNOs:2、16、30、44、58、72、86、100、114、128、142、156、170、184、198、212、226、240、254和268的氨基酸序列的CDR2序列;具有选自SEQIDNOs:3、17、31、45、59、73、87、101、115、129、143、157、171、185、199、213、227、241、255和269的氨基酸序列的CDR3序列;和轻链可变区,所述轻链可变区分别包含具有选自SEQIDNOs:4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256和270的氨基酸序列的CDR1序列;具有选自SEQIDNOs:5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257和271的氨基酸序列的CDR2序列;具有选自SEQIDNOs:6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258和272的氨基酸序列的CDR3序列。因此,此类抗体含有单克隆抗体的VH和VLCDR序列,但仍然含有来自这些抗体的不同构架序列。或者,本发明的另一实施方案涉及分离的抗体,或其抗原结合片段,其包含重链可变区,所述重链可变区分别包含具有选自SEQIDNOs:281、287、293、299、305、311、317、323、329、335、341、347、353、359、365、371、377、383、389和395的氨基酸序列的CDR1序列;具有选自SEQIDNOs:282、288、294、300、306、312、318、324、330、336、342、348、354、360、366、372、378、384、390和396的氨基酸序列的CDR2序列;具有选自SEQIDNOs:283、289、295、301、307、313、319、325、331、337、343、349、355、361、367、373、379、385、391和397的氨基酸序列的CDR3序列;和轻链可变区,所述轻链可变区分别包含具有选自SEQIDNOs:284、290、296、302、308、314、320、326、332、338、344、350、356、362、368、374、380、386、392和398的氨基酸序列的CDR1序列;具有选自SEQIDNOs:285、291、297、303、309、315、321、327、333、339、345、351、357、363、369、375、381、387、393和399的氨基酸序列的CDR2序列;具有选自SEQIDNOs:286、292、298、304、310、316、322、328、334、340、346、352、358、364、370、376、382、388、394和400的氨基酸序列的CDR3序列。因此,此类抗体含有单克隆抗体的VH和VLCDR序列,但仍然含有来自这些抗体的不同构架序列。可从公共DNA数据库或包括种系抗体基因序列的出版的参考文献中获得此类构架序列。例如,人重链和轻链可变区基因的种系DNA序列可见于“VBase”人种系序列数据库(可在互联网mrc-cpe.cam.ac.uk/vbase的worldwideweb上获得),以及Kabat,E.A.,等,1991SequencesofProteinsofImmunologicalInterest,第五版,U.S.DepartmentofHealthandHumanServices,NIH公开号91-3242;Tomlinson,I.M.,等,1992J.Mol.Biol.227:776-798;和Cox,J.P.L.等,1994Eur.JImmunol.24:827-836;各自内容本文明确引入作为参考。用于本发明抗体的构架序列的实例是与本发明所选抗体使用的构架序列,例如本发明单克隆抗体使用的共有序列和/或构架序列在结构上相似的那些构架序列。VHCDR1、2和3序列,以及VLCDR1、2和3序列可移植到与见于构架序列来源的种系免疫球蛋白基因中的序列具有相同序列的构架区上,或者所述CDR序列可移植到与种系序列相比含有一个或更多突变的构架区上。例如,已经发现有利的是在某些情况下在构架区内突变残基以维持或增强抗体的抗原结合力(参见例如,Queen等的美国专利号5,530,101;5,585,089;5,693,762和6,180,370)。可以用作支架(其上构建本文所述的抗体和抗原结合片段)的构架包括,但不限于VH1A、VH1B、VH3、Vk1、Vl2和Vk2。额外的构架为本领域所知并可见于例如vbase.mrc-cpe.cam.ac.uk/index.php?&MMN_position=1:1的worldwideweb上的vBase数据库中。因此,本发明的实施方案涉及分离的P因子结合抗体或其抗原结合片段,其包含重链可变区,所述重链可变区包含选自SEQIDNOs:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259和273的氨基酸序列,或在该序列的构架区中具有一个、两个、三个、四个或五个氨基酸取代、缺失或添加的氨基酸序列,并且进一步包含轻链可变区,所述轻链可变区具有选自SEQIDNOs:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260和274的氨基酸序列,或在该序列的构架区中具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列。另一类型的可变区修饰是在VH和/或VLCDR1、CDR2和/或CDR3区内突变氨基酸残基,由此改善目的抗体的一种或更多结合性质(例如,亲和力),称为“亲和力成熟”。可进行定点诱变或PCR介导的诱变以引入突变,并在如本文所述以及实施例中提供的体外或体内测定中评估对抗体结合或其它目的功能性质的影响。可引入保守修饰(如上文讨论)。所述突变可以是氨基酸取代、添加或缺失。此外,通常改变CDR区内不超过1、2、3、4或5个残基。因此,在另一实施方案中,本发明提供分离的P因子结合抗体,或其抗原结合片段,其由重链可变区组成,所述重链可变区具有由选自SEQIDNOs:1、15、29、43、57、71、85、99、113、127、141、155、169、183、197、211、225、239、253和267的氨基酸序列,或与SEQIDNOs:1、15、29、43、57、71、85、99、113、127、141、155、169、183、197、211、225、239、253或267相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列组成的VHCDR1区;具有选自SEQIDNOs:2、16、30、44、58、72、86、100、114、128、142、156、170、184、198、212、226、240、254和268的氨基酸序列,或与SEQIDNOs:2、16、30、44、58、72、86、100、114、128、142、156、170、184、198、212、226、240、254或268相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VHCDR2区;具有选自SEQIDNOs:3、17、31、45、59、73、87、101、115、129、143、157、171、185、199、213、227、241、255和269的氨基酸序列,或与SEQIDNOs:3、17、31、45、59、73、87、101、115、129、143、157、171、185、199、213、227、241、255或269相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VHCDR3区;具有选自SEQIDNOs:4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256和270的氨基酸序列,或与SEQIDNOs:4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256或270相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VLCDR1区;具有选自SEQIDNOs:5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257和271的氨基酸序列,或与SEQIDNOs:5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257或271相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VLCDR2区;和具有选自SEQIDNOs:6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258和272的氨基酸序列,或与SEQIDNOs:6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258或272相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VLCDR3区。因此,在另一实施方案中,本发明提供分离的P因子结合抗体,或其抗原结合片段,其由重链可变区组成,所述重链可变区具有由选自SEQIDNOs:281、287、293、299、305、311、317、323、329、335、341、347、353、359、365、371、377、383、389和395的氨基酸序列,或与SEQIDNOs:281、287、293、299、305、311、317、323、329、335、341、347、353、359、365、371、377、383、389或395相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列组成的VHCDR1区;具有选自SEQIDNOs:282、288、294、300、306、312、318、324、330、336、342、348、354、360、366、372、378、384、390和396的氨基酸序列,或与SEQIDNOs:282、288、294、300、306、312、318、324、330、336、342、348、354、360、366、372、378、384、390或396相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VHCDR2区;具有选自SEQIDNOs:283、289、295、301、307、313、319、325、331、337、343、349、355、361、367、373、379、385、391和397的氨基酸序列,或与SEQIDNOs:283、289、295、301、307、313、319、325、331、337、343、349、355、361、367、373、379、385、391或397相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VHCDR3区;具有选自SEQIDNOs:284、290、296、302、308、314、320、326、332、338、344、350、356、362、368、374、380、386、392和398的氨基酸序列,或与SEQIDNOs:284、290、296、302、308、314、320、326、332、338、344、350、356、362、368、374、380、386、392或398相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VLCDR1区;具有选自SEQIDNOs:285、291、297、303、309、315、321、327、333、339、345、351、357、363、369、375、381、387、393和399的氨基酸序列,或与SEQIDNOs:285、291、297、303、309、315、321、327、333、339、345、351、357、363、369、375、381、387、393或399相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VLCDR2区;和具有选自SEQIDNOs:286、292、298、304、310、316、322、328、334、340、346、352、358、364、370、376、382、388、394和400的氨基酸序列,或与SEQIDNOs:286、292、298、304、310、316、322、328、334、340、346、352、358、364、370、376、382、388、394或400相比具有1、2、3、4或5个氨基酸取代、缺失或添加的氨基酸序列的VLCDR3区。抗原结合域移植到备选构架或支架中可使用多种抗体/免疫球蛋白构架或支架,只要所得多肽包括至少一个特异性结合P因子的抗原结合区。此类构架或支架包括人免疫球蛋白或其片段的5个主要个体基因型,并包括其它动物物种,优选具有人源化方面的动物物种的免疫球蛋白。单重链抗体,如在骆驼中鉴定的那些单重链抗体在该方面十分重要。本领域技术人员不断发现并开发新的构架、支架和片段。一方面,本发明涉及使用其上可移植本发明CDRs的非免疫球蛋白支架产生基于非免疫球蛋白的抗体。可以使用已知或未知非免疫球蛋白构架和支架,只要它们包含对靶P因子蛋白质特异的结合区。已知的非免疫球蛋白构架或支架包括,但不限于纤连蛋白(CompoundTherapeutics,Inc.,Waltham,MA)、锚蛋白(MolecularPartnersAG,Zurich,Switzerland)、结构域抗体(Domantis,Ltd.,Cambridge,MA,andAblynxnv,Zwijnaarde,Belgium)、脂笼蛋白(PierisProteolabAG,Freising,Germany)、小模块免疫药物(TrubionPharmaceuticalsInc.,Seattle,WA)、maxybodies(Avidia,Inc.,MountainView,CA)、A蛋白(AffibodyAG,Sweden)和affilin(γ-晶体蛋白或泛素)(ScilProteinsGmbH,Halle,Germany)。纤连蛋白支架基于纤连蛋白类型III结构域(例如,纤连蛋白类型III的第十个模块(10Fn3结构域))。纤连蛋白类型III结构域具有在两个β折叠之间分布的7个或8个β链,所述两个β折叠自身彼此包装形成蛋白质的核心,并进一步含有将β链彼此连接且暴露在溶剂中的环(与CDRs类似)。在β折叠夹层每一边缘具有至少三个这样的环,其中所述边缘是与β链方向垂直的蛋白质边界(参见US6,818,418)。这些基于纤连蛋白的支架不是免疫球蛋白,尽管总体折叠与最小功能抗体片段、在骆驼和骆马IgG中包含完整抗原识别单位的重链可变区十分相近。因为该结构,非免疫球蛋白抗体模拟与自然界中相似的抗原结合性质以及与抗体的那些亲和力相似的亲和力。这些支架可用于体外环随机化和改组策略,其与体内抗体的亲和力成熟过程相似。这些基于纤连蛋白的分子可用作支架,其中使用标准克隆技术用本发明的CDRs替换所述分子的环区。锚蛋白技术基于使用具有锚蛋白来源的重复模块的蛋白质作为携带可变区的支架,所述可变区可用于结合不同靶标。所述锚蛋白重复模块是由两个反向平行的α螺旋和β转角组成的33个氨基酸的多肽。通过使用核糖体展示对可变区的结合进行最大优化。Avimers来自含有如LRP-1蛋白质的天然A结构域。这些结构域天然地用于蛋白质-蛋白质相互作用,并且在人中超过250个蛋白质在结构上基于A结构域。Avimers由通过氨基酸接头连接的大量不同的“A结构域”单体(2-10)组成。可使用例如美国专利申请公开号20040175756;20050053973;20050048512和20060008844中描述的方法产生可以结合靶抗原的Avimers。Affibody亲和配体是由基于A蛋白一个IgG结合域的支架的三螺旋束组成的小的简单蛋白质。A蛋白是来自细菌金黄色葡萄球菌(Staphylococcusaureus)的表面蛋白。该支架结构域由58个氨基酸组成,其中13个随机化以产生具有大量配体变体的affibody文库(参见例如,US5,831,012)。Affibody分子模拟抗体,它们与150kDa的抗体分子量相比具有6kDa的分子量。尽管其具有小的尺寸,但affibody分子的结合位点与抗体的结合位点类似。Anticalins是PierisProteoLabAG公司开发的产品。它们衍生自脂笼蛋白,其为一大类小且坚固的蛋白质,一般参与生理运输或储藏化学敏感的或不溶解的化合物。若干天然脂笼蛋白在人组织或体液中产生。蛋白质结构表明为免疫球蛋白,在刚性构架上面具有高变环。然而,与抗体或它们的重组片段相比,脂笼蛋白由具有160到180个氨基酸残基的单条多肽链组成,仅比单个免疫球蛋白结构域稍大。构成结合口袋的四环组显示明显的结构可塑性并耐受多种侧链。因此结合位点在专有方法中可重塑,以识别具有高亲和力和特异性的不同形状的规定靶分子。脂笼蛋白家族的一个蛋白质——PierisBrassicae的后胆色素结合蛋白(BBP)已经用于通过诱变处理四环组来开发anticalins。描述anticalins的专利申请的一个实例在PCT公开号WO199916873中。Affilin分子是设计用来针对蛋白质和小分子具有特异亲和力的小的非免疫球蛋白蛋白质。可从两个文库中非常快速地选择新的affilin分子,每一所述文库基于来自不同人的支架蛋白。Affilin分子与免疫球蛋白蛋白质不显示任何结构同源性。目前,使用两个affilin支架,其中一个是γ晶体蛋白——人结构晶状体蛋白质,另一个是“泛素”超家族蛋白质。两个人支架均非常小,显示高的温度稳定性,并对pH改变和变性剂几乎是有抵抗力的。该高稳定性主要是因为蛋白质扩展的β折叠结构。γ晶体蛋白来源的蛋白质的实例描述于WO200104144中,并且“泛素样”蛋白质的实例描述于WO2004106368中。蛋白质表位模拟(PEM)是模拟蛋白质β发夹二级结构的中等大小、环形的、肽样分子(MW1-2kDa),所述主要二级结构参与蛋白质-蛋白质相互作用。本发明提供特异性结合P因子蛋白质的完全人抗体。与嵌合或人源化抗体相比,当对人受试者施用时,本发明的人P因子结合抗体具有进一步降低的抗原性。骆驼(camelid)抗体从骆驼和单峰骆驼(Camelusbactrianus和Calelusdromaderius)家族的成员,包括新世界成员如骆马物种(Lamapaccos、Lamaglama和Lamavicugna)中获得的抗体蛋白质已经在大小、结构复杂性和对人受试者的抗原性方面进行了表征。自然界中发现的来自该哺乳动物家族的某些IgG抗体缺少轻链,并因此在结构上不同于来自其它动物的抗体的两条重链和两条轻链的典型四链四级结构。参见PCT/EP93/02214(1994年3月3日公开的WO94/04678)。可通过遗传改造获得鉴定为VHH的小的单个可变结构域的骆驼抗体的区域,以产生对靶标具有高亲和力的小蛋白质,得到低分子量的抗体来源蛋白质,称为“骆驼纳米抗体”。参见1998年6月2日提交的美国专利号5,759,808;还参见Stijlemans,B.等,2004JBiolChem279:1256-1261;Dumoulin,M.等,2003Nature424:783-788;Pleschberger,M.等2003BioconjugateChem14:440-448;Cortez-Retamozo,V.等2002IntJCancer89:456-62;和Lauwereys,M.等1998EMBOJ17:3512-3520。例如从Ablynx,Ghent,Belgium通过商业途径获得骆驼抗体和抗体片段的改造库。如同非人来源的其它抗体一样,可重组改变骆驼抗体的氨基酸序列,来获得与人序列更像的序列,即纳米抗体可以进行“人源化”。因此,骆驼抗体对人的天然低抗原性可进一步降低。骆驼纳米抗体的分子量是人IgG分子的大概十分之一,并且所述蛋白质物理直径仅几纳米。小尺寸的一种结果是骆驼纳米抗体能够结合更大抗体蛋白质在功能上看不见的抗原位点,即骆驼纳米抗体可用作使用经典免疫技术检测不到的抗原的试剂,并可能用作治疗剂。因此,小尺寸的另一结果是骆驼纳米抗体因此可抑制靶蛋白质的沟或窄缝中特异位点的结合,并因而可具有这样的能力,其比典型抗体更像典型的低分子量药物的功能。低分子量和紧密尺寸还导致骆驼纳米抗体极其热稳定,对极端pH和蛋白酶解消化稳定,并且抗原性弱。另一结果是骆驼纳米抗体容易从循环系统转移到组织,甚至穿过血脑屏障,可治疗影响神经组织的病症。纳米抗体可进一步利于药物运输穿过血脑屏障。参见2004年8月19日公开的美国专利申请20040161738。这些特征与对人的低抗原性结合表明巨大的治疗潜能。另外,这些分子可在原核细胞,如大肠杆菌(E.coli)中完全表达,并用噬菌体表达为融合蛋白,且是有功能的。因此,本发明的特征是对P因子具有高亲和力的骆驼抗体或纳米抗体。在本文的某些实施方案中,所述骆驼抗体或纳米抗体在骆驼动物中天然产生,即,使用本文为其它抗体描述的技术,用P因子或其肽片段免疫骆驼来产生。或者,改造,即如本文实施例中所述使用P因子作为靶标的淘选方法,通过例如从展示适当诱导的骆驼纳米抗体蛋白质的噬菌体文库中选择产生P因子结合的骆驼纳米抗体。可通过遗传改造进一步定制改造的纳米抗体,以在受体受试者中具有从45分钟到两周的半衰期。在特定实施方案中,如PCT/EP93/02214所述,通过将本发明人抗体的重链或轻链的CDRs序列移植到纳米抗体或单结构域抗体构架序列中来获得骆驼抗体或纳米抗体。双特异性分子和多价抗体另一方面,本发明描述了包含本发明P因子结合抗体或其片段的双特异性或多特异性分子。本发明的抗体或其抗原结合片段可衍生或连接另一功能分子,例如另一肽或蛋白质(例如,另一抗体或受体的配体),来产生结合至少两种不同结合位点或靶分子的双特异性分子。本发明的抗体可实际上衍生或连接超过一种其它功能分子,以产生结合多于两种不同结合位点和/或靶分子的多特异性分子;本文所用的术语“双特异性分子”也旨在包括此类多特异性分子。为了产生本发明的双特异性分子,本发明的抗体可在功能上连接(例如,通过化学偶联、遗传融合、非共价结合或其它)一个或更多其它结合分子,如另一抗体、抗体片段、肽或结合模拟物,以便产生双特异性分子。因此,本发明包括双特异性分子,其包含对P因子的至少第一种结合特异性,和对第二个靶表位的第二种结合特异性。例如,所述第二个靶表位是P因子的不同于第一个靶表位的另一表位。此外,对于其中双特异性分子是多特异性的发明,除了第一个和第二个靶表位之外,所述分子可以还包括第三种结合特异性。在一个实施方案中,本发明的双特异性分子包含作为结合特异性的至少一种抗体,或其抗体片段,包括例如,Fab、Fab'、F(ab')2、Fv或单链Fv。所述抗体还可以是轻链或重链二聚体,或其任何最小片段,如Ladner等美国专利号4,946,778中描述的Fv或单链构建体。双抗体是二价的双特异性分子,其中VH和VL结构域在单条多肽链上表达,通过太短以至于不能在同一条链上两个结构域之间配对的接头连接。所述VH和VL结构域与另一条链的互补结构域配对,由此产生两个抗原结合位点(参见例如,Holliger等,1993Proc.Natl.Acad.Sci.USA90:6444-6448;Poljak等,1994Structure2:1121-1123)。可通过在同一细胞中表达具有结构VHA-VLB和VHB-VLA(VH-VL构型),或VLA-VHB和VLB-VHA(VL-VH构型)的两条多肽链来产生双抗体。大多数的双抗体在细菌中以可溶形式表达。通过连接两条双抗体形成多肽链与大约15个氨基酸残基的接头产生单链双抗体(scDb)(参见Holliger和Winter,1997CancerImmunol.Immunother.,45(3-4):128-30;Wu等,1996Immunotechnology,2(1):21-36)。scDb在细菌中以可溶的活性单体形式表达(参见Holliger和Winter,1997CancerImmunol.Immunother.,45(34):128-30;Wu等,1996Immunotechnology,2(1):21-36;Pluckthun和Pack,1997Immunotechnology,3(2):83-105;Ridgway等,1996ProteinEng.,9(7):617-21)。双抗体可融合到Fc上,以产生“二-双抗体”(参见Lu等,2004J.Biol.Chem.,279(4):2856-65)。可用于本发明的双特异性分子中的其它抗体是鼠类、嵌合和人源化单克隆抗体。可使用本领域已知的方法,通过缀合成分结合特异性来制备双特异性分子。例如,可单独产生双特异性分子的每一结合特异性,然后相互缀合。当结合特异性是蛋白质或肽时,多种偶联或交联剂可用于共价缀合。交联剂的实例包括A蛋白、碳二亚胺、N-琥珀酰亚胺基-S-乙酰-硫代乙酸酯(SATA)、5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、邻-亚苯基二马来酰亚胺(oPDM)、N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)和磺基琥珀酰亚胺基4-(N-马来酰亚胺基甲基)环己烷-l-羧酸酯(磺基-SMCC)(参见例如,Karpovsky等,1984J.Exp.Med.160:1686;Liu,MA等,1985Proc.Natl.Acad.Sci.USA82:8648)。其它方法包括在Paulus,1985BehringIns.Mitt.No.78,118-132;Brennan等,1985Science229:81-83和Glennie等,1987J.Immunol.139:2367-2375中描述的那些。缀合剂是SATA和磺基-SMCC,两者均可从PierceChemicalCo.(Rockford,IL)获得。当结合特异性是抗体时,它们可通过两条重链的C末端铰链区的巯基成键而缀合。在特定实施方案中,在缀合之前修饰铰链区以含有奇数个巯基残基,例如1个。或者,两种结合特异性可在相同载体中编码,并在相同宿主细胞中表达并装配。其中双特异性分子是mAbxmAb、mAbxFab、FabxF(ab')2或配体xFab融合蛋白质时,该方法是特别有用的。本发明的双特异性分子可以单链分子,其包含一个单链抗体和结合决定簇,或包含两个结合决定簇的单链双特异性分子。双特异性分子可包含至少两个单链分子。例如在美国专利号5,260,203;美国专利号5,455,030;美国专利号4,881,175;美国专利号5,132,405;美国专利号5,091,513;美国专利号5,476,786;美国专利号5,013,653;美国专利号5,258,498;和美国专利号5,482,858中描述了用于制备双特异性分子的方法。例如,通过酶联免疫吸附测定(ELISA)、放射免疫测定(REA)、FACS分析、生物测定(例如生长抑制)、或Western印迹测定来验证双特异性分子与其特异性靶标的结合。这些测定法中的每一种一般通过使用对目的复合体特异的标记试剂(例如抗体)检测特别重要的蛋白质-抗体复合物的存在。另一方面,本发明提供多价化合物,其包含结合P因子的本发明抗体的至少两个相同或不同的抗原结合部分。所述抗原结合部分可通过蛋白质融合或共价或非共价键而连接在一起。或者,已经为双特异性分子描述了连接方法。例如通过交联本发明的抗体与结合本发明抗体的恒定区,例如Fc或铰链区获得四价化合物。例如在Borean专利EP1012280B1中描述了三聚化结构域。例如在PCT/EP97/05897中描述了五聚化模块。具有延长半衰期的抗体本发明提供特异性结合P因子蛋白质的在体内具有延长半衰期的抗体。许多因素可影响蛋白质在体内的半衰期。例如,肾过滤、肝中的新陈代谢、蛋白酶解酶(蛋白酶)的降解和免疫原性应答(例如,抗体的蛋白质中和及巨噬细胞和树突状细胞的吸收)。多种策略可用于延长本发明抗体的半衰期。例如,通过化学连接聚乙二醇(PEG)、reCODEPEG、抗体支架、聚唾液酸(PSA)、羟乙基淀粉(HES)、白蛋白结合配体、和糖类保护层;通过遗传融合到结合血清蛋白质的蛋白质,如白蛋白、IgG、FcRn,和转移;通过偶联(遗传上或化学上)到其它结合部分,所述结合部分结合血清蛋白质,如纳米抗体、Fabs、DARPins、avimers、affibodies和anticalins;通过遗传融合rPEG、白蛋白、白蛋白的结构域、白蛋白结合蛋白质和Fc;或通过掺入到nancarriers中,减缓释放制剂和医疗设备。为了延长抗体在体内的血清循环,可使用或不使用多功能接头通过PEG位点特异性缀合到抗体N或C末端或通过赖氨酸残基上存在的ε氨基将惰性聚合分子如高分子量PEG附着到抗体或其片段上。为了聚乙二醇化抗体,抗体或其片段通常与聚乙二醇(PEG),如PEG的活性酯或醛衍生物在其中一个或更多PEG基团变得附着到抗体或其片段的条件下进行反应。可利用活性PEG分子(或类似活性水溶性聚合物)通过酰化反应或烷化反应进行聚乙二醇化。如本文所用,术语“聚乙二醇”旨在包括任何的PEG形式,其已经用于衍生其它蛋白质,如单(C1-C10)烷氧基或芳氧基-聚乙二醇或聚乙二醇-马来酰亚胺。在某些实施方案中,待聚乙二醇化的抗体是无糖基化抗体。使用导致生物活性损失最小的线性或分支聚合物衍生化。可通过SDS-PAGE和质谱密切监测缀合的程度,来保证PEG分子与抗体的正确缀合。可通过大小排排阻或通过离子交换层析从抗体-PEG缀合物中分离未反应的PEG。可使用本领域技术人员熟知的方法,例如通过本文描述的免疫测定法测试PEG衍生抗体的结合活性以及体内功效。聚乙二醇化蛋白质的方法为本领域所知,并可应用到本发明的抗体中。参见例如,Nishimura等的EP0154316和Ishikawa等的EP0401384。其它修改的聚乙二醇化技术包括重建化学正交指导的改造技术(ReCODEPEG),其将化学上特定的侧链通过包括tRNA合成酶和tRNA的重建系统掺入到生物合成蛋白质中。该技术能够在大肠杆菌、酵母和哺乳动物细胞中将多于30个新氨基酸掺入到生物合成蛋白质中。所述tRNA将非天然氨基酸掺入到琥珀密码子定位的任何位置,使琥珀密码子从终止密码子转化成信令化学上特定的氨基酸掺入的一个密码子。重组聚乙二醇化技术(rPEG)也可用于血清半衰期延长。该技术包括将300-600个氨基酸未组织的蛋白质尾巴融合到现有的药物蛋白质上。因为该未组织蛋白质链的表观分子量比其实际分子量大约15倍,所以极大延长了该蛋白质的血清半衰期。与需要化学缀合和再纯化的常规聚乙二醇化相反,该制备方法极其简化并且产品是同质的。多唾液酸化是另一种技术,其使用天然聚合物聚唾液酸(PSA)来延长活性生命并提高治疗肽和蛋白质的稳定性。PSA是唾液酸的聚合物(糖)。当用于蛋白质和治疗肽药物递送时,聚唾液酸在缀合上提供保护性微环境。这增加了治疗蛋白质在循环中的活性生命并防止其被免疫系统识别。PSA聚合物天然见于人体中。其被某些细菌采用,所述细菌进化了超过数百万年,用所述PSA聚合物包被自身的壁。通过分子拟态,这些天然多唾液酸化细菌然后能够挫败身体的防御系统。PSA是自然界的最终隐形技术,可容易地自此类细菌大量产生并具有预定的物理特点。甚至当与蛋白质偶联时,细菌PSA也是完全非免疫原性的,因为它与人体中的PSA在化学上相同。另一技术包括使用连接抗体的羟乙基淀粉(“HES”)衍生物。HES是来自蜡状玉米淀粉的修饰的天然聚合物,并可通过身体的酶进行新陈代谢。一般施用HES溶液来替换不足的血液体积并改善血液的流变学性质。抗体的羟乙基化使得能够通过提高分子的稳定性,以及降低肾清除率来延长循环半衰期,产生提高的生物学活性。通过改变不同的参数,如HES的分子量,可定制广泛的HES抗体缀合物。也可通过向IgG恒定结构域或其FcRn结合片段(优选Fc或铰链Fc结构域片段)中引入一个或更多氨基酸修饰(即,替换、插入或缺失)产生在体内具有增加的半衰期的抗体。参见例如,国际公开号WO98/23289;国际公开号WO97/34631;和美国专利号6,277,375。另外,抗体可缀合到白蛋白(例如人血清白蛋白;HSA)上,以使抗体或抗体片段在体内更稳定或在体内具有更长的半衰期。技术为本领域所熟知,参见例如国际公开号WO93/15199、WO93/15200和WO01/77137;和欧洲专利号EP413,622。此外,在上文所述双特异性抗体的背景中,可以设计抗体的双特异性,使得所述抗体的一个结合域结合P因子,而该抗体的第二个结合域结合血清白蛋白,优选HSA。提高半衰期的策略特别用于纳米抗体、基于纤连蛋白的结合子,和期望提高体内半衰期的其它抗体或蛋白质。抗体缀合物本发明提供特异性结合P因子蛋白质的抗体或其片段,其重组融合或化学缀合(包括共价和非共价缀合)到异源蛋白质或多肽(或其片段,优选至少10、至少20、至少30、至少40、至少50、至少60、至少70、至少80、至少90或至少100个氨基酸的多肽),以产生融合蛋白质。具体而言,本发明提供包含本文所述抗体的抗原结合片段(例如,Fab片段、Fd片段、Fv片段、F(ab)2片段、VH结构域、VHCDR、VL结构域或VLCDR)和异源蛋白质、多肽或肽的融合蛋白质。用于融合或缀合蛋白质、多肽或肽到抗体或抗体片段上的方法为本领域所知。参见例如美国专利号5,336,603、5,622,929、5,359,046、5,349,053、5,447,851和5,112,946;欧洲专利号EP307,434和EP367,166;国际公开号WO96/04388和WO91/06570;Ashkenazi等,1991,Proc.Natl.Acad.Sci.USA88:10535-10539;Zheng等,1995,J.Immunol.154:5590-5600;和Vil等,1992,Proc.Natl.Acad.Sci.USA89:11337-11341。可通过基因改组、基序改组、外显子改组和/或密码子改组(共同称为“DNA改组”)的技术产生额外的融合蛋白质。可使用DNA改组来改变本发明抗体或其片段的活性(例如,具有更高亲和力和更低解离速率的抗体或其片段)。一般参见美国专利号5,605,793、5,811,238、5,830,721、5,834,252和5,837,458;Patten等,1997,Curr.OpinionBiotechnol.8:724-33;Harayama,1998,TrendsBiotechnol.16(2):76-82;Hansson等,1999,J.Mol.Biol.287:265-76;以及Lorenzo和Blasco,1998,Biotechniques24(2):308-313(这些专利和出版物每一文件以其整体引入作为参考)。可在重组之前通过易错PCR、随机核苷酸插入或其它方法进行随机诱变来改变抗体或其片段,或编码的抗体或其片段。编码特异性结合P因子蛋白质的抗体或其片段的多核苷酸可与一种或更多异源分子的一个或更多组分、基序、断片、部分、结构域、片段等重组。此外,抗体或其片段可融合到标记序列上,如肽,以利于纯化。在优选的实施方案中,标记氨基酸序列是六组氨酸肽,如pQE载体(QIAGEN,Inc.,9259EtonAvenue,Chatsworth,CA,91311)中提供的标签,其中许多可以通过商业途径获得。如Gentz等,1989,Proc.Natl.Acad.Sci.USA86:821-824中所述,六组氨酸提供融合蛋白质的便利纯化。可用于纯化的其它肽标签包括,但不限于血凝素(“HA”)标签,其对应于来自流行性感冒血凝素蛋白质的表位(Wilson等,1984,Cell37:767)和“flag”标签。在其它实施方案中,本发明的抗体或其片段缀合诊断或检测试剂。此类抗体可用于监测或预后疾病或病症的开始、发展、进行和/或严重性,作为临床试验程序的一部分,如测定特定治疗的功效。可通过将抗体与可检测物质偶联完成此类诊断和检测,所述可检测物质包括但不限于多种酶,如但不限于,辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、或乙酰胆碱酯酶;辅基,如但不限于链霉抗生物素蛋白生物素和抗生物素蛋白/生物素;荧光物质,如但不限于伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺荧光素、丹磺酰氯或藻红蛋白;发光物质,如但不限于鲁米诺;生物发光物质,如但不限于荧光素酶、荧光素和水母发光蛋白;放射性物质,如但不限于碘(131I、125I、123I和121I)、碳(14C)、硫(35S)、氚(3H)、铟(115In、113In、112In和111In)、锝(99Tc)、铊(201Ti)、镓(68Ga、67Ga)、钯(103Pd)、钼(99Mo)、氙(133Xe)、氟(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ru、68Ge、57Co、65Zn、85Sr、32P、153Gd、169Yb、51Cr、54Mn、75Se、113Sn和117Tin;和使用多种正电子发射断层术的正电子发射金属,和非放射性顺磁金属离子。本发明还包括缀合治疗部分的抗体或其片段的用途。抗体或其片段可缀合到治疗部分,如细胞毒素,例如细胞生长抑制剂或细胞自杀剂,治疗剂或放射性金属离子,例如α粒子发射体。细胞毒素或细胞毒性剂包括对细胞有害的任何试剂。另外,抗体或其片段可缀合到修饰给定生物反应的治疗部分或药物部分。治疗部分或药物部分不解释为限制为典型的化学治疗剂。例如,药物部分可以是具有想要的生物学活性的蛋白质、肽或多肽。此类蛋白质可包括例如,毒素如相思豆毒蛋白、蓖麻毒蛋白A、假单胞菌外毒素、霍乱毒素或白喉毒素;蛋白质如肿瘤坏死因子、α干扰素、β干扰素、神经生长因子、血小板衍生生长因子、组织纤溶酶原激活物、细胞凋亡剂、抗血管生成剂;或生物反应修饰因子,例如淋巴因子。此外,抗体可缀合到治疗部分,如放射性金属离子,如α粒子发射体,如用于将放射性金属离子(包括但不限于131In、131LU、131Y、131Ho、131Sm)缀合到多肽上的213Bi或大环螯合剂。在某些实施方案中,所述大环螯合剂是1,4,7,10-四氮杂环十二烷-N,N’,N”,N”’-四乙酸(DOTA),其可通过接头分子附着到抗体上。此类接头分子为本领域所熟知,并描述于Denardo等,1998,ClinCancerRes.4(10):2483-90;Peterson等,1999,Bioconjug.Chem.10(4):553-7;和Zimmerman等,1999,Nucl.Med.Biol.26(8):943-50,每一参考文献以其整体引入作为参考。用于将治疗部分缀合到抗体上的技术是众所周知的,参见例如Arnon等,“MonoclonalAntibodiesForImmunotargetingOfDrugsInCancerTherapy”,MonoclonalAntibodiesAndCancerTherapy,Reisfeld等(编辑),第243-56页(AlanR.Liss,Inc.1985);Hellstrom等,“AntibodiesForDrugDelivery”,ControlledDrugDelivery(第2版Robinson等(编辑),第623-53页(MarcelDekker,Inc.1987);Thorpe,“AntibodyCarriersOfCytotoxicAgentsInCancerTherapy:AReview”,MonoclonalAntibodies84:BiologicalAndClinicalApplications,Pinchera等(编辑),第475-506页(1985);“Analysis,Results,AndFutureProspectiveOfTheTherapeuticUseOfRadiolabeledAntibodyInCancerTherapy”,MonoclonalAntibodiesForCancerDetectionAndTherapy,Baldwin等(编辑),第303-16页(AcademicPress1985),和Thorpe等,1982,Immunol.Rev.62:119-58。抗体也可附着到固相支持体上,所述固相支持体特别用于靶抗原的免疫测定或纯化。此类固相支持体包括,但不限于玻璃、纤维素、聚丙烯酰胺、尼龙、聚苯乙烯、聚氯乙烯或聚丙烯。产生本发明抗体的方法编码抗体的核酸本发明提供基本纯化的核酸分子,其编码包含上文描述的P因子结合抗体链的区段或结构域的多肽。本发明的一些核酸包含编码示于SEQIDNO:7、21、35、49、63、77、91、105、119、133、147、161、175、189、203、217、231、245、259或273的重链可变区的核苷酸序列,和/或编码示于SEQIDNO:8、22、36、50、64、78、92、106、120、134、148、162、176、190、204、218、232、246、260或274的轻链可变区的核苷酸序列。在特定实施方案中,核酸分子是在表1中鉴定的那些核酸分子。本发明的一些其它核酸分子包含与表1中鉴定的那些核酸分子的核苷酸序列基本相同(例如至少65、80%、95%或99%)的核苷酸序列。当从适当表达载体进行表达时,这些多核苷酸编码的多肽能够显示P因子抗原结合能力。本发明还提供的是编码来自上文阐明的P因子结合抗体的重链和轻链的至少一个CDR区以及一般地所有三个CDR区的多核苷酸。一些其它多核苷酸编码上文阐明的P因子结合抗体的重链和/或轻链的所有或基本上所有可变区序列。因为密码子的简并性,多种核酸序列编码每一种免疫球蛋白氨基酸序列。本发明的核酸分子可编码抗体的可变区和恒定区。一些本发明的核酸序列包含编码成熟重链序列的核苷酸,所述成熟重链序列与在SEQIDNO:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261或275中阐明的成熟重链序列基本相同(例如,至少80%、90%或99%)。一些其它核酸序列包含编码成熟轻链序列的核苷酸,所述成熟轻链序列与在SEQIDNO:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262或276中阐明的成熟轻链序列基本相同(例如,至少80%、90%或99%)。可通过从头固相DNA合成或通过PCR诱变编码P因子结合抗体或其结合片段的现有序列(例如下文实施例中描述的序列)来产生多核苷酸序列。可通过本领域已知的方法,如Narang等,1979,Meth.Enzymol.68:90的磷酸三酯法;Brown等,Meth.Enzymol.68:109,1979的磷酸二酯法;Beaucage等,Tetra.Lett.,22:1859,1981的二乙基亚磷酰胺法;和美国专利号4,458,066的固相支持物法完成核酸的直接化学合成。如PCRTechnology:PrinciplesandApplicationsforDNAAmplification,H.A.Erlich(编辑),FreemanPress,NY,NY,1992;PCRProtocols:AGuidetoMethodsandApplications,Innis等(编辑),AcademicPress,SanDiego,CA,1990;Mattila等,NucleicAcidsRes.19:967,1991;和Eckert等,PCRMethodsandApplications1:17,1991中描述的进行通过PCR向多核苷酸序列中引入突变。本发明还提供用于产生上文所述P因子结合抗体的表达载体和宿主细胞。可使用多种表达载体来表达编码P因子结合抗体链或结合片段的多核苷酸。基于病毒的表达载体和非病毒表达载体均可用于在哺乳动物宿主细胞中产生抗体。非病毒载体和系统包括质粒、游离型载体,通常具有用于表达蛋白质或RNA的表达盒,和人工染色体(参见例如,Harrington等,NatGenet15:345,1997)。例如,用于在哺乳动物(例如人)细胞中表达P因子结合多核苷酸和多肽的非病毒载体包括pThioHisA、B&C、pcDNA3.1/His、pEBVHisA、B&C(Invitrogen,SanDiego,CA)、MPSV载体,和本领域中已知用于表达其它蛋白质的许多其它载体。有用的病毒载体包括基于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒的载体、基于SV40、乳头瘤病毒、HBPEB病毒、痘苗病毒载体和SemlikiForest病毒(SFV)的载体。参见,Brent等,上文;Smith,Annu.Rev.Microbiol.49:807,1995;和Rosenfeld等,Cell68:143,1992。表达载体的选择依赖于其中待表达所述载体的预期宿主细胞。通常,所述表达载体含有有效连接编码P因子结合抗体链或片段的多核苷酸的启动子和其它调节序列(例如,增强子)。在一些实施方案中,使用诱导型启动子来防止插入序列的表达(除了在诱导条件下之外)。诱导型启动子包括,例如阿拉伯糖、lacZ、金属硫蛋白启动子或热激启动子。可在非诱导条件下扩大转化生物的培养,而不偏向编码序列的群体,宿主细胞能更好地耐受所述编码序列的表达产物。除了启动子,也需要或想要其它调节元件用于P因子结合抗体链或片段的有效表达。这些元件通常包括ATG起始密码子和邻近核糖体结合位点或其它序列。此外,可通过包括适合于使用中的细胞系统的增强子来增强表达的效率(参见例如,Scharf等,ResultsProbl.CellDiffer.20:125,1994;和Bittner等,Meth.Enzymol.,153:516,1987)。例如,SV40增强子或CMV增强子可用于提高哺乳动物宿主细胞中的表达。表达载体也可提供分泌信号序列位置,以与插入的P因子结合抗体序列编码的多肽形成融合蛋白质。更经常地,所述插入的P因子结合抗体序列在包括在载体中之前连接信号序列。待用于接受编码P因子结合的抗体轻链和重链可变结构域的序列的载体有时候也编码恒定区或其部分。此类载体允许可变区表达为与恒定区的融合蛋白质,由此导致完整抗体或其片段的产生。通常,此类恒定区是人的恒定区。用于携带并表达P因子结合抗体链的宿主细胞可以是原核细胞或真核细胞。大肠杆菌是用于克隆并表达本发明多核苷酸的一种原核宿主。适于使用的其它微生物宿主包括芽孢杆菌,如枯草杆菌(Bacillussubtilis),和其它肠杆菌科(enterobacteriaceae),如沙门氏菌属(Salmonella)、沙雷氏菌属(Serratia)和多种假单胞菌属(Pseudomonas)物种。在这些原核宿主中,也可以制备表达载体,其通常含有与所述宿主细胞相容的表达控制序列(例如,复制起点)。此外,存在任何数量的多种众所周知的启动子,如乳糖启动子系统、色氨酸(trp)启动子系统、β-内酰胺酶启动子系统,或来自λ噬菌体的启动子系统。所述启动子通常任选地与操纵子序列控制表达,并具有核糖体结合位点序列等,用于起始并完成转录和翻译。其它微生物,如酵母也可用于表达本发明的P因子结合多肽。也可使用昆虫细胞与杆状病毒载体组合。在一些优选的实施方案中,哺乳动物宿主细胞用于表达并产生本发明的P因子结合多肽。例如,它们可以是表达内源免疫球蛋白基因的杂交瘤细胞系(例如,实施例中描述的1D6.C9骨髓瘤杂交瘤克隆)或携带外源表达载体的哺乳动物细胞系(例如,下文示例的SP2/0骨髓瘤细胞)。这些包括任何正常致死或正常或非正常永生动物或人细胞。例如,已经开发了能够分泌完整免疫球蛋白的大量合适宿主细胞系,包括CHO细胞系、多种Cos细胞系、HeLa细胞、骨髓瘤细胞系、转化的B细胞和杂交瘤。一般在例如Winnacker,FROMGENESTOCLONES,VCHPublishers,N.Y.,N.Y.,1987中讨论了哺乳动物组织细胞培养物表达多肽的用途。用于哺乳动物宿主细胞的表达载体可包括表达控制序列,如复制起点、启动子和增强子(参见例如,Queen等,Immunol.Rev.89:49-68,1986)、和必要的加工信息位点,如核糖体结合位点、RNA剪接位点、多腺苷酸化位点和转录终止子序列。这些表达载体一般含有来自哺乳动物基因或来自哺乳动物病毒的启动子。合适的启动子可以是组成型的、细胞类型特异的、阶段特异的、和/或可调整的或可调节的。有用的启动子包括,但不限于金属硫蛋白启动子、组成型腺病毒主要晚期启动子、地塞米松诱导型MMTV启动子、SV40启动子、MRPpolIII启动子、组成型MPSV启动子、四环素诱导型CMV启动子(如人立即早期CMV启动子)、组成型CMV启动子和本领域已知的启动子-增强子组合。用于引入含有目的多核苷酸序列的表达载体的方法根据细胞宿主的类型变化。例如,氯化钙转染通常用于原核细胞,而磷酸钙处理或电穿孔可用于其它细胞宿主。(一般参见Sambrook,等,上文)。其它方法包括,例如电穿孔、磷酸钙处理、脂质体介导的转化、注射和显微注射、生物射弹方法、病毒体、免疫脂质体、聚阳离子:核酸缀合物、裸DNA、人工病毒体、与疱疹病毒结构蛋白VP22的融合物(Elliot和O'Hare,Cell88:223,1997)、DNA的试剂增强的吸收和离体转导。对于重组蛋白质的长期、高产量生产,通常想要稳定表达。例如,可使用含有病毒复制起点或内源表达元件和选择标记基因的本发明的表达载体制备稳定表达P因子结合抗体链或结合片段的细胞系。引入载体后,可以允许细胞在富集培养基中生长1-2天后转换到选择性培养基。选择标记的目的是赋予选择抗性,并且其存在允许成功表达所引入序列的细胞在选择性培养基中生长。使用对细胞类型合适的组织培养技术增殖具有抗性的稳定转染的细胞。本发明单克隆抗体的产生可通过多种技术,包括常规单克隆抗体方法,例如Kohler和Milstein,1975Nature256:495的标准体细胞杂交技术来产生单克隆抗体(mAbs)。可使用产生单克隆抗体的许多技术,例如,病毒转化或B淋巴细胞的致癌性转化。用于制备杂交瘤的动物系统包括小鼠、大鼠和兔系统。小鼠中杂交瘤的产生是良好建立的程序。分离免疫的脾细胞用于融合的免疫方案和技术为本领域所知。融合配偶体(例如鼠类骨髓瘤细胞)和融合步骤也是已知的。可在如上文描述制备的鼠类单克隆抗体的序列基础上制备本发明的嵌合或人源化抗体。可使用标准分子生物学技术从目的鼠类杂交瘤中获得编码重链和轻链免疫球蛋白的DNA,并进行改造以含有非鼠类(例如,人)免疫球蛋白序列。例如,为了产生嵌合抗体,可使用本领域已知的方法将鼠类可变区连接到人恒定区(参见例如,Cabilly等的美国专利号4,816,567)。为了产生人源化抗体,可使用本领域已知的方法将鼠类CDR区插入人构架中。参见例如,Winter的美国专利号5225539,和Queen等的美国专利号5530101;5585089;5693762和6180370。在某一实施方案中,本发明抗体是人单克隆抗体。可使用携带人免疫系统的部分而非小鼠系统的转基因或转染色体小鼠产生针对P因子的此类人单克隆抗体。这些转基因和转染色体小鼠包括本文分别称为HuMAb小鼠和KM小鼠的小鼠,并在本文统称为“人Ig小鼠”。HuMAb(Medarex,Inc.)含有编码未重排人重链(μ和γ)和K轻链免疫球蛋白序列的人免疫球蛋白基因小基因座(miniloci),以及失活内源μ和K链基因座的靶向突变(参见例如,Lonberg,等,1994Nature368(6474):856-859)。因此,小鼠显示降低表达的小鼠IgM或K,并且响应免疫时,引入的人重链和轻链转基因经历类别转换和体细胞突变,产生高亲和力人IgGK单克隆抗体(Lonberg,N.等,1994上文;综述见于Lonberg,N.,1994HandbookofExperimentalPharmacology113:49-101;Lonberg,N.和Huszar,D.,1995Intern.Rev.Immunol.13:65-93,以及Harding,F.和Lonberg,N.,1995Ann.N.Y.Acad.Sci.764:536-546)。HuMAb小鼠的制备和用途以及该小鼠携带的基因组修饰进一步描述于Taylor,L.等,1992NucleicAcidsResearch20:6287-6295;Chen,J.等,1993InternationalImmunology5:647-656;Tuaillon等,1993Proc.Natl.Acad.Sci.USA94:3720-3724;Choi等,1993NatureGenetics4:117-123;Chen,J.等,1993EMBOJ.12:821-830;Tuaillon等,1994J.Immunol.152:2912-2920;Taylor,L.等,1994InternationalImmunology579-591;和Fishwild,D.等,1996NatureBiotechnology14:845-851,所有参考文献的内容以其整体明确引入作为参考。进一步参见均为Lonberg和Kay的美国专利号5,545,806;5,569,825;5,625,126;5,633,425;5,789,650;5,877,397;5,661,016;5,814,318;5,874,299和5,770,429Surani等的美国专利号5,545,807;均为Lonberg和Kay的PCT公开号WO92103918、WO93/12227、WO94/25585、WO97113852、WO98/24884和WO99/45962;和Korman等的PCT公开号WO01/14424。在另一实施方案中,可使用在转基因和转染色体上携带人免疫球蛋白序列的小鼠,如携带人重链转基因和人轻链转染色体的小鼠产生本发明的人抗体。在Ishida等的PCT公开WO02/43478中详细描述了本文称为“KM小鼠”的这种小鼠。进一步,表达人免疫球蛋白基因的备选转基因动物系统可在本领域中获得,并可用于产生本发明的P因子结合抗体。例如,可使用称为Xenomouse(Abgenix,Inc.)的备选转基因系统。在例如Kucherlapati等的美国专利号5,939,598;6,075,181;6,114,598;6,150,584和6,162,963中描述了此类小鼠。此外,表达人免疫球蛋白基因的备选转染色体动物系统可在本领域中获得,并可用于产生本发明的P因子结合抗体。例如,可使用称为“TC小鼠”的携带人重链转染色体和人轻链转染色体的小鼠;在Tomizuka等,2000Proc.Natl.Acad.Sci.USA97:722-727中描述了这种小鼠。另外,携带人重链和轻链转染色体的奶牛已经描述于本领域中(Kuroiwa等,2002NatureBiotechnology20:889-894),并可用于产生本发明的P因子结合抗体。也可使用噬菌体展示方法制备本发明的人单克隆抗体,用于筛选人免疫球蛋白基因文库。在本领域中建立或在下文实施例中描述了用于分离人抗体的此类噬菌体展示方法。参见例如:Ladner等的美国专利号5,223,409;5,403,484;和5,571,698;Dower等的美国专利号5,427,908和5,580,717;McCafferty等的美国专利号5,969,108和6,172,197;和Griffiths等的美国专利号5,885,793;6,521,404;6,544,731;6,555,313;6,582,915和6,593,081。也可使用SCID小鼠制备本发明的人单克隆抗体,在所述SCID小鼠中已经重建了人免疫细胞,使得在免疫后产生人抗体应答。例如在Wilson等的美国专利号5,476,996和5,698,767中描述了此类小鼠。构架或Fc改造本发明的改造抗体包括其中VH和/或VL内构架残基已经进行了修饰,例如以改善抗体性质的那些抗体。通常进行这些构架修饰以降低抗体的免疫原性。例如,一种方法是将一个或更多构架残基“回复突变”成相应的种系序列。更特别地,已经经历体细胞突变的抗体含有不同于抗体来源种系序列的构架残基。可通过比较抗体构架序列与抗体来源的种系序列来鉴定此类残基。为了将构架区序列恢复成它们的种系构型,例如通过定点诱变可以将体细胞突变“回复突变”到种系序列中。此类“回复突变的”抗体也旨在包括在本发明内。另一类型的构架修饰包括突变构架区,或甚至一个或更多CDR区内的一个或更多残基,来去除T细胞表位,由此降低抗体的潜在免疫原性。该方法也称为“去免疫化”,并进一步详细描述于Carr等的美国专利公开号20030153043中。除了在构架或CDR区内进行修饰外或作为备选,可改造本发明的抗体以包括Fc区内的修饰,通常用来改变抗体的一种或更多功能性质,如血清半衰期、补体结合、Fc受体结合,和/或抗原依赖性细胞毒性。另外,可化学修饰(例如,一个或更多化学部分可附着到抗体上)或修饰本发明的抗体以改变其糖基化,再次用于改变抗体的一种或更多功能性质。在下文中进一步详细描述了这些实施方案中每一个实施方案。Fc区中残基的编号是Kabat的EU指数的编号。在一个实施方案中,修饰CH1的铰链区,使得改变,例如增加或减少铰链区中半胱氨酸残基的数量。在Bodmer等的美国专利号5,677,425中进一步描述了该方法。改变CH1的铰链区中半胱氨酸残基的数量,例如用来便于轻链和重链装配,或提高或降低抗体的稳定性。在另一实施方案中,突变抗体的Fc铰链区,以降低抗体的生物半衰期。更特别地,向Fc铰链片段的CH2-CH3结构域界面区引入一个或更多氨基酸突变,使得抗体相对于天然的Fc铰链结构域SpA结合具有受损的葡萄球菌蛋白A(SpA)结合。在Ward等的美国专利号6,165,745中进一步描述了该方法。在另一实施方案中,修饰抗体以增加其生物半衰期。多种方法是可能的。例如,可引入一个或更多以下突变:T252L、T254S、T256F,如Ward的美国专利号6,277,375中所述。或者,为了增加生物学半衰期,可在CH1或CL区内改变抗体,以含有取自IgG的Fc区的CH2结构域的两个环的挽救受体结合表位,如Presta等的美国专利号5,869,046和6,121,022所述。在其它实施方案中,通过用不同氨基酸残基替换至少一个氨基酸残基来改变Fc区域,以改变抗体的效应功能。例如,可用不同氨基酸残基替换一个或更多氨基酸,使得所述抗体对效应配体具有改变的亲和力,但保留亲本抗体的抗原结合能力。对其亲和力改变的效应配体可以是例如,Fc受体或补体的C1组分。在Winter等的美国专利号5,624,821和5,648,260中进一步详细描述了该方法。在另一实施方案中,可用不同氨基酸残基替换选自氨基酸残基的一个或更多氨基酸,使得抗体具有改变的C1q结合/或降低的或消除的补体依赖性细胞毒性(CDC)。在Idusogie等的美国专利号6,194,551中进一步详细描述了该方法。在另一实施方案中,改变一个或更多氨基酸残基,由此改变抗体固定补体的能力。在Bodmer等的PCT公开WO94/29351中进一步详细描述了该方法。在再一实施方案中,修饰Fc区以提高抗体介导抗体依赖性细胞毒性(ADCC)的能力和/或通过修饰一个或更多氨基酸来增加抗体对Fcγ受体的亲和力。在Presta的PCT公开WO00/42072中进一步详细了描述该方法。此外,已经在人IgG1上对FcγRl、FcγRII、FcγRIII和FcRn的结合位点进行作图,并且已经描述了具有提高结合的变体(参见Shields,R.L.等,2001J.Biol.Chen.276:6591-6604)。在再一实施方案中,修饰抗体的糖基化。例如,可制备无糖基化抗体(即,所述抗体缺少糖基化)。可改变糖基化,例如用来增加抗体对“抗原”的亲和力。可通过例如改变抗体序列中一个或更多糖基化位点来完成此类糖类修饰。例如,可进行一个或更多氨基酸取代,由此去除该位点上的糖基化,所述氨基酸取代导致一个或更多可变区构架糖基化位点的去除。这种无糖基化可增加抗体对抗原的亲和力。在Co等的美国专利号5,714,350和6,350,861中进一步详细了描述该方法。此外或备选地,可以制备具有改变类型糖基化的抗体,如具有减少量的岩藻糖残基的低岩藻糖化抗体或具有增加的二等分GlcNac结构的抗体。已经显示此类改变的糖基化模式提高抗体的ADCC能力。例如通过在具有改变的糖基化机器的宿主细胞中表达抗体来完成此类糖类修饰。已经在本领域中描述了具有改变糖基化机器的细胞,并且其可用作宿主细胞,在其中表达本发明重组抗体,由此产生具有改变的糖基化的抗体。例如,Hang等的EP1,176,195描述了具有功能破坏的FUT8基因的细胞系,该基因编码岩藻糖转移酶,使得在这种细胞系中表达的抗体显示低岩藻糖化。Presta的PCT公开WO03/035835描述了变体CHO细胞系Lecl3细胞,其将岩藻糖附着到Asn(297)-连接的糖类上的能力降低,也导致在该宿主细胞中表达的抗体的低岩藻糖化(也参见Shields,R.L.等,2002J.Biol.Chem.277:26733-26740)。Umana等的PCT公开WO99/54342描述了经改造以表达糖蛋白修饰糖基转移酶(例如,β(1,4)-N乙酰葡糖氨基转移酶III(GnTIII)),使得在改造的细胞系中表达的抗体显示增加的二等分GlcNac结构,其导致抗体的ADCC活性提高(也参见Umana等,1999Nat.Biotech.17:176-180)。改造改变的抗体的方法如上讨论,本文显示的具有VH和VL序列或全长重链和轻链序列的P因子结合抗体可用于通过修饰全长重链和/或轻链序列、VH和/或VL序列、或附着到其上的恒定区产生新的P因子结合抗体。因此,在本发明的另一方面,本发明P因子结合抗体的结构特征用于产生结构上相关的P因子结合抗体,其保留了本发明抗体的至少一种功能性质,如结合人P因子,以及抑制P因子的一种或更多功能性质(例如,在MAC沉积测定中抑制MAC沉积,在溶血测定中抑制红细胞溶解)。例如,本发明抗体的一个或更多CDR区或其突变可与已知的构架区和/或其它CDRs重组组合以产生本发明额外的重组改造的P因子结合抗体,如上讨论。其它类型的修饰包括在先前部分中描述的那些。用于改造方法的起始材料是本文提供的一个或更多VH和/或VL序列,或其一个或更多CDR区。为了产生改造的抗体,不必实际制备(即,表达为蛋白质)具有本文提供的一个或更多VH和/或VL序列,或其一个或更多CDR区的抗体。而是,序列中包含的信息用作起始材料,来产生来自初始序列的“第二代”序列,然后制备所述“第二代”序列并将其表达为蛋白质。因此,在另一实施方案中,本发明提供用于制备P因子结合抗体;改变重链可变区抗体序列和/或轻链可变区抗体序列内的至少一个氨基酸残基来产生至少一个改变的抗体序列;并将所述改变的抗体序列表达为蛋白质的方法,所述P因子结合抗体由以下组成:具有选自SEQIDNOs:1、15、29、43、57、71、85、99、113、127、141、155、169、183、197、211、225、239、253和267的CDR1序列、选自SEQIDNOs:2、16、30、44、58、72、86、100、114、128、142、156、170、184、198、212、226、240、254和268的CDR2序列,和/或选自SEQIDNOs:3、17、31、45、59、73、87、101、115、129、143、157、171、185、199、213、227、241、255和269的CDR3序列的重链可变区抗体序列;和具有选自SEQIDNOs:4、18、32、46、60、74、88、102、116、130、144、158、172、186、200、214、228、242、256和270的CDR1序列、选自SEQIDNOs:5、19、33、47、61、75、89、103、117、131、145、159、173、187、201、215、229、243、257和271的CDR2序列,和/或选自SEQIDNOs:6、20、34、48、62、76、90、104、118、132、146、160、174、188、202、216、230、244、258和272的CDR3序列的轻链可变区抗体序列。因此,在另一实施方案中,本发明提供用于制备P因子结合抗体;改变重链可变区抗体序列和/或轻链可变区抗体序列内的至少一个氨基酸残基来产生至少一个改变的抗体序列;并将所述改变的抗体序列表达为蛋白质的方法,所述P因子结合抗体由以下组成:具有选自SEQIDNOs:281、287、293、299、305、311、317、323、329、335、341、347、353、359、365、371、377、383、389和395的CDR1序列、选自SEQIDNOs:282、288、294、300、306、312、318、324、330、336、342、348、354、360、366、372、378、384、390和396的CDR2序列,和/或选自SEQIDNOs:283、289、295、301、307、313、319、325、331、337、343、349、355、361、367、373、379、385、391和397的CDR3序列的重链可变区抗体序列;和具有选自SEQIDNOs:284、290、296、302、308、314、320、326、332、338、344、350、356、362、368、374、380、386、392和398的CDR1序列、选自SEQIDNOs:285、291、297、303、309、315、321、327、333、339、345、351、357、363、369、375、381、387、393和399的CDR2序列,和/或选自SEQIDNOs:286、292、298、304、310、316、322、328、334、340、346、352、358、364、370、376、382、388、394和400的CDR3序列的轻链可变区抗体序列。因此,在另一实施方案中,本发明提供用于制备经过优化以在哺乳动物细胞中表达的P因子结合抗体;改变全长重链抗体序列和/或全长轻链抗体序列内的至少一个氨基酸残基来产生至少一个改变的抗体序列;并将所述改变的抗体序列表达为蛋白质的方法,所述P因子结合抗体由以下组成:具有选自SEQIDNOs:9、23、37、51、65、79、93、107、121、135、149、163、177、191、205、219、233、247、261和275的序列的全长重链抗体序列;和具有选自SEQIDNOs:10、24、38、52、66、80、94、108、122、136、150、164、178、192、206、220、234、248、262和276的序列的全长轻链抗体序列。也可通过筛选抗体文库制备改变的抗体序列,所述抗体文库具有如US20050255552中描述的固定的CDR3序列或最小基本结合决定簇以及CDR1和CDR2序列上的多样性。可根据适合于从抗体文库中筛选抗体的任何筛选技术,如噬菌体展示技术进行筛选。标准分子生物学技术可用于制备和表达改变的抗体序列。所述改变的抗体序列编码的抗体是保留本文所述P因子结合抗体的一种、一些或所有功能性质的抗体,所述功能性质包括,但不限于与人和/或猕猴P因子的特异性结合;和所述抗体在溶血测定中抑制红细胞溶解。在本发明改造抗体的方法的某些实施方案中,可沿全部或部分P因子结合抗体编码序列随机或选择性引入突变,并且可如此处描述的筛选所得的经修饰P因子结合抗体的结合活性和/或其它功能性质。已经在本领域中描述了突变方法。例如,Short的PCT公开WO02/092780描述了使用饱和诱变、合成连接装配或其组合产生并筛选抗体突变的方法。或者,Lazar等的PCT公开WO03/074679描述了使用计算筛选方法来优化抗体理化性质的方法。在本发明的某些实施方案中,已经改造了抗体以去除脱酰胺作用的位点。已知脱酰胺作用在肽或蛋白质中引起结构和功能改变。脱酰胺作用可以导致降低的生物活性,以及蛋白质药物的药物代谢动力学和抗原性的改变(AnalChem.2005Mar1;77(5):1432-9)。可使用本领域中可得的和/或本文所述的标准测定法,如在实施例中阐明的那些测定法(例如,ELISA)评估经改变的抗体的功能性质。预防和治疗用途可以以治疗有用浓度使用本文所述的结合P因子的抗体,通过向需要治疗的受试者施用有效量的本发明抗体或抗原结合片段来治疗与增加的补体活性相关的疾病或病症。在特定实施方案中,本发明提供了通过向需要治疗的受试者施用有效量的本发明抗体治疗年龄相关性黄斑变性(AMD)的方法。尤其可使用本发明的抗体来预防干涩AMD向湿润AMD的发展、减慢和/或预防地图样萎缩的发展、治疗或预防黄斑水肿、降低Lucentis注射的频率和改善因干涩和湿润AMD发展引起的视觉丧失。其也可以与抗VEGF治疗组合使用来治疗湿润AMD患者。眼睛疾病如AMD的治疗和/或预防可以由眼科医师或保健专家使用视觉功能和/或视网膜解剖学的临床相关测量方法来确定。AMD的治疗表示意欲改善或维持视觉功能和/或视网膜解剖学的任何活动(例如,施用本文所述的抗P因子抗体)。此外,当与AMD相关时,预防表示在具有所述恶化危险的患者中预防或减慢视觉功能、视网膜解剖学和/或本文所定义的AMD疾病参数恶化的任何活动(例如,施用本文所述的抗P因子抗体)。视觉功能可以包括,例如视力、低照度的视力、视野、中心视野、周边视觉、对比敏感性、暗适应、光应激恢复、颜色辨别、阅读速度、辅助装置(例如,大打字机字体、放大装置、望远镜)的依赖性、面部识别、操作机动车的熟练度、进行一项或多项日常生活活动的能力、和/或与视觉功能相关的患者报告满意度。因此,可以说AMD的治疗发生在达到预定程度的暗适应时具有至少10%减少或缺少10%或更高增加的受试者中。此外,可以说AMD的治疗发生在这样的受试者中,其在中心视觉暗点的总面积中显示至少10%减少或缺少10%或以上的增加,如通过有资格的保健专家(即眼科医师)确定的视角表示所述中心视觉暗点的总面积。视觉功能的示例性测定包括Snellen视力、ETDRS视力、低照度视力、阿姆斯勒方格表、Goldmann视野、Humphrey视野、微视野检查、Pelli-Robson图表、SKILL卡片、Ishihara颜色板、FarnsworthD15或D100颜色测试、和阅读速度、面部识别、驾驶刺激和患者报告满意度的有效测试。因此,可以说在ETDRS视力表上获得或未获得丢失2行或更多行(或10个字母)的视力后实现AMD的治疗。此外,可以说AMD的治疗发生在阅读速度(字/分钟)显示至少10%增加或缺少10%降低的受试者中。此外,可以说AMD的治疗发生在Ishihara测试上正确鉴定的平板或在Farnsworth测试上连续圆盘的比例显示至少20%增加或缺少20%减少的受试者中。可以治疗或预防的视网膜解剖学的不想要方面包括例如,脉络膜小疣、软脉络膜小疣、硬脉络膜小疣、表皮脉络膜小疣、基底薄片脉络膜小疣、汇合脉络膜小疣、大脉络膜小疣(例如,直径大约125微米)、RPE萎缩、光感受器萎缩、地图样萎缩、脉络膜新生血管、视网膜下新生血管形成、视网膜新生血管形成、经典的脉络膜新生血管形成、隐蔽的脉络膜新生血管形成、视网膜血管瘤增殖、脉络膜视网膜接合、脉络膜解剖学的异常、视网膜下出血、视网膜内出血、玻璃体出血、黄斑伤疤、视网膜下纤维变性和视网膜纤维变性。因此,例如与对照或相同受试者中同一只眼睛先前记载的生长速率相比,可以通过损害生长速率的20%或更多减少来确定地图样萎缩的治疗。评估视网膜解剖学的示例性手段包括眼底镜检查、眼底照相术、荧光素血管造影、吲哚氰绿因管造影、眼相干断层扫描(OCT)、光谱域眼相干断层扫描、激光扫描检眼镜检查、共聚焦显微镜、适应性光学、基底自发荧光、活组织检查、尸体剖检、和免疫组织化学。因此,可以说AMD在如OCT确定的黄斑厚度测量中10%减少,和/或如通过荧光素血管造影确定高荧光减少后在受试者中得到治疗。视网膜解剖学的示例性测量包括脉络膜小疣面积、脉络膜小疣体积、地图样萎缩损害面积、地图样萎缩生长速率,和新血管膜面积。在一些实施方案中,本发明提供通过向需要治疗的受试者施用有效量的本发明抗体治疗补体相关疾病或病症的方法。已知补体相关疾病或病症的实例包括:神经障碍、多发性硬化、中风、吉-巴综合征、外伤性脑损伤、帕金森病、不恰当或不想要补体激活的疾病、血液透析并发症、超急性同种异体移植物排斥、异种移植物排斥、IL-2治疗过程中白细胞介素2诱导的毒性、炎性疾病、自身免疫病炎症、克隆病、成人呼吸道窘迫综合征、包括烧伤或冻伤的热伤、局部缺血后再灌注状况、心肌梗塞、气囊血管成形术、心肺转流术或肾脏转流术中的泵后综合征、血液透析、肾缺血、表面重建后肠系膜动脉再灌注、传染病或脓毒、免疫复合物病症和自身免疫性疾病、类风湿性关节炎、系统性红斑狼疮(SLE)、SLE肾炎、增殖性肾炎、溶血性贫血、和重症肌无力。此外,其它已知补体相关疾病是肺部疾病和病症,如呼吸困难、咯血、ARDS、哮喘、慢性阻塞性肺疾病(COPD)、肺气肿、肺栓塞和梗塞、肺炎、致纤维化粉尘疾病、惰性粉尘和矿物质(例如,硅、煤炭粉末、铍和石棉)、肺纤维化、有机粉尘疾病、化学损伤(因刺激性气体和化学物质,例如氯、光气、二氧化硫、硫化氢、二氧化氮、铵和盐酸)、烟雾损伤、热损伤(例如,烧伤、冻伤)、哮喘、变态反应、支气管收缩、超敏感性肺炎、寄生虫病、肺出血肾炎综合征、肺血管炎和免疫复合物相关的炎症。在特定实施方案中,本发明提供通过向需要治疗的受试者施用有效量的本发明抗体治疗补体相关疾病或病症的方法,其中所述疾病或病症是哮喘、关节炎(例如,类风湿性关节炎)、自身免疫性心脏病、多发性硬化、炎性肠病、缺血-再灌注损伤、巴-西综合征、血液透析、系统性红斑狼疮、红斑狼疮、牛皮癣、多发性硬化、移植、中枢神经系统疾病如阿尔茨海默氏病和其它神经变性状况、aHUS、肾小球肾炎、大疱性类天疱疮或MPGNII。在特定实施方案中,本发明提供通过向需要治疗的受试者施用有效量的包含本发明抗体的组合物来治疗肾小球肾炎的方法。肾小球肾炎的症状包括,但不限于蛋白尿;降低的肾小球滤过率(GFR);血清电解质改变,包括氮质血症(尿毒症、过度血尿氮-BUN)和盐滞留,致使水滞留,导致高血压和水肿;血尿和异常尿沉淀,包括红细胞管型;低白蛋白血症;高脂血症;和脂肪尿。在特定实施方案中,本发明提供通过向需要治疗的受试者施用有效量的包含本发明抗体的组合物来治疗阵发性夜间血红蛋白尿(PNH)的方法。在特定实施方案中,本发明提供通过向需要治疗的受试者施用有效量的包含本发明抗体的组合物来减少与体外循环相关的免疫和止血系统功能异常的方法。本发明的抗体可用于任何方法中,所述方法涉及使患者血管中血液循环穿过导管,并回流到患者血管中,所述导管具有网眼表面,所述网眼表面包含能够引起补体激活、血小板激活、白细胞激活或血小板-白细胞粘着至少一种的材料。此类方法包括,但不限于所有形式的ECC,以及涉及向患者血液循环中引入人工或外源器官、组织或血管的方法。也可利用治疗与黄斑变性相关状况的已知方法,如在美国专利号6,218,368中描述的抗生素治疗向待用本发明治疗剂治疗的受试者施用其它治疗剂。在其它治疗中,免疫抑制剂如环孢菌素是能够抑制免疫应答的治疗剂。这些治疗剂包括细胞毒性药物、皮质类固醇、非类固醇抗炎药物(NSAIDs)、特异的T淋巴细胞免疫抑制剂,和抗体或其片段(参见Physicians'DeskReference,第53版,MedicalEconomicsCompanyInc.,Montvale,N.J.(1999))。通常以一周、一个月、三个月、六个月或一年的间隔继续免疫抑制治疗。在一些患者中,在患者余生中施用治疗。当本发明的治疗剂与另一治疗剂一起施用时,可以任何顺序连续施用或同时施用两种治疗剂。在一些方面,本发明的抗体向也接受第二种治疗剂(例如维替泊芬)治疗的受试者施用。另一方面,结合分子与外科治疗结合施用。与P因子结合抗体组合治疗的合适治疗剂包括本领域中已知的治疗剂,其能够调节补体组分的活性(参见例如,美国专利号5,808,109)。已经报道其它治疗剂降低补体介导的活性。此类治疗剂包括:氨基酸(Takada,Y.等Immunology1978,34,509);膦酸酯(Becker,L.Biochem.Biophy.Acta1967,147,289)、聚阴离子物质(Conrow,R.B.等J.Med.Chem.1980,23,242);磺酰氟(Hansch,C.;Yoshimoto,M.J.Med.Chem.1974,17,1160,和其中引用的参考文献);多核苷酸(DeClercq,P.F.等Biochem.Biophys.Res.Commun.1975,67,255);海松酸(Glovsky,M.M.等J.Immunol.1969,102,1);卟吩(Lapidus,M.和Tomasco,J.Immunopharmacol.1981,3,137);一些抗炎药(Burge,J.J.等J.Immunol.1978,120,1625);酚类(Muller-Eberhard,H.J.1978,MolecularBasisofBiologicalDegradativeProcesses,Berlin,R.D.等,编辑AcademicPress,NewYork,第65页);和苄脒类(Vogt,W.等Immunology1979,36,138)。这些治疗剂中的一些治疗剂通过一般性抑制蛋白酶和酯酶起作用。其它治疗剂对补体途径中任何特定中间步骤并不是特异的,但是却抑制补体激活的一个以上的步骤。后面化合物的实例包括苄脒类,其阻断C1、C4和C3b的利用(参见例如Vogt等Immunol.1979,36,138)。可抑制补体组分活性的本领域已知的额外治疗剂包括来自葡萄穗霉属(Stachybotrys)的真菌代谢物K-76(Corey等,J.Amer.Chem.Soc.104:5551,1982)。已经显示K-76和K-76COOH主要在C3b步抑制补体(Hong等,J.Immunol.122:2418,1979;Miyazaki等,Microbiol.Immunol.24:1091,1980),并防止从正常人补体中产生趋化因子(Bumpers等,Lab.Clinc.Med.102:421,1983)。在高浓度的K-76或K-76COOH中,显示了对C2、C3、C6、C7和C9与其各自先前媒介物的反应的一定抑制。也已经报道了K-76或K-76COOH抑制补体的C3b激活系统(Hong等,J.Immunol.127:104-108,1981)。用于实践本发明方法的其它合适治疗剂包括灰黄霉素(griseofulvin)(Weinberg,PrinciplesofMedicinalChemistry,第2版,Foye,W.O.,编辑,Lea&Febiger,Philadelphia,Pa.,第813页,1981)、isopannarin(Djura等,Aust.J.Chem.36:1057,1983)和Siphonodictyoncoralli-phagum的代谢物(Sullivan等,Tetrahedron37:979,1981)。组合治疗方案可以是累加的,或其可以产生协同结果(例如,补体途径活性的减少超出组合使用两种治疗剂的预期)。在一些实施方案中,本发明提供使用本发明的P因子结合抗体和抗血管发生剂,如抗VEGF治疗剂或另一抗补体抗体,如结合补体因子5(C5)的抗体或其抗原结合片段来预防和/或治疗AMD或如上所述另一补体相关疾病的组合治疗。抗补体抗体的组合一方面,本发明提供抗P因子的任何一个或更多个与结合并抑制补体途径不同组分的活性的额外抗体的组合。具体而言,本发明包括本文所述抗P因子抗体或抗原结合片段中的任何一个或更多个与结合补体组分5(C5)的抗体或抗原结合片段的组合。结合C5并抑制补体激活的抗体或其抗原结合片段的实例可见于例如美国专利8,241,628中(通过参考并入本文)。更特别地,在表2中显示并描述了结合C5并抑制补体途径的抗体或其抗原结合片段。一方面,本发明包括如表1中显示并描述的抗P因子抗体或其抗原结合片段与来自表2的抗C5抗体8109的组合。更特别地,本发明的一个方面涉及来自表1的抗体NVS962(或其抗原结合片段)与来自表2的抗体8109(或其抗原结合片段)的组合。一方面,本文所述抗P因子和抗C5抗体的组合证明了对补体途径,特别是补体旁路途径的协同抑制(syntergisticinhibition)。例如可以使用下文实施例中描述的溶血或聚IC测定证明这种抑制。可以使用本领域所熟知的方法确定使用本文所述抗P因子和抗C5抗体的组合实现的补体旁路途径抑制中的协同作用。例如,可以使用特定的软件,如ChaliceAnalyzer相对于仅累加效果确定抗P因子抗体和抗C5抗体的组合的协同效果。简言之,ChaliceAnalyzer(Lehar等,NatureBiotechnology2009,7:659)软件可以用于确定补体抑制抗体(例如,抗P因子和抗C5)的组合是否协同作用于阻断补体激活。可以通过比较每一个数据点上的抑制与来自单一试剂曲线的组合参考模型来表征组合效果(Greco,Bravo,Parsons(1995).Thesearchforsynergy:acriticalreviewfromaresponsesurfaceperspective.PharmacolRev47(2):331-85)。在Loewe累加性模型(Loewe(1928).DiequantitativenProblemederPharmakologie.Ergebn.Physiol.27:47-187)中,ILoewe(CX,CY)是满足(CX/ICX)+(CY/ICY)=1的抑制,并且ICX,Y是拟合单一试剂曲线的ILoewe处的有效浓度。Loewe累加性是协同作用的一般所接受的参考(Greco等),因为如果X和Y是相同的化合物,那么其代表了所产生的组合应答。一般使用等效线(Greco等)显示功效转移,所述等效线显示当与达到该效果需要的单一试剂剂量相比时,组合中需要多少药物来达到想要的效果水平。可以在ChaliceAnalyzer中手动或自动选择用于等效线展示和组合指数计算的效果水平选择。自动的等水平选择算法发现了具有最大Idata–ILoewe的观察Idata,排除具有超过较少单一试剂Imax的Idata的那些点。应用该排除以保证等效线反映两种单一试剂覆盖水平上的最佳协同作用。已经选择了等效线水平Icut后,通过鉴定对应于与所选等水平交叉的浓度的焦点来绘制等效线。等效线显示了与Loewe剂量累加性“drug-with-itself”标准相比的协同作用的标准等效线分析。对于明确的等效线水平,在ICeffect归一化的线性浓度范围上为组合的两种物质展示观察的等效线(例如,图3中的曲线)与理论剂量累加线(例如,图3中的直线)。剂量累加参考通常是连接两个ICeffect浓度的线。通过插入拟合sigmoidal剂量应答曲线发现ICeffect交叉点。功效转移评定为组合指数(Chou,Talalay(1984).Quantitativeanalysisofdose-effectrelationships:thecombinedeffectsofmultipledrugsorenzymeinhibitors.AdvEnzymeRegul22:27-55)CI。对于所选等效水平Icut,CII=(CX/ECX)I+(CY/ECY)I,其中特定数据点的(CX/ECX)I是X化合物测定浓度与其在所选抑制水平上的有效浓度的比值。可以认为CI是对相对于达到所选效果水平需要的单一试剂剂量的组合所需多少药物的粗略估计,并且0.1的值表示组合仅需要十分之一等量的单一试剂来达到相同的效果水平。0.5-0.7范围内的CI值通常用于当前临床组合的体外测定(Greco等)。1.0的CI值表示抗体组合的累加效果,而小于0.5的CI值表示因抗体组合引起的强协同效果。在ChaliceAnalyzer中,从每一个Icut交叉浓度计算的许多组合指数值报告最佳CI。在所有测定的CI值中,具有最大信噪比水平的一个值报道为最大组合指数。如本文所述抗P因子和抗C5抗体的组合可以单独或作为单一组合物施用。此外,抗P因子和抗C5抗体的相对剂量可以是1:1的比例,或可以是不同的比例。可以通过治疗医师或保健专家最终确定抗P因子抗体相对于抗C5抗体的明确剂量,以实现所治疗的病理状况的改善。例如,当本文所述的组合用于治疗AMD时,医师或保健专家可以定制抗P因子和抗C5抗体的相对剂量,以实现如使用本文所述的测定和标准确定的最佳治疗效果。药物组合物本发明提供药物组合物,其包含与药学上可接受的载体一起配制的P因子结合抗体(完整的或结合片段)。所述组合物可以额外地含有一种或多种其他治疗剂,其适合于治疗或预防例如病理性血管发生或肿瘤生长。药学上可接受的载体增强或稳定组合物,或可以用于方便制备组合物。药学上可接受的载体包括生理学上相容的溶剂、分散介质、包被剂、抗细菌和抗真菌剂、等渗和吸收延迟剂等。可以通过本领域多种方法施用本发明的药物组合物。施用途径和/或方式根据想要的结果而变化。优选玻璃体内、静脉内、肌内、腹膜内或皮下施用,或在靶标位点附近施用。药学上可接受的载体应该适合于玻璃体内、静脉内、肌内、皮下、肠胃外、脊柱或表皮施用(例如,通过注射或输注)。根据施用的途径,可以材料包衣活性化合物,即抗体,双特异和多特异分子,以保护所述化合物免于酸和可能失活所述化合物的其它自然条件的作用。组合物应该是无菌且是流体的。例如可使用包衣,如卵磷脂,在分散情况下维持需要的颗粒大小并使用表面活性剂来维持适当的流动性。在许多情况下,优选在组合物中包括等渗剂,例如,糖、多元醇如甘露醇或山梨醇,和氯化钠。可通过在组合物中引入延迟吸收的物质(例如单硬脂酸铝或明胶)产生可注射组合物的长期吸收。可根据本领域所熟知的且常规实践的方法制备本发明的药物组合物。参见例如,Remington:TheScienceandPracticeofPharmacy,MackPublishingCo.,第20版,2000;和SustainedandControlledReleaseDrugDeliverySystems,J.R.Robinson,编辑,MarcelDekker,Inc.,NewYork,1978。优选在GMP条件下制备药物组合物。通常,在本发明的药物组合物中使用治疗有效剂量或有效剂量的P因子结合抗体。通过本领域技术人员已知的常规方法将P因子结合抗体配制成药学上可接受的剂量形式。调整剂量方案来提供最想要的应答(例如,治疗应答)。例如,可施用快速灌注,可随时间施用若干分份剂量或根据治疗情形的紧急性指示按比例减少或增加剂量。以剂量单位形式配制肠胃外组合物尤其利于容易施用和剂量的均一性。本文所用的剂量单位形式指适合作为待治疗的受试者的单一剂量的物理分离单位;每一单位含有预定量的活性化合物,其经计算以产生与需要的药学载体相关的想要的治疗效果。可改变本发明药物组合物中活性成份的实际剂量水平,以获得活性成份的量,其对特定患者、组合物和施用方式有效实现想要的治疗应答,而对所述患者无毒。所选剂量水平依赖于多种药物代谢动力学因素,包括所用本发明具体组合物或其酯、盐或酰胺的活性、施用途径、施用时间、所用特定化合物的排泄速率、治疗的持续时间、与所用特定组合物组合使用的其它药物、化合物和/或物质、年龄、性别、体重、状况、一般健康和待治疗患者的先前医疗史等因素。医师或兽医可以比需要达到想要的治疗效果更低的水平开始施用药物组合物中所用本发明抗体的剂量,并逐渐增加剂量,直至达到想要的效果。一般地,用于治疗本文描述的变应性炎性病症的本发明组合物的有效剂量根据许多不同因素而变化,所述因素包括施用手段、靶位点、患者的生理状态、患者是人还是动物、施用的其它药剂、以及治疗是预防性的还是治疗性的。需要滴定治疗剂量以使安全性和效力达到最佳。对于抗体的全身施用,剂量范围在约0.0001到100mg/kg宿主体重,并更一般在0.01到15mg/kg宿主体重之间。对于抗体的玻璃体内施用,剂量范围在0.1mg/眼睛-5mg/眼睛之间。例如,0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml、0.6mg/ml、0.7mg/ml、0.8mg/ml、0.9mg/ml、1.0mg/ml、1.1mg/ml、1.2mg/ml、1.3mg/ml、1.4mg/ml、1.5mg/ml、1.6mg/ml、1.7mg/ml、1.8mg/ml、1.9mg/ml、2.0mg/ml、2.1mg/ml、2.2mg/ml、2.3mg/ml、2.4mg/ml、2.5mg/ml、2.6mg/ml、2.7mg/ml、2.8mg/ml、2.9mg/ml、3.0mg/ml、3.1mg/ml、3.2mg/ml、3.3mg/ml、3.4mg/ml、3.5mg/ml、3.6mg/ml、3.7mg/ml、3.8mg/ml、3.9mg/ml、4.0mg/ml、4.1mg/ml、4.2mg/ml、4.3mg/ml、4.4mg/ml、4.5mg/ml、4.6mg/ml、4.7mg/ml、4.8mg/ml、4.9mg/ml或5.0mg/ml。示例性治疗方案使得每两周一次或每月一次或每3到6个月一次进行全身施用。示例性治疗方案使得每两周一次或每月一次或每3到6个月一次进行全身施用。一般在多种情况下施用抗体。单次剂量的间隔可以是每周一次、每月一次或每年一次。如通过测定患者中P因子结合抗体的血液水平指示,间隔也可以是不规则的。此外,可以通过医师确定备选给药间隔并且每月一次或必要时施用以达到有效。功效基于通过谱域光学相干断层扫描(SD-OCT)和二级视力确定的损伤生长、Lucentis恢复的速率、视网膜厚度。在全身施用的一些方法中,调整剂量以达到1–1000μg/ml的血浆抗体浓度,在一些方法中达到25–500μg/ml。或者,抗体可作为持续释放制剂施用,在所述情况下需要更不频繁的施用。剂量和频率根据抗体在患者体内的半衰期而变化。一般地,人源化抗体比嵌合抗体和非人抗体显示更长的半衰期。施用的剂量和频率可根据治疗是预防性的还是治疗性的而变化。在预防性应用中,在长时间段内以相对不频繁的间隔施用相对低的剂量。一些患者在其余生继续接受治疗。在治疗性应用中,有时候需要在相对短间隔内相对高的剂量,直至疾病的发展减慢或终止,并优选直至所述患者显示疾病症状部分或彻底改善。此后,可对患者施用预防性方案。实施例提供以下实施例来进一步阐明本发明,但不限制其范围。本发明的其它变型对本领域的普通技术人员而言是显而易见的并包括在所附权利要求中。实施例1:产生亲和力成熟的P因子抗体完全人噬菌体展示文库用于产生如本文所述的P因子结合抗体。生物素化的和非生物素化的人和猕猴P因子用于溶液和固相淘选。进行标准的淘选以及RapMAT方法(Prassler等,(2009)Immunotherapy1(4):571-583)。亲和力成熟后(Knappik等,(2000)J.Mol.Biol.,296:57-86),随后选择一组10个抗体转化成二硫键桥接的Fab格式。所得的二硫键桥接的Fabs示于表1中(NVS962、NVS963、NVS964、NVS965、NVS966、NVS967)。实施例2:进一步的抗体优化以下实施例描述了可以用于进一步优化如本文所述抗体的方法。脱酰胺作用位点的去除通过在还原条件下运行肽作图和大小排阻层析(SEC)来鉴定脱酰胺作用位点。如Biacore和SET所测定,脱酰胺的材料在MAC沉积测定中具有降低的功效并对人和猕猴FP具有降低的亲和力。脱酰胺作用的程度在还原条件下随时间(3周)、更高的温度(37℃下5天)增加。可以使用离子交换柱检测脱酰胺作用,导致多个峰以及对额外脱酰胺峰的观察。最易于脱酰胺作用的氨基酸序列是:SNG、LNG、LNN、ELN(Daugherty,A.和Mrsny,R.(2010)CurrentTrendsinMonoclonalAntibodyDevelopmentandManufacturing.Springer.第103-129页)。因此,我们进行了一系列研究来去除脱酰胺作用位点并测试修饰的抗体其保留的功能。将两个Fabs(NVS962和NVS965)重新改造以在重链上替换脱酰胺作用位点,尤其发生在位置30处的天冬酰胺。产生以下新的Fabs以去除脱酰胺作用位点和表2中显示的对应的氨基酸替换。表2:脱酰胺的Fabs所产生的额外的Fab在FabNVS962中用丙氨酸替换丝氨酸31,产生FabNVS962-S31A。所述修饰的Fabs的序列示于表1中。去除切割位点在NVS962-S和NVS965-S上进行进一步的优化以去除重链CDR3中的切割位点。尤其是在Y102S103处切割所述重链。下表描述了被进行用来破坏切割位点的氨基酸取代。所述修饰的Fabs的序列示于表1中。表3:修饰的Fabs实施例3:表征经优化的抗体以下实施例描述了可以用于测定抗体亲和力的方法。测定结合亲和力的这些及其他方法为本领域所知。亲和力测定使用BiacoreT200(Biacore)和溶液平衡滴定(SET)通过表面等离振子共振(SPR)测定对P因子的抗体亲和力。每一种技术的解释和P因子结合对应的平均结果描述于下文中。模型假设考虑系统中P因子的浓度、P因子生物合成的动力学和半衰期,以及想要的剂量方案,并提示对P因子的亲和力大于500pM的Fab足以降低游离P因子的水平。Biacore测定可以从传感图中的信息确定相互作用的动力学,即复合体形成的速率(ka)和解离的速率(kd)。如果结合随着样品穿过所制备的传感器表面而发生,那么传感图中的应答增加。如果达到平衡,将会看到持续信号。用缓冲液替换样品引起结合分子解离并且应答增加。Biacore评估软件通过将数据拟合到相互作用模型中产生ka和kd的值(表4)。利用BIAcoreT100(GEHealthcare)使用CM5传感器芯片(GEHealthcare,BR-1005-30)在25℃下进行Biacore动力学实验。运行缓冲液是HBS-EP(+)(GEHealthcare,BR-1001-88)。简言之,进行以下步骤以确定结合亲和力。·制备抗FPIgG固定化的传感器芯片:根据供应商的说明书(GEHealthcare,BR-1000-50)使用氨基偶联方法以10ul/分钟的流速将小鼠抗FP单克隆抗体(Quidel,A235)(乙酸盐pH5.0偶联缓冲液中为30ug/ml(GEHealthcare,BR-1003-51))偶联到CM5芯片上的两种不同的流动小室(Fc1和2)上600秒钟。最终的固定化水平将>7000RU。·在第二个流动小室上捕获FP:将运行缓冲液中的1ug/ml的FP以10ul/分钟注射到第二个流动小室(Fc2)上以达到捕获水平~20RU(对于Fab动力学分析)或~7RU(对于IgG动力学分析)。·将不同浓度的抗FPFab或IgG注射到两个流动小室上:将抗FP溶液(在运行缓冲液中为0.3125nM~10nM;以1:2连续稀释)以60ul/分钟注射到两个流动小室(Fc1和2)上240秒钟。·解离:将HBS-EP(+)运行缓冲液以60ul/分钟注射到两个流动小室上,以监测FP与抗FPFab/IgG之间的解离。对于5nM和2.5MFab/IgG浓度,将解离时间设置为2400秒钟,而对于所有其他浓度,包括另外的5nMFab/IgG浓度,将解离时间设置为300秒钟。·再生:利用10mMGlycine-HClpH1.7(由GEHealthcare提供)+0.05%P20表面活性剂(GEHealthcare,BR-1000-54)以60ul/分钟的流速在两个流动小室上每一个循环结束时进行再生15秒钟,两次。·动力学分析:通过利用BIAevaluation1.1软件应用1:1结合模型获得动力学速率常数,其中局部拟合Rmax值。Biacore结合动力学测定的结果示于表4中。如所示,本文所述的抗体对人P因子显示高亲和力结合,其KD值通常小于或等于1nM,并且在许多情况下小于或等于200pM。这些抗体也对猕猴P因子显示非常高的亲和力(结合亲和力小于500pM)。SET测定与使用传感器表面的动力学测定,如SPR相反,SET是测定溶液中的亲和力的方法。其为不递送动力学数据的平衡测定。在SET中,恒定量的抗体与不同浓度的抗原温育,直至达到平衡。通过在抗原包被的MSDTM平板(MesoScaleDiscoveryTM)上应用溶液,随后与ECL标记的二级抗体温育并测定信号强度来测定平衡溶液中游离抗体的浓度。在低抗原浓度时,实现强的信号(在平板上结合抗原的高浓度的游离抗体),而对于高抗原浓度,抗体完全是抗原捕获的,产生弱的信号。如果在匹配范围内可获得足够数量的抗原浓度,那么滴定曲线允许使用适当的拟合模型合理地测定亲和力。对于完全滴定,必须应用比预期的KD高至少10倍的抗原浓度。在测定中应用的抗体的恒定浓度应该在KD的范围内或低于KD(表4)。对于通过溶液平衡滴定(SET)测定KD,使用抗体蛋白质的单体级分(通过分析SEC分析至少90%单体含量;分别为Superdex75(AmershamPharmacia)用于Fab,或TosohG3000SWXL(TosohBioscience)用于IgG)。溶液中的亲和力测定基本上如参考文献中描述进行(Friguet等305-19)。为了提高SET方法的灵敏性和精确性,从经典的ELISA转变成基于ECL的技术(Haenel等,2005)。根据制造商的说明书利用MSDSulfo-TAGTMNHS-Ester(MesoScaleDiscovery,Gaithersburg,MD,USA)标记1mg/ml山羊抗人(Fab)2片段特异性抗体(Dianova)。人P因子(ComplementTechnologycat#:A139)和从猕猴血清中纯化的猕猴P因子(从Nakano,等,(1986)JImmunolMethods90:77-83改编的方案)以在25μlPBS中0.2-0.3μg/ml包被在标准结合MSD平板上(Meso-ScaleDiscovery,384-孔:MSDcat#:L21XA,96-孔:MSDcat#:L15XA)并在4℃下温育过夜。将P因子抑制剂在温育缓冲液(具有2%BSA(Sigmacat#:A4503)和1%Tween20以及1%Triton-X(Sigmacat#:234729)的PBS)中稀释至固定浓度(1pM或10pM),并加入到温育缓冲液中连续稀释的P因子(人或猕猴)中。允许样品通过在室温下温育过夜而达到平衡。平板在洗涤缓冲液(具有0.05%Tween20的PBS)中洗涤3次,并利用100μl温育缓冲液在室温下封闭2小时。平板在洗涤缓冲液中洗涤3次。向平板中加入含有P因子抑制剂和P因子滴定的样品(25μl),并在室温下温育15分钟。平板在洗涤缓冲液中洗涤3次。加入25μl检测抗体(Anti-Human(Goat)Sulfo-TAG,在温育缓冲液中为1:1000,MSDcat#:R32AJ-1),并在室温下温育60分钟。平板在洗涤缓冲液中洗涤3次,并加入50μl的1xMSD读取缓冲液T(含有表面活性剂,MSDcat#:R92TC-1)。在MSDSpectorImager6000上读取平板。使用GraphPadPrism软件v4,从每一个值中扣除背景(不含有Fab的孔的平均值)分析数据。将X轴值(溶液中P因子的浓度)转换成log10x。从以下模型中拟合KD值(KD):Fab:Y=(Top-((Top/(2×Fab))×((((10^x)+Fab)+KD)-(((((10^x)+Fab)+KD)×(((10^x)+Fab)+KD))-((4×(10^x))×Fab))^0.5))))Top=抗原浓度处的信号=0x=溶液中P因子的浓度Fab=所应用的单价分析物(Fab)的浓度表4:P因子抗体的亲和力结合实施例4:P因子抗体抑制补体旁路途径溶血测定在溶血技术中,所有的补体组分必须均存在并有功能。因此,溶血技术可以筛选补体系统的功能完整性和缺陷(van等,1980;Minh等,1983;Tanaka等,1986)。为了测定经典途径的功能能力,溶血素(针对绵羊红细胞的兔IgG)包被的绵羊红细胞或利用兔抗鸡抗体致敏的鸡红细胞用作靶细胞(致敏细胞)。这些Ag-Ab复合体激活经典途径并当组分有功能且以适当浓度存在时导致靶细胞的裂解。为了测定人和猕猴血清中备选途径的功能能力,兔红细胞用作靶细胞(参见美国专利号6,087,120)。溶血测定是基本的功能测定,其测试补体激活并已经用于评估抗人FPmAbs和Fab分子通过补体途径阻断红细胞(RBCs)裂解的能力。可以使用溶血测定来测定识别人C5的单链Fv片段在体外和体内对补体活性的抑制(Thomas等,1996;Rinder等,1995;Rinder等,1995)。C5a和C5b-9产生的阻断抑制了体外循环过程中白细胞和血小板的激活。简言之,对于经典途径测定,致敏的红细胞(例如,鸡RBCs)用作血清中存在的补体蛋白质进行裂解的靶标。以下测定对表征和筛选P因子抗体对补体旁路途径的抑制十分重要。该方法改编自(Rinder等,1995;Thomas等,1996)。试剂:·兔红细胞(RbRBCs)–Lampire,Cat#7246408·人血清–NovartisBloodResearchProgram;或猕猴血清–AlphaGenesis·明胶巴比妥缓冲液(GVB)–BostonBioProducts,Cat#IBB-300·EGTA–BostonBioProducts,Cat#BM-151·MgCl2·U形底96-孔板–Corning,Cat#3795·平底96-孔板–Corning,Cat#3370·NP-40–Sigma,Cat#74385方案:在GVB/EGTA/Mg++中洗涤兔红细胞(RbRBCs)并调整至8.33x107细胞/ml。向96孔圆底平板的孔中加入在GVB中稀释的50μlFab。然后加入在含有EGTA和Mg++的GVB中稀释的50μl血清。以以下方式制备对照孔:不含有Fab的血清(阴性对照)和细胞加0.1%NP-40(100%裂解对照),和NP-40空白孔。含有和不含有Fab的血清与对照在室温下温育30分钟。在该点上,向样品和对照孔中加入30μlRbRBCs,并向空白孔中加入30μl缓冲液。细胞一般在37℃下温育30分钟并且平板在2000rpm下离心5分钟。收集上清液并转移到平底平板中。在OD415和OD570处读取上清液的吸光值。使用以下公式计算百分比溶血。表5示例了P因子抗体和抗原结合片段在10%人或20%猕猴血清中抑制溶血的能力。本文所述的每一个P因子抗体以小于或等于50nM的IC50抑制溶血。相反,当使用致敏红细胞进行测定以检查经典补体途径的激活时,发现本文所述的P因子抗体不抑制所述经典补体途径(数据未显示)。C3b沉积测定测定在备选途径中针对补体C3的抑制剂活性的一种方法是测定其在酵母多糖上沉积的降解产物C3b。根据以下步骤进行该基于ELISA的测定:碳酸盐缓冲液pH9.6(PierceCat#28382)中25μl的1mg/mlZymosanA(SigmaZ4250)在Maxisorp384-孔ELISA平板(Nunc464718)上于4℃包被过夜。第二天,吸干酵母多糖包被的平板并用100μl/孔ELISA封闭缓冲液Synblock(AbDSerotecBUFO34C)在室温下封闭2小时。在单独反应中,向补充有MgCl2和EGTA至1mMMgCl2和10mMEGTA最终总反应浓度的10%血清中加入在明胶巴比妥钠缓冲液(BostonBioproductsIBB320-10mMBarbital,145mMNaCl,0.1%Gelatin,0.5mMMgCl2,10mMEGTA)中连续稀释的抑制剂。阳性对照不含有抑制剂,而阴性对照含有25mMEDTA。允许混合物通过在室温下温育30分钟而达到平衡。为了去除封闭缓冲液,吸干缓冲液并用TBS/0.05%Tween-20洗涤平板一次。向平板中加入25μl/孔含有抑制剂的10%血清或对照并在37℃下温育30分钟(之前通过时间过程确定在酵母多糖上C3b沉积的线性范围内)。30分钟温育后,平板用TBS/0.05%Tween-20洗涤三次。为了检测酵母多糖上的C3b沉积,向平板中加入根据制造商在具有2%BSAFractionV(FisherCat#ICN16006980)、0.1%Tween20(SigmaCat#P1379)和0.1%TritonX-100(SigmaCat#P234729)的PBS中稀释的25μl/孔鸡抗人C3-HRP缀合的多克隆抗体(ImmunologyConsultantsLaboratory,Inc.Cat#CC3-80P-1)并在室温下温育1小时。然后,平板用TBS/0.05%Tween-20洗涤三次,然后加入25μl的UltraTMBSubstrateSolution(PierceCat#34028.)。当孔中的溶液变蓝时,用15μl的2N硫酸终止反应。使用Spectromax在450nm处读取平板,在570nm处对塑料平板进行校正(OD450-570nm读取)。使用以下公式计算酵母多糖上C3b沉积的百分比:所测试的每一种抗体显示以至少小于或等于10nM的IC50抑制C3b沉积(表5)。MAC沉积测定用于测定P因子抗体抑制补体旁路途径的能力的另一种测定是测定抗体抑制膜攻击复合体(MAC)产生的能力,所述膜攻击复合体在C3转化酶和P因子活性的下游。简言之,在平板上以碳酸盐缓冲液pH9.5中的1mg/ml包被酵母聚糖A(Sigma),以激活备选途径。Fabs与血清(20%血清,5mMMgCl2,10mMEDTA)预先温育,然后加入到平板中并在室温下温育过夜。用TBST洗涤平板三次后,通过与抗C5b-9-ALP(Diatec)温育1小时,然后利用TBST洗涤三次并与补充有2mMMgCl2的4-甲基伞形酮酰磷酸酯(Fisher)温育30分钟来检测MAC。用0.2MEDTA终止反应,并在ex=355nm,em=460nm处读取平板。相对于基线(EDTA处理的人血清)和阳性对照(人血清)计算每一样品的MAC沉积的抑制,并利用PRISM产生IC50曲线。表5显示了证明P因子抗体抑制MAC沉积的能力,因此表明所述抗体抑制补体旁路途径的数据。尤其是,该抗体以小于或等于25nM的IC50抑制MAC沉积。C3a沉积测定用于评估P因子抗体抑制补体旁路途径的能力的另一种方法是在C3转化酶切割C3后测定抗体抑制C3a产生的能力。在10mg/ml的酵母多糖和2n系列稀释的抗备解素Fab预先温育的10%和20%人血清包被的Maxisorp平板上进行测定。向平板中加入血清30分钟,在所述时间收集血清用于评估C3a产生。用抗C3ades-argneo抗体(1ug/ml)包被Maxisorp平板过夜,洗涤三次,并用稀释液在室温下封闭2小时。吸干稀释液后,加入血清1小时。洗涤平板三次并加入在稀释液中以1:1000稀释的100uL/孔检测抗体小鼠抗人C3a生物素。再温育1小时后,在室温下向孔中加入在稀释液中以1:5000稀释的链霉抗生物素HRP二级抗体1小时。在加入TMB检测底物之前洗涤平板四次。使用标准的终止溶液终止反应并在450-570nm处读取吸光值。与加入血清平行,使用在血清中稀释的纯化的C3ades-arg产生标准曲线。从5ug/ml开始,1:4连续稀释C3ades-arg以产生7个点曲线。如上处理、洗涤并读取标准曲线孔。表5:P因子抗体的功能分析ND:未确定实施例5:物种交叉反应性为了确定除人和猕猴外,如本文所述的抗P因子抗体是否能结合来自其他物种的P因子,如上所述进行MAC沉积和溶血测定。如上所述进行BIAcore分析或溶血测定。用于每一物种的血清浓度如下:10和20%兔、10和20%猕猴,和10和20%人血清。通过BIAcore评估鼠P因子结合。如下文表6中所示,P因子抗体能够与若干物种,包括兔、大鼠和猕猴交叉反应。表6:物种交叉反应性抗体人大鼠兔猕猴NVS962XXXXNVS962-SXXXXNVS801XXXXNVS965XNDNDXNVS965-SXNDNDXNVS808XNDXXNVS806XNDXXND:未确定实施例6:表位作图P因子包含若干个血小板反应蛋白重复结构域(TSR0-6)。TSR0结构域也称为N末端结构域。通过为每一个TSR产生小鼠和人嵌合体进行P因子Fabs的表位作图。先前的功能测定显示,Fabs不结合小鼠P因子(溶血测定),尽管每一个嵌合体在P因子缺失的血清中有功能。使用该方法确定所有的Fabs均结合TSR5(SEQIDNO:406)。图1C显示抗体结合TSR5的B区域。市售抗体A233显示不结合该区域。可以使用标准方法通过ELISA或Biacore评估结合。对于一种Ab,NVS487,由于与小鼠P因子的交叉反应性,数据不是结论性的。小鼠和人P因子TSR5结构域的序列比对显示表位包括SEQIDNO:408的氨基酸。实施例7:补体旁路途径的体内抑制利用本发明的抗体在猕猴中进行实验,以确定其抑制补体旁路途径的能力。以表7中所示的剂量水平施用测试项目NVS962。施用途径是玻璃体内(IVT)或静脉内(IV)。表7:体内研究设计如表7中所示,在研究的第1、15和29天玻璃体内和静脉内施用测试项目和载体溶液(载体:10mMHis/His-HCl;10%海藻糖;0.02%Tween20;pH5.5)。毒性评估基于死亡率、临床观察、体重、药效动力学(溶血分析)、眼科检查、眼内压测量、视网膜电图、血液学、临床化学、器官重量和病理学。在研究过程中没有死亡率并且在评估临床症状、体重、眼科检查、眼内压测量、视网膜电图、血液学、临床化学、器官重量和病理学后没有看到测试项目相关的发现。使用上述溶血测定来测定补体介导的溶血活性(参见实施例4)。溶血测定数据的分析显示,IV施用NVS962导致在施用后立即对溶血补体活性完全或近乎完全但短暂的抑制。当通过IVT途径以1mg/眼的剂量施用时,测试项目对血清溶血补体活性具有很少影响或没有影响。以5mg/眼并在10%猕猴血清中,观察到对溶血补体活性的完全或近乎完全的抑制。实施例8:抗体组合对补体旁路途径的协同抑制溶血测定如实施例4中所述进行溶血测定,其使用来自表2的抗C5抗体8109和来自表1的抗P因子抗体NVS962的Fab形式。图2示例了P因子抗体和抗原结合片段与抗C5抗体和抗原结合片段组合在20%人血清中抑制溶血的能力。当温育60分钟时,500nM抗P因子和500nM抗C5Fabs各自证明没有溶血抑制。相反,相同浓度和低至167nM浓度的抗P因子和抗C5抗体的组合证明近乎完全的溶血抑制。此外,近乎完全的溶血抑制持续长达250分钟。ChaliceAnalyzer软件使用来自溶血测定的数据,以确定补体抑制抗体的组合是否协同作用于阻断补体激活。可以通过比较每一个数据点上的抑制与来自单一试剂曲线的组合参考模型的抑制来表征组合效果(Greco,Bravo,Parsons(1995).Thesearchforsynergy:acriticalreviewfromaresponsesurfaceperspective.PharmacolRev47(2):331-85)。在Loewe累加性模型(Loewe(1928).DiequantitativenProblemederPharmakologie.Ergebn.Physiol.27:47-187)中,ILoewe(CX,CY)是满足(CX/ICX)+(CY/ICY)=1的抑制,并且ICX,Y是拟合单一试剂曲线的ILoewe处的有效浓度。Loewe累加性是协同作用的一般所接受的参考(Greco等),因为如果X和Y是相同的化合物,那么其代表了所产生的组合应答。一般使用等效线(Greco等)显示功效转移,所述等效线显示当与达到该效果需要的单一试剂剂量相比时,组合中需要多少较少的药物来达到想要的效果水平。可以在ChaliceAnalyzer中手动或自动选择用于等效线展示和组合指数计算的效果水平选择。自动的等水平选择算法发现了具有最大Idata–ILoewe的观察Idata,排除具有超过较少单一试剂Imax的Idata的那些点。应用该排除以保证等效线反映两种单一试剂覆盖水平上的最佳协同作用。已经选择了等效线水平Icut后,通过鉴定对应于与所选等水平交叉的浓度的焦点来绘制等效线。等效线显示了与Loewe剂量累加性“drug-with-itself”标准相比的协同作用的标准等效线分析。对于明确的等效线水平,在ICeffect归一化的线性浓度范围上为组合的两种物质展示观察的等效线(例如,图3中的曲线)与理论剂量累加线(例如,图3中的直线)。剂量累加参考通常是连接两个ICeffect浓度的线。通过插入拟合sigmoidal剂量应答曲线发现了ICeffect交叉点。功效转移评定为组合指数(Chou,Talalay(1984).Quantitativeanalysisofdose-effectrelationships:thecombinedeffectsofmultipledrugsorenzymeinhibitors.AdvEnzymeRegul22:27-55)CI。对于所选等效水平Icut,CII=(CX/ECX)I+(CY/ECY)I,其中特定数据点的(CX/ECX)I是X化合物测定浓度与其在所选抑制水平上的有效浓度的比值。可以认为CI是对相对于达到所选效果水平需要的单一试剂剂量的组合所需多少药物的粗略估计,并且0.1的值表示组合仅需要十分之一等量的单一试剂来达到相同的效果水平。0.5-0.7范围内的CI值通常用于当前临床组合的体外测定(Greco等)。1.0的CI值表示抗体组合的累加效果,而小于0.5的CI值表示因抗体组合引起的协同效果。在ChaliceAnalyzer中,从每一个Icut交叉浓度计算的许多组合指数值报告最佳CI。在所有测定的CI值中,具有最大信噪比水平的一个值报道为最大组合指数。来自溶血测定的数据表示为%抑制并装载到8x8Excel表,其中抗体浓度表示为uM值。Excel模板上传到Chalice软件(Lehar等2009)中并且通过使用IC20为每一种抗体产生等效图曲线产生组合指数(CI=CX/ICX+CY/ICY,其中ICX和ICy分别是抗P因子抗体和抗C5抗体单独的浓度,其产生20%的抑制效果,CX和Cy是混合物中每一种药物的浓度,其产生20%抑制)。20%抑制的组合指数是0.36,表明抗P因子抗体和抗C5抗体之间的协同性(图3)。巨噬细胞(Marcophage)浸润使用眼科炎症的聚IC鼠类模型在体内评估抗fP和抗C5Fabs各自或组合的效果。利用0.1mlPBS中的合成dsRNA类似物,聚I:C与抗fP(来自表1的抗体NVS962)和抗C5抗体(来自表2的抗体8019)各自或组合地经i.v.全身注射到C57BL/6小鼠中。在指定时间点上对小鼠处以安乐死。收集眼睛和视网膜并制备蛋白质提取物,使用多路测定(Pierce)进行细胞因子和趋化因子分析。为了测定视网膜白细胞浸润,将眼睛固定在4%的多聚甲醛中并用AlexaFluor-488缀合的F4/80抗体为巨噬细胞染色。视网膜扁平封固,其中视网膜脉管系统定位在载玻片上方并且覆盖着一滴Vectashield封固介质(VectorLaboratoriesInc,Burtingame,CA)。使用Axio.ImageM1显微镜(Zeiss)上的AxiocamMR3照相机捕获每一个视网膜上5个(500um)区域的荧光图像。利用Axiovision软件(Version4.5Zeiss)定量嗜中性粒细胞和巨噬细胞的数量。使用光学相干层析成像(OCT),从聚I:C处理的小鼠获得并分析视网膜的图像。这些结果(图4)证明,在所测试的最高浓度(20ug),观察到不高于45%的巨噬细胞抑制的抑制。相反,低至2ug浓度的抗P因子和抗C5抗体的组合证明79%的抑制并且增加浓度实现100%抑制(分别与对抗C5和抗P因子抗体各自仅13%和32%的抑制相比)。来自前述段落中描述的体内聚-IC模型(巨噬细胞浸润)的数据表示为%抑制并装载到4x4Excel表,其中抗体剂量表示为ug值。Excel模板上传到Chalice软件(上文所述)中并且通过使用IC50为每一种抗体产生等效图曲线产生组合指数(CI=CX/ICX+CY/ICY,其中ICX和ICy分别是抗P因子抗体和抗C5抗体单独的浓度,其产生50%的抑制效果,CX和Cy是混合物中每一种药物的浓度,其产生50%抑制)。50%抑制的组合指数是0.42(参见图5),表明抗P因子抗体和抗C5抗体之间的协同性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1