一种功能化取代的二氰基乙烯类化合物的合成方法与流程
本发明涉及一种化合物的合成方法,具体涉及一种功能化取代的二氰基乙烯类化合物的合成方法,属于化学技术领域。
背景技术:
功能化取代的二氰基乙烯类化合物是合成有机光电材料的一类有价值的重要前体,如红光或近红光材料、酞菁、四氮杂卟啉等都可通过二氰基乙烯类化合物作为原料获得。同时,二氰基二苯乙烯在生物医学领域也具有令人关注的应用前景。
二氰基乙烯类化合物的合成通常采用以下几种合成方法:
(1)苯乙腈在含br2或i2的醇盐或氢氧化物水溶液的条件下发生氧化偶联反应:
该合成方法对反应条件和底物的化学结构都具有极高的敏感度,其产率不固定,在20%到80%之间变化,同时卤素的使用限制了此方法在工业上大规模生产的需求。该合成方法所用原料苯乙腈是一种高毒类化学品,对环境有害。
(2)通过温度、碱的浓度和卤素成分的精细控制来优化上面的合成方法:
该合成方法虽然提高了产率,但在很大程度上增加了反应操作的难度,同时仍然不能解决卤素的使用问题,限制了此方法在工业上大规模生产的需求。
(3)采用电催化法合成:
该方法引入了电极的使用,电流效率在40%~70%,仍然不高。该合成方法所用原料苯乙腈是一种高毒类化学品,对环境有危害。
(4)苯乙腈在1-苄基-4-氮杂-1-氮阳离子杂二环[2.2.2]辛烷三溴化物中发生氧化偶联反应:
此方法引入了需合成的原料有机溴化铵,增加了反应步骤和成本,并且对底物敏感,产率不稳定。该合成方法所用原料苯乙腈是一种高毒类化学品,对环境有危害。
(5)二烷基取代的二氰基乙烯的合成:
该方法需要氰化物这类剧毒类原料,对环境有危害。
可见,目前合成二氰基乙烯类化合物时,操作相对复杂,并且通常会使用苯乙腈/氰化物剧毒品,对环境有危害。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种对环境友好、操作更简单的功能化取代的二氰基乙烯类化合物的合成方法。
为了实现上述目标,本发明采用如下的技术方案:
一种功能化取代的二氰基乙烯类化合物的合成方法,其特征在于,以2,5-二硝基噻吩和三苯基膦/亚磷酸三乙酯为原料,在有机溶剂中加热反应,反应温度为90℃~180℃,反应式如下:
式中,r为芳香环类取代基或烷烃类取代基。
前述的合成方法,其特征在于,前述r为芳香环类取代基,前述2,5-二硝基噻吩的合成方法为:以3,4-二溴噻吩为原料,经过硝化反应和suzuki反应得到2,5-二硝基噻吩。
前述的合成方法,其特征在于,前述芳香环类取代基为ph、4-me-c6h4、4-meo-c6h4、4-cl-c6h4、4-cn-c6h4、4-(c6h5)2n-c6h4、4-ch3co-c6h4、4-c6h5-c6h4、萘或蒽。
前述的合成方法,其特征在于,前述r为烷烃类取代基,前述2,5-二硝基噻吩的合成方法为:以3,4-二溴噻吩为原料,经过kumada反应和suzuki反应得到2,5-二硝基噻吩。
前述的合成方法,其特征在于,前述2,5-二硝基噻吩和三苯基膦/亚磷酸三乙酯的投料比为1mol:4mol~8mol。
前述的合成方法,其特征在于,前述有机溶剂为邻二氯苯、氯苯或dmf。
本发明的有益之处在于:
(1)操作简单,底物适用范围广,对环境友好;
(2)对合成芳香环取代的二氰基乙烯类化合物和烷基取代的二氰基乙烯类化合物具有普适性。
附图说明
图1是产物2a的1hnmr图;
图2是产物2a的13cnmr图;
图3是产物2b的1hnmr图;
图4是产物2b的13cnmr图;
图5是产物2c的1hnmr图;
图6是产物2c的13cnmr图;
图7是产物2d的1hnmr图;
图8是产物2d的13cnmr图;
图9是产物2e的1hnmr图;
图10是产物2e的13cnmr图;
图11是产物2f的1hnmr图;
图12是产物2f的13cnmr图;
图13是产物2h的1hnmr图;
图14是产物2h的13cnmr图;
图15是产物3a的1hnmr图;
图16是产物3a的13cnmr图;
图17是产物3b的1hnmr图;
图18是产物3b的13cnmr图;
图19是产物3c的1hnmr图;
图20是产物3c的13cnmr图;
图21是产物3d的1hnmr图;
图22是产物3d的13cnmr图;
图23是产物3e的1hnmr图;
图24是产物3e的13cnmr图;
图25是产物3f的1hnmr图;
图26是产物3f的13cnmr图;
图27是产物3h的1hnmr图;
图28是产物3h的13cnmr图;
图29是产物3i的1hnmr图;
图30是产物3i的13cnmr图。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
本发明的功能化取代的二氰基乙烯类化合物的合成方法为:
以2,5-二硝基噻吩和三苯基膦/亚磷酸三乙酯为原料,二者的投料比为1mol:4mol~8mol,在有机溶剂(例如:邻二氯苯)中加热反应,反应温度为90℃~180℃。
反应式如下:
式中,r为芳香环类取代基或烷烃类取代基。
第一部分:r为芳香环类取代基
r为苯、含有不同取代基(烷基、烷氧基、卤素、氰基、氨基、羰基、苯环)的苯环、萘、蒽等芳香环的一种,例如:ph、4-me-c6h4、4-meo-c6h4、4-cl-c6h4、4-cn-c6h4、4-(c6h5)2n-c6h4、4-ch3co-c6h4、4-c6h5-c6h4。
此时,2,5-二硝基噻吩的合成方法为:以3,4-二溴噻吩为原料,经过硝化反应和suzuki反应得到2,5-二硝基噻吩。
实施例1:3,4-dibromo-2,5-dinitrothiophene的合成
3,4-二溴噻吩5g与10ml混合酸(浓h2so4和浓hno3体积比1:1)在5ml氯仿中反应,反应温度50℃,反应时间4h,得到产物6.9g,除去混合酸,用二氯甲烷和石油醚(体积比1:4)重结晶,产率90%。13cnmr(100mhz,cdcl3)δ147.68,117.51。
实施例2:2,5-dinitro-3,4-diphenylthiophene的合成
称量实施例1所制得的化合物3,4-二溴-2,5-二硝基噻吩0.5g(1.52mmol)、苯硼酸0.75g(6.1mmol)、kf0.4g(6.8mmol)和四三苯基膦钯240mg于反应瓶中,加入甲苯24ml、水10ml以及乙醇5ml,抽换气使反应体系为无氧环境。将温度调至110℃,反应24h。反应完成后,用乙酸乙酯萃取,硫酸镁干燥,石油醚和二氯甲烷(体积比4:1)做淋洗剂过柱子。经称量,得到产物2a0.36g,产率72%。
产物2a的1hnmr如图1所示。1hnmr(400mhz,dmso)δ7.32–7.23(m,2h),7.20–7.13(m,1h)。
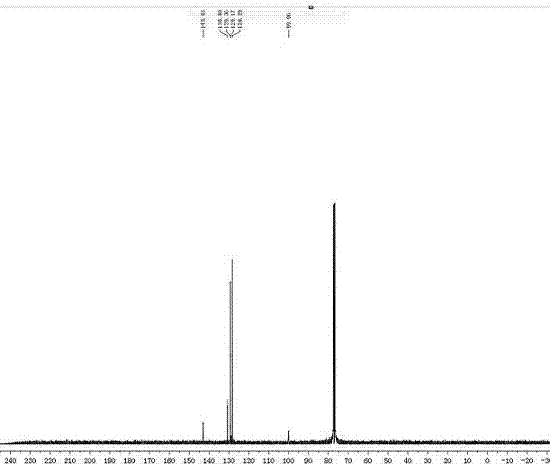
产物2a的13cnmr如图2所示。13cnmr(100mhz,cdcl3)δ147.47,143.07,130.81,129.33,129.17,128.34。
实施例3:2,5-dinitro-3,4-di-p-tolylthiophene的合成
称量实施例1所制得的化合物3,4-二溴-2,5-二硝基噻吩0.5g(1.52mmol)、对甲苯基硼酸0.83g(6.1mmol)、kf0.4g(6.8mmol)和四三苯基膦钯240mg于反应瓶中,加入甲苯24ml、水10ml以及乙醇5ml,抽换气使反应体系为无氧环境。将温度调至110℃,反应24h。反应完成后,用乙酸乙酯萃取,硫酸镁干燥,石油醚和二氯甲烷(体积比4:1)做淋洗剂过柱子。经称量,得到产物2b0.38g,产率70%。
产物2b的1hnmr如图3所示。1hnmr(400mhz,cdcl3)δ7.06(d,j=7.9hz,2h),6.89(d,j=8.0hz,2h),2.31(s,3h)。
产物2b的13cnmr如图4所示。13cnmr(100mhz,cdcl3)δ147.56,143.37,139.19,129.32,129.10,127.93,21.40。
实施例4:3,4-bis(4-chlorophenyl)-2,5-dinitrothiophene的合成
称量实施例1所制得的化合物3,4-二溴-2,5-二硝基噻吩0.5g(1.52mmol)、kf0.4g(6.8mmol)和四三苯基膦钯240mg于反应瓶中,加入甲苯24ml、水10ml以及乙醇5ml,抽换气使反应体系为无氧环境。将温度调至110℃,将对氯苯基硼酸0.95g(6.1mmol)溶于四氢呋喃溶液中,然后滴加到反应体系中,5h滴加完成,反应30h。反应完成后,用乙酸乙酯萃取,硫酸镁干燥,石油醚和二氯甲烷(体积比4:1)做淋洗剂过柱子。经称量,得到产物2c0.44g,产率73%。
产物2c的1hnmr如图5所示。1hnmr(400mhz,cdcl3)δ7.27(d,j=8.8hz,2h),6.95(d,j=8.8hz,2h)。
产物2c的13cnmr如图6所示。13cnmr(100mhz,cdcl3)δ160.73,141.62,135.88,130.74,128.77。
实施例5:3,4-bis(4-methoxyphenyl)-2,5-dinitrothiophene的合成
称量实施例1所制得的化合物3,4-二溴-2,5-二硝基噻吩0.5g(1.52mmol)、对甲氧基苯基硼酸0.93g(6.1mmol)、kf0.4g(6.8mmol)和四三苯基膦钯240mg于反应瓶中,加入甲苯24ml、水10ml以及乙醇5ml,抽换气使反应体系为无氧环境。将温度调至110℃,反应20h。反应完成后,用乙酸乙酯萃取,硫酸镁干燥,石油醚和二氯甲烷(体积比4:1)做淋洗剂过柱子。经称量,得到产物2d0.44g,产率76%。
产物2d的1hnmr如图7所示。1hnmr(400mhz,cdcl3)δ6.93(d,j=11.9hz,1h),6.76(d,j=11.9hz,1h),3.77(s,3h)。
产物2d的13cnmr如图8所示。13cnmr(100mhz,cdcl3)δ160.13,131.09,113.83,55.32。
实施例6:4,4'-(2,5-dinitrothiophene-3,4-diyl)bis(n,n-diphenylaniline)的合成
称量实施例1所制得的化合物3,4-二溴-2,5-二硝基噻吩0.5g(1.52mmol)、(4-(二苯基氨基)苯基)硼酸1.76g(6.1mmol)、kf0.4g(6.8mmol)和四三苯基膦钯240mg于反应瓶中,加入甲苯24ml、水10ml以及乙醇5ml,抽换气使反应体系为无氧环境。将温度调至110℃,反应24h。反应完成后,用乙酸乙酯萃取,硫酸镁干燥,石油醚和二氯甲烷(体积比4:1)做淋洗剂过柱子。经称量,得到产物2e0.75g,产率75%。
产物2e的1hnmr如图9所示。1hnmr9(400mhz,cdcl3)δ7.34–7.20(m,2h),7.07(ddd,j=8.6,5.6,1.2hz,3h)6.97–6.88(m,1h),6.88–6.79(m,1h)。
产物2e的13cnmr如图10所示。13cnmr(100mhz,cdcl3)δ148.45,147.37,143.32,130.75,129.36,125.29,123.62,121.35。
实施例7:4,4'-(2,5-dinitrothiophene-3,4-diyl)dibenzonitrile的合成
称量实施例1所制得的化合物3,4-二溴-2,5-二硝基噻吩0.5g(1.52mmol)、对氰基苯基硼酸1g(6.1mmol)、kf0.4g(6.8mmol)和四三苯基膦钯240mg于反应瓶中,加入甲苯24ml、水10ml以及乙醇5ml,抽换气使反应体系为无氧环境。将温度调至100℃,反应36h。反应完成后,用乙酸乙酯萃取,硫酸镁干燥,石油醚和乙酸乙酯(体积比3:1)做淋洗剂过柱子。经称量,得到产物2f0.2g,产率35%。
产物2f的1hnmr如图11所示。1hnmr(400mhz,cdcl3)δ7.59(d,j=8.8hz,2h),7.16(d,j=9.7hz,2h)。
产物2f的13cnmr如图12所示。13cnmr(100mhz,cdcl3)δ148.17,139.94,134.80,132.52,130.15,117.59,113.92。
实施例8:3,4-di(naphthalen-2-yl)-2,5-dinitrothiophene的合成
称量实施例1所制得的化合物3,4-二溴-2,5-二硝基噻吩0.5g(1.52mmol)、萘基硼酸1.1g(6.1mmol)、kf0.4g(6.8mmol)和四三苯基膦钯240mg于反应瓶中,加入甲苯24ml、水10ml以及乙醇5ml,抽换气使反应体系为无氧环境。将温度调至110℃,反应24h。反应完成后,用乙酸乙酯萃取,硫酸镁干燥,石油醚和二氯甲烷(体积比4:1)做淋洗剂过柱子。经称量,得到产物2h0.36g,产率55%。
产物2h的1hnmr如图13所示。1hnmr(400mhz,cdcl3)δ7.67(d,j=9.2hz,6h),7.58(d,j=2.3hz,2h),7.48–7.35(m,4h),7.14(d,j=1.9hz,1h),7.12(d,j=2.0hz,1h)。
产物2h的13cnmr如图14所示。13cnmr(100mhz,cdcl3)δ148.05,143.10,133.03,132.64,129.34,128.30,128.23,128.13,127.79,127.27,126.67,126.18。
实施例9:2,3-diphenylfumaronitrile的合成
称量产物2a200mg(0.61mmol)、三苯基膦890mg(3.4mmol),抽换气三次,加入高沸点溶剂邻二氯苯3ml,升温至155℃,反应4h。经称量,得到产物3a50mg,产率35%。
产物3a的1hnmr如图15所示。1h-nmr(400mhz,cdcl3)δ7.81-7.86(d,2h),7.51-7.57(m,3h)。
产物3a的13cnmr如图16所示。13c-nmr(100mhz,cdcl3)δ132.05,131.81,129.39,128.79,125.68,116.78。
实施例10:2,3-di-p-tolylfumaronitrile的合成
称量产物2b200mg(0.56mmol)、三苯基膦821mg(3.1mmol),抽换气三次,加入高沸点溶剂邻二氯苯3ml,升温至156℃,反应4h。经称量,得到产物3b50mg,产率34%。
产物3b的1hnmr如图17所示。1hnmr(400mhz,cdcl3)δ7.72(d,j=8.7hz,2h),7.32(d,j=8.8hz,2h),2.43(s,3h)。
产物3b的13cnmr如图18所示。13cnmr(100mhz,cdcl3)δ142.52,129.95,129.46,128.76,124.62,117.12,21.68。
实施例11:2,3-bis(4-chlorophenyl)fumaronitrile的合成
称量产物2c200mg(0.50mmol)、三苯基膦743mg(2.8mmol),抽换气三次,加入高沸点溶剂邻二氯苯3ml,升温至150℃,反应4h。经称量,得到产物3c50mg,产率33%。
产物3c的1hnmr如图19所示。1hnmr(400mhz,cdcl3)δ7.76(d,j=11.4hz,2h),7.51(d,j=15.3hz,2h)。
产物3c的13cnmr如图20所示。13cnmr(100mhz,cdcl3)δ138.44,130.17,130.11,129.81,124.62,116.29。
实施例12:2,3-bis(4-methoxyphenyl)fumaronitrile的合成
称量产物2d200mg(0.52mmol)、三苯基膦760mg(2.9mmol),抽换气三次,加入高沸点溶剂氯苯3ml,升温至152℃,反应4h。经称量,得到产物3d50mg,产率33%。
产物3d的1hnmr如图21所示。1hnmr(400mhz,cdcl3)δ7.78(d,j=12.0hz,2h),7.01(d,j=12.0hz,2h),3.87(s,3h)。
产物3d的13cnmr如图22所示。13cnmr(100mhz,cdcl3)δ161.91,130.74,124.50,122.73,117.57,114.51,55.35。
实施例13:2,3-bis(4-(diphenylamino)phenyl)fumaronitrile的合成
称量产物2e200mg(0.3mmol)、三苯基膦445mg(1.69mmol),抽换气三次,加入高沸点溶剂氯苯3ml,升温至158℃,反应4h。经称量,得到产物3e57mg,产率35%。
产物3e的1hnmr如图23所示。1hnmr(400mhz,cdcl3)δ7.66(d,j=8.9hz,1h),7.32(dd,j=8.3,7.4hz,2h),7.21–7.10(m,3h),7.04(d,j=8.9hz,1h)。
产物3e的13cnmr如图24所示。13cnmr(100mhz,cdcl3)δ150.47,146.34,130.10,129.68,125.98,124.87,124.58,121.06,120.06,117.99。
实施例14:2,3-bis(4-cyanophenyl)fumaronitrile的合成
称量产物2f200mg(0.53mmol)、三苯基膦890mg(2.9mmol),抽换气三次,加入高沸点溶剂dmf3ml,升温至160℃,反应4h。经称量,得到产物3f38mg,产率27%。
产物3f的1hnmr如图25所示。1hnmr(400mhz,cdcl3)δ7.97(d,j=6.9hz,1h),7.87(d,j=5.1hz,1h)。
产物3f的13cnmr如图26所示。13cnmr(100mhz,dmsod6)δ136.45,133.64,130.27,126.51,118.24,114.82,114.77。
实施例15:2,3-di(naphthalen-2-yl)fumaronitrile的合成
称量产物2h200mg(0.47mmol)、三苯基膦688mg(2.6mmol),抽换气三次,加入高沸点溶剂dmf3ml,升温至159℃,反应4h。经称量,得到产物3h52mg,产率34%。
产物3h的1hnmr如图27所示。1hnmr(400mhz,cdcl3)δ8.39(s,1h),8.16–7.77(m,4h),7.61(tt,j=8.2,3.4hz,2h)。
产物3h的13cnmr如图28所示。13cnmr(100mhz,dmsod6)δ134.50,132.84,129.94,129.56,129.36,129.07,128.62,127.98,127.50,125.51,124.59。
第二部分:r为烷烃类取代基
r为烷烃类取代基,例如:己基。
此时,2,5-二硝基噻吩的合成方法为:以3,4-二溴噻吩为原料,经过kumada反应和suzuki反应得到2,5-二硝基噻吩。
实施例16:3,4-dihexylthiophene的合成
称量3,4-二溴噻吩0.9ml(8.06mmol)和nicl2(dppp)催化剂(5%)224mg(0.41mmol)于双口瓶中,抽换气三次,然后加入3ml乙醚溶剂,在冰浴条件下将己基溴化镁10ml(20mmol)滴加到上述反应瓶中,反应12h,随后用hcl(1n)淬灭,有机层用二氯甲烷萃取,用无水mgso4干燥,除去溶剂后,用石油醚做淋洗剂过柱子,获得纯的产物。经计算,产物3,4-二己基噻吩的产率为93%。
实施例17:3,4-dihexyl-2,5-dinitrothiophene的合成
2g实施例16所制得的化合物3,4-dihexylthiophene与6ml混合酸(浓h2so4和浓hno3体积比1:1)在5ml氯仿中反应,反应温度50℃,反应时间4h,除去混合酸,用二氯甲烷和石油醚(体积比1:4)过柱子。经计算,3,4-二己基-2,5-二硝基噻吩的产率为62%。
实施例18:2,3-dihexylfumaronitrile的合成
称量实施例17所制得的3,4-二己基-2,5-二硝基噻吩500mg(1.45mmol)、三苯基膦2.2g(8.12mmol),抽换气三次,加入高沸点溶剂邻二氯苯3ml,升温至160℃,反应4h。经称量,得到产物3i250mg,产率70%。
产物3i的1hnmr如图29所示。1hnmr(400mhz,cdcl3)δ2.46–2.13(t,2h),1.93–1.48(m,2h),1.30(m,j=6.5,3.8hz,6h),0.88(m,3h)。
产物3i的13cnmr如图30所示。13cnmr(101mhz,dmsod6)δ129.06,116.49,31.41,30.53,29.12,27.64,22.30,13.99。
由此可见,本发明的合成方法操作简单,底物适用范围广,对环境友好,此外,对合成芳香环取代的二氰基乙烯类化合物和烷基取代的二氰基乙烯类化合物具有普适性。
需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!