一种M2巨噬细胞诱导剂的制作方法
本发明属于生物医药领域,尤其涉及一种m2巨噬细胞的诱导剂及其制备方法,和用于肥胖症病药物的应用。
背景技术:
肥胖发生是由于异常或过度的脂肪蓄积。大量证据表明,肥胖和诸多疾病的病理生理相关,如胰岛素抵抗,糖尿病,心血管疾病和癌症等。世界卫生组织最近报道,2014年,18岁及以上的成年人中肥胖超过了6亿,肥胖率为13%。全球肥胖率在1980年和2014年之间翻了一倍以上。因此,肥胖的问题受到越来越多的重视。
肥胖伴随着脂肪组织中的慢性低度炎症(hotamisligil,g.s.,2006.inflammationandmetabolicdisorders.nature444,860e867.;ferrante,a.w.,etal.,2007.obesity-inducedinflammation:ametabolicdialogueinthelanguageofinflammation.j.intern.med.262,408e414.;stienstra,r.,etal.,2012.theinflammasomeputsobesityinthedangerzone.cell.metab.15,10e18.)。越来越多的研究表明,改善炎症可以改善胰岛素敏感性,减少肥胖小鼠的脂肪细胞大小和改善脂质代谢。例如,通过给予il-1受体或il-1b的拮抗剂,高脂饮食小鼠胰岛素敏感性增强(larsen,c.m.,etal.,2007.interleukin-1-receptorantagonistintype2diabetesmellitus.n.engl.j.med.356,1517e1526.;ridker,p.m.,etal.,2012.effectsofinterleukin-1betainhibitionwithcanakinumabonhemoglobina1c,lipids,c-reactiveprotein,interleukin-6,andfibrinogen:aphaseiibrandomized,placebo-controlledtrial.circulation126,2739e2748.)。此外,当ccr2-/-小鼠不能把炎症单核细胞从血液补充入组织时,显示比高脂饮食小鼠更少的肥胖相关代谢的易感性(weisberg,s.p.,etal.,2006.ccr2modulatesinflammatoryandmetaboliceffectsofhigh-fatfeeding.j.clin.invest116,115e124.)。因此,寻求减轻肥胖相关炎症的方法为解决肥胖和肥胖相关胰岛素抵抗带来了希望。
巨噬细胞是影响炎症和肥胖相关胰岛素抵抗的关键因素,它们可以分为促炎性巨噬细胞m1和抗炎型巨噬细胞m2。肥胖状态下,促炎巨噬细胞m1大量增殖,加剧脂肪组织和其他器官的胰岛素抵抗。虽然,脂肪组织中的抗炎巨噬细胞m2可抑制炎症,但在肥胖症中,它们相对于巨噬细胞m1的比例低得多。总的来说,在肥胖症中,巨噬细胞m1代替巨噬细胞m2并控制炎症和巨噬细胞的体内平衡,稳定在更高的促炎症“设定点”。这些数据表明纠正脂肪组织的炎症/免疫稳态是必要的。输注m2巨噬细胞可以调节体内巨噬细胞稳态,从而达到改善肥胖的目的。
间充质干细胞(msc)是最重要的多能成体干细胞之一,具有自我更新和自我分化潜能,以及分泌多种因子参与损伤的组织与器官的修复与再生而被广泛应用于多种疾病的治疗。mscs在体内或体外特定的诱导条件下,可分化为胰岛、神经、血管内皮、骨、软骨、肌肉、肝脏、心肌等多种组织细胞。越来越多的研究证实间充质干细胞(mscs)通过分泌的细胞因子可发挥免疫调节与降低炎症的作用。研究发现,间充质干细胞可以通过促进m2巨噬细胞极化来缓解炎症反应并改善胰岛素抵抗,(xiez,haoh,tongc,etal.humanumbilicalcord‐derivedmesenchymalstemcellselicitmacrophagesintoananti‐inflammatoryphenotypetoalleviateinsulinresistanceintype2diabeticrats[j].2016,34(3):627-639.)。mscs效能的治疗机制主要取决于它们的旁分泌活性,msc能分泌大量的生长因子,目前的研究认为,这些生物活性物质使间充质干细胞具有免疫调节、降低炎症的功能,所有的msc分泌物中的生物活性因子和细胞因子可以在条件培养基中收集,累积的证据表明msc条件培养基具有与msc相似的治疗效果。
已有研究证明,干细胞接种到ccss(collagen/chitosanspongescaffolds)胶原-壳聚糖海绵支架后,干细胞的活性增强,修复效应也随之增强(tongc,haoh,xial,etal.hypoxiapretreatmentofbonemarrow-derivedmesenchymalstemcellsseededinacollagen-chitosanspongescaffoldpromotesskinwoundhealingindiabeticratswithhindlimbischemia.[j].woundrepair®eneration,2015,24(1):45.)。
基于上述研究,本发明用ccss对msc进行培养,得到激活的间充质干细胞条件培养基,用来促进巨噬细胞向m2的极化,用来改善肥胖和相关胰岛素抵抗。
技术实现要素:
本发明提供了一种m2巨噬细胞的诱导剂及其制备方法,所述巨噬细胞的诱导剂能够有效促进巨噬细胞向m2的极化,用来改善肥胖和相关胰岛素抵抗。
为实现上述发明目的,本发明采用下述技术方案予以实现:
一种m2巨噬细胞的诱导剂,其特征为,是一种胶原/壳聚糖海绵支架诱导的间充质干细胞条件培养基。所述胶原/壳聚糖海绵支架为胶原与壳聚糖混合物冷冻冻干后,于n-(3-二甲基氨基丙基)-n'-乙基碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)溶液中摇动获得的。所述的间充质干细胞选自脐带间充质干细胞、脂肪间充质干细胞、骨髓间充质干细胞或其组合。
进一步的,所述胶原/壳聚糖海绵支架为将胶原和壳聚糖以1:1的比例混合,随后在-80℃下冷冻2小时,然后冻干24小时;干燥后,将混合物浸入含有n-(3-二甲基氨基丙基)-n'-乙基碳二亚胺(edc)和8mmn-羟基琥珀酰亚胺(nhs)中,同时在室温下缓慢摇动12小时获得。
一种m2巨噬细胞的诱导剂的制备方法,其步骤包括:a)将间充质干细胞接种在胶原/壳聚糖海绵支架上;b)采用无血清培养基培养所述间充质干细胞-胶原/壳聚糖海绵支架;c)收集所述间充质干细胞和培养基;d)加入新鲜无血清培养基,并继续培养所述间充质干细胞;和e)收集所述间充质干细胞的条件培养基。
进一步的,所述步骤a)中将间充质干细胞接种在胶原/壳聚糖海绵支架上的步骤包括:将所述间充质干细胞单细胞悬浮液滴到胶原/壳聚糖海绵支架顶部表面孵育培养;然后将等量间充质干细胞接种在所述间充质干细胞-胶原/壳聚糖海绵支架构建体上孵育培养。
所述步骤c)收集所述间充质干细胞和培养基的步骤包括:移去培养基,采用胰蛋白酶-etda消化所述间充质干细胞,使其收缩脱离胶原/壳聚糖海绵支架;加入所述移去的培养基,中和胰蛋白酶-edta;并轻轻吹打所述间充质干细胞。
所述步骤d)中将所述间充质干细胞在无血清培养基中继续培养12±1小时。
所述步骤e)中离心收集所述间充质干细胞及培养基,以移除细胞碎片;然后用一个7-kda分子量截止袋收集所述条件培养基。
本发明提供的一种m2巨噬细胞的诱导剂在治疗肥胖症中的应用。
本发明的有益效果:
本发明通过ccss培养msc获得条件培养基,作为诱导剂,诱导巨噬细胞极化,明显增强了巨噬细胞的极化效率和改善肥胖和胰岛素抵抗的效果。本发明制备的激活的间充质干细胞条件培养基,经过简单的预处理,本制备体系易于质量控制,易于产业化,制备的条件培养基可以制成冻干粉,易于保存。
附图说明:
图1:bca蛋白质检测试剂盒评估纯化的msc-cm中总蛋白质浓度。
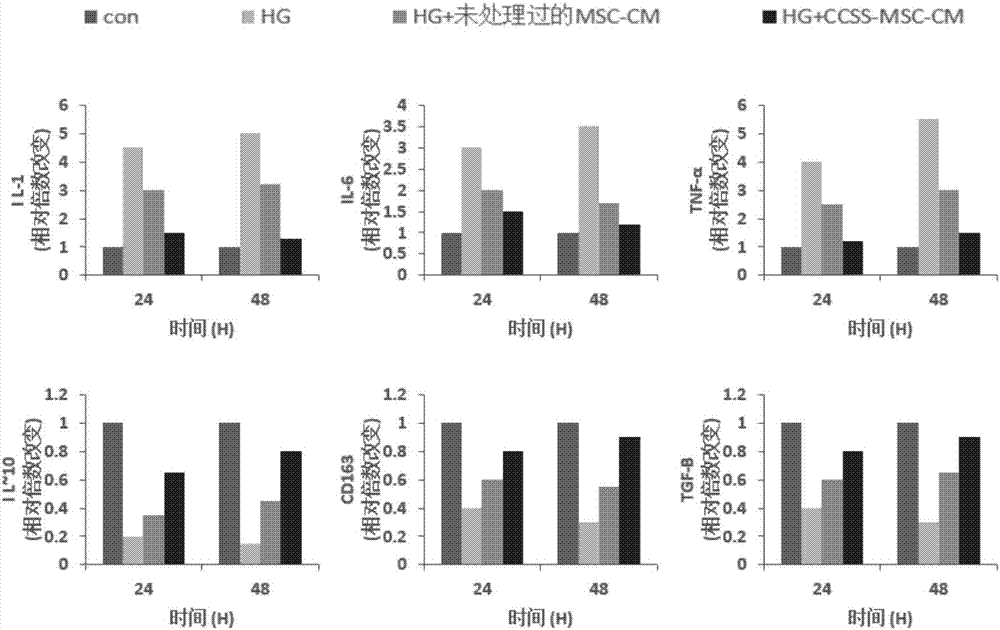
图2:rt-pcr检测的小鼠骨髓巨噬细胞与不同msc共同培养后24h和48h后上清液中促炎细胞因子(il-1、il-6、tnf-α),抗炎细胞因子(il-10、tgf-β)和cd163的相对表达量。con表示对照,hg表示高糖,hg+ccss-msc-cm表示高糖+胶原壳聚糖支架培养的msc的条件培养基。
图3:第二次输注巨噬细胞后的小鼠食物摄取量、腹股沟脂肪组织(inat)重量和附睾脂肪组织(eat)重量。a:小鼠食物摄取量;b:inat重量;c:eat重量。m0为没有经过任何处理的骨髓巨噬细胞,un-m2为未处理过的msc-cm诱导的m2巨噬细胞;ccss-m2为ccss培养的msc-cm诱导的m2巨噬细胞。
图4:通过苏木精-伊红(he)染色检测m0治疗组、un-m2治疗组和ccss-m2巨噬细胞治疗组组小鼠inat和eat脂肪细胞体积变化对比图。
图5:a:westernblot检测的eat中的p-akt的量;b:小鼠的腹腔糖耐受量(ipgtt)试验结果。
图6:不同组小鼠脂肪代谢情况。a:血液的甘油三酯水平;b:低密度脂蛋白水平;c:血液中高密度脂蛋白/低密度脂蛋白比。
具体实施方式
下面以具体实施方式对发明作进一步详细说明
本发明参照特定的实施例进行了描述,但是,很显然仍可以做出各种修改和变换而不违背本发明的精神和范围。因此,本发明的说明书和附图应该认为是说明性的而非限制性的。
实施例1.间充质干细胞的制备
一、脐带间充质干细胞的制备
在超净工作台中进行操作,取新鲜足月健康胎儿脐带,用含2倍100u/ml青霉素和链霉素的生理盐水冲洗去除血渍,将华尔通氏胶剥离,剪成1立方毫米以下块状,均匀涂布,缓慢加入10ml无血清培养基,置37℃、体积分数为5%的二氧化碳、饱和湿度培养箱中培养。将原代细胞培养7天后,更换无血清培养液,培养至细胞达到70%的融合,移去无血清培养液,添加浓度分别为0.25%和0.1%的胰蛋白酶-乙二胺四乙酸钠(edta)消化1min,脐带msc收缩脱离瓶壁,此时加入先前移去的培养上清液,中和胰蛋白酶-edta溶液,并使用移液管轻轻吹打,将脐带msc悬液移入50ml离心管中。1000rpm离心8min,去除上清液;重新加入无血清完全培养基将msc重悬,并计数。按照1传1.5接种10cm培养皿。msc培养融合70%左右时参照上述方法传代培养。
选择第三代培养的msc,在对数生长期,且细胞融合程度不超过80%时按照传代的要求消化、中和、洗涤、收集细胞,采用细胞冻存液(90%胎牛血清和10%二甲亚砜(dmso))重悬msc,充分混匀,每管1ml分装于冻存管密封。将冻存管置于装有异丙醇的冻存盒中,于-80℃冰箱过夜,次日移入液氮罐保存。
msc复苏的步骤为:取出msc冻存管,立即浸入37℃温水中溶解;取适量无血清培养基混悬细胞并离心,弃去上清液;细胞重悬于无血清培养基中,并接种于培养皿中,于37℃、体积分数为5%的二氧化碳、饱和湿度培养箱中培养。
二、骨髓间充质干细胞的制备
采用常规方法于髂前上棘穿刺点,用骨穿针抽取50ml骨髓液,注入50ml的无菌离心管中;用等量含20u/ml肝素的pbs液稀释,并沿管壁加入等体积的比重为1.073g/ml的淋巴细胞分离液;2000rmp离心30min,吸取单个核细胞层;无菌生理盐水离心洗涤2次,每次1000rpm离心5min,弃去上清液,取沉淀;将上述得到的骨髓msc,用无血清培养基混悬,计数细胞,按5×106个/ml接种于的培养瓶中,置37℃体积分数为5%的二氧化碳、饱和湿度的培养箱中培养。培养3天后,更换无血清培养液,弃去未贴壁细胞,以后每3天1次更换培养液;7~9天后,骨髓msc融合达50%~60%时,进行第一次传代。移去无血清培养液,采用浓度分别为0.25%和0.1%的胰蛋白酶-edta37℃消化1min,骨髓msc收缩脱离瓶壁,加入先前移去的培养上清液,中和胰蛋白酶-edta,并使用移液管轻轻吹打,将骨髓间充质细胞悬液移入50ml无菌离心管中。1000rpm离心8min,弃去上清液;重新加入无血清完全培养基重悬,计数,按照1传1-1.5接种10cm培养皿。骨髓msc培养融合70%左右时如上述方法传代培养。
三、脂肪间充质干细胞的制备
按照常规方法分离腹部白色脂肪组织,剔除可见微血管及肌肉组织,无菌pbs洗涤三遍,然后用无菌剪刀将脂肪组织剪碎至1立方毫米以下的糊状,添加无菌消化液(含有0.1%胶原酶ⅰ型和0.05%胰蛋白酶的无血清dme培养基),37℃水浴中匀速搅拌45-50min,至组织块消化干净;200目筛网过滤收集滤液,然后使用含有10%胎牛血清(fbs)的低糖dmem培养基等量中和,1500rpm离心10min,弃去上清液;以1×106个/ml的细胞密度,用无血清培养基重悬脂肪msc,并接种于培养瓶中,37℃、体积分数为5%二氧化碳、饱和湿度培养箱中培养,当脂肪msc生长至接近80%融合时,使用0.25%胰蛋白酶溶液消化msc细胞,以1:3的接种比例接种到新的培养瓶中进行传代培养。脂肪msc融合至不超过80%,1000rpm离心8min,弃去上清液,重新加入无血清完全培养基重悬msc,计数,按照1传1-1.5接种10cm培养皿。脂肪msc培养融合70%左右时如上述方法传代培养。
实施例2.胶原/壳聚糖海绵支架的制作
将胶原(5mg/ml)和壳聚糖(5mg/ml在0.5m乙酸中)以1:1的比例混合,并搅拌均匀,随后在-80℃下冷冻2小时,然后冻干24小时;干燥后,将混合物浸入含有n-(3-二甲基氨基丙基)-n'-乙基碳二亚胺(edc)和8mmn-羟基琥珀酰亚胺(nhs)中,同时在室温下缓慢摇动12小时。用双蒸水洗涤基质直到ph返回到生理范围(7.0-7.4),然后冻干以获得胶原-壳聚糖海绵支架(ccss)。ccss用co60灭菌。
实施例3.胶原/壳聚糖海绵支架msc条件培养基的制备
将msc接种到胶原/壳聚糖海绵支架上
将ccss用pbs浸泡并置于6孔板中,将100μl第三代msc培养液的单细胞悬浮液滴加到ccss的顶部表面,其中msc细胞数为1×106,并在37℃,5%co2中孵育4小时,以使细胞渗透到支架中并粘附。将等量的msc接种在细胞-ccss构建体中,并孵育4小时。待细胞粘附后,将2ml无血清培养基加入每个孔中,37℃下5%co2中培养48±2小时。将msc在空白孔中作为对照进行培养。
胶原/壳聚糖海绵支架msc条件培养基的制备
待msc在ccss上培养一定时间后,移去培养液,用pbs冲洗接种后的ccss三遍,用0.25%的胰蛋白酶etda消化1min,msc收缩脱离ccss,此时加入先前移去的上清液,中和胰蛋白酶edta,并使用移液管轻轻吹打。用离心管收集msc混悬液,用pbs充分洗涤2遍,用15ml无血清dmem培养基将msc重悬,移入t150培养瓶中,培养12±1小时。再将msc混悬液移入50ml离心管,3000rpm下离心10min,收集上清,用一个7-kda分子量截止袋过滤器在peg20000,4℃下透析,把培养基浓缩20倍,制成条件培养基,即ccss-msc-cm。
将ccss-msc-cm冻干制得干粉
将ccss-msc-cm在-80℃冻存凝固的上清液抽真空,升华干燥,除去冰晶制得冻干粉,-20℃保存。
ccss培养的mscs分泌的生长因子明显增多
生长因子是高效蛋白、酶组合,通过bca蛋白质检测试剂盒评估纯化的mcs-cm的蛋白质浓度,即可测得msc-cm中生长因子浓度的改变。从80mlccss培养的5×107msc上清液中分离约410μg蛋白。如图1所示,用ccss培养的msc-cm中的总蛋白量约为95μg/百万细胞,而msc-cm中总蛋白量约为55μg/百万细胞,ccss培养的msc-cm中水平总蛋白量显著高于未处理的msc-cm,证实ccss培养msc可以促进msc生长因子的分泌。
实施例4.胶原/壳聚糖海绵支架msc条件培养基的功能验证
(1)胶原/壳聚糖海绵支架msc-cm促进炎性的小鼠骨髓巨噬细胞向m2巨噬细胞的极化
骨髓巨噬细胞的制备和诱导
引颈处死小鼠,将小鼠后肢的皮毛剥置足部,连同褪下的皮毛剪去足部,剪下后腿,放入盛有无菌pbs的培养皿中。镊子夹住腿骨一端后,用剪刀剔除肌肉,在关节处剪断腿骨。用2ml注射器吸取无血清的1640培养基,将针头刺入骨髓腔,反复冲洗骨髓至骨髓变白,将骨髓冲洗液加入到50ml离心管中,1000rpm离心5min。将离心得到的骨髓细胞用10ml含巨噬细胞集落刺激因子(macrophagecolony-stimulatingfactor)mcsf(50ng/ml)和含血清的1640培养基重悬,然后分装到两个25cm2的细胞培养瓶中,置于37℃和5%co2气体浓度适度的培养箱中培养3天。弃上清,换5ml含mcsf(50ng/ml)和含血清的1640培养基继续培养4天。然后,在6孔板中,用30mm的葡萄糖溶液培养小鼠骨髓巨噬细胞,用佛波醇12-豆蔻酸酯13-乙酸酯(pma,160ng/ml)处理诱导分化。3天后,用pbs漂洗三次去除非粘附细胞。
msc-cm诱导骨髓巨噬细胞
用ccss-msc-cm(20μg/ml)和未处理的msc-cm(20μg/ml)处理上述诱导分化后的贴壁的小鼠骨髓巨噬细胞48小时,得到msc-cmc处理的骨髓巨噬细胞,本申请中分别命名为ccss-m2和un-m2。没有经过任何处理的骨髓巨噬细胞为命名为m0。在注射准备中,首先用刮刀从培养皿中取出巨噬细胞,并以1500rpm离心10分钟。然后,将细胞稀释至2.5×106/ml。
结果:
胶原/壳聚糖海绵支架msc-cm促进了炎性的小鼠骨髓巨噬细胞向m2巨噬细胞的极化
il-1,il-6和tnfα为巨噬细胞可分泌的促炎细胞因子,il-10,tgf-β为巨噬细胞可以产生的抗炎细胞因子,cd163为m2巨噬细胞表面的标志物。本试验采用rt-pcr对上述细胞因子的表达量进行了检测。如图2所示,葡萄糖和pma的处理增加了巨噬细胞中促炎细胞因子的表达,随着时间的延长,表达量进一步增加,而msc-cm的处理抑制了促炎因子的表达,并使促炎因子的表达维持在一定的水平;相对于未采用胶原/壳聚糖海绵支架处理msc-cm,ccss-msc-cm显著并显著抑制促炎细胞因子il-1,il-6和tnfα的表达。葡萄糖和pma的处理降低了巨噬细胞中抗炎细胞因子的表达,随着时间的延长,表达量进一步降低;ccss-msc-cm显著促进小鼠骨髓巨噬细胞的il-10和tgf-β表达,并显著促进m2巨噬细胞表面标志物cd163的表达,这些数据表明ccss-msc-cm促进了巨噬细胞向m2的极化。通过ccss培养的msc,能分泌更多的生长因子,提升了将巨噬细胞诱导成m2巨噬细胞的效率。
(2)胶原/壳聚糖海绵支架msc-cm诱导的骨髓巨噬细胞改善脂质代谢
肥胖小鼠的诱导和处理
将8周龄雄性c57bl/6n小鼠在22℃单独通风笼中12小时光照/黑暗循环下饲养。适应性喂养一周后,分成两组,一组为6只小鼠,标准食物饮食组(正常组),另一组24只小鼠,高脂肪食物饮食(hfd,60%脂肪)组,喂养hfd小鼠12周以符合肥胖模型。
将hfd组的小鼠再分成四组,每组6只小鼠:hfd和pbs输注组(肥胖组),hfd与m0巨噬细胞输注组(m0输注组,实验对照),hfd与ccss-msc-cm诱导的m2巨噬细胞输注组(ccss-m2输注组)和hfd与未处理的msc-cm诱导的m2巨噬细胞输注组(un-m2输注组)。然后,将0.2mlpbs中的5×105m0,ccss-msc-cm诱导的m2巨噬细胞或未处理的msc-cm诱导的m2巨噬细胞通过尾静脉输注到小鼠体内。一周后,进行相同组分的第二次注射,并且在处死前观察所有小鼠一周。整个过程中,所有小鼠保持他们以前的饮食,并记录第二次注射后整周的食物摄取。在处死前,向动物腹膜内注射1%戊巴比妥钠(60mg/kg)麻醉。取小鼠血液,用于测量甘油三酯(tg),高密度脂蛋白胆固醇(hdlc)和低密度脂蛋白胆固醇(ldlc)的脂质代谢分析;记录inat(inguinaladiposetissue,腹股沟脂肪组织)和eat(epididymaladiposetissue,附睾脂肪组织)的重量。脂肪组织在福尔马林中固定用于病理分析。
结果:
m2巨噬细胞的输注减少inat的重量
如图3a所示,巨噬细胞输注治疗之后,肥胖组小鼠的食物摄取量并没有明显改变。而相比于肥胖组的小鼠,巨噬细胞的输注的降低了肥胖小鼠的inat的重量和eat重量。与m0治疗组和un-m2治疗组相比,输注ccss-m2巨噬细胞的小鼠的inat的重量有显著下降(图3b),eat重量减少也较多(图3c)。
m2巨噬细胞的输注使小鼠脂肪细胞体积减小
肥胖导致小鼠的脂肪细胞变大,而巨噬细胞的输注使小鼠脂肪细胞体积减小。如图4所示,苏木精-伊红(he)染色发现,与m0治疗组和un-m2治疗组相比,ccss-m2巨噬细胞输注组小鼠的inat和eat(epididymaladiposetissue附睾脂肪组织)脂肪细胞体积有明显减小。
m2巨噬细胞的输注改善了胰岛素抵抗
p-akt是被广泛用来评估胰岛素敏感性的标记物。通过westernblot检测eat中p-akt,发现相比于m0治疗组和un-m2治疗组,在ccss-m2输注组中eat的p-akt显著增加(图5a)。此外,图5b腹腔糖耐量试验(ipgtt)的结果显示ccss-m2输注组中胰岛素抵抗有明显改善。这些结果表明,ccss-m2巨噬细胞输注改善了肥胖小鼠中的胰岛素抵抗,某种程度上可以刺激体重的减轻。
m2巨噬细胞的输注改善了脂质的代谢
通过对血液的脂质水平测量后发现,肥胖增加了小鼠中甘油三酯(tg)和血浆低密度脂蛋白(ldl-c)的浓度。与m0治疗组和un-m2治疗组相比,ccss-m2治疗组tg和ldl-c有显著降低,hdl-c(高密度脂蛋白)/ldl-c(低密度脂蛋白)显著增加。这些研究结果表明ccss-m2巨噬细胞输注可以改善脂质代谢。
通过ccss培养的msc,能分泌更多的生长因子,提升了将巨噬细胞诱导成m2巨噬细胞的效率。m2巨噬细胞是一种抗炎的免疫细胞,该细胞通过恢复eat的炎症/巨噬细胞稳态,进一步改善胰岛素抵抗和脂质代谢。经过ccss培养的msc-cm诱导的m2巨噬细胞,治疗效果更加显著,通过恢复巨噬细胞体内平衡来治疗肥胖和肥胖相关胰岛素抵抗,为肥胖患者带来了新的治疗希望。
- 还没有人留言评论。精彩留言会获得点赞!