一种菠菜SSR标记的制备方法及应用与流程
本发明涉及生物技术领域,具体涉及一种菠菜ssr标记的制备方法及应用。
背景技术:
菠菜(spinaciaoleraceal.)是重要的叶菜类经济作物之一,生长周期短,复种指数高,在我国南北方普遍种植。我国是最大的菠菜生产和消费国家,年产量1200多万吨,约占世界总产量的90%。菠菜即可生食(拌沙拉),也可熟食(炒、拌、做汤),还可加工出口。菠菜营养丰富,富含纤维素、维生素以及铁、钙等,其含有的胡萝卜素和多种维生素、氨基酸,对预防肺癌和子宫癌有益处。
菠菜起源于波斯地区(今伊朗及周边),于公元647年传入中国,已在世界上广泛栽培,包含2个野生种和1个栽培种,具有十分丰富的种质资源。目前菠菜种质资源的研究主要集中于对植物学性状的描述和品质性状测定上,虽然表型和品质性状的调查及测定快捷简便,可以对植物材料做出快速且较直观的比较和分类,但易受环境因素和植物生长发育时期的影响,而利用分子标记研究菠菜种质资源遗传,则不受样品形态和环境因素的影响,并且分子标记试验所需样品用量少,标记数目多,重复性高,结果可靠,能检测整个基因组及提供中立、客观的遗传多样性评价。目前对于菠菜的遗传多样性研究主要局限于trap等通用的分子标记技术,虽然已经开发出部分ssr标记,但标记的数量小,应用局限,不利于后期的研究。
简单重复序列(simplesequencerepeat,ssr),又叫微卫星(microsatellite),主要是以1-6核苷酸为核心序列的简单串联重复序列,其长度大多在100-300bp。微卫星包括重复基本基序所构成的核心序列与其两侧的侧翼序列。ssr标记利用简单序列重复的侧翼保守序列设计引物,经过pcr扩增,根据条带的大小来反映dna序列的多态性。与其它分子标记相比,ssr标记具有多态性高、共显性遗传、重复性好、特异性强等特点,然而传统ssr标记的开发费时费力、开发成本高,阻碍了该技术在分子遗传育种等领域的应用。
技术实现要素:
本发明针对目前菠菜分子生物学研究基础及分子遗传育种技术薄弱的不足,开发菠菜ssr标记的引物序列,并将其应用于菠菜种质资源遗传多样性评价、遗传连锁图谱构建及qtl定位的研究。本发明的具体技术方案如下:
本发明一方面提供了一种菠菜ssr标记的制备方法,包括以下步骤:
步骤1、获取菠菜基因组或转录组测序数据;
步骤2、利用ssr检索程序进行ssr位点搜索;
步骤3、采用引物设计软件设计含有上述ssr位点的引物序列;
步骤4、提取菠菜材料的总dna;
步骤5、利用形态特征差异明显的菠菜材料的dna筛选出差异ssr标记。
优选地,在上述步骤1中,获取菠菜转录组数据的27376条unigene序列。
优选地,在上述步骤2中,利用microsatellite(misa)程序进行ssr位点搜索,搜索条件为:二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸和七核苷酸最少重复次数分别为10、6、5、5、5和5次。
优选地,在上述步骤3中,采用primer3.0软件对含有ssr位点的unigene序列批量设计引物。
更优选地,设计上述引物的主要参数为:(1)退火温度在55~65℃之间,上、下游引物的tm相差≤2℃;(2)pcr产物大小在100~300bp;(3)引物长度在18~24bp之间;(4)gc含量在40%~60%之间。
优选地,在上述步骤5中,差异ssr标记为筛选出的在形态特征差异明显的12个菠菜材料的dna中存在多态性的标记。
优选地,上述差异ssr标记至少包括如表2所示的20对具有多态性的ssr标记。
优选地,上述菠菜材料至少包括自然群体、f2群体、回交群体、重组自交系、双单倍体群体、近等基因系、残留异质系、qtl等基因系、导入系、单片段代换系和染色体片段代换系中的一种或几种。
更优选地,上述植物材料为菠菜自然群体。
本发明在另一方面提供了根据上述制备方法得到的菠菜ssr标记在菠菜种质资源多样性、连锁图谱构建、亲缘关系研究及分子辅助选育技术中的应用。
根据上述制备方法得到的菠菜ssr标记的应用,包括以下步骤:
步骤1、用上述差异ssr标记扩增目标菠菜材料和f2群体;
步骤2、计算每对引物的多态性信息含量;
步骤3、对目标菠菜材料进行遗传多样性聚类及群体结构分析。
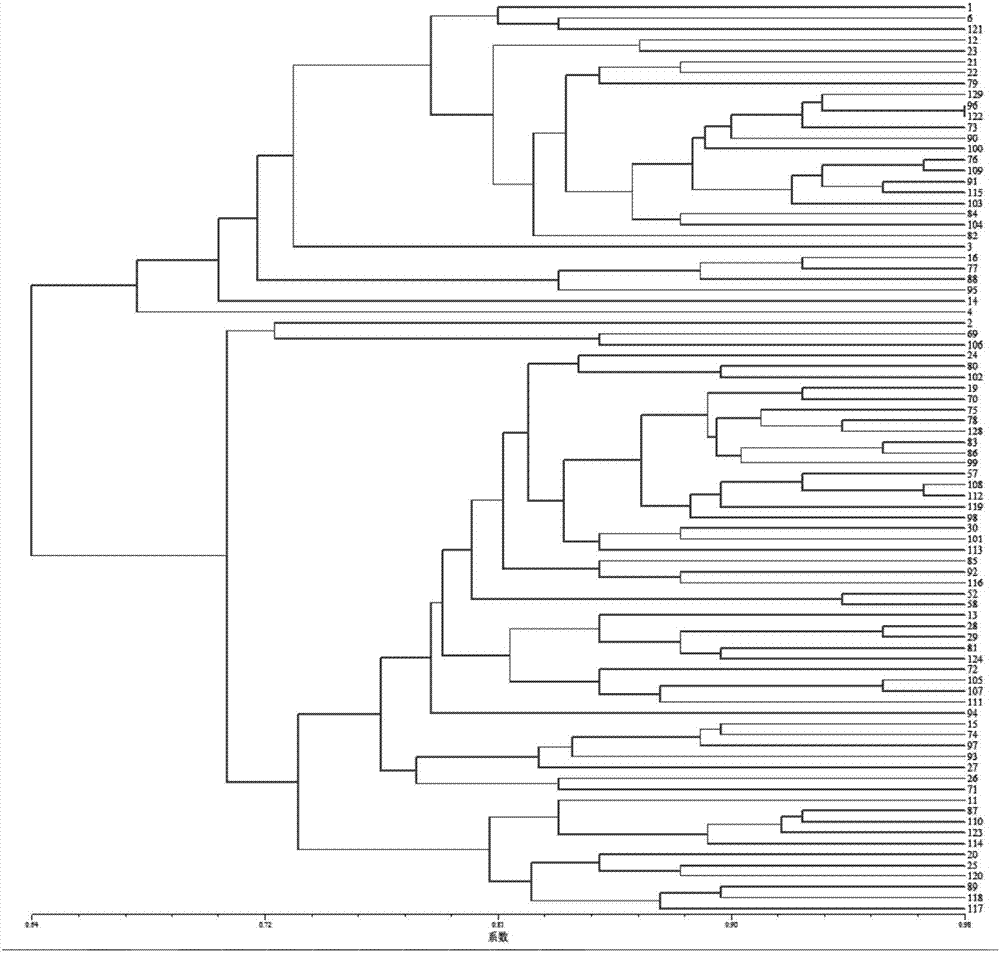
本发明的有益效果在于,共开发菠菜转录组ssr位点7410个,设计ssr特异引物5932对,随机合成60对ssr引物,其中20对能成功地在84份菠菜种质资源中扩增出多态性,20对引物共获得64个多态性位点,最多一对引物检测到了5个多态位点,平均每对引物能检测到3.1个多态性位点。20对ssr引物在84份材料中检测到的多态性信息含量(pic值)范围为0.137-0.668,平均pic值为0.41;基因多样性范围为0.144-0.720,平均0.475;期望杂合度为0.012-0.988,平均值0.413。84份材料的相似系数范围是0.64-0.98,被这些引物分成不同的组别,且基本与其形态特征相吻合。此外群体结构分析表明在q值=0.612时,可以将84份菠菜材料分为2个组,分别为q1和q2。
以下将结合附图对本发明作进一步说明,以充分说明本发明的目的、技术特征和技术效果。
附图说明
图1为本发明较优实施例中的ssr标记对菠菜材料的扩增电泳图;
图2为本发明较优实施例中的ssr标记分析的84份菠菜材料的聚类图;
图3为本发明较优实施例中的ssr标记分析的84份菠菜材料的群体结构图。
具体实施方式
在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
以84份菠菜种质资源为例进行说明。本发明提供的菠菜ssr标记的制备方法以及应用,具体按照以下步骤完成:
(1)、从spinachbase(http://www.spinachbase.org)获取菠菜基因组或转录组测序数据;
(2)、利用microsatellite(misa)程序进行ssr位点搜索;
(3)、用primer3.0软件批量设计含有ssr位点的引物序列;
(4)、获取菠菜材料植株嫩绿叶片,提取总dna;
(5)、用步骤(3)所设计合成的ssr标记的引物序列扩增步骤(4)中如表1所示的形态特征差异明显的12份菠菜材料;
(6)、获得在步骤(5)中12份菠菜材料中有差异的est-ssr标记,其序列如序列表2所示;并用所获差异ssr标记扩增所有菠菜材料;
表1示出了本发明较优实施例中所用的84份菠菜植物材料
(7)、计算每对引物的多态性信息含量;
(8)、对所有菠菜材料进行遗传多样性聚类及群体结构分析。
以下通过实施例对本发明作进一步描述。
实施例1:
1、供试材料(如表1所示):选择形态特征差异的菠菜材料12份(编号分别为1、2、3、4、6、16、24、69、77、88、98和106,剩余菠菜材料72份,其中3份为野生型种质,种植于实验大棚中。
2、ssr标记的制备及引物设计:使用microsatellite(misa)程序进行ssr位点搜索,搜索标准为:二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸和七核苷酸最少重复次数分别为10、6、5、5、5和5次。结果表明:通过对菠菜转录组的27376条unigene序列(序列总长约42968kb)进行搜索,发现其中5454条unigene序列中含有7410个ssr位点,其中1351条unigene序列中含有两个或两个以上ssr位点。总体上,ssr发生频率为19.9%,平均每5.8kb出现1个ssr。ssr的类型丰富,二核苷酸至七核苷酸重复类型均存在。其中二核苷酸和四核苷酸重复出现频率占优势,分别占总ssr的40.3%和41.3%;六核苷酸和七核苷酸重复类型数量较少,分别占总数的0.8%和5.3%。
用primer3.0引物批量设计程序对含有ssr位点的unigene序列设计引物,并且ssr位点侧翼序列长度≥50bp。引物设计的主要参数为:(1)、退火温度(tm)在55~65℃之间,上、下游引物的tm相差≤2℃;(2)、pcr产物大小在100~300bp;(3)、引物长度在18~24bp之间;(4)、gc含量在40%~60%之间;尽量避免引物二级结构如发卡结构、二聚体、错配、引物二聚体的出现。对批量设计的ssrs引物对在unigene库中进行ssr引物的blast验证,共设计了5932对ssr位点特异引物。为了验证其引物的有效性,随机挑选合成了60对ssr引物。
3、菠菜总dna提取方法:田间取所述供试材料的嫩绿叶片,提取其总dna,具体方法步骤如下:
(1)取菠菜的幼嫩叶片50-100mg于2.0ml离心管中,加入750μl新鲜提取缓冲液于植物dna磨样机中充分研磨,65℃条件下水浴30min,12000rpm离心10min,上清液转移至1.5ml离心管;所述提取缓冲液为2%ctab,100mmtris-hcl(ph8.0),20mmedta,1.4mnacl,1%pvp和2%β-巯基乙醇。
(2)加入等体积(750μl)的氯仿:异戊醇为24:1的混合液,上下剧烈颠倒100次,静置2min;12000rpm离心10min,将上清液转移至新的1.5ml离心管中。
(3)加入等体积(750μl)的氯仿:异戊醇为24:1的混合液,上下剧烈颠倒100次,静置2min;12000rpm离心10min,将上清液转移至新的2.0ml离心管中。
(4)加入0.1倍体积3mnaac,轻轻充分混匀,静置1min;加等体积的异丙醇后翻转50次,于-20℃冰箱保存10min,12000r/min离心5min。
(5)倒掉上清液,用1000μl75%的酒精清洗,同时震荡离心,再次倒掉酒精,自然干燥。
(6)加入适量含有rnase的ddh2o(50μl)溶解沉淀,37℃水浴30min。最后测定dna浓度,调至300-500ng/μl置于-20℃备用。
4、利用开发的引物进行分析:具体步骤如下:
4.1、将所有的引物对所选取的差异明显的菠菜材料进行预筛选:
ssr的pcr反应体系为:体系总体积为15μl,模板dna约为20ng,前引物与后引物分别为0.2μm,2.5mmmgcl2,0.4mmdntps,1×taqbuffer和1utaqdnataq聚合酶。pcr反应在96孔pcr仪(etc-811dongshengthermalcycler)上进行。反应程序为:94℃预变性5min;94℃变性0.5min,55℃复性1min,72℃延伸1min,35个循环;72℃延伸5min后4℃保存。扩增产物经琼脂糖凝胶电泳,凝胶浓度1-2%,凝胶大小140×120×2mm,电泳缓冲液为1×tae,恒压100v,电泳0.5h左右。电泳结束后,凝胶用凝胶成像系统拍照保存(tanon2500gelimagesystem)。
4.2、按照步骤4所示用差异ssr标记对剩余的72份菠菜材料进行标记分析。
4.3、数据整理及分析:
在相同迁移率位置上,条带有记为“1”,无则记为“0”构成1、0数据矩阵,建立excel表格的数据库。应用powermarker3.25软件计算基因多样性,杂合性和多态性信息含量(pic,polymorphisminformationcontent)等参数值。利用ntsys-pc2.10软件,采用非加权平均法(upgma)对材料进行聚类分析并绘制系统树图(rohlf,2000)。利用stucture2.3.4软件分析菠菜群体结构。
4.4、引物扩增情况:
随机开发合成的60对ssr引物,其中32对能够在12份菠菜材料中扩增出目的条带,占总引物的53.3%,并且其中20引物在12份菠菜材料中具有多态性(表2),占总引物的33.3%。利用这20对引物对所有的84份菠菜材料进行标记分析,20对ssr引物共获得64个多态性位点,最多一对引物检测到了5个多态位点。平均每对引物能检测到3.1个多态性位点(见图1)。
表2示出了本发明较优实施例中筛选出的20对具有多态性的ssr标记
其中标记物ssr7由核苷酸序列如seqidno.1所示的上游引物和核苷酸序列如seqidno.2所示的下游引物组成;
标记物ssr13由核苷酸序列如seqidno.3所示的上游引物和核苷酸序列如seqidno.4所示的下游引物组成;
标记物ssr17由核苷酸序列如seqidno.5所示的上游引物和核苷酸序列如seqidno.6所示的下游引物组成;
标记物ssr19由核苷酸序列如seqidno.7所示的上游引物和核苷酸序列如seqidno.8所示的下游引物组成;
标记物ssr20由核苷酸序列如seqidno.9所示的上游引物和核苷酸序列如seqidno.10所示的下游引物组成;
标记物ssr21由核苷酸序列如seqidno.11所示的上游引物和核苷酸序列如seqidno.12所示的下游引物组成;
标记物ssr22由核苷酸序列如seqidno.13所示的上游引物和核苷酸序列如seqidno.14所示的下游引物组成;
标记物ssr23由核苷酸序列如seqidno.15所示的上游引物和核苷酸序列如seqidno.16所示的下游引物组成;
标记物ssr28由核苷酸序列如seqidno.17所示的上游引物和核苷酸序列如seqidno.18所示的下游引物组成;
标记物ssr30由核苷酸序列如seqidno.19所示的上游引物和核苷酸序列如seqidno.20所示的下游引物组成;
标记物ssr36由核苷酸序列如seqidno.21所示的上游引物和核苷酸序列如seqidno.22所示的下游引物组成;
标记物ssr38由核苷酸序列如seqidno.23所示的上游引物和核苷酸序列如seqidno.24所示的下游引物组成;
标记物ssr39由核苷酸序列如seqidno.25所示的上游引物和核苷酸序列如seqidno.26所示的下游引物组成;
标记物ssr40由核苷酸序列如seqidno.27所示的上游引物和核苷酸序列如seqidno.28所示的下游引物组成;
标记物ssr42由核苷酸序列如seqidno.29所示的上游引物和核苷酸序列如seqidno.30所示的下游引物组成;
标记物ssr44由核苷酸序列如seqidno.31所示的上游引物和核苷酸序列如seqidno.32所示的下游引物组成;
标记物ssr45由核苷酸序列如seqidno.33所示的上游引物和核苷酸序列如seqidno.34所示的下游引物组成;
标记物ssr53由核苷酸序列如seqidno.35所示的上游引物和核苷酸序列如seqidno.36所示的下游引物组成;
标记物ssr55由核苷酸序列如seqidno.37所示的上游引物和核苷酸序列如seqidno.38所示的下游引物组成;
标记物ssr58由核苷酸序列如seqidno.39所示的上游引物和核苷酸序列如seqidno.40所示的下游引物组成。
4.5、ssr引物的特征:
20对ssr引物在84份材料中检测到的pic值范围为0.137-0.668,平均pic值为0.41;基因多样性范围为0.144-0.720,平均0.475;期望杂合度为0.012-0.988,平均值0.413(见表3)。
表3示出了本发明中筛选出的20对ssr标记遗传多样性
4.6、聚类及群体结构分析:
84份材料的相似系数范围是0.64-0.98(见图2),从图2中可以看出,在相似系数为0.67,84份菠菜材料被分为2个亚组,分别为组a和组b。组a中有29份菠菜材料,包含2份野生型材料,13份来源于中国不同地区的材料;组b有55份材料,又可细分为4个亚组。此外群体结构分析表明在q值=0.612时,可以将84份菠菜材料分为2个组,分别为q1和q2。84份材料基本能被这些引物分成不同的组别,且基本与其形态特征相吻合。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思做出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
sequencelisting
<110>上海师范大学
<120>一种菠菜ssr标记的制备方法及应用
<130>2017
<160>40
<170>patentinversion3.5
<210>1
<211>19
<212>dna
<213>人工合成
<400>1
tcggtgggttccaaacacc19
<210>2
<211>19
<212>dna
<213>人工合成
<400>2
gctggtccggtggaatacc19
<210>3
<211>18
<212>dna
<213>人工合成
<400>3
acgagcccccgttgaaat18
<210>4
<211>20
<212>dna
<213>人工合成
<400>4
ttccaacactctccattgca20
<210>5
<211>20
<212>dna
<213>人工合成
<400>5
tggaaacacctcctcttcca20
<210>6
<211>18
<212>dna
<213>人工合成
<400>6
tgagcaggactgagggca18
<210>7
<211>19
<212>dna
<213>人工合成
<400>7
tgccacgtaagcatcagca19
<210>8
<211>20
<212>dna
<213>人工合成
<400>8
agaagaggtgaagtggagga20
<210>9
<211>19
<212>dna
<213>人工合成
<400>9
gctgacatgtcctcccaga19
<210>10
<211>19
<212>dna
<213>人工合成
<400>10
cggaaccggaactgtcagt19
<210>11
<211>18
<212>dna
<213>人工合成
<400>11
gaagcgttaacagcggcg18
<210>12
<211>18
<212>dna
<213>人工合成
<400>12
atgccccacgctgaaaca18
<210>13
<211>18
<212>dna
<213>人工合成
<400>13
ggaaggtggtgcgatgga18
<210>14
<211>18
<212>dna
<213>人工合成
<400>14
tggtgctggtggtgctac18
<210>15
<211>18
<212>dna
<213>人工合成
<400>15
ggctggttttgccggaat18
<210>16
<211>18
<212>dna
<213>人工合成
<400>16
ctccagcagcagcaccat18
<210>17
<211>18
<212>dna
<213>人工合成
<400>17
cgcggatttggagggagg18
<210>18
<211>19
<212>dna
<213>人工合成
<400>18
ggcgtgaacctgaacctga19
<210>19
<211>19
<212>dna
<213>人工合成
<400>19
gcagatactgggagcgacc19
<210>20
<211>18
<212>dna
<213>人工合成
<400>20
ggacgccgacactttgtg18
<210>21
<211>18
<212>dna
<213>人工合成
<400>21
gaaacacgaggtggccga18
<210>22
<211>18
<212>dna
<213>人工合成
<400>22
aacgtaccgcccatgcaa18
<210>23
<211>18
<212>dna
<213>人工合成
<400>23
ccggaccctccatctcca18
<210>24
<211>20
<212>dna
<213>人工合成
<400>24
agggagaatggaaactggcg20
<210>25
<211>19
<212>dna
<213>人工合成
<400>25
tcctcttcacacactccct19
<210>26
<211>18
<212>dna
<213>人工合成
<400>26
gtgaatttggcacgggcg18
<210>27
<211>18
<212>dna
<213>人工合成
<400>27
tctttgccccctctcccc18
<210>28
<211>18
<212>dna
<213>人工合成
<400>28
tcagtgtcgccgccaaat18
<210>29
<211>18
<212>dna
<213>人工合成
<400>29
cgcgcacaagcaagactc18
<210>30
<211>18
<212>dna
<213>人工合成
<400>30
gcttgcaggagctcggaa18
<210>31
<211>20
<212>dna
<213>人工合成
<400>31
ccttctcttgggtggagtgt20
<210>32
<211>19
<212>dna
<213>人工合成
<400>32
aggagacgaaacgggaaca19
<210>33
<211>18
<212>dna
<213>人工合成
<400>33
tgcacagatccaggtcca18
<210>34
<211>19
<212>dna
<213>人工合成
<400>34
agcctctgccttgtttgga19
<210>35
<211>18
<212>dna
<213>人工合成
<400>35
gaacaacgccggcaatcc18
<210>36
<211>19
<212>dna
<213>人工合成
<400>36
tggaggtctggttgggttg19
<210>37
<211>20
<212>dna
<213>人工合成
<400>37
cggatccctcccaagaaagt20
<210>38
<211>20
<212>dna
<213>人工合成
<400>38
tgttgatggaagctggttgt20
<210>39
<211>18
<212>dna
<213>人工合成
<400>39
caaccgcccctcactctg18
<210>40
<211>18
<212>dna
<213>人工合成
<400>40
gcatcagctgccattgcc18
- 还没有人留言评论。精彩留言会获得点赞!