转基因大豆事件GC1‑1外源插入片段旁侧序列及其应用的制作方法
本发明涉及植物生物技术领域,具体地,涉及一种转基因大豆gc1-1外源插入片段旁侧序列以及用于检测该序列的pcr引物,本发明还涉及利用该引物进行转基因大豆检测的方法和试剂盒。
背景技术:
作物高产途径不外乎培育高产品种、施加有机肥和增产剂以及改善栽培耕作方式等。培育高产品种的手段有传统的杂交育种和现代的分子育种(包括转基因育种)。转基因育种是在对目标基因的功能及作用机制有较明确认识的前提下进行的,因而周期较短、增产效率较高。在大豆中也有很多通过转基因技术提高大豆产量和抗性的报道。如过表达ncl基因(na+、k+和cl-转运蛋白)的大豆具有较高的耐盐性,在高盐地区的产量比野生型提高3.6~5.5倍(doetal.,2016);los5/aba3(脱落酸醛脱氢氧化酶活性相关基因)转基因大豆在干旱条件下气孔开放大小及蒸腾速率降低,抗旱性明显增强,在干旱条件下的产量比野生型约提高21%(lietal.,2013);在美国和阿根廷等国家的实验表明,在大豆中过表达向日葵hahb-4(乙烯信号转导途径基因),能延缓大豆衰老,在干旱等逆境下产量提高7-15%(waltzetal.,2014);孟山都公司报道,在大豆中过表达拟南芥的bbx32开花基因,产量增加5-7%(preussetal.,2016);过表达蓝细菌fbp/sbpase(bifunctionalfructose-1,6/sedoheptulose-1,7-bisphosphatase)基因的大豆,在高co2浓度、高温等逆境(即:未来潜在的环境条件)下保持稳产(kohleretal.,2016);下调大豆bs1(bigseed1)同源基因的表达,显著增加大豆种子大小,干重增加45%以上(geetal.,2016)。apetala2-like基因gmtoe4a的过表达转基因大豆具有株高及节间缩短、茎杆粗壮等高产潜质的农艺性状(zhaoetal.,2015)。
作物的花期及生育期与其产量密切相关,国内外已有多篇文献报道,在水稻、番茄等农作物中,利用转基因手段改变花期相关基因的表达水平可提高其产量。gao等通过图位克隆揭示dth7编码一个apseudo-responseregulator蛋白,其表达受到光周期调控。在长日条件下dth7抑制ehd1从而来延迟开花。作者进一步发现dth7与ghd7和dth8的不同单倍型组合能够在不同的光周期环境中与水稻抽穗期和谷粒产量成显著的相关性。但目前尚未有报道利用花期相关基因培育高产大豆的研究成果。
ft蛋白或(和)mrna是成花素的重要组分。在拟南芥中,ft是一个开花途径整合因子,特异在长日条件下起开花促进作用(kardailskyetal.,1999;kobayashietal.,1999)。hd3a是水稻中ft的同源基因,主要在短日条件下起开花促进作用。不同植物如水稻、番茄、南瓜、矮牵牛、杨树和葡萄的ft同源基因在拟南芥中组成型表达后,都能在非诱导型光周期条件下促进拟南芥开花(hsuetal.,2006;lifschitzandeshed,2006;carmonaetal.,2007;hayamaetal.,2007;linetal.,2007)。申请人将克隆到的大豆ft同源基因gmftl1/2/3/4/5/6在拟南芥中过表达,同样也能促进拟南芥开花(fanetal.,2014)。在木本植物杨树中ft同源基因的组成型表达显著地缩短童期并促进了成花转变(hsuetal.,2006)。这些研究结果表明不同植物来源的ft序列和功能高度保守,都具有抑制营养生长促进植物开花的功能。
申请人将含有大豆花期基因rnai片段的表达载体通过农杆菌介导法转入到大豆基因组中,获得了一个高产转基因大豆事件gc1-1并正在进行中间试验阶段的安全评价。对转基因大豆进行转化事件特异性检测,能更好的对转基因大豆进行监督管理。而外源插入片段的旁侧序列和依据此旁侧序列建立的检测方法,是进行监督管理的一个重要指标。因此需要获得转基因大豆gc1-1的旁侧序列,并建立鉴定体系以备对此事件的监督管理。
技术实现要素:
本发明的目的在于提供一种转基因大豆事件gc1-1外源插入片段旁侧序列及其应用。
本发明另一目的在于提供一种转基因大豆的pcr检测方法和试剂盒。
本发明的高产转基因大豆事件gc1-1按如下方式获得:
以大豆gmftl1的cdna为模板,克隆得到273bp的核苷酸片段,通过ta克隆连接到克隆载体pgwcm,连接到克隆载体上的片段再经过lr反应重组至rna干涉表达载体pb7gwiwg2(i)。该片段转录得到的rna分子能够抑制大豆ft家族6个基因的表达。
将构建好的载体pb7gwiwg2-ftl-rnai通过冻融法转入农杆菌eha105中。通过农杆菌介导的大豆子叶节转化法将载体转化至大豆天隆1号。对获得的转基因植株进行草铵膦涂抹及pcr鉴定得到高产转基因大豆gc1-1。通过在温室及中间试验的田间调查结果显示,转基因大豆gc1-1与天隆1号相比花期延迟5-7天,单株产量增幅在30%以上,达到极显著水平。
本发明提供了高产转基因大豆事件gc1-1插入位点的外源插入片段的3’端旁侧序列,其含有seqidno.1所示的序列或其特异性片段。
本发明提供了seqidno.1所示的旁侧序列在检测转基因大豆中的应用。
特定的转基因事件其旁侧序列是特定的,因此,应用旁侧序列可以特异地检测转基因事件。可设计用于特异性扩增包含至少部分旁侧序列和至少部分外源插入片段的引物,进行pcr扩增,检测特异条带。可以根据在5’旁侧序列设计上游特异性引物,根据外源插入片段设计下游特异性引物,扩增特异性片段;或可以根据外源插入片段设计上游特异性引物,根据3’旁侧序列设计下游特异性引物,扩增特异性片段。
本发明还提供了用于扩增含有seqidno.1所示序列的特异性引物。
在本发明的一个实施例中,提取高产转基因大豆gc1-1叶片基因组dna,利用特异性引物和随机引物进行tail-pcr反应,获得外源基因在大豆基因组整合位点的右边界长约4kb的序列,包括第1-546bp共546bp的载体序列和约3.5kb的大豆基因组序列。分析外源片段整合位点的右边界序列,根据大豆基因组序列信息分别设计特异性下游引物rp:5’-ctgctgaaattgagtttggagc-3’(seqidno.2),根据载体pb7gwiwg2(i)中t-dna区3’端rb序列设计上游鉴定引物rb3:5’-gactctgtatgaactgttcgccag-3’(seqidno.3)。通过普通pcr扩增可得到935bp特异性片段(seqidno.1),包括第1-546共546bp的载体序列和第547-935共389bp的大豆基因组序列。
本发明提供了上述引物在制备检测转基因大豆试剂盒中的应用。
本发明提供了一种检测转基因大豆事件gc1-1的方法,其是以样品总dna为模板,利用本发明提供的引物进行pcr反应,根据pcr产物的电泳片段判断结果。
上述检测转基因大豆事件gc1-1的方法,20μlpcr反应体系为:10×pcr缓冲液2.0μl,10mmol/ldntp1.0μl,5u/μl的taq酶0.3μl,大豆总dna模板1.0μl,10μmol/l上游引物1.0μl,10μmol/l下游引物1.0μl,ddh2o13.7μl;
pcr反应条件为:95℃5min;94℃30s,58℃30s,72℃1min,共35个循环;72℃7min。
pcr产物跑琼脂糖凝胶电泳进行分离,sybrgreen染色后鉴定是否存在特异性条带。如存在特异性扩增产物935bp特异性片段,表明样品中含有gc1-1来源的成分。
本发明还提供了一种检测转基因大豆事件gc1-1的检测试剂盒,该试剂盒含有下列引物:
rp:5’-ctgctgaaattgagtttggagc-3’(seqidno.2)
rb3:5’-gactctgtatgaactgttcgccag-3’(seqidno.3)。
本发明提供了上述引物或检测试剂盒在检测转基因大豆中的应用。
本发明通过tail-pcr扩增得到了高产转基因大豆事件gc1-1的3’旁侧序列,根据这个旁侧序列的序列信息,设计两条新的pcr引物检测该旁侧序列进而建立针对gc1-1事件的鉴定方法,通过普通pcr扩增得到了新的即包含载体片段又包含大豆基因组信息的序列。本发明提供的旁侧序列和引物适用于对转基因大豆gc1-1(包括亲本、杂种f1和后代)及其制品(包括植株、组织、种子及其制品)的检测。
附图说明
图1是克隆载体pgwcm的示意图。
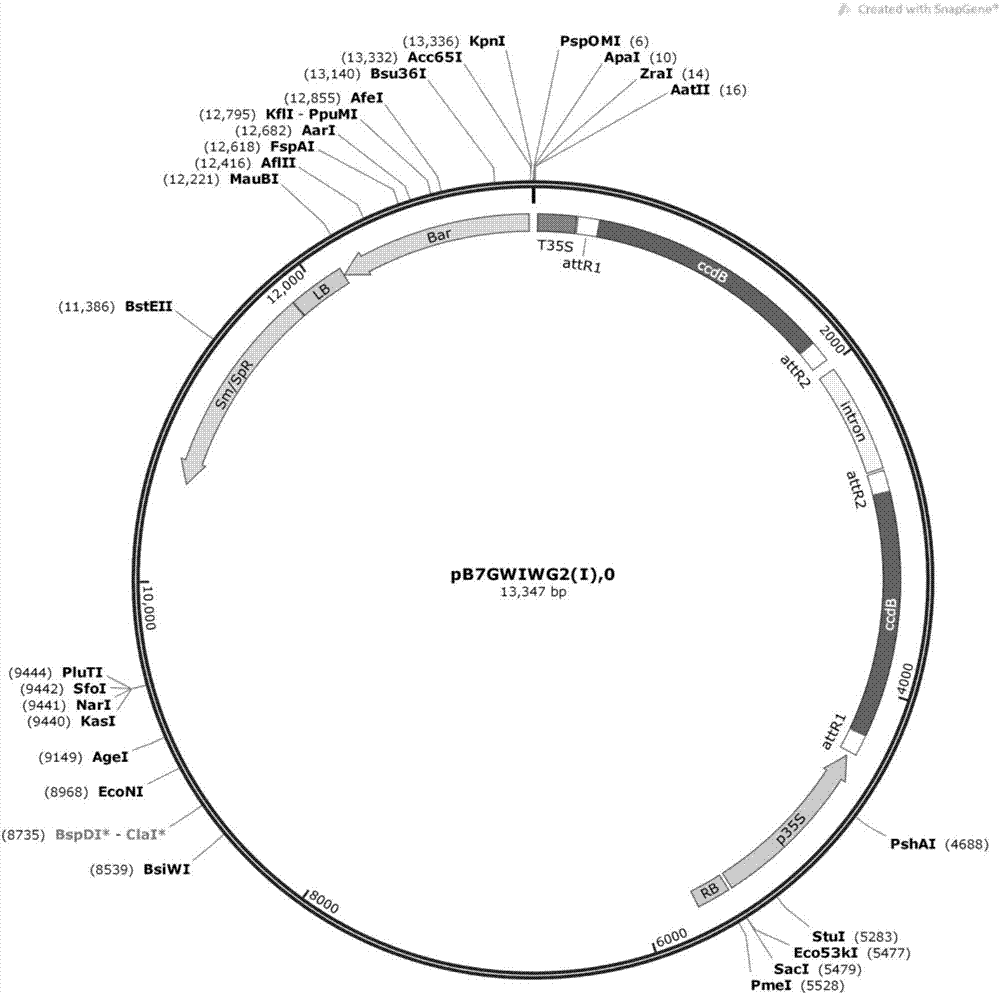
图2是转化载体pb7gwiwg2-ftl-rnai的示意图。
图3是高产转基因大豆gc1-1的t7代植株的pcr检测,其中m,dl5000dnamarker;1-15,转基因植株;ck-,非转基因植株;ck+,质粒pb7gwiwg2-ftl-rnai。
图4是转基因大豆gc1-1的3’端旁侧序列tail-pcr扩增电泳图,m,dl5000dnamarker;1,以简并引物(seqidno.6)与rb1(seqidno.4)为引物的第一轮tail-pcr扩增的产物100倍稀释液做模板,用简并引物与rb2(seqidno.5)进行第二轮tail-pcr产物;2,以泳道1的pcr产物做100倍稀释液做模板,用简并引物与rb3(seqidno.2)进行第三轮tail-pcr产物。
图5是转基因大豆gc1-1后代植株定性pcr扩增图,m:dl5000dnamarker;1,gc1-1植株亲本t7代叶片dna做模板,插入位点两侧的引物lp(seqidno.9所示)+rp(seqidno.2所示)进行pcr扩增;2,gc1-1植株亲本t7代叶片dna做模板,外源插入片段引物rb3+插入位点右侧引物rp进行pcr扩增;3-4泳道为1-2泳道的生物学重复;5,非转基因大豆天隆1号叶片dna为模板,引物lp+rp进行pcr扩增;6,非转基因大豆天隆1号叶片dna为模板,外源插入片段引物rb3+插入位点右侧引物rp进行pcr扩增。所述lp:5'-aactgatcatccgttgtgac-3'(seqidno.9)。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。实施例中所用的生化试剂均为市售。
实施例1高产转基因大豆gc1-1的获得
1、转化载体pb7gwiwg2-ftl-rnai的构建
以大豆ft基因的cdna为模板,克隆并测序获得273bp的rna干扰靶序列。直接按照ta克隆方法克隆到如图1所示的pgwcm载体(chenetal.,2006)上。事先将pgwcm载体用ahdi内切酶水解后用凝胶回收试剂盒回收酶切产物以获得t载体。然后pcr产物和t载体于16℃进行连接,将连接产物转化大肠杆菌dh5α,并在其中扩增,筛选阳性克隆并测序,测序正确的即为ft干扰靶序列的克隆载体。将上述得到的大豆ft家族基因干扰片段与如图2所示的植物rnai表达载体pb7gwiwg2(i)等比例混合后通过lr反应(两种质粒各50ng,lr酶1μl,补h2o至终体积5μl,混匀后25℃反应6小时以上),将该片段构建在pb7gwiwg2(i)上,构建成农杆菌转化载体pb7gwiwg2-ftl-rnai。
2、农杆菌转化大豆获得转基因植株
将载体pb7gwiwg2-ftl-rnai通过冻融法转化到农杆菌eha105中,pcr进行鉴定。以无菌水泡发24小时的大豆种子为材料,沿背部中缝切为两瓣,在子叶处划伤后浸入农杆菌菌液中,浸泡15-20分钟。取出用灭菌滤纸吸干,水平放置在ccm培养基上,在25℃黑暗条件下共培养3天。之后将其倾斜45°角插入含5mg/lglufosinate的sim诱导培养基上,每两周继代一次。待丛生芽诱导出来后转入含8mg/lglufosinate的sem伸长培养基,每两周继代一次。待芽伸长至2-3cm后剪下转入rm生根培养基,生根后将小苗移入混有营养土和蛭石(1:3)的小花盆中。待长出2-3片新叶时移入大花盆中,自交获得种子。
3、转基因植株的pcr鉴定
3.1植物总dna的提取,采用ctab法快速提取大豆叶片总dna,具体步骤如下:
(1)取30-50ml离心管,加入7.5mlctab提取缓冲液(tris100mm,nacl1.4m,20mmedta,2%ctab,0.1%巯基乙醇),在60℃恒温水浴中预热30min;
(2)取适量玉米叶片置于2ml离心管中,在液氮速冻下利用2000geno/grinder组织磨碎仪将叶片磨成粉末状;
(3)打开离心管,加入700μlctab提取缓冲液(tris100mm,nacl1.4m,20mmedta,2%ctab,0.1%巯基乙醇)。60℃水浴中保温30min,其间轻摇几次;
(4)取出离心管,每管中加入1ml饱和酚,摇动均匀后再加700μl氯仿/异戊醇(24:1)轻微而彻底地混合,放置10min以上,待蛋白质变性后离心;室温下以12000r/min离心10min;
(5)将上清液转移到新的离心管中,加三分之二体积的异丙醇,混匀,使核酸沉淀成絮状,12000r/min离心5min,弃上清。
(6)在沉淀中加入1ml70%乙醇,用手指轻弹几下,放置20min以上;
(7)12000r/min离心2min,弃上清;
(8)在超净台上吹干沉淀,溶于适量无菌水(100-200μl)中。
(9)将提取的dna于-20℃下冷藏备用。
3.2鉴定引物设计
根据pb7gwiwg2-ftl-rnai序列信息,设计扩增引物如下
jf:5'-gacgcacaatcccactatcc-3'(seqidno.7)
jr:5'-cacaaacacgaaacgatgaatcc-3'(seqidno.8)
扩增片段长度为517bp。
3.3pcr扩增体系及反应程序
pcr反应体系:
pcr反应程序:
以上述体系及程序进行pcr反应,获得转基因阳性植株,结果如图3所示。
实施例2通过tail-pcr方法获得高产转基因大豆gc1-1外源基因整合位点3’端旁侧序列
1、高产转基因大豆事件gc1-1总dna的提取方法参见实施例1中的3.1。
2、引物设计
根据t-dna的rb序列设计特异性引物:
rb1:gatattcttggagtagacgagagtgtc(seqidno.4)
rb2:agattttcttcttgtcattgagtcg(seqidno.5)
rb3:gactctgtatgaactgttcgccag(seqidno.3)
设计tail-pcr随机引物:
p1:ngtcga(g/c)(a/t)gana(a/t)gaa(seqidno.6)
3、pcr反应
第一轮扩增pcr反应体系:
第二轮扩增pcr反应体系:
第三轮扩增pcr反应体系:
第一轮扩增pcr反应程序
93℃2分钟,95℃1分钟,(94℃30秒,62℃1分钟,72℃3分钟)重复10次;94℃30秒,25℃3分钟,以0.5℃/秒的速度升至72℃,72℃5分钟,(94℃3分钟,68℃20秒,72℃3分钟,94℃3分钟,68℃20秒,72℃3分钟,94℃3分钟,44℃20秒,72℃3分钟)重复15次;72℃5分钟。
第二轮扩增pcr反应程序
(94℃20秒,64℃1分钟,72℃3分钟,94℃20秒,64℃1分钟,72℃3分钟,94℃20秒,44℃1分钟,72℃3分钟)重复14次,72℃5分钟。
第三轮扩增pcr反应程序
(94℃20秒,64℃1分钟,72℃3分钟,94℃20秒,64℃1分钟,72℃3分钟,94℃20秒,44℃1分钟,72℃3分钟)重复8次,72℃5分钟。
提取高产转基因大豆gc1-1叶片基因组dna,利用特异性引物rb1/2/3和随机引物p1进行tail-pcr反应。第三轮用p1和特异性引物rb3做pcr扩增得到约4kb大小的扩增片段(图4)。将此片段通过全式金公司的peasy-t1试剂盒进行ta克隆并测序,测序结果包括第1-546bp共546bp的载体序列和外源基因在大豆基因组整合位点的右边界约3.5kb的大豆基因组序列。测序结果中含有seqidno.1所示的序列,该序列中包含第1-546共546bp的载体序列和第547-935共389bp的大豆基因组序列。
实施例3高产转基因大豆gc1-1旁侧序列的应用
利用高产转基因大豆的旁侧序列(seqidno.1所示)及外源片段中的rb3序列针对插入位点设计一对引物,建立gc1-1事件及其衍生产品的定性pcr鉴定方法。依据外源片段中整合位点3’端大豆基因组设计的引物为rp:5’-ctgctgaaattgagtttggagc-3’,依据载体rb区序列设计的引物为rb3:5’-gactctgtatgaactgttcgccag-3’。
大豆基因组dna的提取及pcr反应体系依实施例1中的方法。pcr反应程序为95℃5min,(94℃30s,58℃30s,72℃1min)30个循环,72℃7min。用此特异性引物进行pcr扩增时,非转基因植株无扩增条带,只有转基因植株gc1-1及其后代的dna扩增序列有特异性935bp目的条带(图5),其核苷酸序列如seqidno.1所示。试验说明利用转基因大豆事件gc1-1旁侧序列进行pcr检测,可以特异性地检测转基因大豆事件gc1-1的亲本和后代及其制品。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
sequencelisting
<110>中国农业科学院作物科学研究所
<120>转基因大豆事件gc1-1外源插入片段旁侧序列及其应用
<130>khp171112313.0
<160>9
<170>patentinversion3.5
<210>1
<211>935
<212>dna
<213>大豆
<400>1
ctgttagatcctcgatctgaatttttgactccatggcctttgattcagtaggaactactt60
tcttagagactccaatctctattacttgccttggtttatgaagcaagccttgaatcgtcc120
atactggaatagtacttctgatcttgagaaatatatctttctctgtgttcttgatgcagt180
tagtcctgaatcttttgactgcatctttaaccttcttgggaaggtatttgatctcctgga240
gattattactcgggtagatcgtcttgatgagacctgccgcgtaggcctctctaaccatct300
gtgggtcagcattctttctgaaattgaagaggctaatcttctcattatcggtggtgaaca360
tggtatcgtcaccttctccgtcgaactttcttcctagatcgtagagatagagaaagtcgt420
ccatggtgatctccggggcaaaggagatcagcttggctctagtcgaccatatgggagagc480
tcaagcttagcttgagcttggatcagattgtcgtttcccgccttcagtttaaactatcag540
tgtttgatcatcattttgtcactacccaatttctttattatttcccttttgtgttccttt600
cgctcattgatatgccttgtgactctttcacttttctcgacactttttctggtttcttta660
tagcatcatcgtattcctcacctcggcagcccaagtcaaatgttttctctttcaacttag720
tgtgtgtaacatattttatcatactaattgattcaagattgtgttttgacgggattctaa780
ccagcatgttttatagagttctaaaatgaatcagtgaacttcagatatattcatgcttgc840
atttattgatattgcatagcatctttgcattggaatgcatttgatataatttcatgttat900
ttaatcacactatgctccaaactcaatttcagcag935
<210>2
<211>22
<212>dna
<213>人工序列
<400>2
ctgctgaaattgagtttggagc22
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
gactctgtatgaactgttcgccag24
<210>4
<211>27
<212>dna
<213>人工序列
<400>4
gatattcttggagtagacgagagtgtc27
<210>5
<211>25
<212>dna
<213>人工序列
<400>5
agattttcttcttgtcattgagtcg25
<210>6
<211>16
<212>dna
<213>人工序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>nisa,c,g,ort
<220>
<221>misc_feature
<222>(7)..(7)
<223>niscorg
<220>
<221>misc_feature
<222>(8)..(8)
<223>nisaort
<220>
<221>misc_feature
<222>(11)..(11)
<223>nisa,c,g,ort
<220>
<221>misc_feature
<222>(13)..(13)
<223>nisaort
<400>6
ngtcgannganangaa16
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
gacgcacaatcccactatcc20
<210>8
<211>23
<212>dna
<213>人工序列
<400>8
cacaaacacgaaacgatgaatcc23
<210>9
<211>20
<212>dna
<213>人工序列
<400>9
aactgatcatccgttgtgac20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种转sck/cry1Ac双价抗虫基因水稻品系科丰8号外源插入片段旁侧序列及应用的制作方法
- 转基因水稻品系Bar68-1的外源插入片段的旁侧序列及其应用的制作方法
- 转基因水稻品系223f-s21的外源插入片段旁侧序列及其应用的制作方法
- 核酸和检测转基因水稻eb7001s及其衍生系的方法以及试剂盒及其用途
- 核酸和检测转基因水稻b2a68及其衍生系的方法以及试剂盒及其用途
- 一种利用动物乳腺生产人血清白蛋白的方法及其表达载体的制作方法
- 转基因水稻品系134Bt的外源插入片段旁侧序列、其扩增引物及其应用的制作方法
- 转基因水稻pa110-15外源插入片段旁侧序列及应用的制作方法
- 转基因水稻品系科丰6号的外源插入片段的旁侧序列的制作方法
- 转基因水稻品系Bt汕优63的外源插入片段的旁侧序列的制作方法