一种小麦功能性NAM‑B1基因的分子标记及其应用的制作方法
本发明涉及一种小麦功能性nam-b1基因的分子标记及其在小麦品种鉴定和分子标记辅助育种中的应用。
背景技术:
小麦(triticumaestivum)是重要的粮食作物,是世界上约30%人口的主食,占全球卡路里消费总量的近20%(iwgsc,2014;pfeiferetal.,2014)。小麦是异源六倍体,基因组由三套染色体组(aabbdd)组成,是由四倍体的野生二粒小麦(t.turgidum,基因组类型aabb)与二倍体的节节麦(a.tauschii,基因组类型dd)杂交获得,后经驯化而来的小麦在世界范围内已占到不同类型麦类作物种植面积的95%以上(iwgsc,2014;marcussenetal.,2014)。
小麦是重要的蛋白质和微量元素铁、锌的来源,所提供的蛋白质占消费总量的25%,提供的铁、锌分别占平均日常膳食获取量的16%和12%(fao,2015;batesetal.,2014)。由于受环境、遗传以及与产量之间的负相关等因素影响,提高小麦籽粒蛋白质含量的研究进展缓慢(simmonds,1995)。早在1978年,avivi等人即在小麦祖先物种野生二粒小麦中发现了一个控制籽粒蛋白质及铁、锌含量的性状位点。2006年,uauy等人通过图位克隆技术在该性状位点发现了nam-b1基因,该基因属于nac类型的转录因子基因。研究表明,在绝大多数小麦中,nam-b1基因由于发生了基因缺失(基因组不含该基因序列)或碱基变异(基因组中存在该基因序列,但基因序列中个别碱基位点发生突变)失去了功能,而功能性nam-b1基因多存在于小麦祖先物种野生二粒小麦和少数北欧来源的小麦品种中(uauyetal.,2006;asplundetal.,2010;hagenbladetal.,2012)。通过分子标记辅助选择的方法将来源于野生二粒小麦或少数小麦中存在的功能性nam-b1基因导入nam-b1基因发生变异的小麦中,籽粒蛋白质和铁、锌等微量元素含量均有显著提高(tabbitaetal.,2017)。因此,筛选、鉴定含有功能性nam-b1基因的小麦种质资源,并通过分子标记辅助育种的方法,将功能性nam-b1基因导入其它不含该功能性基因的小麦品种中,是提高小麦籽粒蛋白质含量和营养品质的重要途径。
自从1978年含有功能性nam-b1基因的性状位点被发现以来,前人就已开展将该功能性基因导入普通小麦中的研究,并开发了一些分子标记用于辅助选择育种。目前报道中所使用的分子标记并非根据功能性nam-b1基因自身序列特征设计,而是根据与功能性nam-b1基因位点相连锁的其它序列位点设计,在应用中存在以下缺点:1,有丝分裂过程中染色体重组,可能导致分子标记与连锁的功能性nam-b1基因位点发生分离,即分子标记不能继续锚定功能性nam-b1基因,尤其是当分子标记的设计位点距离功能性nam-b1基因位点较远时二者发生分离的可能性较高;2,这些分子标记是针对某一特定的小麦供体材料和受体材料设计的,由于小麦种质资源遗传背景的差异,无法保证在其它小麦材料中这些分子标记所在位点特征的稳定性,即分子标记位点特征在不同材料之间可能存在差异,导致在其它材料中不适用,使得该分子标记只在某一特定供体材料和受体材料之间适用;3,如上所述,这些分子标记并不适于从大量的小麦种质资源中筛选和鉴定含有功能性nam-b1基因的小麦材料。4,这些分子标记多为caps(cleavageamplifiedpolymorphicsequences)类型,经pcr扩增后还需要特定的限制性酶切反应,操作上较繁琐、耗时,成本较高。
nam-b1基因的克隆(uauyetal.,2006)为根据nam-b1基因自身序列设计分子标记提供了可能,但是目前还未发现这种类型的分子标记,可能存在如下原因:1,nam-b1基因在小麦中有三种情况,即缺失(不含有该基因序列)、碱基突变和功能性nam-b1基因。在功能性nam-b1基因序列和突变的nam-b1基因序列之间仅有个别碱基的差异,使得根据nam-b1基因自身序列特征设计分子标记区分功能性nam-b1基因和突变的nam-b1基因具有一定的难度;2,小麦是异源六倍体,有3套染色体组(aabbdd)组成,除了nam-b1基因以外,还存在nam-a1、nam-d1、nam-b2和nam-d2等功能性同源基因。不同于绝大多数小麦不含功能性nam-b1基因,以上四个功能性同源基因均存在于小麦中,并且与nam-b1基因序列具有很高的相似性(分别为94.6%、95.5%、85.1%和84.6%)。在使小麦获得功能性nam-b1基因以进一步提高籽粒蛋白质和铁锌含量的分子标记辅助育种中,nam-a1、nam-d1、nam-b2和nam-d2等已存在于小麦中的功能性同源基因序列,对只特异性扩增功能性nam-b1基因的分子标记提出了更高要求。
解超杰等(专利申请号:cn201610305899.7)根据小麦中nam-a1、nam-b1、nam-d1、nam-b2和nam-d2序列之间的保守性区域设计了分子标记,可以同时检测小麦中是否存在以上五个基因。由于该分子标记设计在保守区域,无法对只存在个别碱基差异的功能性nam-b1基因和变异的nam-b1基因进行有效区分。另外,由于小麦已存在nam-a1、nam-d1、nam-b2和nam-d2等功能性基因,也无需再通过分子标记辅助选择的方法使小麦获得这些基因,以上不足在很大程度上限制了其在小麦中发掘功能性nam-b1基因和分子标记辅助育种中的应用。解超杰等(专利申请号:cn201610305899.8;cn201610305899.8)分别在簇毛麦(h.villosa,基因组类型vv)和拟斯卑尔托山羊草(a.speltoides,基因组类型ss)中克隆了小麦功能性nam-b1基因的同源基因nam-v1和nam-s1,并根据基因序列特征设计了特异性的分子标记。通过这些分子标记辅助选择可以将异源的nam-v1和nam-s1基因导入小麦,对提高小麦籽粒蛋白质和铁、锌等微量元素具有潜在的功能。但是,对于小麦自身存在的已研究证明能显著提高籽粒蛋白质和铁、锌等微量元素含量的功能性nam-b1基因,根据其序列特征设计以应用于小麦中功能性nam-b1基因检测和分子标记辅助选择育种的特异性分子标记。
技术实现要素:
本发明针对现有技术中存在的不足,提供小麦功能性nam-b1基因分子标记spnam-b1,该标记能够直接通过pcr产物的扩增鉴定小麦材料中是否含有功能性nam-b1基因,无需再对pcr产物进行酶切分型等操作,利用该标记可以对大量小麦材料进行方便、快速、准确地鉴定,以发掘含有功能性nam-b1基因的小麦材料。
本发明的另一目的是将上述分子标记用于标记辅助选择育种。由于该分子标记是根据功能性nam-b1基因自身序列特征设计,因此,其应用并不受限于供体材料和受体材料的选择,具有广泛的适用性。通过该标记辅助选择育种,能够准确将功能性nam-b1基因转移到受体材料中,为培育高蛋白、高铁锌含量的小麦新品种提供技术手段。
本发明基于以下构思:根据nam-b1基因与nam-a1、nam-d1、nam-b2和nam-d2等基因序列之间的多态性和功能性nam-b1基因与变异的nam-b1基因之间的snp位点分别设计正向引物和反向引物,形成的引物组合只对功能性nam-b1基因序列进行pcr扩增。由于能够排除对变异的nam-b1基因以及nam-a1、nam-d1、nam-b2、nam-d2等小麦中已存在的功能性同源基因的扩增,本发明方法可以用于在小麦种质资源中发掘功能性nam-b1基因和将功能性nam-b1基因导入其它不含该功能性基因小麦的标记辅助选择育种。
为了实现本发明目的,本发明提供一种小麦功能性nam-b1基因分子标记spnam-b1,该标记能够特异性地检测小麦中是否含有功能性nam-b1基因。
用于特异性pcr扩增该分子标记的引物为:正向引物spnam-b1-f5'-catagaaggaagtggcggaatact-3'和反向引物spnam-b1-r5'-ggattattcgattatttaattgcagcg-3'。
本发明还提供所述分子标记在检测小麦品种是否含有功能性nam-b1基因中的应用
具体地,所述应用包括以下步骤:
1)提取待测植株的基因组dna;
2)以待测植株的基因组dna为模板,利用所述引物spnam-b1-f和spnam-b1-r,进行pcr扩增反应;
3)检测pcr扩增产物。
pcr反应体系:50-100ng/uldna模板1ul,10pmol/ul引物spnam-b1-f、spnam-b1-r各0.5ul,2×pcrmix10ul(含pcrbuffer、dntp、taqdna聚合酶、mg2+等),加水至20ul。
pcr反应程序:95℃3min;94℃30s,62℃30s,72℃30s,35个循环;72℃2min。
其中,步骤3)采用1.5%琼脂糖凝胶电泳和溴化乙锭染色检测pcr扩增产物,扩增出的片段大小为773bp,对应于功能性nam-b1基因在引物spnam-b1-f和spnam-b1-r之间的序列片段。
本发明还提供含有所述引物spnam-b1-f和spnam-b1-r的用于检测小麦品种中功能性nam-b1基因的试剂盒,该试剂盒由下列组分组成:含功能性nam-b1基因分子标记spnam-b1引物的pcr反应预混液(还包含pcrbuffer、dntp、taqdna聚合酶、mg2+等)和分别作为阳性对照(含功能性nam-b1基因序列)和阴性对照(不含功能性nam-b1基因序列)的质粒。
本发明进一步提供所述分子标记spnam-b1在小麦分子标记辅助育种中的应用。
本发明提供的分子标记spnam-b1,能够特异性地检测小麦中是否含有功能性nam-b1基因。利用该标记可以方便、快速、准确从大量小麦种质资源中发掘功能性nam-b1基因,该标记可用于小麦高蛋白分子育种,通过该标记辅助选择,能够将功能性nam-b1基因导入其它不含该功能性基因的受体材料中,有助于培育高蛋白、高铁锌含量的小麦新品种。
附图说明
图1为本发明实施例1中分子标记spnam-b1正向引物spnam-b1-f和反向引物spnam-b1-r设计位点的选择;其中,a:正向引物spnam-b1-f设计位点,选择atg上游424bp—446bp的位点(红色标记)设计正向引物,用于区分nam-b1基因序列与其它四个功能性同源基因(nam-a1、nam-d1、nam-b2和nam-d2);b:反向引物spnam-b1-r设计位点,以功能性nam-b1基因序列与变异的nam-b1基因序列在atg下游第301位的snp位点(c/a)为反向引物3’端最后一个碱基,同时将与此位点相邻的第3位碱基改为错配碱基g。反向引物所在位点为atg下游第301bp—327bp,主要用于区分功能性nam-b1基因序列和变异的nam-b1基因序列。spnam-b1-f和spnam-b1-r扩增出的功能性nam-b1基因序列长度为773bp。
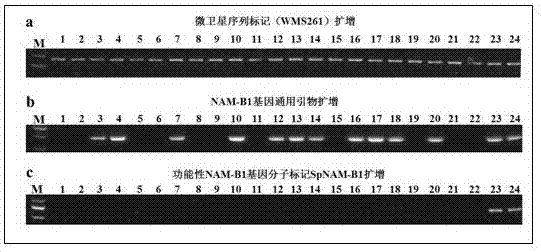
图2为本发明实施例2中分子标记spnam-b1在不同小麦品种中筛选、鉴定功能性nam-b1基因的扩增情况。其中,a:微卫星标记(wms261)引物的扩增情况,b:nam-b1基因通用引物的扩增情况,c:功能性nam-b1基因分子标记spnam-b1的扩增情况;样片编号及对应小麦品种如下:1—宁麦3号,2—宁麦9号,3—宁麦10号,4—宁麦11,5—宁麦13,6—宁麦16,7—宁麦17,8—宁麦19,9—宁麦20,10—宁麦21,11—宁麦22,12—宁麦23,13—扬麦9号,14—扬麦16,15—扬麦20,16—华麦5号,17—华麦6号,18—宁糯麦1号,19—宁盐1号,20—农丰126,21—镇麦5号,22—镇麦6号,23—jathti.keratchna,24—tankokeratchua。
图3为实施例2中13份小麦品种含有的nam-b1基因序列与功能性nam-b1基因序列比较;中国小麦品种:宁麦10号、宁麦11、宁麦17、宁麦21、宁麦23、扬麦9号、扬麦16、华麦5号、华麦6号、宁糯麦1号、农丰126
芬兰小麦品种:jathti.keratchna,24:tankokeratchua。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,以下实施例均按照常规实验条件,如sambrook等分子克隆实验手册(newyork:coldspringharborlaboratorypress,1989)中所述的操作技术规程,或按照厂商所建议的实验条件;所用原料均为市售商品。
实施例1小麦功能性nam-b1基因分子标记的开发
正向引物:根据吴丹等(2015)在小麦中克隆的nam-a1(km820886)、nam-b1(km820887)、nam-d1(km820889)、nam-b2(km820888)和nam-d2(km820890)基因的cdna序列,在小麦基因组数据库(http://www.wheatgenome.org/)中进行blast比对分析,获取各成员基因序列。由于这些基因在起始密码子atg和终止密码子tga之间具有相对较高的同源性,而位于两侧的序列同源性较低,选择atg上游启动子区域nam-b1基因序列与其它4个功能性同源基因序列的差异位点设计正向pcr扩增引物(图1a),以确保对nam-b1基因序列的特异性扩增。引物序列为spnam-b1-f:5'-catagaaggaagtggcggaatact-3',位于nam-b1基因序列atg上游424bp-446bp。
反向引物:根据功能性nam-b1基因序列与变异的nam-b1基因序列在atg下游第301位形成c/a类型snp位点,以此位点作为反向引物3’的端的最后一个碱基,此位点与变异的nam-b1基因序列的错配将有效抑制变异的nam-b1基因序列的扩增。同时,在引物3’端第3位引入错配碱基g(鸟嘌呤脱氧核糖核苷酸),虽然此位点引入错配碱基对功能性nam-b1基因自身的扩增也会产生一定影响,但将进一步抑制变异nam-b1基因序列的扩增(图1b)。引物序列为spnam-b1-r:5'-ggattattcgattatttaattgcagcg-3',位于功能性nam-b1基因序列atg下游301bp-327bp。
分子标记引物spnam-b1-f和spnam-b1-r对功能性nam-b1基因进行pcr扩增的片段长度为773bp。
实施例2利用分子标记spnam-b1筛选、鉴定含有功能性nam-b1基因的小麦材料。
选择22份中国小麦品种(宁麦3号、宁麦9号、宁麦10号、宁麦11、宁麦13、宁麦16、宁麦17、宁麦19、宁麦20、宁麦21、宁麦22、宁麦23、扬麦9号、扬麦16、扬麦20、华麦5号、华麦6号、宁糯麦1号、宁盐1号、农丰126、镇麦5号、镇麦6号)和2份来自北欧(芬兰)的小麦品种(jathti.keratchna和tankokeratchua)作为研究材料,提取各小麦品种基因组dna。利用微卫星标记(microsatellitemarker)wms261对所有样品进行pcr扩增以检测模板dna的完整性(图2a);利用nam-b1基因的通用引物进行pcr扩增以检测是否含有nam-b1基因序列(图2b);利用分子标记spnam-b1进行pcr扩增以检测是否含有功能性nam-b1基因序列(图2c)。对含有nam-b1基因序列的小麦品种,将扩增的pcr产物进行测序,与功能性nam-b1基因序列进行比对分析以验证分子标记spnam-b1的检测结果(图3)。
小麦基因组dna提取方法如下:
1)取0.1g小麦新鲜叶片,用液氮研磨成粉,置于预冷的2mleppendof管中;
2)在65℃水浴中预热ctab提取液(2%ctab,1.4mol/lnacl,20mmo/ledta(ph8.0),100mmol/ltris-hcl(ph8.0),2%pvp-40);
3)每100mg样品中加700μl预热的ctab提取液,迅速混匀,在65℃温浴15~20min,期间混匀3~5次;
4)加1倍体积的氯仿/异戊醇(体积比24:1),混匀;
5)12000rpm室温离心10min;
6)将上清转移至一新的离心管中;
7)用氯仿/异戊醇(体积比24:1)重复步骤(4)~(6);
8)加等体积的异丙醇,颠倒混匀,-20℃放置10min;
9)12000rpm室温离心15min;
10)倒掉上清,用75%乙醇1ml洗沉淀,弃去乙醇,重复2~3次;
11)空气中干燥沉淀,用50μl去离子水或te溶解dna,置于-20℃备用;
12)测定dna浓度,计算需要加入的去离子水量,将基因组dna稀释待用。
微卫星标记wms261及nam-b1基因通用引物序列分别参考korzun等(1998)和uauy等(2006)报道。
pcr扩增反应体系如下:50-100ng/uldna模板1ul,10pmol/ul引物f、r各0.5ul,2×pcrmix10ul(含pcrbuffer、dntp、taqdna聚合酶、mg2+等),加水至20ul。
pcr反应程序:95℃3min;94℃30s,58-62℃30s,72℃30s,35个循环;72℃2min。其中wms261标记引物退火温度为58℃;nam-b1基因通用引物退火温度为59℃;分子标记spnam-b1引物退火温度为62℃。
采用琼脂糖凝胶电泳检测检测pcr扩增产物。
配制琼脂糖凝胶(1.5%)方法如下:称取1.5g琼脂糖凝胶,加入100ml琼脂糖凝胶电泳缓冲液,微波炉溶解后,加入30ul浓度为1mg/ml的溴化乙锭(eb),混匀后倒入制胶板。
琼脂糖凝胶电泳缓冲液(tae)配方(10×)如下:在800ml去离子水中先后溶解48.4gtris和3.72gna2edta·2h2o,加入11.4ml的冰醋酸搅拌混匀,用去离子水定容至1l。
电泳缓冲体系为:1×tae,120v电泳约20分钟。
对电泳后的琼脂糖凝胶采用紫外照射成像。
根据琼脂糖凝胶成像结果,将nam-b1基因通用引物扩增获得的pcr产物,测定各产物序列,利用dnaman软件对获得的片段序列与功能性nam-b1基因序列进行多序列同源比对。
分析结果表明,微卫星标记wms261引物在所有样品基因组dna中均有目的片段出现,说明所有样品基因组dna质量满足pcr检测;nam-b1基因的通用扩增引物在13份小麦品种中扩增出pcr产物,在其余11份小麦品种中没有pcr产物出现,说明这13份小麦品种含有nam-b1基因序列,而其余11份小麦品种缺失nam-b1基因序列;分子标记spnam-b1引物仅在2份北欧(芬兰)小麦品种中扩增出pcr产物(图2),说明只有这2份国外小麦品种含有功能性nam-b1基因序列。为了证明以上结果,将13份小麦品种中nam-b1基因通用引物扩增出的pcr产物序列与功能性nam-b1基因序列进行比对分析(图3),发现在13份含有nam-b1基因序列的小麦品种中,11份中国小麦品种中的nam-b1基因序列均存在相同的2个snp位点,与uauy等人在其它小麦品种中发现的变异位点一致,说明11份中国小麦品种含有变异的nam-b1基因序列。而其余2份国外小麦品种中的nam-b1基因序列与功能性nam-b1基因序列一致,说明了这2份小麦品种含有功能性nam-b1基因,证明了分子标记spnam-b1能够特异性的鉴定功能性nam-b1基因,从而应用于小麦功能性nam-b1基因的发掘与分子标记辅助选择育种。
实施例3分子标记spnam-b1在小麦分子标记辅助育种中的应用。
在小麦育种过程中,可以在每个世代对分离后代利用分子标记进行选择,-能够准确地获得含有功能性nam-b1基因的个体进入下一个育种世代,可以大大地提高育种效率。涉及的实验技术与过程与实施例2相同。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进。本发明的特征之处在于分别利用nam-b1基因与其它4个功能性同源基因(nam-a1、nam-d1、nam-b2和nam-d2)序列之间的差异位点和功能性nam-b1基因与变异的nam-b1基因序列之间的snp位点设计正向引物和反向引物,并通过调整与反向引物3’端碱基相邻(第3位)的其它碱基序列以增强pcr扩增的特异性。选择其它特异性区域、调整与反向引物3’端相邻的其它位点碱基或者调整错配类型还可设计、筛选另外的分子标记,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献
1.internationalwheatgenomesequencingconsortium.achromosome-baseddraftsequenceofthehexaploidbreadwheat(triticumaestivum)genome[j].science,2014,345(6194):1251788.
2.pfeiferm,kuglerkg,sandvesr,etal.genomeinterplayinthegraintranscriptomeofhexaploidbreadwheat[j].science,2014,345(6194):1250091.
3.marcussent,sandvesr,heierl,etal.ancienthybridizationsamongtheancestralgenomesofbreadwheat[j].science,2014,345(6194):1250092.
4.fao,ifad,wfp,2015.thestateoffoodinsecurityintheworld:meetingthe2015internationalhungertargets:takingstockofunevenprogress.fao,rome.http://www.fao.org/3/a-i4646e.pdf.
5.batesb,lennoxa,prenticea,etal.nationaldietandnutritionsurveyresultsfromyears1,2,3and4(combined)oftherollingprogramme(2008/2009-2011/2012):asurveycarriedoutonbehalfofpublichealthenglandandthefoodstandardsagency.2014.
6.simmondsnw.therelationbetweenyieldandproteinincerealgrain[j].journalofthescienceoffoodandagriculture,1995,67(3):309-315.
7.avivil.highproteincontentinwildtetraploidtriticumdicoccoideskorn[c].proceedingsofthe5thinternationalwheatgeneticssymposium.newdelhi,india:indiansocietyofgeneticsandplantbreeding(isgpb).1978:372-380.
8.uauyc,distelfelda,fahimat,etal.anacgeneregulatingsenescenceimprovesgrainprotein,zinc,andironcontentinwheat[j].science,2006,314(5803):1298-1301.
9.asplundl,hagenbladj,leinomw.re-evaluatingthehistoryofthewheatdomesticationgenenam-b1usinghistoricalplantmaterial[j].journalofarchaeologicalscience,2010,37(9):2303-2307.
10.hagenbladj,asplundl,balfourierf,etal.strongpresenceofthehighgrainproteincontentalleleofnam-b1infennoscandianwheat[j].theoreticalandappliedgenetics,2012,125(8):1677-1686.
11.tabbitaf,lewiss,vouillozjp,etal.effectsofthegpc‐b1locusonhighgrainproteincontentintrogressedintoargentineanwheatgermplasm[j].plantbreeding,2013,132(1):48-52.
12.解超杰,孙其信,倪中福,等.小麦nam基因分子标记及其应用.中国专利,cn201610305899.7.2016-07-27.
13.解超杰,孙其信,倪中福,等.簇毛麦nam-v1基因及其分子标记和应用.中国专利,cn201610306058.8.2016-09-28.
14.解超杰,孙其信,倪中福,等.拟斯卑尔脱山羊草nam-s1基因及其分子标记和应用.中国专利,cn201610306056.9.2016-08-03.
15.吴丹,董剑,要燕杰,等.小麦中国春nam转录因子gpc-1和gpc-2灌浆期时空表达模式分析[j].中国农业科学,2015,48(7):1262-1276.
16.korzunv,röderms,ganalmw,etal.geneticanalysisofthedwarfinggene(rht8)inwheat.parti.molecularmappingofrht8ontheshortarmofchromosome2dofbreadwheat(triticumaestivuml.)[j].tagtheoreticalandappliedgenetics,1998,96(8):1104-1109。
sequencelisting
<110>江苏省农业科学院
<120>一种小麦功能性nam-b1基因的分子标记及其应用
<130>
<160>2
<170>patentinversion3.3
<210>1
<211>24
<212>dna
<213>人工序列
<400>1
catagaaggaagtggcggaatact24
<210>2
<211>27
<212>dna
<213>人工序列
<400>2
ggattattcgattatttaattgcagcg27
- 还没有人留言评论。精彩留言会获得点赞!