含CCL5和SSTR2基因的重组痘病毒及其制备方法与流程
本发明属于基因工程和肿瘤生物治疗领域,具体涉及一种含ccl5和sstr2基因的重组痘病毒及其制备方法。
背景技术:
溶瘤痘病毒作为一种肿瘤治疗药物和基因治疗载体近年来发展迅速,痘病毒携带抗癌基因可提高其溶瘤效应,许多基因改造的靶向性溶瘤痘病毒相继进入临床试验,显示出广阔的应用前景。目前已进入临床试验的溶瘤痘病毒中,插入gm-csf基因的wyeth株重组痘病毒jx-594是最早进入临床试验的重组痘病毒,也是目前临床试验研究最多的重组痘病毒。
在jx-594的已完成的ⅰ、ⅱ期临床试验中,并无明显客观疗效报道,为提高溶瘤痘病毒的疗效,ⅲ期临床试验中jx-594瘤内注射联合化疗药物索拉菲尼协同抗肿瘤作用,该计划正在招募中,疗效还未可知。而进入临床试验的重组痘病毒给药方式为瘤内注射或静脉注射,由于各种免疫、生化或物理屏障的作用,导致病毒递送效率很低,病毒进入体内后很快被补体、抗病毒抗体及各种吞噬细胞等破坏,不能发挥有效的抗肿瘤作用,这也是之前的重组痘病毒未能发挥完全溶瘤作用的原因之一。cik细胞具有向肿瘤组织聚集的特性,同时大量临床应用证明cik细胞大剂量回输的安全性,用cik细胞荷载重组痘病毒就显示出明显的优越性。
而痘病毒的溶瘤潜能取决于所选择的病毒株,研究已显示,与wyeth、lister和copenhangen株均具有溶瘤潜能,而wr株具有最强的溶瘤效应,显然与wyeth等其它痘病毒株相比,痘病毒wr株具有更强的感染力和细胞裂解能力,并有悠久的实验室研究背景且完成了基因组全序列的测定,因此痘病毒wr株是作为构建重组痘病毒的首选。含人ccl5和人sstr2基因的重组溶瘤痘病毒rvv-ccl5-sstr2-luc+尚未见报道。
技术实现要素:
本发明提供了一种含ccl5和sstr2基因的重组痘病毒,其为含有人ccl5和人sstr2基因的wr株重组痘病毒。
本发明方法利用ccl5与cik细胞表面高表达的ccr5相匹配的独特优势以及sstr2可以定向诱导奥曲肽靶向抑制肿瘤的特点,可显著提高重组痘病毒的靶向溶瘤活性,使荷载重组痘病毒的cik细胞免疫治疗的安全性得到保障,对cik细胞荷载重组病毒联合奥曲肽靶向肿瘤细胞的免疫治疗在临床的推广应用起到了积极的作用。
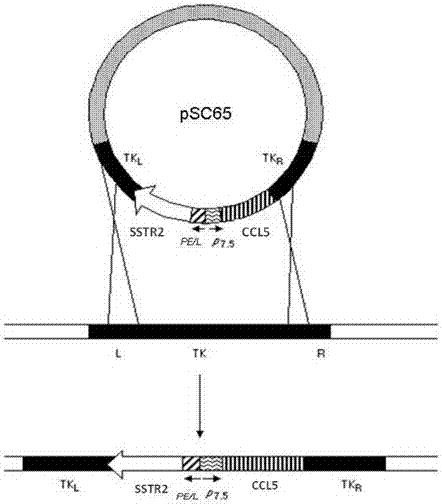
psc65质粒具有与痘病毒tk基因同源的侧翼序列,可用作重组外源基因至痘病毒基因组的载体。将目的基因ccl5和sstr2以及荧光素酶报告基因luciferase克隆至psc65中得到重组的痘病毒真核表达载体psc65-ccl5-sstr2-luc+,并与野生型痘病毒在细胞内进行同源重组得到重组痘病毒rvv-ccl5-sstr2-luc+。
上述含ccl5和sstr2基因的重组痘病毒的制备方法,
(1)分别以含人ccl5和人sstr2cdna序列的质粒为模板,采用如下引物进行pcr扩增,将pcr产物和psc65质粒分别经内切酶酶切、电泳、切胶纯化回收,获得相应dna片段,然后连接、转化,挑取阳性细菌克隆小提质粒,其中人ccl5基因插入p7.5启动子下游,人sstr2基因插入pe/l启动子下游;阳性细菌克隆小提质粒经pcr、电泳和测序鉴定序列正确者命名为psc65-ccl5-sstr2-luc+;
ccl5f:5’-agcgcagagggcagtagcaat-3’
ccl5r:5’-tgatgtactcccgaaccca-3’;
sstr2f:5’-aagcaggctggtaccggtccggaattccc-3’
sstr2r:5’-ataggccggccaggatcgatccagacatgat-3’;
(2)将psc65-ccl5-sstr2-luc+质粒与痘病毒wr株进行同源重组,然后筛选阳性重组子,经纯化、验证,最终获得含人ccl5和sstr2基因的重组痘病毒rvv-ccl5-sstr2-luc+;
(3)检测cik细胞荷载重组痘病毒rvv-ccl5-sstr2-luc+体外杀伤肿瘤的效应。
重组痘病毒表达ccl5,与cik细胞表面高表达的ccr5相匹配具有独特优势,且荷载该重组溶瘤痘病毒的cik细胞高效杀伤肿瘤细胞后,释放出的溶瘤痘病毒能发挥二次杀伤肿瘤细胞的作用,随之所产生的在肿瘤区域稳定且持续的高浓度趋化因子ccl5使肿瘤细胞从无免疫原性变为强免疫原性,不但激活和增强机体的特异性抗肿瘤免疫反应,定向诱导t、nk细胞靶向杀伤肿瘤,同时,还将募集更多荷载了该重组溶瘤病毒的cik细胞到达肿瘤部位,发挥“免疫/溶瘤”双重协同抗肿瘤作用。
肿瘤细胞中是否有sstr2基因的表达,及其表达水平的高低,将直接影响到ssa对肿瘤的治疗效果。其中,奥曲肽(oct,sms201-995)是最常用的ssa,能与sstr2特异性结合。通过重组sstr2基因的溶瘤病毒将其导入肿瘤细胞内,提高sstr2在肿瘤细胞表面的表达水平,将精确定向并诱导奥曲肽到达肿瘤部位抑制肿瘤生长。
构建含ccl5和sstr2基因的重组痘病毒,后期实验中利用cik细胞荷载该痘病毒,不仅避免重组痘病毒被机体免疫系统所清除,而且cik细胞杀伤肿瘤后释放的携带抗癌基因ccl5和sstr2的重组痘病毒,又可发挥二次杀伤肿瘤的效应,发挥出“细胞-基因-病毒”的协同抗肿瘤作用。
本发明相对于现有技术的优点和技术效果如下:
(1)本发明运用的分子水平技术简便易行,稳定可靠;
(2)通过本发明制备得到的重组痘病毒rvv-ccl5-sstr2-luc+具有插入外源基因容量大而其遗传稳定性不受影响的优点;
(3)通过本发明制备得到的重组痘病毒rvv-ccl5-sstr2-luc+在细胞质内复制增殖,并不掺入真核细胞基因组内,不受宿主基因组的影响;
(4)通过本发明制备得到的重组痘病毒rvv-ccl5-sstr2-luc+是一种溶细胞病毒,复制周期快,细胞受感染后在三天内死亡,且宿主范围广,可在体外一定期限内不断扩大培养,且活性稳定,适用于批量生产;
(5)本发明得到的重组溶瘤痘病毒rvv-ccl5-sstr2-luc+自身携带一个失活的tk基因,用于增强病毒的肿瘤杀伤特异性;这一特性使得该溶瘤病毒不仅可利用肿瘤细胞自身表达的tk帮助病毒自身复制,直接发挥溶瘤作用;并且,由于其无法有效利用正常细胞内的复制装置,不能在正常细胞中进行复制,因此具有良好的安全性;
(6)通过本发明制得重组痘病毒后,进行体外实验综合评估cik细胞介导rvv-ccl5-sstr2-luc+联合奥曲肽靶向杀伤大肠癌细胞的疗效,为后期体内实验探讨cik细胞介导rvv-ccl5-sstr2-luc+靶向治疗大肠癌发挥溶瘤效应的作用机制提供前期准备和实验基础。
附图说明
图1为重组质粒psc65-ccl5-sstr2-luc+的琼脂糖凝胶电泳鉴定图,其中图a为ccl5-luc片段(约2000bp)pcr产物琼脂糖凝胶电泳鉴定图,泳道1:dnamarker,泳道2-9:psc65-ccl5-luc单克隆pcr产物鉴定;图b为sstr2片段(约1110bp)pcr产物琼脂糖凝胶电泳鉴定图,泳道1:dnamarker,泳道2-8:sstr2单克隆鉴定pcr产物;
图2为用同源重组方法构建重组痘病毒rvv-ccl5-sstr2-luc+的原理图;
图3a为wb检测rvv-ccl5-sstr2-luc+感染hela细胞60h后sstr2蛋白表达水平,b为相应组条带的灰度分析,结果表明双基因病毒rvv-ccl5-sstr2-luc+的sstr2蛋白表达水平显著高于对照病毒rvv-luc+(**p<0.01);
图4为elisa检测rvv-ccl5-sstr2-luc+感染hela细胞60h后上清中ccl5蛋白表达水平,结果表明双基因病毒rvv-ccl5-sstr2-luc+的ccl5蛋白表达水平显著高于对照病毒rvv-luc+(*p<0.05);
图5为cck8检测cik细胞荷载重组痘病毒rvv-ccl5-sstr2-luc+并联合奥曲肽抑制肿瘤细胞的增殖情况,其中a为其对大肠癌细胞dld1增殖的抑制,b为其对大肠癌细胞hct116增殖的抑制,c为其对宫颈癌细胞hela增殖的抑制。
具体实施方式
下面通过附图和实施例对本发明作进一步详细说明,但本发明的保护范围不局限于所述内容,实施例中方法如无特殊说明的,均采用常规方法。
实施例1:含ccl5和sstr2基因的重组痘病毒的制备方法,具体内容如下:
1、主要材料
(1)bs-c-1(3142c0001000000033),非洲绿猴肾细胞系,购自中国典型培养物保藏中心细胞库(chinacenterfortypeculturecollection,cctcc),bsc-1细胞是病毒载体转染的理想宿主,用于同源重组和病毒滴度测定。
(2)143b(atcc®crl-8303tm),人骨肉瘤细胞系,购自美国模式培养物集存库(americantypeculturecollection,atcc),143b细胞是一株人胸腺激酶缺陷(tk-)的细胞系,用于重组痘病毒的筛选。
(3)hela:人子宫颈癌细胞系,dld1:结肠癌细胞系,hct116:结直肠癌细胞系,购自中国科学院典型培养物保藏委员会昆明细胞库-中国科学院昆明动物研究所。
(4)psc65,购自biovector中国质粒载体菌种细胞基因保藏中心-ntcc国家典型培养物保藏中心,作为构建人ccl5和sstr2基因的痘病毒真核表达载体质粒。含t2a-luc的克隆载体质粒phblv-cmvie-zsgreen-t2a-luc和含ccl5和sstr2基因的克隆载体质粒pdonr223购自上海汉恒生物科技有限公司。
(5)痘病毒vacciniavirus(atcc®vr-1354tm),(wr,nihtc-adapted)株,购自biovector中国质粒载体菌种细胞基因保藏中心-ntcc国家典型培养物保藏中心,作为病毒载体。
细胞培养瓶、培养板均为corning公司(美国)产品;formaco2培养箱(美国);nikon倒置显微镜(日本);大肠杆菌菌株dh5α购自invitrogen(美国);限制性内切酶、凝胶回收试剂盒购自axygen(美国);质粒dna小、大量抽提试剂盒购自天根生化科技(北京)有限公司;hyclonerpmi-1640、mem购自赛默飞世尔生物化学制品(北京)有限公司;细胞培养操作均在二级生物安全实验室的细胞操作间进行,病毒扩大及培养操作在生物安全柜内进行。
2、重组人ccl5、sstr2基因的痘病毒真核表达载体psc65-ccl5-sstr2-luc+的分步构建
引物设计与合成:在ncbi上搜索psc65质粒的全序列sequence57frompatentwo9932646并参考相关文献,用blast系统对各部分序列进行比对分析。可知该质粒全长7252bp,以pbr322为主要骨架(碱基5091-6931),包含pbr322的rep复制子和amp抗性基因。外源基因在合成的早晚期启动子pe/l和p7.5的指导下表达,同时载体上还带有用于同源重组的病毒tk基因的左右侧翼。使用primerprimer5软件,参照人ccl5[nm_002985.2]和人sstr2[nm_001050]基因分别设计合成引物,引入合适酶切位点,将ccl5和sstr2分别插入psc65质粒的p7.5和pe/l启动子下游,此外在ccl5后连接t2a自裂肽再连接luciferase,即p7.5启动子下游为:ccl5-t2a-luc+;
ccl5f:5’-agcgcagagggcagtagcaat-3’
ccl5r:5’-tgatgtactcccgaaccca-3’;
sstr2f:5’-aagcaggctggtaccggtccggaattccc-3’
sstr2r:5’-ataggccggccaggatcgatccagacatgat-3’;
构建步骤如下:(1)xho/eco双酶切psc65载体,切除掉lacz(约3kb),然后克隆入ccl5-t2a-luc,构建psc65-ccl5-t2a-luc重组载体。
酶切体系(37℃孵育2h):
载体酶切完成后进行琼脂糖凝胶电泳鉴定和胶回收。
目的片段与载体连接,反应体系为(连接液在37℃温育30min):
将连接后的片段进行转化,挑选阳性克隆菌落,并进行菌液pcr经琼脂糖凝胶电泳鉴定(图1a)和测序鉴定,鉴定正确者命名为pcs65-ccl5-luc,可进行下一步的构建工作。
(2)kpni单酶切psc65-ccl5-t2a-luc重组载体,插入sstr2序列,完成psc65-ccl5-sstr2-luc重组载体的构建
酶切体系如下(37℃孵育2h):
将处理好的目的片段与酶切后载体连接(37℃下孵育30min),反应体系为:
连接后产物经转化、涂板以及挑选阳性克隆摇菌并进行菌液pcr,经琼脂糖凝胶电泳鉴定(图1b)和测序鉴定后,序列正确者命名为psc65-ccl5-sstr2-luc+,大提质粒,保存备用。
3、psc65-ccl5-sstr2-luc+转染经痘病毒wr株感染的细胞(同源重组(图2)),并完成重组痘病毒ccl5和sstr2的表达验证
前一天接种bs-c-1细胞于六孔板中,5×105cell/孔,待bs-c-1细胞长至70-80%融合度时,弃培养液,加入lml经mem稀释的痘病毒wr株,病毒滴度为moi=0.05pfu/cell,bs-c-1细胞经wr痘病毒感染l-2h后,用lipofectamine2000(invitrogen)将重组质粒psc65-ccl5-sstr2-luc+转染细胞,37℃5%co2培养箱中培养4-6h;弃上清,加入3ml含10%fbs的mem培养基,继续培养2-3天;培养期间于显微镜下观察细胞状态,直至大部分细胞展示出被感染的病理现象,收集细胞离心重悬于lmlmem中,分别依次置于-80℃和37℃水浴中冻融,重复冻融三次;超声波处理以上冻融液1min后,300×g,4℃,离心5min,将上清转入一干净的ep管中,即为混合病毒液(含重组痘病毒和野生型痘病毒)。混合病毒液经筛选纯化、扩增,并提取重组痘病毒dna,通过pcr分析,确定正确的重组痘病毒,即命名为携带了ccl5和sstr2基因并以luc为报告基因的重组痘病毒:rvv-ccl5-sstr2-luc+。
4、蔗糖梯度离心法浓缩纯化重组痘病毒rvv-ccl5-sstr2-luc+
离心机转头预冷至4℃,取以上hela细胞培养重组病毒冻融液转入50ml离心管,300×g,4℃,离心5min,弃沉淀,取上清;将上清缓慢加在2倍体积36%蔗糖溶液之上,12500rpm,4℃,离心80min,小心移除上清,沉淀即为重组痘病毒rvv-ccl5-sstr2-luc+,将沉淀悬浮于约10ml10mmtris-hcl(ph9.0)中;重复36%蔗糖纯化步骤1次,最终将重组痘病毒rvv-ccl5-sstr2-luc+悬浮于1ml10mmtris-hcl(ph9.0)中,-80℃保存,待滴度测定确定重组痘病毒滴度(pfu/ml)。
实施例2:rvv-ccl5-sstr2-luc+感染大肠癌细胞系后,wb检测sstr2和elisa检测ccl5蛋白表达水平
前一天接种人结直肠癌细胞系(hct116,dld1)于六孔板中,37℃5%co2培养箱中培养过夜。重组痘病毒感染hela细胞60h后收取上清和细胞,其中上清用elisa检测ccl5蛋白表达水平,细胞提取总蛋白wb检测sstr2蛋白水平,结果显示感染rvv-ccl5-sstr2-luc+组的sstr2蛋白在hela细胞中表达水平显著高于对照组rvv-luc+(p<0.01)(图3)。图4结果表明双基因病毒rvv-ccl5-sstr2-luc+的ccl5蛋白表达水平显著高于对照病毒rvv-luc+(*p<0.05)。
实施例3:体外检测cik细胞荷载重组痘病毒rvv-ccl5-sstr2-luc+对肿瘤细胞增殖的抑制作用
将通过上述方法制得的重组痘病毒rvv-ccl5-sstr2-luc+,在体外扩大培养进行滴度测定后储存于-80℃,可进行cik细胞荷载重组痘病毒对人大肠癌细胞和人宫颈癌的杀伤实验,分别在杀伤24h、48h、72h、96h检测其细胞的活力。结果显示,cik细胞荷载重组痘病毒对大肠癌细胞dld1的增殖有一定的抑制作用(图5a),其中cik组对dld1细胞的抑制作用最弱,rvv-luc+/cik组由于荷载溶瘤病毒后对dld1细胞的抑制作用稍微增强,rvv-ccl5-sstr2-luc+/cik组由于抗癌基因的作用对dld1细胞的抑制作用明显增强,rvv-ccl5-sstr2-luc+/cik+oct组在抗癌基因和奥曲肽的联合作用下对dld1细胞的抑制作用最强,在hct116和hela细胞中可以得到同样的结果(图5b和5c)。由此证明cik细胞荷载重组痘病毒rvv-ccl5-sstr2-luc+并联合奥曲肽对人大肠癌细胞和人宫颈癌细胞的杀伤效果最好。
序列表
<110>昆明理工大学
<120>含ccl5和sstr2基因的重组痘病毒及其制备方法
<160>4
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工序列
<400>1
agcgcagagggcagtagcaat21
<210>2
<211>19
<212>dna
<213>人工序列
<400>2
tgatgtactcccgaaccca19
<210>3
<211>29
<212>dna
<213>人工序列
<400>3
aagcaggctggtaccggtccggaattccc29
<210>4
<211>31
<212>dna
<213>人工序列
<400>4
ataggccggccaggatcgatccagacatgat31
- 还没有人留言评论。精彩留言会获得点赞!