一种大肠杆菌噬菌体及其应用的制作方法
本发明涉及生物工程领域,特别是一种肠出血性大肠杆菌噬菌体vb_ecom_c1及其应用。
背景技术:
肠出血性大肠杆菌(enterohemorrhagicescherichiacoli,ehec)是产志贺毒素大肠杆菌(shiga-toxinproducingescherichiacoli,stec)的一类亚群,1982年被证实是一种重要的人畜共患病原菌,可以引起人不同程度腹泻、出血性结肠炎(hemorrhagiccolitis,hc),溶血性尿毒综合症(haemolyticuraemicsyndrome,hus)等,严重的可导致死亡。
肠出血性大肠杆菌(enterohemorrhagicescherichiacoli)广泛分布于自然界的土壤、水和农产品及林产品中,在人和动物的肠道及呼吸道内也常见,是典型的条件致病菌,常于动物抵抗力下降时引起暴发性流行,如鹅腹泻、家兔的肠炎、雏鸡腹泻、绵羊的传染性口炎、大熊猫的腹泻、猪腹泻等。
青霉素类、头孢类和碳青霉烯类等β-内酰胺类药物是防治肠出血性大肠杆菌感染最主要的药物,其中青霉素类和头孢类药物在治疗肠出血性大肠杆菌感染中广泛使用,但由于长期的药物选择性压力,病原菌表现出了对这些药物严重的耐药性。
华南农业大学刘健华教授和中国农业大学沈建忠教授(liuyy,wangy,walshtr,yilx,zhangr,spencerj,doiy,tiang,dongb,huangx,yulf,gud,renh,chenx,lvl,hed,zhouh,liangz,liujh,shenj.2016.emergenceofplasmid-mediatedcolistinresistancemechanismmcr-1inanimalsandhumanbeingsinchina:amicrobiologicalandmolecularbiologicalstudy.lancetinfectdis16:161-168.)在动物和住院患者中发现多粘菌素耐药的新基因mcr-1(liuyy,wangy,walshtr,yilx,zhangr,spencerj,doiy,tiang,dongb,huangx,yulf,gud,renh,chenx,lvl,hed,zhouh,liangz,liujh,shenj.2016.emergenceofplasmid-mediatedcolistinresistancemechanismmcr-1inanimalsandhumanbeingsinchina:amicrobiologicalandmolecularbiologicalstudy.lancetinfectdis16:161-168.)该基因由质粒所携带,可以在不同菌株间进行水平转移。此前仅报道过由基因突变导致的多粘菌素耐药,而这种耐药性是不会在细菌间进行传播的。由于多粘菌素被认为是对抗多重耐药细菌的最后一道防线,因此,质粒携带的mcr-1基因一经发现,立即引起全球广泛关注。根据该文献报道mcr-1基因主要存在于中国,可能已传播至东南亚国家,目前尚无良好的防控方法。
噬菌体是一种杀灭细菌的病毒,寄生于细菌并利用细菌来复制繁殖,最后将细菌裂解死亡,由于其天然的杀菌特性,而被科学家认为是潜在的“超级细菌的有效克星”,而噬菌体对宿主细菌的特异性高、强大的裂解能力以及对人类和动物(产品)没有毒副作用、不会产生药物残留等优势而显示出了比抗生素更加广阔的应用前景和价值。
噬菌体制剂的研制开发和应用无疑是解决这一问题的理想方法,在噬菌体产品开发方面,东欧一些国家已经批准某些噬菌体产品应用于人类皮肤金葡菌感染的治疗,美国也批准某些产品应用于动物性食品的表面消毒,如2006年美国fda批准李斯特噬菌体制剂在禽产品和芝士上应用,用于消毒。目前利用噬菌体消杀环境中肠出血性大肠杆菌(特别是mcr-1阳性肠出血性大肠杆菌)尚未见报道。
技术实现要素:
针对上述问题,本发明提供一种能裂解肠出血性大肠杆菌的噬菌体vb_ecom_c1,该噬菌体具有较宽的裂解谱,不仅可以裂解mcr-1阳性肠出血性大肠杆菌,也可以裂解不携带mcr-1的肠出血性大肠杆菌,既可以裂解标准菌株atcc25922,也可以裂解从环境中或者发病动物粪便中分离的肠出血性大肠杆菌临床株,可以单独或与其他物质复配使用,为消毒净化环境提供一种安全、无毒的噬菌体消杀产品,本发明是这样实现的:
一种大肠杆菌噬菌体vb_ecom_c1,其保藏号为cctccm2017190;申请人将该噬菌体自命名为vb_ecom_c1;该噬菌体具有呈正二十面体的头部和可伸缩的尾部;噬菌体在1.2%的lb琼脂培养基上可以形成透亮空斑,周围无晕环,边缘清晰规则,直径为0.5-1mm;基因组核酸的酶切图谱显示该噬菌体核酸是双链dna(dsdna);根据国际病毒分类委员会(ictv)2005年发表的《病毒分类—国际病毒分类委员会第八次报告》,vb_ecom_c1属于肌尾病毒科(myoviridae)。该噬菌体在30-70℃中放置60min,活性稳定,在80℃中则失活;处于ph5.0-10.0时,其效价与初始效价无显著性差异。
进一步,本发明所述肠出血性大肠杆菌噬菌体在制备防治由肠出血性大肠杆菌感染的药物(包括粉剂和液体剂型)中的应用,特别是在制备防治由mcr-1阳性肠出血性大肠杆菌引起的动物腹泻药物中的应用,上述药物可以用于防治人和动物(鸡、猪、牛、鹅、鸭)肠出血性大肠杆菌感染。
进一步,本发明所述肠出血性大肠杆菌噬菌体在杀灭环境中肠出血性大肠杆菌中的应用,特别是杀灭养殖场环境中mcr-1阳性肠出血性大肠杆菌中的应用;所述养殖场环境是指畜禽体表、饲料、养殖器具、地面、墙面、粪便、垫料及其他空间环境。
与现有技术相比,本发明的有益效果在于:
(1)肠出血性大肠杆菌噬菌体vb_ecom_c1具有较强的杀灭活性和较宽的裂解谱,既可以特异性裂解mcr-1阳性肠出血性大肠杆菌,也可以杀灭不含mcr-1基因的其它多重耐药的肠出血性大肠杆菌,应用于制备防治肠出血性大肠杆菌感染的药物中可实现广谱杀菌的效果。
(2)该噬菌体vb_ecom_c1经小鼠试验,毒副作用小,安全性高;由于mcr-1阳性肠出血性大肠杆菌噬菌体具有较好的亲水相,容易配制成喷洒液、药浴液或注射液,对环境的mcr-1阳性肠出血性大肠杆菌的污染可进行有效杀灭。
附图说明
图1.vb_ecom_c1噬菌斑照片。
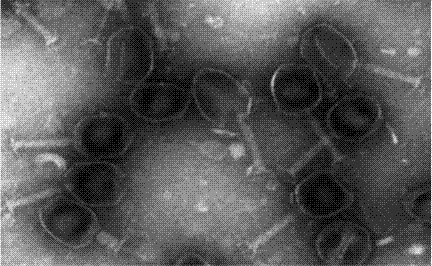
图2.噬菌体vb_ecom_c1的透射电镜照片。
图3.温度对噬菌体vb_ecom_c1活性影响示意图。
图4.ph值对噬菌体vb_ecom_c1活性影响示意图。
图5.培养基中噬菌体vb_ecom_c1杀菌效果示意图。
图6.鹅料槽中噬菌体vb_ecom_c1杀菌效果示意图。
具体实施方式
为方便理解本发明的技术方案,以下结合具体实施例对本发明做进一步说明,下述实施例中所涉及的试剂、器材,若非特别说明,均由商业渠道购买获得。实施例涉及的菌株、试剂及培养基:
实施例中涉及的宿主菌为mcr-1阳性肠出血性大肠杆菌临床株,为江苏地区某鹅场病鹅腹泻粪便中分离得到,由江苏省农业科学院保藏。
1mol/l无菌cacl2溶液(1l):用天平称量111gcacl2固体,倒入烧杯加水溶解,将溶液倒入1l容量瓶并用蒸馏水润洗烧杯2-3次,润洗液一并倒入容量瓶,再向容量瓶里加蒸馏水至刻度为止,混匀后高压灭菌备用。
蛋白胨水(200ml):称取4g蛋白胨,1g氯化钠于200ml蒸馏水中,调节ph为7.4后,121℃高压灭菌15min,冷却备用。
1.2%lb琼脂培养基/平板(200ml):称取2g胰蛋白胨,2g氯化钠,1g酵母粉及2.4g琼脂于200ml蒸馏水中,加热煮沸至完全溶解,121℃高压灭菌15min,冷却备用。
0.6%lb琼脂培养基/平板(200ml):称取2g胰蛋白胨,2g氯化钠,1g酵母粉及1.2g琼脂于200ml蒸馏水中,加热煮沸至完全溶解,121℃高压灭菌15min,冷却备用。
lb液体培养基(200ml):称取2g胰蛋白胨,2g氯化钠,1g酵母粉于200ml蒸馏水中,加热煮沸至完全溶解,121℃高压灭菌15min,冷却备用。
sm溶液(1l):称取6.055gtris于20ml蒸馏水溶解,使用浓盐酸调节ph为7.5,定容至50ml,然后加入5.8gnacl和2gmgso4,溶解后定容至1l,121℃高压灭菌15min,冷却备用。
实施例1噬菌体分离及制备
将宿主菌划线接种于1.2%lb琼脂培养基上,培养过夜后,挑取单克隆接种于1mllb液体培养基中,37℃振荡培养5-6h后作为宿主菌培养物备用。
2016年夏季,采集江苏省常州市某鹅场污水,取上清经双层滤纸过滤,10000rpm离心20min,再用0.22μm滤膜过滤上清;取10ml过滤后的上清,加入0.5ml宿主菌过夜培养物,再加入无菌cacl2母液至终浓度1.25mm混匀后,加入20mllb液体培养基,室温作用30min,再放置于37℃培养6~8h后;然后取培养物以12000rpm,4℃,离心30min,取上清;取此上清10ml,再次加入0.5ml宿主菌过夜培养物,加入无菌cacl2母液至终浓度1.25mm混匀后,加入20mllb液体培养基,按上述培养方法培养离心,获得富集的上清;按照以上的试验方法再富集一次,将富集三次的上清用0.22μm滤膜过滤,形成噬菌体原液。
将1.2%lb琼脂平板分为2个区域:吸取以上宿主菌培养物0.1ml滴于平板正中央,用涂棒将菌液均匀地涂开;待其晾干后,取上述噬菌体原液10ml滴于其中一个区域;待自然晾干后,置于37℃培养箱培养10h后,观察滴加噬菌体区域有无空斑形成。
如果有空斑形成,证明有噬菌体存在。取噬菌体原液100ml,进行一系列的10倍稀释。取10-2、10-4和10-6稀释液各0.1ml与宿主菌培养物0.1ml混匀,室温作用15min后,加入约4ml融化的0.6%lb琼脂培养基,混匀后迅速倾倒入1.2%lb琼脂培养基平板上层,摇匀平置10min,待其凝固,置于37℃温箱培养12h后观察,获得形成单个噬菌斑的双层平板。
实施例2噬菌体扩增和纯化
在实施例1形成噬菌斑的双层平板上,用移液器的枪头挑取直径较大的单个噬菌斑,接种于3~5mllb液体培养基中,加入噬菌体宿主菌液0.1ml,混匀,室温作用15min,37℃培养10~14h,12000rpm,4℃离心10min,取上清,加入0.3%氯仿;重复双层实验,如此反复挑取4-5次单个噬菌斑,将噬菌体纯化成大小一样的噬菌斑。
取1ml新鲜培养的宿主菌,加0.3ml噬菌体裂解液(以单个噬菌体培养物与宿主菌分别按照1:1、1:10和1:100的比例)。37℃温育20min,使噬菌体颗粒吸附于宿主菌;加入100mllb液体培养基,再加入cacl2母液至终浓度1.25mm,37℃摇振培养12~16h,12000rpm,4℃离心10min,取上清,即为噬菌体裂解液。
peg纯化:在50ml裂解液中加入rnasea、dnaseⅰ至终浓度均为1μg/ml,37℃温育30min;加9.3gpeg8000,5.8gnacl,摇匀至溶解,冰浴1h或4℃过夜;4℃离心10000rpm10min,去上清液;加2mlsm液,充分洗涤沉淀,室温作用1h;加入等体积的氯仿抽提,温和振荡30s;4℃,5000rpm离心10min以分离有机相和亲水相,回收含有噬菌体颗粒的亲水相,获得纯化的噬菌体。
cscl等密度梯度离心纯化:离心管底部先缓慢加入1.6gm/cccscl10ml,再依次加入1.4gm/cccscl10ml,25%蔗糖5ml,噬菌体裂解液10ml,平衡;加入离心管套中,缓慢悬挂于转子中;打开超速离心机(optimal-80xpultracentrifuge,beckman)开关,设置转速30000rpm,时间120min,温度18℃;离心结束后待真空下降为0时,打开仓门,取出样品,关机;样品下端有一层白色带,即1.4gm/cc与1.6gm/cc间,用细针头从带侧面插入,小心吸取,20ml样品最终获得约5-8ml;将样品置于透析袋中,用10mmtris-hcl,ph为7.4,100mmmgcl2缓冲液进行透析,2l一次(10-14kd);最终将样品吸出,体积约为10ml,测定噬菌体效价。
采用双层平板法检测噬菌体效价:将以上纯化的噬菌体液进行10倍梯度稀释,取相应的几个梯度的噬菌体稀释液各0.1ml与宿主菌液0.1ml充分混匀,铺双层琼脂平板,37℃恒温培养10h左右,对每个琼脂平皿进行噬菌斑计数。选择出现100-200左右噬菌斑的平皿,根据稀释的倍数计算得到的噬菌体初始浓度即得噬菌体效价。纯化的噬菌体如图1所示,噬菌体在1.2%的lb琼脂培养基中可以形成透亮空斑,周围无晕环,边缘清晰规则,直径为1-2mm。
申请人将纯化的噬菌体自命名为vb_ecom_c1,在中国典型培养物保藏中心保藏,保藏单位地址:中国·武汉·武汉大学,邮编430072,保藏号:cctccm2017190,分类命名:大肠杆菌噬菌体(escherichiacoliphage),保藏日期为2017年4月13日。
实施例3噬菌体vb_ecom_c1透射电镜观察
取实施例2中peg纯化的噬菌体做电镜观察,具体操作步骤为:加10μl样本滴在铜网上,待其沉淀15min,用滤纸吸去多余的液体,用2%的磷钨酸(pta)染色1-2min,干燥后使用透射电镜(日立h-7650)观察;观测结果如图2所示,头部呈正二十面体,头部直径约为80nm,尾长约为110nm。根据国际病毒分类委员会(ictv)2005年发表的《病毒分类—国际病毒分类委员会第八次报告》,vb_ecom_c1属于肌尾病毒科(myoviridae)。
实施例4噬菌体vb_ecom_c1的温度和酸碱耐受性实验
取1ml实施例2获得的纯化的噬菌体(5.2×108pfu/ml)于30℃~80℃水浴分别作用30min和60min,将样品冷却后测其效价;分别取ph2.0~13.0的蛋白胨水和2.5×108pfu/ml纯化噬菌体等量混合,37℃水浴作用2h后测其效价。
温度检测结果如图3所示,噬菌体vb_ecom_c1在32~55℃分别作用30min和60min后,其活性无显著变化;在65℃和75℃作用下,活性有显著降低;80℃作用30min后,无噬菌体存活。
ph检测结果如图4所示,在ph为2.5和3时,检测不到噬菌体;ph为4.2和5.3时,其效价与初始效价相差较大,ph为6.0~10.5时,其效价与初始效价无显著性差异;而当ph大于11时,检测不到噬菌体。
实施例5噬菌体vb_ecom_c1宿主谱分析
将实施例2获得的噬菌体vb_ecom_c1效价调整为1010pfu/ml备用。
试验选择20株乳房炎病牛中分离的肠出血性大肠杆菌临床株和标准菌株atcc25922(购自atcc,)为对象,其中10株临床株携带有mcr-1基因,另外10株临床株为mcr-1基因阴性,对噬菌体vb_ecom_c1的宿主谱进行分析,具体操作如下:分别取20株肠出血性大肠杆菌临床株和2株标准菌株的过夜培养物100μl,滴加在1.2%lb培养基平板中央,用涂棒分别将它们涂制成均匀的菌苔。然后将每个平板平均分成两个区域,其中一个区域,取10μl噬菌体vb_ecom_c1滴加在菌苔表面,另一个区域滴加10μl生理盐水作对照,待液滴干燥后倒置于37℃培养12~16h,观察结果,如有噬菌斑产生则记为“+”,否则为“-”,结果如表1所示:
表1.噬菌体vb_ecom_c1的宿主谱分析
表1中菌株1-20均为申请人自命名的临床株,其中1-10为mcr-1基因阳性,11-20为mcr-1基因阴性。
由表1可见,噬菌体vb_ecom_c1对20株肠出血性大肠杆菌临床株中的13株有裂解作用,裂解率为65%,其中包括7株mcr-1阳性肠出血性大肠杆菌,同时vb_ecom_c1对标准菌株atcc25922也有裂解能力,说明该噬菌体具有宽裂解谱的特性。
实施例6噬菌体vb_ecom_c1在培养基中的杀菌效果
取一株mcr-1阳性肠出血性大肠杆菌的过夜培养物1.0ml,用lb液体培养基将其od600nm值调整为0.5(约为5×108pfu/ml),分别加入噬菌体vb_ecom_c15×104pfu/ml(moi=0.0001)、5×105pfu/ml(moi=0.001)、5×106pfu/ml(moi=0.01)、5×107pfu/ml(moi=0.1)和5×108pfu/ml(moi=1),5×109pfu/ml(moi=10)和5×1010pfu/ml(moi=100)于37℃静置培养,同时以不加噬菌体作为对照组。在培养的0、1、2、3、4、5、6、7h检测od600nm值的变化。
结果见图5,与正常细菌对照组相比,噬菌体vb_ecom_c1处理组,30min后,肠出血性大肠杆菌数量开始下降,且噬菌体浓度越大,细菌数量降低越明显,当moi>0.01时,1h时肠出血性大肠杆菌的数量已控制到较低值,且2h时od600nm的吸光值接近于0,说明噬菌体vb_ecom_c1在培养基中杀菌迅速而且彻底。
实施例7噬菌体vb_ecom_c1控制养殖环境中的mcr-1阳性肠出血性大肠杆菌的污染
以鹅场作为试验地点,选择一株mcr-1阳性肠出血性大肠杆菌临床株为试验菌株,将浓度为105cfu/ml的mcr-1阳性肠出血性大肠杆菌取1ml均匀喷洒在鹅料槽表面(约1m2),然后以1ml浓度为108pfu/ml噬菌体vb_ecom_c1(培养基为lb液体培养基)对料槽表面实施喷杀,1h后,使用平板计数法检测料槽表面mcr-1阳性肠出血性大肠杆菌的数量。
检测结果如图6显示,1h后,料槽表面mcr-1阳性肠出血性大肠杆菌的数量降到103cfu以下,5h后,料槽表面mcr-1阳性肠出血性大肠杆菌的数量降到10cfu以下,说明该噬菌体可以有效杀灭养殖环境(奶牛料槽表面)中的mcr-1阳性肠出血性大肠杆菌。
实施例8噬菌体vb_ecom_c1控制养殖环境中的mcr-1阴性肠出血性大肠杆菌的污染
以鹅场作为试验地点,选择一株不携带mcr-1基因的肠出血性大肠杆菌临床株为试验菌株,将浓度为105cfu/ml的肠出血性大肠杆菌取1ml均匀喷洒在鹅料槽表面(约1m2),然后以1ml浓度为108pfu/ml噬菌体vb_ecom_c1对料槽表面实施喷杀,1h后,使用平板计数法检测肠出血性大肠杆菌的数量。
检测结果显示,2h后,料槽表面肠出血性大肠杆菌的数量降到103cfu以下,5h后,料槽表面肠出血性大肠杆菌的数量降到10cfu以下,说明该噬菌体可以有效杀灭养殖环境(奶牛料槽表面)中的肠出血性大肠杆菌。
实施例9噬菌体vb_ecom_c1控制mcr-1阳性肠出血性大肠杆菌对饲料的污染
将过夜培养的mcr-1阳性肠出血性大肠杆菌调整浓度为105cfu/ml,用小型喷雾器(瓶)将1ml菌液均匀喷洒在摊开的100g鹅育肥饲料(上海金盟饲料有限公司)表面,摊开面积约1m2,然后将纯化的噬菌体vb_ecom_c1以108pfu/ml的浓度实施喷杀,喷施量1ml,2h后开始检测饲料中mcr-1阳性肠出血性大肠杆菌的数量。
检测结果显示,在以108pfu/ml浓度实施喷杀2h后,饲料中宿主菌的数量降到10cfu/g以下,说明该噬菌体可以有效杀灭饲料中污染的mcr-1阳性肠出血性大肠杆菌。
实施例10噬菌体vb_ecom_c1的安全性实验
6-8周龄雌性spf级balb/c小鼠,平均体重27±2g,共40只,购自扬州大学比较医学中心。将小鼠随机分为2组,每组20只;其中一组口服噬菌体vb_ecom_c1108pfu/0.25ml/只(实施例2提供);对照组口服等体积pbs。连续口服14d后,每组脱颈致死5只小鼠,观察内脏、消化道及黏膜变化情况;每组剩余的15只继续饲喂,每天取其粪便检测噬菌体数量变化。
结果显示,此剂量噬菌体对小鼠健康及日常行为没有影响,解剖检查未见任何异常,且在口服噬菌体结束7天后,在小鼠粪便中检测不到噬菌体。
因此认为,该大肠杆菌噬菌体vb_ecom_c1可应用于制备防治肠出血性大肠杆菌感染药物。
在实际使用中,大肠杆菌噬菌体vb_ecom_c1还可以用于杀灭环境中的肠出血性大肠杆菌(特别是mcr-1阳性肠出血性大肠杆菌),所述环境包括养殖场环境(如畜禽体表、饲料、养殖器具、地面、墙面、粪便、垫料)及空间环境。
- 还没有人留言评论。精彩留言会获得点赞!