一种富勒烯丙烯酸衍生物及其制备方法和应用与流程
本发明涉及光电材料领域,具体涉及一种富勒烯丙烯酸衍生物及其制备方法和应用。
背景技术
光伏电池能够将太阳能转变为人类方便使用的电能,是有效利用太阳能、解决人类所面临的能源危机和环境污染的重要途径之一。作为太阳能发电新技术之一,有机光伏器件质轻性柔,适合印刷、喷墨、打印等溶液低成本加工工艺,也容易制备大面积和柔性器件,受到科学界和工业界的广泛关注。近几年来,随着一大批高性能的聚合物和小分子光伏材料和界面材料的发明问世,有机光伏器件的效率已经突破了12%,展示了其光明的应用前景。虽然这一效率水平相比晶体硅光伏电池还有一定的差距,需要进一步的提高,但是有机光伏技术的实用化更需要解决器件稳定性的问题。
有机光伏器件目前采用的活性层是由给体和受体两种材料共混而成本体异质结结构。给体材料是p型半导体材料,体系富有电子,具有提供电子和传递空穴的能力,而受体材料是n型半导体材料,具有接受和传递电子的能力。高效率的光电转换要求这两种材料要形成互穿网络式的纳米级微相分离结构,各材料相的宽度最好保持在20纳米尺度以下。但是,由于两种材料分子之间不存在强的相互作用,即使这两种材料通过各种手段获得较为理想的活性层结构,所获得结构也是热力学上的亚稳态,会随着时间的推移而逐渐演化,向宏观相分离结构发展。因此,有机光伏器件活性层结构的演化是其器件不稳定的重要内在因素,需要得到妥善的解决。为了解决这一问题,科学家提出开发和使用可后交联或后聚合的光伏材料制备电池器件活性层的策略。利用这种策略,在活性层获得较为理想微观结构之后,启动交联或聚合反应,从而可以固化活性层的微观结构,极大程度抑制了活性层的微观结构演变,提高电池器件的稳定性。
由于具有优异的电子接受能力和各向同性的电子传输能力,富勒烯衍生物历来是性能优异的有机光伏受体材料。特别是,[6,6]-苯基-富勒烯-丁酸甲酯(pcbm),包括c60的衍生物pc61bm和c70的衍生物pc71bm,是富勒烯受体材料中的典型代表,光伏性能突出,在领域中最常用。由于其球形分子形态,pcbm分子在活性层中非常容易迁移,经常可以看到活性层在热作用下出现大的聚集体,导致器件性能迅速衰减。基于上述策略,已有一些可交联或可聚合的富勒烯衍生物报道,比如j.mater.chem.2005,15,5158-5163;j.am.chem.soc.2010,132,4887-4893;j.mater.chem.c2014,2,7163–7167;j.mater.chem.a2015,3,21856-21863.。但这些工作报道的可交联或聚合的富勒烯衍生物基本上是利用pcbm作为原料,将其水解成羧酸衍生物,再与携带可聚合官能团的试剂反应,将可聚合的官能团引入至富勒烯衍生物,赋予其可聚合或可交联的性质。但是,这样的分子设计和合成方法得到的富勒烯衍生物,拥有比pcbm更大的可溶性侧链和分子形状,极大损伤了其单独作为受体材料时的光伏性能。
技术实现要素:
本发明所要解决的技术问题在于为了克服现有技术中以pcbm及其衍生物等分子为代表的富勒烯衍生物类有机光伏受体材料在活性层中非常容易迁移,经常在热作用下出现大的聚集体,导致器件性能迅速衰减等问题;或者已有的可交联或聚合的富勒烯衍生物拥有比pcbm更大的可溶性侧链和分子形状,极大损伤了其单独作为受体材料时的光伏性能等问题,因而提供了一种富勒烯丙烯酸衍生物及其制备方法和应用。本发明的富勒烯丙烯酸衍生物不仅合成方法简便,其还具有与pcbm类似的分子形状和大小,单独用于制备有机光伏器件时,表现出与pcbm相媲美的器件性能。另外,本发明中所述的富勒烯丙烯酸衍生物,其重要结构特征是含有可聚合的丙烯酸酯或丙烯酰胺基团,因此该衍生物可以通过热处理和光照处理,引发材料的现场聚合,从而可以固化有机光伏器件活性层的微观结构,保持电池器件的高效率和高稳定性。
本发明通过下述技术方案来解决上述技术问题。
本发明提供了一种富勒烯丙烯酸衍生物,其结构如式i所示:
其中,cn为含n个碳原子的富勒烯,n可取60、70、84或120;
(ar)m为m个各自独立地取代或未取代的芳香基团相连的共轭链段,m选自1-20的任一整数,ar各自独立地代表取代或未取代的芳基或杂芳基;所述的取代或未取代的芳基或杂芳基中的取代基各自独立地选自c1-c40烷基、c1-c40烷氧基、c1-c40卤代烷基、c1-c40-c(=o)-、c1-c40烷基芳基、c1-c40烷基硅炔基;
z为-o-或-nh-;
r1、r2、r3、r4、r5和r6作为碳骨架上的取代基,其各自独立地选自氢原子或c1-c40烷基;
下标x选自1-20的任一整数,其代表-(ar)m-和-z-c(=o)-之间亚甲基的个数;
下标y选自1-6的任一整数,其代表所述的富勒烯cn球体上加成的侧链的数目。
本发明中,所述的硅炔基为光电材料领域中常规所用的用于带来增溶效果的基团,其结构中包含硅原子和炔键,其具体连接成键方式不需特别限定。
本发明中,当y为1时,所示的式i结构表示为单加成的富勒烯衍生物;当y为2时,所示的式i结构表示为双加成的富勒烯衍生物;当y为3-6的任一整数时,所示的式i结构表示为多加成的富勒烯衍生物。
本发明中,ar各自独立地优选为单环芳基或稠环芳基;所述的稠环芳基由2-7个单环芳基互相稠合衍生而得,其中的单环芳基可相同或不同。
其中,所述的单环芳基优选选自下列五元或六元芳基的基团:
式中,z1、z2、z3、z4、z5和z6彼此相同或不同,在各自符合价态和芳香性要求的情况下,各自独立地选自碳、硅、氮、硫、氧、硒或碲原子。
本发明中,m优选为1。
本发明中,ar优选下述任一单环芳基:
其中,r7﹑r8和r9彼此相同或不同,各自独立地选自氢原子或c1-c40烷基。
本发明中,cn优选c60或c70。
本发明中,z优选-o-。
本发明中,r1、r2、r3、r4、r5和r6优选均为氢原子。
本发明中,下标x优选为2-10的任一整数,进一步优选为3、4、5、6、7、8或9。
本发明中,下标y优选1或2。
本发明中,所述的富勒烯丙烯酸衍生物进一步优选为如下任一化合物:
本发明进一步还提供了一种如式i所示的富勒烯衍生物的制备方法,其包括下述步骤:在有机溶剂中,在碱存在的条件下,将如式ii所示的富勒烯衍生物中间体与如式iii所示的丙烯酰氯中间体进行如下所示的缩合反应,即可;
其中,如式ii所示的富勒烯衍生物中间体与如式iii所示的丙烯酰氯中各取代基的定义均如上所述。
本发明中,当如式ii所示的富勒烯衍生物中间体中z为-o-时,所述的缩合反应即采用有机领域常规的醇与酰氯缩合为酯的机理进行;当如式ii所示的富勒烯衍生物中间体中z为-nh-时,所述的缩合反应即采用有机领域常规的胺与酰氯缩合为酰胺的机理进行。
本发明中,所述的缩合反应在有机合成领域此类反应常规所用的反应环境中进行,一般为无水无氧条件下,并以惰性气体如氩气或氮气进行体系保护。
本发明中,所述的有机溶剂可为有机合成领域此类反应常规所用,本发明优选醚类、卤代芳烃类和含氯烷烃类中的一种或多种,进一步优选四氢呋喃、氯苯、邻二氯苯和氯仿中的一种或多种。
本发明中,所述的有机溶剂的用量可为有机合成领域此类反应常规所用,本发明优选所述的如式ii所示的富勒烯衍生物中间体在所述的有机溶剂中的摩尔浓度为0.13:60mol/l。
本发明中,所述的碱可为有机合成领域此类反应常规所用,本发明中优选有机胺类如三乙胺和/或无机碱类如碳酸钠,进一步优选三乙胺。
本发明中,所述的碱的用量可为有机合成领域此类反应常规所用,本发明中优选所述的碱与所述的如式ii所示的富勒烯衍生物中间体的摩尔比为51:1。
本发明中,所述的如式iii所示的丙烯酰氯的用量可为有机合成领域此类反应常规所用,本发明中优选所述的如式iii所示的丙烯酰氯与所述的如式ii所示的富勒烯衍生物中间体的摩尔比为50:1。
本发明中,所述的缩合反应的反应温度可为有机合成领域此类反应常规所用,本发明优选反应温度为-30~150℃,进一步优选0~80℃。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选包括下述步骤:在无水无氧条件下,在氩气气氛中,将如式ii所示的富勒烯衍生物中间体和所述的碱置于所述的有机溶剂中,滴加如式iii所示的丙烯酰氯,滴毕,在所述的反应温度下反应,即可。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还进一步包括后处理过程,所述的后处理过程可为有机合成领域此类反应常规所用,本发明优选包括下述步骤:在所述的缩合反应结束后,加入水淬灭反应,水洗三次、氯仿萃取三次、无水硫酸钠干燥、旋转蒸发除去溶剂,即可。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还进一步包括产物纯化过程,所述的产物纯化过程可为有机合成领域此类反应常规所用,本发明优选所述的产物纯化过程包括下述步骤:将后处理所得的产物粗品通过柱层析色谱分离提纯,洗脱剂优选为二氯甲烷/石油醚;或包括下述步骤:通过凝胶渗透色谱(gpc)分离提纯。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还包括以下步骤:在有机溶剂中,在碱存在的条件下,将如式iv所示的腙类中间体与富勒烯cn进行如下所示的加成反应,即可;
其中,如式iv所示的腙类中间体与所述的富勒烯cn中各取代基的定义均如上所述。
本发明中,所述的加成反应采用有机合成领域此类反应常规反应条件和参数进行。
本发明中,所述的加成反应在有机合成领域此类反应常规所用的反应环境中进行,一般为无水无氧条件下,并以惰性气体如氩气或氮气进行体系保护。
本发明中,所述的有机溶剂为有机合成领域此类反应常规所用,本发明优选吡啶。
本发明中,所述的有机溶剂的用量为有机合成领域此类反应常规所用,本发明优选所述的如式iv所示的腙类中间体在所述的有机溶剂中的摩尔浓度为1.8:30mol/l。
本发明中,所述的碱为有机合成领域此类反应常规所用,一般为强碱,本发明优选醇钠和/或醇钾,进一步优选甲醇钠。
本发明中,所述的碱的用量为有机合成领域此类反应常规所用,本发明中优选所述的碱与所述的如式iv所示的腙类中间体的摩尔比为1:1-1.5:1,如1.5:1.3。
本发明中,所述的富勒烯cn的用量为有机合成领域此类反应常规所用,本发明中优选所述的富勒烯cn与所述的如式iv所示的腙类中间体的摩尔比为0.5:1-1.5:1。
本发明中,所述的富勒烯cn溶液优选以其溶液形式参与反应,进一步优选富勒烯cn的含氯溶剂的溶液;所述的含氯溶剂可以选用氯苯、邻二氯苯、氯仿中的一种或多种,优选氯苯和/或邻二氯苯。
本发明中,所述的加成反应的反应温度为有机合成领域此类反应常规所用,本发明优选室温至200℃,进一步优选50~150℃。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还包括以下步骤:在无水无氧条件下,在氩气气氛中,将如式iv所示的腙类中间体置于所述的有机溶剂中,加入所述的碱,室温处理后,再加入富勒烯cn的含氯溶剂的溶液,在所述的反应温度下反应,即可。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还进一步包括后处理过程,所述的后处理过程可为有机合成领域此类反应常规所用,本发明优选包括下述步骤:在所述的加成反应结束后,减压蒸馏除去溶剂,即可。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还进一步包括产物纯化过程,所述的产物纯化过程可为有机合成领域此类反应常规所用,本发明优选所述的产物纯化过程包括下述步骤:将后处理所得粗品通过柱层析色谱分离提纯,分别使用洗脱剂二硫化碳、二氯甲烷、氯仿/甲醇将产物分离出来。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还包括以下步骤:在有机溶剂中,将如式v所示的酮类化合物与对甲基苯磺酰肼(tsnhnh2)进行缩合反应,即可;
其中,如式v所示的酮类化合物与所述的如式iv所示的腙类中间体中各取代基的定义均如上所述。
本发明中,所述的缩合反应采用有机合成领域此类反应常规反应条件和参数进行。
本发明中,所述的缩合反应在有机合成领域此类反应常规所用的反应环境中进行,一般为无水无氧条件下,并以惰性气体如氩气或氮气进行体系保护。
本发明中,所述的有机溶剂为有机合成领域此类缩合反应常规所用,本发明优选醇类和/或醚类溶剂,所述的醇类溶剂进一步优选甲醇、乙醇和异丙醇中的一种或多种。
本发明中,所述的有机溶剂的用量为有机合成领域此类反应常规所用,本发明优选所述的如式v所示的酮类化合物在所述的有机溶剂中的摩尔浓度为0.05mol/l。
本发明中,所述的对甲基苯磺酰肼(tsnhnh2)的用量为有机合成领域此类反应常规所用,本发明中优选所述的对甲基苯磺酰肼(tsnhnh2)与所述的如式v所示的酮类化合物的摩尔比为1:1-2:1。
本发明中,所述的缩合反应优选还可加入催化剂促进反应,所述的催化剂为有机合成领域此类反应常规所用,本发明中优选布朗斯特酸,进一步优选有机酸如乙酸和/或无机酸如硫酸。
本发明中,所述的布朗斯特酸的用量为有机合成领域此类反应常规所用,并不需要特别限定,本发明中优选所述的布朗斯特酸与所述的如式v所示的酮类化合物的摩尔比0.005:1-0.1:1。
本发明中,所述的缩合反应的反应温度为有机合成领域此类反应常规所用,本发明优选室温至200℃,进一步优选为所述有机溶剂的常压回流温度。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还包括以下步骤:在无水无氧条件下,在氩气气氛中,将如式v所示的酮类化合物与对甲基苯磺酰肼(tsnhnh2)在所述的反应温度下进行缩合反应,即可;如反应体系还存在催化剂,所述的催化剂可与其他反应物料直接混合,反应体系中各物料加入顺序不需特别限定。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还进一步包括后处理过程,所述的后处理过程可为有机合成领域此类反应常规所用,本发明优选包括下述步骤:在所述的缩合反应结束后,浓缩除去溶剂,即可。
本发明中,所述的如式i所示的富勒烯衍生物的制备方法优选还进一步包括产物纯化过程,所述的产物纯化过程可为有机合成领域此类反应常规所用,本发明优选所述的产物纯化过程包括下述步骤:将后处理所得粗品通过柱层析色谱分离,洗脱剂为乙酸乙酯/石油醚,即可。
本发明中,所述的如式v所示的酮类化合物可采用本领域常规制备方法制备得到。
本发明还进一步提供了如式ii、iii或iv所示的各化合物:
本发明还进一步提供了一种如式ii所示的富勒烯衍生物中间体的制备方法,其包括以下步骤:在有机溶剂中,在碱存在的条件下,将如式iv所示的腙类中间体与富勒烯cn进行加成反应,即可;
其中,如式iv所示的腙类中间体与所述的富勒烯cn中各取代基的定义均如上所述。
其中,所述的加成反应的各反应条件和参数均如前所述。
本发明还进一步提供了一种如式iv所示的腙类中间体的制备方法,其包括下述步骤:在有机溶剂中,将如式v所示的酮类化合物与对甲基苯磺酰肼(tsnhnh2)进行缩合反应,即可;
其中,如式v所示的酮类化合物与所述的如式iv所示的腙类中间体中各取代基的定义均如上所述。
其中,所述的缩合反应的各反应条件和参数均如前所述。
本发明还进一步提供了一种如式i所示的富勒烯丙烯酸衍生物作为有机光伏电池的受体材料在制备有机光伏器件中的应用。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
1、本发明的可聚合的富勒烯丙烯酸衍生物不仅合成方法简便,还具有与pcbm相当的分子形状和尺寸,单独用于制备有机光伏器件时,表现出与pcbm相媲美的器件性能;
2、本发明的可聚合的富勒烯丙烯酸衍生物携带的丙烯酸酯或丙烯酰胺基团,非常容易通过热、光照等条件引发聚合,从而将小分子的富勒烯化合物转变为线型或交联的聚合物,固化活性层的微观结构,提高电池器件的效率和稳定性;
3、本发明的可聚合的富勒烯丙烯酸衍生物的开发和应用,有望获得兼具高效率和高稳定性的有机光伏器件,推动有机光伏技术的实用化。
附图说明
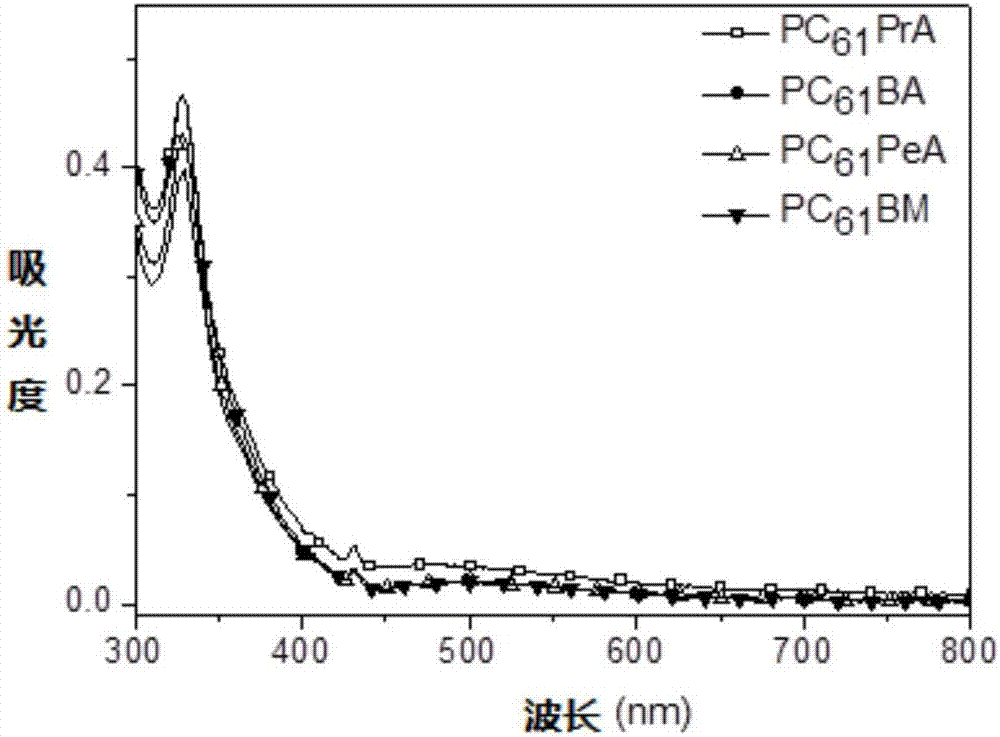
图1为化合物pc61pra、pc61ba、pc61pea和pc61bm氯仿溶液的紫外可见吸收谱图。
图2为化合物pc61pra、pc61ba、pc61pea和pc61bm在电位(-2.0~0)时的循环伏安曲线图。
图3为化合物pc61pra、pc61ba、pc61pea和pc61bm在电位(0~2.0)时的循环伏安曲线图。
图4为基于p3ht/pc61ba、p3ht/pc61bm太阳能电池的电流-电压曲线。
图5为p3ht/pc61ba和p3ht/pc61bm太阳能电池器件在150℃下热处理效率的变化曲线。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1:[6,6]-phenyl-c61-butylacrylate(pc61ba)的合成
(1)5-羟基-1-苯基戊酮对甲苯磺酰腙的合成
装置无水无氧处理,在氩气氛围下,向50ml的三口瓶加入0.64g化合物4-羟基-1-苯基丁酮(3.6mmol,1eq)和0.66g对甲苯磺酰肼(3.6mmol,1eq)。20ml重蒸过的甲醇加入到反应瓶中,在回流状态下反应6h后停止反应,浓缩后通过柱层析色谱分离,洗脱剂为乙酸乙酯/石油醚=2:3(v:v),得到0.94g5-羟基-1-苯基戊酮对甲苯磺酰腙,产率为75%。
(2)环加成反应制备富勒烯衍生物
装置无水无氧处理,在氩气氛围下,向250ml三口瓶中加入0.62g化合物5-羟基-1-苯基戊酮对甲苯磺酰腙(1.8mmol,1.3eq)、0.11g甲醇钠(2.0mmol,1.5eq)和重蒸过的吡啶30ml,室温反应20min。1gc60(1.38mmol,1eq)溶于150ml重蒸过的邻二氯苯溶剂中超声20min,将超声过的c60的邻二氯苯溶液加入到反应瓶中,回流条件下反应48h。反应结束后利用减压蒸馏将溶剂除去,通过柱层析色谱分离提纯,洗脱剂为二硫化碳时淋洗出未反应的c60、二氯甲烷作为洗脱剂淋洗出pc61boh、氯仿/甲醇作为洗脱剂淋洗出多加成的副产物,最后分别得到0.51g未反应的c60、0.45gpc61boh和0.33g多加成的副产物,目标产物的产率为45%。
1hnmr(400mhz,cdcl3/cs2,ppm):δ7.93(d,j=8hz,2h),7.54(t,j=6hz,2h),7.45(t,j=8hz,1h),3.74(t,j=8hz,2h),2.91(t,j=8hz,2h),1.90-1.98(m,2h),1.74-1.82(m,2h).
(3)丙烯酸酯化反应
装置无水无氧处理,在氩气氛围下,向100ml的三口瓶中加入0.12gpc61boh(0.13mmol,1eq)、0.92ml三乙胺(6.63mmol,51eq)和60ml重蒸的氯仿。冰水浴条件下,将0.54ml丙烯酰氯(6.49mmol,50eq)缓慢滴加到反应瓶中,滴加结束后室温反应3h。反应结束后加入水淬灭反应,水洗三次、氯仿萃取三次后用无水硫酸钠干燥,旋转蒸发除去溶剂。通过柱层析色谱分离提纯,洗脱剂为二氯甲烷/石油醚=1:1(v:v)得到产物74.5mg,产率为65%。
1hnmr(400mhz,cdcl3,ppm):δ7.93(d,j=8hz,2h),7.54(t,j=6hz,2h),7.47(t,j=6hz,1h),6.31(dd,j1=16hz,j2=20hz,1h),6.1(dd,j1=j2=12hz,1h),5.81(dd,j1=j2=12hz,j2=8hz,1h),4.24(t,j=8hz,2h),2.89-2.93(m,2h),1.88-1.95(m,2h).13cnmr(100mhz,cdcl3,ppm):δ166.22,147.89,145.09,144.38,142.91,140.72,138.00,137.53,136.90,132.09,130.70,128.39,128.35,128.17,89.00,64.12,52.16,33.80,29.70,28.47,23.43.maldift-ms:m/z936.1143(m+).
实施例2:[6,6]-phenyl-c61-propylacrylate(pc61pra)的合成
(1)4-羟基-1-苯基丁酮对甲苯磺酰腙的合成
合成方法同5-羟基-1-苯基戊酮对甲苯磺酰腙,不同之处在于4-羟基-1-苯基丁酮替代5-羟基-1-苯基戊酮和对甲苯磺酰肼反应。反应结束后将大部分溶剂旋转蒸发掉得到浓缩液,将浓缩液在冰箱中放置过夜析出白色固体,过滤出白色晶体,并用冷的甲醇洗涤一次,常温真空干燥得到产物2.9g,产率为80%。
(2)环加成反应制备富勒烯衍生物
合成方法同pc61boh,不同之处在于将4-羟基-1-苯基丁酮对甲苯磺酰腙替代5-羟基-1-苯基戊酮对甲苯磺酰腙。最后分别得到0.42g未反应的c60、0.45gpc61proh和0.2g多加成的副产物,目标产物的产率为45%。
1hnmr(400mhz,cdcl3,ppm):δ7.94(d,j=8hz,2h),7.55(q,j=8hz,2h),7.45(t,j=8hz,2h),3.84(t,j=8hz,2h),2.95-2.99(m,2h),2.10-2.17(m,2h).
(3)pc61pra分子的合成
方法同pc61ba的合成,不同之处在于将pc61proh替代pc61boh,最后得到粗产物86mg,粗产率为71%,通过gpc进一步提纯最终得到72mg产物,产率为60%。
1hnmr(400mhz,cdcl3,ppm):δ7.93(d,j=8hz,2h),7.56(t,j=6hz,2h),7.48(t,j=6hz,1h),6.40(dd,j1=j2=8hz,1h),6.11(dd,j1=j2=8hz,1h),5.81(dd,j1=j2=4hz,1h),4.35(t,j=4hz,2h),2.97-3.00(m,2h),2.21-2.27(m,2h).13cnmr(100mhz,cdcl3,ppm):δ161.30,143.86,142.85,140.21,138.91,138.14,137.32,135.90,133.17,132.73,131.84,127.19,126.10,123.64,123.45,75.02,59.09,46.75,26.03,21.57.maldift-ms:m/z922.0988(m+).
实施例3:[6,6]-phenyl-c61-pentylacrylate(pc61pea)的合成
(1)6-羟基-1-苯基己酮对甲苯磺酰腙的合成
合成方法同5-羟基-1-苯基戊酮对甲苯磺酰腙的合成,不同之处在于6-羟基-1-苯基己酮替代5-羟基-1-苯基戊酮和对甲苯磺酰肼反应。最后得到产物3.15g,产率为80%。
(2)pc61peoh分子的合成
方法同pcboh的合成,不同之处在于将6-羟基-1-苯基己酮对甲苯磺酰腙替代5-羟基-1-苯基戊酮对甲苯磺酰腙和c60反应。最后分别得到0.75g未反应的c60、0.85gpc61peoh和0.38g多加成的副产物,目标产物的产率为45%。
1hnmr(400mhz,cdcl3/cs2,ppm):δ7.88(d,j=6.9hz,2h),7.49(t,j=7.4hz,2h),7.43(t,j=7.4hz1h),3.64(t,j=6.3hz,2h),2.81-2.87(m,2h),1.84-1.88(m,2h),1.60-1.65(m,2h).1.55-1.56(m,2h).
(3)pc61pea分子的合成
合成方法同pc61ba的合成,不同之处在于将pc61peoh替代pc61boh和丙烯酰氯反应,最后得到产物21mg,产率为47%。
1hnmr(400mhz,cdcl3,ppm):δ7.92(d,j=6.8hz2h),7.54(t,j=6.2hz2h),7.46(t,j=5.9hz1h),6.39(dd,j1=1.1hz,j2=13.9hz,1h),6.10(dd,j1=8.3hz,j2=13.9hz,1h),5.82(dd,j1=1.1hz,j2=8.4hz,1h),4.18(t,j=5.3hz,2h),2.87-2.90(m,2h),1.87-1.92(m,2h).1.75-1.79(m,2h).1.58-1.62(m,2h).13cnmr(100mhz,cdcl3,ppm):δ166.44,149.10,148.18,145.34,144.64,143.28,143.14,142.43,142.26,141.15,140.88,138.17,137.67,137.24,132.26,130.77,128.68,128.48,128.28,8.29,64.65,52.50,34.38,28.78,26.88,26.30.maldift-ms:m/z950.1300(m+).
实施例4:[6,6]-phenyl-c71-propylacrylate(pc71pra)的合成
(1)pc71proh分子的合成
合成方法同pc61proh富勒烯衍生物,不同之处在于原料中利用c70替代c60和4-羟基-1-苯基丁酮对甲苯磺酰腙反应,产率为25%。
(2)pc71pra的合成
合成方法同pc61pra富勒烯衍生物,不同之处在于原料中利用pc71proh替代pc61proh和4-羟基-1-苯基丁酮对甲苯磺酰腙反应,产率为30%。
1hnmr(400mhz,cdcl3,ppm):δ7.94(2h),7.52(2h),7.44(1h),3.81(2h),2.53(2h),2.04(2h).
实施例5:富勒烯衍生物性能的表征
紫外可见吸收光谱的表征:将富勒烯衍生物溶解于三氯甲烷中,配制成10-5mol/l的溶液,测试富勒烯衍生物溶液状态的紫外可见光谱,所测谱图列于图1。结果表明,化合物pc61pra、pc61ba、pc61pea和pc61bm的光吸收范围相似,均在329nm、431nm、490nm(较弱、较宽)和690nm处有相同的吸收峰。更重要的是,它们在710nm处有相同的起始吸收峰,这说明它们拥有相同的光学带隙1.74ev。这些数据表明所发明的富勒烯衍生物具有和pc61bm一样的吸收范围和强度。
电化学性质的表征:采用ag/agno3电极作参比电极、pt电极作辅助电极,玻碳电极作工作电极,二茂铁(fc)作为参比,在邻二氯苯/乙腈混合溶剂中,以50mv/s的速度进行扫描,对pc61pra、pc61ba、pc61pea和pc61bm的电化学性质进行测试,所测谱图列于图2和图3。测试所得二茂铁的初始氧化电位efc/fc+为0.17ev。根据公式:lumo=-(ere,onset-efc/fc++4.8)ev以及homo=-(eox,onset-efc/fc++4.8)ev,计算出它们的homo和lumo能级,列于表1。
表1化合物pc61pra、pc61ba、pc61pea和pc61bm的基本性能
由表1可见所得的可聚合富勒烯衍生物pc61pra、pc61ba、pc61pea和pc61bm有着几乎一样的homo能级和lumo能级。
聚合性质的表征:将pc61ba滴涂到玻璃板上,在150℃下加热1h后,用氯仿洗去可溶解的部分,结果发现,有63.5%的物质残留在玻璃板上。这表明pc61ba具有可交联后固化性质。
实施例6:基于可聚合富勒烯衍生物的有机太阳能电池的制备和表征
有机太阳能的电池器件结构采用ito/pedot:pss/活性层/ca/al,其中活性层由聚(3-己基噻吩)(p3ht)和pc61ba(重量比1:1)共混而成。制备流程为:在洗净的ito导电玻璃上,旋涂(4000rpm)pedot:pss水溶液,然后在150℃下热处理15min形成pedot:pss导电层,随后在n2气氛的手套箱环境中(o2<1ppm,h2o<1ppm),将已配好的p3ht/pc61ba的氯苯溶液旋涂在pedot:pss层上。之后经150℃热处理1h进行聚合固化,在10-6mbar的真空下蒸镀ca及al电极,完成电池的制备。最后,电池置于aaa太阳光模拟系统(oriel94043a,450w)提供的光强100mwcm-2的光照下,由keithley2420源表测试其电流-电压曲线(j-v),表征器件性能。在同样条件下,制备基于p3ht/pc61bm的太阳能电池,测试其j-v曲线。两个器件的j-v曲线列于图4,基本器件参数列于表2。这些数据表明,基于p3ht/pc61ba的器件与p3ht/pc61bm相当。
表2基于p3ht/pc61ba和p3ht/pc61bm太阳能电池的器件参数
这些数据表明,基于p3ht/pc61ba的器件与p3ht/pc61bm相当。
将两个器件置于150℃下热处理不同时间,测试器件的光电转化效率的变化,结果列于图5。从中可以看出,器件p3ht/pc61ba效率的热稳定性要明显好于参比器件p3ht/pc61bm。在150℃下加热35h后,p3ht/pc61ba器件基本上维持在最高水平的80%,而p3ht/pc61bm器件的效率下降到其最高水平的40%左右。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!