一种检测登革病毒和寨卡病毒的双重荧光定量RT‑PCR试剂盒的制作方法
本发明属生物技术领域,涉及一种荧光定量rt-pcr检测试剂盒,具体涉及一种一步法双重实时荧光定量rt-pcr在同一个反应管内检测人或蚊标本中登革病毒和寨卡病毒的核酸检测方法,可应用于登革病毒和寨卡病毒引起暴发疫情的实验室应急诊断、快速筛查、临床诊断及登革病毒和寨卡病毒的流行病学的研究。
背景技术:
登革病毒(denguevirus,denv)和寨卡病毒(zikavirus,zikv)均属于黄病毒科,黄病毒属,基因组为单股正链rna。denv依抗原性不同分为4种血清型:denv-1、denv-2、denv-3和denv-4,同一型别不同毒株可存在抗原差异,且各个型别之间抗原性存在一定的交叉。寨卡病毒依据基因型分为:亚洲型和非洲型两个基因型。登革病毒感染的天然宿主包括人和蚊子等,主要通过埃及伊蚊和白纹伊蚊等媒介昆虫传播。寨卡病毒在非人灵长类动物和蚊媒之间循环,人属于偶然宿主,且普遍易感,该病毒主要通过伊蚊传播,埃及伊蚊为主要传播媒介,而白纹伊蚊和非洲伊蚊等伊蚊也可传播,还存在母婴垂直传播、性传播和血液传播等方式。我国处于亚热带区域,南方部分地区(如广东和广西等)是埃及伊蚊和白纹伊蚊等蚊媒的流行地区,特别是伊蚊高发的夏秋季节,面临登革病毒和寨卡病毒暴发流行的高危地区。
登革病毒和寨卡病毒均广泛流行于热带和亚热带国家和地区,超过125个国家和地区出现登革病毒感染,70%感染人群发生在亚太地区,正逐渐向世界各地蔓延。寨卡病毒在非洲、亚洲、美洲和太平洋岛国地区均有该病暴发流行,疫情呈快速蔓延趋势。我国于1978年首次在广东佛山发现该病毒,以后在海南、广西、福建、浙江、云南等地均有发现,特别是2014年广东省登革热流行呈现近二十年来的高峰,感染人数超过4万,数人死亡;2015年台湾登革热流行造成超过3万人感染,死亡140多人。寨卡病毒于1947年首次在乌干达的恒河猴体内被发现,1952年在乌干达和坦桑尼亚的人体中分离到。2007年以前,全球仅报告14例寨卡病毒病散发病例,2007年首次在太平洋岛国密克罗尼西亚的雅普岛发现寨卡病毒暴发疫情。2015年巴西出现寨卡病毒的暴发流行,其后超过46个国家和地区有疫情报道,我国于2016年出现多例输入性寨卡病毒感染病例,疫情存在全球蔓延趋势。
登革病毒感染多数为无症状的隐性感染,发病者主要临床特征为登革热(denguefever,df)、登革出血热(denguehemorrhagicfever,dhf)和登革休克综合征(dengueshocksyndrome,dss),出现后两者临床症状的死亡率较高。由于登革病毒易于发生变异且有4个血清型别,初次感染者恢复期的血清抗体仅对该血清型起到一定的保护作用,对其他血清型病毒感染不仅没有交叉保护作用,反而能够增强病毒的感染,导致更为严重的临床症状。寨卡病毒感染无症状者常见,仅约20%感染者出现症状,主要临床表现为低热、关节痛及皮肤斑丘疹等,不易于登革热等发热出疹的病毒性疾病区别。此外寨卡病毒具有极强的嗜神经性,其感染与格林-巴利综合征、新生儿小头畸形症存在一定关联,本病病死率低,感染后可获得终身免疫。
目前,尚无安全有效的疫苗被批准应用。控制传播媒介、防止蚊虫叮咬是防治登革病毒和寨卡病毒感染的重要措施,早诊断、早治疗是降低死亡率的有效手段。登革病毒和寨卡病毒的检测主要通过病毒培养、血清学检测、病毒核酸检测等方法。实时荧光定量pcr技术以其全封闭单管扩增、简便快捷、重复性好、实时定量、污染少等优势,克服了以往临床诊断的缺陷,具有高度的特异性和敏感性,为临床诊断提供了准确可靠的实验室依据,可作为一种临床病原诊断的有效、快速的检测手段。
由于登革病毒和寨卡病毒感染患者的临床症状及其相似不易于区别,且实验室中多为检测登革病毒或寨卡病毒的单色实时荧光定量rt-pcr试剂,因此本研究针对登革病毒(denv-1、denv-2、denv-3和denv-4)和寨卡病毒(亚洲型和非洲型)高度保守且型间存在较小差异的非结构蛋白编码区分别设计登革病毒和寨卡病毒通用型高特异性的引物探针。采用单管一步法双重实时荧光定量rt-pcr,能够单管内一次反应同时检测出登革病毒和寨卡病毒,不仅极大的节省了试剂耗材,缩短了检测时间,同时具有极高的特异性和灵敏度。
技术实现要素:
本发明的目的是提供一种用于登革病毒和寨卡病毒通用型检测的一步法双重荧光定量rt-pcr检测试剂盒。本试剂盒包含定量rt-pcr反应液、酶混合液、引物探针混合液、标准品(denv和zikv)、强阳性对照品(denv和zikv,质粒拷贝数均为2×106copies/ml)、弱阳性对照品(denv和zikv,质粒拷贝数均为2×104copies/ml)、阴性对照品。盒内设有容器孔,分别放置定量rt-pcr反应液管、酶混合液管、引物探针混合液管、标准品管(denv和zikv)、强阳性对照品管(denv和zikv)、弱阳性对照品管(denv和zikv)、阴性对照品管。
强、弱阳性对照为包含denv和zikv的保守区基因序列的高、低浓度的阳性质粒样品。其中denv和zikv高浓度质粒(即强阳性对照品)的拷贝数均为2×106copies/ml,而低浓度(即弱阳性对照品)质粒的拷贝数均为2×104copies/ml。
其中定量rt-pcr反应液管包含:pcr反应缓冲液管(含氯化镁和三磷酸脱氧核糖核苷酸混合物等)、酶混合液管(含耐热taqdna聚合酶、rna酶抑制剂和mmlv逆转录酶等)、引物探针混合液管(两组引物和相应的两种不同荧光标记的探针),且引物探针混合液管需为棕色管。阴性对照为高温高压灭菌的depc(焦碳酸二乙酯)处理水,阳性对照为denv和zikv的阳性质粒样品。
双重荧光定量rt-pcr检测用上游引物和下游引物以及相应的特异性探针序列如下:
上游引物denv-f:5’-gactagyggttagaggagacccctc-3’
下游引物denv-r:5’-gcgytctgtgcctggawtgat-3’
特异性探针denv-p:5’-fam-agaccagagatcctgctgt-mgb-3’
上游引物zikv-f:5’-gactgggtaccaactgggagaac-3’
下游引物zikv-r:5’-ggtcgttctcctcaatccacac-3’
特异性探针zikv-p:5’-hex-gaaagggagaatggatgac-mgb-3’
其中denv特异性探针的5’端采用fam荧光标记,zikv特异性探针的5’端采用hex荧光标记;denv和zikv特异性探针的3’端的荧光淬灭标记物均采用mgb荧光染料标记。
上述标准品包括denv、zikv标准品,其保守区基因序列如下:
denv标准品序列为:
gactagcggttagaggagacccctcccatcactgacaaaacgcagcaaaaaagggggcccgaagccaggaggaagctgtactcctggtggaaggactagaggttagaggagacccccccaacacaaaaacagcatattgacgctgggaaagaccagagatcctgctgtctctgcaacatcaatccaggcacagagcgc
zikv标准品序列为:
gactgggtaccaactgggagaaccacctggtcaatccatggaaagggagaatggatgaccactgaggacatgctcatggtgtggaatagagtgtggattgaggagaacgacc
本发明提供的荧光定量试剂盒需于-20℃储存,尽量减少反复冻融;引物探针混合液需避光条件保存。
本发明的另一个目的是提供上述的双重荧光定量rt-pcr检测试剂盒在检测denv和zikv核酸中的应用。
本发明试剂盒的使用方法:在每次标本检测中均应设立阳性对照和阴性对照。标准品用takara公司的easydilution(货号:9160)稀释为1×102-1×107copies/ml。
样本核酸的提取:取200μl血清、血浆或尿液样本加到ep管中,进行核酸提取。核酸提取采用qiagen公司的qiaampviralrnaminikit或qiagenrneasyminikit,按照试剂盒说明书进行提取,取5μl已抽提的待测样品核酸作为模板。
核酸的检测:取5ul已抽提的待测样品核酸作为模板。反应总体积为25μl,其中定量rt-pcr反应液12.5μl,酶混合液1μl,引物探针混合液(20μmol/l,包含两组特异性引物和相应的两种荧光探针)共3μl,模板5μl,加水补足至25μl。在abi7500荧光定量pcr仪(或者其他双色荧光及以上的pcr仪)上进行检测,反应参数为:反转录50℃,20min;95℃5min热启动,然后95℃15s,60℃45s,在60℃进行双重荧光检测,共进行40个循环。
荧光定量结果报告:①denv、zikv检测的各自ct值对应相应的荧光标记的病毒,检测样本ct值为40、0和无数值时,报告为阴性。②检测样本ct值<35时,报告为相应病毒阳性。③检测样本ct值≥35且小于40的样本,建议复检,复检结果ct值<38者,且荧光曲线较好,依据②的判断标准报告为相应病毒阳性。根据所获得的标准曲线,计算待测标本denv或者zikv的病毒量(copies/ml)。
本发明的有益之处是:运用一步法实时荧光定量rt-pcr技术,采用denv和zikv高度特异的引物和荧光标记探针,研制用于denv和zikv检测的双重荧光定量rt-pcr检测试剂盒。该发明是通过一个rt-pcr反应,可以从血清、血浆和/或尿液标本中同时检测出是否有denv和zikv的存在,比单重荧光定量pcr方法更便捷迅速、节约成本。同时,对检测的病毒进行实时准确定量,根据病毒感染的滴度,为临床上患者提供早期诊断,为临床治疗方案的制定提供参考依据;可应用于denv和zikv引起暴发疫情的实验室应急诊断、快速筛查、临床诊断及流行病学的研究。
附图说明
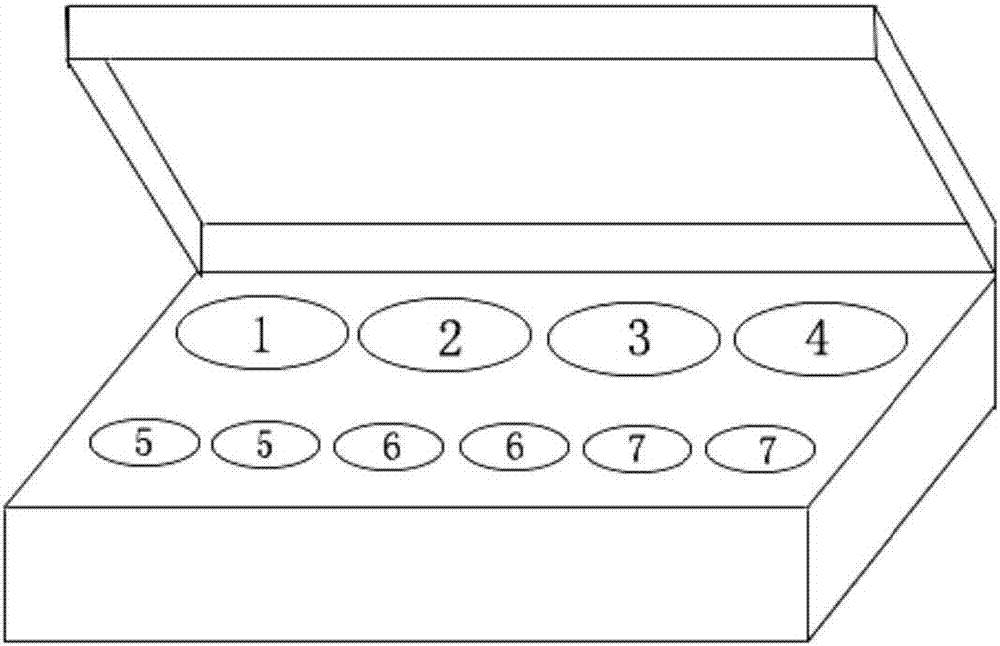
图1为本试剂盒结构示意图,其中1为定量rt-pcr反应液管,2为酶混合液管,3为引物探针混合液管,4为阴性对照品管,5为标准品管(denv、zikv,共2管),6为强阳性对照品管(denv、zikv,共2管),7为弱阳性对照品管(denv、zikv,共2管)。
图2为本试剂盒检测denv的灵敏度,从左到右(1-6)依次为107、106、105、104、103、102copies/ml。
图3为本试剂盒denv标准品实时荧光定量rt-pcr产物凝胶电泳示意图,电泳条带大小约77bp,其中lanem为dl2000marker,lane1-6分别为denv标准品(107copies/ml)十倍梯度稀释后实时荧光定量rt-pcr产物,lane7为阴性对照。
图4为本试剂盒检测zikv的灵敏度,从左到右(1-6)依次为107、106、105、104、103、102copies/ml。
图5为本试剂盒zikv标准品实时荧光定量rt-pcr产物凝胶电泳示意图,电泳条带大小约81bp,其中lanem为dl2000marker,lane1-6分别为zikv标准品(107copies/ml)十倍梯度稀释后实时荧光定量rt-pcr产物,lane7为阴性对照。
具体实施方式
下面具体实施例结合附图对本发明进行进一步阐述本发明,但这些实施例仅限于说明本发明而不限制本发明的范围。
实施例1
一种检测denv和zikv的双重实时荧光定量rt-pcr检测试剂盒,包含:定量rt-pcr反应液、酶混合液、引物探针混合液、标准品(denv、zikv)、强阳性对照品(denv、zikv)、弱阳性对照品(denv、zikv)、阴性对照品。本试剂盒盒体设有容器孔,与试剂盒各组分对应。盒体设有容器孔,分别用于放置定量rt-pcr反应液管(标号1)、酶混合液管(标号2)、引物探针混合液管(标号3)、阴性对照品管(标号4)、标准品管(包括denv、zikv标准品,共2管,标号5)、强阳性对照品管(包括denv、zikv阳性对照品,共2管,标号6)、强阳性对照品管(包括denv、zikv阳性对照品,共2管,标号7),如图1所示。
强、弱阳性对照为包含denv和zikv的保守区基因序列的高、低浓度的阳性质粒样品。其中denv和zikv高浓度质粒(即强阳性对照品)的拷贝数均为2×106copies/ml,而低浓度(即弱阳性对照品)质粒的拷贝数均为2×104copies/ml。
其中定量rt-pcr反应液管包含:pcr反应缓冲液管(含氯化镁和三磷酸脱氧核糖核苷酸混合物等)、酶混合液管(含耐热taqdna聚合酶、rna酶抑制剂和mmlv逆转录酶等)、引物探针混合液管(两组引物和相应的两种不同荧光标记的探针),且引物探针混合液管需为棕色管。阴性对照为高温高压灭菌的depc(焦碳酸二乙酯)处理水,阳性对照为denv和zikv的阳性质粒样品。
双重荧光定量rt-pcr检测用上游引物和下游引物以及相应的特异性探针序列如下:
上游引物denv-f:5’-gactagyggttagaggagacccctc-3’
下游引物denv-r:5’-gcgytctgtgcctggawtgat-3’
特异性探针denv-p:5’-fam-agaccagagatcctgctgt-mgb-3’
上游引物zikv-f:5’-gactgggtaccaactgggagaac-3’
下游引物zikv-r:5’-ggtcgttctcctcaatccacac-3’
特异性探针zikv-p:5’-hex-gaaagggagaatggatgac-mgb-3’
其中denv特异性探针的5’端采用fam荧光标记,zikv特异性探针的5’端采用hex荧光标记;denv和zikv特异性探针的3’端的荧光淬灭标记物均采用mgb荧光染料标记。
上述标准品包括denv、zikv标准品,其保守区基因序列如下:
denv标准品序列为:
gactagcggttagaggagacccctcccatcactgacaaaacgcagcaaaaaagggggcccgaagccaggaggaagctgtactcctggtggaaggactagaggttagaggagacccccccaacacaaaaacagcatattgacgctgggaaagaccagagatcctgctgtctctgcaacatcaatccaggcacagagcgc
zikv标准品序列为:
gactgggtaccaactgggagaaccacctggtcaatccatggaaagggagaatggatgaccactgaggacatgctcatggtgtggaatagagtgtggattgaggagaacgacc
本发明提供的荧光定量试剂盒需于-20℃储存,尽量减少反复冻融;引物探针混合液需避光条件保存。
实施例2
1材料与方法
1.1临床标本与病毒核酸:
denv和zikv的阳性临床样本由浙江省湖州市疾病预防控制中心和浙江省疾病预防控制中心提供,疑似样本来源于浙江省湖州市第一人民医院、浙江省湖州市中心医院和浙江省内其他几家医院疑似患者的血浆、血清和或尿液标本,样本采集后运送至实验室。另外,其他与发热出疹相关的病毒如麻疹病毒、风疹病毒、道病毒71型、柯萨奇病毒a16型和柯萨奇病毒a6型,及甲型、乙型流感病毒等病毒的阳性核酸由浙江省湖州市疾病预防控制中心和浙江省湖州市第一人民医院提供。
1.2引物与探针
从ncbi基因库下载了涵盖国内外denv亚型和zikv基因型的多条基因序列。利用mega6.06软件对其进行同源性比较,确定以上病毒基因组的保守区。使用primerexpress3.0软件在其保守区设计高度特异性的引物与taqman-mgb探针,引物和探针序列均通过blast验证,具有较好特异性。引物和探针序列如下,:
上游引物denv-f:5’-gactagyggttagaggagacccctc-3’
下游引物denv-r:5’-gcgytctgtgcctggawtgat-3’
特异性探针denv-p:5’-fam-agaccagagatcctgctgt-mgb-3’
上游引物zikv-f:5’-gactgggtaccaactgggagaac-3’
下游引物zikv-r:5’-ggtcgttctcctcaatccacac-3’
特异性探针zikv-p:5’-hex-gaaagggagaatggatgac-mgb-3’
以上引物和探针委托上海辉睿生物科技有限公司合成。
1.3病毒核酸的提取与标准品定量标准:
吸取200μl血清、血浆或尿液上清加入到ep管中,采用qiagen公司的qiaampviralrnaminikit或qiagenrneasyminikit,按照试剂盒说明书进行提取,取5ul已抽提的待测样品核酸作为模板。
合成各基因标准品片段,将其连接到质粒载体pmdtm19-tsimplevector(takara公司)。转化后培养。鉴定后提取质粒dna,利用nanodropnd-2000spectrophotometer测量质粒dna的浓度,确定dna的拷贝数作为标准品定量母液。根据实验需要,将标准品定量母液稀释至所需最高浓度,并做十倍稀释至最低浓度,低温保存备用。
1.4双重实时荧光定量rt-pcr反应体系和条件的优化:
反应总体积为25μl,其中定量rt-pcr反应液12.5μl,酶混合液1μl,引物探针混合液(20μmol/l,包含两种病毒的特异性引物和相应的两种荧光探针)共3.0μl,模板5μl,depc水补足至25μl。在abi7500荧光定量pcr仪上进行检测,反应参数为:反转录50℃,20min;95℃5min热启动,然后95℃15s,60℃45s,在60℃进行双重荧光检测,共进行40个循环。结果判断:选择荧光检测模式fam、hex荧光基线调整取3-15个循环的荧光信号平均值,阈值设定以阈值线刚好超过阴性对照品的最高点,样本呈典型的扩增曲线,判断为阳性。无典型的扩增曲线,判断为阴性。体系的优化试验,在以相同浓度阳性核酸为模板的反应体系中,引物浓度从1~20μm,探针浓度从1~20μm,采用矩阵法优选引物和探针的最佳浓度,根据最低ct值和最高荧光强度增加值(δrn)选择最佳引物和探针浓度。
1.5双重实时荧光定量rt-pcr特异性、敏感性和重复性试验
分别选择denv和zikv的阳性核酸(均通过基因测序鉴定)和其他与发热出疹相关的病毒如麻疹病毒、风疹病毒、道病毒71型、柯萨奇病毒a16型和柯萨奇病毒a6型,及甲型和乙型流感病毒等病毒的阳性核酸,用双重实时荧光定量rt-pcr验证本方法的特异性;对已标定拷贝数(copies/ml)的denv合成片段(107copies/ml)和zikv合成片段(107copies/ml)分别稀释后,平行进行荧光pcr反应,比较其灵敏度。此外,对每一个指定浓度的阳性核酸稀释液作3次重复检测,得到的ct值计算其标准差和变异系数,验证该方法的重复性。
2结果
2.1双重实时荧光定量rt-pcr反应体系及条件
该方法的反应总体积为25μl,其中定量rt-pcr反应液12.5μl,酶混合液1μl,引物探针混合液(20μmol/l,包含两组特异性引物和相应的两种荧光探针)共3μl,模板5μl,depc水补足至25μl。在abi7500荧光定量pcr仪上进行检测,反应参数为:反转录50℃,20min;95℃5min热启动,然后95℃15s,60℃45s,在60℃进行双重荧光检测,共进行40个循环。可获得最低ct值和最高荧光强度。
2.2特异性试验
本发明建立的一步法双重荧光定量rt-pcr方法对denv和zikv具有极好的特异性,能完全检出近期采集的临床阳性标本。本发明中的双重引物探针与其他发热出疹相关的病毒:麻疹病毒、风疹病毒、道病毒71型、柯萨奇病毒a16型和柯萨奇病毒a6型,及甲型和乙型流感病毒等病毒的阳性核酸均无交叉反应。
2.3敏感性试验
对denv和zikv敏感性检测试验,将已标定拷贝数(copies/ml)的denv合成片段(107copies/ml)、zikv合成片段(107copies/ml)分别十倍梯度稀释后,用本试剂盒进行检测,结果该方法检测敏感性分别达到102、102copies/ml。结果参见图2(zikv)、图4(denv)。取实时荧光定量rt-pcr产物3μl,120v恒压电泳20min,凝胶成像系统拍照。结果参见图3(zikv)、图5(denv)。其中lanem为dl2000marker,lane1-6分别为片段(108copies/ml)十倍梯度稀释后实时荧光定量rt-pcr产物,lane7为阴性对照。,电泳条带单一,亮度梯度分明,说明本试剂特异性好,定量结果相对准确。
2.4重复性试验
分别取denv合成片段(终浓度为106copies/ml)、zikv合成片段(106copies/ml)按10倍梯度稀释成3个不同的浓度,对每一个浓度的样本作3个重复检测,结果不同核酸浓度各自的检测ct值标准差在0.091~0.266之间,变异系数均低于1.0%,具有较好的重复性(结果见表1)。
表1双重实时荧光定量rt-pcr检测合成核酸的重复性试验
实施例3
采用本试剂盒对临床样本的检测:denv(4份)和zikv(2份)的阳性临床样本由浙江省湖州市疾病预防控制中心和浙江省疾病预防控制中心提供,疑似样本来源于浙江省湖州市第一人民医院、浙江省湖州市中心医院和浙江省内其他几家医院疑似患者的血浆、血清和或尿液标本总共325份。采用本方法中的双重实时荧光定量rt-pcr对收集到的标本进行验证,检测结果如下:denv阳性4份,阳性率1.2%;zikv阳性2份,阳性率0.6%。检测阳性结果与其已报告结果符合度达100%。
<110>湖州市第一人民医院
<120>一种检测登革病毒和寨卡病毒的双重荧光定量rt-pcr试剂盒
<160>8
<210>1
<211>25
<212>dna
<213>人工序列
<220>
<223>根据denv基因保守区序列设计的pcr检测上游引物序列
<400>1
gactagyggttagaggagacccctc25
<210>2
<211>21
<212>dna
<213>人工序列
<220>
<223>根据denv基因保守区序列设计的pcr检测下游引物序列
<400>2
gcgytctgtgcctggawtgat21
<210>3
<211>27
<212>dna
<213>人工序列
<220>
<223>根据denv基因保守区序列设计的taqman-mgb荧光定量检测探针序列
<400>3
agaccagagatcctgctgt19
<210>4
<211>198
<212>dna
<213>人工序列
<220>
<223>根据denv基因设计的荧光定量检测标准品序列
<400>4
gactagcggttagaggagacccctcccatcactgacaaaacgcagcaaaaaagggggcccgaagccaggaggaagctgtactcctggtggaaggactagaggttagaggagacccccccaacacaaaaacagcatattgacgctgggaaagaccagagatcctgctgtctctgcaacatcaatccaggcacagagcgc198
<210>5
<211>23
<212>dna
<213>人工序列
<220>
<223>根据zikv基因保守区序列设计的pcr检测上游引物序列
<400>5
gactgggtaccaactgggagaac23
<210>6
<211>22
<212>dna
<213>人工序列
<220>
<223>根据zikv基因保守区序列设计的pcr检测下游引物序列
<400>6
ggtcgttctcctcaatccacac22
<210>7
<211>19
<212>dna
<213>人工序列
<220>
<223>根据zikv基因保守区序列设计的taqman-mgb荧光定量检测探针序列
<400>7
gaaagggagaatggatgac19
<210>8
<211>113
<212>dna
<213>人工序列
<220>
<223>根据zikv基因保守区序列设计的荧光定量检测标准品序列
<400>8
gactgggtaccaactgggagaaccacctggtcaatccatggaaagggagaatggatgaccactgaggacatgctcatggtgtggaatagagtgtggattgaggagaacgacc113
- 还没有人留言评论。精彩留言会获得点赞!