一种类脑器官器的制备方法和应用与流程
本发明涉及干细胞领域,具体涉及利用干细胞分化出类脑器官器的培养基、制备方法和应用。
背景技术:
干细胞(stemcell)就是指功能还没有特化,能够自我复制、自我更新的细胞,在一定条件下(发育、损伤等),它们可以分化产生多种可以执行机体特殊功能(如神经电活动、细胞分泌)的不同细胞类型。从干细胞来理解细胞分化,细胞分化就是有分裂能力、功能尚未特化的干细胞演变为具有特殊生理功能细胞的过程。从分化发育的潜能和空间区分来看,胚胎干细胞(embryonicstemcell,esc)来源于胚胎植入子宫内膜之前的囊胚阶段未分化的内细胞团。es细胞具有分化上的全能性,可以分化成各种构成人体任何器官和组织的细胞类型,但无法独自发育成一个个体。es细胞能够发育成外胚层、中胚层和内胚层三种胚层的细胞类型,然后再分化成人体的220多种细胞类型。胚胎干细胞具有万能分化性,即使经过多次细胞分裂后,仍然能保持万能分化的潜力。
目前干细胞研究的热点主要集中在疾病发生发展机制、药物筛选和细胞移植治疗等方面。将病人来源的体细胞经诱导后成为诱导的多功能干细胞(ipsc),随后再通过特定的诱导方法将ipsc分化成不同组织中具有特定功能的某种类型的体细胞,建立特定疾病的细胞模型。这些体外分化得到的细胞具有与体内细胞非常相似的功能,甚至能够模拟细胞病变发生的过程。由于这些细胞疾病模型是直接来源于病人,其在细胞和分子水平上它将提供动物模型无法比拟的研究平台。该平台通过模拟疾病的细胞表型和功能代谢机制,能够被有效的应用于临床前药物筛选、评价药物对疾病治疗效果。同时,也能被应用于临床前药物毒性的检测,有助于在药物开发的早期阶段有效的终止有毒药物的研发,节省资源和成本的投入。除此以外,干细胞移植在再生医学领域的应用,已经受到了干细胞生物学家和转化医学家的高度关注。近几年来国际上已经在小鼠和非人灵长类动物疾病模型中进行了细胞移植治疗,将esc或者ipsc诱导分化产生的具有正常功能的细胞移植到病变组织,促进组织细胞的再生和功能重建。
近些年来,体外三维(3d)培养出类似体内组织结构的体系是干细胞应用研究领域中另一个备受关注的内容,它具有非常重要的应用价值。与普通的二维细胞培养比较,三维培养的结构体系能够更好地从组织器官整体发育的过程来模拟细胞与细胞之间的相互作用和细胞外微环境变化对细胞发育、分化的影响,更有助于模拟组织器官发育的过程。
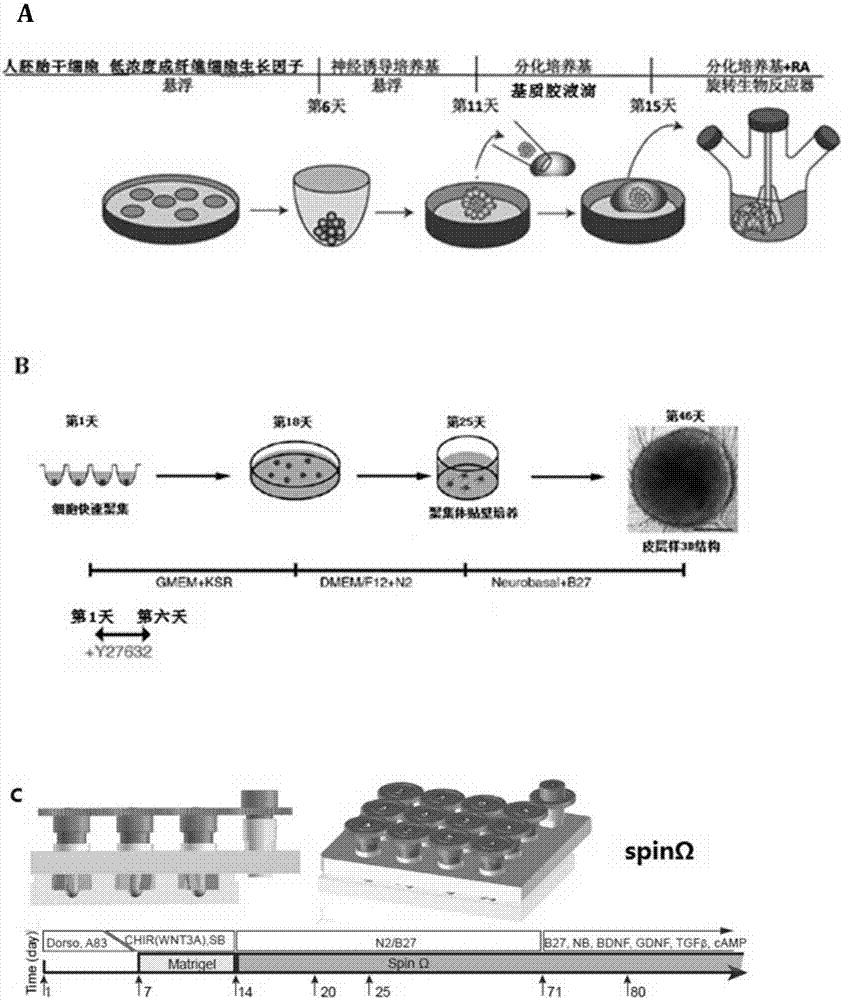
现有技术中关于体外3d培养的技术主要通过如下技术实施流程实现(参见图1a-1c):1a).首先将人诱导的多能干细胞消化成单细胞,再接种于超低吸附96-孔板,添加人胚胎干细胞(humanes)培养基、成纤维细胞生长因子(bfgf)、50mmrho相关蛋白激酶(rock)抑制剂,第二天拟胚体形成,隔天换液。第6天将拟胚体接种于超低吸附24孔板,添加神经诱导培养基。第11天将组织转移到基质胶液滴中,凝固后迅速转移到分化培养基中。在4天后将组织液滴转移至旋转的生物反应器中,在37度培养箱中连续培养。1b).将消化得到的人胚胎干细胞悬液接种于超低吸附96-孔板,添加人胚胎干细胞培养基、50mmrho相关蛋白激酶(rock)抑制剂,第二天拟胚体形成,每天换液。第18天将诱导分化得到的聚集体转移至超低吸附24孔板,改为神经诱导培养基。第25天将类器官贴壁培养,改为分化培养基。1c).将干细胞克隆直接悬浮于超低吸附6孔板中,第二天形成拟胚体,培养基为干细胞培养基中加入2μmdorsomorphine和2μma83-01。第5-6天,一半培养基更换为神经诱导培养基,添加4ng/mlwnt-3a,1μmchir99021,和1μmsb-431542等细胞因子。第7天,将类器官转移至基质胶包埋培养皿中贴壁培养。至第14天转移至spinω中悬浮培养,添加神经分化培养基以及20ng/mlbdnf,20ng/mlgdnf,1ng/mltgfβ和0.5mmcamp等因子。1-3
神经干细胞周围的血管作为一种微环境维持着体内的平衡,在胚胎发育过程中对于神经干细胞的自我更新和增殖起着至关重要的作用。现有技术尚无法从干细胞分化出血管样结构,因此需要一种更精细的类脑组织分化方法,从而来研究神经发育疾病以及相关认知缺陷。
技术实现要素:
本发明目的在于提供干细胞在体外分化发育形成三维结构且具有血管结构的类皮层组织结构(corticalorganoid)的方法和培养条件。而且随着持续的培养还能够建立具有神经元功能和成熟神经环路连接的3d体系,使其更加接近于大脑皮层从胚胎期神经发生到出生后突触发育和功能建立的发育过程。
具体而言,本发明一方面提供一组诱导干细胞向具有血管结构的类脑组织分化的培养基,所述培养基包括以下各项:
1)dmem/f12/ksr培养基:其是在dmem/f12基础培养基中添加血清替代物,iwr1,ldn和/或sb431542。
2)神经诱导培养基:其是在dmem/f12基础培养基中添加n2添加剂和/或b27添加剂。
3)神经分化培养基:其是在neurobasal和dmem/f12基础培养基中添加n2添加剂和/或b27添加剂。
在优选的实施方案中,所述血清替代物(ksr)以10-30%添加,优选20%。
在优选的实施方案中,iwr1以1-10μm添加,优选3μm。
在优选的实施方案中,ldn以0.05-2μm添加,优选0.1μm。
在优选的实施方案中,sb431542以1-15μm添加,优选10μm。
在优选的实施方案中,所述神经诱导培养基中添加剂n2和b27的比例是1∶1-3∶1,优选2∶1。
在优选的实施方案中,所述神经分化培养基中添加剂n2和b27的比例是1∶1-1∶3,优选1∶2,neurobasal和dmem/f12培养基的比例是3∶1-1∶1,优选2∶1。
在优选的实施方案中,所述dmem/f12/ksr培养基还含有非必须氨基酸,其浓度为0.01-1mm,优选0.1mm,glutamax,其浓度为1-5mm,优选2mm,β巯基乙醇,其浓度为0.01-1μm,优选0.1mm。
在优选的实施方案中,所述神经诱导培养基还含有glutamax,其浓度为1-5mm,优选2mm,非必须氨基酸,其浓度为0.01-1mm,优选0.1mm,β巯基乙醇,其浓度为0.01-1mm,优选0.1mm,fgf2(成纤维细胞生长因子),其浓度为10-50μg/ml,优选20μg/ml。
在优选的实施方案中,所述神经分化培养基还含有glutamax,其浓度为1-5mm,优选2mm,非必须氨基酸,其浓度为0.01-1mm,优选0.05mm,β巯基乙醇,其浓度为0.01-1mm优选为0.1mm,bdnf(脑源性神经生长因子),其浓度为5-60ng/ml,优选10ng/ml,gdnf(胶质源性神经生长因子),其浓度为5-60ng/ml,优选10ng/ml,camp(环磷酸腺苷),其浓度为5-15μm优选10μm,和igf(胰岛素样生长因子),其浓度为5-60ng,优选10ng/ml。
本发明另一方面提供一种诱导干细胞分化成类皮层组织样结构(corticalorganoid)的方法,所述方法包括以下步骤:
1)无血清的拟胚体(embryonicbody)(eb)样神经球培养步骤;
2)神经诱导分化培养步骤;
3)神经分化培养;
其中,步骤1)使用前述dmem/f12/ksr培养基,步骤2)使用前述神经诱导培养基,步骤3)使用前述神经分化培养基。
在本发明的情形中,术语“干细胞”在全文中均是指ipsc。
诱导的多能干细胞(ipsc):全称为inducedpluripotentstemcells,是指通过人工诱导非多能性细胞表达某种特定基因得到的。ipscs和天然多功能干细胞在很多方面具有相似性,比如某种干细胞基因和蛋白的表达,染色质甲基化模式,倍增之间,胚体形成,畸胎瘤形成,不同嵌合体的形成,以及分化潜能。
拟胚体(embryonicbody)(eb)样神经球:是指由诱导的多能干细胞在缺乏分化抑制剂悬浮的情况下形成的球状细胞聚团。
神经诱导分化:是指通过外源性添加特定的细胞因子诱导多能干细胞向神经前体细胞方向分化。
神经分化:是指诱导神经前体细胞向成熟神经元分化。
3d培养:不同于传统的贴壁培养方法,是将细胞聚团悬浮在培养基中,使细胞向三维方向生长和分化的培养方法。
在优选的实施方案中,步骤1)包括:
a.将干细胞消化成单细胞,用前述dmem/f12/ksr培养基重悬细胞,
b.将内皮细胞消化成单细胞,用前述dmem/f12/ksr培养基重悬细胞,
c.将重悬得到的干细胞悬液和huvec细胞悬液混合接种,培养5-12天,每天更换一半dmem/f12/ksr培养基,得到eb样神经球。
在进一步优选的实施方案中,所述内皮细胞是huvec细胞。
在进一步优选的实施方案中,干细胞培养在基质胶上。
在进一步优选的实施方案中,所述消化使用accutase和胰酶进行。
在进一步优选的实施方案中,所述细胞悬液接种到stemcell公司生产的800tm低吸附24孔板,每孔包含干细胞1×103到1×105、内皮细胞1×102到1×104。
在进一步优选的实施方案中,所述培养进行5-12天,优选6-10天,更优选6-8天,最优选7天。
在优选的实施方案中,在步骤2)中,将步骤1)中得到的eb样神经球转移到新的平板中,将培养基更换为所述神经诱导培养基,培养35-55天,隔天更换培养基。
在进一步优选的实施方案中,所述新的平板为超低吸附6孔板。
在进一步优选的实施方案中,所述培养进行33-55天,优选35-55天,更优选35-50天,最优选50天。
在优选的实施方案中,在步骤3)中,在步骤2)结束后,将培养基更换为所述神经分化培养基,培养,隔两天更换培养基。
在进一步优选的实施方案中,所述培养在37℃,5%co2细胞培养箱中进行。
体外类器官培养是一种模拟发育的新方法,该方法为相关疾病的病理学研究以及移植治疗的评估提供了实用的研究系统。世界各地的研究团队已报到了多种类脑器官的诱导方法。本发明通过添加内皮细胞来诱导分化形成类脑器官,为神经干细胞的自我更新和分化提供更精细的微环境。类脑器官中的管状结构能够为其周围的神经干细胞和细胞提供更多的氧和营养物质,从而促进细胞增殖阻止死亡。通过本发明的方法,本发明人最终培养出类似于人脑皮层结构的锥体神经元和中间神经元。由于具有更精细的细胞结构,培养出的神经元具有功能性的离子通道并形成了电和化学神经突触。这些具有神经环路的类脑器官意味着脑皮层的终极发育阶段,因此本发明提供的不仅仅是细胞层面的方法而是在体外真正建立了脑的功能。
附图说明
图1.文献已经报道的脑皮层类器官诱导流程图;
图2.脑皮层样类器官诱导培养流程图;
图3.体外3d培养的eb样细胞球逐渐形成皮层样类器官;
a)皮层样类器官在第7天,第40天,第65天以及第210天明场图片;
b)第36天皮层神经上皮样的结构,类器官表达大脑皮层前体细胞标记物:pax6与sox2,以及大脑皮层前体细胞突起标记物:zo-1
c)通过对皮层样类器官的切片进行免疫荧光染色,发现在本方法诱导得到的类器官中存在人大脑皮层发育过程中最重要的两种前体细胞,即:辐射向胶质细胞(radialglia,rg)和外侧辐射向胶质细胞(outerradialglia,org),同时与在体发育类似,这些前体细胞也处于不同的细胞分裂时期,表征这些细胞能够进行细胞分裂;
图4.皮层样类器官形成类似于皮层的结构特征;
a)对第65天皮层样类器官切片进行免疫荧光染色显示形成类似于皮层各片层区的分层样结构特征;
b-d)各个时期类器官的连续切片进行免疫染色,显示皮层兴奋性神经元与抑制性神经元逐渐发育过程,以上过程与在体发育类似;
图5.皮层样类器官中的三维立体血管样结构;
a)对第45天皮层样类器官进行免疫荧光染色显示类器官体中存在血管标记物(laminin)的阳性染色,同时这些血管阳性区域呈现与在体血管类似的网状结构和管状结构;
b)对第210天类器官切片进行免疫荧光染色显示在本培养方法得到的后期的皮层样类器官中同样存在能够形成网状结构的血管阳性染色;
图6.皮层样类器官具有成熟神经元及神经环路连接;
a)对皮层样类器官进行电生理检测的细胞示例;
b)使用膜片钳检测得到在不同天数下的钠电流示例,可见随着类器官发育,钠电流逐渐增大;
c)使用膜片钳检测得到的在不同天数下的细胞发放电情况,随着培养天数增加细胞逐渐成熟;
d)本方法培养分化得到的类器官中细胞自发放电示例;
e)使用膜片钳技术检测到的细胞兴奋性与抑制性突触后电流示例;
f)通过细胞注射技术,在本方法诱导得到的类器官中标记细胞联结示例;
g)通过双通道膜片钳技术记录到的细胞间间隙连接的结果示例;
h)通过钙成像技术来记录类器官中细胞钙活动发放结果示例,以及钙活动的同步性统计结果;
图7.皮层样类器官模拟大脑发育缺陷性疾病模型;
a)健康人以及mcph病人来源的人诱导的多功能干细胞(hipsc)进行本方法的诱导得到的不同时期的类器官明场图片;
b)健康人以及mcph病人来源的类器官皮层神经上皮样结构的免疫荧光染色结果;
c)健康人以及mcph病人来源的类器官皮层片层区免疫荧光染色结果;
d)健康人以及mcph病人来源的皮层样类器官钙成像检测结果,并对两组类器官中的钙活动同步性进行统计比较,结果显示mcph病人来源的类器官中神经元钙活动同步性较健康组降低。
具体实施方式
以下实施例仅用于说明本发明,但不以任何方式限制本发明。以下实施例中使用的干细胞均为商购的ipsc(除病人的ipsc由本实验室制备之外)。
本发明最优选的实施方案中用到的培养基如下,具体包括三种:
1.dmem/f12/ksr培养基:dmem/f12(lifetechnology)基础培养基中添加20%血清替代物ksr(lifetechnology),2mmglutamax(liftechnology),0.1mm非必须氨基酸(lifetechnology),0.1mmβ巯基乙醇(lifetechnology),3μmiwr1(r&d),0.1μmldn(r&d)和10μmsb431542(r&d)。
2.神经诱导培养基:dmem/f12基础培养基中添加n2添加剂和b27添加剂,n2∶b27=2∶1(lifetechnology)和2mmglutamax,0.1mm非必须氨基酸,0.1mmβ巯基乙醇,20μg/mlfgf2(成纤维细胞生长因子)。
3.神经分化培养基:neurobasal和dmem/f12基础培养基(neurobasal:dmem/f12=2∶1)中添加n2添加剂,b27添加剂,n2∶b27=1∶2(lifetechnology)和2mmglutamax,0.05mm非必须氨基酸,0.1mmβ巯基乙醇,10ng/mlbdnf(脑源性神经生长因子),10ng/mlgdnf(胶质源性神经生长因子),10μmcamp(环磷酸腺苷)和10ng/mligf(胰岛素样生长因子)。
实施例1、干细胞体外3d培养分化形成类脑组织
本实施例所述代表性过程总体如图2所示,具体包括:
1)吸去干细胞培养基(lifetechnology),用dmem/f12培养基洗一遍,加入1ml1×accutase(lifetechnology),37℃消化约5min,待克隆被消化成单细胞状态后,添加5倍体积的dmem/f12终止反应。吸去hvuec细胞(国家细胞资源中心)培养基,用pbs(lifetechnology)洗一遍,加入1ml0.25%胰蛋白酶,37℃消化约2min,待其消化成单细胞状态后,添加1倍体积的hvuec细胞培养基(lonza内皮细胞培养基,lonza公司购买)终止反应。
2)收集上述消化后的细胞分别于2支离心管中,200g离心5min,去上清,添加dmem/f12/ksr培养基,轻轻吹打细胞块,制备成单细胞悬液,再将细胞接种于stemcell公司生产的800tm低吸附24孔板中,每孔包含干细胞1×103到1×105和内皮细胞1×102到1×104,放入37℃,5%二氧化碳培养箱中培养。每天更换培养基。第二天观察发现每孔中的干细胞已经聚集成球。
3)在第7天,将每孔中的eb样细胞球转移到超低吸附6孔板中,更换成神经诱导培养基。在37℃,5%co2细胞培养箱中培养,隔天更换培养基。
4)在第50天,将神经诱导培养基更换成神经分化培养基,在37℃,5%co2细胞培养箱中培养,隔两天更换培养基。
以下实施例表明,在诱导分化过程中,形态及冰冻切片的免疫荧光结果显示体外3d培养的eb样细胞球逐渐形成皮层样类器官(图3a)并且具有:1).皮层神经上皮样的结构(图3b);2).极性神经上皮的特征(图3c);3).类似于皮层的结构特征(图4);4).三维立体血管样结构(图5)。另外,电生理结果显示皮层样类器官具有成熟神经元及神经环路连接形成(图6)。应用3d培养方法把mcph病人的ipsc(制备方法参见文献4)培养成皮层样类器官,建立模拟大脑发育缺陷性疾病模型,结果显示mcph病人来源的皮层样类器官具有皮层发育缺陷性结构特征(图7)。
实施例2.冰冻切片的制备
吸去实施例1步骤2)中得到的类器官中的培养基,用1×pbs洗两遍,加入冰的4%pfa,4℃固定过夜,次日加入20%的蔗糖溶液,4℃沉糖过夜。将类器官取出,吸干表面的液体,将其包埋在oct中,-20℃冻存。将包埋好的组织块做连续切片制备成10μm的冰冻切片,并且贴附在防脱载玻片上。
实施例3.免疫荧光染色:
将切片用1×pbs洗三遍,每次5min;用含0.3%tritonx-100和0.1%tween-20的1×pbs缓冲液打孔,常温10min;再用1×pbs洗三遍后,滴加含10%驴血清的封闭液常温封闭1小时;吸去封闭液后,再向组织切片上滴加按一定比例稀释过的一抗(pax6抗体(covance),tbr2抗体(abcam),sox2抗体(santacruz),phospho-vimentin抗体(mblinternationald076-3s(ser55)或者d095-s(ser82),zo1抗体(invitrogen),ctip2抗体(abcam),tbr2抗体(abcam),sox2抗体(santacruz),zo1抗体(invitrogen,),ctip2抗体(abcam),,satb2抗体(abcam),brn2抗体(santacruz),gaba抗体(sigma),calretinin抗体(swant),sst抗体(millipore),neun抗体(millipore),laminin抗体(abcam))封闭液,4℃封闭过夜;次日用1×pbs洗三遍片子,每次10min,再滴加用封闭液稀释过的二抗液(1∶500)(alexafluor488,546,和647偶联的驴血清抗兔、抗鼠、抗大鼠和抗羊二抗(lifetechnology),同工凝集素ib4染料(lifetechnology))常温封闭1h后用1×pbs洗三遍,每遍10min;再用dapi稀释液(工作浓度:1ug/ml),常温孵育10min,1×pbs洗三遍,每遍5分钟;用滤纸拭干切片上的液体,滴加封片剂,盖上盖玻片封片。
图3b染色结果显示pax6和sox2标记阳性的神经干细胞周围有紧密连接蛋白zo1的阳性表达,表现出神经上皮样的结构特征。图3c结果显示sox2和p-vim阳性的辐射向胶质细胞(radialglia,rg)和外侧辐射向胶质细胞(outerradialglia,org)也存在于皮层样类器官中,rg细胞在腔室面的细胞分裂行为符合在体中的特征性表现。
图4显示皮层特定类型神经元的特异标志物免疫染色结果表明皮层样类器官能够模拟出皮层的片层分层样的结构特征,并且能够分化得到皮层各分层中的兴奋性神经元和抑制性神经元。
图5显示血管特异性标志物的免疫染色结果显示了在不同时期的皮层样类器官中能够发育形成类似于皮层中的血管网状性结构,具有血管样的分布和结构特征。
实施例4.类器官的电生理
将实施例1中培养的类器官转移至使用糖人工脑脊液(sucrose-basedacsf)(以mm计:234蔗糖,2.5kcl,26nahco3,1.25nah2po4,11d-葡萄糖,0.5cacl2和10mgso4)配制的3%低熔点琼脂糖包被。冷的糖ascf通氧后使用震动切片机切片,厚度为250或者300μm。切片转移至含有250ul神经分化培养基的24孔板中,并放置到培养箱(5%co2,37℃)中恢复培养至少24小时,之后将单个切片转移至记录灌流浴槽中,并在30±1℃条件下,用含氧的acsf(以mm计:126nacl,3kcl,26nahco3,1.2nah2po4,10d-葡萄糖,2.4cacl2和1.3mgcl2)以每分钟3-5ml的速度对记录灌流浴槽不间断灌流。膜片电极内充满细胞内液(以mm计:130葡糖酸钾,16kcl,2mgcl2,10hepes,0.2egta,4na2-atp,0.4na3-gtp,0.1%luciferyellow和0.5%neurobiotin,ph=7.25,用koh调节)时电阻阻值为5-7mω。电流钳模式通过产生-50pa到300pa(步进为50pa)的一系列刺激电流来记录细胞被诱发的动作电位。电压钳模式通过产生-80mv到40mv(步进为10mv)一系列的刺激脉冲来记录全细胞电流。记录细胞自发抑制性/兴奋性突触后电流时膜电压被分别钳制在-70/0mv。双膜片记录是在电流钳模式下进行的。成对脉冲(1na,持续时间2ms,间隔50ms)分别注入每个单独的细胞中。使用40倍水浸物镜的显微镜配置dgc和相机对细胞进行监测。使用multiclamp700b放大器和digidata1440a进行刺激传递和数据采集,同时由clampex10软件进行调控。膜片钳记录完成后对切片固定。使用fluoresceinstreptavidin(vectorsa-5001,1:500)以及texasredstreptavidin(vectorsa-5006,1:500)对切片染色,观察细胞的形态结构(图6a-6g)。
通过膜片钳技术对不同时间点类器官中细胞进行全细胞记录,结果显示随着培养时间的增加,细胞钠电流逐渐增大(图6b),同时细胞发放电活动也逐渐成熟(图6c),并且伴有细胞自发放电活动产生(图6d),以上数据说明了随着培养时间增加,类器官中的神经元也逐渐成熟。伴随着神经元成熟的同时,神经元之间的细胞连接也在逐渐建立和成熟。通过电生理技术记录得到细胞突触后电流及其统计结果(图6e),说明细胞之间可以建立比较成熟的突触联系。同时通过染料注射的方法,观察到在注射细胞(1’,2’)周围存在被染料标记上的未注射细胞(1-11)(图6f),提示在类器官中的神经元之间存在间隙连接。进一步使用双通道膜片钳技术,检测到两个细胞之间可以产生双向的电荷直接传递(图6g),说明了神经元之间不仅仅存在突触联系,也同时存在间隙连接。
实施例5.钙成像:
染料溶液由50μgfluo-4am,50μldmso和200μgpluronicf-127混合得到。实验时确保切片(根据实施例4中所述方法制备)完全都浸泡在3μl染液中,于37℃孵育30分钟后,转移切片至记录灌流浴槽中,在30±1℃条件下,用含氧的acsf(以mm计:126nacl,3kcl,26nahco3,1.2nah2po4,10d-葡萄糖,2.4cacl2和1.3mgcl2)以每分钟3-5ml的速度对记录灌流浴槽不间断灌流。进行成像实验之前需灌流30分钟。钙离子成像使用安装有可进行5hz成像相机与fitc滤镜组(ex:475/35nm,em:530/43nm)的bx51wi显微镜。后使用imagej进行数据分析。手动选择分析区域并且计算每一帧的荧光值(f),记录时区域最低的平均荧光值fbasal以及所有帧平均荧光值fbackground的计算方法如下:使用公式δf=(f-fbasal)/fbackground来计算随着时间的推移荧光变化。通过平均同步活跃的细胞的时间计算平均同步活跃细胞比例,结果显示类器官中的细胞钙活动正常,并且具有一定的活动同步性(图6h)。
实施例6.建立mcph(头小畸形病)的疾病模型
应用实施例1中的方法把mcph病人的ipsc(制备方法参见文献4)培养成皮层样类器官,建立模拟大脑发育缺陷性疾病模型(图7a)。应用实施例2~5的方法对建立的疾病模型进行检测,结果显示mcph病人来源的皮层样类器官具有皮层发育缺陷性结构特征(图7b-c)。具体表现为mcph病人来源的皮层样类器官虽然能够向皮层神经元分化,但是不能发育形成明显的神经上皮样结构(图7b)和特征性的皮层片层结构(图7c);钙成像结果显示mcph病人来源的类器官中神经元钙活动同步性较健康组降低(图7d)。
参考文献:
1lancaster,m.a.etal.cerebralorganoidsmodelhumanbraindevelopmentandmicrocephaly.nature501,373-379,doi:10.1038/nature12517(2013).
2eiraku,m.etal.self-organizedformationofpolarizedcorticaltissuesfromescsanditsactivemanipulationbyextrinsicsignals.cellstemcell3,519-532,doi:10.1016/j.stem.2008.09.002(2008).
3qian,x.etal.brain-region-specificorganoidsusingmini-bioreactorsformodelingzikvexposure.cell165,1238-1254,doi:10.1016/j.cell.2016.04.032(2016).
4takahashi,k.etal.inductionofpluripotentstemcellsfromadulthumanfibroblastsbydefinedfactors.cell131,861-872,doi:10.1016/j.cell.2007.11.019(2007).
- 还没有人留言评论。精彩留言会获得点赞!