一种极化和扩增CD4+T细胞的方法及组合物及在治愈表达特异性抗原的肿瘤中的应用与流程
本发明属于生物细胞领域,尤其涉及一种极化和扩增cd4+t细胞的方法及组合物及在治愈表达特异性抗原的肿瘤中的应用。
背景技术:
免疫细胞回输是近年发明的癌症治疗方法,其基本原理是:回输的细胞会对宿主的癌症细胞和癌症组织产生特异性的攻击性,或刺激宿主体内的其他免疫细胞,使其攻击癌症。
研究者采用过多种细胞进行回输,包括t淋巴细胞,巨噬细胞(macrophage),自然杀伤细胞(nk)和自然杀伤t细胞(nkt)等。同时,很多实验采用了:以上列举细胞的加工和修饰(如嵌合抗原受体t细胞疗法,car-t),或多种细胞联合使用,或采用细胞和其他药品/细胞素/疫苗的组合(比如注入t细胞后,持续注入il-2)。t淋巴细胞的作用是主导的和不可或缺的,其他几种细胞独自使用几乎没有治疗效果。
t细胞回输疗法,对血液肿瘤和固体肿瘤都产生了不同程度的治疗效果。car-t疗法,在治疗b细胞急性淋巴细胞白血病(bcellall)上,取得了突破性的疗效。novartis和kitepharma的治疗方案kymriah和yescarta,前者在bcellall的化疗失败的病人身上取得了83%的癌症缓解率,后者在bcellall和b细胞淋巴癌(dlbcl)化疗失败病人上,有51%的缓解率。但是这些疗法的缺陷之一是复发率较高。而且一旦复发,就不再有有效治疗手段。
相对其它效果来说,t细胞回输疗法,对固体瘤疗效欠佳。科学家和医生尝试采过用癌症侵入t细胞,dc激活的外周血t细胞和car-t细胞等,对化疗失败的黑色素瘤,肠癌,食道癌,肺癌,脑胶质瘤等多种固体肿瘤治疗,但是至今极少有临床实验,反应率超过50%。多数实验的反应率仅在10%-20%。
t细胞疗法疗法的功效和至少三个指标相关,一是t细胞对癌症的杀伤性,二是t细胞针对癌症的导向性,三是t细胞自身的存活。而且疗法如需成功,必须要专一性强,副作用小。其中导向性,使用car-t和癌症侵入t细胞则可以解决。t细胞的杀伤性和存活性,是目前急需增强的性质。如目前大多数实验室采用的细胞毒性cd8t细胞,在回输病人体内后,一个月内就会损失穿过99%。再如,数次car-t的临床试验中,有病人死于副作用-细胞素风暴。
t细胞有很多亚群,比较为人熟知的有cd4+t细胞,cd8+t细胞和nkt细胞等等。其中每种又有更加细化的亚群划分,如cd4+t细胞,被研究者明确报导过的亚群分为th1(helpertcelltype1),th2,th9,th17,tfh(folliclebhelpertcell)和treg(regulatorytcell)。
目前,大部分研究者在临床实验t细胞回输技术时,只关注采用了cd4+或cd8+的使用,而忽略了更加细分的亚群。如多数临床实验,采用的是纯化的cd8+t细胞,一小部分实验,采用了cd8+t细胞和cd4+t细胞按照1:1比例注射。另一小部分实验,采用了全cd4+t细胞。但是几乎没有临床实验深入关注cd8+和/或cd4+t细胞的具体构成。
技术实现要素:
为了解决以上技术问题,本发明提供一种极化和扩增cd4+t细胞的方法及组合物及在治愈表达特异性抗原的肿瘤中的应用,能够诱导出一种新型t细胞亚群;诱导方法简单,易操作,产生的亚群在基因表达和性状上,也明显区别于现有的t细胞,诱导出的新型t淋巴细胞对呈递特异性抗原的固体和血液肿瘤有强大的杀伤力和清除性,同时拥有长期存活,抵抗疲劳,不会分化为调控性t细胞,不会引起细胞因子风暴(副作用低)和癌症组织导向性等。这种新型t细胞亚群具有干细胞和强力的体内生存能力。
本发明提供解决以上技术问题的一种极化和扩增cd4+t细胞的方法:包括以下步骤:
(1)获取纯化的cd4+t细胞:分离纯化或诱导培育后的cd4+t细胞、cd4+或cd62l+t细胞;
(2)激活细胞:在特殊培养基中0-24小时内激活步骤(1)中获得的细胞;
激活方法为dynabeads,anticd3抗体加anticd28抗体,通过dc细胞呈递特异性多肽,concanavalina试剂或brefeldinacocktail(phorbol12-myristate-13-acetate,ionomycin,加brefeldina)试剂或类似试剂。
(3)培养及细胞增殖:在激活后的第三天,将细胞离心,去上清,并培养于辅以10%胎牛血清,抗生素(antibiotic-antimycotic(1x)-thermofisherscientific)和100u/ml白细胞介素-2的rpmi-1640(后简称为rpmi)培养基中;刺激增值和诱导分化;
被激活后的t细胞会呈现快速的增殖,细胞数加倍时间小于24小时。整体扩增时间大约会持续14天。细胞加倍时间,是衡量细胞增值速度的一个标准。时间越短,细胞增殖越快。本发明中细胞每天以2-10倍的速度增殖,增殖持续≥14天。保护极化增殖刺激至少7天,至多14天后的细胞特性。
(4)取激活末期的细胞并检测,即可。
处于激活末期的t细胞即为成品,应对其功效进行检测,包括体外实验和体内实验。
所述步骤(1)中的细胞来源包括并不限于人源的外周血,脐带血,免疫器官内的血细胞和血前体细胞,癌症侵入淋巴细胞(包括原位肿瘤和转移肿瘤)和鼠源的外周血和免疫器官内的血细胞,比如从脾脏或淋巴结获取。
初始的cd4+t细胞包括所有表达cd4表面抗原的t细胞。包括但不限于,人外周血,脐带血,癌症侵入细胞,以及其他事先操作过的cd4+t细胞。可先从骨髓,脐带血等来源取得造血干细胞,淋巴母细胞等t细胞前体,并诱导分化至cd4+t细胞。
所述步骤(2)中激活细胞的培养基为rpmi辅以10%胎牛血清的培养基中加入100ng/ml转化生长因子β,100ng/ml白细胞介素-4,100ng/ml白细胞介素-21、100ng/ml的γ-干扰素中和抗体,或相同试剂,不同浓度;所述步骤(3)中培养基为rpmi辅以10%胎牛血清+抗生素和100u/ml白细胞介素-2。这样诱导过的细胞,输回病人体内,对癌症有杀伤力。
所述步骤(2)中采用免疫磁珠(dynabeads)激活t细胞,免疫磁珠和细胞比例为1:1,或相似比例。
所述步骤(3)前还有对cd4+t细胞进行修饰步骤;如对t细胞转导嵌合抗原受体或其他细胞因子。优化方案中所述修饰步骤可以在cd4+t细胞被激活后4小时-96小时完成;更进一步优化方案中所述修饰步骤在cd4+t细胞被激活后24小时内完成。
所述修饰步骤为对cd4+t细胞转染或转导一段由dna或rna为载体的编码基因;优化方案中所述转染或转导的编码基因,包扩但不限于嵌合式抗原受体,t细胞受体序列或其他细胞素或细胞表面受体;所述转染或转导的方法包括但不限于使用逆转录病毒,慢病毒或转座子。
所述转染或转导的方法依次包括按照序列生产dna质粒步骤、采用这些质粒进行逆转录病毒的包裹步骤、取得宿主t细胞并进行激活和极化步骤、在极化24小时后采用病毒对t细胞进行转导步骤,以及用上述方法继续扩增t细胞,直到达到所需的t细胞数目,或t细胞停止扩增。
应用时可将细胞通过静脉回输进宿主体内;选择同时辅助以其他癌症疗法,包括但不限于细胞因子注射;即选择细胞素注射作为疗法的一部份,也可以配合其他疗法。
所得到的细胞应以所述方法检测,分为体外检测和体内检测;
所述体内实验包括:
(a)采用鼠源肿瘤模型的小鼠作为受体,采用tcr转基因小鼠的t细胞作为供体,研究本专利所述的新亚群(thscm)亚群在携带肿瘤的小鼠体内的存活,性状和分化;
(b)采用几种鼠源癌症-tcr转基因供体细胞模型,研究新亚群供体细胞对多种,表达特异性抗原的固体和血液肿瘤癌细胞的杀伤作用,并观察小鼠的存活时间。
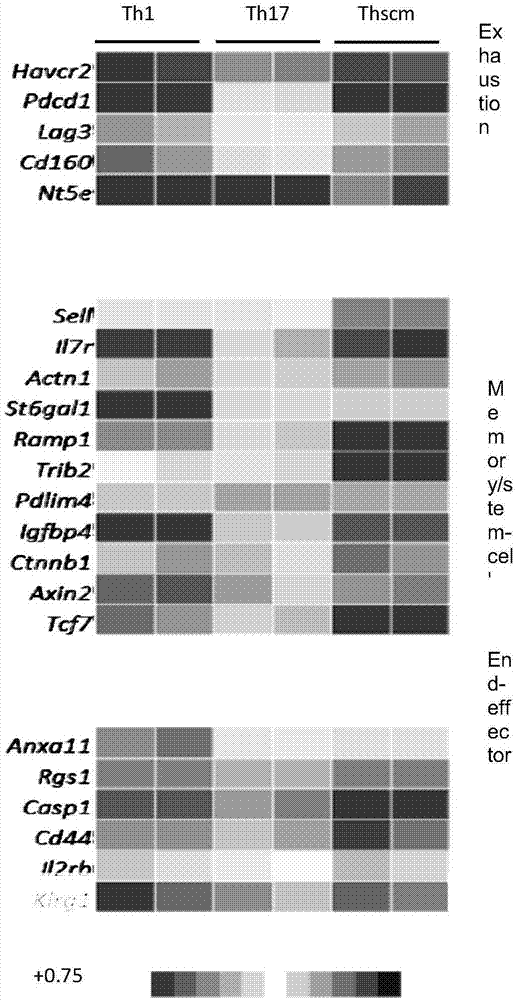
所述体外实验包括:采用实时荧光定量pcr测量新亚群的基因表达,并与其他已经有的cd4+亚群所进行比较;具体为从c57b6的脾细胞中提取cd4+,cd62l+的细胞,诱导分化成为th1,th17和新亚群(thscm),再采用qiagen的rneasykit提取细胞的rna,用thermofisherscientific的superscriptiii将rna逆转录为cdna模板,并用附录中提供的引物做实时荧光定量pcr实验。
新亚群cd4+t细胞,与其他已报道用于抗癌治疗的cd4+t细胞细胞亚群,如th1,th17,th9均有显著区别。我们命名为thscm亚群(thelperstemcellmemory),因为新亚群细胞相比起上述其他cd4+t细胞亚群,有更强的干细胞性。
本发明中用以上方法制备的细胞可以被应用于一种药物组合,该药物组合可用于治愈表达特异性抗原的肿瘤中的应用;所述肿瘤为固体肿瘤或血液肿瘤。
本发明中采集受体的t淋巴细胞,将富集或为富集过的淋巴细胞极化为thscm亚群,在激活过程中,可选择对细胞做出其他改变,如对t细胞转导嵌合抗原受体或其他细胞因子。扩增末期,对细胞进行质量检测,包括但不限于细菌,真菌,支原体和细菌内毒素的检测。
本发明中亚群细胞对表达特异性抗原的固体和血液肿瘤有强烈的杀伤性。同时,本亚群t细胞在回输宿主体内后,有存活力强,副作用小,自我再生,抗疲劳化,抗不利分化(如分化为降低细胞攻击性的调节性t细胞,treg)和增强癌症导向性等效果。在受体针对肿瘤细胞的情况下,细胞群对癌症细胞有强大的杀伤性。
本发明中thscm细胞移植入癌症病人或动物能以实现肿瘤控制。比如将thscm细胞注射入病人静脉,比如将thscm细胞注入病人癌症组织。thscm细胞在同源,肿瘤携带生物体内具有癌症组织导向型和强大的肿瘤杀伤性。
本发明中thscm细胞在同源生物体内长期存活,抵抗疲劳,不会变异为调控型t细胞及引起细胞因子风暴。
本发明中这种方法极化的cd4+t细胞亚群,其对癌症,尤其是晚期固体和血液肿瘤有强大治疗作用。采取人源或鼠源的cd4+未分化t细胞,采用t细胞激活和il-4,il-21,tgfβ,抗infγ抗体一系列细胞因子共同刺激。以此方法极化的t细胞,在大量增殖的情况下,如14日内500-1000倍,同时保有针对癌细胞的杀伤性和自我分化增殖能力。其性状不同于之前报导过,用于对抗癌症的th1,th17和th9等亚群,并且在治疗癌症的功效上有所超过。
在携带b16(黑色素瘤),lewislung(肺癌),e0771(乳腺癌),mc38(结肠癌),rm-1(前列腺癌),panc02(胰腺癌)细胞和raji(b细胞淋巴瘤)的小鼠模型中,以极少的数量,250,000/小鼠,就能治疗以发展至晚期的肿瘤。
附图说明
图1为本发明中delta-deltact的方法进行结果分析图
图2为本发明中细胞在小鼠体内存活总数图
图3和图4为本发明中供体细胞在小鼠体内表面表达的细胞疲劳表面抗原的流式细胞仪分析图
图5为本发明中细胞在小鼠体内的ifnγ染色分析图
图6为本发明中细胞在小鼠体内的foxp3的染色分析图
图7为本发明中cd3+,cd4+细胞在癌症微环境中的比率对比图
图8-图13为本发明中治疗各种固体和血液肿瘤的效果对比图
具体实施方式
下面结合附图及具体实施方式对本发明方法进行进一步说明:
实施例1
(1)取得纯化的人源的cd4+t细胞:将外周血,进行ficoll密度梯度处理,取得存活的细胞,并去除红细胞。采用miltenyi出产的panhumancd4+t细胞磁化分选系统,得到纯化后的cd4+t细胞。
(2)t细胞的激活:从步骤1中获得的t细胞,在培养基(rpmi辅以10%胎牛血清的培养基中加入100ng/mltgfβ,100ng/mlil-4,100ng/mlil-21和100ng/mlanti-ifnγ;以下相同)中用thermalfisher出产的dynabeads激活。
(3)培养及细胞增殖:在激活后的第三天,将细胞离心,去上清,并培养于辅以10%胎牛血清,antibiotic-antimycotic和100u/mlil-2的rpmi培养基中;刺激增值和诱导分化;
被激活后的t细胞会呈现快速的增殖,细胞数加倍时间小于24小时。整体扩增时间大约会持续14天。细胞加倍时间,是衡量细胞增值速度的一个标准。时间越短,细胞增殖越快。本发明中细胞每天以2-10倍的速度增殖,增殖持续≥14天。保护极化增殖刺激至少7天,至多14天后的细胞特性。
(4)取激活末期的细胞并检测其生物安全性,包括可能的细菌,真菌和支原体感染。将收获的细胞冻存。
实施例2
其它内容如实施例1中,极化和扩增cd4+t细胞的方法。增加对t细胞的转导步骤。
(1)如实施例1,从b型白血病病人外周血取得纯化的人源的cd4+t细胞。为了更好的最终结果,可分选cd4+,cd62+的t细胞,因为初始细胞纯度越高,诱导后的细胞纯度越高。
(2)如实施例1,将cd4+t细胞在培养基内,用dynabeads激活
(3)采用其他文献中记载的方法,包裹可以转导人源t细胞的逆转录病毒,其转导序列为car019的嵌合抗原受体分子。[美国专利us9,328,156b2seq8]
(4)培养及细胞增殖:在激活后的第三天,将细胞离心,去上清,并培养于辅以10%胎牛血清,抗生素和100u/mlil-2的rpmi培养基中。一直培养到细胞数达到目的或细胞停止增殖。
(5)这样诱导过的细胞,输回病人体内,对b型白血病有杀伤力。
实施例3
(1)从c57b6小鼠的脾细胞中提取cd4+,cd62l+的细胞。采用小鼠脾脏或淋巴结,获取后,研磨并过40微米筛网,得到细胞悬浮液。将细胞悬浮液或小鼠血液采用普通红细胞裂解液处理,并用磷酸缓冲液清洗两遍。对细胞进行计数,并采用miltenyi出产的panmousecd4+t细胞磁化分选系统,得到纯化后的cd4+t细胞。可分选cd4+,cd62+的t细胞,因为初始细胞纯度越高,诱导后的细胞纯度越高。
(2)按照前文所述的方法和已经发表的方法,诱导分化成为th1,th17和thscm.(由于我们推测新亚群可能会和th17亚群有一定的共同性,我们主要对其与th17亚群进行了比较。)采用qiagen的rneasykit提取细胞的rna。并且用thermofisherscientific的superscriptiii将rna逆转录为cdna模板。并用下表中提供的引物做实时荧光定量pcr实验。
本检测采用基因gapdh和actb作为housekeepinggene,并采用delta-deltact的方法进行结果分析,结果见图1。明显可见,新亚群相比th17亚群有更强的干细胞性。同时,新亚群和th1亚群有更明显的差异。新亚群不同于亚群th9,具体表现为其相较th9有更强的干细胞特性,如th9亚群的干细胞因子sell(cd62),il7r(cd127)等的表达量低于th17亚群,故更加低于新亚群。同时,激活相关因子如cd44,th9亚群高于新亚群。
实施例4
其它内容如实施例3中的内容,其中供体小鼠可以是wildtype型,也可以是tcr转基因型。
实施例5
本发明中thscm细胞移植入小鼠体内后,相较于其他cd4+t细胞亚群,有更强的存活时间,和更强的抗疲劳性。同时副作用也更小。
(1)采用同源的小鼠癌症模型,鼠源b16黑色素瘤和trp-1转基因t细胞。需采用同源的供体和受体,但某个细胞表面因子在两者上的表达需有所不同。如,选择c57b6cd45.2小鼠作为受体时,应选择trp-1cd45.1小鼠t细胞作为供体,以便在流式细胞仪上加以区分。从trp-1cd45.1转基因小鼠脾脏提取cd4+,cd62l+细胞,并按照上文提供的方法,和其他已经报导过的方法将其诱到分化成,th1,th17,th9和thscm亚群,并将同样数目的细胞,通过尾静脉注射的方式输入至携带b16肿瘤(当肿瘤直径达到10mm)的小鼠体内,并在特定的时间点取血或处死小鼠,对注入的t细胞,和小鼠自身的t细胞进行研究。
(2)在细胞注入的第15和30天处死小鼠,并提取小鼠的脾脏和引流淋巴结针细胞,对cd45.1,cd3,cd4,pd-1,lag-3,klrg-1,cd244等细胞表面抗原染色。输入的cd4+t细胞的存活率,可以由以下计算得出cd45.1+细胞总数/(cd3+,cd4+)细胞总数。得到细胞存活总数。见图2,结论,新亚群相比较th1,th17和th9细胞,在宿主体内有更长的存活时间。
(3)重复上述实验的细胞制备和注入小鼠,并在第10天处死小鼠。消化处理其肿瘤组织成为单细胞悬浮液,然后对其中供体细胞(cd45.1+)细胞表面表达的细胞疲劳表面抗原进行流式细胞仪分析(见图3,图4)。结果为,thscm细胞的疲劳化表面抗原,包括pd-1,lag-3,klrg-1和cd244,的表达量,低于th17和th9并远远低于th1。由此可得出,thscm亚群有抵抗疲劳化的特性。
(4)重复上述实验的细胞制备和注入小鼠,并在第10天处死小鼠。消化处理其肿瘤组织成为单细胞悬浮液,对其表面和细胞内的抗原cd45.1,cd3,cd4,cd8,ifnγ,foxp3进行染色。通过对细胞的ifnγ染色可得知,thscm不同于传统th1和th9,是不分泌ifnγ的(见图5)。由于已经证明,ifnγ是细胞因子风暴和多种副作用的主要诱因,可知,thscm在回输体内后,所引起的多种副作用会更轻微。
(5)由对foxp3的染色可知,th17细胞在癌症微环境中,会被部分转化为treg,而thscm细胞不会有这种变化(见图6)。
(6)最后,通过对比cd3+,cd4+细胞在癌症微环境中的比率可得出,thscm亚群t细胞数量在癌症微环境中最高(见图7)。可知,thscm有最优的癌症导向性。
实施例6
本发明中thscm细胞移植入小鼠体内后,相较于其他cd4+t细胞亚群,针对癌症的杀伤性更强,持续时间也最久。
(1)为了验证cd4+t细胞和cd8+t细胞的互动,另一方面,也为了验证thscm亚群对其他固体和血液肿瘤的杀伤性,需使用b16(黑色素瘤)肿瘤细胞,和其他几种固体肿瘤细胞,以及b淋巴癌细胞。除b16的其他几种肿瘤细胞,即lewislung(肺癌),e0771(乳腺癌),mc38(结肠癌),rm-1(前列腺癌),panc02(胰腺癌)细胞和raji(b淋巴癌)细胞。在使用前需通过分子生物技术在中转基因ovalbumin(lewislung,e0771,mc38,rm-1和panc02)或luciferase(raji)。采用b16肿瘤时,须采用trp-1cd45.1+转基因小鼠t细胞作为供体。采用其他ovalbumin转基因肿瘤时,相应应采用ot-ii,cd45.1+小鼠的t细胞作为供体。采用raji(luciferase转基因)肿瘤时,应采用人源t细胞和免疫缺陷小鼠作为受体,并在激活后对t细胞进行car019的嵌合抗原受体分子。[美国专利us9,328,156b2seq8]
(2)为了模仿末期癌症,并尽量使技术适应多种多样的病人,如,在肿瘤中只能分离出少量癌症侵入t细胞的病人,需采用较为极端的实验条件。1,000,000b16黑色素瘤,或其他ovalbumin转基因的癌细胞,被注射在小鼠皮下,以形成肿瘤。在肿瘤形成的过程中,需从供体小鼠的脾脏分离(cd4+。cd62l+)细胞并按照上文和其他报导所述,诱导分化为th1,th17,th9和thscm亚群。需协调癌症生长时间与t细胞分化增殖时间,使得,在癌症细胞的长直径达到10mm时开始治疗,即对宿主免疫细胞的清除(每只小鼠腹腔注射2mgcyclophosphamide)和t细胞的尾静脉注射(cyclophosphamide注射的24小时以后)。在治疗之前,重新对小鼠分组以确保各组的小鼠肿瘤的平均体积最接近。注射计量为0.25millionth1,th17,th9或thscm.注意,0.25million的注射量远远低于主流学术论文报导的供体t细胞注射量。肿瘤注射后,应以每5日-7日为时间点,对所有组小鼠的肿瘤大小进行测量。测量可采用游标卡尺等长度计量工具,并通过公式v=1/2*长直径*(段直径)^2来计算肿瘤的体积。
(3)采用luciferaserajib淋巴癌细胞时,应对小鼠进行尾静脉注射(1,000,000细胞/小鼠)。并且每5日,对小鼠进行体内成像以测量淋巴癌的生长程度。在每小鼠发光强度达到1000000单位时开始治疗,治疗方法同上述固体肿瘤方法。然后每5日,对小鼠进行体内成像。
(4)实验结果为,thscm亚群在治疗各种固体和血液肿瘤方面,与以前报导过的th1,th17和th9亚群相比,取得了最好的治疗效果(图8-图13)。采用thscm亚群治疗时,在血液肿瘤和多种固体肿瘤模型中,实现了100%的治愈率,并且在几十天至几百天的观察时间中,未见复发。相比之下,采用其他亚群的t细胞无法达到如此效果。即使有治愈的情况,也远远达不到100%。同时证明,thscm亚群针对表达特异性抗原的多种固体和血液肿瘤具有强杀伤性。
综上所述,本发明采取人源或鼠源的cd4+未分化t细胞,采用t细胞激活和转化生长因子β(tgfβ),白细胞介素-4(il-4),白细胞介素-21(il-21)和γ-干扰素中和抗体(anti-ifnγ)一系列细胞因子共同刺激。以此方法极化的t细胞,在大量增殖的情况下,如14日内500-1000倍,同时保有针对癌细胞的杀伤性和自我分化增殖能力。其性状不同于之前报导过,用于对抗癌症的th1,th17和th9等亚群,并且在癌症治疗的功效上有所超过。以这种方法极化的cd4+t细胞亚群,其对多种表达特异性抗原的癌症,包括固体和血液肿瘤有强大治疗作用。
以上显示和描述了本发明的基本原理和主要特征以及本发明的优点,上述实施例和说明书所描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都将落入要求保护的本发明范围内。本发明要求保护的范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!