一种延缓衰老的干细胞来源外泌体制剂的制作方法
本发明涉及利用胚胎干细胞分泌的外泌体来延缓间充质干细胞衰老并增强其治疗效果的技术手段,属于组织工程与新医药技术领域。
背景技术:
胚胎干细胞是一种高度未分化的细胞,它能够在体外培养时无限增殖,并且具有高度的自我更新和多向分化的潜能。胚胎干细胞可以分化为所有类型的细胞,是基因治疗最为理想的靶细胞。由于这些优良特性,胚胎干细胞被称为“种子细胞”,为临床的组织器官移植提高大量的原料。但是由于胚胎干细胞在临床应用中受到免疫排斥和伦理道德等方面的约束,限制了其在临床上的应用,因此,科学家们正在寻找一些其他途径代替胚胎干细胞发挥相关的治疗效果。
外泌体通常被认为是由细胞内部多囊泡体向内出芽所产生的微囊泡,在多囊泡体与细胞膜融合时,将其内部的微囊泡释放至细胞膜外,形成外泌体。外泌体的直径约为40-100nm,其内部富含细胞内具有生物活性的信号分子,包括dna、rna、microrna及蛋白质等。所有的培养的细胞类型都可以分泌外泌体,包括干细胞、内皮细胞、免疫细胞等,外泌体也天然存在于体液中,包括乳液、尿液、血液、唾液等。被释放至细胞外的外泌体可以通过不同的途径进入靶细胞内,发挥其生物学功能。第一,与细胞分泌的可溶性旁分泌因子类似,外泌体可以通过与靶细胞膜表面受体结合,触发靶细胞内的信号转导通路,并进一步调节靶细胞内的生物学过程;第二,外泌体可以被靶细胞内在化,这一过程依赖于网格蛋白介导的内吞作用、脂筏介导的内吞作用及胞饮作用等;第三,外泌体可以通过与靶细胞膜融合,直接将外泌体内携带的活性物质递送到靶细胞内。外泌体介导了细胞间的通讯,它的功能取决于它所来源的细胞类型,参与肿瘤的迁移、机体免疫应答、细胞分化、细胞迁移等方面。
间充质干细胞是干细胞家族的主要成员,是一种多能干细胞,在体内或体外经过诱导,可分化为脂肪、软骨、肌肉、神经、心肌等组织。间充质干细胞存在于多种组织,包括骨髓、脐带组织、脐带血、胎盘组织、脂肪组织等,具有多向分化的潜能。我国已将间充质干细胞用于治疗临床上的很多疑难疾病,如脑瘫、系统性红斑狼疮、糖尿病、肝硬化、中风等,并且取得了明显的疗效。随着技术的进步,对间充质干细胞的需求量也随之增大,而在体外培养间充质干细胞过程中,随着传代次数增加,间充质干细胞出现衰老相关的特点,如细胞形态变得扁平,增殖速度减慢,dna损伤程度增大,细胞凋亡增多,端粒缩短等。衰老的细胞在临床上的治疗效果会有一定程度的降低,所以科学家们尝试多种方式来缓解干细胞的衰老,并且为早衰症等疾病的治疗提供一定的思路。
技术实现要素:
本发明是一种利用胚胎干细胞分泌的外泌体来延缓间充质干细胞衰老并增强其治疗效果的技术手段
本发明是一种利用胚胎干细胞来源的外泌体处理复制性衰老的胎盘来源间充质干细胞,从而缓解间充质干细胞的衰老,并进一步提高其治疗效果。
所述外泌体为干细胞来源的外泌体,所述干细胞包括胚胎干细胞,脂肪间充质干细胞、骨髓间充质干细胞、脐带间充质干细胞、胎盘间充质干细胞等。
本发明可以有效缓解间充质干细胞衰老,改善细胞形态,提高细胞增殖速度,提高干细胞干性,减弱dna损伤程度等,并有效的提高间充质干细胞对皮肤损伤的治疗效果。
附图说明
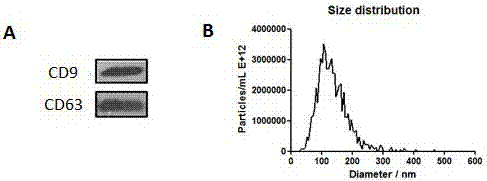
图1为外泌体特征的鉴定,该外泌体为胚胎干细胞来源的外泌体。
图2为外泌体可以被细胞内吞从而发挥作用。
图3为胚胎干细胞来源外泌体处理间充质干细胞,提高细胞增殖能力和降低dna损伤程度以及sa-β-gal染色结果。
图4为外泌体处理之后的间充质干细胞治疗皮肤损伤,h&e染色和masson染色显示外泌体处理组对皮肤损伤的治疗效果更好,皮肤愈合速度更快。
具体实施方式
下述实施例中如无特殊说明所用方法均为常规方法,所用试剂均可以从商业途径获得。
实施例1,本发明提供一种干细胞来源的外泌体提取及鉴定的方法。
细胞培养基、双抗、胰酶等试剂均购于gibco公司;细胞培养耗材均购于corning公司。
细胞培养所需血清为去除外泌体的胎牛血清,购于bi公司,处理步骤如下:将胎牛血清置于超速离心管中,120000g在4℃离心2h,在超净台中取上清,并用0.22μm的针式滤器过滤,保存于-80℃冰箱备用。
细胞传代培养、冻存及复苏等细胞生物学实验操作步骤详见《动物细胞培养(第六版)》。
收集含有外泌体的hp-mscs条件培养基:当培养于75cm2的细胞培养瓶中的hp-mscs处于对数增长期,细胞汇合度达到80%时,吸尽培养基,用pbs洗两次,每瓶加入10ml配置好的含有10%无外泌体的fbs的完全培养基,继续培养24h后,将培养基收集至离心管中,该培养基为富含外泌体的条件培养基。
超速离心法分离提取外泌体:①将上述步骤获得的条件培养基于4℃,300g离心10min,去除细胞碎片;②将所得上清于4℃,12000g离心20min,去除凋亡小体等大的细胞碎片;③用0.22μm的针式滤器过滤所得上清,去除直径大于200nm的微囊泡;④把过滤后的上清置于超速离心管中,4℃100000g离心70min,弃上清,加入适量pbs重悬管底沉淀,于-80℃保存。
通过westernblot检测外泌体标志蛋白cd9和cd63(图1)。
1)蛋白样品制备:将超速离心后得到的外泌体沉淀中加入ripa裂解液裂解外泌体,反复吹打后移入洁净1.5mlep管中,在冰上裂解30min,每10min涡旋振荡一次,于4℃,12000rpm离心15min,将上清移入新的ep管中;使用bca法测定外泌体蛋白浓度,其余蛋白液中加入5×上样缓冲液,在沸水中煮10min,保存于-80℃冰箱中备用。
2)聚丙烯酰胺凝胶电泳:将洁净晾干的玻璃板装于制胶架上,使底边吻合严密,用蒸馏水验漏。按照分离胶配方配制10%的分离胶溶液,充分混匀,用移液器加入4.5ml分离胶溶液至玻璃板缝隙中,立即轻柔加入蒸馏水将分离胶液面压平,约20min后分离胶凝固。按照配方配制5%的浓缩胶溶液,灌注1.5ml浓缩胶溶液到分离胶的上方,立即插入梳子,待浓缩胶凝固后便可使用。将配好的胶板放置到电泳槽内,注意短玻板向内侧,在两块玻板中间加入电泳液,将梳子拔出,按照测定蛋白浓度统一上样量,将蛋白样品加入上样孔中,添加电泳液至电泳槽标记处,盖好电泳槽盖,注意连接正负极,90v开始电泳,待溴酚蓝跑至分离胶时,将电压调至120v,直至溴酚蓝接近玻板底部时停止电泳。
3)转膜:将转膜夹与海绵及滤纸浸泡于预冷的转膜缓冲液中,把聚丙烯酰胺凝胶置于黑色夹板一侧,剪取适宜大小的pvdf膜,置于甲醇中活化60s,放置于胶上,除尽气泡,覆盖滤纸和海绵,按照转膜夹负极(黑色)-海绵-滤纸-胶-膜-滤纸-海绵-正极(白色)顺序夹好转膜夹,放置于转膜槽中,添加转膜液,冰浴恒压120v转膜2h。
4)封闭:将转膜完成的pvdf膜取出,用tbst溶液洗尽凝胶残渣,置于5%的脱脂牛奶(封闭液)中,水平摇床100rpm室温封闭1h。
5)抗体杂交:①一抗孵育:用封闭液按照说明书稀释一抗(gapdh,1:5000稀释,cd9,1:1000稀释,cd63,1:1000稀释),吸取2ml一抗置于抗体孵育盒中,对照蛋白marker将目的条带剪下,浸泡于对应一抗中,4℃孵育过夜;②二抗孵育:将条带用tbst溶液清洗3次,每次5min,然后加入对应二抗,水平摇床100rpm室温孵育2h,孵育完成后用tbst洗3次,每次5min。
6)发光检测:把发光液a/b按1:1比例进行混合配成工作液,在暗室中将发光液滴加在膜上,待目的条带发出绿色荧光时,用胶片进行曝光、显影及定影。
实施例2,本发明提供建立衰老细胞模型的方法。
间充质干细胞在体外培养扩增的过程中,细胞形态变得扁平,增殖速度减慢,此时细胞周期相关蛋白表达升高,抑制细胞增殖,并且β-gal活性增加,说明细胞处于衰老的状态,因此用这种复制性衰老的细胞作为细胞衰老的模型。
实施例3,本发明提供一种用外泌体缓解间充质干细胞衰老的技术
用分离得到的胚胎干细胞来源的外泌体处理衰老的间充质干细胞,检测处理12h,24h,48h之后细胞增殖情况的变化。在处理48h之后,提取蛋白质和rna,对相关的基因和蛋白质的表达进行检测,并对dna损伤位点γ-h2ax进行检测,各项衰老相关指标检测结果表明,胚胎干细胞来源的外泌体能够缓解间充质干细胞的衰老。
实施例4,本发明提供小鼠皮肤损伤模型的构建方法。
小鼠皮肤损伤模型的构建:称取小鼠体重,按330mg/kg(10μl/g)4%水合氯醛的剂量,腹腔注射麻醉小鼠;在小鼠背部剪除全层皮肤及肉膜,暴露肌肉层,造成直径为1cm的圆形皮肤缺损;将手术后动物随机分为4组:f12处理组,间充质干细胞条件培养基(pmsc-cm)处理组,胚胎干细胞条件培养基(es-cm)处理组,外泌体(es-exo)处理组,并于皮肤损伤位点分别注射f12,pmsc-cm,es-cm,es-exo处理的间充质干细胞。
- 还没有人留言评论。精彩留言会获得点赞!