尿液miRNAs生物标志物及其筛选方法和应用与流程
本发明属于生物医学领域,涉及尿液mirnas生物标志物的筛选方法及其在肝癌诊断标志物发现中的应用。
背景技术:
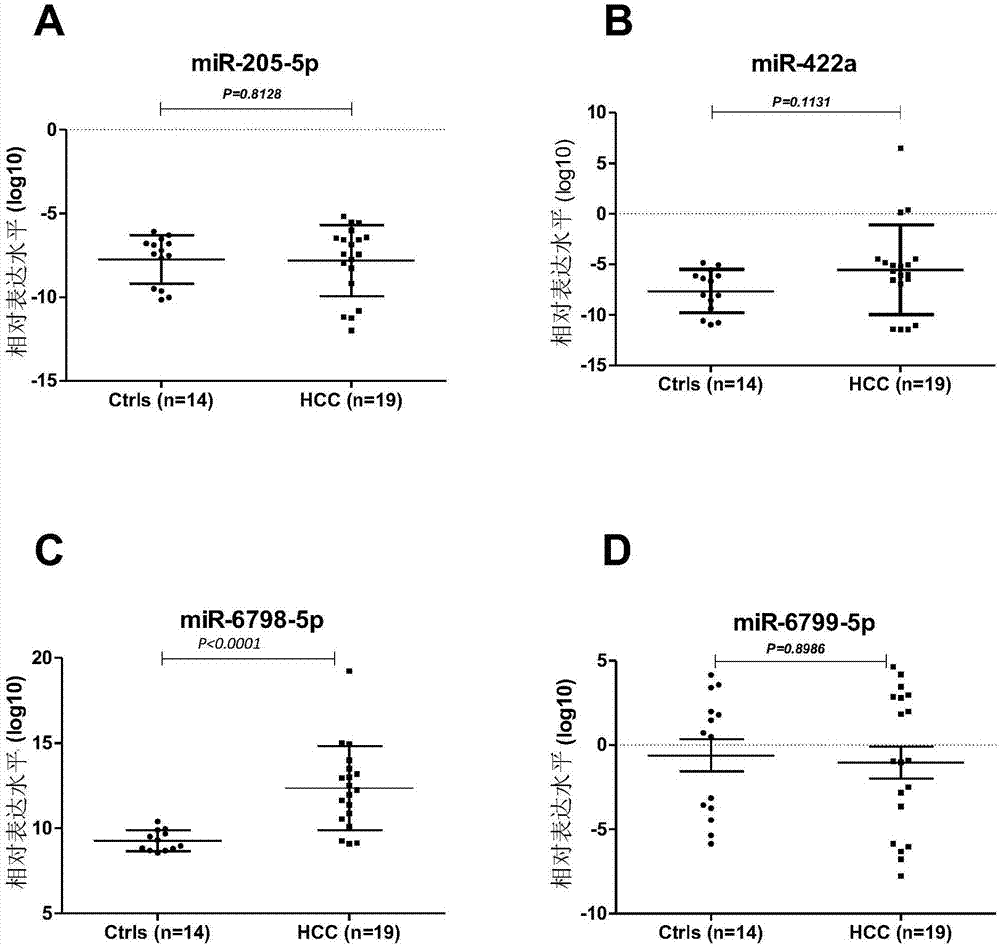
:原发性肝细胞肝癌(hepatocellularcarcinoma,hcc)是临床上最常见的恶性肿瘤之一,在全球恶性肿瘤发病率和死亡率分别为第七位和第五位,我国卫生部统计得出肝癌死亡率占肿瘤死亡率的第二位。在肝癌的治疗中,早期手术切除是目前首选的、最有效的治疗方法,而早期诊断和早期治疗,是提高疗效的关键。但是鉴于肝癌起病隐匿,恶性程度高,进展迅速,只有10-20%适合手术治疗。因此,早期诊断对提高肝癌患者的生存率和改善肝癌患者预后至关重要。mirnas是现代生物医学中的一个重要的调节分子,它通过对基因转录表达的调控,调控着人体所有细胞、组织和器官的各种功能,在人类疾病的发生和防治中具有十分重要的作用。现大量研究发现,mirnas可以广泛而稳定地存在于细胞外液,包括血清、血浆、尿液和组织间液之中。它们不仅是细胞内基因转录和表达的调节分子,还是细胞之间信息传递的信号分子。在病理过程中,血清/血浆/尿液mirnas表达谱会发生特征性的改变,这些改变有助于对疾病进行诊断和预后判断,甚至与临床分期分级密切相关。且循环和尿液中mirnas作为疾病诊断和预后的标志物,具有检测损伤小、稳定性好、灵敏度高等诸多优点。在正常机能状态下,机体内循环和尿液中mirnas的种类及其表达丰度可能处于一个相对稳定、平衡的状态。当机体处于疾病过程中,表现为异常代谢或特定疾病状态下某些循环/尿液mirnas的表达水平显著性升高或降低。本研究以肝癌患者为研究对象,检测出肝癌患者尿液中mirnas的表达谱和特征性的mirnas,对于丰富肝癌的辅助诊断及病理机制等,具有重要的学术意义和应用前景。技术实现要素:本发明旨在提供一种尿液mirnas生物标志物的筛选方法。本发明还将尿液mirnas应用于肝癌的辅助诊断标志物。技术方案为,尿液mirnas生物标志物的筛选方法,包括如下步骤:1)采集健康者和肝癌患者的尿液,提取总rna;2)初筛:检测健康者和肝癌患者临床尿液标本中mirnas表达,比较健康者和肝癌患者的mirnas表达谱,找出肝癌患者尿液中异常表达的mirnas作为候选;3)复筛:采用实时定量rt-pcr技术,测定尿样中候选mirnas的含量,分别进行小样本和/或扩大样本筛选,筛选和确定可用作肝癌标志物的mirnas;4)用roc曲线法确定步骤3)筛选的肝癌标志物的mirnas。步骤2)中,用mirnas表达谱芯片检测mirnas的表达;利用t检验的p值和倍数变化值进行差异mirna筛选,筛选的标准为差异倍数变化值≥2且p值≤0.05。步骤3)中,选择的标准为差异倍数变化值≥2,且p值≤0.05。步骤3)中,所述的定量rt-pcr技术采用mirna特异的茎环引物逆转录法,并用sybrgreenqpcr检测法进行检测。通过上述方法,步骤2)初筛结果发现,有13个mirnas表达呈上调:mir-125b-2-3p、mir-139-3p、mir-1587、mir-205-5p、mir-422a、mir-3154、mir-3615、mir-3659、mir-422a、mir-4535、mir-4651、mir-6798-5p、mir-6799-5p、mir-6880-5p。步骤3)中,选取mir-205-5p、mir-422a、mir-6798-5p和mir-6799-5p用实时定量rt-pcr方法进行小样本复筛,筛选得到mir-6798进行扩大样本筛选。用roc曲线法(受试者工作特性曲线,receiveroperatorcharacteristiccurve,简称roc曲线)评估mir-6798-5p作为肝癌标志物的临床价值,结果显示,尿液mir-6798-5p进行肝癌诊断的曲线下面积(areaunderthecurve,auc)为0.83,效果良好。由此可见,mir-6798-5p在肝癌患者尿液中高表达,可以作为尿液样本中辅助诊断肝癌的生物标志物,也可以用来筛选治疗肝癌的药物。mir-6798-5p检测引物和逆转录引物,可用来检测尿液样本中mir-6798-5p的表达量,从而用于制备诊断或辅助诊断肝癌的试剂、试剂盒或生物芯片,或者用于筛选治疗肝癌药物的试剂、试剂盒或生物芯片。本发明另一个技术方案为:一种试剂盒或生物芯片,包括在肝癌患者尿液中表达异常的mirna的qpcr逆转录引物和正向检测引物,用于检测在肝癌患者尿液中表达异常的mirna及其表达量,可用来诊断肝癌或者辅助肝癌诊断,也可以用来筛选或辅助筛选治疗肝癌的药物。优选的,所述检测肝癌的试剂盒或生物芯片包括mir-6798-5p的qpcr的转录引物和正向检测引物。优选的,所述检测肝癌的试剂盒或生物芯片,所述mir-6798-5p的逆转录引物的序列包括seqidno.1所述的序列:ctcaactggtgtcgtggagtcggcaattcagttgagcccaagct;所述的正向检测引物序列包括seqidno.2所述的序列:acactccagctgggccagggggatgggcga。更优选的,所述mir-6798-5p的逆转录引物的序列如seqidno.1所示:ctcaactggtgtcgtggagtcggcaattcagttgagcccaagct;所述的正向测序引物序列如seqidno.2所示:acactccagctgggccagggggatgggcga。试剂盒或生物芯片中还包括通用反向检测引物,其序列为:tggtgtcgtggagtcg。由此可见,mir-6798-5p在肝癌患者尿液中高表达,可以作为辅助筛选肝癌的生物标志物。也可以用来筛选治疗肝癌的药物。含有mir-6798-5p检测引物和逆转录引物的试剂盒或生物芯片,可用来检测尿液样本中mir-6798-5p的表达量,从而用于制备诊断肝癌或者筛选治疗肝癌药物的试剂盒或生物芯片。本发明的有益效果在于:1.建立了尿液mirnas生物标志物的筛选方法,并发现与健康者比较,肝癌患者尿液中mirnas存在异常表达;尿液mirnas可作为肝癌诊断标志物,可用于肝癌患者的辅助诊断,对于肝癌的辅助诊断及丰富肝癌的病理机制等,具有重要的学术意义和应用前景;2.mir-6798-5p在肝癌患者尿液中呈高表达,可能是肝癌患者特征性的mirnas分子;采用mir-6798-5p作为尿液中的肝癌生物标志物,可以方便快速地检测,不会对患者造成创伤,mir-6798-5p可用于诊断的标志物及筛选治疗肝癌的药物;3.本发明以尿液为样本,生物样本易得,收集简便、无创、数量大,通过检测疾病标志物mirnas就可以进行诊断或辅助诊断,mirnas作为疾病生物标记物具有广阔的应用前景。附图说明图1为本发明筛选方法的流程图;图2为健康者(ctrls)和肝癌(hcc)患者尿液mir-205-5p、mir-422a、mir-6798-5p和mir-6799-5p表达情况(小样本验证);图3为健康者(ctrls)和肝癌(hcc)患者尿液mir-6798-5p表达情况;图4为肝癌(hcc)患者尿液mir-6798-5p的roc曲线。具体实施方式筛选过程如图1所示,步骤包括:(a)采集健康者(ctrls)和肝癌患者(hcc)的尿液,提取总rna(包括mirnas);(b)初筛:用mirnas芯片检测健康者和肝癌患者临床尿液标本中mirnas表达谱,比较健康者和肝癌患者的mirnas表达谱,初筛找出肝癌患者尿液中异常表达的mirnas作为候选;(c)小样本复筛:用实时定量rt-pcr(qrt-pcr)技术,测定每份尿样中候选mirnas的含量,筛选可以用作hcc标志物的mirnas;(d)扩大样本复筛:用实时定量rt-pcr(qrt-pcr)技术,测定每份尿样中候选mirnas的含量,进一步确定可用作hcc标志物的mirnas;(e)用roc曲线法分析筛选的肝癌标志物的mirnas,进行临床价值评估。实施例1采集样本和用mirvanatmparistmkit(ambion-1556)提取尿液totalrna:1.取尿液样本800μl,加入等量的2×denaturingsolution,涡旋混匀,冰上放置5分钟。2.加入等体积的酚/氯仿,涡旋混匀30-60秒。3.加入10μlcel-mir-39(1.5x109copies/μl),充分混匀。室温,12000转/分钟离心5分钟。4.小心吸取上清到新的1.5ml离心管中,添加1.25倍体积的无水乙醇,涡旋混匀。5.转移至柱子中(最大体积700μl),10000g离心30s。6.混合10μldnasei和70μlbufferrddqiagen(#79254)总体积:80μl,加到离心柱中的膜上,室温放置15min。7.加入350μlmirnawashsolution1到离心柱中,10000g,室温离心15秒,弃流过液,将离心柱重新放置到收集管中8.加入500μlwashsolution2/3过柱两次,10000g,室温离心15秒,弃流过液,之后空柱离心1分钟。将离心柱放置到新的收集管中,柱中心加50μl95℃预热的elutionsolution,室温12000转/分钟离心20-30秒,收集管中的液体即为提取的totalrna,可放置在-80℃保存或进行后继实验。实施例2芯片检测初筛,芯片杂交的操作流程如下:取100ngtotalrna起始,定容到2μl。(1)去磷酸化:a.按下表所示的顺序配制去磷酸化混合液:表acipmastermix1×9×10×calfinterinalphosphatasebuffer0.4μl3.6μllabelingspike-in1.1μl9.9μlcalfintestinalphosphatase0.5μl4.5μl总体积2μl18μlb.pcr仪反应:37℃下扩增30min。(本步骤结束后,如不立即进行下面的反应,可将反应样品置于-80℃保存备用。)(2)样品变性:a.在每管样品中添加2.8μl100%dmso,混匀离心;b.上述反应混合液置于100℃pcr仪中5-10分钟(7分钟);c.迅速转入冰水浴中冷却。(3)连接标记:a.将10×t4rnaligasebuffer置于37℃温育并间隔涡旋,直至沉淀全部溶解,然后将其冷却至室温备用。b.按下表配制连接反应混合液(注意,反应混合液应在使用前配制,配好后放在冰上,并在15分钟内使用):表bligationmastermix1×9×10×t4rnaligasebuffer1μl9μlcy3-pcp3μl27μlt4rnaligase0.5μl4.5μltotal4.5μl40.5μlc.pcr反应:16℃温育2小时。(4)标记后rna纯化:标记后rna移至2ml管,1000×g离心2min;取上清液移至1.5ml管,向样品中加入38.7μl超纯水(rfwater)定容至50μl,1000×g离心4min,弃上清,定容至50μl。(5)纯化后样品抽干:1)45℃浓缩1小时(如未经纯化的样品45℃浓缩3小时)2)将抽干的样品重新溶解在17μlnuclease-free水中(6)准备10×blockingagent:1)在冻干的10×geblockingagent管中加入125μlnuclease-free水,轻微涡旋,以使其完全溶解,必要时可将其置于37℃温育4-5分钟。2)稍离心,放置备用。配制好的10×geblockingagent可放置在-20℃保存2个月,每次融化使用时,注意涡旋混匀并离心。(7)准备杂交反应:1)配置反应体系表c杂交反应体系混合物样品17μlhybspike-in1μl10×geblockingagent4.5μl2×hi-rpmhybridizationbuffer22.5μl总体积45μl2)反应条件:100℃5min冰水混合物5min3)上芯片,55℃20小时,20rpm滚动杂交。杂交后,取出芯片于洗液1中洗涤5分钟;再将芯片放入洗液2中洗涤5分钟(37℃)。然后在agilent扫描仪中选择相应的参数扫描。结果如表1所示,mir-125b-2-3p、mir-139-3p、mir-1587、mir-205-5p、mir-422a、mir-3154、mir-3615、mir-3659、mir-422a、mir-4535、mir-4651、mir-6798-5p、mir-6799-5p、mir-6880-5p的表达均有2倍以上提高,而且p值≤0.05。表1.肝癌患者(hcc)尿液中mirnas的表达(hcc/ctrls)实施例3复筛:rt-qpcr检测小样本复筛选取mir-205-5p、mir-422a、mir-6798-5p和mir-6799-5p,检测ctrls和hcc患者尿液中这些mirnas分子表达情况(ctrls14个,hcc19个)。结果显示,mir-6798-5p在肝癌患者尿液中呈高表达(p<0.0001),如图2所示。其余的mirnas表达量没有显著差异,而且p值超过0.1。大样本复筛检测mir-6798-5p在肝癌患者尿液中的表达(ctrls24个,hcc47个)。结果显示,mir-6798-5p在肝癌患者尿液中呈高表达(p<0.0001),如图3所示。用“两步法”rt-qpcr的方法定量基因表达。两步法中,首先,rna用反转录酶生成cdna。第二步为取一部分cdna作为模板再进行多个qpcr反应。小样本复筛和扩大样本复筛均按以下步骤操作。1.第一步:cdna模板的制备(反转录)20μl反转录体系如下:表d试剂浓度体积mirna逆转录引物0.5μm2μl总rna——13μl其中,逆转录引物rtp的序列如表2所示。轻柔混匀,65℃孵育5min,之后,放到冰上冷却,短暂离心收集,加入以下试剂:表e试剂浓度体积终浓度5×rtbuffer5×4μl1×rtenzymemix1μl轻柔混匀,37℃孵育60min,之后,70℃孵育15min,灭活m-mlv活性。置于冰上冷却,短暂离心收集,可以直接用于pcr扩增,或于-20℃保存。2.第二步:pcr反应(a)pcr反应液的配制表f(b)pcr的反应条件95℃60s,(95℃15s,60℃20s,72℃10s)×40循环,溶解曲线分析以上pcr反应所使用的引物序列如表2所示,其中,rtp表示rtprimer,即逆转录引物;fp表示forwardprimer,即上游检测引物。下游检测引物为urp(统一反向引物)。表2mirnas的qrt-pcr表达检测引物数据处理与统计分析采用cel-mir-39标化、计算每一种被检mirnas的△ct值,录入excel数据表,建库。采用2△ct分析不同组别间的mirnas表达水平的差异,△ct=ct内参基因-ct靶基因。数据正态性检验采用动差法,非正态数据的组间比较采用mann-whitney检验或kruskal-wallis检验。对差异表达的mirnas、差异表达的mirnas与中医证候及临床指标等进行相关性分析和统计学处理,采用spss15.0和sas软件完成,以p<0.05为显著性检验水准。roc(receiveroperatingcharacteristic,roc)分析及auc(areaunderthecurve,auc)计算由graphpadprism软件完成。小样本复筛的结果如图2所示,其中ctrls数量为14个,hcc样本数量19个。结果显示,mir-6798-5p的表达量有显著提高,而且<0.0001;其余3种mirnas的ctrls和hcc表达量没有明显差异,p值大于0.1,其中,mir-205-5p为0.8128,mir-422a为0.1131,mir-6799-5p为0.8986。。扩大样本复筛进一步验证(ctrls数量为24个,hcc样本数量71个),mir-6798-5p的复筛结果如图3所示,hcc患者尿样中的mir-6798-5p表达量有明显增加,而且p<0.0001。用roc曲线法(受试者工作特性曲线,receiveroperatorcharacteristiccurve,简称roc曲线)分析mir-6798-5p在hcc方面的诊断价值。结果如图4所示,其中纵轴为灵敏度,横轴为100%-specificity%(即100%-特异度%,假阳性率)。曲线下面积auc=0.83,说明诊断的正确度高。由此可见,mir-6798-5p在肝癌患者尿液中高表达,可以作为筛选肝癌的生物标志物,也可以用来筛选治疗肝癌的药物。mir-6798-5p检测引物和逆转录引物,可用来检测尿液样本中mir-6798-5p的表达量,从而用于制备诊断或辅助诊断肝癌的试剂、试剂盒或生物芯片,或者用于制备筛选治疗肝癌药物的试剂、试剂盒或生物芯片。含有mir-6798-5p检测引物和逆转录引物的试剂盒或生物芯片,可用来检测尿液样本中mir-6798-5p的表达量,从而用于诊断或辅助诊断肝癌,或者筛选治疗肝癌药物。sequencelisting<110>上海中医药大学<120>尿液mirnas生物标志物及其筛选方法和应用<130>0<160>2<170>patentinversion3.3<210>1<211>44<212>dna<213>人工序列<400>1ctcaactggtgtcgtggagtcggcaattcagttgagcccaagct44<210>2<211>30<212>dna<213>人工序列<400>2acactccagctgggccagggggatgggcga30当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1