CXCL4单抗治疗肿瘤及化疗后肿瘤加速再增殖基因筛选法的制作方法
本申请是申请日为2014年6月24日、申请号为201410289048.9和发明名称为“cxcl4单抗治疗肿瘤及化疗后肿瘤加速再增殖基因筛选法”的发明专利申请的分案申请。
本发明属于生物技术领域,具体涉及一种cxcl4单抗治疗肿瘤及化疗后肿瘤加速再增殖基因筛选法。
背景技术:
肿瘤放化疗诱发的肿瘤“加速再增殖”现象:放化疗仍然是肿瘤的最常用治疗手段,其主要抗肿瘤机理是产生细胞毒作用,导致大量肿瘤细胞死亡。通常认为这一过程中濒死的或已经死亡的细胞会被周围存活的细胞或巨噬细胞等清除细胞消化吸收,而如果有少量的肿瘤细胞存活下来,估计会慢慢的增殖、逐渐的导致肿瘤复发。40年前就开始有文献报道肿瘤在放疗后开启了被称为“加速再增殖(acceleratedrepopulation)”的过程,这一过程中,在放疗打击下逃逸的少量肿瘤细胞存活下来,并能以更加快的增殖速度重建严重受损的肿瘤组织(hermens,a.f.&barendsen,g.w.changesofcellproliferationcharacteristicsinaratrhabdomyosarcomabeforeandafterx-irradiation.eur.j.cancer,5:173–189,1969.),(stephens,t.c.,currie,g.a.&peacock,j.h.repopulationofgamma-irradiatedlewislungcarcinomabymalignantcellsandhostmacrophageprogenitors.br.j.cancer,38:573–582,1978.)。最近,发明人课题组在荷瘤小鼠模型上也观察到了化疗后,残余肿瘤细胞“加速再增殖”的现象。这种本领域技术人员在分子水平知之甚少的“加速再增殖”现象在目前化疗和放疗过程中发挥着主要作用。
治疗后肿瘤“加速再增殖”分子机理是亟需解决的肿瘤学重大科学问题:研究人员为了阐明肿瘤放化疗后加速再增殖的分子机理已经做了大量的研究。最近,我国科学家首次报道在放疗条件下死亡肿瘤细胞在凋亡过程中产生生长刺激信号从而刺激残余肿瘤细胞加速再增殖(huangq,lif,liux,etal.caspase3-mediatedstimulationoftumorcellrepopulationduringduringcancerradiotherapy.natmed,17:860-6,2011.)。他们进一步研究显示caspase3这一凋亡过程关键蛋白参与了肿瘤细胞的生长刺激。caspase3调节的下游信号蛋白前列腺素e2(pge2)能够刺激存活肿瘤细胞的增殖。在肿瘤细胞或肿瘤间质细胞中拮抗caspase3可以提高异种移植肿瘤或小鼠肿瘤对放疗的敏感性。临床上癌症患者肿瘤组织中高水平活化状态的caspase3与病人肿瘤高复发率和高死亡率存在显著相关性。他们的研究揭示了caspase3在放疗后肿瘤加速再增殖通路中扮演了关键角色(huangq,lif,liux,etal.caspase3-mediatedstimulationoftumorcellrepopulationduringduringcancerradiotherapy.natmed,17:860-6,2011.)。揭示了放疗对肿瘤生长具有细胞毒和加速再生长的双重作用和作用机理。特别是“加速再增殖”作用,并不是放疗的直接作用,而是通过上调了caspase3实现的。因此,靶向“加速再增殖”通路的关键分子caspase3提供了抑制放疗后“加速再增殖”的作用,从而也提高了肿瘤对放疗的敏感性。靶向caspase3有可能成为新的抗肿瘤药物靶点,而具有社会和经济价值。
化疗药物除了直接的细胞毒作用外,还可作用于机体的免疫系统影响其发挥抗肿瘤活性。最新研究报道(bruchardm,mignotg,ghiringhellif,etal.chemotherapy-triggeredcathepsinbreleaseinmyeloid-derivedsuppressorcellsactivatesthenlrp3inflammasomeandpromotestumorgrowth.natmed,19:57-64,2013.),临床常用的两个化疗药物吉西他滨和5-fu,能够激活nod样受体家族,即髓源性抑制细胞(myeloid-derivedsuppressorcell,mdsc)中的pyrin结构域蛋白3(nlrp3)依赖的caspase-1激活复合物(也称为炎症体-inflammasome),导致mdsc高表达白细胞介素-1(il-1)。il-1会进一步诱导cd4+t细胞释放白细胞介素-17(il-17),il-17通过促进肿瘤组织血管生成导致化疗后肿瘤“加速再增殖”。相应地,当肿瘤建立在nlrp3-/-、caspase1-/-小鼠或用白细胞介素-1受体拮抗剂(il-1ra,拮抗il-1)处理的野生型小鼠上时,化疗后肿瘤“加速再增殖”作用受到抑制,使得化疗能够发挥更强的抗肿瘤作用(bruchardm,mignotg,ghiringhellif,etal.chemotherapy-triggeredcathepsinbreleaseinmyeloid-derivedsuppressorcellsactivatesthenlrp3inflammasomeandpromotestumorgrowth.natmed,19:57-64,2013.)。研究结果揭示了化疗对抗肿瘤细胞毒和“加速再增殖”的双重作用,对后者的分子机理研究证实其并不是化疗药物直接对肿瘤的作用,而是通过作用于肿瘤组织中的mdsc间接提高肿瘤血管再生、增加肿瘤组织血液供应实现的。因此,化疗后肿瘤“加速再增殖”通路中的关键分子为开发新的抗肿瘤药物提供了新靶点和新思路,如文章中提到的il-1ra的应用即可抑制化疗后肿瘤“加速再增殖”从而提供化疗抗肿瘤效果。
这些研究揭示了放化疗后肿瘤“加速再增殖”的一些重要机制。然而,最近研究还表明一些化疗药物反而能够通过清除免疫抑制细胞增强抗肿瘤免疫应答(mattarollo,s.r.etal.pivotalroleofinnateandadaptiveimmunityinanthracyclinechemotherapyofestablishedtumors.cancerres,71:4809–4820,2011.)。化疗药物5-fu能够选择性地清除mdsc(vincent,j.etal.5-fluorouracilselectivelykillstumor-associatedmyeloid-derivedsuppressorcellsresultinginenhancedtcell–dependentantitumorimmunity.cancerres,70:3052–3061,2010.),而mdscs是一类不成熟的骨髓细胞,能够抑制人类和小鼠t细胞的活化(gabrilovich,d.i.&nagaraj,s.myeloid-derivedsuppressorcellsasregulatorsoftheimmunesystem.nat.rev.immunol,9:162–174,2009.)。5-fu介导的mdsc清除还不足以避免化疗后肿瘤“加速再增殖”。因而,揭示导致肿瘤细胞“加速再增殖”的另外分子通路非常必要。
cxcl4(pf-4)是最早发现存在于血小板α-颗粒中的肝素结合蛋白,同时其它多种细胞均能够表达cxcl4(kasperb,petersenf.molecularpathwaysofplateletfactor4/cxcl4signaling.eurjcellbiol,90:521-26,2011.)。cxcl4的受体是cxc趋化因子受体3(cxcr3),cxcr3是七次跨膜的g蛋白耦联受体超家族成员。人cxcr3受体可分为两种亚型cxcr3-a和cxcr3-b。目前已经在t细胞和内皮细胞上发现了cxcr3-b的表达,而cxcl4的特异性受体是cxcr3-b。趋化因子cxcl4受体cxcr3在淋巴细胞、内皮细胞和上皮细胞中广泛表达,能够通过激活多条信号通路对细胞的增殖、迁移和凋亡进行调节。多项研究证实,cxcl4及其受体对结直肠癌细胞的浸润和转移有着显著的影响,且cxcl4已作为结直肠癌复发的生物标记物(pilatovak,greplovak,zdrazilova-dubskal,etal.roleofplateletchemokines,pf-4andctap-iii,incancerbiology.jhematoloncol,6:42,2013.)。
技术实现要素:
本发明的目的在于针对现有技术存在的不足,提供一种cxcl4单抗治疗肿瘤及化疗后肿瘤加速再增殖基因筛选法;具体涉及抗cxcl4单克隆抗体的用途及肿瘤化疗后加速再增殖基因簇的筛选方法;所述抗cxcl4单克隆抗体用于抑制高表达cxcl4的肿瘤加速再增殖。
本发明的目的是通过以下技术方案来实现的:
第一方面,本发明涉及一种抗cxcl4单克隆抗体在制备抑制肿瘤增殖药物中的用途。
优选的,所述用途具体为在制备抑制化疗引起的cxcl4高表达的肿瘤增殖药物中的用途。
优选的,所述抗cxcl4单克隆抗体与化疗时采用的化疗药物联合用药。
优选的,所述抗cxcl4单克隆抗体在化疗后cxcl4表达水平达到最高前施用。
优选的,所述化疗时采用的化疗药物为细胞周期依赖性化疗药。
优选的,所述化疗药物为5-fu。
优选的,所述抗cxcl4单克隆抗体与5-fu联合用药。
优选的,所述5-fu用药后4天以内,进行抗cxcl4单克隆抗体给药。
优选的,所述肿瘤为cxcl4高表达的肿瘤或化疗引起的cxcl4高表达的肿瘤。
优选的,所述肿瘤为5-fu敏感型肿瘤。
优选的,所述肿瘤为消化道肿瘤。
优选的,所述肿瘤为胃癌。
优选的,所述肿瘤为结肠癌肿瘤。
第二方面,本发明还涉及一种肿瘤化疗后加速再增殖基因簇的筛选方法,包括如下步骤:
a、建立荷瘤动物模型或体外肿瘤细胞培养系统;
b、给予不同的化疗药物或化疗药物的组合;
c、化疗后,在不同时间点取肿瘤样本;
d、用基因表达芯片筛查获得肿瘤组织基因表达谱;
e、生物信息学分析获得有表达规律的基因作为肿瘤化疗后加速再增殖候选基因;
f、对所述候选基因开展系统的药效药理研究,确认影响肿瘤化疗后加速再增殖的关键基因。
第三方面,本发明还涉及一种cxcl4在制备抑制肿瘤增殖药物中的用途。
优选地,所述用途具体为:cxcl4作为肿瘤增殖的靶点在制备抑制肿瘤增殖药物中的用途。
优选地,所述用途包括如下步骤:获取能够与cxcl4或cxcl4下游信号中和的结合物,使用所述结合物中和cxcl4靶点或下游信号,实现抑制肿瘤增殖。
优选地,所述结合物为以cxcl4为抗原制备的抗体,或所述抗体的片段,或所述抗体的融合蛋白。
优选地,所述结合物为以cxcl4受体为抗原制备的抗体,或所述抗体的片段,或所述抗体的融合蛋白。
优选地,所述cxcl4受体为cxcr3,或cxcr3a,或cxcr3b。
优选地,所述结合物为cxcl4受体,或cxcl4受体的可溶性受体,或cxcl4受体的受体融合蛋白;
所述cxcl4受体为cxcr3,cxcr3a,或cxcr3b。
优选地,所述结合物为cxcl4突变体,所述cxcl4突变体能够竞争结合cxcl4受体,同时不引起受体激活。
优选地,所述结合物为靶向cxcl4,或靶向cxcl4受体,或靶向下游信号成员的mrna。
优选地,所述结合物为以cxcl4,或以cxcl4的受体,或以cxcl4下游通路成员为靶标筛选获得的拮抗剂。
肿瘤在化疗后会开启被称为“加速再增殖”的过程,即在化疗打击下逃逸的肿瘤细胞存活下来,并能以更加快的速度增殖。基因型决定表型,在肿瘤细胞或组织化疗后加速再增殖的过程中,必然存在化疗诱导激活的起内在调控驱动作用的加速再增殖基因簇。加速再增殖基因簇可能起正向调控或负向调控作用,所以肿瘤细胞或组织在不同的化疗药物或化疗药物的组合的作用下,在不同的时间点加速再增殖基因簇会发生与肿瘤细胞或组织生长速度一致或完全相反的规律性波动,这种基因表达水平的规律性改变能够在全基因组表达芯片上显示出来。根据基因表达芯片筛查化疗后基因在肿瘤组织表达差异,经大规模生物信息学数据分析和判断,对候选基因进行表达确证,从而获得参与化疗后“加速再增殖”候选基因。
本发明中涉及的肿瘤化疗后加速再增殖基因簇筛选方法能大规模的筛选出不同肿瘤在不同化疗药物或化疗药物的组合作用下与肿瘤化疗后加速再增殖有关的基因簇,从而为临床针对不同肿瘤不同化疗手段提供联合化疗治疗新方案。
本发明中涉及的抗cxcl4单克隆抗体的用途即是本发明中涉及的肿瘤化疗后加速再增殖基因簇筛选方法的应用实例,本发明用小鼠结肠癌模型,对可能参与化疗后肿瘤“加速再增殖”基因簇进行了系统筛查。取皮下小鼠ct26结肠癌5-fu化疗后不同时间点的肿瘤组织,制备全基因组表达谱芯片,根据基因表达芯片筛查化疗后基因在肿瘤组织表达差异,经大规模数据分析和判断,对候选基因进行表达确证,从而获得参与化疗后“加速再增殖”候选基因。最终将研究重点聚焦到趋化因子家族,筛选出了趋化因子cxcl4。cxcl4在5-fu化疗后表现出显著的先上升后下降的表达特点,提示其可能参与结肠癌化疗后“加速再增殖”的过程。本发明阐明了cxcl4在肿瘤化疗后“加速再增殖”的分子机理,并通过干预此机理提供联合化疗治疗结肠癌新方案。
与现有技术相比,本发明具有的有益效果为:本发明通过应用结肠癌荷瘤小鼠5-fu化疗模型,揭示cxcl4表达变化与结肠癌5-fu化疗后“加速再增殖”之间的关系,阐明cxcl4参与化疗后肿瘤“加速再增殖”过程中的分子机制,完成拮抗cxcl4(使用自主研发的cxcl4单克隆抗体)协同5-fu抑制结肠癌细胞再增殖的药效药理研究,为成功开发cxcl4抗体药物提供依据。
同时,本发明发现的cxcl4参与化疗后肿瘤“加速再增殖”过程中的分子机制具有开创意义,cxcl4能够起到肿瘤增殖靶点的作用,进而能够通过作用该靶点进行肿瘤的相关治疗工作;与靶点作用的机制有很多种,这些机制均能应用于本发明,实现抑制肿瘤增殖的效果;这些机制包括但不限于以下:
获能够与cxcl4或cxcl4下游信号中和的结合物,使用所述结合物中和cxcl4靶点或下游信号,实现抑制肿瘤增殖;
进一步地,结合本领域常识可知,能够作用靶点而实现抑制肿瘤的机制还包括:
获取能够与cxcl4或cxcl4下游信号中和的结合物,使用所述结合物中和cxcl4靶点或下游信号,实现抑制肿瘤增殖,所述结合物可为:
所述结合物为以cxcl4为抗原制备的抗体,或所述抗体的片段,或所述抗体的融合蛋白。
所述结合物为以cxcl4受体为抗原制备的抗体,或所述抗体的片段,或所述抗体的融合蛋白。
所述cxcl4受体为cxcr3,或cxcr3a,或cxcr3b。
所述结合物为cxcl4受体,或cxcl4受体的可溶性受体,或cxcl4受体的受体融合蛋白;所述cxcl4受体为cxcr3,cxcr3a,或cxcr3b。
所述结合物为cxcl4突变体,所述cxcl4突变体能够竞争结合cxcl4受体,同时不引起受体激活。
所述结合物为靶向cxcl4,或靶向cxcl4受体,或靶向下游信号成员的mrna。
所述结合物为以cxcl4,或以cxcl4的受体,或以cxcl4下游通路成员为靶标筛选获得的拮抗剂。
显然,能够与本发明要求保护的cxcl4靶点作用的机制,相关物质都应在本发明的保护范围之内,并不限于以上列举的内容,这是本领域技术人员显然可以确定的。
本发明的成功实施,为结直肠癌新药研发提供新靶点和新抗体药物,为结直肠癌药物治疗提供新思路;因而,具有重大的社会意义和经济价值。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为对ct26荷瘤小鼠一次性注射5-fu(200mg/kg),化疗后第0、2、4、6、8天皮下肿瘤体积的测量结果图;
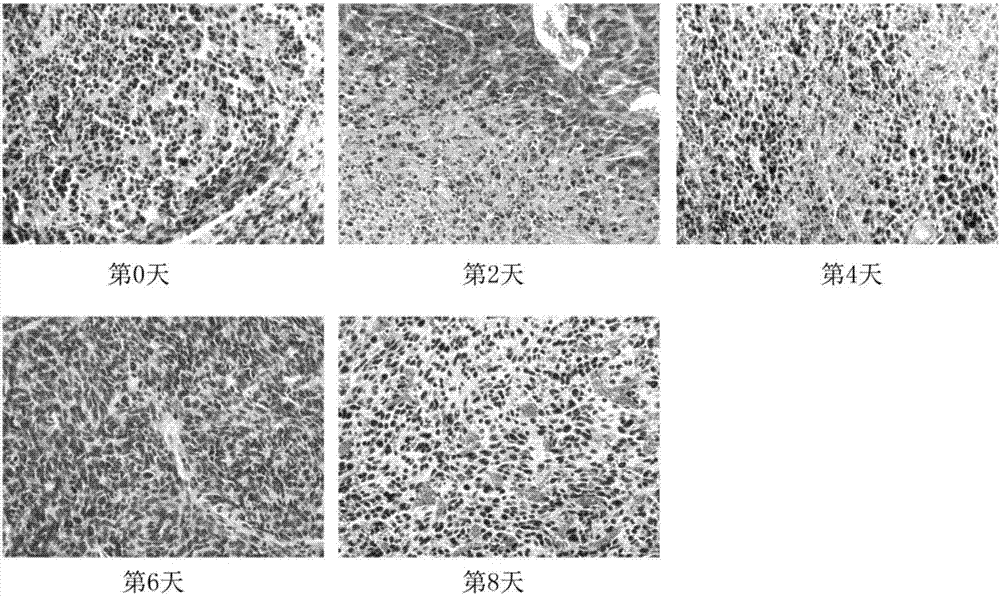
图2为5-fu(200mg/kg)化疗后第0、2、4、6、8天ct26肿瘤组织切片he染色结果示意图;
图3为对ct26荷瘤小鼠一次性注射5-fu(200mg/kg),化疗后皮下肿瘤组织的检测结果示意图;其中,a为基因芯片结果显示的肿瘤组织中cxcl4mrna水平在5-fu化疗后的趋势图,b为rt-pcr检测ct26肿瘤化疗后第4天组织中cxcl4在基因水平的表达变化示意图(n=3)(**p<0.01vs第0天);
图4为对体外培养ct26细胞和mfc细胞5-fu(200mg/kg)或l-ohp(30μg/ml)孵育后,rt-pcr检测cxcl4mrna表达量变化示意图(n=3,*p<0.05,**p<0.01);其中,a.5-fu孵育ct26细胞,b.l-ohp孵育ct26细胞,c.5-fu孵育mfc细胞,d.l-ohp孵育mfc细胞;
图5为mtt法检测rhcxcl4对ct26细胞和iec-6细胞的增殖作用示意图(**p<0.01,***p<0.001);其中,a为不同浓度的rhcxcl4(0-3μg/ml)对iec-6细胞的增殖作用示意图,b为不同浓度的rhcxcl4(0-3μg/ml)对ct26细胞的增殖作用示意图;
图6为anti-cxcl4mab特性的鉴定示意图;其中,a为sds/page(8%)(a)与westernblotting(b)方法分析纯化的anti-cxcl4mab,b为biacore方法分析anti-cxcl4mab的亲和力,c为rhcxcl4对achn细胞的生长抑制作用示意图,d为anti-cxcl4mab拮抗rhcxcl4(72.6μg/ml)对achn细胞的抑制作用示意图;
图7为抗cxcl4单抗联合5-fu对肿瘤生长的抑制作用示意图;其中,a为各组小鼠肿瘤体积大小变化示意图,b为各组小鼠死亡变化情况示意图,c为化疗对照组与化疗加单抗给药组小鼠化疗后第4天和第6天肿瘤组织切片brdu染色示意图,d为brdu免疫组化切片肿瘤细胞增殖指数统计示意图,(n=3),**p<0.01;
图8为抗cxcl4单抗联合5-fu对t淋巴细胞移植裸鼠接种肿瘤生长的抑制作用示意图;其中,a为皮下接种ct26肿瘤的balb/cnu/nu裸小鼠,5-fu(150mg/kg)化疗后加单抗给药组皮下注射抗cxcl4单抗(1mg/kg),肿瘤体积随时间的变化示意图,b为尾静脉移植健康balb/c小鼠淋巴细胞的balb/cnu/nuct26荷瘤裸小鼠,5-fu(150mg/kg)化疗后加单抗给药组皮下注射抗cxcl4单抗(1mg/kg),肿瘤体积随时间的变化示意图。
图9为rt-pcr检测ct26肿瘤组织中ifn-r和gran-bmrna表达量变化示意图;其中,a为rt-pcr检测ifn-γmrna的表达量,b为rt-pcr检测gran-bmrna的表达量;(n=3)(*p<0.05vspbscontrol组)。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实施例中涉及的杂交瘤细胞16d6-3已于2012年11月29日递交中国典型培养物保藏中心保藏,保藏地址为中国.武汉.武汉大学,保藏编号为cctccno:c20120186。
实施例
1.1结肠癌荷瘤小鼠化疗模型的建立
临床治疗结直肠癌的化疗方案是以5-fu为基础的单药化疗或联合化疗方案(5-fu+l-ohp或cpt-11)。为贴近临床,选择5-fu单次化疗构建结肠癌皮下荷瘤小鼠化疗模型。合适的化疗剂量对于模型的稳定性也有重要意义。若化疗药剂量过低,则化疗对肿瘤的杀伤作用不明显;若化疗药剂量过高,则会导致过高的小鼠死亡率。经过剂量摸索,在后续的动物实验研究中,5-fu的单药化疗剂量均控制在150-200mg/kg。
在balb/c小鼠右侧腋下皮下接种小鼠结直肠癌肿瘤细胞ct261×106个,待肿瘤体积长至400-500mm3时,一次性尾静脉注射化疗药物5-fu(200mg/kg),化疗后每两天用游标卡尺量取肿瘤体积大小,这样得到了小鼠结肠癌肿瘤经5-fu化疗后其生长变化情况;图1即对ct26荷瘤小鼠一次性注射5-fu(200mg/kg),化疗后第0、2、4、6、8天皮下肿瘤体积的测量结果示意图,由图1可知,ct26肿瘤在5-fu化疗后,肿瘤体积先减小,第4天达到最低点,然后反弹增大,表现为典型的“加速再增殖”现象。这表明单次化疗对结肠癌肿瘤的生长抑制作用有限,肿瘤存在化疗后复发增殖的情况,与临床观察现象一致。
对5-fu化疗后第0、2、4、6、8天的ct26肿瘤组织进行h&e染色切片,图2即5-fu(200mg/kg)化疗后第0、2、4、6、8天ct26肿瘤组织切片he染色结果示意图,由图2可知,结果显示肿瘤组织在化疗后出现大面积坏死,以第4天最为严重,但从第6天后坏死急剧减少乃至消失,与肿瘤生长体积在化疗后的变化情况一致。
1.25-fu诱导结肠癌细胞表达cxcl4
取5-氟尿嘧啶(5-fu)化疗后0、2、4、6、8天共5个时间点的新鲜ct26小鼠结肠癌组织,抽取rna,送样制作高密度寡核苷酸微阵列,得到结肠癌肿瘤化疗后耐药生长过程中的基因表达动态图谱。通过分析高密度寡核苷酸微阵列中mrna的表达情况,发现,趋化因子cxcl4在5-fu化疗后ct26肿瘤组织的表达量上调,而在单次化疗后期肿瘤恢复生长时期表达量下降。由图3a可知,与化疗前相比,5-fu化疗后cxcl4的表达在第2天达到了最高值,随后开始下降。为了进一步验证芯片结果,采用real-timepcr(rt-pct)的方法检测了ct26肿瘤组织中cxcl4在5-fu化疗后第4天的表达变化,如图3b(n=3,**p<0.01)所示,结果验证了与未化疗的第0天对照组相比,cxcl4基因表达显著上调。
1.35-fu特异性介导结肠癌细胞cxcl4激活表达
5-fu诱导肿瘤组织cxcl4的表达激活,而肿瘤组织的异质性使得研究cxcl4是由肿瘤组织中的哪类细胞表达显得极为必要。在体外培养小鼠结肠癌细胞ct26,以200μg/ml5-fu孵育3小时后换液,收集换液后4小时、24小时和48小时的细胞,抽提rna,利用rt-pcr技术研究cxcl4mrna的表达量变化。由图4a(n=3,*p<0.05,**p<0.01)可知,从5-fu化疗后4小时起,与未经化疗的对照相比,ct26细胞显著激活上调cxcl4mrna。
接下来进一步研究了肿瘤细胞cxcl4表达激活是否为化疗药特异性或为肿瘤细胞特异性。体外培养小鼠结肠癌细胞ct26和小鼠胃癌细胞mfc,以200μg/ml5-fu或30μg/ml奥沙利铂(l-ohp)孵育3小时后换液,收集换液后4小时、24小时和48小时的细胞,抽提rna,利用rt-pcr技术研究cxcl4mrna的表达量变化。由图4c(n=3,p<0.05)可知,结果表明,相比于ct26细胞,mfc细胞在5-fu后48小时,cxcl4mrna才有显著激活上调。而l-ohp不能激活ct26(图4b)或mfc细胞(图4d)上调cxcl4表达。以上结果说明结肠癌细胞cxcl4激活表达是由5-fu特异性介导的。
1.4rhcxcl4体外对ct26结肠癌细胞增殖不起作用
前面研究表明5-fu化疗能特异性诱导结肠癌细胞激活表达cxcl4,接下来研究cxcl4是否对结肠癌细胞有直接作用。在体外用不同浓度的rhcxcl4(0-3μg/ml)对小鼠结肠癌细胞ct26和大鼠未分化小肠隐窝上皮细胞iec-6(阳性对照)进行细胞培养,48h后用mtt显色法检测活细胞相对数量,计算ct26细胞和iec-6细胞在不同浓度rhcxcl4培养条件下的存活率。图5a为不同浓度的rhcxcl4(0-3μg/ml)对iec-6细胞的增殖作用示意图,图5b为不同浓度的rhcxcl4(0-3μg/ml)对ct26细胞的增殖作用示意图;图5a、5b的结果显示,在体外rhcxcl4在0.33μg/ml的浓度下就对iec-6细胞的生长有显著的抑制作用,且抑制作用呈现浓度依赖性,而rhcxcl4体外对ct26细胞的增殖无影响。
1.5抗cxcl4单抗的制备及其理化性质的鉴定
多克隆抗体由于其血清来源成分较为复杂,本实施例制备和纯化了具有中和人源及鼠源cxcl4的单克隆抗体。经纯度检测、内毒素检测和生物学活性检测(图6),证明了单抗的质量都已达到动物实验标准。
以纯化的人cxcl4重组蛋白免疫sd大鼠,经细胞融合以及3次克隆筛选得到了一株分泌抗重组人和小鼠cxcl4单克隆抗体的杂交瘤细胞株,命名为16d6-3。16d6-3细胞株体外连续培养1个月,经elisa方法滴度检测证明,抗体分泌能力稳定。用该细胞株腹腔注射裸鼠收集腹水后,以亲和柱hitrapproteinghp(gehealthcare)纯化腹水中的单克隆抗体anti-cxcl4mab,经sds-page检测抗体纯度达到98%(图6a-a),并用westernblot方法检测单克隆抗体与重组人cxcl4蛋白的结合活性(图6a-b)。用biacore检测纯化得到的anti-cxcl4mab与重组人cxcl4的亲和力,经biaevaluation分析软件处理数据,采用一对一langmuir结合模型计算结合率(kon)和解离率(koff),平衡解离常数(kd)为kon与koff的比值;计算得到的结合率(kon)和解离率(koff)分别为1.79×10-6(1/s)和97.8(1/ms),平衡解离常数(kd)为1.83×10-8m(图6b)。进一步检测了抗cxcl4单抗的生物学活性,根据文献报道将achn细胞用10μg/ml-100μg/ml的rhcxcl4蛋白孵育,72小时后mtt检测发现rhcxcl4(ic50=72.6μg/ml)有效抑制了achn细胞的增殖,与文献报道一致(图6c),而抗cxcl4单抗有效阻断了cxcl4(72.6μg/ml)对achn细胞的生长抑制作用,并且呈现浓度依赖性(图6d)。
1.6抗cxcl4单抗协同5-fu化疗抑制结肠癌肿瘤细胞生长
在体外细胞实验确证cxcl4对结肠癌肿瘤细胞没有直接作用的基础上,接下来研究cxcl4在体内对ct26肿瘤细胞的作用。利用实验室自己制备和纯化的抗cxcl4单克隆抗体(申请号:201310066089.7的中国发明专利《抗趋化因子4单克隆抗体、杂交瘤细胞系及应用》)从反面验证了cxcl4在ct26肿瘤5-fu化疗中的作用。
在balb/c小鼠右侧腋下皮下接种小鼠结直肠癌肿瘤细胞ct261×106个,待肿瘤体积长至200-300mm3时,随机分组,包括阴性对照组,化疗对照组,化疗加单抗给药组。化疗方案为一次性尾静脉注射化疗药物5-fu(150mg/kg)。抗cxcl4单抗给药方案为化疗当天皮下给药,给药剂量1mg/kg。pbs对照组仅皮下注射同体积pbs,化疗对照组注射同体积pbs。给药后每2天用游标卡尺量取皮下肿瘤大小。图7为抗cxcl4单抗联合5-fu对肿瘤生长的抑制作用示意图,结果显示,与单独5-fu化疗相比,抗cxcl4单抗能够协同5-fu显著提高化疗对肿瘤生长的抑制作用(图7a)(n=10,p<0.01)。
图7b(n=10,p<0.05)为抗cxcl4单抗对荷瘤小鼠化疗后死亡率的影响,实验结果表明抗cxcl4单抗亦能够协同5-fu显著提高荷瘤小鼠化疗后的存活时间。
对化疗对照组和化疗加单抗给药组的肿瘤组织进行切片,brdu免疫组化染色检测肿瘤组织中细胞的增殖情况,如图7c、7d;结果显示,相较于对5-fu化疗对照组,抗cxcl4单抗与5-fu联用减少了肿瘤在化疗后第2、4、6天的brdu阳性细胞数(切片中呈棕色着色)(图7c),增殖指数统计差异显著(p<0.01)(图7d)。增殖指数统计:显微镜400视野下随机选取3个视野,计数每个视野下brdu阳性细胞个数(n=3)。
以上结果表明,与单独5-fu化疗相比,抗cxcl4单抗显著抑制5-fu后的“加速再增殖”,表现为协同5-fu抑制肿瘤细胞增殖,同时单抗与5-fu联用还能显著延长荷瘤小鼠化疗后的存活时间。这也从反面证明了化疗后肿瘤细胞可以通过激活表达cxcl4来获得化疗后的“加速再增殖”优势。
1.7抗cxcl4单抗通过作用于t淋巴细胞协同5-fu化疗抑制结肠癌细胞再增殖
抗cxcl4单抗协同5-fu提高化疗对肿瘤生长的抑制作用,这表明化疗后肿瘤细胞可以通过激活表达cxcl4获得了自身的增殖优势。而体外细胞实验证实cxcl4对肿瘤细胞没有直接作用,这预示cxcl4可能通过间接作用于肿瘤组织中的间质细胞来帮助结肠癌细胞获得增殖优势。
首先以先天性无胸腺t淋巴细胞发育缺陷的balb/cnu/nu裸小鼠为对象建立ct26荷瘤小鼠模型,在裸鼠右侧腋下皮下接种小鼠结直肠癌肿瘤细胞ct261×106个,待肿瘤体积长至200-300mm3,一次性注射化疗药物5-fu(150mg/kg)后随机分组,实验组化疗当天皮下注射抗cxcl4单抗1mg/kg,对照组注射同体积pbs,给药后每2天用游标卡尺量取皮下肿瘤大小。图8为抗cxcl4单抗联合5-fu对t淋巴细胞移植裸鼠接种肿瘤生长的抑制作用示意图;结果显示,与单独5-fu化疗相比,抗cxcl4单抗不能协同5-fu化疗提高对肿瘤生长的抑制作用(图8a)(n=6)。
接下来对balb/cnu/nu裸鼠每周尾静脉移植健康balb/c小鼠脾脏分离的淋巴细胞1×107个,首次淋巴细胞移植3天后皮下接种ct26细胞1×106个,待肿瘤体积长至200-300mm3,一次性注射化疗药物5-fu(150mg/kg)。随机分组,实验组化疗当天皮下注射抗cxcl4单抗1mg/kg,对照组注射同体积pbs,给药后每2天用游标卡尺量取皮下肿瘤大小。结果显示,抗cxcl4单抗能够协同5-fu显著提高化疗对肿瘤生长的抑制作用(图8b)(n=8,p<0.05)。
以上实验结果都表明,抗cxcl4抗体是通过作用于t淋巴免疫系统来协同5-fu抑制结肠癌细胞再增殖,也即是说5-fu化疗诱导肿瘤细胞激活表达cxcl4可以作用于t淋巴细胞使得肿瘤细胞能够逃避免疫监视而获得增殖优势。
1.8抗cxcl4单抗增强肿瘤组织中t淋巴细胞的抗肿瘤作用
肿瘤组织中浸润淋巴细胞具有抗肿瘤作用,例如细胞毒性t淋巴细胞(ctl)和自然杀伤细胞(nk)可以通过分泌干扰素(ifn-γ)、颗粒酶a(gran-a)和颗粒酶b等(gran-b)来抑制肿瘤生长。已有文献表明临床癌症病人肿瘤组织中的浸润淋巴细胞与病人预后及存活时间有显著相关。前期实验已经证明抗cxcl4单抗是通过作用于t淋巴细胞来协同5-fu化疗抑制结肠癌肿瘤生长,假设抗cxcl4单抗的协同机制是抗cxcl4单抗能增强肿瘤浸润淋巴细胞的抗肿瘤作用。
在balb/c小鼠右侧腋下皮下接种ct26细胞1×106个,待肿瘤体积长至200-300mm3时,随机分组,包括阴性对照组,化疗对照组,化疗加单抗给药组。pbs对照组仅皮下注射同体积pbs,化疗对照组一次性注射化疗药物5-fu(150mg/kg)。化疗加单抗给药组在5-fu化疗当天颈部皮下注射抗cxcl4单抗1mg/kg。化疗后第4天处死小鼠,剥取新鲜肿瘤组织,抽提rna,利用rt-pcr技术比较各组小鼠肿瘤组织中ifn-γ和gran-bmrna的表达量。图9为rt-pcr检测ct26肿瘤组织中ifn-r和gran-bmrna表达量变化示意图;结果表明,5-fu化疗能抑制ifn-γ和gran-b的表达,而抗cxcl4单抗能显著提高化疗肿瘤组织中ifn-γ(图9a)和gran-b(图9b)的表达(n=3,p<0.05)。以上实验结果表明,抗cxcl4单抗能显著增强肿瘤组织中t淋巴细胞的抗肿瘤作用。
综上所述,本发明通过应用结肠癌荷瘤小鼠5-fu化疗模型,揭示cxcl4表达变化与结肠癌5-fu化疗后“加速再增殖”之间的关系,阐明cxcl4参与化疗后肿瘤“加速再增殖”过程中的分子机制,完成拮抗cxcl4协同5-fu抑制结肠癌细胞再增殖的药效药理研究,本发明的成功实施,为结直肠癌新药研发提供新靶点和新抗体药物,为结直肠癌药物治疗提供新思路;因而,具有重大的社会意义和经济价值。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!