Mettl14敲除的精子发生障碍动物模型及其构建方法与流程
本发明涉及mettl14敲除的精子发生障碍动物模型及其构建方法。
背景技术:
不育不孕症作为一个危害全球公共健康的大问题,影响着约10-15%育龄夫妇,其中男方因素占50%。临床上的非阻塞性无精症、少精症、弱精症及畸精症是精子发生障碍的主要表现;同时,精子发生障碍也是自发性流产和胚胎发育异常的重要原因之一。然而,目前对精子发生异常的确切机制所知甚少。
精子发生过程包括精原细胞增殖、精母细胞减数分裂和精子变态三个不同阶段。以小鼠为例,就精原细胞增殖而言,首先是单个型精原细胞(asinglespermatogonia,as)通过自我更新或增殖形成配对型精原细胞(apairedspermatogonia,ap),ap进一步增殖生成链状型精原细胞(aalignedspermatogonia,aal)。as、ap以及aal统称为未分化精原细胞。aal未经有丝分裂直接转化形成a1型精原细胞,该过程称为精原细胞分化。a1型精原细胞经过五次有丝分裂逐次形成a2、a3、a4、中间型(in型)直至b型精原细胞。a1至b型精原细胞统称为分化型精原细胞。b型精原细胞再经一次有丝分裂生成初级精母细胞(细线前期),初级精母细胞继而经过两次减数分裂形成单倍体的圆形精子细胞。通过一系列(十六步)的形态变化过程,圆形精子细胞最终变态转化为精子。
哺乳动物的精子发生过程中rna代谢尤为活跃,代谢方式也是复杂多样。已有的研究表明m6arna修饰参与多种rna代谢活动。在芽殖酵母中,m6arna修饰酶ime4的失活会导致减数分裂异常,无法正常形成配子。在哺乳动物中m6arna修饰酶mettl3及mettl14形成的复合物,共同作用催化形成m6a。细胞水平上的研究表明mettl3及mettl14均具有甲基转移酶活性,并且二者存在一定的功能冗余。
技术实现要素:
本发明第一方面提供一种构建精子发生障碍啮齿类动物模型的方法,所述方法包括:
应用crispr/cas9技术构建mettl3条件性基因敲除的啮齿类动物或mettl14条件性基因敲除的啮齿类动物,并将其分别与表达cre的生殖细胞特异表达的同类啮齿类动物进行交配,从而获得生殖细胞特异敲除mettl3或mettl14的精子发生障碍啮齿类动物模型。
在一个或多个实施方案中,所述应用crispr/cas9技术构建mettl3条件性基因敲除的啮齿类动物或mettl14条件性基因敲除的啮齿类动物包括构建基因敲入载体的步骤,其中,所述基因敲入载体含有待敲入的基因序列、位于该待敲入的基因序列两端的loxp序列、以及分别位于两个loxp序列两端的5’同源臂序列和3’同源臂序列,用以将含有loxp位点及它们之间的待敲入的基因序列同源重组到mettl3或mettl14基因的预定位置上。
在一个或多个实施方案中,所述待敲入的基因序列为mettl3外显子4或mettl14外显子2的dna序列。
在一个或多个实施方案中,所述mettl3条件性基因敲除的啮齿类动物或mettl14条件性基因敲除的啮齿类动物的构建包括:
(1)根据mettl3或mettl14基因待敲入位置两侧的序列,设计序列特异的sgrna,构建sgrna的表达质粒;
(2)将cas9表达质粒以及步骤(1)构建得到的sgrna的表达质粒线性化,以线性化的质粒为模板进行体外转录,获得cas9mrna和sgrna;
(3)将所述cas9mrna、sgrna以及基因敲入载体显微注射至啮齿类动物的受精卵胞质,将注射后的受精卵移植到假孕雌性啮齿类动物输卵管内,从而分别构建得到在mettl3基因序列的指定位置插入含两个loxp序列及位于两个loxp序列之间的待敲入基因序列的mettl3条件性基因敲除的啮齿类动物或在mettl14基因序列的指定位置插入含两个loxp序列及位于两个loxp序列之间的待敲入基因序列的mettl14条件性基因敲除的啮齿类动物。
在一个或多个实施方案中,所述受精卵来自预先经pmsg和hcg处理的雌鼠与雄鼠交配产生的受精卵。
在一个或多个实施方案中,所述精子发生障碍的啮齿类动物模型为精原干细胞特异性mettl3基因敲除小鼠模型mettl3fl/del,vasa-cre,所述方法包括使所述mettl3条件性基因敲除小鼠与vasa-cre小鼠交配,构建得到所述精原干细胞特异性mettl4基因敲除小鼠模型mettl3fl/del,vasa-cre。
在一个或多个实施方案中,所述精子发生障碍的啮齿类动物模型为a1精原细胞特异性mettl3基因敲除小鼠模型mettl3fl/del,stra8-gfpcre,所述方法包括使所述mettl3条件性基因敲除小鼠与stra8-gfpcre小鼠交配,构建得到所述a1精原细胞特异性mettl3基因敲除小鼠模型mettl3fl/del,stra8-gfpcre。
在一个或多个实施方案中,所述精子发生障碍的啮齿类动物模型为精原干细胞特异性mettl14基因敲除小鼠模型mettl14fl/del,vasa-cre,所述方法包括使所述mettl14条件性基因敲除小鼠与vasa-cre小鼠交配,构建得到所述精原干细胞特异性mettl14基因敲除小鼠模型mettl14fl/del,vasa-cre。
在一个或多个实施方案中,所述精子发生障碍的啮齿类动物模型为a1精原细胞特异性mettl14基因敲除小鼠模型mettl14fl/del,stra8-gfpcre,所述方法包括使所述mettl14条件性基因敲除小鼠与stra8-gfpcre小鼠交配,构建得到所述a1精原细胞特异性mettl14基因敲除小鼠模型mettl14fl/del,stra8-gfpcre。
在一个或多个实施方案中,以mettl3fl/+、mettl14fl/+和stra8-gfpcre小鼠为基础,反复多次交配,获取mettl3基因和mettl14基因敲除小鼠模型mettl3fl/del,mettl14fl/del,stra8-gfpcre。
本发明还提供一种试剂盒,所述试剂盒含有用于在mettl3或mettl14基因的指定位置插入待敲入基因及其两侧的loxp序列的基因敲入载体,所述基因敲入载体含有待敲入的基因序列,位于该基因序列两端的loxp序列,以及位于两个loxp序列两端的5’同源臂序列和3’同源臂序列。
在一个或多个实施方案中,所述敲入载体含有mettl3外显子4或mettl14外显子2的dna序列、位于该dna序列两端的loxp序列、以及分别位于两个loxp序列两端的5’同源臂序列和3’同源臂序列。
在一个或多个实施方案中,所述试剂盒还含有利用crispr/cas9技术实施基因操纵所需的试剂。
在一个或多个实施方案中,所述试剂包括cas9表达载体和相应的sgrna的表达载体,用以将表达载体线性化的内切酶,以及以所述线性化的表达载体为模板进行体外转录的试剂。
本发明还提供一种用于将loxp位点及它们之间的待敲入的基因序列同源重组到啮齿类动物mettl3基因或mettl14基因的预定位置上的基因敲入载体,其特征在于,所述基因敲入载体含有待敲入的基因序列、位于该待敲入的基因序列两端的loxp序列、以及分别位于两个loxp序列两端的5’同源臂序列和3’同源臂序列。
在一个或多个实施方案中,所述待敲入的基因序列为mettl3基因的外显子4或mettl14的外显子2。
本发明还提供采用本文所述的方法构建得到的小鼠模型在研究雄性不育病因中的应用。
本发明还提供mettl3基因或mettl3蛋白和/或mettl14基因或mettl14蛋白和/或本文所述的基因敲入载体在构建用于研究雄性不育病因的小鼠模型中的应用。
附图说明
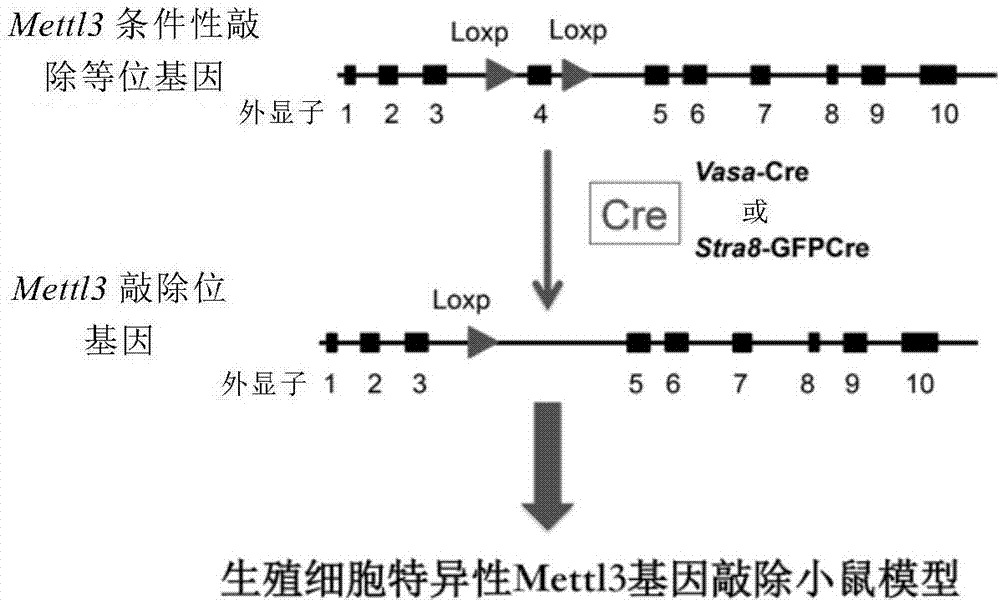
图1:生殖细胞特异性mettl3基因敲除小鼠模型构建示意图。
图2:生殖细胞特异性mettl4基因敲除小鼠模型构建示意图。
图3:早期生殖细胞特异性失活mettl3后,mettl3蛋白不再表达于生殖细胞。
图4:a1型精原细胞内特异性失活mettl3后,mettl3蛋白不再表达于a1及后续生殖细胞。
图5:早期生殖细胞特异性失活mettl14后,mettl14蛋白不再表达于生殖细胞。
图6:a1型精原细胞内特异性失活mettl14后,mettl14蛋白不再表达于a1及后续生殖细胞。
图7:早期生殖细胞特异性失活mettl3导致精原干细胞丢失。
图8:a1型精原细胞内特异性失活mettl3和mettl14后,mettl3和mettl14蛋白不再表达于a1及后续生殖细胞。
图9:在a1精原细胞内失活mettl3和mettl14后,小鼠表现为弱精、少精、精子畸形。
图10:测序结果显示在mettl3中在正确位置插入了loxp1和loxp2。
图11:测序结果显示在mettl14中在正确位置插入了loxp1和loxp2。
具体实施方式
应理解,在本申请范围内中,本文各实施方案中所述的各技术特征和以及实施例中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。
本文通过应用crispr/cas9技术构建mettl3条件性基因敲除小鼠或mettl14条件性基因敲除小鼠,并将其分别与生殖细胞特异表达的vasa-cre及stra8-gfpcre小鼠进行交配,获得生殖细胞特异敲除的mettl3或mettl14突变小鼠,构建得到精子发生障碍动物模型,为人类男性不育病因诊断、预防和治疗以及预防减少父源性出生缺陷等提供了新的思路和新手段。
本文中,动物模型优选是啮齿类动物模型。
本文中,mettl3基因和mettl4基因可以是本领域周知的mettl3和mettl4的基因,优选来自哺乳动物或啮齿类动物,例如来自人或鼠的mettl3和mettl14基因。在某些实施方案中,本文使用来自鼠,尤其是c57bl/6j小鼠的mettl3和mettl14基因,它们在genbank上的登陆号分别为nc_000080.6和nc_000069.6。应理解的是,针对不同种属的动物或同一种属不同个体的动物,可使用该动物自身所携带的mettl3和mettl14基因,用于构建该类动物的不育动物模型。
为构建本文所述的精子发生障碍动物模型,需构建mettl3基因和/或mettl14基因敲入载体。基因敲入载体通常含有待敲入的基因序列,位于该待敲入基因序列两侧的loxp位点,以及分别位于两个loxp位点两侧的5’同源臂和3’同源臂。通常,该待敲入的基因序列可以是mettl3基因或mettl14基因或其片段,或是一段任意的核苷酸序列(不是mettl3或mettl14基因序列本身,也不是其片段),只要基因敲入后,loxp位点间的序列被敲除后,mettl3或mettl14不表达,或不正确表达(例如表达的蛋白无mettl3和mettl14原本具有的修饰酶活性)即可。在某些实施方案中,该待敲入的基因序列是mettl3基因或mettl14基因的某个外显子序列,如mettl3基因的外显子4或mettl14基因的外显子2。
loxp位点可以是本领域已知的loxp位点,具有本领域已知的核苷酸序列。
同源臂可根据待敲入的位置而容易确定,只要能通过同源重组将loxp-待敲入的基因序列-loxp同源重组至目标位置即可。
可利用本领域已知的用于基因敲入的载体作为骨架载体,构建本文的基因敲入载体。例如,在某些实施方案中,本文使用pbluescriptsk(+)-2loxp载体构建基因敲入载体。
在使用基因敲入载体时,同时利用crispr/cas9技术将目标基因序列插入到mettl3或mettl14基因感兴趣的位置中,用于构建条件性敲除mettl3或mettl14基因的动物模型。
cas9可以是本领域周知的cas9。例如,cas9酶可以是来自不同物种的cas9酶,包括但不限于来自化脓链球菌的cas9(spcas9)、来自金黄色葡萄球菌的cas9(sacas9),以及来自嗜热链球菌的cas9(st1cas9)等。可以使用cas9酶的各种已知变体,只要该cas9酶保留其核酸酶和解旋酶活性即可。
cas/sgrna复合物行使功能需要在dna的非模板链(3’到5’)有前间区序列邻近基序(pam)。不同cas酶,其对应的pam并不完全相同。例如,针对spcas9的pam通常是ngg,如tgg;针对sacas9酶的pam通常是nngrr;针对st1cas9酶的pam通常是nnagaa;其中,n为a、c、t或g,r为g或a。
sgrna通常包括两部分:靶标结合区和cas蛋白识别区。靶标结合区与cas蛋白识别区通常以5’到3’的方向连接。靶标结合区的长度通常为15~25个碱基,更通常为18~22个碱基,如20个碱基。靶标结合区与dna的模板链特异性结合,从而将cas9招募到预定位点。通常,dna模板链上sgrna结合区域的对侧区紧邻pam,或者隔开数个碱基(例如10个以内,或8个以内,或5个以内)。因此,在设计sgrna时,通常先根据所用的cas酶确定该酶的pam,然后在dna的非模板链上寻找可作为pam的位点,之后将该非模板链(3’到5’)pam位点下游紧邻该pam位点或与该pam位点隔开10个以内(例如8个以内、5个以内等)的长15~25个碱基、更通常长18~22个碱基的片段作为sgrna的靶标结合区的序列。sgrna的cas蛋白识别区则根据所使用的cas蛋白而确定,这为本领域所技术人员所掌握。
当要敲入本文所述的含loxp的基因序列至mettl3或mettl14基因的感兴趣位置时,可在插入位置附近寻找适合的pam位点,并据此寻找合适的cas9,设计相应的sgrna的cas蛋白识别区和靶标识别区,由此构建cas9的表达载体和sgrna的表达载体。同时,根据待插入位置设计基因敲入载体的同源重组臂,构建含有5’同源臂、loxp、待敲入的基因序列、loxp和3’同源臂的基因敲入载体。之后可将cas9的表达载体、sgrna的表达载体以及基因敲入载体共转感兴趣的细胞,例如小鼠的胚胎干细胞,筛选出基因组中感兴趣位置敲入了loxp-待敲入的基因序列-loxp的细胞。
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
例如,在本申请的某些实施方案中,本申请先用常规的内切酶将cas9的表达载体和sgrna的表达载体线性化,然后以线性化的表达载体为模板进行体外转录,获得cas9mrna和sgrna。之后在将cas9mrna、sgrna以及基因敲入载体转入啮齿类动物的受精卵中,如通过显微注射的方式转入受精卵胞质中。
以小鼠为例,可将注射后的受精卵移植到假孕母鼠输卵管内,最终获得在mettl3的基因序列中插入loxp序列-待敲入的基因序列-loxp序列的flox小鼠(mettl3fl/+)和在mettl14的基因序列中插入插入loxp序列-待敲入的基因序列-loxp序列的flox小鼠(mettl14fl/+)。
当待敲入的基因序列为mettl3基因的外显子4或mettl14的外显子2时,则构建得到的小鼠的基因组序列中,在mettl3外显子4的两侧分别插入了loxp序列,或在mettl14外显子2的两侧分别插入了loxp序列。
为了进一步构建mettl3或mettl14敲除小鼠,可将所获得的mettl3fl/+小鼠或mettl14fl/+小鼠与表达cre且特异性表达不同精原细胞的小鼠如本领域周知的vasa-cre小鼠或stra8-gfpcre小鼠交配,由于cre将切除两个loxp位点之间的基因序列,因此,所得的小鼠将不表达mettl3或mettl14蛋白,或表达无活性的mettl3或mettl4蛋白,从而构建得到mettl3或mettl14敲除的动物模型。
为了构建mettl3和mettl14都敲除的小鼠,可用mettl3fl/+、mettl14fl/+与vasa-cre小鼠或stra8-gfpcre小鼠反复交配,由此获得不表达mettl3和mettl14蛋白,或表达无活性的mettl3和mettl4蛋白的小鼠。
应理解,当构建其它动物模型,尤其是啮齿类动物模型时,可采用类似的方式进行。
应理解的是,本文所述的“敲除”既包括全基因敲除,也包括基因的一部分敲除,只要敲除后原本该表达的蛋白不表达,或表达无活性的蛋白即可。
精子发生过程包括精原细胞增殖、精母细胞减数分裂和精子变态三个不同阶段。精原细胞增殖依次生成as、ap和aal未分化精原细胞。aal未经有丝分裂直接转化形成a1型精原细胞,该过程称为精原细胞分化。a1型精原细胞经过五次有丝分裂逐次形成a2、a3、a4、中间型(in型)直至b型精原细胞。在不同精子发育阶段敲除mettl3基因或mettl14基因会获得不同结果。通常,在精原细胞未分化阶段敲除mettl3基因和/或mettl14基因,可导致精原干细胞丢失,结果导致雄性成年鼠不育。但在精原细胞分化阶段,例如在形成了al型精原细胞后,单独敲除mettl3基因和/或mettl14基因后,鼠的生育力正常及精子发生仍然正常,只有同时敲除mettl3基因和/或mettl14基因,从导致鼠的生育力下降,精子发生表现为无精、少精、精子畸形。因此,当出于不同目的构建不同的动物模型时,可选用具有不同精原细胞特异性表达的动物进行交配。
因此,本申请也提供不同的动物模型,所述动物模型的mettl3和/或mettl14基因被敲除。在某些实施方案中,所述动物模型是本文所述的mettl3fl/+或mettl14fl/+与vasa-cre小鼠或stra8-gfpcre小鼠交配获得的mettl3或mettl14敲除的小鼠模型。在某些实施方案中,所述动物模型是mettl3fl/+、mettl14fl/+与stra8-gfpcre小鼠反复交配获得的mettl3和mettl14同时敲除的小鼠。
由于mettl3和mettl14基因或mettl3和mettl14蛋白影响到精子的发生,因此,本申请也包括mettl3和mettl14基因或mettl3和mettl14蛋白在调控精子发生中的应用。这些应用包括但不限于诊断、治疗或预防男性不育或父源性出生缺陷等,以及用于制备用于诊断、治疗或预防男性不育或父源性出生缺陷用的药剂,或者用于研究雄性不育病因,构建雄性不育病因的动物模型等等。应理解的是,本文所述的制药用途未必就以mettl3和mettl14基因或mettl3和mettl14蛋白为活性成分制备药剂。在本文所述的制药用途中,mettl3和mettl14基因或mettl3和mettl14蛋白可以是制药过程中用到的试剂,如为被作用的对象。
本发明还提供一种试剂盒,所述试剂盒含有基因敲入载体,该基因敲入载体含有待敲入的基因序列,位于该基因序列两端的loxp序列,以及位于两个loxp序列两端的5’同源臂序列和3’同源臂序列。该待敲入的基因序列可以是mettl3基因序列或mettl14基因序列或其片段,也可以是其它的核苷酸序列。该5’同源臂和3’同源臂序列应使得该loxp-待敲入的基因序列-loxp序列能被同源重组到mettl3或mettl14基因的感兴趣的位置上,使得该待敲入的基因序列被cre敲除后,mettl3或mettl14基因被完全或部分敲除,从而不表达或表达无活性的mettl3或mettl14蛋白。在某些实施方案中,该待敲入的基因序列为mettl3基因的外显子4或mettl14基因的外显子2。试剂盒中还可含有利用crispr/cas9技术实施基因操纵所需的试剂,例如,cas9表达载体和相应的sgrna的表达载体,用以将表达载体线性化的内切酶,以及以所述线性化的表达载体为模板进行体外转录的试剂。
下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并非限制本发明。实施例中所用的方法、材料和试剂,除非另有说明,否则为本领域常规的方法、材料和试剂。
一、实验材料和方法
1、根据mettl3外显子4和mettl14外显子2两侧的序列,设计序列特异的sgrna:
mettl3sgrna1:ggaagttacactcttttagggagg(seqidno:1)
mettl3sgrna2:gggaaggatatcgtccaggaagg(seqidno:2)
mettl14sgrna1:ggtatttcattcaccattggcgacagg(seqidno:3)
mettl14sgrna2:ggacttatgggggagcttcggggg(seqidno:4)。
2、根据sgrnas序列合成互补配对的单链寡核苷酸,退火形成双链,将双链克隆到puc57-sgrna表达载体内。
3、外源供体是根据小鼠基因组序列设计的,共分为三段:左端臂序列、外显子编码序列和右端臂序列。将三段序列分别克隆到pbluescriptsk(+)-2loxp质粒中,三段序列被两个同向loxp序列间隔开。
获得左端臂序列所用引物:
mettl3f1:cccaagcttcccgagtttgcttttgttcatg(seqidno:5)
mettl3r1:cccaagcttcctaaaagagtgtaacttcccct(seqidno:6)
mettl14f1:ggggtacctgtgagtgcttgccgtttag(seqidno:7)
mettl14r1:gcgtcgacgccaatggtgaatgaaatacaa(seqidno:8);
获得外显子编码序列所用引物:
mettl3f2:tctaccggtgggaggtaagatcggcttact(seqidno:9)
mettl3r2:cgggatccggaaggcctccttactccag(seqidno:10)
mettl14f2:tctaccggtgacagggaatcatcctaatttca(seqidno:11)
mettl14r2:ggcgatatcaagctcccccataagtcaca(seqidno:12);
获得右端臂序列所用引物:
mettl3f3:cgacgcgttggacgatatccttcccttta(seqidno:13)
mettl3r3:ataagaatgcggccgcatgcctgagaaacccaggac(seqidno:14)
mettl14f3:cgacgcgtcgggggaatgagacagtca(seqidno:15)
mettl14r3:ataagaatgcggccgctgcagcctcccaaaatctac(seqidno:16);
loxp序列:
5'-ataacttcgtatagcatacattatacgaagttat-3'(seqidno:17)。
4、cas9及sgrna的体外转录:用agei内切酶将cas9表达质粒线性化,以线性化的质粒为模板用t7ultrakit(ambion)进行体外转录。用drai内切酶将sgrna表达质粒线性化,以线性化的质粒为模板用megashortscriptkit(ambion)进行体外转录。转录后的cas9mrna及sgrna用megaclearkit(ambion)进行纯化回收。
5、cas9/sgrna的显微注射:4周龄的雌鼠先注射30单位的pmsg(血清促性腺激素,sigma),48小时后注射30单位的hcg(sigma),随即将雌鼠与雄鼠交配。次日,获得小鼠受精卵。受精卵在ksom(millipore)中37℃,5%co2培养2小时。将含有cas9mrna(25ng/μl),sgrnas(各10ng/μl)以及外源供体(4ng/μl)的混合液显微注射至小鼠受精卵胞质。将注射后的受精卵移植到假孕母鼠输卵管内,最终获得在mettl3外显子4的dna序列两端各有一个loxp序列的flox小鼠(mettl3fl/+)和在mettl14外显子2的dna序列两端各有一个loxp序列的flox小鼠(mettl14fl/+)(图10和11)。
二、实验结果
1、建立了两种不同发育阶段的生殖细胞特异性mettl3基因敲除小鼠模型。
如图1所示,应用crispr/cas9技术,构建了floxedmettl3基因敲除小鼠(mettl3fl/+)。将mettl3fl/+小鼠与特异表达始于胚胎15.5天龄生殖细胞的vasa-cre小鼠交配,建立了精原干细胞特异性mettl3基因敲除小鼠(mettl3fl/del,vasa-cre)模型。免疫荧光染色证实了生殖细胞内mettl3的敲除(图3)。
以mettl3fl/+小鼠与a1精原细胞特异性表达的stra8-gfpcre小鼠交配,建立了a1精原细胞特异性mettl3基因敲除小鼠(mettl3fl/del,stra8-gfpcre)模型。免疫荧光染色证实了a1型精原细胞以后的生殖细胞内mettl3的敲除(图4)。
2、建立了两种不同发育阶段的生殖细胞特异性mettl14基因敲除小鼠模型
如图2所示,应用crispr/cas9技术,构建了floxedmettl14基因敲除小鼠(mettl14fl/+)。
采用相同的策略,分别构建了精原干细胞特异性mettl14基因敲除小鼠(mettl14fl/del,vasa-cre)模型和a1精原细胞特异性mettl14基因敲除小鼠(mettl14fl/del,stra8-gfpcre)模型。免疫荧光染色证实了生殖细胞内mettl14在不同发育阶段生殖细胞内的敲除(图5、6)。
3、建立了a1精原细胞特异性mettl3和mettl14复合型基因敲除小鼠(mettl3fl/del,mettl14fl/del,stra8-gfpcre)模型
以mettl3fl/+、mettl14fl/+和stra8-gfpcre小鼠为基础,反复多次交配,获取了mettl3fl/del,mettl14fl/del,stra8-gfpcre小鼠模型。免疫荧光染色证实了生殖细胞内mettl3及mettl14在a1型精原细胞以后的生殖细胞内的敲除(图7)。
4、mettl3、mettl14通过m6a调控精原干细胞命运决定
研究发现mettl3fl/del,vasa-cre雄性成年小鼠不育,组织学研究发现其睾丸生精上皮仅有支持细胞,进一步研究证实失活mettl3导致精原干细胞丢失(图8)。
通过对来自于对照组(mettl3fl/del)和突变组小鼠(mettl3fl/del,vasa-cre)的未分化精原细胞polyarna进行m6a质谱分析,发现突变组未分化精原细胞m6a水平(m6a/a:0.11%)显著低于对照组(m6a/a:0.33%),表明失活mettl3造成细胞内m6a水平下降,从而导致精原干细胞丢失。
失活mettl14后,其表型与失活mettl3类似,突变组未分化精原细胞m6a水平(m6a/a:0.18%)显著低于对照组(m6a/a:0.33%)。
5、mettl3和mettl14共同调控精子形成
mettl3fl/del,stra8-gfpcre或mettl14fl/del,stra8-gfpcre小鼠生育力正常,其精子发生也正常,但是复合型基因敲除小鼠(mettl13fl/del,mettl14fl/del,stra8-gfpcre)生育力下降,其精子发生表现为无精、少精、精子畸形(图9)。
序列表
<110>中国科学院上海生命科学研究院
<120>mettl14敲除的精子发生障碍动物模型及其建立构建方法
<130>170671
<160>17
<170>siposequencelisting1.0
<210>1
<211>24
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(24)
<223>sgrna
<400>1
ggaagttacactcttttagggagg24
<210>2
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>sgrna
<400>2
gggaaggatatcgtccaggaagg23
<210>3
<211>27
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(27)
<223>sgrna
<400>3
ggtatttcattcaccattggcgacagg27
<210>4
<211>24
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(24)
<223>sgrna
<400>4
ggacttatgggggagcttcggggg24
<210>5
<211>31
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(31)
<223>引物
<400>5
cccaagcttcccgagtttgcttttgttcatg31
<210>6
<211>32
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(32)
<223>引物
<400>6
cccaagcttcctaaaagagtgtaacttcccct32
<210>7
<211>28
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(28)
<223>引物
<400>7
ggggtacctgtgagtgcttgccgtttag28
<210>8
<211>30
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(30)
<223>引物
<400>8
gcgtcgacgccaatggtgaatgaaatacaa30
<210>9
<211>30
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(30)
<223>引物
<400>9
tctaccggtgggaggtaagatcggcttact30
<210>10
<211>28
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(28)
<223>引物
<400>10
cgggatccggaaggcctccttactccag28
<210>11
<211>32
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(32)
<223>引物
<400>11
tctaccggtgacagggaatcatcctaatttca32
<210>12
<211>29
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(29)
<223>引物
<400>12
ggcgatatcaagctcccccataagtcaca29
<210>13
<211>29
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(29)
<223>引物
<400>13
cgacgcgttggacgatatccttcccttta29
<210>14
<211>36
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(36)
<223>引物
<400>14
ataagaatgcggccgcatgcctgagaaacccaggac36
<210>15
<211>27
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(27)
<223>引物
<400>15
cgacgcgtcgggggaatgagacagtca27
<210>16
<211>36
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(36)
<223>引物
<400>16
ataagaatgcggccgctgcagcctcccaaaatctac36
<210>17
<211>34
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(34)
<223>loxp序列
<400>17
ataacttcgtatagcatacattatacgaagttat34
- 还没有人留言评论。精彩留言会获得点赞!