一种提高小鼠ES细胞向早期胚胎上胚层嵌合能力的方法与流程
本发明涉及一种提高小鼠es细胞向早期胚胎上胚层嵌合能力的方法。
背景技术:
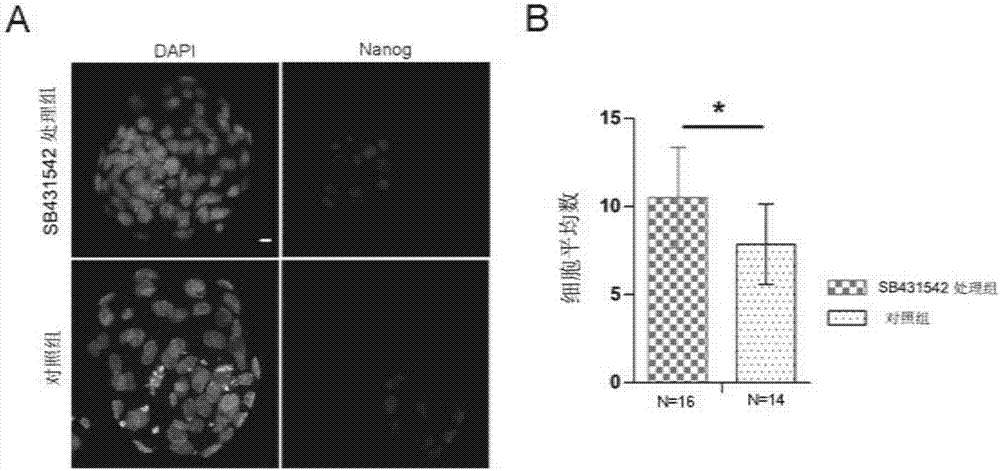
:自1981年小鼠胚胎干细胞(es细胞)成功建系以来,由基因修饰后的胚胎干细胞获得转基因小鼠就成为了基因功能研究的一项重要手段。而以es细胞为基础来生产小鼠通常是把es细胞注射到正常的二倍体小鼠囊胚中,这样就能够获得由es细胞和受体胚胎共同发育而来的嵌合体小鼠。而嵌合体小鼠通常需要花费大量的时间进行传代获得纯合的es细胞来源的小鼠后才能进行表型分析以及功能验证。鉴于囊胚注射生产小鼠的这一缺点,人们经过长期的研究,最终发现将es细胞注射到更为早期的小鼠胚胎(如4细胞胚胎、8细胞胚胎)中,能够在f0代就获得几乎完全由es细胞发育而来的小鼠,这种小鼠经验证是可以直接进行基因表型分析的,这就大大的缩短了基因编辑小鼠获得的时间,从而加速了基因功能研究的进程。尽管4细胞胚胎或8细胞胚胎注射能够获得较高嵌合的小鼠个体,该技术要求注射一定数量的es细胞,这就不利于生产规模的扩大。技术实现要素:本发明的目的是提供一种提高小鼠es细胞向早期胚胎上胚层嵌合能力的方法。本发明提供了一种用于制备嵌合体的受体胚胎培养液,其中含有浓度为500-1000ng/ml的激活素a。所述受体胚胎培养液由激活素a和基础胚胎培养液组成。所述受体胚胎培养液中含有浓度为500ng/ml的激活素a。本发明还保护一种用于制备嵌合体的试剂盒(试剂盒甲),包括以上任一所述的受体胚胎培养液和记载有方法甲的载体;所述方法甲包括如下步骤:(1)将4细胞期受体胚胎采用所述受体胚胎培养液培养至囊胚期;(2)将供体细胞注射入步骤(1)得到的囊胚期受体胚胎中;(3)将步骤(2)处理后的囊胚期受体胚胎移植到假孕受体子宫内,得到嵌合体。本发明还保护一种用于制备嵌合体的试剂盒(试剂盒乙),包括受体胚胎培养液和基础胚胎培养液;所述受体胚胎培养液为以上任一所述的受体胚胎培养液。所述试剂盒乙还包括记载有方法乙的载体;所述方法乙包括如下步骤:(a)将2细胞期受体胚胎采用所述基础胚胎培养液培养至4细胞期;(b)将步骤(a)得到的4细胞期受体胚胎采用所述受体胚胎培养液培养至囊胚期;(c)将供体细胞注射入步骤(b)得到的囊胚期受体胚胎中;(d)将步骤(c)处理后的囊胚期受体胚胎移植到假孕受体子宫内,得到嵌合体。本发明还保护一种用于制备嵌合体的试剂盒(试剂盒丁),包括激活素a和基础胚胎培养液;所述激活素a和基础胚胎培养液的配比为500-1000ng:1ml。所述激活素a和基础胚胎培养液的配比具体可为500ng:1ml。本发明还保护激活素a应用,为如下(a1)-(a6)中的至少一种:(a1)制备用于制备嵌合体的受体胚胎培养液;(a2)培养用于制备嵌合体的受体胚胎;(a3)阻碍胚胎上胚层的发育;(a4)阻碍胚胎干细胞从囊胚中分离;(a5)促进胚胎干细胞与胚胎上胚层的嵌合;(a6)提高胚胎干细胞在嵌合体中的嵌合比率。本发明还保护一种制备嵌合体的方法,包括如下步骤:用以上任一所述的受体胚胎培养液培养受体胚胎。本发明一种制备嵌合体的方法,包括如下步骤:(1)将4细胞期受体胚胎采用以上任一所述的受体胚胎培养液培养至囊胚期;(2)将供体细胞注射入步骤(1)得到的囊胚期受体胚胎中;(3)将步骤(2)处理后的囊胚期受体胚胎移植到假孕受体子宫内,得到嵌合体。以上任一所述基础胚胎培养液具体可为ksom培养液。以上任一所述嵌合体具体可为小鼠嵌合体。以上任一所述受体胚胎具体可为小鼠胚胎。所述小鼠胚胎具体可为cd-1小鼠胚胎。以上任一所述供体细胞可为胚胎干细胞。所述胚胎干细胞具体可为小鼠胚胎干细胞。所述小鼠胚胎干细胞具体可为g4-dsred-mstescs。以上任一所述供体细胞与所述受体胚胎的注射比例为10-15个细胞/胚胎。以上任一所述假孕受体具体可为假孕雌鼠。所述假孕雌鼠为2.5天假孕雌鼠。所述雌鼠具体可为cd-1雌鼠。以上任一所述激活素a具体可为由两个βa亚基通过二硫键构成的大小为26kda的蛋白,每个βa亚基由116个氨基酸残基(序列表的序列1)组成。所述激活素a具体可为peprotech公司,货号为120-14e的产品。本发明通过研究发现,activina能够有效地阻碍胚胎上胚层(epi)的发育。与对照组相比,当以activina处理后的胚胎(由4细胞处理到囊胚期)作为受体胚胎时,es细胞更易于嵌合到epi中,从而提高es细胞在嵌合体中的嵌合比率,这将有利于优化嵌合体生产系统,并对生产规模的扩大具有一定的促进作用。附图说明图1为实施例2的实验结果。a:activina处理和非处理的4.5dpc囊胚的nanog免疫荧光染色,标尺:20μm;b:activina处理和非处理的4.5天胚胎中epi细胞(nanog阳性细胞)的平均细胞数,**p<0.01,n表示用于实验的胚胎数;c:activina处理和非处理的的4.5dpc囊胚,标尺:20μm;d:epi细胞相关标记基因的实时荧光定量检测,**p<0.01。图2为实施例3的实验结果。a:sb431542处理和非处理的4.5dpc囊胚的nanog免疫荧光染色,标尺:20μm;b:sb431542处理和非处理的4.5天胚胎中epi细胞(nanog阳性细胞)的平均细胞数,**p<0.01,n表示用于实验的胚胎数。图3为实施例4的实验结果。a:衍生物分析实验流程;b:activina处理和非处理组胚胎获得衍生物的免疫荧光染色,标尺:50μm;c:activina处理和非处理组胚胎获得的nanog阳性衍生物的平均大小,以面积(μm2)计算,*p<0.05。图4为实施例5的实验结果。a:activina处理后胚胎囊胚注射实验流程图;b:用于囊胚注射的es细胞克隆(左侧:明场;右侧:dsred),标尺:20μm;c:es细胞注射后的嵌合囊胚,标尺:20μm;d:es细胞注射后嵌合囊胚的免疫荧光染色,标尺:20μm;e:10.5天的嵌合胚胎,标尺:500mm;f:es细胞在10.5天嵌合胎儿中的平均嵌合率,利用imagej进行统计,*p<0.05。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实施例中均采用cd-1小鼠作为实验动物。cd-1小鼠:购自北京维通利华实验动物技术有限公司。激活素a(activina):peprotech,货号:120-14e。激活素a是由两个βa亚基通过二硫键构成的大小为26kda的蛋白,每个βa亚基由116个氨基酸残基(序列表的序列1)组成。实施例1、胚胎获取以及体外培养第一天下午4点左右对雌鼠进行腹腔注射pmsg(5iu/只,孕马血清促性腺激素,购自宁波第二激素厂),并于46-48小时后注射hcg(5iu/只,人绒毛膜促性腺激素,购自宁波第二激素厂),注射后与雄鼠合笼。第三天早上8点左右对所有雌鼠进行检栓,并将见栓的雌鼠(即为0.5dpc)进行标记。第四天下午,从标记的小鼠的输卵管中将2细胞期胚胎冲取出来,用小鼠胚胎操作液m2(millipore,mr-015-d)清洗干净后将其转入小鼠胚胎体外培养液ksom(millipore,mr-121-d)中培养。实施例2、activina阻碍epi发育1、采用小鼠胚胎体外培养液ksom将activina配制为浓度为500ng/ml的activina工作液,并以10-20μl每滴的标准做成微滴,用石蜡油(sigma,m8410)覆盖后置于37℃培养箱中平衡至少2个小时,得到含activina的培养滴。2、将实施例1培养至4细胞时期的胚胎置于酸性台式液中(millipore,mr-004-d)洗吹几遍,待透明带降解后将胚胎移出,并用小鼠胚胎操作液m2轻轻吹吸,清洗干净后置于步骤1中平衡好的含activina的培养滴中培养,设置未添加activina工作液的培养滴作为对照;待胚胎发育到晚期囊胚(4.5dpc)时,收取胚胎,进行如下检测:(1)提取胚胎总rna,并反转录为cdna;以cdna为模板,进行荧光实时定量pcr检测epi相关标记基因rna水平表达。荧光实时定量pcr的反应体系如表1所示。荧光实时定量pcr采用的引物如表2所示。表1荧光实时定量pcr反应体系成分用量cdna0.5μl反向引物(10μm)0.5μl正向引物(10μm)0.5μlsybrgreen(公司roche,货号:4707516001)7.5μl水6μl总体积15.0μl表2荧光实时定量pcr采用的引物信息基因名称正向引物序列(5'-3')反向引物序列(5'-3')β-actingatctggcaccacaccttctggggtgttgaaggtctcaaapou5f1gttggagaaggtggaaccaactccttctgcagggctttcsox2aagggttcttgctgggttttagaccacgaaaacggtcttgnanogttcttgcttacaagggtctgcagaggaagggcgaggaga(2)采用免疫荧光染色的方法对胚胎epi相关标记基因蛋白水平进行检测,具体依次按照如下步骤操作:(a)将胚胎转移到固定液(4%多聚甲醛溶液)中,室温固定0.5h;(b)将胚胎转移到0.2%(质量百分含量)bsa水溶液中,清洗3次,每次3-5min;(c)将胚胎转移到0.5%(体积百分含量)tritonx-100水溶液进行细胞膜的通透,室温孵育20min,用0.2%(质量百分含量)bsa水溶液洗3次;(d)将胚胎转移到3%(质量百分含量)bsa水溶液中,室温孵育1h;(e)将胚胎转移到一抗(nanog,cellsignalingtechnology,货号:8822s)中,室温孵育4h;(f)将胚胎转移到0.2%(质量百分含量)bsa水溶液中,清洗3次,每次3-5min;(g)将胚胎转移到二抗(alexa594goatanti-rabbitigg,invitrogen,货号:a-11012)中,室温避光孵育1h;(h)将胚胎转移到0.2%(质量百分含量)bsa水溶液中,清洗3次,每次3-5min;(i)将胚胎转移到载玻片上,用含有dapi的mountingmedium(abcam,ab104140)进行封片,观察拍照,统计分析。结果如图1所示。结果表明,500ng/ml的activina能够有效地降低胚胎上胚层(epi)的细胞数目(图1a、图1b)。activina处理和非处理的的4.5dpc囊胚如图1c所示。与对照组相比,activina处理后的胚胎中epi相关基因的表达较低(图1d),这与免疫荧光染色的结果是一致的。上述结果表明activina能够阻碍epi的发育。实施例3、sb431542促进epi的发育1、采用小鼠胚胎体外培养液ksom将sb431542(selleck,s1067)配制为浓度为10μm的sb431542工作液,并以10-20μl每滴的标准做成微滴,用石蜡油(sigma,m8410)覆盖后置于37℃培养箱中平衡至少2个小时,得到含sb431542的培养滴。2、将实施例1培养至4细胞时期的胚胎置于酸性台式液中(millipore,mr-004-d)洗吹几遍,待透明带降解后将胚胎移出,并用小鼠胚胎操作液m2轻轻吹吸,清洗干净后置于步骤1中平衡好的含sb431542的培养滴中培养,设置未添加sb431542工作液的培养滴作为对照;待胚胎发育到晚期囊胚(4.5dpc)时,收取胚胎,采用免疫荧光染色的方法对胚胎epi相关标记基因蛋白水平进行检测(方法同实施例2步骤2中的方法)。结果如图2所示。sb431542是tgfβ家族的抑制剂,主要抑制的alk4,alk5以及alk7等受体,因此,sb431542可以作为activina的抑制剂。结果表明,用10μm的sb431542处理4细胞胚胎至晚期囊胚时,与对照组相比,sb431542处理组的epi细胞数目是有所增加的(图2a、2b)。这就更进一步的证实了activina对epi的阻碍作用。实施例4、activina阻碍es衍生物的产生一、feeder细胞制备1、将怀孕13.5天的小鼠通过脱颈的方法处死,用消毒后的剪刀剪开小鼠腹部,取出子宫置于无菌的培养皿中;去除子宫、胎盘和羊膜,获得小鼠胎儿,用dpbs(gibco,货号:14190-250)清洗干净。2、将步骤1处理后的小鼠胎儿放到新的培养皿中,去除胎鼠头部,尾,四肢以及所有内脏组织,将剩余部分放到无菌的1.5ml离心管中,并剪碎组织。3、将步骤2剪碎的组织移到50ml离心管,加胰酶(gibco,货号:25200-072)1ml,37℃消化15min,期间震荡3-5次,然后向消化后的混合液中加入等体积的feeder细胞培养基进行中和,并尽可能的吹散细胞团块。4、按1个胚胎1个10cm培养皿的标准,将步骤3中和后的组织悬液转移到培养皿中,补充feeder细胞培养基至8-10ml,放到37℃,5%co2培养箱培养(此时的细胞称为原代细胞,标记为p0)。。5、当细胞生长密度接近100%后,用胰酶进行消化,按照1:6比例传代。待细胞生长密度再次达到100%后,再次进行传代,此时细胞标记为p2。6、p2代的细胞长满后,加入丝裂霉素c(roche,货号:10107409001)处理两个小时。处理后的细胞经过dpbs洗三遍去除丝裂霉素c;用胰酶消化细胞,离心,1000rpm,5min弃上清,重悬细胞,计数并冻存feeder细胞备用。feeder细胞培养基配方如表3所示。表3feeder细胞培养基配方二、衍生物分析分别将实施例2步骤2得到的activina处理过的胚胎和对照胚胎接种于步骤一制备的feeder细胞上(每个胚胎一个培养皿,培养皿中feeder细胞:105个细胞/cm2),在es细胞分离培养基中进行es细胞分离,8天后进行免疫荧光染色(方法同实施例2步骤2中的免疫荧光染色),来检测衍生物分离情况。es细胞分离培养基配方如表4所示。表4es细胞分离培养基配方结果如图3和表5所示。表5activina处理和非处理组胚胎获得衍生物情况注:p<0.05本实验流程如图3a所示。根据多能性标记蛋白nanog表达情况将所得到的衍生物分为两类:一中为nanog阳性,这种衍生物是成功分离es细胞的,另一类是nanog呈阴性,即为es分离失败的。对成功分离es细胞的胚胎数进行统计发现activina处理组es分离成功率(55.6%)要低于对照组(91.7%)(表5),并且activina处理组所获得的nanog阳性的克隆的面积要小于对照组的(图3b、3c)。上述结果更进一步的说明了activina阻碍了早期胚胎epi的发育,从而使得es细胞分离受阻。实施例5、activina提高es细胞向epi的嵌合能力1、采用小鼠胚胎体外培养液ksom将activina配制为浓度为500ng/ml的activina工作液,并以10-20μl每滴的标准做成微滴,用石蜡油(sigma,m8410)覆盖后置于37℃培养箱中平衡至少2个小时,备用。2、将实施例1培养至4细胞时期的胚胎置于酸性台式液中(millipore,mr-004-d)洗吹几遍,待透明带降解后将胚胎移出,并用小鼠胚胎操作液m2轻轻吹吸,清洗干净后置于步骤1中平衡好的含activina的培养滴中培养,设置未添加activina工作液的培养滴作为对照;待胚胎发育到囊胚期(3.75-4.0dpc)时,收取胚胎。3、将供体细胞g4-dsred-mstescs(参考文献:vintersten,k.,monetti,c.,gertsenstein,m.,zhang,p.,laszlo,l.,biechele,s.,andnagy,a.(2004).mouseinred:redfluorescentproteinexpressioninmouseescells,embryos,andadultanimals.genesis40,241-246.;公众可以从中国农业大学获得;采用es细胞培养基培养)消化成单细胞,然后采用piezo显微操作系统对步骤2得到的胚胎进行显微注射,10-15个细胞/胚胎。es细胞培养基配方如表6所示。表6es细胞培养基配方4、第一天下午将雌鼠与输精管结扎的不育雄鼠合笼,第二天早上8点左右对所有雌鼠进行检栓,并将见栓的雌鼠(即为0.5天假孕鼠)进行标记,两天后(即第四天)得到2.5天假孕鼠。5、将步骤3注射后的囊胚移植到步骤4得到的2.5天假孕雌鼠的子宫中,每侧子宫移植7到9枚胚胎。6、待嵌合胚胎发育到晚期囊胚(4.5dpc)时,采用免疫荧光染色的方法对嵌合胚胎epi的标记蛋白nanog(cellsignalingtechnology、8822s)进行检测(方法同实施例2步骤2中的免疫荧光染色)。7、待嵌合胚胎发育到10.5dpc时,将胎儿去除,对其中的荧光分布进行观察,并用imagej进行统计,分析比较。结果如图4、表7和表8所示。表7es细胞在晚期囊胚中嵌合情况注:p<0.05,高嵌合指的是es细胞与nanog+细胞几乎重合,其他的标记为低嵌合。表8es细胞在10.5嵌合胎儿中嵌合情况注:p<0.05本实验流程如图4a所示。采用activina处理后的胚胎(从4细胞期处理到囊胚期)作为受体胚胎,红色荧光(dsred)标记的es细胞(g4-dsred-mstescs)(图4b)作为供体细胞。对晚期囊胚中es细胞分布进行了检测,结果发现es细胞集中嵌合到内细胞团(icm)中(图4c)。es细胞的荧光与nanog免疫荧光染色共定位结果表明,activina处理组中es在晚期囊胚epi中的嵌合比率是高于对照组的(图4c、4d和表7)。除此之外,将注射后的胚胎移植到受体小鼠体内,待其发育到10.5天时对es细胞在胎儿个体中的嵌合比率进行检测,结果同样表明,实验组中es细胞的嵌合率要明显高于对照组(图4e、4f和表8)。上述结果表明:用activina处理后的胚胎作为受体,能够有效的提高外源es细胞在受体胎儿中的嵌合比率。<110>中国农业大学<120>一种提高小鼠es细胞向早期胚胎上胚层嵌合能力的方法<160>1<210>1<211>116<212>prt<213>人工序列<220><223><400>1glyleuglucysaspglylysvalasnilecyscyslyslysglnphe151015phevalserphelysaspileglytrpasnasptrpileilealapro202530serglytyrhisalaasntyrcysgluglyglucysproserhisile354045alaglythrserglyserserleuserphehisserthrvalileasn505560histyrargmetargglyhisserprophealaasnleulyssercys65707580cysvalprothrlysleuargprometsermetleutyrtyraspasp859095glyglnasnileilelyslysaspileglnasnmetilevalgluglu100105110cysglycysser115当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1