一种具有乙酸糠醛香草醛耐受性重组酿酒酵母及制备方法、应用与流程
本发明属于微生物生物技术领域,特别涉及一种具有乙酸糠醛香草醛耐受性重组酿酒酵母及制备方法、应用。
背景技术:
随着经济的快速发展,能源短缺问题不断突出,燃料乙醇作为一种清洁的可再生能源因此受到广泛关注。我国作为农业大国,木质纤维素来源丰富、价格低廉且可再生。因此发展以农林废弃物木质纤维素为原料生产燃料乙醇具有重要意义。使用木质纤维素为底物生产燃料乙醇,首先需要对木质纤维素进行酸碱预处理,过程中会产生大量有毒副产物,如有机酸、呋喃类和芳香族化合物等(biotechnologyforbiofuels,2013,6(1):1-10),通过干扰细胞膜组成、影响胞内酶活等抑制酵母生长和乙醇生成,严重影响酵母乙醇发酵的正常进行。
研究表明,ypl162c基因编码的蛋白质位于液泡膜上,具体功能未知,目前推测其功能与细胞周期形态有关(genomebiology,2010,11:r24)。同时参与zn2+转运(journalofcellbiology,2015,211:639-652)。在酿酒酵母w303-1a面对氧化胁迫时ypl162c基因表达上调,可能ypl162c基因编码的蛋白参与氧化胁迫后细胞损伤的修复(molecularbiologyofthecell,2006,17:1472-1482)。但是该基因在乙酸、糠醛和香草醛耐受性方面的研究较少,目前未发现该基因过表达可提高乙酸、糠醛和香草醛耐受性的报道。
技术实现要素:
为弥补现有技术的不足,本发明提供一种具有乙酸糠醛香草醛耐受性重组酿酒酵母及制备方法、应用,该菌株能在分别含有高浓度乙酸、糠醛和香草醛等环境胁迫条件下良好生长,并能在较强的抑制物胁迫条件下,比如高浓度乙酸条件下具有较高的乙醇发酵效率。
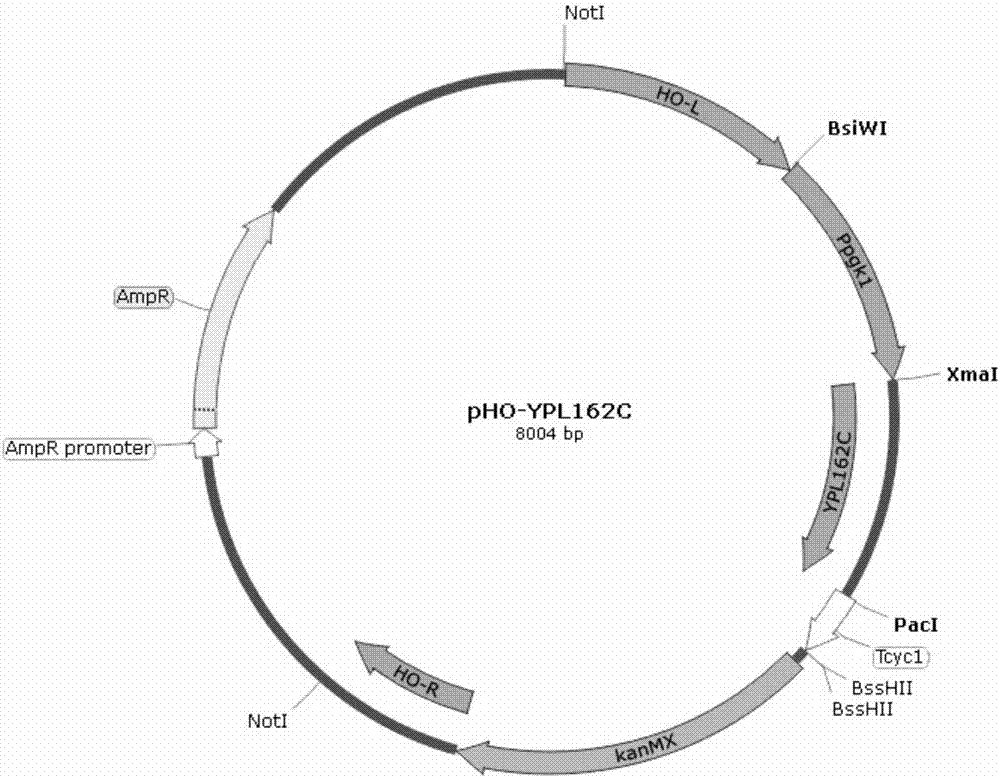
本发明的技术方案如下:一种具有乙酸糠醛香草醛耐受性重组酿酒酵母s288c-ypl162c(saccharomycescerevisiae),该菌株的保藏编号为cgmccno.13925,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期为2017年03月23日,保藏地址:北京市朝阳区北辰西路1号院3号;该菌株携带有ypl162c基因,ypl162c基因genbank登录号为nm_001183976.1。该酿酒酵母菌株为单细胞真菌,形状大多呈现卵圆形和圆形。菌落形态与细菌相似,但较大较厚,呈乳白色,表面湿润、粘稠。营养方式为异养兼性厌氧型。在培养基中生长时为游离态,乳白色。
pgk1启动子序列genbank登录号为fj415226.1,cyc1终止子序列genbank登录号为ef210198.1。通过基因工程手段在酵母的pho整合载体(ncbi:#af324728,美国utah大学davidj.stillman惠赠;nucleicacidsresearch,2001,29:e59)的基础上连接pgk1强启动子和cyc1终止子构成pho组成型表达载体。前期研究表明自絮凝酵母spsc01与游离酵母spsc01△flo1相比具有更高的环境胁迫耐受性,因此以自絮凝酵母spsc01基因组为模板,通过pcr扩增获得ypl162c基因,连接在pgk1启动子和cyc1终止子之间。线性化后通过化学转化法导入酿酒酵母s288c中进行过表达(natureprotocols,2007,2(1):31-35)。导入的目的片段在酿酒酵母基因组的ho基因位点(yeast,1997,13:1563-1573)进行整合表达。
本发明采用酿酒酵母的pho组成型表达载体进行重组菌株的整合表达,pho组成型表达载体可以通过同源重组的方式在酿酒酵母的ho基因位点进行整合表达,该载体通过基因工程手段在质粒的多克隆位点插入pgk1启动子和cyc1终止子,获得组成型整合表达载体,根据载体含有的遗传霉素g418抗性进行筛选(在含有g418的平板上进行筛选,只有成功导入含g418基因的目的片段的个体才能在平板上生长)。
本发明同时请求保护所述的酿酒酵母菌s288c-ypl162c在抑制物胁迫条件下的应用,比如与对照菌株s288c-ho相比,在高浓度乙酸、糠醛或香草醛的条件下生长良好,并且有较高的乙醇发酵效率。
本发明的有益效果如下:(1)本发明提供了一种新型菌株;(2)本发明的重组酿酒酵母s288c-ypl162c能在分别含有高浓度乙酸、糠醛和香草醛等环境胁迫条件下良好生长和乙醇发酵。
附图说明
图1ypl162c基因片段的pcr扩增;
图2ypl162c载体;
图3阳性转化子pcr鉴定;
图4重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c中基因ypl162c表达量比较;
图5重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c显微镜检测图;
其中:(a)s288c-ho,(b)s288c-ypl162c。
图6重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c在含有不同抑制物的平板中生长比较;
其中:(a)不添加抑制物情况下过表达菌株和对照菌株生长情况;
(b)乙酸10g/l添加下过表达菌株和对照菌株生长情况;(c)香草醛1g/l添加下过表达菌株和对照菌株生长情况;(d)糠醛1.5g/l添加下过表达菌株和对照菌株生长情况。
图7重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c在10g/l乙酸添加下乙醇发酵情况;
其中:(a)乙酸10g/l添加下过表达菌株和对照菌株生长随时间变化情况;(b)乙酸10g/l添加下发酵液中乙醇浓度和残余葡萄糖随时间的变化情况。
图8重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c在2g/l香草醛添加下乙醇发酵情况;
其中:(a)2g/l香草醛添加下过表达菌株和对照菌株生长随时间变化情况;(b)2g/l香草醛添加下发酵液中乙醇浓度和残余葡萄糖随时间的变化情况。
图9重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c在3g/l糠醛添加下乙醇发酵情况;
其中:(a)3g/l糠醛添加下过表达菌株和对照菌株生长随时间变化情况;(b)3g/l糠醛添加下发酵液中乙醇浓度和残余葡萄糖随时间的变化情况。
具体实施方式
实施例1:未知功能蛋白基因ypl162c的重组酿酒酵母的构建和转化
本发明涉及的基因ypl162c序列来自于ncbi公共数据库,ypl162c基因的genbank登录号为nm_001183976.1。基因的启动子用pgk1启动子,用cyc1终止子作为终止子,以酶切连接的方式在pgk1启动子和cyc1终止子之间分别插入ypl162c基因。然后通过限制性内切酶noti把构建的质粒酶切成线性,转化到酿酒酵母s288c中整合表达。
1.1酿酒酵母基因组dna提取
(1)从新培养的ypd平板上挑取酵母单菌落,接入100ml液体ypd培养基中,在30℃,150rpm的条件下过夜培养。
(2)取4ml菌液,10000rpm,离心1min,收集酵母细胞,用去离子水洗涤2次,将培养基等细胞表面杂质去除。
(3)在上述酵母细胞中加入500μl裂解液(2%tritonx-100,0.1mtris·hclph8.0,50mmedta,2%sds),重悬酵母细胞,转入1.5ml离心管。
(4)加入大约500μl直径为0.5mm的酸洗玻璃珠,与25μl5mm的nacl溶液混合,高速漩涡振荡5min,破碎细胞。
(5)将上述细胞破碎液在12000rpm离心5min,将上清转移至干净的1.5ml离心管中。
(6)在(5)离心后获得的上清中加入等体积的苯酚/氯仿/异戊醇(25:24:1),振荡混匀,12000rpm离心5min后,把上清转移至干净的离心管中。
(7)在(6)离心后获得的上清中加入2倍体积预冷的无水乙醇,-80℃静置30min,沉淀基因组dna,4℃,12000rpm离心10min。
(8)弃上清,沉淀用预冷的70%乙醇洗涤2次,室温放置5min使乙醇挥发,用50μlte缓冲液溶解dna沉淀。
(9)加入1μl10mg/mlrnasea,在37℃温育30min,消化rna,-20℃保存。
1.2pcr扩增目的基因条带
以絮凝酵母spsc01dna作为模板扩增基因ypl162c。引物序列如下:
pcr反应体系如下(50μl):
pcr反应程序设置:
pcr结束后,产物用琼脂糖凝胶电泳检测片断大小,与ncbi数据库中序列长度一致(图1)。
1.3目的片段酶切
将pcr产物用dna纯化试剂盒进行纯化,然后酶切。酶切反应体系如下:
37℃温育反应3h。
用凝胶回收试剂盒回收目的dna片段,经检测后于-20℃冻存备用。1.4目的基因与载体连接(25μl)
将制备好的目的片段与酶切回收后的载体片段进行连接。
反应体系如下:
在连接仪中反应时间10h,反应温度为16℃(构建的载体见图2)。
1.5连接产物转化大肠杆菌dh5α
1.5.1大肠杆菌感受态细胞制备
(1)取-80℃保存的大肠杆菌dh5α200μl接种于lb液体培养基中,37℃,200rpm培养过夜;
(2)按1:100的比例转接过夜培养的菌液至50ml新鲜lb液体培养基中,37℃,200rpm培养3-4h,至od600nm约为0.5;
(3)将菌液转入在冰上预冷的50ml离心管中,冰上放置30min,4℃,4000rpm离心5min;
(4)弃上清,用预冷的0.1mol/lcacl2溶液15ml悬浮细胞,冰上放置30min,4℃,4000rpm离心5min,弃去上清;
(5)重复上述步骤;
(6)加入预冷的0.1mol/lcacl2溶液2ml重悬细胞,加入2ml预冷的30%甘油,轻轻混匀,分装成200μl的小份,-80℃冻存。
1.5.2连接产物的转化
(1)从-80℃冰箱中取200μl感受态细胞,冰上融化;
(2)将10μl连接产物加入感受态细胞中,用移液枪轻轻混匀,冰上放置30min;
(3)将感受态细胞置于42℃水浴锅中热激90s,然后迅速置于冰浴中冷却2min;
(4)向管中加入800μllb液体培养基(不含抗生素),混匀后37℃振荡培养1h;
(5)4000rpm离心5min,弃部分上清,将剩余溶液混匀后涂布于含相应抗生素的筛选平板上(氨苄青霉素终浓度100μg/ml),正面向上放置半小时,待菌液完全晾干后倒置培养皿,37℃培养12-16h;
(6)挑阳性菌落进行鉴定。
1.5.3转化子质粒提取
使用omeg质粒提取试剂盒提取转化子质粒(e.z.n.aplasmiddnaminikitiprotocol-spinprotocol)。
1.5.4pcr鉴定阳性转化子
将提取的质粒作为模板进行pcr反应,以验证转化子。按照1.2中方法扩增目的基因,进行pcr验证。
pcr结束后,产物用琼脂糖凝胶电泳检测基因片断大小是否正确。
1.6重组质粒的线性化
因为重组质粒需要线性化后才能转入酵母中,进行整合表达,所以用noti限制性内切酶对质粒进行酶切。酶切反应体系如下:
37℃温育反应10h。
用凝胶回收试剂盒回收目的dna片段,检测无误后于-20℃冻存备用。
实施例2:未知蛋白基因ypl162c的酿酒酵母化学法转化
酿酒酵母细胞化学转化方法如下:
(1)将-80℃保存的酵母菌株s288c接入ypd培养基,30℃,150rpm培养12-14h,然后转接入新的ypd培养基(1%接种)培养6h;
(2)用50ml离心管离心收集菌体,3000rpm离心3min;
(3)弃上清,用20ml无菌超纯水重悬细胞,3000rpm离心3min;
(4)弃上清,用20ml0.1mliac(醋酸锂溶液)重悬细胞,3000rpm离心3min;
(5)弃上清,用0.5-2ml0.1mliac重悬细胞,至菌液浓度od620nm为2.0-3.0;
(6)取100μl上述菌液至1.5ml离心管中,3000rpm离心3min;
(7)弃上清,在离心管中加入240μl50%peg(平均分子量3350~4000),36μl1mliac,50μl2mg/ml单链鲑鱼精dna,1μgdna片段,混匀;
(8)42℃水浴40~60min;
(9)3000rpm离心3min,弃上清,加入800μlypd培养基,30℃,150rpm培养1-2h;
(10)3000rpm离心3min,弃去部分上清获得浓缩菌液,涂布于含有300μg/mlg418的ypd平板上;
(11)将平板倒置于30℃培养箱培养,至酵母转化子克隆长出。
(12)随机挑取生长状态较好的单菌落接入ypd液体培养基中(含100μg/ml的g418抗生素),获得一定量的菌体进行基因组dna提取(方法与1.1相同),以获得的基因组为模板扩增验证片段(引物如下),验证(方法与1.2相同)目的基因的整合情况,验证片段包含部分目的基因ypl162c片段和部分抗性基因片段g418,全长1000bp。并进一步通过琼脂糖凝胶电泳进行验证(图3)。
验证片段引物如下:
实施例3:重组菌株s288c-ypl162c中ypl162c基因的表达情况及显微镜检测细胞生长形态
3.1重组菌株ypl162c基因的表达情况
(1)将重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c接入100ml种子培养基(30g/l葡萄糖,3g/l蛋白胨,4g/l酵母浸粉)中,30℃,150rpm,培养24h;
(2)分别取菌液,测其在620nm处吸光值,然后用种子培养基调节od620至1.5;
(3)以10%(v/v)的接种量接入发酵培养基(100g/l葡萄糖,3g/l蛋白胨,4g/l酵母浸粉,ph4.5),在30℃,150rpm的条件下进行培养;
(4)菌株发酵到12h(对数生长期),分别取4ml菌液离心弃上清液,细胞用无菌水洗涤2次,菌体迅速用液氮冷冻,-80℃保存,提取rna备用;
(5)采用天根rnasimple总rna提取试剂盒提取重组菌s288c-ypl162c,和对照菌s288c-ho对数生长期的总rna;
(6)参照takaraprimescripttmrtreagentkitwithgdnaeraser试剂盒方法将提取的rna反转录为cdna;real-timepcr参照
结果:在不添加任何抑制物情况下重组菌株s288c-ypl162c基因ypl162c的表达量是对照菌株表达量的2.4倍。表明目的基因ypl162c在重组菌中实现了过表达,结果如图4所示。
3.2重组菌株显微镜检测细胞生长形态
(1)将重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c接种入100ml种子培养基(30g/l葡萄糖,3g/l蛋白胨,4g/l酵母浸粉)中,30℃,150rpm,培养至对数中期(12h);
(2)分别取s288c-ho和s288c-ypl162c对数生长期细胞1μl,制备细胞装片,用显微镜观察细胞形态并拍照。
结果:如图5所示,s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c在显微镜下观察细胞形态无明显差异,说明过表达ypl162c基因后未对原始菌株细胞形态造成影响。
实施例4:重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c在含有不同胁迫因素下的平板生长比较
(1)将重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c接种入100ml种子培养基(30g/l葡萄糖,3g/l蛋白胨,4g/l酵母浸粉)中,30℃,150rpm,过夜培养;
(2)取过夜培养的菌液,以10%(v/v)的接种量分别转接入种子培养基中(同步骤(1)),30℃,150rpm培养12h;
(3)分别取菌液,测其在620nm处吸光值,用灭菌后的种子培养基调节od值至1.0;
(4)将上述菌液分别进行5倍梯度稀释;
(5)将梯度稀释后的菌液取2μl依次点样于分别含10g/l乙酸,1.5g/l糠醛,1g/l香草醛,和不添加抑制物的ypd平板上(20g/l葡萄糖,20g/l蛋白胨,10g/l酵母浸粉,15g/l琼脂粉);
(6)于30℃培养箱中倒置培养,待菌落长出后观察对比并拍照。
结果:从图6(a)对照组中看出,在正常培养条件下(培养36h)两株菌种s288c-ho和s288c-ypl162c的生长状态一致,说明ypl162c基因过表达后对菌株的生长没有影响。
如图6(b)当培养基中添加10g/l的乙酸(培养36h),其它条件不变时,菌株s288c-ypl162c在5-6稀释梯度有菌落生长,而对照菌株s288c-ho在5-5稀释梯度基本不能生长,说明ypl162c基因过表达提高了重组菌s288c-ypl162c对乙酸耐受性。
同样如图6(c)、(b),当培养基中分别添加1.5g/l糠醛、1g/l香草醛时,s288c-ypl162c菌株在固体培养基中生长状态均明显优于对照菌株s288c-ho,说明过表达ypl162c基因提高了菌株对糠醛和香草醛的耐受性。
通过本次不同胁迫条件下平板生长实验表明,在酿酒酵母s288c的染色体上整合表达未知功能蛋白基因ypl162c后,得到的酿酒酵母菌株s288c-ypl162c分别对抑制物乙酸、糠醛和香草醛的耐受性明显增强。
实施例5:重组空载酵母s288c-ho对照菌株和重组酿酒酵母s288c-ypl162c在添加不同抑制物条件下的乙醇发酵情况比较
(1)分别将对照菌株s288c-ho和重组酿酒酵母s288c-ypl162c接入含有100ml种子培养基(30g/l葡萄糖,3g/l蛋白胨,4g/l酵母浸粉)的250ml摇瓶中,30℃,150rpm,培养24h;
(2)分别取菌液,测其在620nm处吸光值,然后用种子培养基调节od为1.5;
(3)以10%(v/v)的接种量分别接入含有10g/l乙酸、2g/l香草醛、3g/l糠醛的发酵培养基中(100g/l葡萄糖,3g/l蛋白胨,4g/l酵母浸粉,ph4.5),在30℃,150rpm条件下进行乙醇发酵实验。
(4)在空载酵母s288c-ho和重组酿酒酵母s288c-ypl162c乙醇发酵过程中定时取样,分别取一定量菌液用酶标仪测定吸光值来确定菌体的密度;剩余的菌液离心后取上清液通过dns法检测发酵液中剩余葡萄糖浓度,气相色谱仪检测发酵液中乙醇浓度,当上清液中葡萄糖的浓度低于1g/l时定义为乙醇发酵结束。
结果:从图7(a)看出,随着乙醇发酵的进行,过表达菌株s288c-ypl162c和对照菌株s288c-ho于12h同时进入对数期,发酵至48h两个菌株同时达到最大值,且重组菌株比对照菌株的菌体密度高9%。从图7(b)看出过表达菌株s288c-ypl162c的葡萄糖消耗速率及乙醇产生速率均高于对照菌株s288c-ho。在发酵36h时,s288c-ypl162c已消耗完所有葡萄糖,比对照菌株s288c-ho提前了12h。在36h时,重组菌株乙醇浓度达到最大值37.3g/l,对照菌株在48h达到最大浓度36.8g/l,发酵时间提前了12h。表明过表达菌株s288c-ypl162c在含有10g/l乙酸的发酵培养基中生长状态及发酵性能均优于s288c-ho,提高了菌株的乙酸耐受性。
从图8(a)看出,在乙醇发酵过程中,从12h开始,过表达菌株s288c-ypl162c的od值快速增加,至60h菌体密度达到最大值,比对照菌株提前6h,且比对照菌株提高了71.4%。根据图8(b)所示,过表达菌株s288c-ypl162c的葡萄糖消耗速率及乙醇产率均高于对照菌株s288c-ho,分别为36h时葡萄糖消耗完毕且乙醇浓度达到最大值,比对照菌株提前了44h。表明过表达基因ypl162c的重组酿酒酵母s288c-ypl162c在含有2g/l香草醛的发酵培养基中生长状态及发酵性能均明显优于s288c-ho,增强了菌株对香草醛的耐受性。
从图9(a)看出,s288c-ypl162c比对照菌株提前30h进入对数期,且最大的菌体密度比对照菌株提高52%。根据图9(b)所示,菌株s288c-ypl162c从12h开始进入快速耗糖阶段,比对照菌株提前44h消耗完葡萄糖。菌株s288c-ypl162c在42h乙醇浓度达到最大36g/l,最大乙醇浓度比对照菌提高了24%,且发酵时间缩短了38h。由此表明重组菌株s288c-ypl162c在3g/l糠醛发酵中生长状态及发酵性能均明显优于对照菌株,显著提高了原始菌株对糠醛的耐受性。
<110>大连理工大学
<120>一种具有乙酸糠醛香草醛耐受性重组酿酒酵母及制备方法、应用
<160>1
<210>1
<211>822
<212>dna
<400>1
atgtatgtttctaatgggaaagacacttgccagttgttggggcccgtgtctctttttgtccagacattgatgggtatgacagccgtgattgtgttattggtgaaaagaaactatgagcatccaaggagaaaaatgattgtgtggagttatgacattggaaaacaaatcatcggctctcttggaatccattttttgaatctaggcatcagcatactgaagaaaagacgaaggtcactcttcgcaatcactgcaaaaggcaatgatgatgaggatcaatgcgattggtattttcttaacttactcctggatactactgttgggattcccattctttggttgtgcttatacataattgaaaaagtgctaaaatccttacacttccaaaacattgaaagtggtaattattttccatctaaaaccgttgggagccaccccagaaaacccttattctctgccttcgtgaaacagctgcttatattcattgttgggctgggcgtgatgaagttctgcgtgtttctaatactaaactacttagaagacttggcatactggttcgccgatcttatccttggctggtcagattcatggccaaactttcaagtttttctggtcatgtttgtctttcctatcttactgaattgcttccagtacttttgtgtcgacaatgtcatcaggttacattctgagagcctaacgataaccaatgcagagaattttgaaacgaacacattcctaaatgacgaaattcctgatttatcggaagtctcaaatgaagtgcctaacaaggataacaacatttccagctatggtagcataatatag
<110>大连理工大学
<120>一种具有乙酸糠醛香草醛耐受性重组酿酒酵母及制备方法、应用
<160>2
<210>1
<211>273
<212>氨基酸
<400>1
myvsngkdtcqllgpvslfvqtlmgmtavivllvkrnyehprrkmivwsydigkqiigslgihflnlgisilkkrrrslfaitakgnddedqcdwyflnllldttvgipilwlclyiiekvlkslhfqniesgnyfpsktvgshprkplfsafvkqllifivglgvmkfcvflilnyledlaywfadlilgwsdswpnfqvflvmfvfpillncfqyfcvdnvirlhsesltitnaenfetntflndeipdlsevsnevpnkdnnissygsii
- 还没有人留言评论。精彩留言会获得点赞!