用于猪传染性胃肠炎病毒检测的DPO引物组、含有该引物组的试剂盒及其应用的制作方法
本发明涉及一种用于猪传染性胃肠炎病毒检测的引物组、含有该引物组的试剂盒及其应用,特别涉及一种用于猪传染性胃肠炎病毒进行定性、定量检测的双启动寡核苷酸(dpo)引物组、含有该引物组的试剂盒及其应用。本发明属于生物检测
技术领域:
。
背景技术:
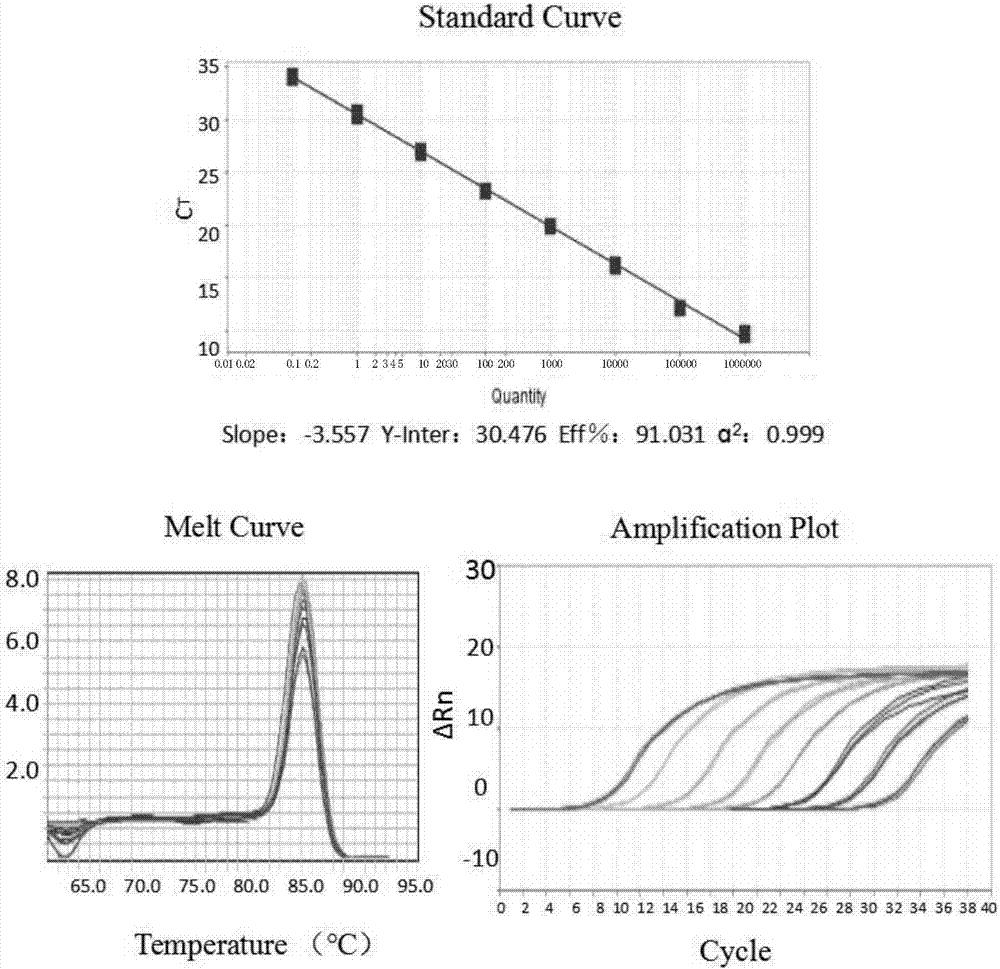
:猪传染性胃肠炎(transmissiblegastroenteritis)是由猪传染性胃肠炎病毒(tgev)引起的一种高度接触性、急性消化道传染病。以呕吐,严重腹泻和脱水为特征,危害严重,是影响养猪业发展的主要病毒性传染病之一,且该病经常与猪流行性腹泻与猪轮状病毒混合感染。病猪和带毒猪是主要传染源,经粪便、呕吐物、乳汁、鼻液和呼出的气体排出病毒,污染饲料、饮水、空气、车辆、工具和环境,经消化道和呼吸道传染给易感猪,死亡率高,严重危害猪业发展。目前常用的临床诊断的方法包括病理学检查、血清学检测和rt-pcr检测等,例如王劭等(猪传染性胃肠炎病毒rt-pcr检测方法的建立,王劭等,动物医学进展,2007,28(11):12-16)公开了一种猪传染性胃肠炎病毒rt-pcr检测方法,但rt-pcr检测引物设计过程复杂,需要对引物参数进行反复优化,有时即使反复优化过后仍然避免不了非特异性扩增及引物二聚体的存在。而且特异性差,避免不了非特异性扩增的出现。为解决此问题,本发明利用双启动寡核苷酸引物,即dpo引物,通过对猪传染性胃肠炎病毒特异性n基因序列dnaman比对,选取其高特异性序列进行dpo引物设计,建立了猪传染性胃肠炎病毒dporeal-timert-pcr检测方法,dpo引物特异性高,退火温度范围宽,避免了传统方法中反复优化反应的麻烦。本发明检测方法特异强、敏感高,显着提高了对猪传染性胃肠炎病毒的检测效率及其敏感性,为猪传染性胃肠炎病毒的检测提供了重要的技术支持。技术实现要素:本发明所要解决的技术问题是提供一种能够特异的、灵敏的检测猪传染性胃肠炎病毒的dpo-realtimert-pcr检测方法。为了达到上述目的,本发明采用了以下技术手段:为建立特异、快速检测猪传染性胃肠炎病毒的dpo-realtimert-pcr检测方法,本研究针对测猪传染性胃肠炎病毒的n基因设计了一对双启动寡核苷酸(dpo)引物,建立了猪传染性胃肠炎病毒dpo-realtimert-pcr检测方法。试验结果显示,本发明方法的检测下限为2.21×101copies/ul,在40℃-65℃退火温度范围内均可高效扩增靶基因片段,表明该方法退火温度范围宽,同时dpo引物特异性强,pcr反应过程中不会产生非特异性扩增。利用该方法对采集的128份样品进行检测,共计检出65份猪传染性胃肠炎阳性样品,经国标法(sn/t1446-2010)复验,两者检测结果一致,显示了良好的实用性。本发明的一种用于猪传染性胃肠炎病毒检测的dpo引物组,其由上游引物和下游引物组成,所述的上游引物以及下游引物的序列如下所示:上游引物:5’ctgttcttgccgcacttaaaaiiiiiggtgttgac3’下游引物:5’tagctccataaaatcttgtcacatciiiiitacctgcag3’其中,i表示次黄嘌呤核苷。进一步的,本发明还提出了所述的引物组在制备检测或诊断猪传染性胃肠炎病毒的试剂中的用途。一种用于猪传染性胃肠炎病毒检测的dpo-realtimert-pcr试剂盒,其含有本发明所述的引物组。在本发明所述的试剂盒中,优选的,还包括荧光染料、反应缓冲液、dntp、rnasin、随机引物、反转录酶、阳性标准品、阴性对照以及无rna酶水。在本发明所述的试剂盒中,优选的,所述的反转录酶为m-mlv,所述的阳性标准品为含有猪传染性胃肠炎n基因序列第32-212位的质粒。使用本发明所述的试剂盒检测猪传染性胃肠炎病毒时,按照以下步骤进行:(1)提取待测样本的总rna(2)反转录对步骤(1)提取得到的总rna进行反转录得到dna模板;(3)荧光定量pcr检测利用阳性标准品作为对照,以步骤(2)得到的dna为模板,使用本发明所述的引物组进行荧光定量pcr扩增,荧光定量pcr体系为:荧光定量pcr程序为:95℃10min,95℃15s,60℃1min,共进行35~40个循环。(4)标准曲线的制作利用一系列不同浓度梯度的阳性标准品为模板,按照步骤(3)进行荧光定量pcr扩增,以标准品拷贝数的对数做为x轴,ct值做为y轴自动绘制标准曲线;(5)样本中病毒含量的计算根据建立的标准曲线分别计算样本中病毒的拷贝数。相较于现有技术,本发明的有益效果是:本发明采用dpo引物结合实时荧光定量pcr方法,因为实时荧光定量具有线性检测范围大、检测速度快、通量高、封闭检测无污染、灵敏度高等诸多优点,已经在核酸拷贝数定量方面有了诸多临床应用,dpo引物具有退火温度范围广,特异性好,设计简单,避免优化反应条件等优点。基于上述问题的考虑,本发明将登录于genbank中高度保守的猪传染性胃肠炎n基因序列大量比对筛选,最终确定高度保守区以设计dpo-realtimert-pcr引物。从基因水平去构建猪传染性胃肠炎标准质粒,进行标准曲线的建立,能够实现现有检测技术所无法完成的定量、快速、特异、敏感的结果判定。本发明建立的dpo-realtimert-pcr方法设计简单、特异性强、灵敏度高,为猪传染性胃肠炎病毒的快速准确检测提供了新的技术手段。附图说明图1为tgev荧光定量pcr检测方法建立结果;图2为tgev荧光定量pcr标准曲线建立结果;图3为tgev荧光定量pcr灵敏度检测结果;注:1-7分别为2.21×107copies/ul-2.21×101copies/ul浓度的质粒标准品图4为tgev荧光定量pcr特异性检测结果;1:tgev-n阳性质控;2:tgevcdna;3~10:prvcdna、pedvcdna、bvdvcdna、ibdvcdna、ifnvcdna、brvdna、fipvcdna、阴性对照;图5为real-timepcr常规引物与dpo引物特异性比对结果;图5a中,1:tgev-n3基因/tgev-cg引物;2:tgev-n3基因/tgev-dpo引物;图5b中,1:tgev-n5基因/tgev-cg引物;2:tgev-n5基因/tgev-dpo引物;图5c中,1:tgev-sn3基因/tgev-cg引物;2:tgev-sn3基因/tgev-dpo引物;图5d中,1:tgev-sn5基因/tgev-cg引物;2:tgev-sn5基因/tgev-dpo引物;图6为dpo引物与已发表引物特异性对比结果。a)tgev-p引物;b)tgev-dpo引物。具体实施方式下面通过实施例对本发明做进一步的说明验证,所有实施例仅用于例证本发明,不限制本发明的保护范围。本领域技术人员知晓对于本发明权利要求内所做的更改或等效变更,均落入本发明的保护范围之内。实施例1用于猪传染性胃肠炎病毒检测的dpo引物组的设计与合成通过猪传染性胃肠炎病毒生物信息分析,确定了n基因作为本发明的目的基因。根据genbank中登录的猪传染性胃肠炎n基因序列,使用dnaman比对诸多序列筛选出高度保守区,具体为编码n基因的第32-212位。根据该保守区设计并合成了用于猪传染性胃肠炎病毒检测的dpo引物组,包括上游引物和下游引物,具体序列如下:tgev-dpo-f:5’ctgttcttgccgcacttaaaaiiiiiggtgttgac3’tgev-dpo-r:5’tagctccataaaatcttgtcacatciiiiitacctgcag3’。其中,“i”表示次黄嘌呤核苷。实施例2猪传染性胃肠炎病毒检测方法的建立1、猪传染性胃肠炎病毒检测方法的建立(1)提取待测样本的总rna取约100mgtgev阳性、阴性样本组织或已知阳性tgev病毒细胞培养物于冰浴匀浆器中,加入1mltrizol(invitrogen,usa),迅速研磨成匀浆液,加入200μl氯仿,震荡30s,冰上放置5min。4℃,12000rpm,离心10min,取上层水相转移至另一1.5ml离心管中,加入等体积的异丙醇,颠倒混匀,-20℃静置2h。然后4℃,12000rpm,离心20min,弃上清,加入1ml75%乙醇,轻轻混匀,4℃,12000rpm,离心10min,吸净上清液,于室温下晾干,加入20μldepc处理的去离子水溶解沉淀,-80℃保存备用。(2)反转录使用试剂盒(promega,usa)对所述总rna进行反转录得到cdna模板。反转录反应液组成如下表1所示:表1反转录体系试剂名称用量5×rt-pcr反应液5uldntp(10um/ul)2.5ulrnasin(20u/ul)2ulrna8ug随机引物(0.1ug/ul)1ulm-mlv(5u/ul)6ul无rna酶水补足至25ul42℃反转录50min,95℃5min灭活反转录酶。(3)荧光定量pcr检测以反转录得到的cdna作为模板,分别根据表2和表3的程序与体系,使用dpo引物进行荧光定量pcr实验,每种样品做三个平行样。结果如图1所示,结果可见,tgev阳性、待检样本出现扩增,阴性样本未出现扩增曲线。从溶解曲线上看,阳性样本与已知阳性tgev病毒细胞培养物为单峰且无非特异性峰出现,表明本方法有很好的特异性。表2real-timepcr反应体系表3real-timepcr反应程序2、标准曲线的制作(1)猪传染性胃肠炎质粒标准品的构建通过猪传染性胃肠炎病毒生物信息分析,确定了n基因作为本发明的目的基因。根据genbank中登录的猪传染性胃肠炎n基因序列,使用dnaman比对诸多序列筛选出高度保守区,具体为编码n基因的第32-212位。然后,将含有该片段的n基因的pcr产物回收纯化克隆入pmd19-t载体,构建的质粒命名为pmd19-t-n。(2)标准曲线的制作利用一系列不同浓度梯度的目的基因标准品质粒绘制标准曲线后,分别计算样本中各自标准品的拷贝数。本方法采用2.21×108copies/ul-2.21×101copies/ul不同的8个稀释度样本作为模板,使用abi7500荧光定量pcr仪根据表2,表3完成扩增。检测后,生成动力学曲线图,并以标准品拷贝数的对数做为x轴,ct值做为y轴自动绘制标准曲线。结果显示,相关系数r2可达0.999,斜率m=-3.557,证明该标准曲线在2.21×108copies/ul-2.21×101copies/ul8个不同浓度范围内具有良好的线性关系,标准品可用(图2)。3、灵敏度检测利用一系列10倍稀释浓度梯度的目的基因标准品质粒做模板,按照表2、表3中的程序与体系、dpo引物,进行荧光定量pcr实验。每种样品做三个平行样,避光条件下进行。得出本发明建立的荧光定量pcr方法能够检测出的最低拷贝数。结果如图3所示,实验证明最低可检测限度为2.21×101copies/ul。4、特异性检测利用所建立的方法检测猪轮状病毒、猪传染性胃肠炎、猪流行性腹泻病毒、牛病毒性腹泻病毒、牛轮状病毒、鸡传染性法氏囊病病毒、传染性造血器官坏死病病毒、牛细小病毒、猫传染性腹膜炎病毒,阴性对照。只有猪传染性胃肠炎病毒得到阳性结果,结果如图4所示。实施例3对比试验1、猪传染性胃肠炎real-timepcrdpo引物与常规引物设计与比较将上述重组质粒pmd19-t-n基因进行点突变,分别采取①3’端突变三个位点(命名为tgev-n3,seqidno.2所示);②5’端突变三个位点(命名为tgev-n5,seqidno.3所示);③3’端突变五个位点(命名为tgev-sn3,seqidno.4所示);④5’端突变五个位点(命名为tgev-sn5,seqidno.5所示);⑤未突变n基因(命名为tgev-n,seqidno.1所示)。分别比较常规引物tgev-cg与本发明设计的dpo引物的特异性,引物序列见表4。表4引物序列注:“i”表示次黄嘌呤核苷。以上述突变基因为模板,按照各自的反应体系以及反应条件进行rt-pcr比较实验,结果如图5,从图5结果可以看出,dpo引物扩增明显受到了抑制,其特异性优于常规引物,说明dpo引物特异性良好。2、猪传染性胃肠炎real-timepcrdpo引物与已发表文献(王劭等发表)所用引物特异性比较使用6种病毒的细胞培养物cdna(猪传染性胃肠炎病毒、猪流行性腹泻病毒、牛病毒性腹泻病毒、牛轮状病毒、鸡传染性法氏囊病病毒、传染性造血器官坏死病病毒)使用王劭等(猪传染性胃肠炎病毒rt-pcr检测方法的建立,王劭等,动物医学进展,2007,28(11):12-16)公开的引物以及本发明的dpo引物进行特异性比较,引物序列如表1所示,结果如图6所示,使用dpo引物只有tgev有扩增曲线,其余无扩增信号(图6b);使用tgev-p引物有假阳性出现(图6a),证明dpo引物有较强的特异性。实施例4用于猪传染性胃肠炎病毒检测的dpo-realtimert-pcr试剂盒组成该dpo-realtimert-pcr试剂盒包括:反转录pcr反应液、dntp(10um/ul)、rnasin(20u/ul)、随机引物(0.1ug/ul)、m-mlv(5u/ul)、faststartuniversalsybrgreenmaster、dpo引物对(10um,实施例1)、阳性标准品(pmd19-t-n质粒)、阴性对照以及无rna酶水。序列表<110>东北农业大学<120>用于猪传染性胃肠炎病毒检测的dpo引物组、含有该引物组的试剂盒及其应用<130>klpi170888<160>5<170>patentin3.5<210>1<211>234<212>dna<213>tgev-n<400>1aataacaagaaggatgacagtgtagaacaagctgttcttgccgcacttaaaaagttaggt60gttgacacagaaaaacaacagcaacgctctcgttctaaatctaaagaacgtagtaactct120aagacaagagatactacacctaagaatgaaaacaaacacacctggaagagaactgcaggt180aaaggtgatgtgacaagattttatggagctagaagcagttcagccaattttggt234<210>2<211>230<212>dna<213>tgev-n3<400>2aataacaagaaggatgacagtgtagaacaagctgttcttgccgcacttaaaaagttagat60ctttacacagaaaaacaacagcaacgctctcgttctaaatctaaagaacgtagtaactct120aagacaagagatactacacctaagaatgaaaacaaacacacctggaagagaactacggtt180aaaggtgatgtgacaagattttatggagctagaagcagttcagccaattt230<210>3<211>230<212>dna<213>tgev-n5<400>3aataacaagaaggatgacagtgtagaacaagctgttattgctgcacttcaaaagttaggt60gttgacacagaaaaacaacagcaacgctctcgttctaaatctaaagaacgtagtaactct120aagacaagagatactacacctaagaatgaaaacaaacacacctggaagagaactgcaggt180aaaggtgatatgacaatattttatgcagctagaagcagttcagccaattt230<210>4<211>230<212>dna<213>tgev-sn3<400>4aataacaagaaggatgacagtgtagaacaagctgttcttgccgcacttaaaaagttacat60gctagcacagaaaaacaacagcaacgctctcgttctaaatctaaagaacgtagtaactct120aagacaagagatactacacctaagaatgaaaacaaacacacctggaagagaaccgtatga180gaaggtgatgtgacaagattttatggagctagaagcagttcagccaattt230<210>5<211>230<212>dna<213>tgev-sn5<400>5aataacaagaaggatgacagtgtagaacaagctgttcatgcagctcctaaagagttaggt60gttgacacagaaaaacaacagcaacgctctcgttctaaatctaaagaacgtagtaactct120aagacaagagatactacacctaagaatgaaaacaaacacacctggaagagaactgcaggt180aaaggtaatttgagaagattatatgaagctagaagcagttcagccaattt230当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1