一种绿色荧光的蓝细菌光敏色素荧光标记物的制备方法与流程
本发明涉及融合蛋白表达领域,特别涉及一种光敏色素荧光标记物的制备方法。
背景技术:
荧光探针(或荧光标记物)是荧光免疫检测技术的重要基础原料,主要是通过化学修饰法,将荧光底物同生物素-链霉亲和素系统结合得到,可进一步放大荧光信号,提高免疫检测的灵敏度。
天然藻胆蛋白是最常见的荧光底物之一,其天然结构一般为六聚体,亚基由脱辅基蛋白和藻胆色素,通过裂合酶催化结合而成。藻胆色素则由血红素经过血红素氧化酶(HO1)和各种胆绿素还原酶催化形成,常见的藻胆色素有藻红胆素(PEB),藻尿胆素(PUB),藻蓝胆素(PCB)和藻紫胆素(PVB)。通过结合不同的藻胆色素,藻胆蛋白吸收400nm~700nm范围内不同波段的光后,可发出不同的荧光。
传统的藻胆蛋白荧光探针制备流程,首先是获取高纯度天然藻胆蛋白,然后通过化学修饰法,与生物素-链霉亲和素系统结合,进一步纯化后再用于免疫检测。但是高纯度的天然藻胆蛋白获取困难,制备成本高,同时结构不稳定,聚合形态多变。这使得藻胆蛋白荧光探针的成本居高不下。
通过微生物表达融合蛋白是一种成本较低的蛋白制备方法。然而融合蛋白的表达往往受到融合基因的设计和发酵工艺的限制,并不能稳定的表达,难以得到质量稳定的合格产品。
如何选择合适的蛋白片断进行融合,使其可以更为稳定地发酵生产,是有待解决的技术问题。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种易于表达的融合蛋白序列及其表达方法。
本发明所采取的技术方案是:
一种融合蛋白,其包括蓝细菌光敏色素蛋白all3691的第2个GAF结构域和链霉亲和素。
作为上述融合蛋白的进一步改进,融合蛋白中还添加有亲和标记。
作为上述融合蛋白的进一步改进,融合蛋白的序列为:MGSSHHHHHHSQDPEAGITGTWYNQLGSTFIVTAGADGALTGTYESAVGNAESRYVLTGR YDSAPATDGSGTALGWTVAWKNNYRNAHSATTWSGQYVGGAEARINTQWLLTSGTTEANAWKSTLVGHDTFTKVKPSAASGSGTDDDDKAMADGILFNVVNQMRQSLDLNAIFCVVTQNIRRILDVDRVGIYQFHLDVNYEYGEFVAEDVSPAFPSALAVKVQDHCFGENYANLYKQGRICAITDVQSSEILDCHRQILAQFHVRASLVVPIMQEEELWGLLCIHQCDRPRQWEPLEMQFAQQVGAQMGIALKQTDLLIQTQK。
表达上述融合蛋白的核苷酸序列。进一步的,核苷酸序列根据宿主菌进行密码子优化。
插入有上述核苷酸序列的质粒。
作为上述质粒的进一步改进,质粒为pET Duet载体质粒,核苷酸序列通过酶切位点BamHⅠ、EcoRⅠ插入pET Duet载体质粒的多克隆位点1。
一种融合蛋白的制备方法,包括如下步骤:
1)根据上述融合蛋白的序列,设计得到融合蛋白基因序列;
2)将融合蛋白基因序列插入到质粒中,得到融合蛋白质粒;
3)将融合蛋白质粒和表达藻红胆素合成的相关基因:血红素氧化酶基因ho1,胆绿素还原酶基因pebS的质粒共转入大肠杆菌,得到基因工程菌;
4)使用三级接种方法在培养基中接种基因工程菌,37℃发酵培养至生长前期;
5)降温至20℃,培养0.8~1.2h;
6)升温至25℃,加入终质量浓度为1.3~1.6%的乳糖诱导培养14~16h;
7)收集菌体提取、纯化得到融合蛋白。
作为上述制备方法的进一步改进,发酵培养基的质量组成为:蛋白胨1%,酵母粉0.5%,氯化钠1%,甘油0.4%,0.004%~0.04%猪血球蛋白粉或血红素,余量为水,pH值调至7.2。
作为上述制备方法的进一步改进,加入终质量浓度为1.5%的乳糖诱导培养。
本发明的有益效果是:
本发明的融合蛋白序列,易于在微生物中稳定表达,规避了高纯度天然藻胆蛋白和蓝细菌光敏色素的获取困难,制备成本较高;化学修饰剂的使用;天然藻胆蛋白聚合形态不稳定等缺点。
本发明的表达方法,无需藻胆蛋白裂合酶参与,减少转化的基因数量,提高菌种稳定性和筛选效率。同时通过优化发酵培养基和发酵条件,大大提高了融合蛋白的产量。
附图说明
图1是光敏色素荧光标记物的光谱特征图;
图2是光敏色素荧光标记物(对照)的光谱特征图;
图3是不同发酵培养基的发酵效果对比。
具体实施方式
下面结合实施例,进一步说明本发明的技术方案。
实施例1
蓝细菌光敏色素GAF结构域序列的选取
蓝细菌光敏色素基因序列all3691(藻种PCC7120),存在有2个同源性较高的GAF结构域,本方案选取的GAF结构域基因序列为第二个结构域基因序列,以下称为gaf基因序列。其表达后的蛋白质氨基酸序列如下:
ILFNVVNQMRQSLDLNAIFCVVTQNIRRILDVDRVGIYQFHLDVNYEYGEFVAEDVSPAFPSALAVKVQDHCFGENYANLYKQGRICAITDVQSSEILDCHRQILAQFHVRASLVVPIMQEEELWGLLCIHQCDRPRQWEPLEMQFAQQVGAQMGIALKQTDLLIQTQK(SEQ ID NO:1)。
转基因质粒组合的选择
本方案采用Duet系列双质粒组合,sa::gaf融合基因接入pET Duet的多克隆位点1;藻红胆素合成酶质粒采用pACYC Duet-ho1-pebS。
链霉亲和素sa序列与gaf序列,6his-taq亲和标记序列进行融合设计,并针对大肠杆菌表达系统进行基因序列优化。最终sa::gaf基因序列所表达的融合蛋白质氨基酸序列如下:
MGSSHHHHHHSQDPEAGITGTWYNQLGSTFIVTAGADGALTGTYESAVGNAESRYVLTGRYDSAPATDGSGTALGWTVAWKNNYRNAHSATTWSGQYVGGAEARINTQWLLTSGTTEANAWKSTLVGHDTFTKVKPSAASGSGTDDDDKAMADGILFNVVNQMRQSLDLNAIFCVVTQNIRRILDVDRVGIYQFHLDVNYEYGEFVAEDVSPAFPSALAVKVQDHCFGENYANLYKQGRICAITDVQSSEILDCHRQILAQFHVRASLVVPIMQEEELWGLLCIHQCDRPRQWEPLEMQFAQQVGAQMGIALKQTDLLIQTQK(SEQ ID NO:2)。
融合后的基因序列通过酶切位点BamHⅠ(GGATCC),EcoRⅠ(GAATTC)接入pET Duet载体质粒的多克隆位点1(MCS1),得到质粒pET Duet-sa::gaf。
菌种制备筛选
1)从新鲜涂布的平板上挑取大肠杆菌菌株BL21(DE3)单菌落,接种于5mL LB培养基,37℃振荡培养过夜;
2)取100μL饱和培养物,无菌转接至5mL LB培养基,37℃振荡培养至OD600=0.3~0.4时,将菌液转移至5mL无菌离心管中,冰上放置10min;离心1min(10000g,4℃)弃去上清,收集沉淀菌体;
3)用1mL预冷的0.1mol/LCaCl2无菌溶液重悬菌体,离心30s(10000g,4℃)去上清,菌体沉淀用100μL预冷的0.1mol/L CaCl2重悬,放置于冰上,加入一定量的构建好的质粒,混匀后冰浴放置30min,42℃热休克90s,冰浴5min后加入300μL LB培养基,37℃低速振荡培养45min,无菌涂布在含有相应抗生素的LB培养基平板上,倒置于37℃培养箱至形成可见的单克隆菌斑。
经实验证明,本方案培养的菌落数大概在1~102,而同条件下藻胆蛋白荧光探针的三质粒组合转化方案培养的菌落数大概在1~10。本方案的基因工程菌筛选效率更高。
小量表达
将挑取出来的单克隆菌种,通过无菌操作接种于4个摇瓶中,每个摇瓶300mL LB培养基,37℃振荡培养至OD600为0.3至0.4;然后摇瓶用冰水浴降温0.5h;加入异丙基硫代-β-D-半乳糖苷(isoprophylthio-β-D-galactoside,简称IPTG)至终浓度为1mmol/L,20℃振荡表达约12小时;8000g离心收集菌体细胞。
发酵
1)制备一级种液:取合格的单克隆菌种种液20μL,接入25mL LB培养基中,37℃低速振荡过夜培养至饱和浓度;
2)制备二级种液:将5mL一级种液转接入1.5L LB培养基中,37℃中速振荡培养3~4h,OD600控制在0.5以下;
3)接种:将1.5L二级种液转接至200L发酵罐中,培养基150L,发酵培养基配方:蛋白胨1%,酵母粉0.5%,氯化钠1%,甘油0.4%,0.04%猪血球蛋白粉,pH值用NaOH溶液调至7.2;
4)培养:37℃,300rpm中速培养至生长前期,时长约1h;
5)降温:罐温设置降至20℃,转速降至150rpm,低速培养时长约1h;
6)诱导:加入乳糖终浓度约1.5%,25℃,150rpm低速培养,诱导表达时长约16h;
7)下罐:离心收取湿菌体。
发酵效果评价:取1g重量的湿菌体,用5mL磷酸盐缓冲液(20mM KPP,0.5M NaCl,pH7.2)重悬后,取样进行荧光发射光谱检测。根据单位质量湿菌体的荧光量评估发酵效果。
提取
1)湿菌体按照20%比例,用pH7.2的磷酸盐缓冲液(20mM KPP,0.5M NaCl)重悬;
2)超声破碎提取,功率250W,时间1s,间隔3s,总时长5min;(或者冻融法提取,反复冻融3次,每次冷冻至少2h);
3)10000g,10min,重复离心两次,取上清;
4)0.45μm孔径水系滤膜过滤,取上清。
纯化
镍离子鏊合凝胶亲和层析。上样后,50mM咪唑溶液洗脱杂质,分部收集样品。pH7.2的磷酸盐缓冲液(20mM KPP,0.5M NaCl)透析除去咪唑。
纯化后的样品,进行荧光发射光谱检测和吸收光谱扫描,扫描范围300nm~800nm,检测数据可用于评估产品的荧光性能。其特征吸收与荧光光谱如图1所示。图中,实线为荧光发射光谱,激发波长460nm,扫描范围300nm~700nm;虚线为可见吸收光谱,扫描范围300nm~700nm。该标记物选择的GAF结构域荧光性能极佳,适合用于免疫标记。
对比例1:
同实施例1,不同之处在于GAF结构域表达后的蛋白质氨基酸序列如下:
QQYQHTLLLKQITEEIRQSLQWEKILKTTVTEVQRILQVDRALIFQINSDGSGKVVQEAVMPGWSVTLDQDIYDPCLKDGYLNMYRDGRITAIADVYQGGLKPCYVEFLQQFQVKANLVVPIRVRRNLWGLLIVHQCDRPRQWTELELDLLKHLADQMGIALTQSQLLAQETRQA(SEQ ID NO:3),最终基因序列所表达的融合蛋白质氨基酸序列如下:
MGSSHHHHHHSQDPEAGITGTWYNQLGSTFIVTAGADGALTGTYESAVGNAESRYVLTGRYDSAPATDGSGTALGWTVAWKNNYRNAHSATTWSGQYVGGAEARINTQWLLTSGTTEANAWKSTLVGHDTFTKVKPSAASGSGTDDDDKAMADGQQYQHTLLLKQITEEIRQSLQWEKILKTTVTEVQRILQVDRALIFQINSDGSGKVVQEAVMPGWSVTLDQDIYDPCLKDGYLNMYRDGRITAIADVYQGGLKPCYVEFLQQFQVKANLVVPIRVRRNLWGLLIVHQCDRPRQWTELELDLLKHLADQMGIALTQSQLLAQETRQA(SEQ ID NO:4)
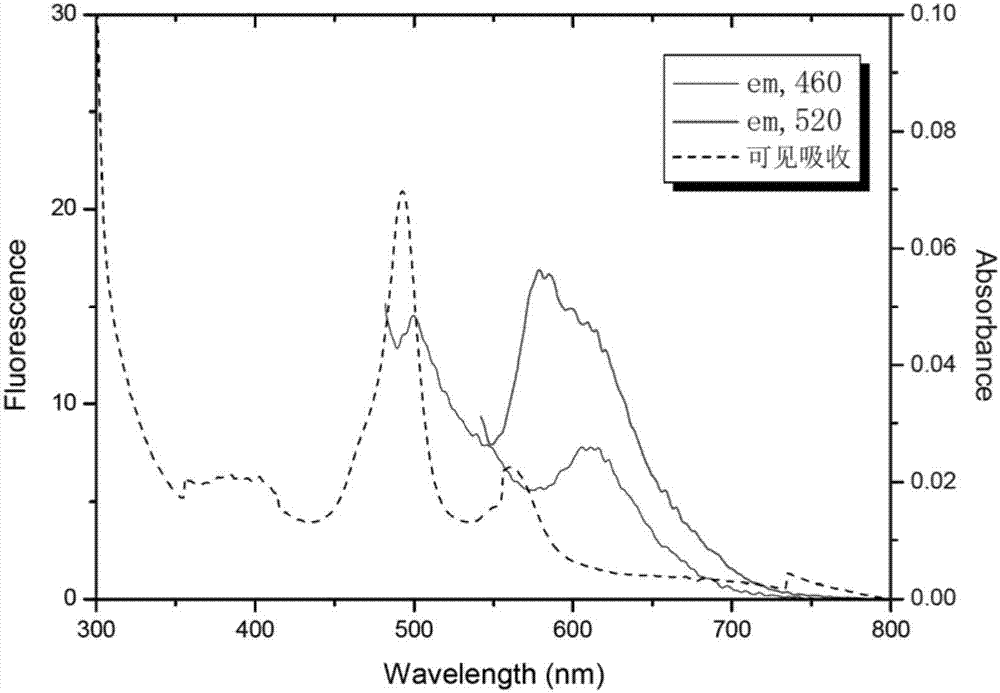
其纯化得到的融合蛋白特征吸收与荧光光谱如图2所示。图2中,实线为荧光发射光谱,激发波长分别为460nm和520nm,扫描范围300nm~800nm;虚线为可见吸收光谱,扫描范围300nm~800nm。
通过对比图1和图2可知,对比例的GAF结构域荧光性能较差,与图1的产品性能相差10倍以上,不能用于免疫检测。
不同发酵培养基对发酵效果的影响
实施例2:
取实施例1的发酵使用的单克隆菌种,按如下方法进行发酵。
1)制备一级种液:取合格的单克隆菌种种液20μL,接入25mL LB培养基中,37℃低速振荡过夜培养至饱和浓度;
2)制备二级种液:将5mL一级种液转接入1.5L LB培养基中,37℃中速振荡培养3~4h,OD600控制在0.5以下;
3)接种:将1.5L二级种液转接至200L发酵罐中,培养基150L,发酵培养基配方:蛋白胨1%,酵母粉0.5%,氯化钠1%,甘油0.4%,0.004%血红素,pH值用NaOH溶液调至7.2;
4)培养:37℃,300rpm中速培养至生长前期,时长约1h;
5)降温:罐温设置降至20℃,转速降至150rpm,低速培养时长约1h;
6)诱导:加入乳糖终浓度约1.5%,25℃,150rpm低速培养,诱导表达时长约16h;
7)下罐:离心收取湿菌体。
实施例3:
取实施例1的发酵使用的单克隆菌种,按如下方法进行发酵。
1)制备一级种液:取合格的单克隆菌种种液20μL,接入25mL LB培养基中,37℃低速振荡过夜培养至饱和浓度;
2)制备二级种液:将5mL一级种液转接入1.5L LB培养基中,37℃中速振荡培养3~4h,OD600控制在0.5以下;
3)接种:将1.5L二级种液转接至200L发酵罐中,培养基150L,发酵培养基配方:蛋白胨1%,酵母粉0.5%,氯化钠1%,甘油0.4%,pH值用NaOH溶液调至7.2;
4)培养:37℃,300rpm中速培养至生长前期,时长约1h;
5)降温:罐温设置降至20℃,转速降至150rpm,低速培养时长约1h;
6)诱导:加入乳糖终浓度约1.5%,25℃,150rpm低速培养,诱导表达时长约16h;
7)下罐:离心收取湿菌体。
实施例1、实施例2和实施例3分别采用了不同的发酵培养基配方,配方成分一致的部分,都采用了同一批次原料。其发酵效果对比如图3所示,实施例1和实施例2为优化后的培养基,实施例3为传统的培养基。实施例1和2发酵产物的荧光性能较实施例3提升了至少50%,符合纯度质量要求,说明其培养基组成更有利于融合蛋白的表达。
表达稳定性:
分别按实施例1的发酵工艺和实施例2的发酵工艺发酵生产融合蛋白3批,发现融合蛋白的表达量非常稳定,平均表达量的偏差在5%以内。
SEQUENCE LISTING
<110> 广州天宝颂原生物科技开发有限公司
<120> 一种绿色荧光的蓝细菌光敏色素荧光标记物的制备方法
<130> 2
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 169
<212> PRT
<213> 藻种PCC7120
<400> 1
Ile Leu Phe Asn Val Val Asn Gln Met Arg Gln Ser Leu Asp Leu Asn
1 5 10 15
Ala Ile Phe Cys Val Val Thr Gln Asn Ile Arg Arg Ile Leu Asp Val
20 25 30
Asp Arg Val Gly Ile Tyr Gln Phe His Leu Asp Val Asn Tyr Glu Tyr
35 40 45
Gly Glu Phe Val Ala Glu Asp Val Ser Pro Ala Phe Pro Ser Ala Leu
50 55 60
Ala Val Lys Val Gln Asp His Cys Phe Gly Glu Asn Tyr Ala Asn Leu
65 70 75 80
Tyr Lys Gln Gly Arg Ile Cys Ala Ile Thr Asp Val Gln Ser Ser Glu
85 90 95
Ile Leu Asp Cys His Arg Gln Ile Leu Ala Gln Phe His Val Arg Ala
100 105 110
Ser Leu Val Val Pro Ile Met Gln Glu Glu Glu Leu Trp Gly Leu Leu
115 120 125
Cys Ile His Gln Cys Asp Arg Pro Arg Gln Trp Glu Pro Leu Glu Met
130 135 140
Gln Phe Ala Gln Gln Val Gly Ala Gln Met Gly Ile Ala Leu Lys Gln
145 150 155 160
Thr Asp Leu Leu Ile Gln Thr Gln Lys
165
<210> 2
<211> 323
<212> PRT
<213> 融合蛋白
<400> 2
Met Gly Ser Ser His His His His His His Ser Gln Asp Pro Glu Ala
1 5 10 15
Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val
20 25 30
Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser Ala Val
35 40 45
Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala
50 55 60
Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp
65 70 75 80
Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln
85 90 95
Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr
100 105 110
Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His
115 120 125
Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Gly Ser Gly Thr
130 135 140
Asp Asp Asp Asp Lys Ala Met Ala Asp Gly Ile Leu Phe Asn Val Val
145 150 155 160
Asn Gln Met Arg Gln Ser Leu Asp Leu Asn Ala Ile Phe Cys Val Val
165 170 175
Thr Gln Asn Ile Arg Arg Ile Leu Asp Val Asp Arg Val Gly Ile Tyr
180 185 190
Gln Phe His Leu Asp Val Asn Tyr Glu Tyr Gly Glu Phe Val Ala Glu
195 200 205
Asp Val Ser Pro Ala Phe Pro Ser Ala Leu Ala Val Lys Val Gln Asp
210 215 220
His Cys Phe Gly Glu Asn Tyr Ala Asn Leu Tyr Lys Gln Gly Arg Ile
225 230 235 240
Cys Ala Ile Thr Asp Val Gln Ser Ser Glu Ile Leu Asp Cys His Arg
245 250 255
Gln Ile Leu Ala Gln Phe His Val Arg Ala Ser Leu Val Val Pro Ile
260 265 270
Met Gln Glu Glu Glu Leu Trp Gly Leu Leu Cys Ile His Gln Cys Asp
275 280 285
Arg Pro Arg Gln Trp Glu Pro Leu Glu Met Gln Phe Ala Gln Gln Val
290 295 300
Gly Ala Gln Met Gly Ile Ala Leu Lys Gln Thr Asp Leu Leu Ile Gln
305 310 315 320
Thr Gln Lys
<210> 3
<211> 175
<212> PRT
<213> 藻种PCC7120
<400> 3
Gln Gln Tyr Gln His Thr Leu Leu Leu Lys Gln Ile Thr Glu Glu Ile
1 5 10 15
Arg Gln Ser Leu Gln Trp Glu Lys Ile Leu Lys Thr Thr Val Thr Glu
20 25 30
Val Gln Arg Ile Leu Gln Val Asp Arg Ala Leu Ile Phe Gln Ile Asn
35 40 45
Ser Asp Gly Ser Gly Lys Val Val Gln Glu Ala Val Met Pro Gly Trp
50 55 60
Ser Val Thr Leu Asp Gln Asp Ile Tyr Asp Pro Cys Leu Lys Asp Gly
65 70 75 80
Tyr Leu Asn Met Tyr Arg Asp Gly Arg Ile Thr Ala Ile Ala Asp Val
85 90 95
Tyr Gln Gly Gly Leu Lys Pro Cys Tyr Val Glu Phe Leu Gln Gln Phe
100 105 110
Gln Val Lys Ala Asn Leu Val Val Pro Ile Arg Val Arg Arg Asn Leu
115 120 125
Trp Gly Leu Leu Ile Val His Gln Cys Asp Arg Pro Arg Gln Trp Thr
130 135 140
Glu Leu Glu Leu Asp Leu Leu Lys His Leu Ala Asp Gln Met Gly Ile
145 150 155 160
Ala Leu Thr Gln Ser Gln Leu Leu Ala Gln Glu Thr Arg Gln Ala
165 170 175
<210> 4
<211> 329
<212> PRT
<213> 融合蛋白
<400> 4
Met Gly Ser Ser His His His His His His Ser Gln Asp Pro Glu Ala
1 5 10 15
Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val
20 25 30
Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser Ala Val
35 40 45
Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala
50 55 60
Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp
65 70 75 80
Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln
85 90 95
Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr
100 105 110
Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His
115 120 125
Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Gly Ser Gly Thr
130 135 140
Asp Asp Asp Asp Lys Ala Met Ala Asp Gly Gln Gln Tyr Gln His Thr
145 150 155 160
Leu Leu Leu Lys Gln Ile Thr Glu Glu Ile Arg Gln Ser Leu Gln Trp
165 170 175
Glu Lys Ile Leu Lys Thr Thr Val Thr Glu Val Gln Arg Ile Leu Gln
180 185 190
Val Asp Arg Ala Leu Ile Phe Gln Ile Asn Ser Asp Gly Ser Gly Lys
195 200 205
Val Val Gln Glu Ala Val Met Pro Gly Trp Ser Val Thr Leu Asp Gln
210 215 220
Asp Ile Tyr Asp Pro Cys Leu Lys Asp Gly Tyr Leu Asn Met Tyr Arg
225 230 235 240
Asp Gly Arg Ile Thr Ala Ile Ala Asp Val Tyr Gln Gly Gly Leu Lys
245 250 255
Pro Cys Tyr Val Glu Phe Leu Gln Gln Phe Gln Val Lys Ala Asn Leu
260 265 270
Val Val Pro Ile Arg Val Arg Arg Asn Leu Trp Gly Leu Leu Ile Val
275 280 285
His Gln Cys Asp Arg Pro Arg Gln Trp Thr Glu Leu Glu Leu Asp Leu
290 295 300
Leu Lys His Leu Ala Asp Gln Met Gly Ile Ala Leu Thr Gln Ser Gln
305 310 315 320
Leu Leu Ala Gln Glu Thr Arg Gln Ala
325
- 还没有人留言评论。精彩留言会获得点赞!