L-氨基酸的制造方法与流程
本发明涉及一种使用了微生物的L-氨基酸的发酵生产方法,具体而言涉及L-赖氨酸或L-精氨酸等碱性氨基酸的发酵生产法。L-氨基酸作为动物饲料用添加物、调味料或饮食品的成分、或氨基酸输液等在工业上是有用的。
背景技术:
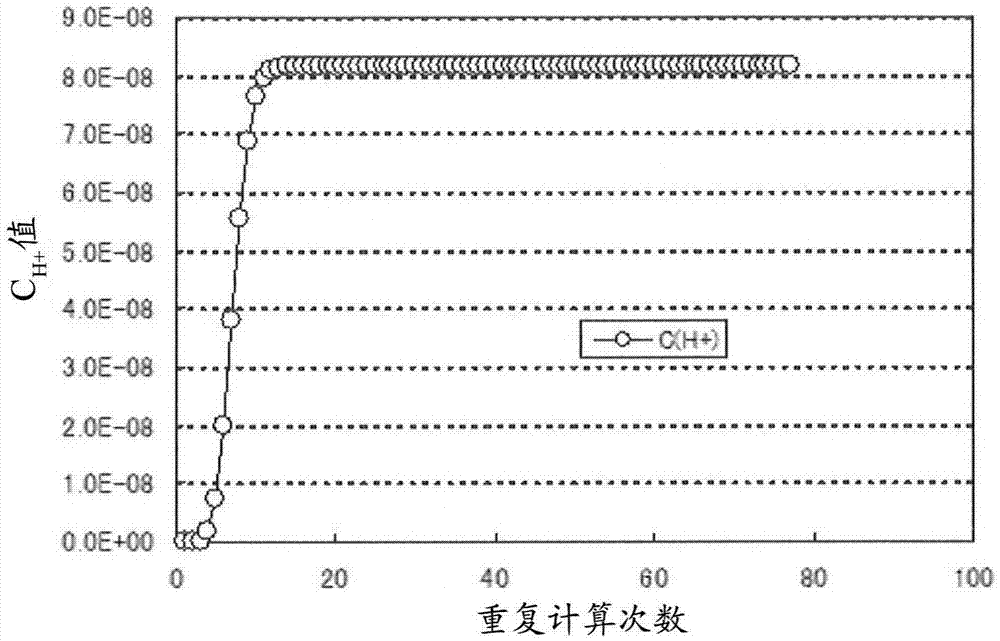
:碱性氨基酸等L-氨基酸通过例如使用具有L-氨基酸生产能力的微生物的发酵法而进行工业生产。在利用发酵法的碱性氨基酸的制造方法中,将具有碱性氨基酸生产能力的微生物进行培养,在发酵液中生成碱性氨基酸并蓄积,从发酵液中采取碱性氨基酸。此时,以分批方式、流加方式、或连续方式进行培养。目前,在碱性氨基酸的发酵生产中,为了将培养基的pH保持在中性,作为碱性氨基酸的反阴离子利用硫酸根离子或氯化物离子(专利文献1、2)。但是,利用硫酸根离子或氯化物离子的方法在纯化成本或发酵槽的腐蚀等方面存在改善的余地。从发酵液中采集碱性氨基酸的过程中,在需要纯化的情况下,大多通过离子交换而进行。例如,在L-赖氨酸的情况下,将发酵液调整为酸性,使L-赖氨酸吸附于离子交换树脂之后,用铵离子使之从树脂中脱离,制成赖氨酸碱直接使用,或者使用盐酸制成L-赖氨酸盐酸盐进行结晶化。另一方面,不纯化的情况下,也通常进行将发酵液直接浓缩,或者将发酵液用盐酸或硫酸调整为酸性后,进行喷雾造粒。该情况下,由于培养基中所含的残留成分,得到的发酵生产物中碱性氨基酸的含有率被限制,因此,添加于培养基中的反阴离子不能忽视。因此,不仅从制造经费方面,而且也从产品的品质方面考虑,降低反阴离子的使用量具有重要的意义。作为降低反阴离子的使用量的方法,也已知有将碳酸氢根离子和/或碳酸根离子作为碱性氨基酸的反离子来使用进行发酵生产碱性氨基酸的方法(也称为碳酸盐发酵;专利文献3、4)。如果利用碳酸盐发酵,则可以减少硫酸根离子和/或氯化物离子的使用量,同时发酵生产碱性氨基酸。另外,在需要纯化的情况下,通过提高温度或使pH为酸性,可以通过进行脱羧而简单地得到赖氨酸碱溶液。现有技术文献专利文献专利文献1:日本特开平5-30985号公报专利文献2:日本特开平5-24969号公报专利文献3:US2002-025564A专利文献4:WO2006/038695技术实现要素:发明所要解决的技术问题氨基酸的发酵液大多进行加热处理。例如除了以杀菌或浓缩等目的实施加热处理之外,从提高生产率的观点出发,也大多在高温下实施除菌或离子交换树脂处理等处理。这里,本发明人发现:在加热赖氨酸的碳酸盐发酵液的情况下,赖氨酸含量减少(表1及表2)。本发明人还发现:在加热赖氨酸的碳酸盐发酵液的情况下,通过作为反离子使用的碳酸氢根离子和/或碳酸根离子以二氧化碳气体形式飞散并脱离而pH上升,但pH越高,赖氨酸含量减少的比例越高(表3)。通过用盐酸或硫酸使发酵液的pH降低,可以防止这样的碱性氨基酸含量的减少,但该情况下,在纯化阶段,可以减少硫酸根离子和/或氯化物离子的使用量的碳酸盐发酵的优点被抵消。因此,本发明的技术问题在于,开发防止通过碳酸盐发酵而得到的发酵液中的碱性氨基酸含量的减少的新方法,提供有效的碱性氨基酸或含有其的发酵生产物的制造方法。用于解决问题的技术方案本发明人为了解决上述课题进行了深入研究,结果发现,在将通过碳酸盐发酵而得到的发酵液进行加热处理时,通过在可以防止从由发酵液产生二氧化碳气体的压力下实施该加热处理,可以防止发酵液中的碱性氨基酸含量的减少,完成了本发明。即,本发明可以例示如下。[1]一种碱性氨基酸或含有其的发酵生产物的制造方法,其包含以下工序:(A)在培养基中培养具有碱性氨基酸生产能力的微生物,并使得碳酸氢根离子和/或碳酸根离子成为碱性氨基酸的反离子,得到含有碱性氨基酸的发酵液;以及(B)在能够防止由该发酵液产生二氧化碳气体的压力下对所述发酵液进行加热处理。[2]如上述方法,其中,所述压力以表压计为所述加热处理温度下所述发酵液的碳酸分压和水蒸气分压的合计值以上的压力,所述碳酸分压为将所述发酵液中的碱性氨基酸、CO2、NH3、K、Mg、Cl、SO4、醋酸及琥珀酸的浓度、以及所述加热处理温度作为变量而确定的值。[3]如上述方法,其中,所述压力以表压计为下述式所示的压力以上的压力:压力(kPa)=1.99×10-3×温度2.54(式中,“温度”表示所述加热处理的温度(℃))。[4]如上述方法,其中,所述压力以表压计为将所述发酵液放入密闭容器并使得装置空隙率为6%v/v、并且调整为所述加热处理温度时的密闭容器内的气相的压力以上的压力。[5]如上述方法,其中,所述压力以表压计为400kPa以上。[6]如上述方法,其中,所述压力以表压计为1000kPa以上。[7]如上述方法,其中,所述加热处理的温度为80℃~130℃。[8]如上述方法,其中,所述加热处理的温度为100℃~130℃。[9]如上述方法,其中,在压力容器内实质上不存在气相的条件下在压力容器内实施所述工序B。[10]如上述方法,其还包含对进行了所述加热处理的发酵液进行脱羧处理的工序。[11]如上述方法,其中,在培养的至少一部分期间将培养基的pH控制在7.2~9.0来实施所述工序A。[12]如上述方法,其中,实施所述工序A并使得培养结束时的培养基的pH为7.2以上。[13]如上述方法,其中,实施所述工序A,并且在培养的至少一部分期间将发酵槽内压力控制为正;和/或实施所述工序A,并且通过向培养基供给二氧化碳气体,使碳酸氢根离子和/或碳酸根离子在培养基中存在20mM以上。[14]如上述方法,其中,实施所述工序A,使得培养基中的碳酸氢根离子和/或碳酸根离子以外的阴离子的浓度成为900mM以下。[15]如上述方法,其中,所述发酵槽内压力以表压计为0.03~0.2MPa。[16]如上述方法,其中,在培养的至少一部分期间将培养基中的总氨浓度控制在300mM以下来实施所述工序A。[17]如上述方法,其中,所述碱性氨基酸为L-赖氨酸。[18]如上述方法,其中,所述微生物为棒杆细菌(coryne)或大肠杆菌。[19]如上述方法,其中,所述发酵生产物选自发酵液、发酵液的上清液、它们的脱羧物、它们的浓缩物、它们的干燥物、它们的加工品。附图说明图1是表示实施利用Newton法进行的重复计算时的CH+的变化的图。图2是表示pH的实测值和模拟值的图。图3是表示38℃及120℃下的Lys解离曲线的图。图4是表示38℃及120℃下的离子平衡的图像的图。图5是表示120℃下的Lys解离状态的图。图6是表示防止由发酵液产生二氧化碳气体所必需的压力的计算值和实验值的图。图7是表示针对模型赖氨酸发酵液(赖氨酸浓度11g/dl,pH9.0)所得到的、防止由发酵液产生二氧化碳气体所必须的压力的近似式的图。具体实施方式下面,详细地说明本发明。本发明的方法为碱性氨基酸或含有其的发酵生产物的制造方法,其包含以下工序:(A)在培养基中培养具有碱性氨基酸生产能力的微生物,并使得碳酸氢根离子和/或碳酸根离子成为碱性氨基酸的反离子,得到含有碱性氨基酸的发酵液;以及(B)在能够防止由该发酵液产生二氧化碳气体的压力下对所述发酵液进行加热处理。工序A也称为“发酵工序”,工序B也称为“加压加热处理工序”。含有工序A中得到的碱性氨基酸的发酵液也简称为“发酵液”。具有碱性氨基酸生产能力的微生物也称为“碱性氨基酸生产菌”。作为碱性氨基酸,可举出L-赖氨酸、L-精氨酸及L-组氨酸。其中,优选L-赖氨酸。在本发明中,可以制造1种碱性氨基酸,也可以制造2种或其以上的碱性氨基酸。另外,发酵生产物可以含有1种碱性氨基酸,也可以含有2种或其以上的碱性氨基酸。在本发明中,只要没有特殊说明,碱性氨基酸均为L-氨基酸。<1>具有碱性氨基酸生产能力的微生物<1-1>具有碱性氨基酸生产能力的微生物“具有碱性氨基酸生产能力的微生物(碱性氨基酸生产菌)”是指具有以下能力的微生物:在培养基中进行培养时,生成目标碱性氨基酸,并在培养基中蓄积到能够回收的程度。具有碱性氨基酸生产能力的微生物可以是能够在培养基中蓄积优选0.5g/L以上、更优选1.0g/L以上的量的目标碱性氨基酸的微生物。具有碱性氨基酸生产能力的微生物可以仅具有1种碱性氨基酸的生产能力,也可以具有2种或其以上的碱性氨基酸的生产能力。具有碱性氨基酸生产能力的微生物只要可以通过碳酸盐发酵来生产碱性物质,就没有特别限制。作为微生物,可举出细菌或酵母。其中,优选细菌。作为细菌,可举出棒杆细菌、埃希氏菌属细菌、沙雷氏菌属细菌、杆菌属细菌。作为棒杆细菌,可举出属于棒状杆菌(Corynebacterium)属、短杆菌(Brevibacterium)属、及细杆菌(Microbacterium)属等属的细菌。作为棒杆细菌,具体而言,可举出如下所述的种。嗜乙酰乙酸棒杆菌(Corynebacteriumacetoacidophilum)乙酰谷氨酸棒杆菌(Corynebacteriumacetoglutamicum)解烷棒杆菌(Corynebacteriumalkanolyticum)帚石南棒状杆菌(Corynebacteriumcallunae)钝齿棒状杆菌(Corynebacteriumcrenatum)谷氨酸棒杆菌(Corynebacteriumglutamicum)百合棒状杆菌(Corynebacteriumlilium)栖糖蜜棒杆菌(Corynebacteriummelassecola)嗜热产氨棒杆菌(有效棒状杆菌)(Corynebacteriumthermoaminogenes(Corynebacteriumefficiens))力士棒杆菌(Corynebacteriumherculis)散枝短杆菌(谷氨酸棒状杆菌)(Brevibacteriumdivaricatum(Corynebacteriumglutamicum))黄色短杆菌(谷氨酸棒状杆菌)(Brevibacteriumflavum(Corynebacteriumglutamicum))未成熟短杆菌(Brevibacteriumimmariophilum)乳酸发酵短杆菌(谷氨酸棒状杆菌)(Brevibacteriumlactofermentum(Corynebacteriumglutamicum))玫瑰色短杆菌(Brevibacteriumroseum)解糖短杆菌(Brevibacteriumsaccharolyticum)硫殖短杆菌(Brevibacteriumthiogenitalis)产氨短杆菌(停滞棒杆菌)(Corynebacteriumammoniagenes(Corynebacteriumstationis))白色短杆菌(Brevibacteriumalbum)蜡状短杆菌(Brevibacteriumcerinum)小杆菌属嗜氨小杆菌(Microbacteriumammoniaphilum)作为棒杆细菌,具体而言,可举出如下所述的菌株。CorynebacteriumacetoacidophilumATCC13870CorynebacteriumacetoglutamicumATCC15806CorynebacteriumalkanolyticumATCC21511CorynebacteriumcallunaeATCC15991CorynebacteriumcrenatumAS1.542CorynebacteriumglutamicumATCC13020,ATCC13032,ATCC13060,ATCC13869,FERMBP-734CorynebacteriumliliumATCC15990CorynebacteriummelassecolaATCC17965Corynebacteriumefficiens(Corynebacteriumthermoaminogenes)AJ12340(FERMBP-1539)CorynebacteriumherculisATCC13868Brevibacteriumdivaricatum(Corynebacteriumglutamicum)ATCC14020Brevibacteriumflavum(Corynebacteriumglutamicum)ATCC13826,ATCC14067,AJ12418(FERMBP-2205)BrevibacteriumimmariophilumATCC14068Brevibacteriumlactofermentum(Corynebacteriumglutamicum)ATCC13869BrevibacteriumroseumATCC13825BrevibacteriumsaccharolyticumATCC14066BrevibacteriumthiogenitalisATCC19240Corynebacteriumammoniagenes(停滞棒杆菌)ATCC6871,ATCC6872BrevibacteriumalbumATCC15111BrevibacteriumcerinumATCC15112MicrobacteriumammoniaphilumATCC15354需要说明的是,棒状杆菌属细菌目前被分类为短杆菌属,但也包含目前划归为棒状杆菌属的细菌(Int.J.Syst.Bacteriol.,41,255(1991))。另外,停滞棒杆菌目前被分类为产氨短杆菌,但也包含通过16SrRNA的碱基序列分析等而被再分类为停滞棒杆菌的细菌(Int.J.Syst.Evol.Microbiol.,60,874-879(2010))。作为埃希氏菌属细菌,没有特别限制,可举出通过微生物学的专家所公知的分类被分类为埃希氏菌属的细菌。作为埃希氏菌属细菌,可举出例如Neidhardt等的著作(Backmann,B.J.1996.DerivationsandGenotypesofsomemutantderivativesofEscherichiacoliK-12,p.2460-2488.Table1.InF.D.Neidhardt(ed.),EscherichiacoliandSalmonellaCellularandMolecularBiology/SecondEdition,AmericanSocietyforMicrobiologyPress,Washington,D.C.)中所记载的细菌。作为埃希氏菌属细菌,可举出例如大肠杆菌(Escherichiacoli)。作为大肠杆菌,可举出例如:W3110株(ATCC27325)或MG1655株(ATCC47076)等大肠杆菌K-12株;大肠杆菌K5株(ATCC23506);BL21(DE3)株等大肠杆菌B株;及这些派生株。这些菌株例如可以接受由美国典型培养物保藏中心(住所12301ParklawnDrive,Rockville,Maryland20852P.O.Box1549,Manassas,VA20108,UnitedStatesofAmerica)分开出售。即赋予对应于各菌株的登录号,可以利用该登录号接受分开出售(参见http://www.atcc.org/)。对应于各菌株的登录号记载于美国典型培养物保藏中心的商品目录。另外,这些菌株例如可以从寄托各菌株的寄托机关中获得。具有碱性氨基酸生产能力的微生物可以为本来具有碱性氨基酸生产能力的微生物,也可以为对其进行修改而具有碱性氨基酸生产能力的微生物。具有碱性氨基酸生产能力的微生物例如可以通过对如上所述的微生物赋予碱性氨基酸生产能力、或通过增强如上所述的微生物的碱性氨基酸生产能力来获得。碱性氨基酸生产能力的赋予或增强,目前可以通过棒杆细菌或埃希氏菌属细菌等氨基酸生产菌的育种中所采用的方法来进行(参见氨基酸发酵、(株)学会出版中心、1986年5月30日发行第一版、第77~100页)。作为这样的方法,可举出例如:取得营养要求性变异株、取得碱性氨基酸的模拟耐性株得、取得代谢控制变异株、构建增强了碱性氨基酸的生物合成类酶的活性的重组株。在碱性氨基酸生产菌的育种中,所赋予的营养要求性、模拟耐性、代谢控制变异等性质可以为单独一种,也可以为2种或3种以上。另外,在碱性氨基酸生产菌的育种中,活性被增强的碱性氨基酸生物合成类酶也可以为单独一种,也可以为2种或3种以上。另外,也可以组合营养要求性、模拟耐性、代谢控制变异等性质的赋予和生物合成系酶的活性增强。具有碱性氨基酸生产能力的营养要求性变异株、模拟耐性株、或代谢控制变异株可以通过对亲株或野生株进行通常的变异处理,从得到的变异株中选择显示营养要求性、模拟耐性或代谢控制变异、且具有碱性氨基酸生产能力的变异株来取得。作为通常的变异处理,可举出照射X射线或紫外线、利用N-甲基-N’-硝基-N-亚硝基胍(MNNG)、乙基甲烷磺酸酯(EMS)、甲基甲烷磺酸酯(MMS)等变异剂进行处理。碱性氨基酸生产能力的赋予或增强可以通过增强目标碱性氨基酸的生物合成类酶的活性来实现。酶活性的增强例如可以通过增强编码上述酶的基因的表达而实现。增强基因表达的方法记载于WO00/18935号小册子、欧洲专利申请公开1010755号说明书等。关于增强酶活性的详细的方法,后文阐述。另外,碱性氨基酸生产能力的赋予或增强也可以通过使下述酶的活性降低来实现,所述酶是催化从目标碱性氨基酸的生合成经路分支出来而生成目标碱性氨基酸以外的化合物的反应的酶。需要说明的是,在这里所说的“催化从目标碱性氨基酸的生合成经路分支出来而生成目标碱性氨基酸以外的化合物的反应的酶”中也包含参与目标氨基酸分解的酶。酶活性的降低例如可以通过破坏编码上述酶的基因来实现。关于使酶活性降低的详细的方法,后文阐述。下面,对赋予或增强碱性氨基酸生产菌、及碱性氨基酸生产能力的方法具体地进行例示。需要说明的是,用于赋予或增强以下所例示的碱性氨基酸生产菌具有的性质及碱性氨基酸生产能力的修饰均可以单独使用,也可以适当组合使用。<L-赖氨酸生产菌>作为用于赋予或增强L-赖氨酸生产能力的方法,可举出例如修饰细菌使得选自L-赖氨酸生物合成类酶中的1种或1种以上的酶的活性增大的方法。作为这样的酶,没有特别限制,可举出:二氢吡啶二羧酸合酶(dihydrodipicolinatesynthase)(dapA)、天门冬氨酸激酶III(aspartokinaseIII)(lysC)、二氢吡啶二羧酸还原酶(dihydrodipicolinatereductase)(dapB)、二氨基庚二酸脱羧酶(diaminopimelatedecarboxylase)(lysA)、二氨基庚二酸脱氢酶(diaminopimelatedehydrogenase)(ddh)(美国专利第6,040,160号)、磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvatecarboxylase)(ppc)、天冬氨酸半醛脱氢酶(aspartatesemialdehydedehydrogenase)(asd)、天冬氨酸转氨酶(aspartateaminotransferase)(天门冬氨酸氨基转移酶(aspartatetransaminase))(aspC)、二氨基庚二酸差向异构酶(diaminopimelateepimerase)(dapF)、四氢吡啶二羧酸琥珀酰酶(tetrahydrodipicolinatesuccinylase)(dapD)、琥珀酰二氨基庚二酸脱酰酶(succinyl-diaminopimelatedeacylase)(dapE)、及天冬氨酸酶(aspartase)(aspA)(EP1253195A)。需要说明的是,括号内为编码该酶的基因的一例(在以下的记载中也同样)。在这些酶中,例如优选增强选自二氢吡啶二羧酸还原酶、二氨基庚二酸脱羧酶、二氨基庚二酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、天冬氨酸转氨酶、二氨基庚二酸差向异构酶、天冬氨酸半醛脱氢酶、四氢吡啶二羧酸琥珀酰酶、及琥珀酰二氨基庚二酸脱酰酶中的1种或其以上的酶的活性。另外,在L-赖氨酸生产菌或用于诱导其的亲株中,与能量效率有关的基因(cyo)(EP1170376A)、编码烟酰胺核苷酸转氢酶(nicotinamidenucleotidetranshydrogenase)的基因(pntAB)(美国专利第5,830,716号)、ybjE基因(WO2005/073390)、或它们的组合的表达水平可以增大。由于天门冬氨酸激酶III(lysC)受到L-赖氨酸导致的反馈抑制,因此,为了增强该酶的活性,可以利用编码解除了L-赖氨酸导致的反馈抑制的天门冬氨酸激酶III的变异型lysC基因。作为解除了L-赖氨酸导致的反馈抑制的天门冬氨酸激酶III,可举出具有318位的蛋氨酸残基被异亮氨酸残基置换的变异、323位的甘氨酸残基被天门冬氨酸残基置换的变异、352位的苏氨酸残基被异亮氨酸残基置换的变异中的1种或其以上的变异的来自大肠杆菌的天门冬氨酸激酶III(美国专利第5,661,012号、美国专利第6,040,160号)。另外,由于二氢二甲基吡啶酸合成酶(dapA)受到L-赖氨酸导致的反馈抑制,因此,为了增强该酶的活性,可以利用编码解除了L-赖氨酸导致的反馈抑制的二氢二甲基吡啶酸合成酶的变异型dapA基因。作为解除了L-赖氨酸导致的反馈抑制的二氢二甲基吡啶酸合成酶,可举出具有118位的组氨酸残基被酪氨酸残基置换的变异的来自大肠杆菌的二氢二甲基吡啶酸合成酶(美国专利第6,040,160号)。另外,作为用于赋予或增强L-赖氨酸生产能力的方法,也可举出例如修饰细菌并使得选自催化从L-赖氨酸的生物合成经路分支出来而生成L-赖氨酸以外的化合物的反应的酶中的1种或其以上的酶的活性降低的方法。作为这样的酶,没有特别限制,可举出:高丝氨酸脱氢酶(homoserinedehydrogenase)、赖氨酸脱羧酶(lysinedecarboxylase)(美国专利第5,827,698号)、及苹果酸酶(malicenzyme)(WO2005/010175)。另外,作为用于对棒杆细菌赋予或增强L-赖氨酸生产能力的方法,可举出例如修饰细菌使得赖氨酸排出系(lysE)的活性增大的方法(WO97/23597)。谷氨酸棒杆菌(CorynebacteriumglutamicumATCC13032)的lysE基因在NCBI数据库中以GenBankaccessionNC_006958(VERSIONNC_006958.1GI:62388892)被登录的基因组序列中,相当于1329712~1330413位的序列的互补序列。谷氨酸棒杆菌(CorynebacteriumglutamicumATCC13032)的LysE蛋白质作为GenBankaccessionYP_225551(YP_225551.1GI:62390149)被登录。另外,作为L-赖氨酸生产菌或用于诱导其的亲株,可举出对L-赖氨酸模拟具有耐性的变异株。L-赖氨酸模拟会抑制肠杆菌科的细菌或棒杆细菌等细菌的生长,但该抑制在L-赖氨酸共存于培养基时完全或部分地被解除。作为L-赖氨酸模拟,没有特别限制,可举出:氧代赖氨酸、赖氨酸氧肟酸盐、S-(2-氨基乙基)-L-半胱氨酸(AEC)、γ-甲基赖氨酸、α-氯己内酰胺。对这些赖氨酸模拟具有耐性的变异株可以通过对细菌实施通常的人工变异处理来得到。作为L-赖氨酸生产菌或用于诱导其的亲株,具体而言,可举出例如E.coliAJ11442(FERMBP-1543,NRRLB-12185;参见美国专利第4,346,170号)及E.coliVL611。在这些株中,天门冬氨酸激酶的L-赖氨酸导致的反馈抑制被解除。作为L-赖氨酸生产菌或用于诱导其的亲株,具体而言,也可举出E.coliWC196株。WC196株通过对来自E.coliK-12的W3110株赋予AEC耐性而进行育种(美国专利第5,827,698号)。WC196株被命名为E.coliAJ13069,在1994年12月6日,在工业技术院生命工程工业技术研究所(目前,独立行政法人制品评价技术基础机构专利生物保藏中心、邮政编码:292-0818、地址:日本国千叶县木更津市上总镰足2-5-8120号室)以保藏号FERMP-14690被保藏,在1995年9月29日被转移至基于布达佩斯条约的国际保藏,赋予保藏号FERMBP-5252(美国专利第5,827,698号)。作为优选的L-赖氨酸生产菌,可举出E.coliWC196ΔcadAΔldc或E.coliWC196ΔcadAΔldc/pCABD2(WO2010/061890)。WC196ΔcadAΔldc是由WC196株通过破坏编码赖氨酸脱羧酶的cadA及ldcC基因而构建的株。WC196ΔcadAΔldc/pCABD2为通过在WC196ΔcadAΔldc中导入含有赖氨酸生物合成系基因的质粒pCABD2(美国专利第6,040,160号)而构建的株。WC196ΔcadAΔldc被命名为AJ110692,在2008年10月7日,在独立行政法人产业技术总合研究所专利生物保藏中心(现在的独立行政法人制品评价技术基础机构专利生物保藏中心、邮政编码:292-0818、地址:日本国千叶县木更津市上总镰足2-5-8120号室)以保藏号FERMBP-11027进行国际保藏。pCABD2包含:具有L-赖氨酸导致的反馈抑制被解除的变异(H118Y)的编码来自大肠杆菌的二氢二甲基吡啶酸合成酶(DDPS)的变异型dapA基因、具有L-赖氨酸导致的反馈抑制被解除的变异(T352I)的编码来自大肠杆菌的天门冬氨酸激酶III的变异型lysC基因、编码来自大肠杆菌的二氢吡啶二羧酸还原酶的dapB基因、和编码来自乳糖发酵短杆菌的二氨基庚二酸脱氢酶的ddh基因。作为优选的L-赖氨酸生产菌,也可举出E.coliAJIK01株(NITEBP-01520)。AJIK01株被命名为E.coliAJ111046,在2013年1月29日,在独立行政法人制品评价技术基础机构专利微生物保藏中心(邮政编码:292-0818、地址:日本国千叶县木更津市上总镰足2-5-8122号室)被保藏,在2014年5月15日被转移至基于布达佩斯条约的国际保藏,赋予保藏号NITEBP-01520。另外,作为具有L-赖氨酸生产能力的棒杆细菌,可举出例如:AEC耐性变异株(Corynebacteriumglutamicum(Brevibacteriumlactofermentum)AJ11082(NRRLB-11470)株等;参见日本特公昭56-1914号公报、日本特公昭56-1915号公报、日本特公昭57-14157号公报、日本特公昭57-14158号公报、日本特公昭57-30474号公报、日本特公昭58-10075号公报、日本特公昭59-4993号公报、日本特公昭61-35840号公报、日本特公昭62-24074号公报、日本特公昭62-36673号公报、日本特公平5-11958号公报、日本特公平7-112437号公报、日本特公平7-112438号公报);在其生长中需要L-高丝氨酸等氨基酸的变异株(参见日本特公昭48-28078号公报、日本特公昭56-6499号公报);对AEC显示耐性、并要求L-亮氨酸、L-高丝氨酸、L-脯氨酸、L-丝氨酸、L-精氨酸、L-丙氨酸、L-缬氨酸等氨基酸的变异株(参见美国专利第3708395号及第3825472号说明书);对DL-α-氨基-ε-己内酰胺、α-氨基-月桂基内酰胺、天门冬氨酸模拟、磺胺剂、醌化物、N-月桂酰亮氨酸显示耐性的变异株;对草酰乙酸脱羧酶抑制剂或呼吸系酶抑制剂显示耐性的变异株(日本特开昭50-53588号公报、日本特开昭50-31093号公报、日本特开昭52-102498号公报、日本特开昭53-9394号公报、日本特开昭53-86089号公报、日本特开昭55-9783号公报、日本特开昭55-9759号公报、日本特开昭56-32995号公报、日本特开昭56-39778号公报、日本特公昭53-43591号公报、日本特公昭53-1833号公报);要求肌醇或醋酸的变异株(日本特开昭55-9784号公报、日本特开昭56-8692号公报);对氟丙酮酸或34℃以上的温度显示感受性的变异株(日本特开昭55-9783号公报、日本特开昭53-86090号公报);对乙二醇显示耐性的变异株(美国专利第4411997号说明书)。<L-精氨酸生产菌>作为用于赋予或增强L-精氨酸生产能力的方法,可举出例如修饰细菌从而使得选自L-精氨酸生物合成系酶中的1种或其以上的酶的活性增大的方法。作为这样的酶,没有特别限制,可举出:N-乙酰谷氨酸合成酶(argA)、N-乙酰谷氨酰磷酸还原酶(argC)、鸟氨酸乙酰转移酶(argJ)、N-乙酰谷氨酸激酶(argB)、乙酰鸟氨酸转氨酶(argD)、乙酰鸟氨酸脱酰基酶(argE)、鸟氨酸氨基甲酰转移酶(argF)、精氨琥珀酸合成酶(argG)、精氨琥珀酸裂解酶(argH)、氨基甲酰磷酸合成酶(carAB)。作为N-乙酰谷氨酸合成酶(argA)基因,例如优选使用相当于野生型的15位~19位的氨基酸残基被置换、并编码解除了L-精氨酸导致的反馈抑制的变异型N-乙酰谷氨酸合成酶的基因(欧洲申请公开1170361号说明书)。作为L-精氨酸生产菌或用于诱导其的亲株,具体而言,可举出例如:E.coli237株(VKPMB-7925)(美国专利申请公开2002/058315A1)、导入有编码变异型N-乙酰谷氨酸合成酶的argA基因的其诱导株(俄罗斯专利申请第2001112869号,EP1170361A1)、来自237株的醋酸同化能力得以提高的株即E.coli382株(VKPMB-7926)(EP1170358A1)、及在382株中导入了来自E.coliK-12株的野生型ilvA基因的株即E.coli382ilvA+株。E.coli237株在2000年4月10日在俄罗斯国家工业微生物保藏中心(VKPM)(FGUPGosNIIGenetika,1Dorozhnyproezd.,1Moscow117545,Russia)以VKPMB-7925的保藏号被保藏,在2001年5月18日被转移至基于布达佩斯条约的国际保藏。E.coli382株在2000年4月10日在俄罗斯国家工业微生物保藏中心(VKPM)(FGUPGosNIIGenetika,1Dorozhnyproezd.,1Moscow117545,Russia)以VKPMB-7926的保藏号被保藏。另外,作为L-精氨酸生产菌或用于诱导其的亲株,还可举出对氨基酸模拟等具有耐性的株。作为这样的株,可举出例如对α-甲基蛋氨酸、对氟苯基丙氨酸、D-精氨酸、精氨酸异羟肟酸、S-(2-氨基乙基)-半胱氨酸、α-甲基丝氨酸、β-2-噻嗯基丙氨酸、或磺胺胍具有耐性的大肠杆菌变异株(参见日本特开昭56-106598号公报)。另外,作为L-精氨酸生产菌或用于诱导其的亲株,还可举出缺失精氨酸抑制因子即ArgR而得到的株(美国专利申请公开2002-0045223号)或使细胞内的谷氨酰胺合成酶活性上升而得到的株(美国专利申请公开2005-0014236号公报)等棒杆细菌。另外,作为L-精氨酸生产菌或用于诱导其的亲株,还可举出对氨基酸模拟等具有耐性的棒杆细菌的变异株。作为这样的株,例如除2-噻唑丙氨酸耐性之外,可举出具有L-组氨酸、L-脯氨酸、L-苏氨酸、L-异亮氨酸、L-蛋氨酸或L-色氨酸要求性的株(日本特开昭54-44096号公报);对酮丙二酸、氟丙二酸、或单氟醋酸具有耐性的株(日本特开昭57-18989号公报);对精氨酸醇具有耐性的株(日本特公昭62-24075号公报);对X-胍(X为脂肪链或其衍生物)具有耐性的株(日本特开平2-186995号公报);对精氨酸氧肟酸盐及6-氮尿嘧啶具有耐性的株(日本特开昭57-150381号公报)。作为具有L-精氨酸生产能力的棒杆细菌的具体例,可举出如下所述的菌株。Corynebacteriumglutamicum(Brevibacteriumflavum)AJ11169(FERMBP-6892)Corynebacteriumglutamicum(Brevibacteriumlactofermentum)AJ12092(FERMBP-6906)Corynebacteriumglutamicum(Brevibacteriumflavum)AJ11336(FERMBP-6893)Corynebacteriumglutamicum(Brevibacteriumflavum)AJ11345(FERMBP-6894)Corynebacteriumglutamicum(Brevibacteriumlactofermentum)AJ12430(FERMBP-2228)<L-组氨酸生产菌>作为用于赋予或增强L-组氨酸生产能力的方法,可举出例如:修饰细菌从而使得选自L-组氨酸生物合成系酶中的1种或其以上的酶的活性增大的方法。作为这样的酶,没有特别限制,可举出:ATP磷酸核糖转移酶(hisG)、磷酸核糖-AMP环化水解酶(hisI)、磷酸核糖-ATP焦磷酸水解酶(hisI)、磷酸核糖亚氨甲基-5-氨基咪唑甲酰胺核糖核苷酸异构酶(hisA)、酰胺转移酶(hisH)、磷酸组胺醇氨基转移酶(hisC)、组胺醇磷氧化酶(hisB)、组胺醇脱氢酶(hisD)。其中,已知由hisG及hisBHAFI编码的L-组氨酸生物合成系酶因L-组氨酸而被抑制。因此,L-组氨酸生产能力例如可以通过在ATP磷酸核糖转移酶基因(hisG)中导入赋予对反馈抑制的耐性的变异而被赋予或增强(俄罗斯专利第2003677号及第2119536号)。作为L-组氨酸生产菌或用于诱导其的亲株,具体而言,可举出例如:E.coli24株(VKPMB-5945,RU2003677)、E.coliNRRLB-12116~B-12121(美国专利第4,388,405号)、E.coliH-9342(FERMBP-6675)及H-9343(FERMBP-6676)(美国专利第6,344,347号)、E.coliH-9341(FERMBP-6674)(EP1085087)、E.coliAI80/pFM201(美国专利第6,258,554号)、导入保持编码L-组氨酸生物合成系酶的DNA的载体而得到的E.coliFERMP-5038及5048(日本特开昭56-005099号)、导入了氨基酸输送的基因的E.coli株(EP1016710A)、磺胺胍、DL-1,2,4-三唑-3-丙氨酸、及赋予了对链霉素的耐性的E.coli80株(VKPMB-7270,俄罗斯专利第2119536号)等属于埃希氏菌属的株。另外,作为赋予或增强碱性氨基酸生产能力的方法,可举出例如修饰细菌从而使得参与糖代谢的蛋白质或参与能量代谢的蛋白质的活性增大的方法。作为参与糖代谢的蛋白质,参可举出与糖摄入有关的蛋白质或糖酵解酶。作为编码参与糖代谢的蛋白质的基因,可举出:葡萄糖6-磷酸异构酶基因(pgi;国际公开第01/02542号小册子)、丙酮酸羧化酶基因(pyc;国际公开99/18228号小册子、欧洲申请公开1092776号说明书)、磷酸葡糖苷酶基因(pgm;国际公开03/04598号小册子)、果糖二磷酸醛缩酶基因(pfkB,fbp;国际公开03/04664号小册子)、转醛缩酶基因(talB;国际公开03/008611号小册子)、延胡索酸酶基因(fum;国际公开01/02545号小册子)、non-PTS蔗糖摄入基因(csc;欧洲申请公开1149911号小册子)、蔗糖同化性基因(scrAB操纵子;美国专利7,179,623号说明书)。作为编码参与能量代谢的蛋白质的基因,可举出:转氢酶基因(pntAB;美国专利5,830,716号说明书)、细胞色素bo型氧化酶(细胞色素bo型氧化酶(cytochromoebotypeoxidase))基因(cyoB;欧洲专利申请公开1070376号说明书)。碱性氨基酸生产菌的育种中所使用的基因及蛋白质分别可以具有例如上述例示的基因及蛋白质的公知的碱基序列及氨基酸序列(以下,也简称为“公知的碱基序列及氨基酸序列”)。需要说明的是,“具有(氨基酸或碱基)序列”这一表述包括该“含有(氨基酸或碱基)序列”的情况及该“由(氨基酸或碱基)序列构成”的情况。另外,碱性氨基酸生产菌的育种中所使用的基因及蛋白质分别可以为具有公知的碱基序列及氨基酸序列的基因及蛋白质的保守变种。“保守变种”是指维持了原来的功能的变种。作为保守变种,可举出例如具有公知的碱基序列及氨基酸序列的基因及蛋白质的同源染色体或人为变异体。“维持原来的功能”是指:基因或蛋白质的变种具有对应于原来的基因或蛋白质的功能(活性或性质)的功能(活性或性质)。基因“维持原来的功能”是指:基因的变种编码维持了原来的功能的蛋白质。例如,二氢吡啶二羧酸还原酶基因“维持原来的功能”是指:基因的变种编码具有二氢吡啶二羧酸还原酶活性的蛋白质。另外,二氢吡啶二羧酸还原酶“维持原来的功能”是指:蛋白质的变种具有二氢吡啶二羧酸还原酶活性。下面,对保守变种进行例示。碱性氨基酸生产菌的育种中所使用的基因或蛋白质的同源染色体例如可以利用将公知的碱基序列或氨基酸序列用作查询序列的BLAST检索或FASTA检索从公开数据库中容易地取得。另外,碱性氨基酸生产菌的育种中所使用的基因的同源染色体例如可以通过将棒杆细菌等生物的染色体作为模板、将基于公知的碱基序列制作的寡核苷酸用作引物的PCR来取得。碱性氨基酸生产菌的育种中所使用的基因只要维持原来的功能即可,可以分别是编码如下蛋白质的基因,所述蛋白质是具有在公知的氨基酸序列中的1个或多个位置上的1个或多个氨基酸被置换、缺失、插入或附加而成的氨基酸序列的蛋白质。例如,所编码的蛋白质其N末端和/或C末端可以被延长或缩短。需要说明的是,上述“1个或多个”也因氨基酸残基的蛋白质的立体结构中的位置或种类而不同,具体而言,例如意指1~50个、1~40个、1~30个、优选1~20个、更优选1~10个、进一步优选1~5个、特别优选1~3个。上述的1个或多个氨基酸的置换、缺失、插入或附加为正常维持蛋白质功能的保守变异。保守变异的代表变异类型为保守置换。保守置换是指如下变异:在置换部位为芳香族氨基酸的情况下,是在Phe、Trp、Tyr间相互置换的变异;在置换部位为疏水性氨基酸的情况下,是在Leu、Ile、Val间相互置换的变异;在置换部位为极性氨基酸的情况下,是在Gln、Asn间相互置换的变异;在置换部位为碱性氨基酸的情况下,是在Lys、Arg、His间相互置换的变异;在置换部位为酸性氨基酸的情况下,是在Asp、Glu间相互置换的变异,在置换部位为具有羟基的氨基酸的情况下,是在Ser、Thr间相互置换的变异。作为被视为保守置换的置换,具体而言,可举出:从Ala置换为Ser或Thr、从Arg置换为Gln、His或Lys、从Asn置换为Glu、Gln、Lys、His或Asp、从Asp置换为Asn、Glu或Gln、从Cys置换为Ser或Ala、从Gln置换为Asn、Glu、Lys、His、Asp或Arg、从Glu置换为Gly、Asn、Gln、Lys或Asp、从Gly置换为Pro、从His置换为Asn、Lys、Gln、Arg或Tyr、从Ile置换为Leu、Met、Val或Phe、从Leu置换为Ile、Met、Val或Phe、从Lys置换为Asn、Glu、Gln、His或Arg、从Met置换为Ile、Leu、Val或Phe、从Phe置换为Trp、Tyr、Met、Ile或Leu、从Ser置换为Thr或Ala、从Thr置换为Ser或Ala、从Trp置换为Phe或Tyr、从Tyr置换为His、Phe或Trp、及从Val置换为Met、Ile或Leu。另外,在如上所述的氨基酸的置换、缺失、插入、附加、或逆位等中,也包括:基于基因来源的生物的个体差异、种类的不同的情况等的天然产生的变异(mutant或variant)而产生的上述变异。另外,碱性氨基酸生产菌的育种中所使用的基因只要维持原来的功能即可,分别可以为编码以下蛋白质的基因,所述蛋白质相对于公知的氨基酸序列整体具有同一性达到例如50%以上、65%以上、80%以上、优选90%以上、更优选95%以上、进一步优选97%以上、特别优选99%以上的氨基酸序列的蛋白质。另外,在本说明书中,“同一性”(homology)意指“同源性”(identity)。另外,碱性氨基酸生产菌的育种中所使用的基因只要维持原来的功能即可,分别可以为与可由公知的碱基序列制备的探针、例如公知的碱基序列的整体或一部分的互补序列在严格的条件下杂交的DNA。“严格的条件”是指:形成所谓的特异性杂交体,而不形成非特异性杂交体的条件。如果示出一例,则可举出:同一性高的DNA之间、例如具有50%以上、65%以上、80%以上、优选90%以上、更优选95%以上、进一步优选97%以上、特别优选99%以上的同一性的DNA之间杂交、而与其相比同一性低的DNA之间不杂交的条件、或者在通常的Southern杂交的洗涤的条件即相当于60℃、1×SSC、0.1%SDS、优选60℃、0.1×SSC、0.1%SDS、更优选68℃、0.1×SSC、0.1%SDS的盐浓度及温度下清洗1次、优选2~3次的条件。如上所述,用于上述杂交的探针可以为基因的互补序列的一部分。这样的探针可以通过:将基于公知碱基序列制作的寡核苷酸作为引物、以含有上述基因的DNA片段为模板的PCR来制作。例如,作为探针,可以使用300bp左右的长度的DNA片段。在使用300bp左右的长度的DNA片段作为探针的情况下,作为杂交的洗涤的条件,可举出50℃、2×SSC、0.1%SDS。另外,密码子的简并性因宿主而不同,因此,碱性氨基酸生产菌的育种中所使用的基因可以为将任意的密码子置换为与其等效的密码子而成的基因。两个序列间的序列同源性的百分比例如可以使用数学的算法来确定。作为这样的数学的算法的没有限定的实例,可举出:Myers及Miller(1988)CABIOS4:1117的算法、Smithetal(1981)Adv.Appl.Math.2:482的局部同源算法、Needleman及Wunsch(1970)J.Mol.Biol.48:443453的同源比对算法、Pearson及Lipman(1988)Proc.Natl.Acad.Sci.85:24442448的检索类似性的方法、Karlin及Altschul(1993)Proc.Natl.Acad.Sci.USA90:58735877中所记载的被改良的Karlin及Altschul(1990)Proc.Natl.Acad.Sci.USA872264的算法。可以利用基于这些数学的算法的程序,进行用于确定序列同源性的序列比较(比对)。程序可以适当利用计算机来执行。作为这样的程序,没有特别限定,可举出:PC/Gene程序的CLUSTAL(可从Intelligenetics,MountainView,Calif.中获得)、ALIGN程序(Version2.0)、以及WisconsinGeneticsSoftwarePackage,Version8(可从GeneticsComputerGroup(GCG),575ScienceDrive,Madison,Wis.,USA中获得)的GAP、BESTFIT、BLAST、FASTA、及TFASTA。使用这些程序的比对例如可以使用初期参数而进行。关于CLUSTAL程序,经常记载于HigGlnsetal.(1988)Gene73:237244(1988)、HigGlnsetal.(1989)CABIOS5:151153、Corpetetal.(1988)NucleicAcidsRes.16:1088190、Huangetal.(1992)CABIOS8:15565、及Pearsonetal.(1994)Meth.Mol.Biol.24:307331。为了得到与编码对象蛋白质的核苷酸序列具有同一性的核苷酸序列,具体而言,例如可以通过BLASTN程序、得分=100、字长=12进行BLAST核苷酸检索。为了得到与对象蛋白质具有同一性的氨基酸序列,具体而言,例如可以通过BLASTX程序、得分=50、字长=3进行BLAST蛋白质检索。关于BLAST核苷酸检索或BLAST蛋白质检索,希望参见http://www.ncbi.nlm.nih.gov。另外,为了以比较为目的得到加入间隙的比对,可以利用GappedBLAST(BLAST2.0)。另外,可以将PSI-BLAST(BLAST2.0)用于进行检测序列间的疏远的关系的重复检索。关于GappedBLAST及PSI-BLAST,希望参见Altschuletal.(1997)NucleicAcidsRes.25:3389。利用BLAST、GappedBLAST、或PSI-BLAST的情况下,例如可使用各程序(例如相对于核苷酸序列为BLASTN、相对于氨基酸序列为BLASTX)的初期参数。比对可以通过手动进行。两个序列间的序列同源性以在将两个序列整理为最大一致时在两个序列间一致的残基的比率算出。<1-2>使蛋白质的活性增大的方法下面,对使蛋白质的活性增大的方法进行说明。“蛋白质的活性增大”是指:该蛋白质在单位细胞中的活性相对于野生株或亲株等非变异株增大。这里所说的“非变异株”意指没有发生像目标蛋白质的活性增大那样的改变的对照株。作为非变异株,可举出野生株或亲株。需要说明的是,将“蛋白质的活性增大”也称为“蛋白质的活性被增强”。“蛋白质的活性增大”具体而言是指:与非变异株相比,该蛋白质在单位细胞中的分子数增加、和/或该蛋白质在单位分子中的功能增大。即,“蛋白质的活性增大”时的“活性”并不限于蛋白质的催化剂活性,也可以指编码蛋白质的基因的转录量(mRNA量)或翻译量(蛋白质的量)。另外,“蛋白质的活性增大”不仅包含在本来就具有目标蛋白质的活性的菌株中使该蛋白质的活性增大,而且还包含对本来不存在目标蛋白质的活性的菌株赋予该蛋白质的活性。另外,作为结果,只要蛋白质的活性增大即可,也可以在使宿主本来具有的目标蛋白质的活性降低或消失的基础上,赋予合适的目标蛋白质的活性。就蛋白质活性的增大程度而言,只要与非变异株相比蛋白质的活性增大,就没有特别限制。蛋白质的活性例如与非变异株相比可以上升至1.5倍以上、2倍以上、或3倍以上。另外,非变异株不具有目标蛋白质的活性的情况下,通过导入编码该蛋白质的基因而生成该蛋白质即可,例如可以以能够测定其活性的程度生产同蛋白质。蛋白质的活性增大这样的修饰例如通过提高编码该蛋白质的基因的表达来实现。“提高基因的表达”是指:与野生株或亲株等非变异株相比,基因在单位细胞中的表达量增大。“提高基因的表达”具体而言可以意指:基因的转录量(mRNA量)增大、和/或基因的翻译量(蛋白质的量)增大。需要说明的是,将“提高基因的表达”也称为“基因的表达被增强”。基因的表达例如与非变异株相比,可以上升至1.5倍以上、2倍以上、或3倍以上。另外,“提高基因的表达”不仅包括在目标基因本来就表达的菌株中使该基因的表达量上升,而且还包括在目标基因本来不表达的菌株中使该基因表达。即,“提高基因的表达”包括例如在不保持目标基因的菌株中导入该基因,并使该基因表达。提高基因的表达例如可以通过使基因的拷贝数增加来实现。基因的拷贝数的增加可以通过向宿主的染色体导入该基因来实现。向染色体导入基因例如可以利用同源重组来进行(MillerI,J.H.ExperimentsinMolecularGenetics,1972,ColdSpringHarborLaboratory)。作为利用同源重组的基因导入法,可举出例如使用Red驱动集成(Red-drivenintegration)法(Datsenko,K.A,andWanner,B.L.Proc.Natl.Acad.Sci.USA.97:6640-6645(2000))等直链状DNA的方法、使用含有温度感受性复制起点的质粒的方法、使用可接合传递的质粒的方法、使用不具有在宿主内起作用的复制起点的自杀载体的方法、使用噬菌体的转导(transduction)法。就基因而言,可以仅导入1拷贝,也可以导入2拷贝或其以上。例如,通过将在染色体上存在许多拷贝的序列作为目标进行同源重组,可以向染色体导入大量的基因拷贝。作为在染色体上存在许多拷贝的序列,可举出重复DNA序列(repetitiveDNA)、存在于转座子的两端的倒置重复。另外,也可以将目标物质的生产中不需要的基因等染色体上的适当的序列作为目标进行同源重组。另外,也可以使用转座子或Mini-Mu在染色体上随机地导入基因(日本特开平2-109985号公报、US5,882,888、EP805867B1)。在染色体上导入了目标基因的确认可以通过使用了具有与该基因的全部或一部分互补的序列的探针的Southern杂交、或使用了基于该基因的序列而制作的引物的PCR等来确认。另外,基因的拷贝数的增加也可以通过将含有该基因的载体导入于宿主来实现。例如,可以将含有目标基因的DNA片段与在宿主中起作用的载体连结而构建该基因的表达载体,通过在该表达载体中对宿主进行转化,使该基因的拷贝数增加。含有目标基因的DNA片段例如可以通过以具有目标基因的微生物的基因组DNA为模板的PCR来取得。作为载体,可以使用能够在宿主的细胞内进行自主复制的载体。载体优选为多拷贝载体。另外,为了选择转化体,载体优选具有抗生物质耐性基因等的标记。另外,载体可以具备用于表达被插入的基因的启动子或终止子。载体例如可以为来自细菌质粒的载体、来自酵母质粒的载体、来自噬菌体的载体、粘粒或噬菌粒等。作为能够在大肠杆菌等肠杆菌科的细菌中自主复制的载体,具体而言,可举出例如:pUC19、pUC18、pHSG299、pHSG399、pHSG398、pBR322、pSTV29(均可从TaKaRaBio公司获得)、pACYC184、pMW219(日本基因公司)、pTrc99A(Pharmacia公司)、pPROK系载体(Clontech公司)、pKK233-2(Clontech公司制造)、pET类载体(Novagen公司制造)、pQE系载体(QIAGEN公司制造)、pACYC系载体、广宿主域载体RSF1010。作为能够在棒杆细菌中自主复制的载体,具体而言,可举出例如:pHM1519(Agric,Biol.Chem.,48,2901-2903(1984));pAM330(Agric.Biol.Chem.,48,2901-2903(1984));具有将这些进行了改良的药剂耐性基因的质粒;日本特开平3-210184号公报中记载的质粒pCRY30;日本特开平2-72876号公报及美国专利5,185,262号说明书公报中记载的质粒pCRY21、pCRY2KE、pCRY2KX、pCRY31、pCRY3KE及pCRY3KX;日本特开平1-191686号公报中记载的质粒pCRY2及pCRY3;日本特开昭58-192900号公报中记载的pAJ655、pAJ611及pAJ1844;日本特开昭57-134500号公报中记载的pCG1;日本特开昭58-35197号公报中记载的pCG2;日本特开昭57-183799号公报中记载的pCG4及pCG11;日本特开平10-215883号公报中记载的pVK7;日本特开平9-070291号公报中记载的pVC7。导入基因的情况下,基因可表达地保持于本发明的细菌即可。具体而言,可以以收到在本发明的细菌中起作用的启动子序列引起的控制而表达的方式导入基因即可。启动子可以为来自宿主的启动子,也可以为来自不同种的启动子。启动子可以为导入的基因的固有的启动子,也可以为其它基因的启动子。作为启动子,例如可以利用如后所述的更强力的启动子。在基因的下游可以配置转录终结用终止子。终止子只要在本发明的细菌中起作用,就没有特别限制。终止子可以为来自宿主的终止子,也可以为来自不同种的终止子。终止子可以为导入的基因的固有的终止子,也可以为其它基因的终止子。作为终止子,具体而言,可举出例如:T7终止子、T4终止子、fd噬菌体终止子、tet终止子、及trpA终止子。关于可以在各种微生物中利用的载体、启动子、终止子,例如详细地记载于“微生物学基础讲座8基因工程、共立出版、1987年”,可以利用这些。另外,导入两个或其以上的基因的情况下,各基因可表达地保持在本发明的细菌中即可。例如,各基因可以全部保持在单一的表达载体上,也可以全部保持在染色体上。另外,各基因可以分别保持在多个表达载体上,也可以分别保持在单一或多个表达载体上和染色体上。另外,也可以由两种或其以上的基因构成操纵子而导入。作为“导入两种或其以上的基因的情况”,可举出例如:导入分别编码两种或其以上的酶的基因的情况、导入分别编码构成单一酶的两种或其以上的子单元的基因的情况、及它们的组合。所导入的基因只要编码在宿主中起作用的蛋白质即可,没有特别限制。所导入的基因可以为来自宿主的基因,也可以为来自不同种基因。所导入的基因例如可以使用基于该基因的碱基序列设计的引物、将搭载具有该基因的生物基因组DNA或该基因的质粒等作为模板、通过PCR来取得。另外,所导入的基因例如可以基于该基因的碱基序列进行全合成(Gene,60(1),115-127(1987))。取得的基因可以直接利用或者适当改变而利用。需要说明的是,以蛋白质由多个子单元构成的复合体的形式起作用的情况下,作为结果只要蛋白质的活性增大,则可以改变这些多个子单元的全部,也可以仅改变一部分。即,例如,通过使基因的表达上升而使蛋白质的活性增大的情况下,可以增强编码这些子单元的多个基因的全部的表达,也可以仅增强一部分表达。通常优选增强编码这些子单元的多个基因的全部的表达。另外,构成复合体的各子单元只要复合体具有目标蛋白质的功能,则可以为来自1种生物的子单元,也可以为来自2种或其以上的不同生物的子单元。即,例如可以将编码多个子单元的来自同一生物的基因导入于宿主,也可以分别将来自不同的生物的基因导入于宿主。另外,提高基因的表达可以通过使基因的转录效率提高来实现。另外,提高基因的表达可以通过使基因的翻译效率提高来实现。基因的转录效率或翻译效率的提高例如可以通过表达调节序列的改变来实现。“表达调节序列”为影响到基因的表达的部位的总称。作为表达调节序列,可举出例如:启动子、Shine-Dalgarno(SD)序列(也称为核糖体结合部位(RBS))、及RBS和起始密码子之间的间隔区。表达调节序列可以使用启动子检索载体或GENETYX等基因分析软件而确定。这些表达调节序列的改变例如可以通过使用有温度感受性载体的方法、或Red驱动积分法(WO2005/010175)来进行。基因的转录效率的提高例如可以通过将染色体上的基因的启动子置换为更强力的启动子来实现。“更强力的启动子”意指基因的转录与本来存在的野生型的启动子相比提高的启动子。作为更强力的启动子,可举出例如:作为公知的高表达启动子的T7启动子、trp启动子、lac启动子、thr启动子、tac启动子、trc启动子、tet启动子、araBAD启动子、rpoH启动子、msrA启动子、来自Bifidobacterium的Pm1启动子、PR启动子、及PL启动子。另外,作为可以在棒杆细菌中利用的更强力的启动子,可举出人为地进行了设计变更的P54-6启动子(Appl.Microbiol.Biotechnolo.,53,674-679(2000))、在棒杆细菌内用醋酸、乙醇、丙酮酸等可以诱导的pta、aceA、aceB、adh、amyE启动子、在棒杆细菌内表达量多的强力的启动子即cspB、SOD、tuf(EF-Tu)启动子(JournalofBiotechnology104(2003)311-323,ApplEnvironMicrobiol.2005Dec;71(12):8587-96.)、lac启动子、tac启动子、trc启动子。另外,作为更强力的启动子,通过使用各种报告基因,可以取得原有的启动子的高活性型的物质。例如,通过使启动子区域内的-35、-10区域接近于共有序列,可以提高启动子的活性(国际公开第00/18935号)。作为高活性型启动子,可举出各种tac样启动子(KatashkinaJIetal.RussianFederationPatentapplication2006134574)或pnlp8启动子(WO2010/027045)。启动子的强度的评价法及强力的启动子的实例记载于Goldstein等的论文(Prokaryoticpromotersinbiotechnology.Biotechnol.Annu.Rev.,1,105-128(1995))等。基因的翻译效率的提高例如可以通过将染色体上的基因的Shine-Dalgarno(SD)序列(也称为核糖体结合部位(RBS))置换为更强力的SD序列来实现。“更强力的SD序列”意指mRNA的翻译与本来存在的野生型的SD序列相比提高的SD序列。作为更强力的SD序列,可举出例如来自噬菌体T7的基因10的RBS(OlinsP.O.etal,Gene,1988,73,227-235)。另外,已知RBS和起始密码子之间的间隔区、特别是紧邻起始密码子的上游的序列(5’-UTR)中的多个核苷酸的置换、或插入、或缺失会对mRNA的稳定性及翻译效率产生非常显著的影响,通过改变这些,也可以使基因的翻译效率提高。基因的翻译效率的提高例如也可以通过密码子的改变来实现。据说在大肠杆菌等中,在mRNA分子的集团内所发现的61种氨基酸密码子间存在明显的密码子的偏离,某种tRNA的存在量与对应的密码子的使用频率直接成正比(Kane,J.F.,Curr.Opin.Biotechnol.,6(5),494-500(1995))。即,含有过量的稀有密码子的mRNA大量地存在时,可产生翻译的问题。根据近年来的研究,特别是暗示AGG/AGA、CUA、AUA、CGA、或CCC密码子的簇可使所合成的蛋白质的量及质的两者降低。这样的问题特别是会发生在不同种基因的表达之时。因此,在进行基因的不同种表达的情况等下,通过将存在于基因中的稀有密码子置换为以更高频率被利用的同义密码子,可以使基因的翻译效率提高。即,所导入的基因例如可以以根据使用的宿主的密码子使用频率而具有最适的密码子的方式进行改变。密码子的置换例如可以通过在DNA的目标部位上导入目标变异的部位特异的变异法来进行。作为部位特异的变异法,可举出使用PCR的方法(Higuchi,R.,61,inPCRtechnology,Erlich,H.A.Eds.,Stocktonpress(1989);Carter,P.,Meth.inEnzymol.,154,382(1987))、或使用噬菌体的方法(Kramer,W.andFrits,H.J.,Meth.inEnzymol.,154,350(1987);Kunkel,T.A.etal.,Meth.inEnzymol.,154,367(1987))。另外,可以将置换了密码子的基因片段进行全合成。各种生物中的密码子的使用频率被公开于“密码子使用数据库”(http://www.kazusa.or.jp/codon;Nakamura,Y.etal,Nucl.AcidsRes.,28,292(2000))。另外,提高基因的表达也可以通过对使基因表达上升的调节子进行扩增、或使降低基因表达的调节子缺失或弱化来实现。使如上所述的基因的表达上升的方法可以单独使用,也可以以任意的组合使用。另外,蛋白质的活性增大这样改变例如也可以通过增强蛋白质的比活性来实现。在比活性的增强中也包含反馈抑制的降低及解除。增强了比活性的蛋白质例如可以探索各种生物并取得。另外,也可以通过在原有的蛋白质中导入变异而取得高活性型的物质。所导入的变异例如可以为蛋白质的1个或多个位置上的1个或多个氨基酸被置换、缺失、插入、或附加的变异。变异的导入例如可以通过如上所述的部位特异的变异法来进行。另外,变异的导入例如可以通过突变处理来进行。作为突变处理,可举出X射线的照射、紫外线的照射、以及N-甲基-N'-硝基-N-亚硝基胍(MNNG)、乙基甲烷磺酸酯(EMS)、及甲基甲烷磺酸酯(MMS)等利用变异剂的处理。另外,也可以在活体内将DNA直接用羟基胺进行处理,诱发随机变异。比活性的增强可以单独使用,也可以与如上所述的增强基因表达的方法任意地组合而使用。转化的方法没有特别限定,可以使用目前已知的方法。例如可以使用关于大肠杆菌K-12所报道的、将受容菌细胞用氯化钙进行处理而增加DNA的透过性的方法(Mandel,M.andHiga,A.,J.Mol.Biol.1970,53,159-162)、或关于枯草芽胞杆菌所报道的、从增殖阶段的细胞制备感受态细胞而导入DNA的方法(Duncan,C.H.,Wilson,G.A.andYoung,F.E..,1997.Gene1:153-167)。或者,也可以应用关于枯草芽胞杆菌、放线菌类、及酵母所公知的、将DNA受容菌的细胞设为容易地摄入重组DNA的原生质体或原生质球状体的状态而将重组DNA导入于DNA受容菌的方法(Chang,S.andChoen,S.N.,1979.Mol.Gen.Genet.168:111-115;Bibb,M.J.,Ward,J.M.andHopwood,O.A.1978.Nature274:398-400;Hinnen,A.,Hicks,J.B.andFink,G.R.1978.Proc.Natl.Acad.Sci.USA75:1929-1933)。或者,也可以利用关于棒杆细菌所报道的、电脉冲法(日本特开平2-207791)。蛋白质的活性增大可以通过测定该蛋白质的活性来确认。蛋白质的活性增大也可以通过确认编码该蛋白质的基因的表达上升来确认。基因的表达上升可以通过确认该基因的转录量上升、或确认由该基因表达的蛋白质的量上升来确认。基因的转录量上升的确认可以通过将由该基因转录的mRNA的量与野生株或亲株等非变异株进行比较而进行。作为评价mRNA的量的方法,可举出Northern杂交、RT-PCR等(Sambrook,J.,etal.,MolecularCloning:ALaboratoryManual/ThirdEdition,ColdSpringHarborLaboratoryPress,ColdSpringHarbor(USA),2001)。与非变异株相比,mRNA的量例如可以上升至1.5倍以上、2倍以上、或3倍以上。蛋白质的量上升的确认可以通过使用抗体利用蛋白质免疫印迹而进行(MolecularCloning(ColdSpringHarborLaboratoryPress,ColdSpringHarbor(USA),2001))。与非变异株相比,蛋白质的量例如可以上升至1.5倍以上、2倍以上、或3倍以上。使上述的蛋白质的活性增大的方法可以利用于任意的蛋白质、例如碱性氨基酸生物合成系酶或赖氨酸排出系的活性增强、或任意的基因、例如编码碱性氨基酸生物合成系酶或赖氨酸排出系的基因的表达增强。<1-3>使蛋白质的活性降低的方法下面,对使蛋白质的活性降低的方法进行说明。“蛋白质的活性降低”意指与野性株或亲株等非变异株相比该蛋白质在单位细胞中的活性减少,包含活性完全消失的情况。这里所说的“非变异株”意指没有发生目标蛋白质的活性降低这样改变的对照株。作为非变异株,可举出野生株或亲株。“蛋白质的活性降低”具体而言是指:与非变异株相比,该蛋白质在单位细胞中的分子数降低,和/或该蛋白质在单位分子中的功能降低。即,“蛋白质的活性降低”时的“活性”并不限于蛋白质的催化剂活性,可以意指编码蛋白质的基因的转录量(mRNA量)或翻译量(蛋白质的量)。需要说明的是,在“蛋白质在单位细胞中的分子数降低”中包含完全不存在该蛋白质的情况。另外,在“蛋白质在单位分子中的功能降低”中包含该蛋白质在单位分子中的功能完全消失的情况。就蛋白质的活性的降低的程度而言,只要蛋白质的活性与非变异株相比降低,就没有特别限制。蛋白质的活性例如可以降低至非变异株的50%以下、20%以下、10%以下、5%以下、或0%。蛋白质的活性降低这样的改变例如可以通过使编码该蛋白质的基因的表达降低来实现。“基因的表达降低”意指与野生株或亲株等非变异株相比该基因在单位细胞中的表达量减少。“基因的表达降低”具体而言可以意指基因的转录量(mRNA量)降低、和/或基因的翻译量(蛋白质的量)降低。在“基因的表达降低”中包含该基因没有完全表达的情况。需要说明的是,将“基因的表达降低”也称为“基因的表达被弱化”。基因的表达例如可以降低至非变异株的50%以下、20%以下、10%以下、5%以下、或0%。基因表达的降低例如可以为转录效率的降低导致的,也可以为翻译效率的降低导致的,还可以为它们的组合导致的。基因表达的降低例如可以通过改变基因的启动子、Shine-Dalgarno(SD)序列(也称为核糖体结合部位(RBS))、RBS和起始密码子之间的间隔区等表达调节序列来实现。在改变表达调节序列的情况下,表达调节序列改变优选1碱基以上、更优选2碱基以上、特别优选3碱基以上。另外,可以使表达调节序列的一部分或全部缺失。另外,基因表达的降低例如也可以通过操作与表达控制有关的因子来实现。作为与表达控制有关的因子,可举出与转录或翻译控制有关的低分子(诱导物质、抑制物质等)、蛋白质(转录因子等)、核酸(siRNA等)等。另外,基因的表达的降低例如也可以通过在基因的编码区域中导入基因的表达降低那样的变异来实现。例如,通过将基因的编码区域的密码子置换为在宿主中以更低频率利用的同义密码子,可以使基因的表达降低。另外,例如通过如后所述的基因的破坏,基因的表达自身可得以降低。另外,蛋白质的活性降低的改变例如可以通过破坏编码该蛋白质的基因来实现。“基因被破坏”是指以不产生正常起作用的蛋白质的方式改变该基因。在“不产生正常起作用的蛋白质”中包含完全无法由基因产生蛋白质的情况、或由该基因产生单位分子的功能(活性或性质)降低或消失的蛋白质的情况。基因的破坏例如可以通过使染色体上的基因的编码区域的一部分或全部缺损来实现。另外,也可以使包含染色体上的基因的前后序列在内的基因整体缺失。只要可以实现蛋白质的活性的降低,则所缺失的区域可以为N末端区域、内部区域、C末端区域等任一区域。通常所缺失的区域较长时,可以可靠地使基因失活。另外,所缺失的区域的前后的序列优选读框不一致。另外,基因的破坏例如也可以通过在染色体上的基因的编码区域中导入氨基酸置换(错义变异)、导入终止密码子(无义变异)、或者导入附加或缺失1~2碱基的移码变异等来实现(JournalofBiologicalChemistry272:8611-8617(1997),ProceedingsoftheNationalAcademyofSciences,USA955511-5515(1998),JournalofBiologicalChemistry26116,20833-20839(1991))。另外,基因的破坏例如也可以通过在染色体上的基因的编码区域中插入其它序列来实现。插入部位可以为基因的任一区域,但插入的序列较长时,可以可靠地使基因失活。另外,插入部位的前后的序列优选读框不一致。作为其它序列,只要使所编码的蛋白质的活性降低或消失,就没有特别限制,可举出例如抗生物质耐性基因等标记基因或对目的物质的生产有用的基因。如上述那样改变染色体上的基因例如可以通过制作发生了改变从而不产生正常起作用的蛋白质的缺失型基因,在含有该缺失型基因的重组DNA中将宿主转化,在缺失型基因和染色体上的野生型基因中引起同源重组、通过将染色体上的野生型基因置换为缺失型基因来实现。此时,在重组DNA中,按照宿主的营养要求性等形质,含有标记基因时,操作容易进行。作为缺失型基因,可举出:缺失了基因的全区域或者一部分区域的基因、导入有错义变异的基因、导入有无义变异的基因、导入有移码变异的基因、导入有转座子或标记基因等插入序列的基因。由缺失型基因所编码的蛋白质即使生成,也具有与野生型蛋白质不同的立体结构,功能降低或消失。这样的利用了同源重组的基因置换导致的基因破坏已经确立,包括以下方法:被称为“Red驱动积分(Red-drivenintegration)”的方法(Datsenko,K.A,andWanner,B.L.Proc.Natl.Acad.Sci.USA.97:6640-6645(2000))、组合Red驱动积分法和来自λ噬菌体的切出系统(Cho,E.H.,Gumport,R.I.,Gardner,J.F.J.Bacteriol.184:5200-5203(2002))的方法(参见WO2005/010175号)等使用直链状DNA的方法、或使用含有温度感受性复制起点的质粒的方法、使用可接合传递的质粒的方法、使用不具有在宿主内起作用的复制起点的自杀载体的方法等(美国专利第6303383号、日本特开平05-007491号)。另外,蛋白质的活性降低这样改变例如可以通过突变处理而进行。作为突变处理,可举出:X射线的照射、紫外线的照射、以及利用N-甲基-N'-硝基-N-亚硝基胍(MNNG)、乙基甲烷磺酸酯(EMS)、及甲基甲烷磺酸酯(MMS)等变异剂的处理。需要说明的是,以蛋白质由多个子单元构成的复合体的形式起作用的情况下,作为结果只要蛋白质的活性降低,则可以改变这些多个子单元的全部,也可以改变仅一部分。即,例如可以将编码这些子单元的多个基因的全部破坏等,也可以仅将一部分破坏等。另外,在蛋白质中存在多个异构酶的情况下,作为结果,只要蛋白质的活性降低,则可以使多个异构酶的全部的活性降低,也可以仅使一部分的活性降低。即,例如可以将编码这些异构酶的多个基因的全部破坏等,也可以仅将一部分破坏等。蛋白质的活性降低可以通过测定该蛋白质的活性来确认。蛋白质的活性降低也可以通过确认编码该蛋白质的基因的表达降低来确认。基因的表达降低可以通过确认该基因的转录量降低来确认、或通过确认由该基因表达的蛋白质的量降低来确认。基因的转录量降低的确认可以通过将由该基因转录的mRNA的量与非变异株进行比较来进行。作为评价mRNA的量的方法,可举出Northern杂交、RT-PCR等(MolecularCloning(ColdSpringHarborLaboratoryPress,ColdSpringHarbor(USA),2001))。与非变异株相比,mRNA的量例如可以降低至50%以下、20%以下、10%以下、5%以下、或0%。蛋白质的量降低的确认可以通过使用抗体利用蛋白质免疫印迹来进行(MolecularCloning(ColdSpringHarborLaboratoryPress,ColdSpringHarbor(USA),2001))。与非变异株相比,蛋白质的量例如可以降低至50%以下、20%以下、10%以下、5%以下、或0%。基因被破坏可以根据用于破坏的手段,根据确定该基因的一部分或全部的碱基序列、限制酶地图、或全长等来确认。上述的使蛋白质的活性降低的方法可以利用于任意的蛋白质的活性降低、例如催化从目标碱性氨基酸的生合成路径分支出来而生成目标碱性氨基酸以外的化合物的反应的酶的活性降低、或任意的基因、例如编码催化从目标碱性氨基酸的生合成路径分支出来而生成目标碱性氨基酸以外的化合物的反应的酶的基因的表达降低。<2>发酵工序发酵工序为在培养基中培养具有碱性氨基酸生产能力的微生物,得到含有碱性氨基酸的发酵液的工序。发酵工序以碳酸氢根离子和/或碳酸根离子成为碱性氨基酸的反离子的方式来实施。将这样的发酵形态称为“碳酸盐发酵”。根据碳酸盐发酵,可以减少目前作为碱性氨基酸的反离子使用的硫酸根离子和/或氯化物离子的使用量,并且发酵生产碱性氨基酸。碳酸盐发酵例如可以以记载于US2002-025564A、EP1813677A、日本特开2002-65287的方式实施。碳酸盐发酵可以如下实施,具体而言例如具有碳酸氢根离子和/或碳酸根离子在培养基中存在20mM以上、优选30mM以上、更优选40mM以上的培养期。需要说明的是,上述例示的浓度为碳酸氢根离子的浓度及碳酸根离子的浓度的合计。“具有碳酸氢根离子和/或碳酸根离子以给定的浓度存在于培养基中的培养期”是指:碳酸氢根离子和/或碳酸根离子在培养的至少一部分期间以该浓度存在于培养基中。即,碳酸氢根离子和/或碳酸根离子可以在培养的全期间以上述例示的浓度存在于培养基中,也可以在培养的一部分期间以上述例示的浓度存在于培养基中。所谓“一部分期间”,只要可得到所期望的碱性氨基酸的生产率,就没有特别限制。“一部分期间”例如可以为培养的总期间的10%以上、20%以上、30%以上、50%以上、70%以上、或90%以上的期间。需要说明的是,在培养分成种培养和本培养而进行的情况下,“培养的总期间”意指本培养的总期间。碳酸氢根离子和/或碳酸根离子优选在生产碱性氨基酸的期间以上述例示的浓度存在于培养基中。即,例如发酵工序包含使碱性氨基酸生产菌增殖的阶段(增殖期)和使碱性氨基酸产生的阶段(生产期)的情况下,碳酸氢根离子和/或碳酸根离子优选至少在物质生产期以上述例示的浓度存在于培养基中。“增殖期”是指主要在菌体生长中使用碳源的时期,具体而言,可以意指从培养开始至3小时、6小时或10小时的期间。“生产期”意指碳源主要被用于物质生产的时期,具体而言,可以意指培养开始的3小时以后、6小时以后、或10小时以后的期间。使碳酸氢根离子和/或碳酸根离子存在于培养基中这一点可以通过服下方式实现:将发酵槽内压力控制为正、向培养基供给二氧化碳气体、或它们的组合。将发酵槽内压力控制为正例如可以通过使给气压比排气压高来实现。通过将发酵槽内压力控制为正,通过发酵而生成的二氧化碳溶解于培养基而产生碳酸氢根离子和/或碳酸根离子,可以使得碳酸氢根离子和/或碳酸根离子成为碱性氨基酸的反离子。发酵槽内压力具体而言例如以表压(相对于大气压的差压)计可以为0.03~0.2MPa、优选0.05~0.15MPa、更优选0.1~0.3MPa。另外,向培养基供给二氧化碳气体例如可以通过将纯二氧化碳气体或含有二氧化碳的混合气体吹送至培养基来实现。作为含有二氧化碳的混合气体,可举出含有5%v/v以上的二氧化碳的混合气体。发酵槽内压力、二氧化碳的供给量、及被限制的给气量例如可以根据培养基的pH、培养基中的碳酸氢根离子和/或碳酸根离子浓度、及培养基中的氨浓度等各种条件而适当设定。在现有的碱性氨基酸的制造方法中,作为碱性氨基酸的反离子源的充分量的硫酸铵和/或氯化铵、以及将作为营养成分的蛋白质等的硫酸分解物和/或盐酸分解物添加于培养基。因此,在培养基中大量地存在硫酸根离子和/或氯化物离子,作为弱酸性的碳酸根离子浓度非常低,为ppm能级。另一方面,碳酸盐发酵的特征在于,减少硫酸根离子和/或氯化物离子的使用量,使在微生物发酵时放出的二氧化碳和/或从外部供给的二氧化碳溶解于培养基中,作为碱性氨基酸的反离子利用。即,在碳酸盐发酵中,目的之一是减少硫酸根离子和/或氯化物离子的使用量,因此,不需要在培养基中添加碱性氨基酸生产菌的生长所需要的量以上的硫酸根离子和/或氯化物离子。优选在培养开始时在培养基中添加生长所需要的量的硫酸铵等,而在培养中途停止添加。或者,可以一边保持培养基中的碳酸根离子和/或碳酸氢根离子的溶存量的平衡,一边添加硫酸铵等。通过减少硫酸根离子和/或氯化物离子的使用量,可以降低培养基中的硫酸根离子和/或氯化物离子浓度。通过降低硫酸根离子和/或氯化物离子浓度,可以使碳酸氢根离子和/或碳酸根离子更容易地存在于培养基中。因此,在碳酸盐发酵中,与现有法相比,可以将培养基的pH值抑制在较低水平,所述培养基的pH值是为了使作为碱性氨基酸的反离子所必须的量的碳酸氢根离子和/或碳酸根离子存在于培养基中的培养基的pH值。培养基中所含的硫酸根离子及氯化物离子的摩尔浓度的合计具体而言例如可以为900mM以下、优选700mM以下、更优选500mM以下、进一步优选300mM以下、进一步优选200mM以下、特别优选100mM以下。在碳酸盐发酵中,培养基的pH只要能使碳酸氢根离子和/或碳酸根离子以给定的浓度存在于培养基中,且可得到所期望的碱性氨基酸的生产率即可,没有特别限制。培养基的pH可以根据使用的微生物的种类、培养基中的碳酸氢根离子和/或碳酸根离子浓度、及培养基中的氨浓度等各种条件而适当设定。培养基的pH在培养中例如可以控制在6.5~9.0、优选7.2~9.0。培养基的pH可以在培养的至少一部分期间控制在上述例示的值。即,培养基的pH可以在培养的全期间控制在上述例示的值,也可以在培养的一部分期间控制在上述例示的值。控制培养基的pH的“一部分期间”,可以适用关于碳酸氢根离子和/或碳酸根离子存在于培养基中的培养期的记载。即,培养基的pH例如可以在生产碱性氨基酸期间控制在上述例示的值。另外,培养基的pH在培养结束时例如可以为7.2以上、优选7.2~9.0。即,培养基的pH可以以可得到上述例示的培养结束时的pH的值的方式进行控制。培养基的pH例如通过以pH自身为指标进行直接控制,也可以通过控制总氨浓度来间接地控制(WO2006/038695)。另外,在培养基中可含有碳酸氢根离子和/或碳酸根离子以外的阴离子(也称为其它阴离子)。就培养基中的其它阴离子的浓度而言,只要含有碱性氨基酸生产菌的生长所需要的量即可,优选较低。作为其它阴离子,可举出氯化物离子、硫酸根离子、磷酸根离子、有机酸离子、氢氧化物离子。培养基中所含的其它阴离子的摩尔浓度的合计具体而言例如可以为900mM以下、优选700mM以下、更优选500mM以下、进一步优选300mM以下、特别优选200mM以下、100mM以下、50mM以下、或20mM以下。另外,在培养基中可含有碱性氨基酸以外的阳离子(也称为其它阳离子)。作为其它阳离子,可举出来自培养基成分的K离子、Na离子、Mg离子、Ca离子。培养基中所含的其它阳离子的摩尔浓度的合计具体而言例如可以为总阳离子的摩尔浓度的50%以下、优选10%以下、更优选5%以下、特别优选2%以下。另外,在碳酸盐发酵中,优选将培养基中的总氨浓度控制在不阻碍碱性氨基酸生产的浓度(WO2006/038695、WO2015/050234)。“总氨浓度”是指未解离的氨(NH3)的浓度及铵离子(NH4+)的浓度的合计。作为“不阻碍碱性氨基酸生产”的总氨浓度,可举出例如与在最适条件下生产碱性氨基酸的情况的收率和/或生产率相比,可得到优选50%以上、更优选70%以上、特别优选90%以上的收率和/或生产率的总氨浓度。培养基中的总氨浓度具体而言例如可以为300mM以下、250mM以下、200mM以下、100mM以下、或50mM以下。pH升高时,氨的解离度降低。未解离的氨与铵离子相比对菌的毒性更强。因此,总氨浓度的上限也取决于发酵液的pH。即,发酵液的pH越高,所允许的总氨浓度越低。因此,“不阻碍碱性氨基酸的生产”的总氨浓度优选根据不同的pH而设定。但是,可以将在培养过程中的最高pH下所允许的总氨浓度范围作为贯穿培养期间的总氨浓度范围来使用。培养基中的总氨浓度可以在培养的至少一部分期间控制在上述例示的浓度。即,培养基中的总氨浓度可以在培养的全期间控制在上述例示的浓度,也可以在培养的一部分期间控制在上述例示的浓度。关于控制培养基中的总氨浓度的“一部分期间”,可以适用关于碳酸氢根离子和/或碳酸根离子存在于培养基中的培养期的记载。即,培养基中的总氨浓度例如可以在生产碱性氨基酸期间控制在上述例示的浓度。另外,作为控制培养基中的总氨浓度的“一部分期间”,具体而言,可举出:由于硫酸根离子及氯化物离子等反离子相对于碱性氨基酸的积累发生不足导致培养基的pH上升的期间。另一方面,作为碱性氨基酸生产菌的生长及碱性氨基酸的生产所需要的氮源的总氨浓度,只要在培养中不会持续出现氨枯竭的状态、且不引起氮源不足导致的碱性氨基酸生产率降低即可,没有特别限制,可以适当设定。例如可以在培养中实时地测定氨浓度,如果培养基中的氨枯竭,则将少量的氨添加于培养基。添加氨时的氨浓度具体而言例如以总氨浓度计可以为优选1mM以上、更优选10mM以上、特别优选20mM以上。培养基中的总氨浓度例如可以利用WO2015/050234中记载的氨控制装置及氨控制方法来控制。使用的培养基只要是通过碳酸盐发酵而生产碱性氨基酸的培养基即可,没有特别限制。培养基可以适当含有碳源、氮源、微量营养素等各种有机成分和无机成分。培养基成分的种类或浓度可以根据碱性氨基酸生产菌的种类或制造的碱性氨基酸的种类等各种条件而适当设定。碳源只要是能够使得碱性氨基酸生产菌进行同化并生成碱性氨基酸的碳源即可,没有特别限定。作为碳源,具体而言,可举出例如:葡萄糖、果糖、蔗糖、乳糖、半乳糖、阿拉伯糖、废糖蜜、淀粉水解物、生物质的水解物等糖类、醋酸、富马酸、柠檬酸、琥珀酸、苹果酸等有机酸类、乙醇、甘油、粗甘油等醇类、甲烷等烃类、脂肪酸类。作为碳源,可以使用1种碳源,也可以组合2种或其以上的碳源而使用。作为氮源,具体而言,可举出例如:铵盐、氨、脲等无机氮源、或胨、酵母提取物、肉提取物、大豆蛋白质分解物等有机氮源。作为氮源,可以使用1种氮源,也可以组合2种或其以上的氮源而使用。作为微量营养素,具体而言,可举出例如:氨基酸类、维生素类、微量金属元素。作为微量营养素,可以使用1种成分,也可以组合2种或其以上的成分而使用。在使用生长中需要氨基酸等的营养要求性变异株的情况下,优选补添培养基所要求的营养素。例如,L-赖氨酸生产菌中大多L-赖氨酸生合成途径被强化,而L-赖氨酸分解能力被弱化。在培养这样的L-赖氨酸生产菌的情况下,优选将例如选自L-苏氨酸、L-高丝氨酸、L-异亮氨酸、L-蛋氨酸中的1个或其以上的氨基酸补添于培养基。培养条件只要通过碳酸盐发酵而生产碱性氨基酸即可,没有特别限制。培养条件可以根据碱性氨基酸生产菌的种类等各种条件而适当设定。例如可以使用液体培养基,通过通气培养或振荡培养有氧性地进行培养。培养温度例如可以为20~45℃、优选25℃~37℃。培养期间例如可以为10小时~120小时。可以通过分批培养(batchculture)、流加培养(Fed-batchculture)、连续培养(continuousculture)、或它们的组合而实施培养。另外,也可以从发酵液中回收菌体并再利用(法国专利2669935号说明书)。培养可以分成前培养和本培养而进行。通过如上述那样培养碱性氨基酸生产菌,在培养基中蓄积碱性氨基酸,可得到含有碱性氨基酸的发酵液。发酵液还含有碳酸氢根离子和/或碳酸根离子。发酵液中所含的碳酸氢根离子和/或碳酸根离子可以作为碱性氨基酸的反离子起作用。即,“以碳酸氢根离子和/或碳酸根离子成为碱性氨基酸的反离子的方式实施发酵工序”具体而言可以意指通过发酵工序而得到含有碳酸氢根离子和/或碳酸根离子的发酵液。发酵液中所含的碳酸氢根离子和/或碳酸根离子的浓度没有特别限制。发酵液中所含的碳酸氢根离子和/或碳酸根离子的浓度例如可以为20mM以上、优选30mM以上、更优选40mM以上。需要说明的是,上述例示的浓度为碳酸氢根离子的浓度及碳酸根离子的浓度的合计。另外,发酵液中所含的碳酸氢根离子和/或碳酸根离子的浓度例如可以为下述式所示的当量浓度比率成为5以上、10以上、或20以上的浓度,也可以为成为100以下、90以下、或80以下的浓度,还可以为成为它们的组合的浓度。当量浓度比率=(碳酸氢根离子及碳酸根离子的当量浓度/总阳离子的当量浓度)×100碱性氨基酸生成可以通过用于化合物的检测或鉴定的公知方法来确认。作为这样的方法,可举出例如HPLC、LC/MS、GC/MS、NMR。这些方法可以单独使用,或者适当组合而使用。<3>加压加热处理工序加压加热处理工序是在可以防止从该发酵液中产生二氧化碳的压力下对通过发酵工序得到的发酵液进行加热处理的工序。该处理也称为“加压加热处理”。换言之,加压加热处理工序是一边对通过发酵工序得到的发酵液施加可以防止从该发酵液中产生二氧化碳的压力,一边加热该发酵液的工序。在加压加热处理工序中,可以通过加压防止加热引起的由发酵液产生二氧化碳。“由发酵液产生二氧化碳”是指溶解于发酵液中的碳酸物质发生气体化而从发酵液中脱离。“碳酸物质”为二氧化碳分子、碳酸分子、碳酸根离子及碳酸氢根离子的总称。需要说明的是,由发酵液产生二氧化碳的过程也称为“脱羧”。将防止由发酵液产生二氧化碳所需要的最低限度的压力称为“必要压力”。即,加压加热处理的压力为必要压力以上。加压加热处理的压力只要是必要压力以上,就没有特别限制。就加压加热处理的压力而言,为了充分地防止二氧化碳的产生,例如可以为必要压力的101%以上、103%以上、105%以上、110%以上、115%以上、120%以上、或130%以上的压力。在本发明中,只要没有特殊说明,“压力”表示表压(相对于大气压的差压)。必要压力可以根据发酵液组成、发酵液的pH、加压加热处理的温度等各种条件而适当确定。具体而言,必要压力例如可以将发酵液中的碱性氨基酸、CO2、NH3、K、Mg、Cl、SO4、醋酸及琥珀酸等成分的浓度、以及温度作为变量而算出(确定)。即,首先,将发酵液中的碱性氨基酸、CO2、NH3、K、Mg、Cl、SO4、醋酸及琥珀酸等成分的浓度、以及温度作为变量,可以算出给定的温度下的发酵液的pH。接着,将pH及温度作为变量,可以确定碱性氨基酸的解离状态。假定在加压加热处理的温度下不具有碱性氨基酸作为反离子的HCO3离子(因加热而失去反离子的HCO3离子)发生气化,基于碱性氨基酸的解离状态、碱性氨基酸的浓度及CO2的浓度,算出在加压加热处理的温度下不具有碱性氨基酸作为反离子的HCO3离子存在比率,可以利用Henry法则算出碳酸分压。即,碳酸分压可以将发酵液中的碱性氨基酸、CO2、NH3、K、Mg、Cl、SO4、醋酸及琥珀酸等成分的浓度以及温度作为变量算出。被用作变量的成分的种类只要可以确定必要压力,就没有特别限制。被用作变量的成分的种类可以根据发酵液组成等各种条件而适当选择。例如可以将选自碱性氨基酸、CO2、NH3、K、Mg、Cl、SO4、醋酸及琥珀酸中的一部分或全部的成分的浓度作为变量使用。作为一部分成分,具体而言,可举出例如碱性氨基酸、CO2、NH3、Cl及SO4。另外,水蒸气分压例如可以使用Wagner式算出。而且,可以将碳酸分压和水蒸气分压的合计值作为必要压力。具体而言,例如在碱性氨基酸为L-赖氨酸的情况下,必要压力可以通过实施例2中记载的步骤算出。另外,L-赖氨酸以外的碱性氨基酸的情况也可以适当改变实施例2中记载的步骤而算出必要压力。各成分的浓度例如可以通过如上所述的用于化合物的检测或鉴定的公知方法来确定。另外,特别是离子的浓度例如可以利用离子色谱法来确定。另外,可以利用上述步骤,用近似式求出特定的发酵液组成中的必要压力。具体而言,例如,后述表5所示的赖氨酸发酵液的必要压力可以用下述式表示(实施例4)。式中,“温度”表示加压加热处理的温度(℃)。必要压力(kPa)=1.99×10-3×温度2.54另外,必要压力可以进行实测。即,加压加热处理的压力例如可以是被实测的必要压力以上。具体而言,必要压力可以如下测定:将发酵液放入于密闭容器,调整(加热)至加压加热处理的温度,测定此时的密闭容器内的气相的压力作为必要压力。即,具体而言,“被实测的必要压力”可以意指将发酵液放入于密闭容器、调整(加热)至加压加热处理的温度时密闭容器内的气相的压力。作为这样的密闭容器,可举出TEM-V型反应装置(耐压硝子工业)。放入于密闭容器的发酵液的量只要可以以所期望的精度测定必要压力,就没有特别限制。发酵液例如可以以装置空隙率成为如下所述的值的方式放入于密闭容器。“装置空隙率”为密闭容器内的气相容积相对于密闭容器的内容积的比率。装置空隙率优选小,例如可以设为2%v/v~10%v/v,具体而言,可以设为6%v/v。上述实测法中的初期气相(加热前的气相)设为空气。必要压力可以每次(每实施发酵工序时)确定,也可以预先确定。预先确定必要压力的情况下,例如可以使用在同样的条件下得到的发酵液或以同样的组成制备的模型发酵液确定必要压力。本发明的方法可以包含确定必要压力的工序(也称为“压力确定工序”),也可以不包含。压力确定工序可以在工序B之前实施。需要说明的是,“加压加热处理的压力为利用某种方法所确定的必要压力以上”这一表述意指:加压加热处理的应力为假设采用该手段就应该能够得到的必要压力以上即可,不管是否实际上实施该手段。加压加热处理的压力具体而言例如可以为100kPa以上、200kPa以上、300kPa以上、400kPa以上、500kPa以上、600kPa以上、700kPa以上、800kPa以上、900kPa以上、1000kPa以上、1100kPa以上、或1200kPa以上。加压加热处理的压力的上限没有特别限制,只要设为所使用的装置能够采用的最大压力以下即可。加压加热处理的压力具体而言例如可以为3000kPa以下、2000kPa以下、或1500kPa以下。加压加热处理的压力可以为上述例示的值的组合的范围内。加压加热处理是否是在可以防止由发酵液产生二氧化碳的压力下实施的,即加压加热处理的压力是否为可以防止由发酵液产生二氧化碳压力这一点例如可以基于加压加热处理前后的发酵液的pH的变动而判断。即,由发酵液产生二氧化碳的情况下,发酵液的pH上升。因此,例如在以某种压力进行加压加热处理时的发酵液的pH的上升量为0.3以下、0.2以下、0.1以下、或0.05以下的情况下,可以认为该压力是可以防止由发酵液产生二氧化碳的压力。另外,加压加热处理是否是在可以防止由发酵液产生二氧化碳的压力实施的,即加压加热处理的压力是否为可以防止由发酵液产生二氧化碳的压力这一点例如可以通过确认加压加热处理时是否从发酵液产生了二氧化碳的发泡来确认。即,在以某种压力进行加压加热处理时无法看到发酵液产生的二氧化碳发泡的情况下,可以认为该压力是可以防止由发酵液产生二氧化碳的压力。加压加热处理的温度只要可得到防止碱性氨基酸含量的减少的效果,就没有特别限制。加压加热处理的温度是比通过发酵工序得到的发酵液的温度高的温度、即比培养温度高的温度。加压加热处理的温度例如可以是能够杀灭发酵液中的碱性氨基酸生产菌的温度。即,加压加热处理可以兼作杀菌处理。加压加热处理的温度例如可以为60℃以上、80℃以上、100℃以上、105℃以上、110℃以上、115℃以上、120℃以上、125℃以上,也可以为150℃以下、140℃以下、135℃以下、130℃以下,还可以为它们的组合。加压加热处理的温度例如可以为60℃~130℃、80℃~130℃、100℃~130℃、110℃~130℃、115℃~125℃。加压加热处理的方法没有特别限制。加压加热处理可以在能够进行加热和加压的适当的容器内实施。将这样的容器称为“压力容器”。加压加热处理在压力容器内在实质上不存在气相的条件下实施。即,换句话说,加压加热处理在压力容器内实质上被发酵液充满的条件下实施。“在压力容器内实质上不存在气相”是指:压力容器内中所含的气相的容积在加压加热处理时为压力容器的内容积的1%v/v以下、0.5%v/v以下、0.1%v/v以下、或0。加压加热处理例如可以通过将发酵液加压送液至压力容器内、或利用活塞等对充满了压力容器内的发酵液进行加压而实施。此时,将压力容器内的发酵液进行加热。例如,可以根据压力容器所具备的加热功能对发酵液进行加热,也可以利用外部加热装置从压力容器的外部连压力容器一起对发酵液进行加热。压力容器的形状或种类没有特别限制。作为压力容器,可举出滞留管或罐。即,例如以必要压力以上的送液压力将发酵液送液于滞留管等压力容器即可。向压力容器内导入发酵液及从压力容器内排除发酵液可以连续地或间歇地实施,并使之能够得到规定的滞留时间(处理时间)。即,加压加热处理例如可以以连续式实施,也可以以间歇式实施。通过以必要压力以上的压力进行加压加热处理,可以防止压力容器内产生二氧化碳。以连续式实施加压加热处理的情况下,通过防止压力容器内的二氧化碳的产生,也可得到将流速保持在一定的次要的效果。加压加热处理的时间只要可得到防止碱性氨基酸含量的减少的效果即可,没有特别限制。时间可以根据加压加热处理的温度或压力等各种条件而适当设定。加压加热处理的时间例如可以为能够杀灭发酵液中的碱性氨基酸生产菌的时间。加压加热处理的时间例如可以为30秒以上、1分钟以上、2分钟以上、3分钟以上、5分钟以上、10分钟以上,也可以为120分钟以下、90分钟以下、60分钟以下、30分钟以下、15分钟以下,还可以为它们的组合。加压加热处理的时间例如可以为30秒~60分钟、1分钟~30分钟、2分钟~15分钟。以连续式实施加压加热处理的情况下,以可得到给定的处理时间的方式设定流速即可。通过加压加热处理,可以防止碱性氨基酸含量的减少。“碱性氨基酸含量”意指发酵液中的碱性氨基酸的含量(例如浓度)。作为“防止碱性氨基酸含量的减少”,可举出防止在加压加热处理时及加压加热处理后碱性氨基酸含量的减少。作为“防止碱性氨基酸含量的减少”,具体而言,可举出防止在加压加热处理时及加压加热处理后的加热时碱性氨基酸含量的减少。作为“防止加压加热处理后碱性氨基酸含量的减少”,具体而言,可举出在实施加压加热处理后的脱羧等处理时防止碱性氨基酸含量的减少。防止加压加热处理后碱性氨基酸含量的减少也可以取决于在加压加热处理时杀灭发酵液中的碱性氨基酸生产菌。通过加压加热处理,可得到进行了加压加热处理的发酵液。<4>其它处理进行了加压加热处理的发酵液可以进一步进行其它处理。作为其它处理,可举出脱羧、除菌、纯化、浓缩、干燥。这些处理可以单独或者适当组合而实施。需要说明的是,“对进行了加压加热处理的发酵液进行其它处理”这一表述并不限于对进行了加压加热处理的发酵液本身进行其它处理的情况,也包含对加压加热处理后的发酵液的进一步处理物再进行其它处理的情况。即,例如“对加压加热处理后的发酵液进行脱羧处理”这样的表述并不限于对加压加热处理后的发酵液本身进行脱羧处理的情况,也包含对加压加热处理后的发酵液进行除菌等脱羧处理以外的处理后再进行脱羧处理的情况。在本发明中,在“发酵生产物”这样的术语中包含进行了加压加热处理的发酵液本身、及由其得到的含有碱性氨基酸的所有的产物。作为“发酵生产物”,具体而言,可举出:发酵液(这里是进行了加压加热处理的发酵液)、发酵液的上清液、它们的脱羧物、它们的浓缩物、它们的干燥物、它们的加工品。作为这样的干燥物或者加工品,具体而言,可举出含有碱性氨基酸的造粒干燥物。脱羧处理例如可以通过加热、浓缩、减压、降低pH、或它们的组合而实施。脱羧处理的方法例如可以根据制造的产物的种类等各种条件而适当选择。作为脱羧处理的方法,尤其优选加热。通过减压以外的方法进行脱羧处理的情况下,脱羧处理例如可以在大气压下(开放体系)实施。通过加热而进行脱羧处理的情况下,加热的温度没有特别限制,例如可以为40℃~100℃、优选60℃~90℃。通过减压而进行脱羧处理的情况下,减压时的气相的压力没有特别限制,例如以绝对压计可以为600kPa以下、优选40kPa~200kPa。降低pH可以通过添加盐酸等强酸而实施。通过脱羧处理,可以从发酵液中除去碳酸氢根离子及碳酸根离子等碳酸物质。即,“脱羧物”是指除去了碳酸氢根离子及碳酸根离子等碳酸物质的产物。需要说明的是,通过降低pH以外的方法进行脱羧处理的情况下,pH因脱羧而上升,但在加压加热处理后的发酵液中,期待即使pH上升,也能够充分地防止碱性氨基酸含量的减少。除菌处理例如可以通过离心分离、过滤、或它们的组合而实施。碱性氨基酸的回收(纯化)可以通过用于化合物的分离精制的公知的方法而进行。作为这样的方法,可举出例如离子交换树脂法、膜处理法、沉淀法、及晶析法。这些方法可以单独使用或者适当组合而使用。需要说明的是,在菌体内也蓄积碱性氨基酸的情况下,例如可以利用超声波等将菌体破碎,从通过离心分离除去菌体而得到的上清液中利用离子交换树脂法等回收碱性氨基酸。另外,碱性氨基酸析出于培养基中的情况下,可以通过离心分离或过滤等进行回收。另外,析出于培养基中的碱性氨基酸可以在将溶解于培养基中的碱性氨基酸进行晶析后一并回收。所回收的碱性氨基酸可以为游离体、其盐、或它们的混合物。即,本发明中的“碱性氨基酸”的术语可以意指游离体的氨基酸、其盐、或它们的混合物。作为盐,可举出例如碳酸盐、碳酸氢盐、盐酸盐、硫酸盐。另外,所回收的碱性氨基酸除碱性氨基酸以外,例如也可以含有微生物菌体、培养基成分、水分、及微生物的代谢副产物等成分。碱性氨基酸可以纯化为所期望的程度。所回收的碱性氨基酸的纯度例如可以为30%(w/w)以上、50%(w/w)以上、70%(w/w)以上、80%(w/w)以上、90%(w/w)以上、或95%(w/w)以上。碱性氨基酸例如可以以含有碱性氨基酸的造粒干燥物的形式提供。例如,L-赖氨酸可以以含有L-赖氨酸的造粒干燥物的形式提供。作为制造含有L-赖氨酸的造粒干燥物的方法,可举出US7416740中记载的方法。具体而言,可以将阴离子/L-赖氨酸当量比为0.68~0.95、优选0.68~0.90、更优选0.68~0.86的L-赖氨酸发酵液作为原料,制造含有L-赖氨酸的造粒干燥物。“阴离子/L-赖氨酸当量比”是由L-赖氨酸(L-Lys)含量、硫酸根离子含量、氯离子含量、铵离子含量、钠离子含量、钾离子含量、镁离子含量、钙离子含量,基于下述式所算出的值。式中,[]表示摩尔浓度。阴离子/L-赖氨酸当量比=(2×[SO42-]+[Cl-]-[NH4+]-[Na+]-[K+]-2×[Mg2+]-2×[Ca2+])/[L-Lys]即,可以根据需要将进行了加压加热处理的L-赖氨酸发酵液的阴离子/L-赖氨酸当量比调整为上述例示的范围,制造含有L-赖氨酸的造粒干燥物。使阴离子/L-赖氨酸当量比上升例如可以通过添加盐酸或硫酸、添加阴离子/L-赖氨酸当量比高(例如高于0.95)的L-赖氨酸水溶液、或它们的组合而实施。作为阴离子/L-赖氨酸当量比高于0.95的L-赖氨酸水溶液,可举出碳酸盐发酵以外的发酵法中得到的L-赖氨酸发酵液等pH为中性至酸性的L-赖氨酸水溶液。使阴离子/L-赖氨酸当量比降低例如可以通过添加阴离子/L-赖氨酸当量比低(例如低于0.68)的L-赖氨酸水溶液来实现。作为阴离子/L-赖氨酸当量比低于0.68的L-赖氨酸水溶液,可举出L-赖氨酸碱(游离体的L-赖氨酸)的水溶液。另外,加压加热处理后的L-赖氨酸发酵液可以在进行脱羧或浓缩等处理之后,用于造粒干燥物的制造。通过该方法,可得到阴离子/L-赖氨酸当量比为0.68~0.95、优选0.68~0.90、更优选0.68~0.86的含有L-赖氨酸的造粒干燥物。相对于造粒干燥物中的总固体成分,该造粒干燥物的L-赖氨酸含量例如可以为40~85重量%、优选50~85重量%、更优选60~85重量%。另外,相对于造粒干燥物的总量,该造粒干燥物的水分含量例如可以为5重量%以下。由进行了加压加热处理的L-赖氨酸发酵液制造造粒干燥物可以通过用于制造含有L-氨基酸的造粒干燥物的公知方法进行。作为这样的方法,可举出例如将发酵液进行固体化后对固体化物进行造粒的方法、或使用种子直接进行造粒干燥的方法(US7416740)。实施例下面,通过实施例进一步具体地说明本发明。参考例1:赖氨酸发酵液中的赖氨酸浓度减少的温度依赖性按照US2002-025564A中记载的方法进行碳酸盐发酵,得到含有赖氨酸的pH8.3的发酵液(也称为“赖氨酸发酵液”)。将赖氨酸发酵液移至反应装置,在20℃、40℃、60℃下分别搅拌,确认赖氨酸浓度的变化。将其结果示于表1。表中,赖氨酸浓度以相对于初期赖氨酸浓度的相对值(=赖氨酸浓度/初期赖氨酸浓度)表示。温度越高,赖氨酸浓度的减少越迅速地进行,随着时间推移,减少速度变慢。另外,赖氨酸浓度使用HPLC进行测定(下同)。[表1]表1赖氨酸浓度的变化参考例2:赖氨酸发酵液中的赖氨酸浓度减少的pH依赖性在参考例1中得到的赖氨酸发酵液(pH8.3)中添加盐酸,分别制备pH4.5、5.5、7.0的赖氨酸发酵液。将赖氨酸发酵液(pH8.3)和调整了pH的赖氨酸发酵液(pH4.5、5.5、7.0)在60℃下分别搅拌,确认赖氨酸浓度的推移。将其结果示于表2。表中,赖氨酸浓度作为相对于初期赖氨酸浓度的相对值(=赖氨酸浓度/初期赖氨酸浓度)表示。pH越高,赖氨酸浓度的减少越迅速地进行,在pH5.5以下,赖氨酸浓度的减少不进行。[表2]表2赖氨酸浓度的变化实施例1:抑制高压条件下赖氨酸浓度的减少将参考例1中得到的赖氨酸发酵液(pH8.3)在温度60℃/压力0.1MPa、温度120℃/压力0.2MPa、温度120℃/压力1.5MPa的条件下分别在滞留管内进行加压加热处理,确认处理前后的赖氨酸浓度的变化及处理前后的pH。将其结果示于表3。表中,赖氨酸浓度以相对于初期赖氨酸浓度的相对值(=赖氨酸浓度/初期赖氨酸浓度)来表示。在温度60℃/压力0.1MPa的条件(实验条件1,2)及温度120℃/压力0.2MPa的条件(实验条件2、3、4、5、6、7)下发生赖氨酸浓度的减少。另一方面,在温度120℃/压力1.5MPa的条件(实验条件8、9)下,赖氨酸浓度的减少得以抑制。在温度60℃/压力0.1MPa的条件(实验条件1、2)及温度120℃/压力0.2MPa的条件(实验条件2、3、4、5、6、7)下,可看到pH的上升,由此可知:从赖氨酸发酵液中产生二氧化碳。另一方面,在温度120℃/压力1.5MPa的条件(实验条件8、9)下,没有发现pH的上升,由此可知:防止了由赖氨酸发酵液产生二氧化碳。由以上可知:通过在可以防止从该发酵液中产生二氧化碳的压力下对含有由碳酸盐发酵得到的碱性氨基酸的发酵液进行加热处理,可以防止加热处理中该发酵液中的碱性氨基酸浓度的减少。[表3]表3实施例2:防止由赖氨酸发酵液产生二氧化碳而需要的压力的计算通过以下的步骤,利用计算式计算防止由赖氨酸发酵液产生二氧化碳所需要的压力。<1>pH模拟防止由发酵液产生二氧化碳所需要的压力取决于发酵液中所含的各离子的解离状态。发酵液中所含的各离子的解离状态取决于发酵液的pH。因此,为了计算防止由发酵液产生二氧化碳所需要的压力,为了确定发酵液中所含的各离子的解离状态,需要确定发酵液的pH。发酵液的pH可依赖于发酵液的温度。但是,由于在超过100℃的条件下测定pH需要耐压性的密闭装置,因此,难以在这样的高温条件下直接测定发酵液的pH。因此,首先导出用于计算各温度下的发酵液的pH的关系式。<1-1>酸解离常数K和温度的关系吉布斯自由能和平衡常数(酸解离常数K)存在下述式(1)所示的关系。[数学式1]ΔG=-RT×lnK…(1)另外,吉布斯自由能和热函的变化满足下述式(2)所示的关系。[数学式2]由式(1)及式(2)得到下述式(3)。由式(3)可知:酸解离常数K为温度的函数。[数学式3]因此,对于赖氨酸发酵液中所含的离子中被认为在中性~弱碱性区域内由温度引起的解离平衡变化时,对必要压力的计算产生很大的影响的Lys及CO2,使用下述式(4-1)~(4-5)所示的pK值(L.N.PlummerandE.Busenberg.Geochim.Cosmochim.Acta46,1011-1040(1982))作为含有温度因子的pK值。通过将式(4-1)~(4-5)进行变形,得到温度函数形式的酸解离常数K。[数学式4]<1-2>pH模拟利用上述中得到的Lys及CO2的酸解离常数K,模拟pH。在本模拟中,除Lys及CO2之外,还使用赖氨酸发酵液中可能较多地含有的NH3、K、Mg、Cl、SO4、醋酸及琥珀酸的浓度。另外,NH3及有机酸的酸解离常数K也被认为是温度的函数,但在本模拟中,NH3作为pKNH3=9.24(一定值),有机酸分别作为1元强酸处理。由于溶液中的总离子浓度为电中性,因此,下述式(5)成立。式中,各“C”表示摩尔浓度(以下,相同)。[数学式5]式(5)中的各赖氨酸离子浓度由下述式(6-1)~(6-3)算出。式中,KLys,1,2,3为由式(4-1)~(4-3)得到的温度的函数。式中,“CLys”表示赖氨酸的总摩尔浓度、即赖氨酸分子(未发生离子化的赖氨酸)和赖氨酸离子的总摩尔浓度。[数学式6]式(5)中的碳酸根离子及碳酸氢根离子浓度由下述式(7-1)~(7-2)算出。式中,KCO2,1,2是由式(4-4)~(4-5)得到的温度的函数。式中,“CCO2”表示碳酸物质的总摩尔浓度、即二氧化碳分子、碳酸分子、碳酸根离子、及碳酸氢根离子的总摩尔浓度。[数学式7]使用Newton法求出式(5)的解(CH+)。具体而言,将式(5)进行微分,通过在Excel中重复CH+的算出而算出恒定化的CH+。即,通过将式(5)进行微分,可得到下述式(8)。[数学式8]式(8)的各参数由下述式(9-1)~(9-8)算出。[数学式9]由式(5)及式(8)的解,利用下述式(10)重复上述计算,至CH+成为一定。恒定化的CH+的计算针对各种发酵液的组成及温度均实施。即,这里,关于参考例1中得到的赖氨酸发酵液(组成示于表4(后述)),算出各温度下的恒定化的CH+。关于该赖氨酸发酵液,将实施35℃下的重复计算时的CH+的变化示于图1。[数学式10]最后使用确认了已恒定化的CH+值,利用下述式(11)算出pH。即,这里,对于参考例1中得到的赖氨酸发酵液(组成示于表4(后述)),算出各温度下的pH。[数学式11]<1-3>pH模拟结果的验证使用120℃的油浴调整参考例1中得到的赖氨酸发酵液(组成示于表4(后述))的温度,测定达到指定温度(25、35、42、53、60、70℃)的时刻的pH。需要说明的是,发酵液中所含的HCO3被加热气化的情况下,认为发酵液的组成会发生变化,因此,在不产生发泡的温度的范围内进行pH的测定。具体而言,本实验中在70℃以上的条件下产生明显的发泡,因此,将70℃设为测定上限。将实测值和模拟值示于图2。实测值和模拟值的pH的振幅为0.1以下,确认高度相关。由以上可以判定:本pH模拟的精度非常高,可以通过本pH模拟来估算各温度下的赖氨酸发酵液的pH。<2>必要压力模拟的构建<2-1>用于构建必要压力模拟模型的假定通过上述<1>确立了可以根据发酵液组成估算pH的方法。该结果,可以由作为温度的函数的pK值及想定温度下的pH模拟来计算该温度下的Lys的解离状态。作为一例,将38℃及120℃下的Lys解离曲线示于图3。例如,pH8的情况下,在38℃下,Lys的约80%带电成为Lys+,但在120℃下,Lys+及Lys±变化为大致1:1的存在比率。由本解离状态分析结果得到下述假定1及2。<假定1>由于在赖氨酸发酵液中以高浓度含有Lys,因此,38℃、pH8的情况下,HCO3离子作为Lys离子的反离子溶解于发酵液。另一方面,通过将赖氨酸发酵液加热至120℃,Lys的约一半失去电荷而以Lys±形式存在,因此,产生不具有Lys作为反离子的HCO3离子。假定该不具有Lys作为反离子的HCO3离子发生气化。将38℃及120℃下的离子平衡的示意图示于图4。<假定2>已知Henry法则对于含有挥发性溶质的稀薄溶液成立,假定Henry法则对于赖氨酸发酵液也成立。<2-2>必要压力模拟模型的构建由假定1及2,假定Henry法则对于由于加热而失去反离子的HCO3离子成立,构建用于计算该HCO3离子不发生气化所需要的压力的模拟模型。模拟模型针对120℃进行构建。<2-2-1>120℃下的Lys解离状态的计算将120℃下的Lys解离状态示于图5。由于用于模拟的赖氨酸发酵液在120℃下的pH为7~7.5(图2),假定pH7~7.5的解离曲线可以近似为直线,将pH7下的Lys解离状态作为基准,利用下述式算出pH7~7.5的指定pH下的Lys+存在比率。“Lys+存在比率”表示Lys+的量相对于赖氨酸总量的比率(摩尔比)。[数学式12]<2-2-2>不具有反离子的HCO3离子存在比率的计算利用下述式算出加热至120℃后赖氨酸发酵液中不具有反离子的HCO3离子的存在比率。式中,“HCO3浓度”表示HCO3离子的总浓度、即具有反离子的HCO3离子和不具有反离子的HCO3离子的总浓度。“HCO3浓度”例如可以利用离子色谱法进行测定。另外,式中,“Lys浓度”表示赖氨酸的总浓度(包括离子化的赖氨酸以及未离子化的赖氨酸)。“不具有反离子的HCO3离子的存在比率”表示不具有反离子的HCO3离子的量相对于HCO3离子的总量的比率(摩尔比)。这里所说的“不具有反离子的HCO3离子”为由于加热而失去反离子的HCO3离子。[数学式13]<2-2-3>碳酸分压PCO2的算出使用120℃下的Henry常数(AleksanderDhima,Jean-CharlesdeHemptinne,andJacquesJose,Ind.Eng.Chem.Res.1999,38,3144-3161),利用下述式算出碳酸分压PCO2。[数学式14]PCO2=Henry常数×1000×HCO3浓度/44×10×②/55.5…③<2-2-4>水蒸气分压的算出使用Wagner式,由下述式算出水蒸气分压PH2O。[数学式15]A=776451B=145838C=2.7758D=123303Tc=647.3[K]Pc=22120[kPa]<2-2-5>必要压力的计算由下述式算出必要压力P。[数学式16]必要压力P=③+⑤...⑥实施例3:防止由赖氨酸发酵液产生二氧化碳所需要的压力的实验值和计算值的比较验证<1>计算值的计算利用实施例2所示的计算式,对参考例1中得到的赖氨酸发酵液(pH8.3),在60℃~130℃的范围内计算防止由发酵液产生二氧化碳所需要的压力。将该赖氨酸发酵液的组成示于表4。[表4]表4发酵液的组成[%]赖氨酸13.93CO22.51氨0.08钾0.06镁0.04氯化物离子0.08硫酸根离子0.12琥珀酸0.22乙酸0.18<2>实验值的测定将参考例1中得到的赖氨酸发酵液(pH8.3)导入到高温高压反应装置(TEM-V;耐压硝子工业)中并密闭并使得装置空隙率(气相的比率)为6%v/v,加热至60℃、80℃、100℃、105℃、110℃、115℃、120℃、125℃、130℃。在上述各温度下测定气相的压力,作为防止该温度下由发酵液产生二氧化碳所需要的压力。<3>实验值和计算值的比较将计算值和实验值示于图6。计算值和实验值非常一致,显示实施例2所示的计算式可以用于计算防止由发酵液产生二氧化碳所需要的压力。实施例4:防止由赖氨酸发酵液产生二氧化碳所需要的压力的计算例利用实施例2所示的计算式,对表5中记载的组成的模型赖氨酸发酵液(赖氨酸浓度11g/dl,pH9.0),在25℃~130℃的范围内计算防止由发酵液产生二氧化碳所需要的压力。将计算结果变换成近似式,将得到的近似式示于图7。本实施例中使用的模型赖氨酸发酵液(赖氨酸浓度11g/dl,pH9.0)与实施例3中使用的赖氨酸发酵液(赖氨酸浓度13.93g/dl,pH8.3)相比,pH高,赖氨酸浓度低,因此需要的CO2浓度低,因此计算出的防止由赖氨酸发酵液产生二氧化碳所需要的压力也较低。另外,利用该近似式,必要压力可以表示为:必要压力=1.99×10-3×温度2.54。[表5]表5发酵液的组成[%]赖氨酸11.5CO20.80氨0.08钾0.06镁0.04氯化物离子0.08硫酸根离子0.12琥珀酸0.22乙酸0.18实施例5:加压加热处理后脱羧时赖氨酸浓度减少的抑制将参考例1中得到的赖氨酸发酵液(pH8.3)移至反应装置,在120℃、0.1MPa下在滞留管内进行加压加热处理,其后,在大气压下60℃下加热24小时。作为对照,不对参考例1中得到的赖氨酸发酵液(pH8.3)进行加压加热处理而是在大气压下60℃下加热24小时。在各自的条件下确认赖氨酸浓度的变化。表6表示其结果。显示:通过对发酵液进行加压加热处理,可以抑制其后的纯化工艺中赖氨酸浓度的减少。[表6]表6高温高压处理给予赖氨酸浓度减少的影响工业上的可利用性根据本发明,可以防止由碳酸盐发酵得到的发酵液中碱性氨基酸含量的减少,可以高效地制造碱性氨基酸或含有其的发酵生产物。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1