通过改变乙酰-COA羧化酶的负调控因子来增加植物油含量的制作方法
本申请要求2015年8月28日提交的62/211,371号美国临时申请的利益,其全部内容通过引用在此引入。关于联邦资助研究的声明本发明是在国家科学基金会授予的批准号PGRPIOS-1339385和美国国立卫生研究院的批准号T32GM008396的政府支持下完成的。政府对本发明享有一定的权利。序列表引入包含在于2016年7月6日创建的名为“UVMO115WO_ST25.txt”的文件(其在微软Windows操作系统测量为331千字节)中的序列表以电子方式随同本文提交并在此引入作为参考。
技术领域:
本发明涉及用于增加植物油含量的方法和系统,并且更具体地涉及下调从头脂肪酸合成的负调控因子的表达的构建体和方法,从而在携带该负调节因子家族的植物和藻类中增加脂肪酸和最终增加三酰甘油的产生。
背景技术:
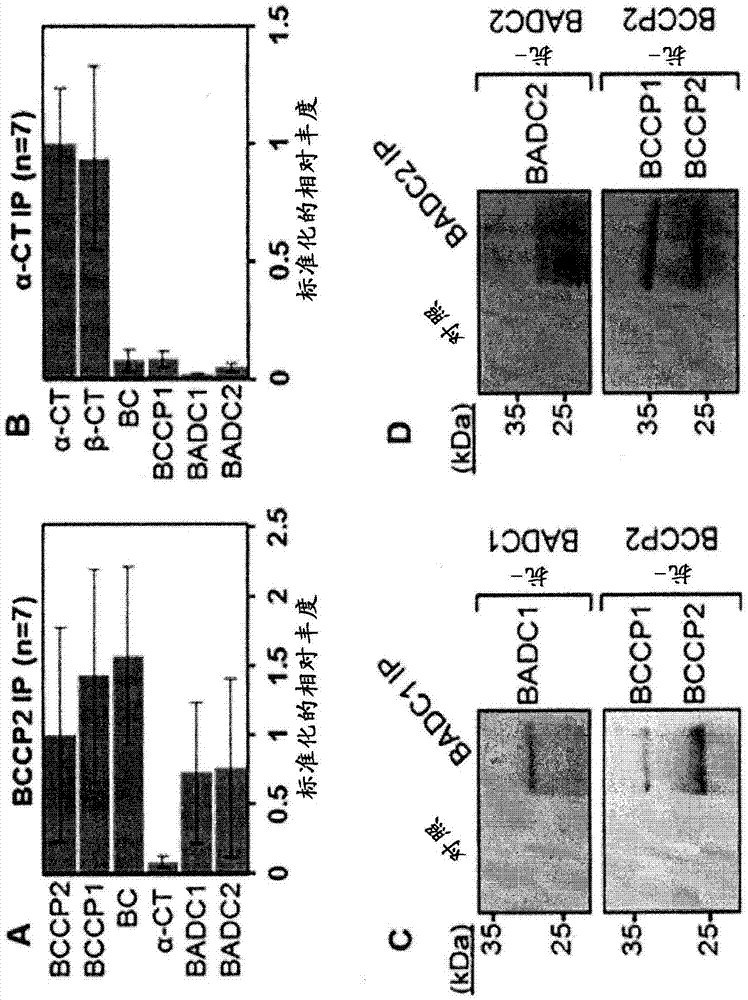
:植物油是食品、能源和工业原料的碳氢化合物的重要可再生资源。随着对这种商品需求的增加,发现提高作物中油产量的途径将成为农业上的优先考虑事项。油产生开始于从头脂肪酸合成(FAS)途径以产生酰基链,其最终被酯化成甘油以产生三酰甘油(其是种子中的主要储存脂质)。从头FAS的关键步骤由乙酰辅酶A羧化酶(ACCase)催化,其在需要ATP、碳酸氢盐和生物素辅因子的两步反应中羧化乙酰辅酶A以形成丙二酰辅酶A。在原核生物中和在大多数植物的质体中,ACCase是需要四个不同亚基的异聚合的复合物:生物素羧化酶(BC)、生物素羧基载体蛋白(BCCP)以及α-和β-羧基转移酶(CT)。禾本科植物(Graminaceousmonocots)具有质体ACCase的同聚形式,其中催化组分串联邻接为单一多肽。异聚ACCase的结构模型主要基于在大肠杆菌中的研究。大肠杆菌ACCase由两种子复合体组成:α/β-CT异四聚体和BC/BCCP异四聚体。两种子复合体的组分形成稳定的缔合,而子复合体本身表现出相互之间相对较弱的相互作用。该性质造成了来自植物的异聚ACCase的生物化学和结构表征的困难。质体ACCase受到光、反馈抑制和2-酮戊二酸结合蛋白PII的调节。这种调节是否由其他蛋白质介导或者是否涉及其他因子仍然不清楚,因为植物异聚ACCase从未被充分表征过。需要对ACCase蛋白相互作用进行全面研究。因此,有必要提供对于ACCase的蛋白质结构和调控的更好的了解,以利用操纵通过从头FAS的这一关键的和不可逆的步骤的通量的潜能。还需要开发有效提高ACCase活性从而增加植物和藻类中的脂肪酸,和最终增加三酰甘油的产生的新方法。技术实现要素:一方面,本发明提供了调节或改变植物和藻类中的脂肪酸和蛋白质产生的方法/系统。这些方法包括改变ACCase的活性水平的步骤,ACCase是从头脂肪酸生物合成的关键步骤。本发明可以包括改变负调节因子基因家族的表达的步骤,所述负调节因子为含生物素/硫辛酰连接结构域(BADC或BLADC)蛋白,其结合于在双子叶植物和非禾本科植物的质体以及藻类中发现的多亚基ACCase。降低BADC水平可使得藻类和/或陆地植物中(在营养或生殖组织,包括但不限于叶和种子中)的油含量更高。另外,增加或过表达植物或藻类中的一个或多个BADC基因的表达可以通过降低ACCase活性和通过从头FAS的通量来实现较高的蛋白质含量。根据本发明的一个实施方式,该方法可以包括通过利用生物技术或选择性育种途径下调BADC基因来增强植物或藻类细胞中的质体ACCase活性的步骤。在一些实施方式中,完全或部分沉默可包括反义、RNAi、CRISPR、TALON、纳米抗体、EMS、T-DNA或转座子介导的基因敲除或常规诱变/靶向育种(targetedbreeding)。在一个实施方式中,这样的方法可以进一步包括含有SEQIDNO:7或138的RNAi盒。在一些实施方式中,这些途径可以包括完全或部分沉默一个或多个BADC基因,例如BADC1、BADC2和/或BADC3的基因和基因直系同源物或者含有必需BADC基序的人造基因。在一个实施方式中,所述一个或多个BADC基因可包含与选自SEQIDNO:2、4、6、7和138的核苷酸序列或其互补序列的约70%至约100%的序列同一性。在另一个实施方式中,所述一个或多个BADC基因可编码包含与选自SEQIDNO:1、3、5、8-137和139-143的多肽序列的约70%至约100%的序列同一性的多肽。在另一个实施方式中,本发明提供了通过本文所述方法产生的植物或其部分,其中所述植物包含增加的种子油含量,或者提供了产生所述植物或其部分的种子,其中所述种子包含增加的种子油含量。在一些实施方式中,这样的方法可以在含有拟南芥(Arabidopsisthaliana)BADC基因的直系同源物的生物体中进行,例如,无油樟(Amborellatrichopoda)、深山南芥(Arabidopsislyrata)、Arabidopsisalpine、落花生(Arachishypogaea)、原壳小球藻(Auxenochlorellaprotothecoides)、甘蓝型油菜(Brassicanapus)、芜菁(Brassicarapa)、亚麻荠(Camelinasativa)、Capsellarubella、红花(Cathamustinctorius)、莱茵衣藻(Chlamydomonasreinhardtii)、小球藻(Chlorellavariabilis)、鹰嘴豆(Cicerarietinum)、克莱门柚(Citrusclementina)、甜橙(Citrussinensis)、亚椭圆胶球藻(Coccomyxasubellipsoideas)C-169、中果咖啡(Coffeacanephora)、甜瓜(Cucumismelo)、黄瓜(Cucumissativus)、油棕(Elaeisguineensis)、猴面花(Erythrantheguttata)、巨桉(Eucalyptusgrandis)、盐芥(Eutremasalsugineum)、欧洲草莓(Fragariavesca)、黄花螺旋狸藻(Genliseaaurea)、大豆(Glycinemax)、向日葵(Helianthusannuus)、HelicosporidiumATCC50920、麻疯树(Jatrophacurcas)、百脉根(Lotusjaponicas)、蒺藜苜蓿(Medicagotruncatula)、川桑(Morusnotabilis)、小果野芭蕉(Musaacuminate)、莲(Nelumbonucifera)、美花烟草(Nicotianasylvestris)、绒毛状烟草(Nicotianatomentosiformis)、菜豆(Phaseolusvulgaris)、海枣(Pheonixdactylifera)、小立碗藓(Physcomitrellapatens)、北美云杉(Piceasitchensis)、Polytomellaparva、毛果杨(Populustrichocarpa)、青梅(Prunusmume)、碧桃(Prunespersica)、白梨(Pyrusxbretschneideri)、蓖麻(Ricinuscommunis)、江南卷柏(Selaginellamoellendorffii)、芝麻(Sesamumindicum)、番茄(Solanumlycopersicum)、马铃薯(Solanumtuberosum)、可可(Theobromacacao)、菥蓂(Thlaspiarvense)、葡萄(Vitisvinifera)或者团藻(Volvoxcarteri)。在本发明的另一个实施方式中,所述方法可以包括在含有拟南芥BADC基因的直系同源物的生物体中通过利用生物技术或选择性育种方法上调BADC基因来降低质体ACCase活性的步骤。在一个实施方式中,一个或多个BADC基因的这种上调可以包括改变植物或藻类的种子或营养组织中的一个或多个BADC基因(例如BADC1、BADC2和/或BADC3的基因和基因直系同源物,或含有必需BADC基序的人造基因)的表达。在一个实施方式中,所述一个或多个BADC基因可包含与选自SEQIDNO:2、4、6、7和138的核苷酸序列或其互补序列的约70%至约100%的序列同一性。在另一个实施方式中,所述一个或多个BADC基因可编码包含与选自SEQIDNO:1、3、5、8-137和139-143的多肽序列的约70%至约100%的序列同一性的多肽。在另一个实施方式中,本发明提供了通过本文所述的方法产生的植物或其部分(其中所述植物包含增加的种子油含量),或产生所述植物或其部分的种子(其中所述种子包含增加的种子油含量),例如,无油樟、深山南芥、Arabidopsisalpine、落花生、原壳小球藻、甘蓝型油菜、芜菁、亚麻荠、Capsellarubella、红花、莱茵衣藻、小球藻、鹰嘴豆、克莱门柚、甜橙、亚椭圆胶球藻C-169、中果咖啡、甜瓜、黄瓜、油棕、猴面花、巨桉、盐芥、欧洲草莓、黄花螺旋狸藻、大豆、向日葵、HelicosporidiumATCC50920、麻疯树、百脉根、蒺藜苜蓿、川桑、小果野芭蕉、莲、美花烟草、绒毛状烟草、菜豆、海枣、小立碗藓、北美云杉、Polytomellaparva、毛果杨、青梅、碧桃、白梨、蓖麻、江南卷柏、芝麻、番茄、马铃薯、可可、菥蓂、葡萄或者团藻。根据本文提供的描述,本公开的其他应用领域将变得显而易见。应该理解的是,该描述和特定实施例仅用于说明的目的,而不旨在限制本教导的范围。附图说明为了更彻底地理解本发明的特征和优点,现在参考本发明的详细描述以及附图。这里描述的附图仅用于说明的目的,而并不意图以任何方式限制本教导的范围。图1-显示来自拟南芥(Arabidopsisthaliana)幼苗的ACCase和BADC蛋白的共免疫沉淀。(A和B)使用对ACCase亚基BCCP2(A)或α-CT(B)特异性的抗体从拟南芥天然粗叶绿体裂解产物沉淀蛋白质并通过LC-MS/MS鉴定。用未包被的蛋白A琼脂糖珠进行对照沉淀。对于这两组研究,n=7。误差棒代表标准偏差。通过将每种蛋白质的总光谱匹配除以蛋白质大小并针对抗体特异性蛋白质标准化来测定半定量标准化相对丰度值。(C和D)来自相同拟南芥裂解产物的相互co-IPs的蛋白质印迹分析显示ACCase的BCCP亚基与BADC1(C)和BADC2(D)共沉淀。印迹代表三个生物学重复。图2-显示用于酵母双杂交和重组表达克隆研究的引物设计。(A)用于扩增所示基因的引物是从Sigma-Aldrich订购的,并包括:BCCP1(登录号AT5G16390)有义和反义引物(分别为SEQIDNO:144和145);BCCP2(登录号AT5G15530)有义和反义引物(分别为SEQIDNO:146和147);BADC1(登录号AT3G56130)有义和反义引物(分别为SEQIDNO:148和149);BADC2(登录号AT1G52670)有义和反义引物(分别为SEQIDNO:150和151);BADC3(登录号AT3G15690)有义和反义引物(分别为SEQIDNO:152和153)和apo-BCCP1(登录号AT5G16390)突变体有义和反义引物(分别为SEQIDNO:160和161)。加下划线的节段表示限制性内切酶位点。(B)转运肽长度使用TargetP预测。引物设计为从目的基因删除编码这些肽的碱基以允许正确的蛋白质折叠。图3-显示了BADC蛋白与ACCase的BCCP亚基的直接相互作用。(A)用含有所示基因的诱饵和猎物构建体转化AH109酵母菌株。阴性对照显示极少或没有生长。Sv40和p53用作阳性对照。核纤层蛋白C被用作阴性对照。将转化的酵母接种在缺乏Trp、Leu和His的培养基上。显示的结果代表三个生物学重复。(B)显示来自大肠杆菌的Ni2+-NTA纯化的蛋白质的洗脱级分的考马斯染色的凝胶。在右侧,天然蛋白质与His6-标记的蛋白质共表达。在左侧,天然蛋白质单独表达。只有当与His6-标记的蛋白质共表达时,天然蛋白质才强烈存在于洗脱级分中。通过LC-MS/MS确认蛋白质身份。图4-显示BADC蛋白与拟南芥中ACCase的BCCP亚基共有显著的序列同一性。将来自拟南芥的蛋白质序列进行比对,并使用Clustal-W计算百分氨基酸同一性。图5显示BADC蛋白质的预测结构与拟南芥中ACCase的BCCP亚基相似。使用SWISS-MODEL生成每种蛋白质的结构。使用缺乏预测的转运肽残基的蛋白质序列作为输入。图6A-显示拟南芥BCCP和BADC蛋白C-末端的比对,证明BADC蛋白类似于BCCP异形体但缺乏保守的生物素化基序和生物素赖氨酸残基。BCCP1(SEQIDNO:1),BCCP2(SEQIDNO:2),BADC1(SEQIDNO:3),BADC2(SEQIDNO:4)和BADC3(SEQIDNO:5)。图6B和图6C-显示BCCP和BADC蛋白之间生物素化的差异,说明BADC蛋白类似于BCCP异形体但不是生物素化的。(B)使用生物素特异性抗体的重组拟南芥蛋白质的蛋白质印迹分析。观察到BCCP2是生物素化的,而BADC则不是。(C)来自拟南芥幼苗的体内免疫沉淀的BADC1的蛋白质印迹分析。印迹用BADC1特异性抗体沉淀,显示样品中存在BADC1,而用生物素特异性抗体的印迹显示没有BADC1的识别。图7-显示含有拟南芥BADC蛋白的直系同源物的物种。系统发育树显示被鉴定为含有拟南芥中的一个或多个BADC蛋白的直系同源物的所有物种。通过对每种BADC蛋白的一级序列进行PSI-BLAST鉴定直系同源物候选物。结果通过针对拟南芥蛋白质组进行交互BLAST来过滤。物种分类用颜色指明。所有鉴定的物种都含有异聚ACCase。图8-显示BADC3降低大肠杆菌中的ACCase活性。(A)显示随时间的L8大肠杆菌细胞的光密度的生长曲线。培养物在不存在脂肪酸的情况下在37℃下在M63液体培养物中生长。转化的细胞含有下列载体:空pET28a(EV28a)、含有大肠杆菌BCCP基因的pET28a(EcBCCP)、空pET11a(EV11a)和/或含有拟南芥BADC3基因的pET11a(BADC3)。EV对照细胞在37℃下显示出最小的生长,而重新引入原始EcBCCP补充温度敏感的表型。单独的BADC3表达没有显示与EV对照的统计学差异(除了在T=10h时),BADC3与EcBCCP的共表达在多个研究中显示出与单独的EcBCCP相比生长减少约75%。显示的结果代表三个独立的研究。误差棒代表标准偏差。(B)Ni2+-NTA纯化的His6-BADC3的考马斯蓝染色和抗生物素蛋白质印迹。图9-BADC降低拟南芥中的ACCase活性。通过将放射性标记的碳酸氢钠掺入到酸稳定的产物中来测定从10日龄拟南芥长角果提取的蛋白质的ACCase活性。试验在不存在(WT)或存在10μM重组BADC1、BADC2、BADC3、BCCP2或BSA的情况下进行。计算每个试验的比活性,然后针对WT对照标准化。对每个试验进行四个生物学重复。误差棒表示SEM。图10-显示拟南芥长角果中BADC和hetACCase基因表达的光依赖性的变化。(A)曲线图显示通过qPCR获得的给定基因的绝对表达水平。在各种光暴露量后收集10日龄的拟南芥长角果。使用从这些组织中提取的RNA创建用于该分析的cDNA。显示了四个生物学重复的平均值。所有数据点的标准误差为约5%至10%。(B)曲线图描绘了响应于光的BADC和BCCP总转录物水平的偏移。对于每个时间点(A)中BCCP和BADC的转录物水平的总和针对在6小时光暴露时BCCP转录物的总和标准化。在T=0时,BADC∶BCCP转录物的比率是9∶1。在T=6时,比率变为1∶4。图11显示了说明26个突变体BADC1RNAi系和一个野生型的种子油含量的条形图。统计学显著性由Student′st-检验确定(*,P<0.05)。图12-BADC1的种子特异性RNAi沉默增加了拟南芥的种子油含量。(A)条形图显示在WT和含有沉默种子中的BADC1表达的构建体的basta抗性T2拟南芥品系中的总种子油含量。每个条代表四个植物的平均值。误差棒表示SD。(B)BADC1RNAi沉默系的RT-PCR分析。BADC1转录物水平相对于肌动蛋白转录物水平进行定量并针对WT标准化。用于分析的RNA是从10日龄长角果的4个生物学重复提取的。误差棒表示SEM。在这两个曲线图中,统计学显著性由Student′st检验确定(*,P<0.05)。图13A-显示使用公众可得的转录组学数据证明拟南芥的发育种子中ACCase和BADC基因的表达谱的散点图。图13B-显示表明在发育的大豆种子中ACCase和BADC基因的表达谱的散点图。图14显示BADC1对ACCase活性的剂量依赖性抑制。(A)显示来自20日龄拟南芥叶提取物的ACCase活性,四个生物学重复的平均值。误差棒表示标准偏差。(B)显示来自(A)的值的表格。(C)显示了在用于图(A)的测定中使用的纯化的重组BADC1蛋白的SDS-PAGE分析。图15-显示BADC对ACCase的负调控的模型。ACCase的BC-BCCP子复合体由两个BC的二聚体和四个BCCP蛋白组成。提出了一种模型,其中BADC蛋白与BCCP竞争结合BC。BADC的结合阻止了必需BCCP亚基的结合。BC/BCCP和BC/BCCP/BADC子复合体池然后竞争与CT子复合体的相互作用,导致ACCase活性的可变降低。尽管两个ACCase半反应的瞬时关联是已知的,但是BADC是否可以从组装的BC/BCCP子复合体置换BCCP尚不清楚(虚线箭头)。缩写:BC,生物素羧化酶;BCCP,生物素羧基载体蛋白;BADC,生物素/硫辛酰连接结构域蛋白;CT,羧基转移酶。序列简述SEQIDNO:1-BADC1多肽序列,AT3G56130,含生物素/硫辛酰连接结构域的蛋白质。SEQIDNO:2-BADC1全基因组核酸序列,AT3G56130,含生物素/硫辛酰连接结构域的蛋白质。SEQIDNO:3-BADC2多肽,AT1G52670,单杂交基序蛋白。SEQIDNO:4-BADC2全基因组核酸,AT1G52670,单杂交基序蛋白。SEQIDNO:5-BADC3多肽,AT3G15690,单杂交基序蛋白。SEQIDNO:6-BADC3全基因组核酸,AT3G15690,单杂交基序蛋白。SEQIDNO:7-核酸,用于拟南芥中BADC1沉默的RNAi盒。SEQIDNO:8-134-各种生物体间各个BADC直系同源物的多肽序列。通过使用来自拟南芥的每种BADC的蛋白质序列作为针对已知植物和藻类蛋白质组的查询进行PSI-BLAST检索来鉴定直系同源蛋白质。直系同源物通过针对拟南芥蛋白质组的交互BLAST检索来确认。序列显示GenBankID,参考号,蛋白质注释以及属和种的名称。SEQIDNO:135-137-显示通过拟南芥中所有鉴定的BADC直系同源物和三种BADC异形体的多重序列比对鉴定的共有序列。该共有序列将蛋白质鉴定为BADC直系同源物。SEQIDNO:135-拟南芥BADC1蛋白,登录号AT3G56130,的内部44个氨基酸的多肽序列。这44个氨基酸在BADC蛋白家族中是保守的。SEQIDNO:136-BADC共有基序1的内部44个氨基酸,在位置1、2、11、12、28、29、36、38和42处具有相同的氨基酸残基。SEQIDNO:137-BADC共有基序1的内部44个氨基酸,在位置1、2、11、12、28、29、36、38和42处具有可变的氨基酸残基,并且提供可变的残基。SEQIDNO:138-核酸,对于大豆中BADC1和BADC3基因的RNAi盒。SEQIDNO:139-BCCP1蛋白质序列。SEQIDNO:140-BCCP2蛋白质序列。SEQIDNO:141-BADC1蛋白质序列。SEQIDNO:142-BADC2蛋白质序列。SEQIDNO:143-BADC3蛋白质序列。SEQIDNO:144和145-分别BCCP1(登录号AT5G16390)有义和反义引物的序列。SEQIDNO:146和147-分别BCCP2(登录号AT5G15530)有义和反义引物的序列。SEQIDNO:148和149-分别BADC1(登录号AT3G56130)有义和反义引物的序列。SEQIDNO:150和151-分别BADC2(登录号AT1G52670)有义和反义引物的序列。SEQIDNO:152和153-分别BADC3(登录号AT3G15690)有义和反义引物的序列。SEQIDNO:154和155-用于扩增AtBADC1的引物序列。SEQIDNO:156-用于扩增BADC1的有义引物的序列。SEQIDNO:157-用于扩增BADC1的反义引物的序列。SEQIDNO:158-用于扩增肌动蛋白8的有义引物的序列。SEQIDNO:159-用于扩增肌动蛋白8的反义引物的序列。SEQIDNO:160和161-分别apo-BCCP1(登录号AT5G16390)突变体有义和反义引物的序列。具体实施方式本发明提供了调节植物和藻类中的脂肪酸以及最终三酰甘油产生以及蛋白质产生的方法和手段。这些方法包括改变由乙酰-CoA羧化酶(ACCase)催化的从头脂肪酸生物合成的关键步骤的活性水平。根据本发明,本文所述的方法可以通过分别下调或上调含生物素/硫辛酰连接结构域(BADC)基因来提高或降低ACCase活性水平。BADC蛋白是拟南芥中三种蛋白质的家族,并且类似于ACCase的生物素羧基载体蛋白(BCCP)亚基。BADC蛋白表达对ACCase活性具有负面影响,其转而影响植物和藻类中的油产生。ACCase在催化从头脂肪酸合成的关键步骤和调节通过该中心代谢途径的通量的活性是本领域已知的。在双子叶和非禾本科单子叶植物和藻类中,质体ACCase是由四个催化亚基组成的异聚复合物:生物素羧化酶(BC)、生物素羧基载体蛋白(BCCP)以及α-和β-羧基转移酶(α-CT,β-CT)。该植物复合物与常规的纯化方案不相容,且因此完全组装的结构和组成是未知的。如下面详细描述的,与亚基特异性抗体的体内共免疫沉淀用于鉴定在拟南芥中的BADC蛋白(本文提供为SEQIDNO:1-6)的新家族。已确定BADC蛋白类似于BCCP(ACCase复合物的亚基),但不能被生物素化,并且基于来自正交技术的结果,所有三种BADC蛋白都与两种拟南芥BCCP异形体和ACCase的生物素羧化酶亚基相互作用(基于酵母双杂交和异源共表达分析)。与BCCP对照不同,BADC蛋白没有一种在植物中原位或在大肠杆菌中表达时生物素化。BADC的基因直系同源物仅在含有异聚ACCase的植物和绿藻物种中发现,表明BADC基因与这种形式的ACCase共同进化。进一步发现当在温度敏感性大肠杆菌BCCP突变体中与功能性BCCP共表达时,BADC蛋白的表达抑制ACCase活性。因此,BADC蛋白通过与BCCP竞争以形成活性较低的复合物来调节ACCase。下调BADC基因(即,沉默BADC蛋白的表达)促进活性ACCase复合物的形成,其继而提高ACCase活性水平并由此提高植物和/或藻类中的油产生。下调一个或多个BADC基因可以通过本文所述和/或本领域已知的各种生物技术或选择性育种方法来实现。本发明还提供了通过过表达BADC基因来减少植物和/或藻类中的脂肪酸合成的方法。这种方法会减少储存在种子中的三酰甘油的量,并同时增加储存在种子中的蛋白质的量。因此,BADC基因的过表达可以降低ACCase活性并进而降低脂肪酸生物合成。本公开提供了标记辅助选择作为含有较高油含量的植物和/或藻类物种的筛选工具的方法。BADC基因是可以被监测以选择可能具有产生更多三酰甘油的潜能的特定生物体的性状。BADC基因的表达水平可以是用于辅助这种选择的标志物,其中可以选择具有天然降低的BADC基因表达的生物体。植物油是用于食品、能源和工业原料的碳氢化合物的重要可再生资源。以三酰甘油存储的酰基链通过从头脂肪酸合成(FAS)途径产生。从头FAS的关键步骤是由异聚乙酰辅酶A羧化酶(hetACCase)催化的,其在需要ATP、碳酸氢盐和生物素辅因子的两步反应中将乙酰-CoA羧化以形成丙二酰-CoA。在原核生物中以及在双子叶植物和非禾本科单子叶植物的质体中,hetACCase是一种需要四种不同亚基的异聚复合物:生物素羧化酶(BC)、生物素羧基载体蛋白(BCCP)及α-和β-羧基转移酶(CT)。禾本科单子叶植物具有同聚形式的质体ACCase,其中催化组分串联融合为单一多肽。hetACCase的结构模型基于对大肠杆菌同源物的研究。大肠杆菌hetACCase由两种酶子复合体组成:α/β-CT异四聚体和BC/BCCP异八聚体。每个子复合体的组分形成稳定的缔合,而两个子复合体本身表现出相互之间相对弱的相互作用。该性质造成了来自植物的hetACCase的生物化学和结构表征中的困难。在不局限于特定理论的情况下,可用于本发明的植物可以包括但不限于植物或藻类物种,例如,无油樟、深山南芥、Arabidopsisalpine、原壳小球藻、甘蓝型油菜、芜菁、Capsellarubella、莱茵衣藻、小球藻、鹰嘴豆、克莱门柚、甜橙、亚椭圆胶球藻C-169、中果咖啡、甜瓜、黄瓜、油棕、猴面花、巨桉、盐芥、欧洲草莓、黄花螺旋狸藻、大豆、向日葵、HelicosporidiumATCC50920、麻疯树、百脉根、蒺藜苜蓿、川桑、小果野芭蕉、莲、美花烟草、绒毛状烟草、菜豆、海枣、小立碗藓、北美云杉、Polytomellaparva、毛果杨、青梅、碧桃、白梨、蓖麻、江南卷柏、番茄、马铃薯、可可、葡萄或者团藻。I.核酸、多肽和植物转化构建体本发明的某些实施方式涉及关于拟南芥中BADC蛋白的新家族的分离的核酸序列和相应的多肽序列,本文作为SEQIDNO:1-6提供。还提供了本文所述的任何核酸或蛋白质序列的互补序列。如本领域所熟知的,“同一性”是如通过比较序列确定的两个或更多个多肽序列或者两个或更多个多核苷酸序列之间的关系。在本领域中,“同一性”还意指多肽或多核苷酸序列之间的序列相关性水平,如通过这些序列的串之间的匹配所确定的。确定“同一性”的方法被设计为在测试序列之间给出最大的匹配。此外,确定同一性的方法在公众可用的程序中编码。可通过已知方法容易地计算“同一性”,所述方法包括,但不限于Lesk编辑,(1988);Smith编辑,(1993);Griffin和Griffin编辑,(1994);vonHeinje,(1987);Gribskov和Devereux编辑,(1991);和Carillo和Lipman,(1988)中描述的那些。计算机程序可用于确定两个序列之间的“同一性”,这些程序包括但不限于,GCG(Devereux,1984);5个BLAST程序的软件包,3个设计用于核苷酸序列查询(BLASTN、BLASTX和TBLASTX),和2个设计用于蛋白质序列查询(BLASTTP和TBLASTN)(Coulson,1994;Birren,等,1997)。BLASTX程序可从NCBI和其他来源公开获得(BLASTManual,Altschul,S.,等,NCBINLMNIH,Bethesda,Md.20894;Altschul,S.,等,1990)。众所周知的SmithWaterman算法也可以用来确定同一性。根据本发明,如本文所述的多核苷酸或多肽序列可表现出与本文所示的序列中的至少一个至少约70%至约100%的序列同一性。例如,在一个实施方式中,如本文所述的BADC基因可包含例如,与选自SEQIDNO:2、4、6、7或138的序列或其互补序列的70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。在其他实施方式中,本文所述的BADC蛋白可包含例如,与选自于SEQIDNO:1、3或5的序列或其互补序列的70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。多肽序列比较的参数包括如下:算法:Needleman和Wunsch(1970);比较矩阵:来自Hentikoff和Hentikoff,(1992)的BLOSUM62;空位罚分:12;和空位长度罚分:4。可以用于这些参数的程序作为来自GeneticsComputerGroup,MadisonWI的“空位”程序公开可得。上述参数以及没有对于末端空位的罚分可以作为用于肽比较的默认参数。核酸序列比较的参数包括如下:算法:Needleman和Wunsch(1970);比较矩阵:匹配=+10;错配=0;空位罚分:50;和空位长度罚分:3。可以用于这些参数的程序作为来自GeneticsComputerGroup,MadisonWis的“空位”程序公开可得。上述参数可以用作核酸比较的默认参数。如本文所用,“杂交”、“使杂交”或“能够杂交”应理解为指形成双链或三链分子或者具有部分双链或三链性质的分子。这种杂交可以发生在相对高的严格性条件下,包括低盐和/或高温条件,例如通过在约50℃至约70℃的温度下在约0.02M至约0.15MNaCl中洗涤10分钟。在本发明的一个实施方式中,该条件是0.15MNaCl和70℃。严格条件几乎不耐受在核酸和目标链之间的错配。这样的条件对于本领域普通技术人员是公知的,并且对于需要高选择性的应用是优选的。非限制性应用包括分离核酸,如基因或其核酸节段,或检测至少一种特定mRNA转录物或其核酸节段等。还可以包括蛋白质或多肽或其片段,例如本文所述的任何一种。本文作为SEQIDNO:1-6提供的核酸可以来自任何来源,例如鉴定为天然存在于植物中的,或可以合成,例如通过SEQIDNO:1-6的诱变。在一个实施方式中,天然存在的序列可以来自任何植物或藻类物种,例如,无油樟、深山南芥、Arabidopsisalpine、原壳小球藻、甘蓝型油菜、芜菁、Capsellarubella、莱茵衣藻、小球藻、鹰嘴豆、克莱门柚、甜橙、亚椭圆胶球藻C-169、中果咖啡、甜瓜、黄瓜、油棕、猴面花、巨桉、盐芥、欧洲草莓、黄花螺旋狸藻、大豆、向日葵、HelicosporidiumATCC50920、麻疯树、百脉根、蒺藜苜蓿、川桑、小果野芭蕉、莲、美花烟草、绒毛状烟草、菜豆、海枣、小立碗藓、北美云杉、Polytomellaparva、毛果杨、青梅、碧桃、白梨、蓖麻、江南卷柏、番茄、马铃薯、可可、葡萄或者团藻。编码序列可以以有义或反义方向提供在与在植物中起作用的异源启动子可操作地连接的重组载体中。还可以提供包含这些序列(包括其反义寡核苷酸)的表达构建体。在其他实施方式中,可提供用所述序列转化的植物和植物细胞。可以使用根据本发明的这些或其他序列与植物转化技术结合使用的载体的构建对于本领域技术人员参照本公开是已知的(参见,例如Sambrook等,1989;Gelvin等,1990)。因此,本发明的技术不限于任何特定的核酸序列。与编码序列或相应编码产物结合使用的任何附加元件的选择可取决于转换的目的。如本文所述,农作物植物转化的主要目的之一是向植物添加商业上期望的农艺学重要的性状。用于植物转化的载体可以包括例如,质粒、粘粒、YAC(酵母人工染色体)、BAC(细菌人工染色体)或任何其他合适的克隆系统,以及其DNA片段。因此,当使用术语“载体”或“表达载体”时,包括所有前述类型的载体以及从其分离的核酸序列。预期利用具有大插入能力的克隆系统将允许引入包含多于一个选定基因的大DNA序列。根据本发明,这可用于将对应于例如整个生物合成途径的基因导入植物中。特别适用于转化的是从这些载体分离的表达盒。用于转化植物细胞的DNA片段通常包含人们希望引入宿主细胞中并在宿主细胞中表达的cDNA、基因或多基因。这些DNA片段可以根据需要进一步包括诸如启动子、增强子、多聚接头或甚至调控基因的结构。选择用于细胞引入的DNA片段或基因通常编码将在所得重组细胞中表达的蛋白质,其产生可筛选或可选择的性状和/或其将对所得转基因植物赋予改善的表型。很可能包括在本发明中使用的载体中的优选组分如下。A.调控元件用于表达核酸序列的示例性启动子包括植物启动子,例如CaMV35S启动子(Odell等,1985),或者其他的启动子,如CaMV19S(Lawton等,1987)、nos(Ebert等,1987)、Adh(Walker等,1987)、蔗糖合成酶(Yang和Russell,1990)、α微管蛋白、肌动蛋白(Wang等,1992)、cab(Sullivan等,1989)、PEPCase(Hudspeth和Grula,1989)或者那些与R基因复合物相关的启动子(Chandler等,1989)。组织特异性启动子,如叶特异性启动子或组织选择性启动子(例如,指导其在叶原基中比在其他组织中更大表达的启动子)和组织特异性增强子(Fromm等,1986)也被认为是有用的,正如诱导型启动子如ABA-和turgor-诱导启动子。本领域已知的任何合适的启动子可用于在植物中表达编码序列。转录起始位点和编码序列起始之间的DNA序列,即非翻译前导序列,也可以影响基因表达。因此人们可能希望将特定前导序列用于本发明的转化构建体。在一个实施方式中,预期前导序列包括那些包含预期指导所连接基因的最佳表达的序列的前导序列,即包括可提高或维持mRNA稳定性并防止不适当的翻译起始的共有前导序列。依据本公开,这些序列的选择对于本领域技术人员是已知的。设想可用于改变如本文所述的ACCase的活性水平的序列可以包含本文所述的任何序列,例如SEQIDNO:1-6。在某些实施方式中,可用于改变ACCase水平的基因可包括改变BADC基因的表达,如本文分别显示为SEQIDNO:2、4和6的BADC1、BADC2、BADC3,或者其直系同源物或同源物。这种直系同源物或同源物可以来自根据本发明有用的任何物种。这样的序列可以在新型启动子、增强子等的控制下或者同源的或组织特异性或组织选择性启动子或控制元件的控制下引入植物中。用于在转基因植物中基因的组织特异性靶向的载体通常包括组织特异性或组织选择性启动子,并且还可以包括其他组织特异性或组织选择性控制元件,例如增强子序列。根据本公开内容,本领域技术人员将了解在某些植物组织中指导特异性表达或增强表达的启动子。这些包括,例如,对绿色组织特异性的rbcS启动子;在根中具有较高的活性的ocs、nos和mas启动子;或在发育种子中具有较高活性的napin和大豆球蛋白启动子。B.终止子根据本发明制备的转化构建体可以包括3′末端DNA序列,其充当终止转录的信号并使得通过与启动子可操作地连接的编码序列产生的mRNA的多聚腺苷酸化。在本发明的一个实施方式中,可以使用BADC编码序列的天然终止子。或者,异源3′末端可以增强有义或反义BADC编码序列的表达。可用于这种情况中的终止子的实例包括,来自根癌农杆菌(Agrobacteriumtumefaciens)的胭脂碱合酶基因(nos3′末端)(Bevan等,1983)、来自根癌农杆菌的章鱼碱合酶基因的T7转录物的终止子和来自马铃薯或番茄的蛋白酶抑制剂I或II基因的3′末端的那些。在需要时,可以进一步包括调控元件,如Adh内含子(Callis等,1987)、蔗糖合酶内含子(Vasil等,1989)或TMVω元件(Gallie等,1989)。C.转运或信号肽与表达基因的编码序列连接的序列(其在翻译后从初始翻译产物除去并且有助于蛋白质转运进入或穿过细胞内或细胞外膜)称为转运序列(通常进入液泡、囊泡、质体和其他细胞内细胞器)和信号序列(通常至内质网、高尔基体和细胞膜外)。通过促进蛋白质运输到细胞内和细胞外的区室中,这些序列可以通过保护它们免受蛋白水解降解而增加基因产物的积累。这些序列还允许来自高度表达基因的另外的mRNA序列连接到基因的编码序列。因为被核糖体翻译的mRNA比裸mRNA更稳定,所以在基因前面的可翻译mRNA的存在可以增加来自基因的mRNA转录物的总体稳定性,且从而增加基因产物的合成。由于转运和信号序列通常在翻译后从初始翻译产物去除,所以这些序列的使用允许添加可能不出现在最终多肽上的额外翻译序列。进一步设想,可能需要靶向某些蛋白质以增强蛋白质的稳定性(美国专利号5,545,818,通过引用将其全部内容并入本文)。另外,可以构建载体并将其用于转基因植物细胞内特定基因产物的细胞内靶向或将蛋白质指引到细胞外环境。这通常通过将编码转运或信号肽序列的DNA序列与特定基因的编码序列连接来实现。所得的转运或信号肽分别将蛋白质转运至特定的细胞内或细胞外目的地,且然后将其翻译后去除。D.标记基因通过使用可选择的或可筛选的标志物,可以提供或增强鉴别转化体的能力。“标记基因”是赋予表达标志物蛋白的细胞不同表型并因此允许将这种转化的细胞与不具有标志物的细胞区分开的基因。这些基因可以编码可选择的或可筛选的标志物,这取决于标志物是否赋予可以通过化学手段,即通过使用选择性试剂(例如除草剂、抗生素等)来“选择”的性状,或者其是否只是可通过观察或测试,即通过“筛选”(例如,绿色荧光蛋白)识别的性状。当然,合适的标志物蛋白的许多实例是本领域已知的并且可以用于本发明的实施中。许多选择标记编码区是已知的并且可以与本发明一起使用,包括但不限于提供卡那霉素抗性并可以使用卡那霉素、G418、巴龙霉素等选择的neo(Potrykus等,1985);赋予双丙氨膦或草丁膦抗性的bar;赋予草甘膦抗性的突变EPSP合酶蛋白(Hinchee等,1988);赋予溴苯腈抗性的腈水解酶,如来自臭鼻克雷伯菌(Klebsiellaozaenae)的bxn(Stalker等,1988);赋予对咪唑啉酮、磺酰脲或其他ALS抑制化学物质的抗性的突变型乙酰乳酸合酶(ALS)(欧洲专利申请154,204,1985);抗甲氨蝶呤DHFR(Thillet等,1988),赋予对除草剂茅草枯的抗性的茅草枯脱卤酶;或赋予对5-甲基色氨酸的抗性的突变的邻氨基苯甲酸合酶。能够用于系统中以选择转化体的选择标记的说明性实施方式是编码草丁膦乙酰转移酶的那些,例如来自吸水链霉菌(Streptomyceshygroscopicus)的bar基因或来自绿色产色链霉菌(Streptomycesviridochromogenes)的pat基因。草丁膦乙酰转移酶(PAT)使除草剂双丙氨膦中的活性成分,草丁膦(PPT)失活。PPT抑制谷氨酰胺合成酶(Murakami等,1986;Twell等,1989),从而导致氨的迅速积累和细胞死亡。本发明提供的序列的一种有益用途可以通过用本文所述的编码序列(例如,BADC编码序列)进行遗传转化来改变植物和/或藻类中的植物表型(例如脂肪酸或三酰甘油产生)以及蛋白质产生。如本文所述的BADC编码序列可以与其他序列一起提供。在不一定是标志物编码区的可表达编码区与标志物编码区组合使用时,可以在相同或不同DNA片段上使用单独的编码区进行转化。在后一种情况下,不同的载体同时递送至受体细胞以使共转化最大化。II.遗传转化本文另外提供了用上述鉴定的编码BADC或调节其表达的序列的重组载体转化的转基因植物。用于转化植物或用于本发明的其他细胞的合适方法据信实际上包括可以将DNA引入细胞中的任何方法,例如通过直接DNA递送,例如通过PEG-介导的原生质体转化(Omirulleh等人,1993),通过干燥/抑制介导的DNA摄取(Potrykus等人,1985),通过电穿孔(美国专利号5,384,253,特别在此通过引用整体并入本文),通过用碳化硅纤维搅拌(Kaeppler等,1990;美国专利号5,302,523,其全部内容特别地通过引用整体并入本文;以及美国专利号5,464,765,其全部内容特别地通过引用整体并入本文),通过农杆菌介导的转化(美国专利号5,591,616和美国专利号5,563,055;两者均特别地通过引用并入本文)和通过DNA包被颗粒的加速(美国专利号5,550,318;美国专利号5,538,877;和美国专利号5,538,880;每个特别地通过引用整体并入本文)等。通过应用诸如这些的技术,实际上任何植物物种的细胞可以被稳定地转化,并且这些细胞发育成转基因植物。农杆菌介导的转移是用于将基因引入植物细胞中的广泛适用的系统,因为DNA可以被引入整个植物组织中,从而不需要从原生质体再生完整植物。使用农杆菌介导的植物整合载体将DNA引入植物细胞中是本领域熟知的。参见,例如,Fraley等人,(1985),Rogers等人,(1987)和美国专利号5,563,055描述的方法,其特别通过引用整体并入本文。农杆菌介导的转化在双子叶植物中是最有效的,并且是用于转化双子叶植物(包括拟南芥属、烟草、番茄、苜蓿和马铃薯)的优选方法。事实上,虽然农杆菌介导的转化已经常规地用于包括苜蓿(Thomas等,1990)在内的双子叶植物多年,但它最近才变得可应用于单子叶植物。农杆菌介导的转化技术的进展现在使得该技术适用于几乎所有的单子叶植物。例如,现已将农杆菌介导的转化技术应用于水稻(Hiei等,1997;美国专利号5,591,616,特别地通过引用将其全部并入本文)、小麦(McCormac等,1998)、大麦(Tingay等,1997;McCormac等,1998)和玉米(Ishidia等,1996)。现代农杆菌转化载体能够在大肠杆菌以及农杆菌中复制,从而允许如所述的方便的操作(Klee等,1985)。此外,用于农杆菌介导的基因转移的载体的最近技术进步已经改善了载体中基因和限制性位点的排列以利于构建能够表达各种多肽编码基因的载体。描述的载体(Rogers等,1987)具有方便的多接头区(其侧接用于直接表达插入的多肽编码基因的启动子和聚腺苷酸化位点),并且适用于本发明的目的。GatewayTM和其他基于重组的克隆技术也可用于用于植物转化的载体。另外,含有武装的和解除武装的Ti基因两者的农杆菌可用于转化。在其中农杆菌介导的转化是有效的那些植物株系中,由于基因转移的简单和限定的性质,它是选择的方法。也可以采用原生质体进行植物电穿孔转化(Bates,1994;Lazzeri,1995)。例如,Dhir和Widholm在国际专利申请公开号WO9217598(特别地通过引用并入本文)中描述了通过子叶来源的原生质体的电穿孔产生转基因大豆植物。已对于原生质体转化描述过的物种的其他实例包括大麦(Lazerri,1995)、高粱(Battraw等,1991)、玉米(Bhattacharjee等,1997)、小麦(He等,1994)和番茄(Tsukada,1989)。根据本发明的用于将转化的DNA片段递送至植物细胞的另一种方法是微粒轰击(美国专利号5,550,318;美国专利号5,538,880;美国专利号5,610,042;以及PCT申请WO94/09699;其各自的全部内容特此通过引用并入本文)。在这种方法中,颗粒可以用核酸包被并通过推进力递送到细胞中。示例性颗粒包括由钨、铂和优选金组成的那些颗粒。预期在某些情况下,DNA沉淀到金属颗粒上对于使用微粒轰击将DNA递送到受体细胞不是必需的。然而,预期颗粒可以含有DNA而不是用DNA包被。因此,提议DNA包被的颗粒可以通过颗粒轰击来增加DNA递送的水平,但其本身不是必需的。通过加速将DNA递送到植物细胞中的方法的说明性实施方式是Biolistics颗粒递送系统,其可以用于将用DNA包被的颗粒或细胞通过筛网(例如不锈钢或Nytex筛网)推进到用悬浮培养的单子叶植物细胞覆盖的过滤器表面上。筛网将颗粒分散,使得它们不会以大的聚集体递送至受体细胞。微粒轰击技术广泛适用,并且可用于转化实际上任何植物物种。通过微粒轰击转化的物种的实例包括单子叶植物物种,如玉米(PCT申请WO95/06128)、大麦(Ritala等,1994;Hensgens等,1993)、小麦(美国专利号5,563,055,特此通过引用整体并入本文)、水稻(Hensgens等,1993)、燕麦(Torbet等,1995;Torbet等,1998)、黑麦(Hensgens等,1993)、甘蔗(Bower等,1992)和高粱(Casa等,1993;Hagio等,1991);以及许多双子叶植物,包括烟草(Tomes等,1990;Buising和Benbow,1994)、大豆(美国专利号5,322,783,特别地通过引用整体并入本文)、向日葵(Knittel等,1994)、花生(Singsit等,1997)、棉花(McCabe和Martinell,1993)、番茄(VanEck等,1995)和总体地豆类(美国专利号5,563,055,特此通过引用整体并入本文)。表达异源BADC的本发明的转基因植物可以是任何植物或藻类物种,如无油樟、深山南芥、Arabidopsisalpine、原壳小球藻、甘蓝型油菜、芜菁、Capsellarubella、莱茵衣藻、小球藻、鹰嘴豆、克莱门柚、甜橙、亚椭圆胶球藻C-169、中果咖啡、甜瓜、黄瓜、油棕、猴面花、巨桉、盐芥、欧洲草莓、黄花螺旋狸藻、大豆、向日葵、HelicosporidiumATCC50920、麻疯树、百脉根、蒺藜苜蓿、川桑、小果野芭蕉、莲、美花烟草、绒毛状烟草、菜豆、海枣、小立碗藓、北美云杉、Polytomellaparva、毛果杨、青梅、碧桃、白梨、蓖麻、江南卷柏、番茄、马铃薯、可可、葡萄或者团藻。该植物可以是R0转基因植物(即,由原始转化组织衍生的植物)。该植物还可以是R0转基因植物的任何代的后代植物,其中转基因植物具有来自R0转基因植物的核酸序列。还可以提供任何上述转基因植物的种子,特别地其中该种子包含核酸序列。另外考虑的是用上述重组载体转化的宿主细胞。在一些实施方式中,该宿主细胞是植物细胞。本文还考虑经遗传工程改造以提高BADC表达的植物,其中BADC包含SEQIDNO:2、4、6、7或138的蛋白质产物,其中蛋白质产物(例如多肽)如本文所述改变植物形态。这样的蛋白质产物可以包含适用于本发明的SEQIDNO:1、3或5,或本文所述的任何其它序列。在一个实施方式中,改变的植物形态可以是增加或减少的脂肪酸含量。这种改变的形态可以通过下调或上调本文所述的BADC基因来增加或降低ACCase活性水平来实现。这些植物在实施例中描述,并且可以用作例如商业植物。具有改变的ACCase或一个或多个BADC基因的表达的这些实施方式的植物可以是任何物种。该物种可以是任何单子叶或双子叶植物,如本文所述的那些。本领域技术人员将认识到,通过采用本文所述的方法和本领域已知的其他方法,本发明可以应用于其他物种的植物。这些系统应用于不同的植物株系取决于从原生质体再生该特定植物株系的能力。已经描述了用于从原生质体再生谷物的说明性方法(Toriyama等,1986;Yamada等,1986;Abdullah等,1986;Omirulleh等,1993和美国专利号5,508,184;各自特此全部并入作为参考)。使用谷物原生质体的直接摄取转化的实例包括水稻(Ghosh-Biswas等,1994)、高粱(Battraw和Hall,1991)、大麦(Lazerri,1995)、燕麦(Zheng和Edwards,1990)和玉米(Omirulleh等,1993)的转化。组织培养物可用于某些转化技术中以用于制备用于转化的细胞和用于由其再生植物。组织培养物的维持需要使用培养基和受控的环境。“培养基”是指用于在体外(即在完整活生物体外)生长细胞的多种营养混合物。培养基通常是大多数细胞类型生长所需的各种类别的成分(盐、氨基酸、生长调节剂、糖、缓冲剂)的混悬液。然而,每种特定的细胞类型需要特定范围的成分比例进行生长,并且需要甚至更具体范围的配方以获得最佳生长。细胞生长的速度在用允许该细胞类型的生长的多种培养基启动的培养物之间也有所不同。可在培养物中生长的组织包括分生组织细胞、I型、II型和III型愈伤组织、未成熟胚和配子细胞如小孢子、花粉、精子和卵细胞。I型、II型和III型愈伤组织可以从组织来源开始,包括但不限于未成熟胚、幼芽顶端分生组织、根、叶、小孢子等。能够作为愈伤组织增殖的那些细胞也是用于遗传转化的受体细胞。体细胞具有各种类型。胚性细胞是体细胞的一个实例,其可被诱导以通过胚形成再生植株。非胚性细胞是通常不会以这种方式反应的那些细胞。可以使用某些技术来富集细胞群体内的受体细胞。例如,II型愈伤组织发育,随后人工选择和脆弱的胚胎发生组织的培养通常会导致细胞的富集。可用于选择靶细胞的人工选择技术可包括,例如评估细胞形态和分化,或可使用各种物理或生物学手段。冷冻保存也是选择受体细胞的可能方法。A.改变植物中的基因表达根据本发明,如本文所述的基因表达的改变可以包括增加基因的表达或降低基因的表达。如本文所述,本发明可以包括改变BADC基因的表达。在一些实施方式中,提供了包括完全沉默或下调基因表达的方法。在其他实施方式中,基因的部分或不完全沉默或下调可能足以实现期望的效果。植物中基因表达的改变可以通过本领域已知的多种方法来完成。根据本发明,可以使用任何可用于改变基因或基因产物的表达的方法,包括但不限于反义、RNAi、CRISPR、TALON、纳米抗体、EMS、T-DNA或转座子介导的基因敲除,或常规诱变/靶向育种。这样的方法在本领域中是已知的。如本文所用,词语“基因抑制”旨在指用于降低由于基因转录成mRNA并随后翻译mRNA而产生的蛋白质的水平的任何众所周知的方法。基因抑制还意在指减少从基因或编码序列的蛋白质表达,包括转录后基因抑制和转录抑制。转录后基因抑制是由从靶向抑制的基因或编码序列转录的mRNA的全部或部分和用于抑制的相应双链RNA之间的同源性介导的,并且是指在细胞中可用于被核糖体结合的可得mRNA的量的显著和可测量的减少。转录的RNA可以以有义取向而实现所谓的共抑制,以反义方向而实现所谓的反义抑制,或者以两种取向,在这种情况下可以产生dsRNA以实现RNA干扰(RNAi)。根据本发明,这类方法可用于如本文所述的下调或沉默BADC基因。转录抑制通过细胞中dsRNA(基因抑制剂)的存在介导,从而显示出与DNA序列或其互补序列的显著序列同一性而导致启动子反式抑制。基因抑制可能有效对抗与性状相关的天然基因,例如以产生具有降低水平的由天然基因编码的蛋白质或具有增加或降低的受影响基因产物的水平的植物。基因产物可以包括RNA分子,包括但不限于mRNA、rRNA、tRNA、siRNA、shRNA等。基因产物还可以包括蛋白质或多肽或其片段。通过反义或有义定向的RNA调节植物细胞中基因表达的转录后基因抑制是本领域已知的,正如使用dsRNA抑制植物中的基因。植物中的转录后基因抑制可以使用稳定的(例如作为发夹结构或茎环结构)有义定向和反义定向的转录的RNA。如本文所用,术语“表达”是指源自核酸的有义或反义RNA的转录和稳定累积。“表达”还可以指将mRNA翻译成多肽或蛋白质。如本文所用,术语“反义RNA”是指与通常在细胞中产生的mRNA的全部或部分互补的RNA转录物。反义RNA的互补性可以是与特定基因转录物的任何部分,即在5′非编码序列、3′非翻译序列、内含子或编码序列上。如本文所用,术语“RNA转录物”是指由RNA聚合酶催化的DNA序列转录产生的产物。当RNA转录物是DNA序列的完美互补拷贝时,其被称为初级转录物,或者其可以是由初始转录本物转录后加工衍生的RNA序列,并被称为成熟RNA。如本文所用,短语“基因表达的抑制”或“抑制靶基因的表达”是指来自靶基因的蛋白质和/或mRNA产物水平的缺乏(或可观察的降低)。特异性是指抑制靶基因而对细胞的其他基因不表现出影响并且对正产生dsRNA分子的细胞内的任何基因没有任何影响的能力。如本文所述的对靶基因的基因表达的抑制可以导致植物中新的表型性状。III.稳定转化植物的产生与表征在实现外源DNA至受体细胞的递送后,接下来的步骤通常涉及鉴定转化的细胞用于进一步培养和植物再生。为了提高鉴定转化体的能力,人们可能希望将可选择或可筛选标记基因用于根据本发明制备的转化载体。在这种情况下,人们然后通常通过将细胞暴露于一种或多种选择剂来分析潜在转化的细胞群体,或者筛选细胞的所需标志物基因性状。据信在任何一项研究中,DNA只引入到一小部分靶细胞中。为了提供用于鉴定接受DNA并将其整合到其基因组中的那些细胞的有效系统,可以采用用于选择那些稳定转化的细胞的手段。这种方法的一个示例性实施方式是向宿主细胞中引入赋予对一些通常抑制性试剂(如抗生素或除草剂)的抗性的标记基因。可以使用的抗生素的实例包括氨基糖苷类抗生素新霉素、卡那霉素和巴龙霉素或者抗生素潮霉素。对氨基糖苷类抗生素的抗性由氨基糖苷磷酸转移酶如新霉素磷酸转移酶II(NPTII)或NPTI赋予,而对潮霉素的抗性由潮霉素磷酸转移酶赋予。然后将潜在转化的细胞暴露于选择剂。在存活细胞群体中是其中通常已经整合赋予抗性的基因并以足够的水平表达以允许细胞存活的那些细胞。细胞可以进一步测试以确认外源DNA的稳定整合。构成理想选择剂的一种除草剂是广谱除草剂双丙氨膦。在本发明实施中可用于选择转化细胞系的除草剂的另一个实例是广谱除草剂草甘膦。草甘膦抑制在芳香族氨基酸生物合成途径中有活性的酶EPSPS的作用。该酶的抑制导致氨基酸苯丙氨酸、酪氨酸和色氨酸以及由其衍生的次级代谢物的饥饿。4,535,060号美国专利描述了EPSPS突变的分离,其赋予由基因aroA编码的鼠伤寒沙门氏菌(Salmonellatyphimurium)的EPSPS上的草甘膦抗性。克隆来自玉米(Zeamays)的EPSPS基因,并在体外引入与在草甘膦抗性areA基因中发现的那些突变类似的突变。编码草甘膦抗性的EPSPS酶的突变基因描述于,例如,国际专利WO97/4103中。为了使用bar-双丙氨磷或EPSPS-草甘膦选择系统,将转化的组织在非选择性培养基上培养0-28天,并随后根据需要转移到含有1-3mg/l双丙氨膦或1-3mM草甘膦的培养基中。尽管1-3mg/l双丙氨膦或1-3mM草甘膦的范围通常是优选的,但建议0.1-50mg/l双丙氨膦或0.1-50mM草甘膦的范围会具有效用。从选择剂的暴露存活的细胞或在筛选试验中评定为阳性的细胞可以在支持植物再生的培养基中培养。在一个示例性实施方式中,可以通过包含其他物质(如生长调节剂)来改良MS和N6培养基。一种这样的生长调节剂是麦草畏或2,4-D。然而,可以使用其他生长调节剂,包括NAA、NAA+2,4-D或毒莠定。已经发现这些和类似方式的培养基改良促进了细胞在特定发育阶段的生长。可以将组织保持在具有生长调节剂的基本培养基上直到有足够的组织可用于开始植物再生工作,或者在重复轮的手动选择之后,直到组织的形态适于再生,至少2周,然后将其转移至有利于胚状体成熟的培养基。培养物在这种培养基上每两周继代。发芽将给出转移至不含生长调节剂的培养基的时间的信号。然后允许通过选择或筛选鉴定的并在支持再生的适当培养基中培养的转化细胞成熟为植物。将发育中的组培苗(plantlet)转移到无土的植物生长混合物中,并且例如,在环境可控的室中,例如在约85%的相对湿度,600ppm的CO2和25-250微爱因斯坦m-2s-1的光照下炼苗(hardened)。植物可以在生长室或温室中成熟。根据最初的组织,植物可在转化体鉴定后约6周至10个月内再生。在再生期间,细胞在组织培养容器中的固体培养基上生长。这类容器的说明性实施方式是皮氏培养皿和PlantCons。再生的植物可以生长在大约19到28℃下。再生植物达到芽和根发育的阶段后,可将其转移至温室进行进一步生长和测试。为了确认再生植物中外源DNA或“转基因”的存在,可以进行多种分析。这样的分析包括,例如,“分子生物学”分析,例如DNA和RNA印迹和PCRTM;“生物化学”分析,例如检测蛋白质产物的存在,如通过免疫学方式(ELISA和蛋白质印迹)或通过酶学功能;植物部分分析,如叶或根分析;并且还有,通过分析整个再生植物的表型。可以使用DNA杂交技术确定DNA整合到宿主基因组中的阳性证据和转化体的独立身份。使用这种技术,可以鉴定引入宿主基因组中的特定DNA序列和侧翼宿主DNA序列。因此,给定转化体的DNA杂交图谱用作该转化体的鉴定特征。此外,有可能通过DNA杂交证明在高分子量DNA中存在引入的基因,即确认引入的基因已经整合到宿主细胞基因组中。DNA杂交技术提供了使用PCRTM获得的信息,例如基因的存在,并且还证明了整合到基因组中并表征各单个转化体。PCRTM和DNA杂交技术均可用于证明转基因向子代的传递。在大多数情况下,给定转化体的特征性DNA杂交图谱将在子代中作为一个或多个孟德尔基因分离(Spencer等,1992),表明转基因的稳定遗传。尽管可以使用从植物的任何部分分离的DNA进行DNA分析技术,但RNA将仅在特定的细胞或组织类型中表达,和因此有必要从这些组织制备RNA用于分析。PCRTM技术也可用于检测和定量从引入基因产生的RNA。在PCRTM的这种应用中,首先需要使用诸如逆转录酶的酶将RNA逆转录成DNA,和然后通过使用常规PCRTM技术扩增DNA。在大多数情况下,PCRTM技术(尽管是有用的)不会证明RNA产物的完整性。有关RNA产物的性质的更多信息可以通过RNA印迹获得。这一技术将证明RNA种类的存在并提供关于该RNA的完整性的信息。也可以使用斑点或狭线印迹RNA杂交来确定RNA种类的存在或不存在。这些技术是RNA印迹的改进,并且仅证明RNA物质的存在或不存在。通常通过评估基因产物表达的表型结果来确定基因产物的表达。这些测定还可以采取许多形式,包括但不限于分析植物的化学组成、形态或生理学特性的变化。化学组成可以通过编码改变氨基酸组成的酶或存储蛋白的基因的表达来改变,并且可以通过氨基酸分析或通过改变可以通过近红外反射光谱法分析的淀粉量的酶来检测。形态变化可能包括更高或更粗壮的茎。植物或植物部分对施加的处理的响应中最通常的变化在称为生物测定的严格控制的条件下进行评估。IV.本发明的育种植物除了用根据本发明制备的构建体直接转化特定的植物基因型之外,可以通过将具有本发明的选择的DNA的植物与缺乏该构建体的第二植物杂交来制备转基因植物。例如,选择的BADC编码序列可以通过杂交被引入到特定的植物品种中,而完全不需要直接转化该给定品种的植物。因此,本发明不仅包括根据本发明直接转化的植物或者从根据本发明转化的细胞再生的植物,而且还包括这些植物的后代。如本文所用,术语“后代”表示根据本发明制备的亲代植物的任何世代的后代,其中该后代包含根据本发明制备的选择的DNA构建体。如本文所公开的,“杂交”植物以提供相对于起始植物系具有一种或多种添加的转基因的植物系被定义为通过使起始株系植物与含有本发明转基因的供体植物系的植物杂交而导致本发明的转基因被引入植物系中的技术。要实现这一点,可以执行例如,以下步骤:(a)种植第一(起始株系)和第二(包含本发明转基因的供体植物株系)亲本植物的种子;(b)使第一和第二亲本植物的种子生成成带花的植物;(c)用来自第二亲本植物的花粉给来自第一亲本植物的花授粉;知(d)收获在带有受精花的亲本植物上产生的种子。本文中将回交定义为包括以下步骤的过程:(a)将含有所需基因、DNA序列或元件的第一基因型的植物与不含所需基因、DNA序列或元件的第二基因型的植物杂交;(b)选择一个或多个含有所需基因、DNA序列或元件的后代植物;(c)将后代植物与第二基因型的植物杂交;和(d)为了将所需的DNA序列从第一基因型的植物转移到第二基因型的植物,重复步骤(b)和(c)。将DNA元件渗入植物基因型中被定义为回交转化过程的结果。DNA序列已经被渗入其中的植物基因型可以称为回交转化的基因型、品系、近交系或杂交系。类似地,缺乏所需DNA序列的植物基因型可以称为未转化的基因型、品系、近交系或杂交系。V.定义如本文所用,登录号AT3G56130、AT1G52670和AT3G15690分别意指BADC1、BADC2和BADC3。如本文所用,α-CT是指AT2G38040;β-CT是指ATCG00500;BC指的是AT5G35360;BCCP1是指AT5G16390;BCCP2是指AT5G15530;BADC1是指AT3G56130;BADC2是指AT1G52670;和BADC3是指AT3G15690。内源性的:在宿主细胞或相同物种的细胞中天然存在的序列。在一个实施方式中,内源性序列可以过表达或与野生型相比以更高的水平表达,并且仍被认为是内源性的。表达:通过编码DNA分子(如结构基因)发生以产生多肽的细胞内过程(包括转录和翻译)的组合。遗传转化:将DNA序列或构建体(例如载体或表达盒)引入其中该外源DNA被整合到染色体中或能够自主复制的细胞或原生质体中的过程。异源性的:在目前发现该序列的遗传背景的给定宿主基因组中正常情况下不存在的序列。在这方面,该序列对于宿主基因组来说可以是原有的,但是相对于宿主序列内的其他基因序列重排。例如,调控序列可以是异源的,因为它相对于天然调控序列与不同编码序列连接。另外,特定的序列对于其中它被引入的细胞或生物体可以是“异源的”(例如,在该特定细胞或生物体中不天然存在的序列)。获得:当与转基因植物细胞或转基因植物一起使用时,获得意指转化非转基因植物细胞或植物以产生转基因植物细胞或植物,或者种植转基因植物种子以产生转基因植物细胞或植物。这种转基因植物种子可以来自R0转基因植物,或者可以来自从起始转基因亲本植物遗传给定的转基因序列的其任何世代的后代。启动子:DNA序列或DNA序列组上的识别位点,其为结构基因提供表达控制元件,且RNA聚合酶特异性地与其结合并启动该基因的RNA合成(转录)。R0转基因植物:已被遗传转化的植物或从已被遗传转化的植物细胞或细胞再生的植物。再生:从植物细胞(例如,植物原生质体、愈伤组织或外植体)生长植物的过程。选择的DNA:人们希望通过遗传转化引入或已经被引入植物基因组中的DNA片段。转化构建体:经设计用于通过遗传转化引入宿主基因组中的嵌合DNA分子。优选的转化构建体将包含指导一个或多个外源基因的表达所必需的全部遗传元件。在本发明的具体实施方式中,可能需要以表达盒的形式将转化构建体引入宿主细胞中。转化细胞:其中通过将外源DNA分子引入细胞中而改变了DNA互补的细胞。转基因:已经整合到宿主基因组中或能够在宿主细胞中自主复制并且能够引起一个或多个编码序列的表达的DNA片段。示例性的转基因将为宿主细胞或从其再生的植物提供相对于相应的未转化的细胞或植物的新表型。转基因可以通过遗传转化直接引入植物中,或者可以从用DNA片段转化的任何前代植物遗传。转基因植物:植物或由其衍生的任何后续世代的后代植物,其中所述植物或其后代的DNA含有引入的外源DNA片段,所述外源DNA片段不天然存在于相同株系的非转基因植物中。转基因植物可另外包含对转化植物而言天然的序列,但其中“外源”基因已被改变以改变基因表达的水平或模式,例如通过使用一个或多个异源调控或其他元件。载体:为转化至宿主细胞中而设计的DNA分子。一些载体可能能够在宿主细胞中复制。质粒是示例性的载体,由其分离的表达盒也是如此。本文的描述本质上仅仅是示例性的,因此,不脱离所描述的主旨的变化意在属于本教导的范围内。这些变化不被认为是背离本教导的精神和范围。实施例包括以下实施例以说明本发明的优选实施方式。本领域技术人员应该理解,在实施例中公开的技术遵循发明人所公开的代表性技术,在本发明的实施中发挥了良好作用,并且因此可以被认为构成用于其实施的优选模式。然而,根据本公开,本领域技术人员应该理解,可以在所公开的特定实施方式中做出许多改变,并且仍然获得相似或类似的结果而不脱离本发明的精神和范围。实施例1两种新蛋白(BADC1和BADC2)与hetACCase共免疫沉淀为了发现未知的与hetACCase的蛋白质相互作用剂,进行定量共免疫沉淀(co-IP)分析。将野生型拟南芥(生态型-Columbia-0)在长日照(16小时,23℃,50%湿度,50pmol/m-2s-1)和短夜(8小时,20℃,50%湿度)条件下在生长室中生长。为了进行共免疫沉淀研究,用潮湿的土壤(SunshineMix#6,SunGroHorticulture)填充8.5em×8.5em的罐,用筛子(1mm2孔径)覆盖并用种子包被。为了来自拟南芥幼苗的hetACCase的共免疫沉淀,在光照1小时后从大约10g的14-日龄的拟南芥幼苗分离粗叶绿体。使用Waring搅拌器将新鲜叶子在冰冷的研磨缓冲液(50mMHEPES-KOHpH8.0,330mM山梨糖醇,1.5mMMnCl2,2mMMgCl2,2mMEDTA,0.1%(w/v)BSA)中匀浆。将匀浆通过两层Miracloth过滤并在4℃下以2,600g离心20分钟。在冰冷的裂解缓冲液(50mMHEPES-KOHpH8.0,10%(v/v)甘油,0.5%(v/v)TritonX-100)中将叶绿体裂解30分钟。将裂解物在Dounce匀浆器中在冰上均质化10次,然后在4℃下以30kg离心20分钟。然后,将1mL的30kg上清液加入到未包被(对照)或用对α-CT、BCCP、BADC1或BADC2特异性的抗体包被的25μL蛋白A-琼脂糖珠(SigmaAldrich)中。在4℃下伴随温和混合进行共免疫沉淀(co-IP)3小时。用1mL冰冷的裂解缓冲液将珠子洗涤两次,并通过加入30μL的6x的SDS样品缓冲液(350mMTris-HCl,pH6.8,350mMSDS,30%(v/v)甘油,100mM二硫苏糖醇,2.5mM溴酚蓝)洗脱沉淀的蛋白质并在65℃下加热10分钟。在10%SDS-PAGE凝胶上解析洗脱的蛋白质用于进行Western和质谱分析。如上面详细描述的,将来自14-日龄的拟南芥幼苗的澄清的叶绿体裂解物与用BCCP2或α-CT的多克隆抗体包被的蛋白A-琼脂糖珠一起孵育。使用未涂布的珠进行对照沉淀。通过胰蛋白酶消化的肽的LC-MS/MS分析鉴定沉淀的蛋白质。对于质谱法,样品制备和分析如下。通过10%SDS-PAGE解析来自co-IP的沉淀蛋白质,并用胶体考马斯亮蓝(CBB)G-250染色。将每条泳道分离成0.5em的片段,并随后切成约1mm3的凝胶块。凝胶块用测序级胰蛋白酶消化,并根据本领域已知的方法提取肽。将胰蛋白酶化的肽冻干并于-20℃下储存直至通过液相色谱-串联质谱(LC-MS/MS)分析。如前所述制备冻干的肽用于质谱分析。根据Swatek等人(BiochemJ459(1):15-25,2014),在LTQOrbitrapXLETD(ThermoFisherScientific)上分析样品,除了肽使用30分钟乙腈梯度(5-43%乙腈)洗脱,选择来自前体扫描的前8个质量进行数据依赖性采集,并且使用CID(碰撞诱导解离)将前体离子片段化。使用以下设置实现动态排除:重复计数,3;重复持续时间,30秒;排除列表,50;和排除列表持续时间,30秒。获取的谱图针对TAIR10蛋白质数据库(70,773条目,于2012年11月6日下载)进行检索,连接至随机TAIR10数据库作为诱饵。SEQUEST的检索参数设置是半胱氨酸-羧基酰胺甲基化的静态修饰和甲硫氨酸氧化的可变修饰。SEQUEST的其他检索参数设置包括两个缺失的胰蛋白酶切割位点,绝对阈值:1000,最小离子计数:10,质量范围:650-3500,和分别1Da和1000ppm的母体和碎片离子容差。将检索结果文件加载到ProteomeDiscoverer1.3(ThermoFisherScientific)中。使用以下标准将鉴别的肽过滤至<1%的错误发现率:10ppm肽质量偏差,′Xcorr对电荷状态′,以及分别对于co-IP和2DBN-SDSPAGE的2和1的肽最小值。蛋白质分组也能够实现。使用谱计数手动计算错误发现率。通过ProteomeDiscoverer1.3对于每个生物学重复产生的文件被输出到MicrosoftExcel中作进一步分析。将从SEQUEST检索鉴别的蛋白质与已经以与hetACCase亚基co-IP相同的方式处理的未包被的Sepharose珠对照进行比较。仅在hetACCase亚基co-IP中鉴定的蛋白质被认为是推定的相互作用客体。忽略所有其他蛋白质。从未在对照中鉴定到hetACCase亚基。这些co-IP的定量质谱分析揭示了ACCase的所有四种已知亚基和两种注释为“含生物素/硫辛酰连接结构域”(BADC)蛋白的未知蛋白质。从α-CTco-IP的七个生物学重复中,鉴定了整个hetACCase复合物。同样,所有亚基(除了β-CT外)用BCCP2的抗体从co-IP鉴定(图1A和1B)。正如所预期的,在BCCP2和α-CTco-IP中BC/BCCP和α/β-CT子复合体的丰度分别相对较高。此外,从两个co-IP鉴定出具有“含生物素连接结构域”区域的两种未知蛋白质,以下称为BADC1(AT3G56130)和BADC2(AT1G52670)。BADC1蛋白分别存在于BCCP2和α-CTco-IP的七个和一个重复中,而BADC2分别存在于BCCP2和α-CTco-IP的六个和两个重复中。这些蛋白质的标准化的相对丰度与来自两种co-IP分析的α-和β-CT相比与BC和BCCP的丰度更相称。使用对BADC1和BADC2特异性的抗体的交互co-IP沉淀了两种BCCP异形体(图1C和1D)。因此,BADC1和BADC2表现为与hetACCase的BC/BCCP组分相互作用。实施例2重组蛋白的表达和纯化以及免疫印迹通过PCR从cDNA克隆(ABRC)扩增BCCP1、BCCP2、BADC1、BADC2和BADC3的ORF。用于这些扩增的引物对与酵母双杂交构建体形成中使用的那些引物对相同(图2)。如通过TargetP所预测的,这些引物被设计成去除转运肽。将所有五种基因的扩增ORF克隆到表达载体pET28a或pET11a中,分别产生N-末端His-标记的融合蛋白或未标记的重组蛋白。所有构建体都通过DNA测序进行序列确认。然后将构建体转化到大肠杆菌菌株BL21(B2685:Sigma)中。从转化的BL21细胞表达和纯化重组蛋白质(如Swatek等,JProteomeRes10(9):4076-4087,2011中所述)。对于共表达研究,使用~200ng的每种质粒转化BL21细胞。将通过SDS-PAGE解析的蛋白质转移至PVDF膜上,并在4℃下用合适的第一抗体染色过夜以用于蛋白质印迹分析。所有抗体以PBS-T(10mMNaH2PO4-NaOHpH7.2,150mMNaCl,0.3%(v/v)吐温20)中的1∶5000稀释使用。本研究中使用的hetACCase抗体来源于用重组豌豆(P.sativum)α-CT、重组拟南芥BCCP2或重组拟南芥BADC1免疫的兔子。将印迹在PBS-T中冲洗两次并在室温下在二抗中探测1小时并显影。与碱性磷酸酶偶联的山羊抗兔IgG二抗获自Sigma-Aldrich(St.Louis,MO)。实施例3正交方法证实了来自南芥的三种BADC和两种BCCP异形体之间的直接相互作用酵母双杂交构建体设计。将目的基因的ORF插入到诱饵和猎物载体PGBKT7和pGADT7中。如由TargetP预测的,引物被设计成从编码区排除转运肽(图2)。基因从南芥生物资源中心(ArabidopsisBiologicalResourceCenter)获得的cDNA克隆扩增。首先将扩增子插入ZeroBluntTOPO载体(LifeTechnologies)中,并通过DNA测序检查错误。然后将无错误的扩增子亚克隆到pGBKT7或pGADT7载体中。将完成的构建体转化到感受态DH5α细胞中。将用pGBKT7和pGADT7转化的细胞分别在含有50pg/mL卡那霉素(Kan)和100pg/mL氨苄青霉素(Amp)的LB培养基琼脂平板上生长。质粒使用Q1AprepSpinMiniprep试剂盒(Qiagen)从5mL阳性集落培养物纯化。为了证实co-IP结果并确定哪个hetACCase亚基直接与BADC1和BADC2相互作用,使用乙酸锂方法的适应来进行靶向酵母双杂交分析。用100ng诱饵和猎物载体转化菌株AH109酵母。将沉淀的转化细胞重悬于300μL无菌水中。将等份的100μL细胞悬浮液涂布在不含亮氨酸、色氨酸和组氨酸的合成营养缺陷型(syntheticdropout)(SD)培养基上。平板在30℃下孵育4天和然后成像。所显示的图像代表至少三个重复研究。除了两个实验鉴定的BADC之外,还测试了第三个推定的BADC异形体,称为BADC3(AT3G15690),其通过拟南芥基因组的BLAST问询鉴定。该蛋白质与BADC2具有61%的氨基酸同一性,表明它可能具有相似的功能。基于酵母双杂交分析,三种BADC蛋白中的每一种都与每种BCCP异形体相互作用。如图3A中所示,用含有所示基因的诱饵和猎物构建体转化菌株AH109酵母。阴性对照显示最少或没有生长。使用Sv40和p53作为阳性对照。将转化的酵母接种在缺乏Trp、Leu和His的培养基上。显示的结果代表三个生物学重复。此外,每种BADC异形体彼此相互作用。为了进一步评估BADC和BCCP之间的相互作用,在大肠杆菌中将拟南芥BCCP1与三种拟南芥BADC蛋白中的每一种共表达。在这些研究中,BADC或BCCP1蛋白中任一个与His6标签一起表达,而另一个不含亲和标签。当通过Ni2+-NTA亲和色谱纯化Hiss-标记的蛋白质时,相应的“未标记的”蛋白质存在于相同的洗脱级分中。在图3B中,考马斯染色的凝胶显示来自大肠杆菌的Ni2+-NTA纯化蛋白的洗脱级分。在右侧,天然蛋白质与His6标记的蛋白质共表达。在左侧,天然蛋白质单独表达。只有当与His6标记的蛋白质共表达时,天然蛋白质才强烈存在于洗脱级分中。通过LC-MS/MS确认蛋白质身份。进行这些研究以测试BADC蛋白是否可以直接与ACCase相互作用。结果证实BADC蛋白通过与BCCP和BC亚基的直接相互作用而与ACCase结合。作为对照,证实未标记的蛋白质不能与亲和柱结合。使用该系统,观察到拟南芥BC和BADC3也被共纯化,表明BADC3以及很可能BADC1和2也可以与BC相互作用。这些研究证实BADC异形体直接与hetACCase的BCCP和BC亚基相互作用。实施例4生物素不是BADC-BCCP相互作用需要的为了确定BCCP-BADC相互作用是否涉及生物素辅因子,如先前对于PII与hetACCase相互作用报道的,通过定点诱变将BCCP1上的生物素基Lys245残基突变为Arg。该突变阻止BCCP1的生物素化。使用这种′apo-BCCP1′,用BADC重复酵母双杂交和共表达分析。显示所有BADC异形体与apo-BCCP1相互作用。实施例5重组AtBADC1和AtBADC3通过二硫键形成同二聚体先前对大肠杆菌BCCP的分析表明,该亚基在体内形成功能性同二聚体。通过纯化的重组BCCP2的完整质量分析,观察到植物BCCP也可以形成同二聚体。此外,重组BADC的分析显示BADC1和BADC3,但不是BADC2,可以形成同二聚体。观察到的每个BADC的单体大小与预测的质量一致,表明这些蛋白质未被修饰。在不存在DTT的情况下,纯化的重组BCCP2、BADC1和BADC3在通过SDS-PAGE变性和解析时显示出单体和二聚体条带。重组BADC2仅显示单体条带。增加DTT浓度导致二聚体条带消失,表明二硫键参与BADC和植物BCCP的二聚体形成。实施例6BADC类似于BCCP,但不是生物素化的三种BADC异形体与来自拟南芥的两种BCCP异形体共有许多特征。首先,这些蛋白质含有典型的质体靶向肽,并基于生物信息学预测、co-IP和蛋白质印迹研究进行质体定位。其次,BADC异形体与BCCP异形体共有24至29%的氨基酸同一性(图4)。最后,BADC和BCCP蛋白的结构预测(图5)显示了类似的具有特征性“拇指基序(thumbmotif)”的3-折叠二级结构(3-sheetsecondarystructure),如先前针对大肠杆菌BCCP所观察到的。完整质量分析显示BADC蛋白能够形成同二聚体。尽管有这些相似之处,BADC蛋白缺乏典型的生物素化基序。如图6A所示,拟南芥BCCP1和BCCP2及BADC蛋白(BADC1、BADC2和BADC3)的C末端的比对显示多个保守残基(以黑体显示)。BCCP1/2中含生物素基赖氨酸的典型生物素化基序在序列比对的第1行和第2行加框显示。比对比较表明BADC蛋白类似于BCCP异形体但缺乏典型的生物素化基序。四肽(AlaNal)-Met-Lys-(Met/Leu)是已知的生物素化基序,和通常位于距离C末端的34或35个残基处。然而,BADC蛋白在位于C末端附近的类似(Val/Ile)-(LeuNal)-Lys-(Leu/Ile)基序中具有保守的Lys残基,这表明非典型生物素化基序的可能性。为了测试这种可能性,纯化在大肠杆菌表达的重组BADC蛋白和来自拟南芥幼苗的天然BADC1蛋白,并使用生物素特异性抗体探测生物素化。如图6B所示,基于使用生物素特异性抗体对重组南芥蛋白的蛋白质印迹分析,观察到BCCP2是生物素化的,而BADC则不是。如图6C所示,其是来自南芥幼苗的体内免疫沉淀BADC1的蛋白质印迹分析,用BADC1特异性抗体的印迹沉淀显示样品中存在BADC1,而用生物素特异性抗体的印迹没有显示对BADC1的识别。这些研究的结果证实BADC蛋白在体内没有生物素化,尽管BCCP对照明显是生物素化的。实施例7BADC直系同源物存在于绿藻和陆地植物中,但不存在于细菌中。BADC直系同源物的鉴定和共现分析(co-occurrenceanalysis)表明BADC首先出现在红藻中。直接BADC-BCCP相互作用的证据表明BADC功能与hetACCase相关联。如果这是真的,拟南芥BADCs的直系同源物(AtBADC)预计将仅存在于含有hetACCase的生物体中,但不是在真核生物中占主导地位的同聚形式。为了搜索AtBADC直向同源蛋白的存在,使用每个AtBADC的初级序列来检索KEGG序列相似性数据库。推定的直系同源物通过针对拟南芥蛋白质组的交互BLAST检索来确认。所有AtBADC直系同源物均缺乏BCCP中发现的保守生物素基赖氨酸。在78种不同陆地植物物种和藻类中鉴定了AtBADC的直系同源蛋白(表1)。使用鉴定的AtBADC直系同源物的全长蛋白质序列来产生最大可能性系统发育树。所有携带推定的AtBADC直系同源物的物种也含有异聚形式的ACCase。在仅含有同聚ACCase的生物体中未检测到直系同源物。另外,在也含有hetACCase的原核生物中未检测到AtBADC直系同源物。在藻类而不是原核生物中直系同源物的存在表明BADC首先出现在藻类中。为了确定BADC是否来自先前在藻类中起作用的BCCP,进行了共现分析。除了两种红藻和Cyanophoraparadoxa外,所有物种都含有AtBCCP和AtBADC直系同源物。在红藻中,只有一种推定的AtBADC1直系同源物(GenBankID:XP_005708748.1)在Galdieriasulphuraria物种中被鉴定。该蛋白与AtBADC1和AtBADC2共有相同数量的相同的(31个)和相似的(46个)氨基酸残基,以及与AtBADC3共有30个相同和44个相似的氨基酸残基。然而,BLAST检索将最高评分赋予AtBADC1。此外,在红藻物种皱波角叉菜(Chondruscrispus)和Cyanidioschyzonmerolae中鉴定到两种推定的BCCP蛋白质,其缺少生物素基序残基但与AtBADC相比具有更高的与AtBCCP2的序列相似性(分别XP_005535248.1和GenBankIDXP_005715802.1),其表明BADC源自于红藻中的BCCP基因重复和失能突变。从这一观察结果来看,似乎不仅BADC和BCCP相关,而且这些蛋白质之间的分支点出现在红藻中,特别是因为更原始的灰胞藻门植物不含AtBADC直系同源物。如果BADC蛋白是乙酰-CoA羧化酶而不是其他酰基-CeA羧化酶独有的,则BADC蛋白直系同源物将仅在含有hetACCase的植物进化枝中被发现。为了检索包含BADC直系同源物的物种,使用来自拟南芥的每个BADC的一级序列进行PSI-BLAST。推定的直系同源物通过针对拟南芥蛋白质组的交互BLAST检索来确认,并且所有推定的BADC都人工确认为缺少保守的生物素基赖氨酸。图7显示了含有所有三种BADC的直系同源物的物种的系统进化树。拟南芥BADC的直系同源物仅在双子叶植物、非禾本科单子叶植物和绿藻中观察到。该家族的基础成员,BADC3,可以追溯到绿藻。所有这些植物进化枝都含有hetACCase。在原核生物或禾本科单子叶植物中未检测到BADC直系同源物,后者仅含有ACCase的同聚形式。实施例8BADC3表达降低温度敏感的大肠杆菌突变体中的hetACCase活性由于它们与BCCPs相似但缺乏保守的生物素化基序,BADCs可以是hetACCase活性的负调控因子。由于大肠杆菌含有hetACCase但缺乏BADC直系同源物,因此该系统适用于测试该理论。进行大肠杆菌accb菌株L8中的体内生长测定以评估BADC蛋白对hetACCase活性的潜在影响。该菌株在BCCP基因(accB)中含有温度敏感性(Ts)突变,其阻止从头FAS。因此,当缺乏外部脂肪酸源时,37℃下的细胞生长与hetACCase活性直接相关。在仅含有葡萄糖和甘油作为碳源的基本培养基中进行实验。简而言之,从大肠杆菌遗传库存中心(Yale,NewHaven,CT)获得温度敏感性(Ts)L8菌株大肠杆菌,并使用热休克方法用文中的载体转化。通过抗生素抗性选择转化体并通过PCR确认。在生长实验之前,培养物在30℃下在LB培养基中生长过夜。将过夜培养物以3,000g离心并重悬于5mL无菌去离子水中。将培养物再次离心并重悬于M63基本培养基中以使OD600=3.75。然后将200μL细胞悬液加入15mL无菌培养管中的7mLM63培养基加抗生素中。在T=0时,培养物含有各自50μg/mL的Kan和Amp(如果需要)以及1μM异丙基β-D-1-硫代吡喃半乳糖苷。为了补偿Ts表型,将天然大肠杆菌BCCP(EcBCCP)基因在诱导型pET28a载体中克隆到L8细胞中。在缺乏脂肪酸的培养基中诱导的EcBCCP表达在37℃拯救细胞生长,而空载体对照显示最小的生长。在图8A中,生长曲线显示L8大肠杆菌细胞随时间的光密度。转化的L8细胞的培养物在不含脂肪酸的情况下在37℃下M63液体培养物中生长。转化的细胞含有下列载体:空白pET28a(EV28a)、含大肠杆菌BCCP基因的pET28a(EcBCCP)、空pET11a(EV11a)和/或含AtBADC3基因的pET11a(BADC3)。在T=0h,光密度为0.15,并用1μMIPTG诱导蛋白质表达。EV对照细胞在37℃下显示出最小的生长,而重新引入天然EcBCCP补偿温度敏感表型。除了在T=10h,单独的BADC3表达与EV对照相比没有统计学差异,而BADC3与EcBCCP的共表达显示出与单独的EcBCCP相比,在多个研究中生长减少约75%。显示的结果代表三个独立的研究。误差棒代表标准偏差。以相同的方式,将拟南芥BADC3基因克隆到L8细胞中,并且不能补偿Ts表型。在多个重复中BADC3与EcBCCP的共表达使EcBCCP表达的补偿效应降低了71至74%。用标记的BADC3的亲和力下拉试验证实抑制作用是通过与EcBCCP的相互作用介导的。图8B显示Ni2+-NTA纯化的His6-BADC3的考马斯蓝染色和抗-生物素蛋白印迹。蛋白质印迹显示EcBCCP蛋白与His6-BADC3共纯化,表明其对ACCase活性的直接作用。实验证明BADC蛋白表达对大肠杆菌生长具有负面影响。体内BADC3与EcBCCP的共同结合证实该生长表型是由于BADC3直接抑制hetACCase活性。实施例9重组BADC抑制植物hetACCase活性为了测试BADC是否也可以抑制植物hetACCase,在10日龄的拟南芥长角果提取物上进行酶活性测定。通过测量H14CO3在酸稳定的产物中的掺入,在10日龄长角果中体外监测hetACCase的活性。在光暴露6小时后收获拟南芥WTCol-010日龄长角果。在每个试验中,测定三个长角果的四个生物学重复。在匀浆缓冲液(20mMTES,pH7.5,10%甘油,5mMEDTA,2mMDTT,2mM苯甲脒,2mMPMSF,1%TritonX-100)中碾碎长角果,以10kg离心15s,并在收获的5分钟内测定以最小化hetACCase活性的损失。在存在10μM的氟吡甲禾灵(haloxyfop)下进行测定以抑制同聚ACCase活性。从(+)乙酰-CoA试验减去(-)乙酰-CoA对照的酶活性值以确定真正的hetACCase活性水平。在加入长角果裂解物之前,将纯化的重组蛋白加入到测定管中。在存在10μM纯化的重组BADC1、BADC2、BADC3、BCCP2或BSA下进行测定并与缓冲液对照(WT)进行比较。四个生物学重复的平均值显示,所有三种BADC抑制hetACCase活性25%至37%,而BCCP2和BSA没有显示出效果(图9)。除了大肠杆菌表达结果(图8A)之外,这些结果证实BADC可以负面影响hetACCase活性。实施例10BADC和hetACCase亚基的表达谱对光的反应不同在光暴露时,光合细胞中HetACCase活性增强。在10日龄拟南芥长角果中监测BADC和核编码的hetACCase亚基的绝对转录物水平以测定光对基因表达的影响。在黑暗适应或暴露于不同长度的光后收获长角果。来自这些样品的RNA提取物的定量PCR分析显示对hetACCase的每个核编码的催化亚基的基因表达响应于光而显著增加。6小时后,BCCP1、BCCP2和α-CT的表达增加约15倍,而BC表达增加35倍(图10A)。相比之下,BADC1和BADC2表达减少约10倍,而BADC3表达增加了8倍。尽管BADC异形体中存在相互冲突的变化,但在光暴露6小时后总BADC转录物水平降低了一半(图10B)。总BADC∶BCCP转录物比率在光暴露之前为约9∶1,和然后在光暴露6小时后转变为几乎1∶4(图10B),表明在黑暗中BADC蛋白水平相对高于BCCP蛋白水平,在光中反之亦然。这些数据进一步支持了BADC基因是ACCase的负调控因子的假设。实施例11拟南芥种子中的油产生响应于沉默BADC1基因而增加本发明人进一步设计了植物内原位实验以证实沉默BADC蛋白质表达对拟南芥中的ACCase活性具有正向作用,并导致脂肪酸产生的增加。产生RNAi盒(SEQIDNO:7)并转化到野生型植物中以沉默拟南芥中的BADC1表达。靶向AtBADC1的反向重复序列被插入到pMU103载体中。该重复序列编码cDNA序列的碱基774至1034(登录号AT3G56130.1)。用于扩增序列的引物是5′-GTGTTAGTCACATCTCCCGCAGT-3′(SEQIDNO:154)和5′-GATGTTGATGTCGTGGAAAGATGGC-3′(SEQIDNO:155)。使用浸花法将序列确认的构建体转化到拟南芥生态型Col-0中。使用Basta除草剂筛选鉴定独立系。RNAi盒的表达由大豆球蛋白启动子驱动。为了监测种子油含量,将来自每个独立系的T2植物与野生型植物一起生长至成熟。收获干种子用于分析。收集并分析T3代中的脂肪酸含量以显示增加的油产量。如Li等人(Phytochemistry67,904-915,2006)所述的,将种子油衍生化。十七烷酸被用作内标。通过HewlettPackard6890气相色谱系统分析FAME。对于WT和每个独立系,分别分析来自13个和4个植物的5mg种子。在分析之前将种子在干燥剂上干燥一周。图11说明了(在拟南芥种子中)的油产量响应于BADC1基因的沉默而增加。已经分析了含有BADC1RNAi盒的26个独立拟南芥品系以及野生型的总种子油含量。条形图显示平均含有较高种子油含量的27个株系中的22个较高。星号表示统计学显著性(*,P<0.05,**,P<0.01)。在26个系中,8个系表现出统计学上较高的种子油含量,增加了7.7%至11.7%,其列于表2中。表2.具有统计学上较高的种子油含量的T3系植物系P值从野生型的百分变化5-10.00611.715-10.00011.524-50.00810.914-10.00110.38-10.0059.425-40.0059.118-10.0407.97-20.0237.7种子油含量分析显示在六个独立的T2系中的三个中油的显著增加(图12A)。此外,整个长角果组织的RT-PCR分析显示在含有显著较高种子油的三个系中平均约22%的BADC1转录水平的显著降低(图12B)。使用RNeasyPlantMiniKit(Qiagen)从10日龄长角果提取用于RT-PCR和qPCR分析的RNA。从四个生物学重复的500ngRNA合成cDNA。用于分析中的引物是:BADC1有义,5′-GCTCCTAGCCCATCTCAAGC-3′(SEQIDNO:156);BADC1反义,5′-TCCAGATGCCTCCAAAGCAG-3′(SEQIDNO:157);肌动蛋白8有义,5′-CCAGATCTTCATCGTCGTGGT-3′(SEQIDNO:158);肌动蛋白8反义,5′-ATCCAGCCTTAACCATTCCAGT-3′(SEQIDNO:159)。在ABI7500系统(AppliedBiosystems)上进行qPCR分析。反应体积为20μL,并含有SYBRGreenPCRMasterMix(AppliedBiosystems)。对照反应不含模板并一式三份进行。通过解链曲线分析证实扩增子的身份。对于qPCR分析,使用已知浓度的系列稀释扩增子的标准曲线计算绝对转录物量。部分沉默在一定程度上是由于使用整个长角果组织而不是分离的种子进行RT-PCR分析。这些结果表明BADC蛋白是hetACCase的负调控因子。实施例12拟南芥(Arabidopsisthaliana)种子发育过程中BADC和ACCase基因的基因表达水平图13A显示拟南芥种子发育过程中BADC和ACCase基因的基因表达水平(ComprehensiveSystemsBiology项目,csbdb.mpimp-golm.mpg.de)。尽管所有三种BADC蛋白在种子灌浆过程中表达,但BADC2在这些时间点显示出最高的表达。图13B显示了在种子发育期间大豆中BADC和ACCase基因的基因表达水平(SoybaseDatabase,soybase.org)。在该物种中,BADC1直系同源物在种子中最高表达,而BADC3表达相对较低并且BADC2不存在。因此,BADC1的RNAi沉默最可能增加大豆种子中的ACCase活性。尽管如此,在大多数植物中存在多个BADC基因表明,由于基因补偿的可能,多拷贝的靶向基因沉默(即特异性启动子)可能是获得ACCase活性且因此油产量的最大增加所必需的。实施例13BADC1对ACCase活性的剂量依赖性抑制如图14所示,在20天龄的拟南芥叶提取物中用增加浓度的重组BADC1体外监测ACCase活性。对于每个实验确定比活性,并将0μM对照标准化为1。对照的比活性值范围为0.84-2.00nmol/min/mg。每个数据点代表四个生物学重复的平均值,每个生物学重复由四个光适应的叶组成。数据拟合多项式曲线,其中R2=0.987。在这些条件下,BADC1的Ki被确定为约4.3μtM。还进行SDS-PAGE分析以证明测定中使用的重组BADC1蛋白的纯度。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于光电器件的二萘嵌苯四羧酰亚胺衍生物的制作方法
- 新的乙酰辅酶a羧化酶(acc)抑制剂及其在糖尿病、肥胖症和代谢综合征中的应用的制作方法
- 新的乙酰辅酶a羧化酶(acc)抑制剂及其在糖尿病、肥胖症和代谢综合征中的应用的制作方法
- 用于治疗神经元代谢减退的乙酰coa羧化酶抑制剂的制作方法
- 制备5-(二羧酰亚氨基)乙酰丙酸烷基酯和4-氧-戊烯酸烷基酯的方法
- 乙酰辅酶a羧化酶剪接变体及其用途的制作方法
- 1-[间-羧酰氨基(杂)芳基-甲基]-杂环基-甲酰胺衍生物的制作方法
- 新的乙酰辅酶a羧化酶(acc)抑制剂及其在糖尿病、肥胖症和代谢综合征中的应用的制作方法
- 一种多肽——CoA羧化酶41和编码这种多肽的多核苷酸的制作方法
- 作为乙酰辅酶a羧化酶(acc)抑制剂的螺苯并二氢吡喃-4-酮的制作方法