用于生产发酵产物的方法与流程
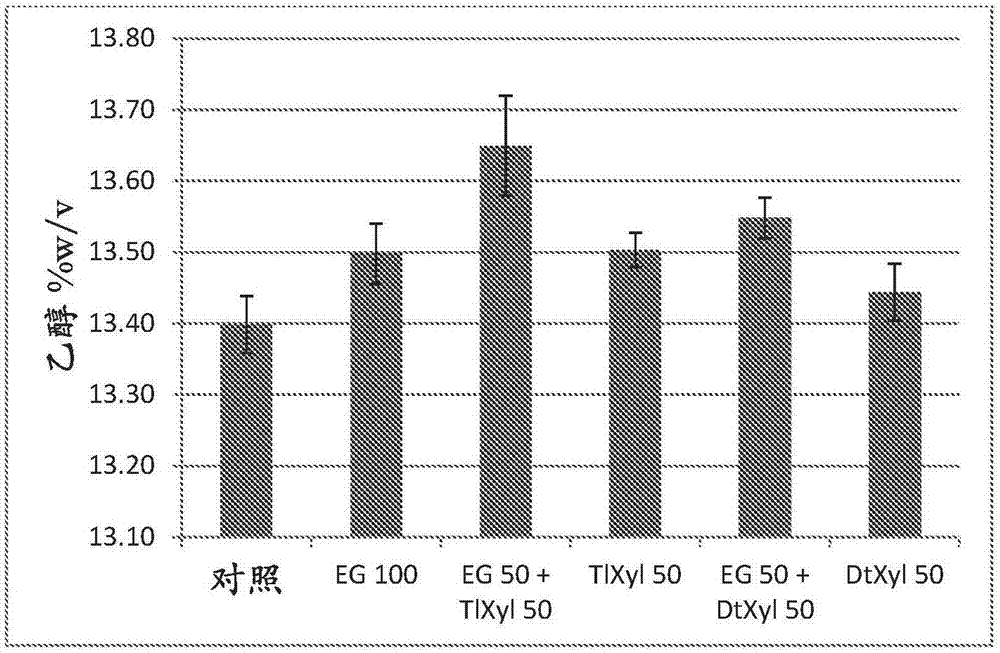
本发明涉及用于从含淀粉材料生产发酵产物(尤其是乙醇)的方法。本发明还涉及适合于在本发明的方法中使用的组合物,以及本发明的组合物的用途。序列表的引用本申请含有计算机可读形式的序列表。将该计算机可读形式通过引用结合在此。发明背景从含淀粉材料生产发酵产物,例如,乙醇,是本领域中熟知的。目前在工业上使用两种不同种类的方法。最常使用的方法通常被称作“传统方法”,包括在高温下典型地使用细菌α-淀粉酶液化经糊化的淀粉,随后在葡糖淀粉酶和发酵生物体的存在下进行同时糖化和发酵。另一种众所周知的方法通常被称作“生淀粉水解”-方法(RSH方法),包括典型地在至少一种葡糖淀粉酶的存在下在低于初始糊化温度进行颗粒淀粉的同时糖化和发酵。尽管在过去几十年中发酵产物生产发生了显著改善,但是显著量的残余淀粉材料未被转化为所希望的发酵产物,例如乙醇。因此,仍然存在对于提供用于从含淀粉材料生产发酵产物,例如,乙醇的方法的希望和需求,这些方法可以提供更高的发酵产物得率,或与传统方法相比的其他优点。技术实现要素:本发明涉及使用发酵生物,从含淀粉材料生产发酵产物(如尤其是乙醇)的方法。本发明还涉及用于本发明的方法中的组合物。在第一方面,本发明涉及用于从含淀粉材料生产发酵产物(如优选地乙醇)的方法,该方法包括以下步骤:i)在高于初始糊化温度的温度(优选地在80℃至90℃之间),使用以下液化该含淀粉材料:-α-淀粉酶,如细菌α-淀粉酶;-具有大于80℃熔点(DSC)的半纤维素酶,优选地木聚糖酶;-任选地,具有大于70℃熔点(DSC)的内切葡聚糖酶;ii)使用产碳水化合物源的酶进行糖化;iii)使用发酵生物进行发酵。在优选的实施例中,半纤维素酶是木聚糖酶,特别是GH10木聚糖酶或GH11木聚糖酶。半纤维素酶,特别是木聚糖酶,尤其是GH10或GH11木聚糖酶,优选地具有大于82℃,如大于84℃、如大于86℃、如大于88℃、如大于88℃、如大于90℃、如大于92℃、如大于94℃、如大于96℃、如大于98℃、如大于100℃、如在80℃和110℃之间、如在82℃和110℃之间、如在84℃和110℃之间的熔点(DSC)。适合的半纤维素酶(特别是木聚糖酶)的实例包括源自嗜热网团菌的菌株的显示在本文的SEQIDNO:3或本文的SEQIDNO:34中的木聚糖酶;源自Rasomsoniabyssochlamydoides的菌株的显示在本文SEQIDNO:4中的木聚糖酶;源自雷塞氏篮状菌(Talaromycesleycettanus)的菌株的显示在本文SEQIDNO:5中的木聚糖酶;源自烟曲霉的菌株的显示在本文的SEQIDNO:8中的木聚糖酶、或具有半纤维素酶活性(优选地木聚糖酶活性)的多肽,该多肽与本文的SEQIDNO:3、4、5、8和34的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性,优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。在另一个方面,本发明涉及组合物,该组合物包含:-α-淀粉酶;-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);-任选地,内切葡聚糖酶;-任选地,蛋白酶;-任选地,产碳水化合物源的酶。其他酶(如支链淀粉酶和植酸酶)也可以包含在本发明的组合物中。在优选的实施例中,本发明的组合物包含-α-淀粉酶,优选是细菌α-淀粉酶;-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶;-具有大于70℃、优选地大于75℃、尤其是大于80℃、特别是大于85℃的熔点(DSC)的内切葡聚糖酶。附图说明图1显示在液化中添加TlEG(SEQIDNO:9)和Tl木聚糖酶(SEQIDNO:5)或Dt木聚糖酶(SEQIDNO:34)、和SSF与葡糖淀粉酶SA(GSA)的乙醇的产量。具体实施方式本发明涉及使用发酵生物,从含淀粉材料生产发酵产物(例如,乙醇)的方法。本发明还涉及用于本发明的方法中的组合物。诸位发明人已经发现,当在热稳定的半纤维素酶的存在下使用α-淀粉酶液化含淀粉材料时,获得增加的乙醇产量(参见实例19)。还发现当另外地添加热稳定的内切葡萄糖时,乙醇产量进一步增加。在第一方面,本发明涉及用于从含淀粉材料生产发酵产物(如优选地乙醇)的方法,该方法包括以下步骤:i)在高于初始糊化温度的温度(如在80℃至90℃之间)下,使用以下液化该含淀粉材料:-α-淀粉酶,如细菌α-淀粉酶;-具有大于80℃的熔点(DSC)的半纤维素酶;ii)使用产碳水化合物源的酶进行糖化;iii)使用发酵生物进行发酵。步骤ii)和iii)可以依序或同时进行。在优选的实施例中,步骤ii)和iii)同时进行。α-淀粉酶、半纤维素酶(优选地木聚糖酶)具有大于80℃的熔点(DSC);并且任选地,可以在液化步骤i)之前和/或过程中添加具有大于70℃的熔点(DSC)的热稳定的内切葡聚糖酶。任选地,也可以存在和/或添加蛋白酶、产碳水化合物源的酶,优选地,葡糖淀粉酶、支链淀粉酶、和/或植酸酶。在优选的实施例中,以下定义的本发明的组合物可适用于本发明方法中的液化。酶可以单独添加或作为一种或多种混合组合物添加,该混合组合物包含具有大于80℃的熔点(DSC)的α-淀粉酶、半纤维素酶(优选木聚糖酶)、以及任选的内切葡聚糖酶、和任选的蛋白酶、产碳水化合物源的酶、支链淀粉酶和/或植酸酶。α-淀粉酶的实例可以发现于下文的“液化过程中存在的和/或添加的α-淀粉酶”-部分中。在实施例中,α-淀粉酶是本文SEQIDNO:1中显示的α-淀粉酶的变体,如具有选自下组的突变的源自嗜热脂肪芽孢杆菌菌株的一个:-I181*+G182*;-I181*+G182*+N193F;优选地-I181*+G182*+E129V+K177L+R179E;-I181*+G182*+N193F+E129V+K177L+R179E;-I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+Q254S+M284V;以及-I181*+G182*+N193F+E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用本文的SEQIDNO:1用于编号)。当生产时,嗜热脂肪芽孢杆菌α-淀粉酶通常被截短为约491个氨基酸长(与WO99/19467中的SEQIDNO:3或本文中的SEQIDNO:1进行比较),如从约480至495个氨基酸长。在实施例中,将该细菌α-淀粉酶,例如,芽胞杆菌属α-淀粉酶,如尤其是嗜热脂肪芽孢杆菌α-淀粉酶,以在0.01-10KNU-A/gDS之间的浓度给出到液化中,例如,在0.02和5KNU-A/gDS之间,如0.03和3KNU-A,优选地0.04和2KNU-A/gDS,如尤其是0.01和2KNU-A/gDS。在实施例中,将该细菌α-淀粉酶,例如,芽孢杆菌属α-淀粉酶,如尤其是嗜热脂肪芽孢杆菌α-淀粉酶,以在0.0001至1mgEP(酶蛋白)/gDS,例如,0.0005至0.5mgEP/gDS,如0.001至0.1mgEP/gDS的浓度剂量添加至液化。具有大于80℃的熔点(DSC)的适合的半纤维素酶的实例(如木聚糖酶)可以发现于下文的“液化过程中存在的和/或添加的支链淀粉酶”-部分中。适合的半纤维素酶(特别是木聚糖酶)的具体实例包括例如源自嗜热网团菌的菌株的显示在本文的SEQIDNO:3和本文的SEQIDNO:34中的木聚糖酶;例如源自Rasomsoniabyssochlamydoides的菌株的显示在本文SEQIDNO:4中的木聚糖酶;例如源自雷塞氏篮状菌的菌株的显示在本文SEQIDNO:5中的木聚糖酶;例如源自烟曲霉的菌株的显示在本文的SEQIDNO:8中的木聚糖酶、或具有半纤维素酶活性(优选地木聚糖酶活性)的多肽,该多肽分别与本文的SEQIDNO:3、4、5、8和34的多肽的任一项的成熟部分具有至少60%、如至少70%、如至少75%同一性,优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%,如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。具有大于70℃的熔点(DSC)的适合的任选的内切葡聚糖酶的实例可以发现于下文的“液化过程中存在的和/或添加的支链淀粉酶”-部分中。在优选的实施例中,内切葡聚糖酶是本文的SEQIDNO:9中显示的内切葡聚糖酶,如源自雷塞氏篮状菌的菌株(WO2013/019780)的内切葡聚糖酶、或与本文的SEQIDNO:9具有至少80%同一性的内切葡聚糖酶。在优选的实施例中,内切葡聚糖酶是本文的SEQIDNO:9中显示的内切葡聚糖酶,如源自雷塞氏篮状菌的菌株的内切葡聚糖酶(WO2013/019780-特此通过引用结合)、或与具有大于70℃的熔点(DSC)的本文的SEQIDNO:9具有至少90%同一性的内切葡聚糖酶。任选的蛋白酶的实例可以发现于下文的“液化过程中存在的和/或添加的支链淀粉酶”-部分中。适合的任选的产碳水化合物源的酶、优选地热稳定的产碳水化合物源的酶、特别是葡糖淀粉酶的实例可以发现于下文的“液化过程中存在的和/或添加的支链淀粉酶”-部分中。适合的任选的支链淀粉酶可以发现于下文的“液化过程中存在的和/或添加的支链淀粉酶”-部分中。在优选的实施例中,支链淀粉酶源自芽孢杆菌属。任选的植酸酶的实例可以发现于下文的“液化过程中存在的和/或添加的支链淀粉酶”-部分中。在优选的实施例中,植酸酶源自布丘氏菌属的菌株。在糖化和/或发酵或同时糖化和发酵(SSF)过程中存在的和/或添加的适合的纤维素酶或纤维素分解酶组合物可以发现于下文的“液化过程中存在的和/或添加的纤维素酶或纤维素分解酶组合物”-部分中。在实施例中,纤维素酶或纤维素分解酶组合物源自里氏木霉。在优选的实施例中,纤维素酶或纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,其进一步包括具有纤维素分解增强活性的橙色嗜热子囊菌GH61A多肽(WO2005/074656中的SEQIDNO:2或本申请中的SEQIDNO:30)、以及烟曲霉β-葡糖苷酶(WO2005/047499的SEQIDNO:2或本文的SEQIDNO:29)。在实施例中,纤维素酶或纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,其进一步包含披露为WO2011/041397中SEQIDNO:2或本文的SEQIDNO:31的埃默森青霉菌GH61A多肽、以及披露为WO2005/047499中的SEQIDNO:2或本文的SEQIDNO:29的烟曲霉β-葡糖苷酶或其变体,该变体具有以下取代的一个、优选地以下取代的全部:F100D、S283G、N456E、F512Y(使用本文的SEQIDNO:29用于编号)。根据本发明的方法,在液化过程中的pH可以是在4.0至6.5之间,如4.5至6.2、如超过4.8至6.0、如在5.0至5.8之间。根据本发明,温度可以高于初始糊化温度。术语“初始糊化温度”指典型地通过加热,淀粉开始溶解的最低温度。针对不同淀粉,该温度可以变化。初始糊化温度可以从50℃至70℃。在实施例中,在液化步骤i)过程中的温度是在从70℃至100℃的范围,如在70℃至95℃之间、如在75℃至90℃之间、优选地在80℃至90℃之间、如约85℃。在实施例中,本发明的方法在步骤i)之前进一步包括以下步骤:a)优选地通过干式碾磨来减小含淀粉材料的粒度;b)形成包含该含淀粉材料和水的浆料。该含淀粉起始材料(如全谷物)可(例如通过磨制)减少粒度以打开结构、增大表面积并且允许进一步加工。通常,存在以下两种类型的方法:湿式和干式碾磨。在干式碾磨中,整个谷粒被碾磨并且使用。湿式碾磨使胚芽与粗粉(淀粉颗粒和蛋白质)良好分离。湿式碾磨常常应用于使用淀粉水解物产生例如糖浆的场合(location)。干式和湿式碾磨两者都是淀粉领域所熟知的。根据本发明,优选干式碾磨。可以将粒度甚至进一步减少,例如通过土耳其式研磨(Turkishgrinding)。在实施例中,将粒度减小至0.05mm至3.0mm、优选0.1mm至0.5mm,或使得至少30%、优选至少50%、更优选至少70%、甚至更优选至少90%的含淀粉材料适合通过具有0.05mm至3.0mm筛网、优选0.1mm至0.5mm筛网的筛子。在另一个实施例中,至少50%,优选至少70%,更优选至少80%,尤其是至少90%的含淀粉材料适合通过具有#6筛网的筛子。在实施例中,至少75%的含淀粉材料适合通过具有小于0.5mm筛网的筛子,更优选地至少79%或80%的含淀粉材料适合通过具有小于0.425mm筛网的筛子。在实施例中,至少50%的含淀粉材料适合通过具有0.25mm至0.425mm筛网的筛子,更优选地至少59%或60%的含淀粉材料适合通过具有0.25mm至0.425mm筛网的筛子。该水性浆料可以包含含淀粉材料的从10至55w/w-%干固体(DS),优选25至45w/w-%干固体(DS),更优选30至40w/w-%干固体(DS)。可以将浆料加热至大于初始糊化温度,优选地至在70℃至95℃之间,如在80℃至90℃之间,在pH5.0至7.0之间、优选地在5.0和6.0之间持续30分钟制5小时,如约2小时。在实施例中,在从70℃至95℃的温度在从4至6的pH,将液化步骤i)进行0.5至5小时。在优选的实施例中,在从80℃至90℃的温度在从4至6的pH,将液化步骤i)进行0.5至3小时。可以将α-淀粉酶和半纤维素酶以及任选的热稳定的内切葡聚糖酶、任选的蛋白酶、任选的产碳水化合物源的酶、特别是葡糖淀粉酶、任选的支链淀粉酶、和/或任选的植酸酶初始添加至水性浆料以开始液化(稀释)。在实施例中,这些酶中仅有一部分被添加到该水性浆料中,而这些酶中的剩余部分在液化步骤i)过程中添加。在实施例中,该水性浆料在经受步骤i)中的液化之前可以喷射蒸煮以进一步使该浆料糊化。该喷射蒸煮可在95℃至-160℃之间、如在110℃至145℃、优选120℃至140℃、如125℃至135℃、优选约130℃的温度进行约1至15分钟,优选进行约3至10分钟,尤其是大约5分钟左右。糖化与发酵根据本发明的方法,一种或多种产碳水化合物源的酶,特别是葡糖淀粉酶,可以是在糖化步骤ii)和/或发酵步骤iii)过程中存在的和/或添加的。该产碳水化合物源的酶优选地可以是葡糖淀粉酶,但还可以是选自下组的酶,该组由以下组成:β-淀粉酶、麦芽糖淀粉酶、和α-葡糖苷酶。在糖化步骤ii)和/或发酵步骤iii)过程中添加的产碳水化合物源的酶典型地与任选地在液化步骤i)过程中添加的任选的产碳水化合物源的酶,特别是葡糖淀粉酶不同。在实施例中,该产碳水化合物源的酶,特别是葡糖淀粉酶是与真菌α-淀粉酶一起添加的。产碳水化合物源的酶(包括葡糖淀粉酶)的实例可以发现于下文的“糖化和/或发酵过程中存在的和/或添加的产碳水化合物源的酶”-部分中。当依序进行糖化和发酵时,糖化步骤ii)可以在本领域中熟知的条件下进行。例如,糖化步骤ii)可以持续达从约24至约72小时。在实施例中,进行预糖化步骤。在实施例中,在糖化步骤ii)和/或发酵步骤iii)之前进行的预糖化过程中添加产碳水化合物源的酶。也可以在同时糖化和发酵(SSF)之前的预糖化过程中添加产碳水化合物源的酶。在糖化步骤ii)和/或发酵步骤iii)之前的预糖化过程中添加在实施例中,产碳水化合物源的酶、优选地葡糖淀粉酶、和/或纤维素酶或纤维素分解酶组合物。也可以在同时糖化和发酵(SSF)之前的预糖化过程中添加产碳水化合物源的酶、优选地葡糖淀粉酶、和纤维素酶或纤维素分解酶组合物。预糖化在30℃至65℃之间(典型地约60℃)的温度典型地进行40至90分钟。在同时糖化和发酵(SSF)中,预糖化之后可以是发酵过程中的糖化。糖化典型地在从20℃至75℃、优选地从40℃至70℃,典型地约60℃的温度处并且在4与5之间的pH、如在约pH4.5进行。同时糖化和发酵(“SSF”)广泛地用于工业规模的发酵产物生产方法中,尤其是乙醇生产方法中。当进行SSF时,同时进行糖化步骤ii)和发酵步骤iii)。糖化可能不存在保持阶段,这意味着,发酵生物(如酵母)和一种或多种酶(根据本发明的优选的实施例中,葡糖淀粉酶、和纤维素酶或纤维素分解酶组合物)可以一起添加。然而,还考虑了分开添加发酵生物以及一种或多种酶。根据本发明,发酵或SSF可典型地在25℃至40℃,如28℃至35℃,如30℃至34℃、优选大约32℃左右的温度进行。在实施例中,发酵进行6至120小时,尤其进行24至96小时。在实施例中,pH是在3.5至5之间,特别是在3.8和4.3之间。发酵培养基“发酵培养基”(Fermentationmedia或fermentationmedium)是指其中进行发酵的环境。发酵培养基包括发酵底物,即被发酵生物代谢的碳水化合物源。根据本发明,发酵培养基可以包括针对一种或多种发酵生物的营养素和一种或多种生长刺激剂。营养物和生长刺激物在发酵领域中广泛使用,且包括氮源如氨;尿素,维生素和矿物质,或其组合。发酵生物术语“发酵生物”是指适合用于发酵过程中并且能够生产所希望的发酵产物的任何生物体,包括细菌和真菌生物体,尤其是酵母。尤其适合的发酵生物能够使糖(如葡萄糖或麦芽糖)直接或间接发酵成(即,转化成)所希望的发酵产物(如乙醇)。发酵生物的实例包括真菌生物体,如酵母。优选的酵母包括酵母属的菌株,特别是酿酒酵母。在发酵(如SSF)过程中,有活力的发酵生物的合适的浓度在本领域是众所周知的,或可以由本领域的技术人员容易地确定。在一个实施例中,将发酵生物(如乙醇发酵酵母(例如,酿酒酵母))添加至发酵培养基中,使得每mL的发酵培养基的有活力的发酵生物(如酵母)计数在从105至1012,优选从107至1010的范围内,尤其是约5x107个。可商购的酵母的实例包括例如REDSTARTM和ETHANOLREDTM酵母(可获得自富酶泰斯公司/乐斯福公司(Fermentis/Lesaffre),美国)、FALI(可获得自弗莱希曼酵母公司(Fleischmann’sYeast),美国)、SUPERSTART和THERMOSACCTM新鲜酵母(可获得自乙醇技术公司(EthanolTechnology),威斯康星州,美国)、BIOFERMAFT和XR(可获得自NABC-北美生物制品公司(NorthAmericanBioproductsCorporation),佐治亚州,美国)、GERTSTRAND(可获得自格特·斯特兰德公司(GertStrandAB),瑞典)以及FERMIOL(可获得自帝斯曼特殊产品公司(DSMSpecialties))。含淀粉材料根据本发明可以使用任何适合的含淀粉材料。通常基于希望的发酵产物来选择起始材料。适合在本发明的方法中使用的含淀粉材料的实例包括全谷物、玉米、小麦、大麦、黑麦、蜀黍(sago)、西米、木薯、木薯粉、高粱、稻、豌豆、豆类、或甜薯、或其混合物、或者由其衍生的淀粉、或谷类。还考虑了糯型与非糯型(waxyandnon-waxytypes)的玉米与大麦。在优选实施例中,用于根据本发明的乙醇生产的含淀粉材料是玉米或小麦。发酵产物术语“发酵产物”意思指通过包括使用发酵有机体进行的发酵步骤在内的工艺生产的产物。根据本发明考虑的发酵产物包括醇(例如,乙醇、甲醇、丁醇;多元醇例如甘油、山梨醇和肌醇);有机酸(例如,柠檬酸、乙酸、衣康酸、乳酸、丁二酸、葡糖酸);酮(例如丙酮);氨基酸(例如,谷氨酸);气体(例如,H2和CO2);抗生素(例如,青霉素和四环素);酶;维生素(例如,核黄素、B12、β-胡萝卜素);和激素。在优选实施例中,该发酵产物是乙醇,例如燃料乙醇;饮用乙醇,即中性饮用酒精;或用于消费性醇工业(例如,啤酒和酒)、乳品工业(例如,发酵的乳制品)、皮革工业和烟草工业的工业乙醇或产物。优选的啤酒类型包括爱尔啤酒(ale)、烈性黑啤酒(stout)、波特啤酒(porter)、拉格啤酒(lager)、苦啤酒(bitter)、麦芽酒(maltliquor)、低麦芽啤酒(happoushu)、高醇啤酒、低醇啤酒、低热量啤酒、或清淡啤酒。优选地,本发明的方法是用于生产醇,如乙醇。根据本发明获得的发酵产物(如乙醇)可以用作典型地与汽油共混的燃料。然而,在乙醇的情况下,它还可以用作饮用乙醇。回收发酵、或SSF之后,可以将发酵产物与发酵培养基分开。可以蒸馏浆料以提取所希望的发酵产物(例如,乙醇)。可替代地,可以通过微滤或膜过滤技术从发酵培养基中提取所希望的发酵产物。还可以通过汽提或本领域熟知的其他方法来回收发酵产物。液化过程中存在的和/或添加的α-淀粉酶根据本发明,在液化中使α-淀粉酶与半具有大于80℃、如在80℃和95℃之间的熔点(DSC)的纤维素酶(优选地木聚糖酶)、以及任选的内切葡聚糖酶、任选的蛋白酶、任选的产碳水化合物源的酶、特别是葡糖淀粉酶、任选的支链淀粉酶、和/或任选的植酸酶一起存在和/或添加。在液化步骤i)过程中添加的α-淀粉酶可以是任何α-淀粉酶。优选的是细菌α-淀粉酶,如尤其是芽孢杆菌α-淀粉酶,如在液化过程中使用的温度是稳定的嗜热脂肪芽孢杆菌α-淀粉酶。细菌α-淀粉酶术语“细菌α-淀粉酶”意指在EC3.2.1.1项下分类的任何细菌α-淀粉酶。根据本发明使用的细菌α-淀粉酶可例如源自芽孢杆菌属(有时也称作地芽孢杆菌属)的菌株。在实施例中,该芽孢杆菌属α-淀粉酶源自解淀粉芽孢杆菌、地衣芽孢杆菌、嗜热脂肪芽孢杆菌、芽孢杆菌属TS-23、或枯草芽孢杆菌的菌株,但是也可源自其他芽孢杆菌属菌种。细菌α-淀粉酶的具体实例包括WO99/19467中的SEQIDNO:3或本文的SEQIDNO:1的嗜热脂肪芽孢杆菌α-淀粉酶、WO99/19467中的SEQIDNO:5的解淀粉芽孢杆菌α-淀粉酶、和WO99/19467中的SEQIDNO:4的地衣芽孢杆菌α-淀粉酶、以及WO2009/061380中披露为SEQIDNO:1的芽胞杆菌属TS-23α-淀粉酶(所有序列都特此通过引用结合)。在实施例中,细菌α-淀粉酶可为分别与WO99/19467中的SEQIDNO:3、4或5以及WO2009/061380中的SEQIDNO:1所示的任何序列具有至少60%,例如至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性程度的酶。在实施例中,该α-淀粉酶可以是与WO99/19467中的SEQIDNO:3、或本文的SEQIDNO:1所示的任何序列具有至少60%,例如至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性程度的酶。在优选的实施例中,该α-淀粉酶来源自嗜热脂肪芽孢杆菌。该嗜热脂肪芽孢杆菌α-淀粉酶可以是成熟野生型或其成熟变体。成熟嗜热脂肪芽孢杆菌α-淀粉酶或其变体可以是在重组产生过程中天然地截短的。例如,成熟嗜热脂肪芽孢杆菌α-淀粉酶可以是在C-末端截短的,所以它是约491个氨基酸长(与WO99/19467中的SEQIDNO:3或本文的SEQIDNO:1比较),如从480至495个氨基酸长。该芽孢杆菌α-淀粉酶还可为变体和/或杂合体。这样的变体的实例可见于以下任一者中:WO96/23873、WO96/23874、WO97/41213、WO99/19467、WO00/60059、WO02/10355以及WO2009/061380(所有文件都特此通过引用结合)。具体的α-淀粉酶变体在美国专利号6,093,562、6,187,576、6,297,038和7,713,723中披露(特此通过引用结合)并包括具有以下改变的嗜热脂肪芽孢杆菌α-淀粉酶(常常称作BSGα-淀粉酶)变体:在位置R179、G180、I181和/或G182的任何一处的一个或两个氨基酸的缺失,优选WO96/23873中披露的双缺失-参见例如第20页,第1-10行(特此通过引用结合),优选与WO99/19467中披露的SEQIDNO:3或本文的SEQIDNO:1所述的嗜热脂肪芽孢杆菌α-淀粉酶的氨基酸序列相比对应于位置I181和G182的缺失,或使用WO99/19467中的SEQIDNO:3或本文的SEQIDNO:1的氨基酸R179和G180的缺失。甚至更优选的是芽孢杆菌α-淀粉酶,尤其是嗜热脂肪芽孢杆菌(BSG)α-淀粉酶,其与WO99/19467中披露的SEQIDNO:3或本文SEQIDNO:1中列出的野生型BSGα-淀粉酶氨基酸序列相比在对应于位置R179、G180、I181和G182具有一个或两个氨基酸缺失,优选地其对应于R179和G180具有双缺失,或优选地位置181和182的缺失(被表示为I181*+G182*),并且任选地,进一步包含N193F取代(被表示为I181*+G182*+N193F)。细菌α-淀粉酶还可以在对应于WO99/19467中的SEQIDNO:4所示的地衣芽孢杆菌α-淀粉酶、或WO99/19467中的SEQIDNO:3的嗜热脂肪芽孢杆菌α-淀粉酶的S242变体或本文的SEQIDNO:1中的S239的位置处具有取代。在实施例中,该变体是嗜热脂肪芽孢杆菌α-淀粉酶的S242A、E或Q变体,优选S242Q或A变体(使用本文的SEQIDNO:1进行编号)。在实施例中,该变体是嗜热脂肪芽孢杆菌α-淀粉酶的E188变体,优选E188P变体(使用本文的SEQIDNO:1进行编号)。其他预期的变体是WO2009/061380中披露的芽孢杆菌属TS-23变体,尤其是WO2009/061380的权利要求1中定义的变体(特此通过引用结合)。细菌杂合α-淀粉酶该细菌α-淀粉酶也可为杂合细菌α-淀粉酶,例如包含地衣芽孢杆菌α-淀粉酶(WO99/19467的SEQIDNO:4中所示)的445个C-末端氨基酸残基和源自解淀粉芽孢杆菌的α-淀粉酶(WO99/19467的SEQIDNO:5中所示)的37个N-末端氨基酸残基的α-淀粉酶。在优选的实施例中,该杂合体具有下列取代中的一个或多个,尤其是全部:G48A+T49I+G107A+H156Y+A181T+N190F+I201F+A209V+Q264S(使用WO99/19467的SEQIDNO:4中的地衣芽孢杆菌编号)。还优选的是具有以下突变(或在其他芽孢杆菌α-淀粉酶中的对应突变)中的一个或多个的变体:H154Y、A181T、N190F、A209V以及Q264S和/或在位置176与179之间的两个残基的缺失,优选E178和G179的缺失(使用WO99/19467的SEQIDNO:5进行位置编号)。在实施例中,该细菌α-淀粉酶是嵌合α-淀粉酶的成熟部分,其披露于Richardson等人,2002,TheJournalofBiologicalChemistry[生物化学杂志],277(29):.267501-26507,称作BD5088或其变体。此α-淀粉酶与WO2007134207中的SEQIDNO:2所示的相同。成熟酶序列在位置1处的起始“Met”氨基酸之后开始。热稳定的α-淀粉酶根据本发明,将α-淀粉酶与具有大于80℃的熔点(DSC)的半纤维素酶(优选是木聚糖酶)组合使用。任选地,可以包括具有大于70℃、如大于75℃、特别是大于80℃的熔点(DSC)的内切葡聚糖酶。热稳定的α-淀粉酶(如细菌α-淀粉酶)优选地源自嗜热脂肪芽孢杆菌或芽孢杆菌属TS-23。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少15的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少20的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少25的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少30的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少40的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少50的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少60的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在10-70之间的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在15-70之间的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在20-70之间的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在25-70之间的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在30-70之间的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在40-70之间的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在50-70之间的T1/2(min)。在实施例中,该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有在60-70之间的T1/2(min)。在实施例中,α-淀粉酶是细菌α-淀粉酶,优选地源自芽胞杆菌属,尤其是嗜热脂肪芽孢杆菌的菌株,特别是嗜热脂肪芽孢杆菌,如在WO99/19467中披露为SEQIDNO:3或本文的SEQIDNO:1,其中在位置R179、G180、I181和/或G182处具有一个或两个氨基酸缺失,特别是R179和G180缺失、或具有I181和G182缺失,具有如下突变列表中的突变。在优选的实施例中,嗜热脂肪芽孢杆菌α-淀粉酶具有双缺失I181+G182,以及任选的取代N193F,任选地进一步包括选自以下列表的突变:在实施例中,α-淀粉酶选自嗜热脂肪芽孢杆菌α-淀粉酶变体的组:-I181*+G182*;-I181*+G182*+N193F;优选地-I181*+G182*+E129V+K177L+R179E;-I181*+G182*+N193F+E129V+K177L+R179E;-I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+Q254S+M284V;以及-I181*+G182*+N193F+E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用本文的SEQIDNO:1用于编号)。在实施例中,细菌α-淀粉酶,如芽孢杆菌α-淀粉酶,如嗜热脂肪芽孢杆菌α-淀粉酶与本文的SEQIDNO:1的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。在实施例中,细菌α-淀粉酶变体,如芽孢杆菌α-淀粉酶变体,如嗜热脂肪芽孢杆菌α-淀粉酶变体与本文的SEQIDNO:1的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、但少于100%同一性。应理解的是,当提及嗜热脂肪芽孢杆菌α-淀粉酶及其变体时,它们通常以截短的形式自然地产生。特别地,截短是这样的以使得WO99/19467中的SEQIDNO:3或在此的SEQIDNO:1中所示的嗜热脂肪芽孢杆菌α-淀粉酶或其变体在C-末端截短并且典型地是约491个氨基酸长,例如从480至-495个氨基酸长。在液化过程中存在的和/或添加的热稳定的半纤维素酶根据本发明,将具有大于80℃的熔点(DSC)的半纤维素酶(优选地木聚糖酶)与α-淀粉酶(如细菌α-淀粉酶(以上描述的)组合存在和/或添加至液化步骤i)中。半纤维素酶(优选地木聚糖酶)的热稳定性可以如“材料与方法”部分“通过差示扫描量热法测定Td对内切葡聚糖酶和半纤维素酶的测定”中所述测定。在实施例中,半纤维素酶,特别是木聚糖酶,尤其是GH10或GH11木聚糖酶具有大于82℃,如大于84℃、如大于86℃、如大于88℃、如大于88℃、如大于90℃、如大于92℃、如大于94℃、如大于96℃、如大于98℃、如大于100℃、如在80℃和110℃之间、如在82℃和110℃之间、如在84℃和110℃之间的熔点(DSC)。在优选的实施例中,半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:3的多肽的成熟部分具有至少60%、如至少70%、如至少75%、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自网团菌属的菌株、如嗜热网团菌的菌株。在优选的实施例中,半纤维素酶,特别是木聚糖酶,尤其是GH11木聚糖酶与本文的SEQIDNO:34的多肽的成熟部分具有至少60%、如至少70%、如至少75%、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自网团菌属的菌株,如嗜热网团菌的菌株。在优选的实施例中,半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:4的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自Rasamsonia属的菌株,如Rasomsoniabyssochlamydoides的菌株。在优选的实施例中,半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:5的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自篮状菌属的菌株、如雷塞氏篮状菌的菌株。在优选的实施例中,半纤维素酶、特别是木聚糖酶、尤其是GH10木聚糖酶与本文的SEQIDNO:8的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自曲霉属的菌株、如烟曲霉的菌株。在液化过程中存在的和/或添加的热稳定的内切葡聚糖酶根据本发明,可以将具有大于70℃(如在70℃和95℃之间)的熔点(DSC)的任选的内切葡聚糖酶(“EG”)与α-淀粉酶(如热稳定的细菌α-淀粉酶)和具有大于80℃的熔点(DSC)的半纤维素酶(优选地木聚糖酶)组合在液化步骤i)中存在和/或添加。内切葡聚糖酶的热稳定性可以如“材料与方法”部分“通过差示扫描量热法测定Td对内切葡聚糖酶和半纤维素酶的测定”中所述测定。在实施例中,内切葡聚糖酶具有大于72℃、如大于74℃、如大于76℃、如大于78℃、如大于80℃、如大于82℃、如大于84℃、如大于86℃、如大于88℃、如在70℃和95℃之间、如在76℃和94℃之间、如在78℃和93℃之间、如在80℃和92℃之间、如在82℃和91℃之间、如在84℃和90℃之间的熔点(DSC)。在优选的实施例中,在本发明的方法中使用的或包含在本发明的组合物中的内切葡聚糖酶是糖苷水解酶家族5内切葡聚糖酶或GH5内切葡聚糖酶(参见在“www.cazy.org”网站的CAZy数据库)。在实施例中,GH5内切葡聚糖酶来自家族EGII,如本文的SEQIDNO:9中显示的雷塞氏篮状菌内切葡聚糖酶;本文的SEQIDNO:35中显示的胶囊青霉内切葡聚糖酶、以及本文的SEQIDNO:36中显示的褐孢长毛盘菌内切葡聚糖酶。在实施例中,内切葡聚糖酶是家族GH45内切葡聚糖酶。在实施例中,GH45内切葡聚糖酶来自家族EGV,如本文的SEQIDNO:38中显示的粪生粪壳菌或本文的SEQIDNO:37中显示的土生梭孢壳酶内切葡聚糖酶。在实施例中,内切葡聚糖酶与本文的SEQIDNO:9的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。在实施例中,内切葡聚糖酶是源自篮状菌属(Talaromyces)的菌株,如雷塞氏篮状菌的菌株。在实施例中,内切葡聚糖酶与本文的SEQIDNO:35的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自青霉菌属的菌株,如胶囊青霉的菌株。在实施例中,内切葡聚糖酶与本文的SEQIDNO:36的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自长毛盘菌属的菌株,如褐孢长毛盘菌的菌株。在实施例中,切葡聚糖酶与本文的SEQIDNO:37的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自梭孢壳属的菌株、如土生梭孢壳酶的菌株。在实施例中,内切葡聚糖酶与本文的SEQIDNO:38的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自粪壳菌属的菌株,如粪生粪壳菌的菌株。在实施例中,在液化步骤i)中在从1至10,000μgEP(酶蛋白)/gDS)如10至1,000μgEP/gDS的剂量添加内切葡聚糖酶。液化过程中存在的和/或添加的蛋白酶在本发明的实施例中,在液化中可以将任选的蛋白酶(如热稳定的蛋白酶)与α-淀粉酶(如热稳定的α-淀粉酶)、和具有大于80℃的熔点(DSC)的半纤维素酶(优选地木聚糖酶)、以及任选地内切葡聚糖酶、产碳水化合物源的酶(特别是葡糖淀粉酶、任选地支链淀粉酶和/或任选地植酸酶)一起存在和/或添加。蛋白酶根据其催化机制分为以下几类:丝氨酸蛋白酶(S)、半胱氨酸蛋白酶(C)、天冬氨酸蛋白酶(A)、金属蛋白酶(M)以及未知或还未分类的蛋白酶(U),参见HandbookofProteolyticEnzymes[蛋白水解酶手册],A.J.Barrett,N.D.Rawlings,J.F.Woessner(编辑),AcademicPress[学术出版社](1998),尤其是概述部分。在优选实施例中,根据本发明使用的热稳定蛋白酶是“金属蛋白酶”,其定义为属于EC3.4.24(金属内肽酶);优选EC3.4.24.39(酸性金属蛋白酶)的蛋白酶。为了确定给定的蛋白酶是否是金属蛋白酶,参照上述“HandbookofProteolyticEnzymes[蛋白水解酶手册]”以及其中指示的原则。可以对所有类型的蛋白酶进行这样的测定,而不论其是天然存在的还是野生型蛋白酶;或者是基因工程化的还是合成的蛋白酶。可以使用任何适合的测定来测量蛋白酶活性,其中采用这样的底物,该底物包括与所讨论的蛋白酶的特异性相关的肽键。pH测定和温度测定同样适用于所讨论的蛋白酶。测定pH值的实例是pH6、7、8、9、10或11。测定温度的实例是30℃、35℃、37℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃或80℃。蛋白酶底物的实例为酪蛋白,如Azurine-CrosslinkedCasein(天青精-交联的酪蛋白,AZCL-酪蛋白)。在下文“材料与方法”部分中描述了两种蛋白酶测定,其中所谓的“AZCL-酪蛋白测定”是优选的测定。在实施例中,通过在“材料与方法”部分中描述的AZCL-酪蛋白测定确定的,热稳定蛋白酶具有JTP196变体(实例2)或蛋白酶Pfu(本文的SEQIDNO:13)的至少20%,如至少30%、如至少40%、如至少50%、如至少60%、如至少70%、如至少80%、如至少90%、如至少95%、如至少100%的蛋白酶活性。对于在本发明的方法或组合物中使用的热稳定的蛋白酶的来源没有限制,只要其满足下文定义的热稳定性特性。在一个实施例中,该蛋白酶是真菌来源的。在优选实施例中,热稳定蛋白酶是如上定义的金属蛋白酶的变体。在实施例中,在本发明的方法或组合物中使用的热稳定蛋白酶是真菌起源的,如真菌金属蛋白酶,如源自嗜热子囊菌属的菌株,优选橙色嗜热子囊菌(Thermoascusaurantiacus)的菌株,尤其是橙色嗜热子囊菌CGMCCNo.0670(分类为EC3.4.24.39)的真菌金属蛋白酶。在实施例中,热稳定蛋白酶是披露于WO2003/048353中的SEQIDNO:2所示的金属蛋白酶的成熟部分的或披露于WO2010/008841的SEQIDNO:1的成熟部分的和如本文的SEQIDNO:2所示的变体,该变体进一步具有选自以下列表的突变:-S5*+D79L+S87P+A112P+D142L;-D79L+S87P+A112P+T124V+D142L;-S5*+N26R+D79L+S87P+A112P+D142L;-N26R+T46R+D79L+S87P+A112P+D142L;-T46R+D79L+S87P+T116V+D142L;-D79L+P81R+S87P+A112P+D142L;-A27K+D79L+S87P+A112P+T124V+D142L;-D79L+Y82F+S87P+A112P+T124V+D142L;-D79L+Y82F+S87P+A112P+T124V+D142L;-D79L+S87P+A112P+T124V+A126V+D142L;-D79L+S87P+A112P+D142L;-D79L+Y82F+S87P+A112P+D142L;-S38T+D79L+S87P+A112P+A126V+D142L;-D79L+Y82F+S87P+A112P+A126V+D142L;-A27K+D79L+S87P+A112P+A126V+D142L;-D79L+S87P+N98C+A112P+G135C+D142L;-D79L+S87P+A112P+D142L+T141C+M161C;-S36P+D79L+S87P+A112P+D142L;-A37P+D79L+S87P+A112P+D142L;-S49P+D79L+S87P+A112P+D142L;-S50P+D79L+S87P+A112P+D142L;-D79L+S87P+D104P+A112P+D142L;-D79L+Y82F+S87G+A112P+D142L;-S70V+D79L+Y82F+S87G+Y97W+A112P+D142L;-D79L+Y82F+S87G+Y97W+D104P+A112P+D142L;-S70V+D79L+Y82F+S87G+A112P+D142L;-D79L+Y82F+S87G+D104P+A112P+D142L;-D79L+Y82F+S87G+A112P+A126V+D142L;-Y82F+S87G+S70V+D79L+D104P+A112P+D142L;-Y82F+S87G+D79L+D104P+A112P+A126V+D142L;-A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L;-A27K+Y82F+S87G+D104P+A112P+A126V+D142L;-A27K+D79L+Y82F+D104P+A112P+A126V+D142L;-A27K+Y82F+D104P+A112P+A126V+D142L;-A27K+D79L+S87P+A112P+D142L;-D79L+S87P+D142L。在优选实施例中,热稳定蛋白酶是披露为以下的成熟金属蛋白酶的变体:披露于WO2003/048353中的SEQIDNO:2的成熟部分或披露于WO2010/008841中的SEQIDNO:1的成熟部分或本文的SEQIDNO:2,该变体具有以下突变:D79L+S87P+A112P+D142L;D79L+S87P+D142L;或A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L。在实施例中,蛋白酶变体与披露于WO2003/048353中的SEQIDNO:2的多肽的成熟部分或披露于WO2010/008841中的SEQIDNO:1的成熟部分或本文的SEQIDNO:2具有至少75%的同一性,优选至少80%,更优选至少85%,更优选至少90%,更优选至少91%,更优选至少92%,甚至更优选至少93%,最优选至少94%,以及甚至最优选至少95%,如甚至至少96%、至少97%、至少98%、至少99%,但小于100%的同一性。该热稳定性蛋白酶还可源自任何细菌,只要该蛋白酶具有根据本发明定义的热稳定性特性。在实施例中,该热稳定的蛋白酶源自细菌火球菌属的菌株,如强烈火球菌的菌株(pfu蛋白酶)。在实施例中,该蛋白酶是如美国专利号6,358,726-B1(宝酒造公司(TakaraShuzoCompany))的SEQIDNO:1、和本文的SEQIDNO:13所示的一种。在实施例中,该热稳定性蛋白酶是披露在本文的SEQIDNO:13或是与美国专利号6,358,726-B1中的SEQIDNO:1或本文的SEQIDNO:13具有至少80%同一性、如至少85%、如至少90%、如至少95%、如至少96%、如至少97%、如至少98%、如至少99%同一性的蛋白酶。强烈火球菌蛋白酶可以购买自日本宝酒造生物公司(TakaraBio,Japan)。强烈火球菌蛋白酶是一种根据本发明的热稳定性蛋白酶。发现商用产品强烈火球菌蛋白酶(PfuS)在pH4.5具有110%(80℃/70℃)和103%(90℃/70℃)的热稳定性(参见实例5),如实例2中所述的进行测定。在一个实施例中,热稳定的蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,如实例2中所述的进行测定。在实施例中,蛋白酶具有确定为在80℃/70℃的相对活性的,超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%、超过100%、如超过105%、如超过110%、如超过115%、如超过120%的热稳定性。在实施例中,蛋白酶具有确定为在80℃/70℃的相对活性的,在20%与50%之间、如在20%与40%之间、如20%与30%的热稳定性。在实施例中,蛋白酶具有确定为在80℃/70℃的相对活性的,在50%与115%之间、如在50%与70%之间、如在50%与60%之间、如在100%与120%之间、如在105%与115%之间的热稳定性。在实施例中,蛋白酶具有确定为在85℃/70℃的相对活性的、超过10%的热稳定性值,如实例2中所述的进行测定。在实施例中,蛋白酶具有确定为在85℃/70℃的相对活性的,超过10%,例如超过12%、超过14%、超过16%、超过18%、超过20%、超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%、超过100%、超过110%的热稳定性。在实施例中,蛋白酶具有确定为在85℃/70℃的相对活性的,在10%与50%之间、如在10%与30%之间、如在10%与25%之间的热稳定性。在实施例中,蛋白酶具有超过20%、超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%C的测定为在80℃的残余活性;和/或在施例中,蛋白酶具有超过20%、超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%C的测定为在84℃的残余活性。“相对活性”以及“残余活性”的测定是如在实例2中描述的进行的。在实施例中,蛋白酶在85℃可以具有高于90,例如高于100的热稳定性,如使用实例3中披露的Zein-BCA测定法确定的。在实施例中,蛋白酶在85℃具有高于60%,例如高于90%,例如高于100%,例如高于110%的热稳定性,如使用Zein-BCA测定法确定的。在实施例中,蛋白酶在85℃具有在60%至120%之间,例如在70%至120%之间,例如在80%至120%之间,例如在90%至120%之间,例如在100%至120%之间,例如110%至120%的热稳定性,如使用Zein-BCA测定法确定的。在实施例中,通过在“材料与方法”部分中描述的AZCL-酪蛋白测定确定的,热稳定蛋白酶具有JTP196蛋白酶变体或蛋白酶Pfu的至少20%,如至少30%、如至少40%、如至少50%、如至少60%、如至少70%、如至少80%、如至少90%、如至少95%、如至少100%的蛋白酶活性。液化过程中存在的和/或添加的产碳水化合物源的酶根据本发明,在液化中任选的产碳水化合物源的酶,特别是葡糖淀粉酶,优选是热稳定的葡糖淀粉酶可以与α-淀粉酶和具有大于80℃的熔点(DSC)的半纤维素酶(优选地木聚糖酶)、以及任选的具有大于70℃的熔点(DSC)的内切葡聚糖酶、以及任选的支链淀粉酶和/或任选的植酸酶一起存在和/或添加。术语“产碳水化合物源的酶”包括产生可发酵糖的任何酶。产碳水化合物源的酶能够产生可以被讨论中的一种或多种发酵有机体用作能源的碳水化合物,例如,当在用于生产发酵产物(例如乙醇)的本发明的工艺中使用时。产生的碳水化合物可以被直接或间接地转化为希望的发酵产物,优选乙醇。根据本发明,可以使用产碳水化合物源的酶的混合物。具体实例包括葡糖淀粉酶(为葡萄糖生产者)、β-淀粉酶和麦芽糖淀粉酶(为麦芽糖生产者)。在优选的实施例中,该产碳水化合物源的酶是热稳定的。该产碳水化合物源的酶,特别是热稳定性葡糖淀粉酶可以与α-淀粉酶和热稳定性蛋白酶一起或分开添加。在实施例中,该产碳水化合物源的酶,优选热稳定的葡糖淀粉酶在85℃具有至少20%、至少30%、优选至少35%的相对活性热稳定性,如实例4(热稳定性)中描述的进行测定。在实施例中,该产碳水化合物源的酶是葡糖淀粉酶,在pH5.0的pH最佳值时具有至少90%,优选至少95%,优选至少97%,例如100%的相对活性,如实例4(pH最佳值)中描述的进行测定。在实施例中,该产碳水化合物源的酶是葡糖淀粉酶,在pH5.0具有至少80%,至少85%、至少90%的pH稳定性,如实例4(pH稳定性)中描述的进行测定。在具体并优选的实施例中,产碳水化合物源的酶是热稳定的葡糖淀粉酶,优选真菌来源,优选丝状真菌,如来自青霉属的菌株,尤其是草酸青霉菌的菌株,特别是在WO2011/127802(特此将其通过引用结合)中披露为SEQIDNO:2的以及显示在本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶。在实施例中,该热稳定的葡糖淀粉酶与WO2011/127802的SEQIDNO:2或本文的SEQIDNO:14中显示的成熟多肽具有至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、以及甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%或100%同一性。在实施例中,产碳水化合物源的酶,特别是热稳定的葡糖淀粉酶是本文的SEQIDNO:14中显示的草酸青霉菌葡糖淀粉酶。在优选的实施例中,产碳水化合物源的酶是披露为WO2011/127802中的SEQIDNO:2以及显示在本文的SEQIDNO:14中的草酸青霉葡糖淀粉酶的变体,具有K79V取代(称为“PE001”)(使用SEQIDNO:14中所示的成熟序列用于编号)。如WO2013/036526(其通过提述由此并入)中披露的,该K79V葡糖淀粉酶变体相对于亲本对蛋白酶降解具有降低的敏感度。涵盖的草酸青霉葡糖淀粉酶变体披露于WO2013/053801(其通过提述由此并入)中。在实施例中,这些变体具有对蛋白酶降解的降低的敏感度。在实施例中,这些变体与亲本相比具有改进的热稳定性。更具体地,在实施例中,该葡糖淀粉酶具有对应于PE001变体的K79V取代(使用在此的SEQIDNO:14进行编号),并且进一步包括至少一种以下取代或取代的组合:T65A;Q327F;E501V;Y504T;Y504*;T65A+Q327F;T65A+E501V;T65A+Y504T;T65A+Y504*;Q327F+E501V;Q327F+Y504T;Q327F+Y504*;E501V+Y504T;E501V+Y504*;T65A+Q327F+E501V;T65A+Q327F+Y504T;T65A+E501V+Y504T;Q327F+E501V+Y504T;T65A+Q327F+Y504*;T65A+E501V+Y504*;Q327F+E501V+Y504*;T65A+Q327F+E501V+Y504T;T65A+Q327F+E501V+Y504*;E501V+Y504T;T65A+K161S;T65A+Q405T;T65A+Q327W;T65A+Q327F;T65A+Q327Y;P11F+T65A+Q327F;R1K+D3W+K5Q+G7V+N8S+T10K+P11S+T65A+Q327F;P2N+P4S+P11F+T65A+Q327F;P11F+D26C+K33C+T65A+Q327F;P2N+P4S+P11F+T65A+Q327W+E501V+Y504T;R1E+D3N+P4G+G6R+G7A+N8A+T10D+P11D+T65A+Q327F;P11F+T65A+Q327W;P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;P11F+T65A+Q327W+E501V+Y504T;T65A+Q327F+E501V+Y504T;T65A+S105P+Q327W;T65A+S105P+Q327F;T65A+Q327W+S364P;T65A+Q327F+S364P;T65A+S103N+Q327F;P2N+P4S+P11F+K34Y+T65A+Q327F;P2N+P4S+P11F+T65A+Q327F+D445N+V447S;P2N+P4S+P11F+T65A+I172V+Q327F;P2N+P4S+P11F+T65A+Q327F+N502*;P2N+P4S+P11F+T65A+Q327F+N502T+P563S+K571E;P2N+P4S+P11F+R31S+K33V+T65A+Q327F+N564D+K571S;P2N+P4S+P11F+T65A+Q327F+S377T;P2N+P4S+P11F+T65A+V325T+Q327W;P2N+P4S+P11F+T65A+Q327F+D445N+V447S+E501V+Y504T;P2N+P4S+P11F+T65A+I172V+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+S377T+E501V+Y504T;P2N+P4S+P11F+D26N+K34Y+T65A+Q327F;P2N+P4S+P11F+T65A+Q327F+I375A+E501V+Y504T;P2N+P4S+P11F+T65A+K218A+K221D+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+S103N+Q327F+E501V+Y504T;P2N+P4S+T10D+T65A+Q327F+E501V+Y504T;P2N+P4S+F12Y+T65A+Q327F+E501V+Y504T;K5A+P11F+T65A+Q327F+E501V+Y504T;P2N+P4S+T10E+E18N+T65A+Q327F+E501V+Y504T;P2N+T10E+E18N+T65A+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+T568N;P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+K524T+G526A;P2N+P4S+P11F+K34Y+T65A+Q327F+D445N+V447S+E501V+Y504T;P2N+P4S+P11F+R31S+K33V+T65A+Q327F+D445N+V447S+E501V+Y504T;P2N+P4S+P11F+D26N+K34Y+T65A+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+F80*+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+K112S+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+T516P+K524T+G526A;P2N+P4S+P11F+T65A+Q327F+E501V+N502T+Y504*;P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+S103N+Q327F+E501V+Y504T;K5A+P11F+T65A+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+T516P+K524T+G526A;P2N+P4S+P11F+T65A+V79A+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+V79G+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+V79I+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+V79L+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+V79S+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+L72V+Q327F+E501V+Y504T;S255N+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+E74N+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+G220N+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+Y245N+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+Q253N+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+D279N+Q327F+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+S359N+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+D370N+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+V460S+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+V460T+P468T+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+T463N+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+S465N+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+T477N+E501V+Y504T。在优选的实施例中,该草酸青霉菌葡糖淀粉酶变体具有K79V取代,使用本文的SEQIDNO:14进行编号(PE001变体),并且进一步包括以下突变中的一种:P11F+T65A+Q327F;P2N+P4S+P11F+T65A+Q327F;P11F+D26C+K33C+T65A+Q327F;P2N+P4S+P11F+T65A+Q327W+E501V+Y504T;P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;或P11F+T65A+Q327W+E501V+Y504T。在实施例中,葡糖淀粉酶变体,如草酸青霉菌葡糖淀粉酶变体与本文的SEQIDNO:14的成熟多肽具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、但小于100%同一性。产碳水化合物源的酶(特别是麦芽糖酶)能以从0.1微克EP/gDS至100微克EP/gDS、如0.5微克EP/gDS至50微克EP/gDS、如1微克EP/gDS至25微克EP/gDS、如2微克EP/gDS至12微克EP/gDS的量添加。在液化过程中存在的和/或添加的支链淀粉酶任选地,在液化步骤i)过程中支链淀粉酶可以与α-淀粉酶和具有大于80℃的熔点(DSC)的半纤维素酶(优选地木聚糖酶)一起存在和/或添加。如以上提及的,蛋白酶、产碳水化合物源的酶、优选地热稳定的葡糖淀粉酶也可以任选地在液化步骤i)过程中存在和/或添加。支链淀粉酶可以是在液化步骤i)和/或糖化步骤ii)或同时糖化发酵过程中存在的和/或添加的。支链淀粉酶(E.C.3.2.1.41,支链淀粉6-葡聚糖-水解酶)是去分支酶,其特征在于它们在例如分枝淀粉和支链淀粉中水解α-1,6-糖苷键的能力。根据本发明考虑的支链淀粉酶包括来自美国专利号4,560,651(特此通过引用结合)中披露的淀粉脱支芽孢杆菌(Bacillusamyloderamificans)的支链淀粉酶、WO01/151620(特此通过引用结合)中披露为SEQIDNO:2的支链淀粉酶、WO01/151620(特此通过引用结合)中披露为SEQIDNO:4的脱支芽孢杆菌(Bacillusderamificans)的支链淀粉酶,以及来自WO01/151620(特此通过引用结合)中披露为SEQIDNO:6的嗜酸性支链淀粉芽孢杆菌的支链淀粉酶,以及还有描述于FEMSMic.Let.[FEMS微生物学通讯](1994)115,97-106中的支链淀粉酶。根据本发明考虑的另外的支链淀粉酶包括来自沃斯氏热球菌、特别是来自WO92/02614中披露的沃斯氏热球菌DSMNo.3773的支链淀粉酶。在实施例中,该支链淀粉酶是GH57家族支链淀粉酶。在实施例中,该支链淀粉酶包括如披露于WO2011/087836中的(将其特此通过引用结合)中的X47结构域。更具体地该支链淀粉酶可以源自热球菌属的菌株,包括嗜热高温球菌(Thermococcuslitoralis)和热水高温球菌(Thermococcushydrothermalis),如显示在WO2011/087836中的在X47结构域之后的X4位点右侧截短的热水高温球菌支链淀粉酶。该支链淀粉酶还可以是嗜热高温球菌和热水高温球菌支链淀粉酶杂合体或具有截短位点X4的、披露于WO2011/087836(特此将其通过引用结合)中的热水高温球菌/嗜热高温球菌杂合酶。在另一个实施例中,该支链淀粉酶是包括披露于WO2011/076123(诺维信公司)中的X46结构域的一种支链淀粉酶。根据本发明,该支链淀粉酶能以有效量添加,包括约0.0001至10mg酶蛋白/克DS的优选量,优选0.0001至0.10mg酶蛋白/克DS,更优选0.0001至0.010mg酶蛋白/克DS。支链淀粉酶活性可以确定为NPUN。用于确定NPUN的测定法描述于下文的“材料与方法”-部分中。适合的可商购支链淀粉酶产品包括PROMOZYME400L、PROMOZYMETMD2(诺维信公司(NovozymesA/S),丹麦)、OPTIMAXL-300(杰能科公司,美国)、以及AMANO8安能满公司,日本)。液化过程中存在的和/或添加的植酸酶任选地,在液化中植酸酶可以与α-淀粉酶和具有大于80℃的熔点(DSC)的半纤维素酶(优选地木聚糖酶)组合存在和/或添加。根据本发明使用的植酸酶可以是能够从植酸(肌醇六磷酸盐)或其任何盐(植酸盐)中释放无机磷酸盐的任何酶。植酸酶可以根据其在初始水解步骤中的特异性进行分类,据此首先水解磷酸酯基团。本发明中使用的植酸酶可以具有任何特异性,例如是3-植酸酶(EC3.1.3.8)、或6-植酸酶(EC3.1.3.26)或5-植酸酶(无EC号)。在实施例中,植酸酶具有大于50℃最适温度,如在从50℃至90℃的范围。植酸酶可以源自植物或微生物,如细菌或真菌,例如酵母或丝状真菌。植物植酸酶可以来自麦麸、玉米、大豆或百合花粉。适合的植物植酸酶描述在Thomlinson等人,Biochemistry[生物化学],1(1962),166-171;Barrientos等人,Plant.Physiol.[植物生理学],106(1994),1489-1495;WO98/05785;WO98/20139中。细菌植酸酶可以来自芽孢杆菌属、柠檬酸杆菌属、哈夫尼菌属、假单胞菌属、布丘氏菌属或埃希氏菌属,特别是枯草芽孢杆菌、布氏柠檬酸杆菌、弗氏柠檬酸杆菌、蜂房哈夫尼菌、布伽瓦尼布丘氏菌(Buttiauxellagaviniae)、乡间布丘菌(Buttiauxellaagrestis)、Buttiauxellanoackies和大肠杆菌。适合的细菌植酸酶描述在Paver和Jagannathan,1982,JournalofBacteriology[细菌学杂志]151:1102-1108;Cosgrove,1970,AustralianJournalofBiologicalSciences[生物科学澳大利亚杂志]23:1207-1220;Greiner等人,Arch.Biochem.Biophys.[农业生物化学生物生理学],303,107-113,1993;WO1997/33976;WO1997/48812、WO1998/06856、WO1998/028408、WO2004/085638、WO2006/037327、WO2006/038062、WO2006/063588、WO2008/092901、WO2008/116878、和WO2010/034835中。酵母植酸酶可以源自酵母属或许旺酵母属,具体的物种是酿酒酵母或许旺酵母。前面的酶已经描述为适合的酵母植酸酶描述于Nayini等人,1984,LebensmittelWissenschaftundTechnologie[食品科学与技术]17:24-26;Wodzinski等人,Adv.Appl.Microbiol.[应用微生物学进展],42,263-303;AU-A-24840/95;来自丝状真菌的植酸酶可以源自子囊菌(Ascomycota、ascomycetes)真菌门或担子菌门,例如曲霉属、嗜热真菌属(也称为腐质霉属)、毁丝霉属、红曲霉属、青霉菌属、隔孢伏革属、田头菇属(Agrocybe)、桩菇属(Paxillus)或栓菌属(Trametes),具体的是物种土曲霉、黑曲霉、黑曲霉泡盛曲霉(Aspergillusnigervar.awamori)、无花果曲霉、烟曲霉、米曲霉、疏绵状嗜热丝孢菌(也称为疏棉状腐质霉)、嗜热毁丝霉、隔孢伏革菌、平田头菇(Agrocybepediades)、安卡红曲霉、卷边网褶菌(Paxillusinvoltus)或绒毛栓菌(Trametespubescens)。适合的真菌植酸酶描述在Yamada等人,1986,Agric.Biol.Chem.[农业和生物化学]322:1275-1282;Piddington等人,1993,Gene[基因]133:55-62;EP684,313;EP0420358;EP0684313;WO1998/28408;WO1998/28409;JP7-67635;WO1998/44125;WO1997/38096;WO1998/13480中。在优选的实施例中,植酸酶源自布丘氏菌属(如布伽瓦尼布丘氏菌、乡间布丘菌、或Buttiauxellanoackies),如分别披露为WO2008/092901(特此通过引用结合)中的SEQIDNO:2、SEQIDNO:4和SEQIDNO:6中的布丘氏菌属。在优选的实施例中,植酸酶源自柠檬酸杆菌属,如布氏柠檬酸杆菌,如在WO2006/037328(特此通过引用结合)中披露的。通过本领域已知的方法获得修饰的植酸酶或植酸酶变体,特别是通过以下中披露的方法:EP897010;EP897985;WO99/49022;WO99/48330、WO2003/066847、WO2007/112739、WO2009/129489、和WO2010/034835中。含有产物的可商购的植酸酶包括BIO-FEED植酸酶TM、植酸酶NOVOTMCT或L(均来自诺维信公司(Novozymes))、LIQMAX(杜邦公司(DuPont))或RONOZYMETMNP、HiPhos、P5000(CT)、NATUPHOSTMNG5000(来自DSM)。糖化和/或发酵过程中存在的和/或添加的产碳水化合物源的酶根据本发明,在糖化和/或发酵过程中存在和/或添加产碳水化合物源的酶,优选葡糖淀粉酶。在优选的实施例中,该产碳水化合物源的酶是一种真菌起源的葡糖淀粉酶,优选来自曲霉属,优选黑曲霉、泡盛曲霉、或米曲霉的菌株;或木霉属的菌株,优选里氏木霉;或篮状菌属的菌株,优选埃默森篮状菌的菌株,葡糖淀粉酶根据本发明,糖化和/或发酵中存在的和/或添加的葡糖淀粉酶可以来源于任何适合的来源,例如,来源于微生物或植物。优选的葡糖淀粉酶是真菌或细菌来源的,选自下组:曲霉属葡糖淀粉酶,特别是黑曲霉G1或G2葡糖淀粉酶(Boel等,1984,EMBOJ.[欧洲分子生物学学会杂志]3(5),第1097-1102页),或其变体,如WO92/00381、WO00/04136和WO01/04273中公开的那些(来自丹麦诺维信公司,(Novozymes,Denmark));WO84/02921中披露的泡盛曲霉葡糖淀粉酶、米曲霉葡糖淀粉酶(Agric.Biol.Chem.[农业和生物化学],1991,55(4):941-949),或其变体或片段。其他曲霉属葡糖淀粉酶变体包括具有增强热稳定性的变体:G137A和G139A(Chen等人(1996),Prot.Eng.[蛋白质工程]9,499-505);D257E和D293E/Q(Chen等人(1995),Prot.Eng.[蛋白质工程]8,575-582);N182(Chen等人(1994),Biochem.J[生物化学杂志]301,275-281);二硫键、A246C(Fierobe等人(1996),Biochemistry[生物化学],35,8698-8704);以及在A435和S436位置导入Pro残基(Li等人(1997),ProteinEng.[蛋白质工程]10,1199-1204)。其他葡糖淀粉酶包括罗耳阿太菌(以前命名为罗尔伏革菌)葡糖淀粉酶(参见美国专利号4,727,026和Nagasaka等人,(1998),“Purificationandpropertiesoftheraw-starch-degradingglucoamylasesfromCorticiumrolfsii[来自罗尔伏革菌的生淀粉降解葡糖淀粉酶的纯化和特性]”)Appl.Microbiol.Biotechnol.[应用微生物学与生物技术]50:323-330),篮状菌属葡糖淀粉酶,特别是来源于埃默森篮状菌(WO99/28448)、雷塞氏篮状菌(美国专利登记号32,153)、Talaromycesduponti、以及雷塞氏篮状菌(美国专利号4,587,215)。在优选的实施例中,糖化和/或发酵过程中使用的葡糖淀粉酶是WO99/28448中披露的埃默森篮状菌葡糖淀粉酶。涵盖的细菌葡糖淀粉酶包括来自梭菌属(Clostridium),特别是热解淀粉梭菌(C.thermoamylolyticum)(EP135,138)和热硫化氢梭菌(C.thermohydrosulfuricum)(WO86/01831)的葡糖淀粉酶。涵盖的真菌葡糖淀粉酶包括均在WO2006/069289中披露的瓣环栓菌,纸质大纹饰孢(Pachykytosporapapyracea);和大白桩蘑(Leucopaxillusgiganteus);和WO2007/124285中披露的红边隔孢伏革菌(Peniophorarufomarginata);或它们的混合物。根据本发明还涵盖杂合葡糖淀粉酶。实例包括WO2005/045018中披露的杂合葡糖淀粉酶。具体实例包括实例1的表1和4中披露的杂合葡糖淀粉酶(这些杂合体通过提述由此并入)。在实施例中,该葡糖淀粉酶来源于密孔菌属的菌株,具体地如WO2011/066576中所描述的密孔菌属菌株(SEQIDNO2、4或6);或来源于褐褶茵属的菌株,具体地如WO2011/068803中所描述的褐褶茵属的菌株(SEQIDNO:2、4、6、8、10、12、14或16)或黑层孔属的菌株,具体地如WO2012/064351中所披露的黑层孔属的菌株(SEQIDNO:2)(所有参考文献通过引用并入本文)。还考虑了以下葡糖淀粉酶,该葡糖淀粉酶展现与上述葡糖淀粉酶的任一种的高同一性,即,与上述酶序列的成熟部分中的任一个具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、例如100%的同一性。在实施例中,葡糖淀粉酶能以如下量添加到糖化和/或发酵中:0.0001至20AGU/gDS,优选0.001至10AGU/gDS,尤其是0.01至5AGU/gDS之间,如0.1至2AGU/gDS。包含葡糖淀粉酶的可商购组合物包括AMG200L;AMG300L;SANTMSUPER、SANTMEXTRAL、SPIRIZYMETMPLUS、SPIRIZYMETMFUEL、SPIRIZYMETMB4U、SPIRIZYMETMULTRA、SPIRIZYMETMEXCEL、SPIRIZYMETMACHIEVE、和AMGTME(来自诺维信公司(NovozymesA/S));OPTIDEXTM300、GC480、GC417(来自杰能科国际(GenencorInt.));AMIGASETM和AMIGASETMPLUS(来自DSM);G-ZYMETMG900、G-ZYMETM和G990ZR(来自美国丹尼斯克公司(DaniscoUS))。麦芽糖淀粉酶糖化和/或发酵过程中存在的和/或添加的产碳水化合物源的酶还可以是麦芽糖α-淀粉酶。“产麦芽糖α-淀粉酶”(葡聚糖1,4-α-麦芽水解酶,E.C.3.2.1.133)能将直链淀粉和支链淀粉水解成α-构型的麦芽糖。来自嗜热脂肪芽孢杆菌菌株NCIB11837的麦芽糖淀粉酶可商购自诺维信公司。麦芽糖α-淀粉酶描述于美国专利号4,598,048、4,604,355和6,162,628中,将其通过引用而特此结合。在优选的实施例中,能以0.05至5mg总蛋白/克DS或0.05至5MANU/gDS的量添加麦芽糖淀粉酶。在糖化和/或发酵或SSF中存在的和/或添加的纤维素酶或纤维素分解酶组合物在本发明的优选的实施例中在步骤ii)的糖化中和/或在步骤iii)的发酵或SSF中存在和/或添加纤维素酶或纤维素分解酶组合物。纤维素酶或纤维素分解酶组合物可以包含一种或多种纤维素分解酶。纤维素酶或纤维素分解酶组合物可以是任何来源。在优选的实施例中,纤维素酶或纤维素分解酶组合物包含真菌来源的纤维素分解酶。在实施例中,纤维素酶或纤维素分解酶组合物源自木霉属的菌株,如里氏木霉;或腐质霉属的菌株,例如特异腐质霉;或金孢子菌属的菌株,例如卢克诺文思金孢子菌(Chrysosporiumlucknowense);或青霉属的菌株,例如斜卧青霉。在优选实施例中,该纤维素分解酶组合物源自里氏木霉的菌株。纤维素酶可以是β-葡糖苷酶、纤维二糖水解酶和内切葡聚糖酶或其组合。该纤维素分解酶组合物可以包括β-葡糖苷酶、纤维二糖水解酶、和内切葡聚糖酶。在施例中,纤维素酶或纤维素分解酶组合物包括一种或多种选自下组的多肽,该组由以下组成:-β-葡糖苷酶;-纤维二糖水解酶I;-纤维二糖水解酶II;或它们的混合物。在优选实施例中,纤维素酶或纤维素分解酶组合物进一步包含具有纤维素分解增强活性的GH61多肽。如在WO2011/041397(通过引用结合)中所述限定和确定纤维素分解增强活性。术语“具有纤维素分解增强活性的GH61多肽”是指通过具有纤维素分解活性的酶增强纤维素材料的水解的GH61多肽。就本发明而言,通过测量来自由纤维素分解酶在下述条件下水解纤维素材料的还原糖增加或纤维二糖与葡萄糖的总量增加可以确定纤维素分解增强活性:在PCS(预处理的玉米秸秆)中的1mg至50mg的总蛋白/g的纤维素,其中总蛋白由以下组成:50%w/w至99.5%w/w纤维素分解酶蛋白和0.5%w/w至50%w/w与对照水解进行比较具有增强的纤维素分解活性的GH61多肽的蛋白(持续1至7天,在50℃),其中具有相等的总蛋白加载,但不具有增强的纤维素分解活性(1mg至50mg的纤维素分解蛋白/g的PCS中的纤维素)。在优选方面,使用在总蛋白重量的2%至3%的米曲霉β-葡糖苷酶(根据WO02/095014在米曲霉中重组地产生的)或总蛋白重量的2%至3%的烟曲霉β-葡糖苷酶(如WO2002/095014中所描述在米曲霉中重组地产生的)的纤维素酶蛋白负载量存在的情况下的CELLUCLASTTM1.5L(诺维信公司,巴格斯瓦尔德丹麦)的混合物作为纤维素分解活性的来源。纤维素分解酶组合物可以包含β-葡糖苷酶,优选地源自曲霉属的菌株如米曲霉的β-葡糖苷酶,如WO2002/095014中披露的β-葡糖苷酶或WO2008/057637中披露的具有β-葡糖苷酶活性的融合蛋白(参见SEQIDNO:74或76),或如烟曲霉的β-葡糖苷酶,如在WO2005/047499中的SEQIDNO:2或本文的EQIDNO:29中披露的β-葡糖苷酶,或WO2012/044915中披露的烟曲霉β-葡糖苷酶变体;或源自青霉属(Penicillium)的菌株,如WO2007/019442中披露的巴西青霉(Penicilliumbrasilianum)的菌株,或木霉属的菌株,如里氏木霉的菌株。在实施例中,该β-葡糖苷酶来自曲霉属的菌株,例如烟曲霉的菌株,例如是烟曲霉β-葡糖苷酶(在此的SEQIDNO:29)、或其变体,该变体包括一个或多个选自下组的取代,该组由以下组成:L89M、G91L、F100D、I140V、I186V、S283G、N456E以及F512Y;例如其变体,具有以下取代:-F100D+S283G+N456E+F512Y;-L89M+G91L+I186V+I140V;-I186V+L89M+G91L+I140V+F100D+S283G+N456E+F512Y(使用本文的SEQIDNO:29用于编号)。亲本β-葡糖苷酶与本文的SEQIDNO:29的成熟多肽可以具有至少60%同一性,如至少70%、如至少80%、如至少90%、如至少95%、如至少96%、如至少97%、如至少98%、如至少99%、如100%同一性。在β-葡糖苷酶是β-葡糖苷酶变体的情况下,它可以与本文的SEQIDNO:29的成熟多肽具有至少60%的同一性,如至少70%、如至少80%、如至少90%、如至少95%、如至少96%、如至少97%、如至少98%、如至少99%、但是小于100%同一性。在纤维素分解酶组合物可以包含GH61多肽的情况下,它可以是源自嗜热子囊菌属(如橙色嗜热子囊菌的菌株)的多肽,如WO2005/074656中作为SEQIDNO:2或本文的SEQIDNO:30所述的多肽;或源自梭孢壳属,如土生梭孢霉的菌株的多肽,如WO2005/074647中作为SEQIDNO:7和SEQIDNO:8描述的多肽;或源自曲霉属的菌株,如烟曲霉的菌株的多肽,如WO2010/138754中作为SEQIDNO:1和SEQIDNO:2描述的多肽;或源自青霉属的菌株如埃默森青霉的菌株的多肽,如WO2011/041397中作为SEQIDNO:2或本文的SEQIDNO:31披露的多肽。在优选的实施例中,GH61多肽(如源自青霉菌属的菌株(优选是埃默森青霉菌的菌株)的多肽)选自下组,该组由以下组成:(i)GH61多肽,包括本文的SEQIDNO:31的成熟多肽;(ii)包括以下氨基酸序列的GH61多肽,该氨基酸序列与在此的SEQIDNO:31的成熟多肽具有至少60%,例如至少70%,例如至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的同一性。在实施例中,该纤维素分解酶组合物包含纤维二糖水解酶I(CBHI),如源自曲霉属的菌株,如烟曲霉的菌株的,如WO2011/057140中的SEQIDNO:6或本文的SEQIDNO:32中披露的Cel7aCBHI,或源自木霉属的菌株,例如里氏木霉的菌株。在优选的实施例中,如源自曲霉属的菌株,优选是烟曲霉的菌株的纤维二糖水解酶I选自下组,该组由以下组成:(i)包含本文的SEQIDNO:32的成熟多肽的纤维二糖水解酶I;(ii)包括以下氨基酸序列的纤维二糖水解酶I,该氨基酸序列与在此的SEQIDNO:32的成熟多肽具有至少60%,例如至少70%,例如至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的同一性。在实施例中,纤维素分解酶组合物包含纤维二糖水解酶II(CBHII),如源自曲霉属的菌株,如烟曲霉的菌株的纤维二糖水解酶II;如披露为本文的SEQIDNO:33的纤维二糖水解酶II,或源自木霉属,如里氏木霉的菌株,或源自梭孢壳属的菌株,如土生梭孢霉的菌株,如是来自土生梭孢霉的纤维二糖水解酶IICEL6A。在优选的实施例中,如源自曲霉属的菌株,优选是烟曲霉的菌株的纤维二糖水解酶II选自下组,该组由以下组成:(i)包括在此的SEQIDNO:33的成熟多肽的纤维二糖水解酶II;(ii)包含氨基酸序列的纤维二糖水解酶II,该氨基酸序列与本文的SEQIDNO:33的成熟多肽具有至少60%、如至少70%,例如少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%同一性。在实施例中,该纤维素分解酶组合物包含具有纤维素分解增强活性的GH61多肽以及β-葡糖苷酶。在实施例中,纤维素分解酶组合物包括源自青霉属的菌株例如埃默森青霉菌菌株的具有纤维素分解增强活性的GH61多肽,例如披露为WO2011/041397中的SEQIDNO:2或在此的SEQIDNO:31的GH61多肽,以及β-葡糖苷酶。在实施例中,该纤维素分解酶组合物包含具有纤维素分解增强活性的GH61多肽、β-葡糖苷酶、以及CBHI。在实施例中,纤维素分解酶组合物包含源自青霉菌属的菌株(如埃默森青霉菌菌株)的具有纤维素分解增强活性的GH61多肽(例如披露为WO2011/041397中的SEQIDNO:2或本文的SEQIDNO:31的GH61多肽)、β-葡糖苷酶以及CBHI。在实施例中,该纤维素分解酶组合物包括具有纤维素分解增强活性的GH61多肽、β-葡糖苷酶、CBHI以及CBHII。在实施例中,纤维素分解酶组合物包含源自青霉菌属的菌株(如埃默森青霉菌的菌株)的具有纤维素分解增强活性的GH61多肽(例如披露为WO2011/041397中的SEQIDNO:2或本文的SEQIDNO:31的GH61多肽)、β-葡糖苷酶、CBHI、以及CBHII。在实施例中,纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,其进一步包含橙色嗜热子囊菌GH61A多肽(WO2005/074656中的SEQIDNO:2或本文的SEQIDNO:30)、以及米曲霉β-葡糖苷酶融合蛋白(WO2008/057637)。在实施例中,纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,其进一步包括具有纤维素分解增强活性的橙色嗜热子囊菌GH61A多肽(WO2005/074656中的SEQIDNO:2或本文的SEQIDNO:30)、以及烟曲霉β-葡糖苷酶(WO2005/047499的SEQIDNO:2或本文的SEQIDNO:29)。在实施例中,纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,其进一步包含披露为WO2011/041397中SEQIDNO:2或本文的SEQIDNO:31的埃默森青霉菌GH61A多肽、以及披露为WO2005/047499中的SEQIDNO:2或本文的SEQIDNO:29的烟曲霉β-葡糖苷酶或其变体,该变体具有以下取代的一个、优选地以下取代的全部:F100D、S283G、N456E、F512Y。在实施例中,纤维素分解酶组合物包含一种或多种以下组分:(i)烟曲霉纤维二糖水解酶I;(ii)烟曲霉纤维二糖水解酶II;(iii)烟曲霉β-葡糖苷酶或其变体。在实施例中,烟曲霉β-葡糖苷酶(在此的SEQIDNO:29)包括选自下组的一个或多个取代,该组由以下组成:L89M、G91L、F100D、I140V、I186V、S283G、N456E、和F512Y;例如其变体,具有以下取代:-F100D+S283G+N456E+F512Y;-L89M+G91L+I186V+I140V;或-I186V+L89M+G91L+I140V+F100D+S283G+N456E+F512Y。在实施例中,该纤维素分解酶组合物进一步包含本文的SEQIDNO:31中示出的青霉属GH61多肽;或GH61多肽,该GH61多肽包含与本文的SEQIDNO:31的成熟多肽具有至少60%、如至少70%,例如至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%、如100%同一性的氨基酸序列。在实施例中,纤维素分解酶组合物包含以下组分:(i)本文的SEQIDNO:32中显示的烟曲霉纤维二糖水解酶I;(ii)本文的SEQIDNO:33中显示的烟曲霉纤维二糖水解酶II;(iii)SEQIDNO:29中显示的具有以下取代的烟曲霉β-葡糖苷酶的变体:F100D+S283G+N456E+F512Y;以及(iv)本文的SEQIDNO:31中显示的青霉菌属GH61多肽。在实施例中,纤维素分解酶组合物(即,在步骤ii)的糖化和/或步骤iii)的发酵或SSF过程中)从0.0001至3mgEP/gDS、优选地0.0005至2mgEP/gDS、优选地0.001至1mg/gDS、更优选的从0.005至0.5mgEP/gDS、甚至更优选的0.01至0.1mgEP/gDS剂量添加。本发明优选方法的实例在优选的实施例中,本发明涉及从含淀粉材料生产发酵产物的方法,该方法包括以下步骤:i)在从大于4.0至6.5之间范围内的pH在从70℃至100℃范围内的温度,使用以下液化含淀粉材料:-源自嗜热脂肪芽孢杆菌的α-淀粉酶;-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;-具有大于70℃的熔点(DSC)的任选的内切葡聚糖酶;ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。在优选实施例中,本发明的方法包括以下步骤:i)在从大于4.5至6.2之间范围内的pH在大于初始糊化温度的温度,使用以下液化含淀粉材料:-α-淀粉酶,优选地源自嗜热脂肪芽孢杆菌,在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min);-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;-具有大于70℃的熔点(DSC)的任选的内切葡聚糖酶;ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。在优选实施例中,本发明的方法包括以下步骤:i)在从大于4.0至6.5之间范围内的pH在70℃至100℃之间的温,液化含淀粉材料:-细菌α-淀粉酶,优选地源自嗜热脂肪芽孢杆菌,在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min);-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;-具有在70℃和95℃之间的熔点(DSC)的任选的内切葡聚糖酶;-任选地,蛋白酶,优选地源自强烈火球菌或橙色嗜热子囊菌,具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值;ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。在优选实施例中,本发明的方法包括以下步骤:i)在从大于4.0至6.5之间范围内的pH在大于初始糊化温度的温度,使用以下液化含淀粉材料:-α-淀粉酶,该α-淀粉酶显示在SEQIDNO:1中的在位置R179+G180或I181+G182具有双缺失、以及任选的取代N193F的;以及任选地以下取代集合中的另一种:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S;-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用本文的SEQIDNO:1用于编号);-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;如与本文的SEQIDNO:3、4、5、8和34(优选地本文的SEQIDNO:5)的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性的木聚糖酶;-具有在70℃和95℃之间的熔点(DSC)的任选的内切葡聚糖酶;如与本文的SEQIDNO:9、35、36、37或38中显示的任何多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%的内切葡聚糖酶;-任选地,蛋白酶,该蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,源自强烈火球菌和/或橙色嗜热子囊菌;-任选地,本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶,优选地具有选自下组的取代:-K79V;-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F;(使用SEQIDNO:14用于编号);ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。在优选实施例中,本发明的方法包括以下步骤:i)在从大于4.0至6.5之间范围内的pH在70℃至100℃之间的温度,使用以下液化含淀粉材料:-源自嗜热脂肪芽孢杆菌的α-淀粉酶,该α-淀粉酶具有在位置I181+G182的双缺失、以及任选的取代N193F;以及任选地以下取代集合中的另一种:-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;或-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQIDNO:1本文(使用本文的SEQIDNO:1用于编号);-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;如与本文的SEQIDNO:3、4、5、8和34(优选地本文的SEQIDNO:5)的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性的木聚糖酶;-具有在70℃和95℃之间的熔点(DSC)的任选的内切葡聚糖酶;优选地与本文的SEQIDNO:9的多肽的成熟部分具有至少90%同一性;-任选的蛋白酶,该蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,源自强烈火球菌和/或橙色嗜热子囊菌;以及-任选地,本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶,优选地具有选自下组的取代:-K79V;或-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F(使用本文的SEQIDNO:14用于编号);ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。在优选实施例中,本发明的方法包括以下步骤:i)在从大于4.0至6.5之间范围内的pH在70℃至100℃之间的温度,使用以下液化含淀粉材料:-源自嗜热脂肪芽孢杆菌的α-淀粉酶,该α-淀粉酶具有在位置I181+G182的双缺失、以及任选的取代N193F;以及任选地以下取代集合中的另一种:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V;-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用在此的SEQIDNO:1进行编号);-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;-具有在70℃和95℃之间的熔点(DSC)的任选的内切葡聚糖酶;优选地与本文的SEQIDNO:9的多肽的成熟部分具有至少90%同一性;-蛋白酶,该蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,源自强烈火球菌;-本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶,优选地具有选自下组的取代:-K79V;-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F;或-K79V+P11F+D26C+K33C+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327W+E501V+Y504T;或-K79V+P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;或-K79V+P11F+T65A+Q327W+E501V+Y504T(使用本文的SEQIDNO:14用于编号);ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。在优选的实施例中,在发酵或同时糖化和发酵过程中存在和/或添加纤维素酶或纤维素分解酶组合物。在优选的实施例中,在发酵或同时糖化和发酵(SSF)过程中存在和/或添加源自里氏木霉的纤维素酶或纤维素分解酶组合物。在优选的实施例中,在发酵或同时糖化和发酵过程中存在和/或添加纤维素酶或纤维素分解酶组合物和葡糖淀粉酶。在实施例中,纤维素酶或纤维素分解酶组合物源自里氏木霉、特异腐质霉、卢克诺文思金孢子菌或斜卧青霉。本发明的组合物本发明的组合物包含α-淀粉酶(如热稳定的α-淀粉酶)和具有大于80℃的熔点(DSC)的半纤维素酶(优选地木聚糖酶);具有大于70℃的熔点(DSC)的任选的内切葡聚糖酶;任选的蛋白酶(如热稳定的蛋白酶)。该组合物还进一步包含产碳水化合物源的酶,特别是葡糖淀粉酶、任选地支链淀粉酶以及任选地植酸酶。因此,在这个方面,本发明涉及包含以下项的组合物:-α-淀粉酶;-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;-具有大于70℃的熔点(DSC)的任选的内切葡聚糖酶;-任选地,蛋白酶;-任选地,产碳水化合物源的酶。α-淀粉酶:该α-淀粉酶可以是任何α-淀粉酶。在优选的实施例中,α-淀粉酶是细菌α-淀粉酶,如源自芽孢杆菌属(如嗜热脂肪芽孢杆菌)的α-淀粉酶,优选地本文的SEQIDNO:1中显示的α-淀粉酶。该α-淀粉酶可以是热稳定的α-淀粉酶。该热稳定性α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下可以具有至少10的T1/2(min),例如至少15,例如至少20,例如至少25,例如至少30,例如至少40,例如至少50,例如至少60,例如在10至70之间,例如在15至70之间,例如在20至70之间,例如在25至70之间,例如在30至70之间,例如在40至70之间,例如在50至70之间,例如在60至70之间。在实施例中,该α-淀粉酶选自嗜热脂肪芽孢杆菌α-淀粉酶变体,特别是具有选自下组的突变的截短至491个氨基酸长(如从480个至495个氨基酸长):-I181*+G182*;-I181*+G182*+N193F;优选地-I181*+G182*+E129V+K177L+R179E;-I181*+G182*+N193F+E129V+K177L+R179E;-I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-I181*+G182*+N193F+V59AQ89R+E129V+K177L+R179E+Q254S+M284V;以及-I181*+G182*+N193F+E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用本文的SEQIDNO:1用于编号)。应理解,这些α-淀粉酶仅是具体实例。在上文的“液化过程中存在的和/或添加的α-淀粉酶”-部分中披露的任何α-淀粉酶可以用作在本发明的组合物中的α-淀粉酶组分。内切葡聚糖酶:根据本发明,任选的内切葡聚糖酶组分可以包含在该组合物中。其可以是具有大于70℃、如大于75℃、特别是大于80℃、如在70℃和95℃之间的熔点(DSC)的任何内切葡聚糖酶,使用在以下“材料与方法”部分中所述的差示扫描量热法(DSC)所确定的。在实施例中,内切葡聚糖酶具有大于72℃、如大于74℃、如大于76℃、如大于78℃、如大于80℃、如大于82℃、如大于84℃、如大于86℃、如大于88℃、如在70℃和95℃之间、如在76℃和94℃之间、如在78℃和93℃之间、如在80℃和92℃之间、如在82℃和91℃之间、如在84℃和90℃之间的熔点(DSC)。在优选的实施例中,包含在本发明的组合物中的在本发明的方法中使用的内切葡聚糖酶是糖苷水解酶家族5内切葡聚糖酶或GH5内切葡聚糖酶(参见在“www.cazy.org”网站的CAZy数据库)。在实施例中,GH5内切葡聚糖酶来自家族EGII,如本文的SEQIDNO:9中显示的雷塞氏篮状菌内切葡聚糖酶;本文的SEQIDNO:35中显示的胶囊青霉内切葡聚糖酶、以及本文的SEQIDNO:36中显示的褐孢长毛盘菌内切葡聚糖酶。在实施例中,内切葡聚糖酶是家族GH45内切葡聚糖酶。在实施例中,GH45内切葡聚糖酶来自家族EGV,如本文的SEQIDNO:38中显示的粪生粪壳菌或本文的SEQIDNO:37中显示的土生梭孢壳酶内切葡聚糖酶。在实施例中,内切葡聚糖酶与本文的SEQIDNO:9的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。在实施例中,内切葡聚糖酶是源自篮状菌属的菌株,如雷塞氏篮状菌的菌株。在实施例中,内切葡聚糖酶与本文的SEQIDNO:35的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自青霉菌属的菌株,如胶囊青霉的菌株。在实施例中,内切葡聚糖酶与本文的SEQIDNO:36的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自长毛盘菌属的菌株,如褐孢长毛盘菌的菌株。在实施例中,切葡聚糖酶与本文的SEQIDNO:37的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自梭孢壳属的菌株、如土生梭孢壳酶的菌株。在实施例中,内切葡聚糖酶与本文的SEQIDNO:38的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自粪壳菌属的菌株,如粪生粪壳菌的菌株。应当理解是,这些内切葡聚糖酶仅仅是具体实例。以上在“在液化过程中存在和/或添加的热稳定的内切葡聚糖酶”-部分中披露的任何内切葡聚糖酶可以用于本发明的组合物中的任选的内切葡聚糖酶部分。在尤其优选的实施例中,内切葡聚糖酶(EG)与本文的SEQIDNO:9的多肽的成熟部分具有至少90%同一性,源自具有大于80℃的熔点(DSC)的雷塞氏篮状菌的菌株。蛋白酶:本发明的组合物可以任选地包含蛋白酶,如热稳定的蛋白酶。对该蛋白酶组分的起源没有限制,只要其满足在此定义的热稳定性特性。在实施例中,该蛋白酶是真菌来源的。在实施例中,该蛋白酶是金属蛋白酶。在实施例中,该蛋白酶源自本文的SEQIDNO:2中显示的橙色嗜热子囊菌。在优选的实施例中,该蛋白酶是具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值(如实例2中所述的进行测定)的上述橙色嗜热子囊菌蛋白酶的变体。在具体优选的实施例中,该蛋白酶是源自橙色嗜热子囊菌的金属蛋白酶的变体,披露为WO2003/048353中披露的SEQIDNO:2的成熟部分或WO2010/008841中SEQIDNO:1的成熟部分或本文的SEQIDNO:2,具有选自下组的突变:-D79L+S87P+A112P+D142L;-D79L+S87P+D142L;以及-A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L。在另一个实施例中,该蛋白酶是细菌蛋白酶。在另一个实施例中,该蛋白酶是丝氨酸蛋白酶。在优选的实施例中,该蛋白酶源自强烈火球菌的菌株,如US6,358,726中的SEQIDNO:1或本文的SEQIDNO:13中显示的蛋白酶。应理解,这些蛋白酶仅是实例。在上文的“液化过程中存在的和/或添加的蛋白酶”-部分中披露的任何蛋白酶可以用作在本发明的组合物中的蛋白酶组分。产碳水化合物源的酶:本发明的组合物可以任选地进一步包含产碳水化合物源的酶,特别是葡糖淀粉酶(如热稳定的葡糖淀粉酶),其在85℃、pH5.3具有至少30%(优选地至少35%)的热稳定性。所述产碳水化合物源的酶可以是热稳定性葡糖淀粉酶,该热稳定性葡糖淀粉酶在85℃具有至少20%、至少30%、优选至少35%的相对活性热稳定性,如实例4(热稳定性)中描述的进行测定。在实施例中,该产碳水化合物源的酶是葡糖淀粉酶,在pH5.0的pH最佳值时具有至少90%,优选至少95%,优选至少97%,例如100%的相对活性,如实例4(pH最佳值)中描述的进行测定。在实施例中,该产碳水化合物源的酶是葡糖淀粉酶,在pH5.0具有至少80%,至少85%、至少90%的pH稳定性,如实例4(pH稳定性)中描述的进行测定。在优选的实施例中,该产碳水化合物源的酶是热稳定的葡糖淀粉酶,优选真菌来源,优选丝状真菌,如来自青霉属的菌株,尤其是在WO2011/127802(特此将其通过引用结合)中披露为SEQIDNO:2的草酸青霉菌的菌株或其变体,并显示在本文的SEQIDNO:14中。在实施例中,该葡糖淀粉酶或其变体与显示在WO2011/127802中的SEQIDNO:2或本文的SEQIDNO:14的成熟多肽可以具有至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。在具体并优选的实施例中,产碳水化合物源的酶是披露为WO2011/127802中的SEQIDNO:2以及显示在本文的SEQIDNO:14中的草酸青霉葡糖淀粉酶的变体,该变体具有K79V取代(使用本文的SEQIDNO:14中所示的成熟序列用于编号)。如WO2013/036526(其通过提述由此并入)中披露的,该K79V葡糖淀粉酶变体相对于亲本对蛋白酶降解具有降低的敏感度。适合的热稳定的草酸青霉菌葡糖淀粉酶变体的实例在上文以及在以下实例17和18中列出。在实施例中,产碳水化合物源的酶,如葡糖淀粉酶、如草酸青霉菌葡糖淀粉酶具有支链淀粉酶副活性。应理解,这些产碳水化合物源的酶,特别是葡糖淀粉酶仅是实例。在上文的“液化过程中存在的和/或添加的产碳水化合物源的酶”-部分中披露的任何产碳水化合物源的酶可以用作在本发明的组合物中的组分。在优选的实施例中,该产碳水化合物源的酶是显示在本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶或者与进一步包含K79V取代的其具有至少90%同一性的序列。支链淀粉酶:本发明的组合物可以任选地进一步包含支链淀粉酶。该支链淀粉酶可以是任何来源的。在实施例中,该支链淀粉酶是细菌来源的。在实施例中,该支链淀粉酶源自芽孢杆菌属的菌株。在实施例中,该支链淀粉酶是GH57家族支链淀粉酶。在优选的实施例中,该支链淀粉酶包括如披露于WO2011/087836中的(将其特此通过引用结合)中的X47结构域。具体地,该支链淀粉酶可以来源于来自嗜热球菌属的菌株,包括嗜热高温球菌和热水高温球菌,或其杂合体。支链淀粉酶可以是显示在本文的SEQIDNO:11在位点X4截短的热水高温球菌支链淀粉酶,或者如WO2011/087836中披露的具有截短位点X4的热水高温球菌/嗜热高温球菌杂合酶(SEQIDNO:12本文)。另一个实施例中,该支链淀粉酶是包括披露于WO2011/076123(诺维信公司(Novozymes))中的X46结构域的支链淀粉酶。应理解,这些支链淀粉酶仅是具体实例。以上在“在液化过程中存在和/或添加的支链淀粉酶”-部分中披露的任何支链淀粉酶可以用于本发明的组合物中的任选的支链淀粉酶部分。植酸酶:本发明的组合物可以任选地进一步包含植酸酶。该植酸酶可以是任何来源的。在实施例中,该植酸酶是细菌来源的。在实施例中,该植酸酶源自布丘氏菌属,如布伽瓦尼布丘氏菌的菌株,如披露为(氨基酸1-33预期是信号肽)WO2008/092901中的SEQIDNO:2的植酸酶布伽瓦尼布丘氏菌;或乡间布丘菌,如显示为WO2008/092901中SEQIDNO:4(氨基酸-9至-1预期为信号肽的部分)的乡间布丘菌;或Buttiauxellanoackies,如显示为WO2008/092901中SEQIDNO:6的Buttiauxellanoackies。在另一个实施例中,该植酸酶是源自柠檬酸杆菌属的菌株,如布氏柠檬酸杆菌的菌株,如披露为WO2006/037328(特此通过引用结合)中的SEQIDNO:2或4的菌株。应当理解的是,这些植酸酶仅仅是具体实例。以上在“在液化过程中存在和/或添加的植酸酶”-部分中披露的任何植酸酶可以用于本发明的组合物中的任选的植酸酶部分。在优选的实施例中,植酸酶源自布丘氏菌属的菌株。本发明的组合物的优选的实施例的实例在优选的实施例中,本发明的组合物包含-源自嗜热脂肪芽孢杆菌的α-淀粉酶;-具有大于80℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;-具有大于70℃(如在70℃和95℃之间)的熔点(DSC)的任选的内切葡聚糖酶;-任选地,蛋白酶,该蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,源自强烈火球菌或橙色嗜热子囊菌;以及-任选地,葡糖淀粉酶,如源自草酸青霉菌的葡糖淀粉酶。在另一个实施例中,本发明的组合物包含-α-淀粉酶,优选地源自嗜热脂肪芽孢杆菌,在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min);-具有大于80℃熔点(DSC)的半纤维素酶,优选地木聚糖酶;-具有在70℃和95℃之间的熔点(DSC)的任选的内切葡聚糖酶;-任选的蛋白酶,优选地源自强烈火球菌或橙色嗜热子囊菌,具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值;以及-任选地,葡糖淀粉酶,例如源自草酸青霉菌。在另一个实施例中,本发明的组合物包含-源自嗜热脂肪芽孢杆菌的α-淀粉酶,该α-淀粉酶具有在位置I181+G182的双缺失、以及任选的取代N193F;以及任选地以下取代集合中的另一种:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V;以及-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用在此的SEQIDNO:1进行编号);-具有大于80℃的熔点(DSC)的半纤维素酶;-具有大于70℃的熔点(DSC)的任选的内切葡聚糖酶;-任选地,蛋白酶,优选地源自强烈火球菌和/或橙色嗜热子囊菌,具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值;以及-任选地一种SEQIDNO:14的草酸青霉菌葡糖淀粉酶,具有选自下组的取代:-K79V;-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F;或-K79V+P11F+D26C+K33C+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327W+E501V+Y504T;或-K79V+P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;或-K79V+P11F+T65A+Q327W+E501V+Y504T(使用SEQIDNO:14用于编号)。在实施例中,该嗜热脂肪芽孢杆菌α-淀粉酶(本文的SEQIDNO:1)或其变体是成熟α-淀粉酶或与本文的SEQIDNO:1具有至少80%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少99%同一性的相应的成熟α-淀粉酶。在实施例中,半纤维素酶,特别是木聚糖酶,尤其是GH10或GH11木聚糖酶具有大于82℃,如大于84℃、如大于86℃、如大于88℃、如大于88℃、如大于90℃、如大于92℃、如大于94℃、如大于96℃、如大于98℃、如大于100℃、如在80℃和110℃之间、如在82℃和110℃之间、如在84℃和110℃之间的熔点(DSC)。适合的半纤维素酶(特别是木聚糖酶)的实例包括源自嗜热网团菌的菌株的显示在本文的SEQIDNO:3或本文的SEQIDNO:34中的木聚糖酶;源自Rasomsoniabyssochlamydoides的菌株的显示在本文SEQIDNO:4中的木聚糖酶;源自雷塞氏篮状菌的菌株的显示在本文SEQIDNO:5中的木聚糖酶;源自烟曲霉的菌株的显示在本文的SEQIDNO:8中的木聚糖酶、或具有半纤维素酶活性(优选地木聚糖酶活性)的多肽,该多肽与本文的SEQIDNO:3、4、5、8和34的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性,优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%,如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。在实施例中,该任选的内切葡聚糖酶具有大于74℃、如大于76℃、如大于78℃、如大于80℃、如大于82℃、如大于84℃、如大于86℃、如大于88℃、如在70℃和95℃之间、如在76℃和94℃之间、如在78℃和93℃之间、如在80℃和92℃之间、如在82℃和91℃之间、如在84℃和90℃之间的熔点(DSC)。在实施例中,该任选的内切葡聚糖酶与本文的SEQIDNO:9、35、36、37或38的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性。在实施例中,该内切葡聚糖酶与本文的SEQIDNO:9的多肽的成熟部分具有至少80%同一性。在实施例中,该内切葡聚糖酶与本文的SEQIDNO:9的多肽的成熟部分具有至少90%同一性,该内切葡聚糖酶具有大于70℃的熔点(DSC)。在实施例中,该强烈火球菌蛋白酶(本文的SEQIDNO:13)和/或橙色嗜热子囊菌蛋白酶(本文的SEQIDNO:2)或其变体是成熟蛋白酶、或分别与本文的SEQIDNO:2或本文的SEQIDNO:13具有至少80%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少99%同一性的相应的成熟蛋白酶。在实施例中,草酸青霉菌葡糖淀粉酶(本文的SEQIDNO:14)或其变体是成熟葡糖淀粉酶、或与本文的SEQIDNO:14具有至少80%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少99%同一性的相应的成熟葡糖淀粉酶。本发明的另外方面在本发明的另外的方面,其涉及使用本发明的组合物用于液化含淀粉材料。在本发明的最后方面,其涉及生产液化的淀粉的方法,该方法包括用本发明的组合物液化含淀粉材料。在以下各段落中进一步概述本发明:1.一种用于从含淀粉材料生产发酵产物的方法,该方法包括以下步骤:i)在高于初始糊化温度的温度,使用以下项液化该含淀粉材料:-α-淀粉酶;-具有大于80℃的熔点(DSC)的半纤维素酶;ii)使用产碳水化合物源的酶进行糖化;iii)使用发酵生物进行发酵。2.如段落1所述的方法,其中该半纤维素酶是木聚糖酶,特别是GH10木聚糖酶或GH11木聚糖酶。3.如段落1或2所述的方法,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10或GH11木聚糖酶具有大于82℃、如大于84℃、如大于86℃、如大于88℃、如大于88℃、如大于90℃、如大于92℃、如大于94℃、如大于96℃、如大于98℃、如大于100℃、如在80℃和110℃之间、如在82℃和110℃之间、如在84℃和110℃之间的熔点(DSC)。4.如段落1-3中任一项所述的方法,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10或GH11木聚糖酶与本文的SEQIDNO:3(GH10)或本文的SEQIDNO:34(GH11)的多肽的成熟部分具有至少60%、如至少70%、如至少75%、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自网团菌属的菌株,如嗜热网团菌的菌株。5.如段落1-3中任一项所述的方法,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:4的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自Rasamsonia属的菌株,如Rasomsoniabyssochlamydoides的菌株。6.如段落1-3中任一项所述的方法,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:5的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自篮状菌属的菌株,如雷塞氏篮状菌的菌株。7.如段落1或2所述的方法,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:8的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自曲霉属的菌株,如烟曲霉的菌株。8.如段落1-7中任一项所述的方法,其中-α-淀粉酶;-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是95℃的熔点(DSC)的半纤维素酶;-具有大于70℃、优选地大于75℃、特别是大于80℃、尤其是大于85℃的熔点(DSC)的任选的内切葡聚糖酶是在液化步骤i)中存在的和/或添加的。9.如段落1-8中任一项所述的方法,在液化步骤i)之前进一步包括以下步骤:a)优选地通过干式碾磨来减小含淀粉材料的粒度;b)形成包含该含淀粉材料和水的浆料。10.如段落1-9中任一项所述的方法,其中至少50%,优选至少70%,更优选至少80%,尤其是至少90%的含淀粉材料适合通过一个具有#6筛网的筛子。11.如段落1-10中任一项所述的方法,其中在液化过程中的pH是在4.0至6.5之间,如4.5至6.2、如大于4.8至6.0、如在5.0至5.8之间。12.如段落1-11中任一项所述的方法,其中在液化过程中的温度是在从70℃至100℃的范围,如在70℃至95℃之间、如在75℃至90℃之间、优选地在80℃至90℃之间、如约85℃。13.如段落1-12中任一项所述的方法,其中在步骤i)的液化之前进行喷射蒸煮步骤。14.如段落13所述的方法,其中该喷射蒸煮在95℃至160℃之间、如在110℃至145℃之间、优选地120℃至140℃、如125℃至135℃、优选地约130℃的温度进行约1分钟至15分钟、优选地进行约3分钟至10分钟、尤其是大约5分钟左右。15.如段落1-14中任一项所述的方法,其中糖化和发酵是顺序进行或同时进行。16.如段落1-15中任一项所述的方法,其中糖化在从20℃至75℃、优选地从40℃至70℃、如约60℃的温度,以及在4和5之间的pH进行。17.如段落1-16中任一项所述的方法,其中发酵或同时糖化和发酵(SSF)在从25℃至40℃、如从28℃至35℃、如从30℃至34℃、优选地大约32℃左右的温度进行如6至120小时、特别是24至96小时。18.如段落1-17中任一项所述的方法,其中发酵产物是在发酵之后,例如通过蒸馏回收的。19.如段落1-18中任一项所述的方法,其中发酵产物是醇,优选乙醇,尤其是燃料乙醇、饮用乙醇和/或工业乙醇。19.如段落1-18中任一项所述的方法,其中该含淀粉起始材料是全谷物。20.如段落1-19中任一项所述的方法,其中该含淀粉材料源自玉米、小麦、大麦、黑麦、蜀黍、西米、木薯、树薯、木薯淀粉、高粱、稻或马铃薯。21.如段落1-20中任一项所述的方法,其中该发酵生物是酵母,优选酵母属菌株,尤其是酿酒酵母菌株。23.如段落1-22中任一项所述的方法,其中该α-淀粉酶是细菌α-淀粉酶,特别地源自芽孢杆菌属,如嗜热脂肪芽孢杆菌的菌株,特别是嗜热脂肪芽孢杆菌α-淀粉酶的变体,如在WO99/019467中的SEQIDNO:3或本文的SEQIDNO:1中显示的α-淀粉酶。24.如段落23所述的方法,其中该嗜热脂肪芽孢杆菌α-淀粉酶或其变体是截短的,优选为约491个氨基酸长,如从约480个至495个氨基酸长。25.如段落23或24中任一项所述的方法,其中该嗜热脂肪芽孢杆菌α-淀粉酶具有在位置I181+G182的双缺失、以及任选地N193F取代、或在位置R179+G180的双缺失(使用本文的SEQIDNO:1进行编号)。26.如段落23-25中任一项所述的方法,其中该嗜热脂肪芽孢杆菌α-淀粉酶在位置S242具有取代、优选地S242Q或S242A取代(使用本文的SEQIDNO:1用于编号)。27.如段落23-26中任一项所述的方法,其中该嗜热脂肪芽孢杆菌α-淀粉酶在位置E188具有取代、优选地E188P取代(使用本文的SEQIDNO:1用于编号)。28.如段落1-27中任一项所述的方法,其中该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min),例如至少15,例如至少20,例如至少25,例如至少30,例如至少40,例如至少50,例如至少60,例如在10至70之间,例如在15至70之间,例如在20至70之间,例如在25至70之间,例如在30至70之间,例如在40至70之间,例如在50至70之间,例如在60至70之间。29.如段落1-28中任一项所述的方法,其中该α-淀粉酶选自下组:具有以下突变的嗜热脂肪芽孢杆菌α-淀粉酶变体:I181*+G182*、以及任选地N193F(使用SEQIDNO:1用于编号),以及任选地另外的:30.如段落1-29中任一项所述的方法,其中该α-淀粉酶选自嗜热脂肪芽孢杆菌α-淀粉酶变体的组:-I181*+G182*;-I181*+G182*+N193F;优选地-I181*+G182*+E129V+K177L+R179E;-I181*+G182*+N193F+E129V+K177L+R179E;-I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S-I181*+G182*+N193F+V59AQ89R+E129V+K177L+R179E+Q254S+M284V;以及-I181*+G182*+N193F+E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用SEQIDNO:1用于编号)。31.如段落1-30中任一项所述的方法,进一步地其中在液化中存在和/或添加蛋白酶,其中该蛋白酶具有确定为在80℃/70℃的相对活性的、超过25%的热稳定性值。32.如段落1-31中任一项所述的方法,其中该蛋白酶具有确定为在80℃/70℃的相对活性的,超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%、超过100%、如超过105%、如超过110%、如超过115%、如超过120%的热稳定性。33.如段落1-26中任一项所述的方法,其中该蛋白酶具有确定为在80℃/70℃的相对活性的,在20%和50%之间、如在20%和40%之间、如在20%和30%之间的热稳定性。34.如段落1-33中任一项所述的方法,其中该蛋白酶具有确定为在80℃/70℃的相对活性的,在50%和115%之间、如在50%和70%之间、如在50%和60%之间、如在100%和120%之间、如在105%和115%之间的热稳定性,或者其中该蛋白酶具有确定为在85℃/70℃的相对活性的,超过10%、如超过12%、超过14%、超过16%、超过18%、超过20%、超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%、超过100%、超过110%的热稳定性。35.如段落1-34中任一项所述的方法,其中该蛋白酶具有确定为在85℃/70℃的相对活性的,在10%和50%之间、如在10%和30%之间、如在10%和25%之间的热稳定性。36.如段落1-35中任一项所述的方法,其中该蛋白酶在85℃具有高于60%、如高于90%、如高于100%、如高于110%的热稳定性,如使用Zein-BCA测定法确定的。37.如段落1-36中任一项所述的方法,其中该蛋白酶在85℃具有在60%至120%之间、如在70%至120%之间、如在80%至120%之间、如在90%至120%之间、如在100%至120%之间、如110%至120%的热稳定性,如使用Zein-BCA测定法确定的。38.如段落1-37中任一项所述的方法,其中该蛋白酶是真菌来源的。39.如段落1-38中任一项所述的方法,其中该蛋白酶是源自嗜热子囊菌属的菌株、优选地橙色嗜热子囊菌的菌株、尤其是橙色嗜热子囊菌CGMCCNo.0670的金属蛋白酶、特别是SEQIDNO:2中显示的成熟序列的变体。40.如段落1-39中任一项所述的方法,其中该蛋白酶是披露为以下的金属蛋白酶的变体:WO2003/048353中披露的SEQIDNO:2的成熟部分或WO2010/008841中SEQIDNO:1的成熟部分或本文的SEQIDNO:2,突变选自下组:-S5*+D79L+S87P+A112P+D142L;-D79L+S87P+A112P+T124V+D142L;-S5*+N26R+D79L+S87P+A112P+D142L;-N26R+T46R+D79L+S87P+A112P+D142L;-T46R+D79L+S87P+T116V+D142L;-D79L+P81R+S87P+A112P+D142L;-A27K+D79L+S87P+A112P+T124V+D142L;-D79L+Y82F+S87P+A112P+T124V+D142L;-D79L+Y82F+S87P+A112P+T124V+D142L;-D79L+S87P+A112P+T124V+A126V+D142L;-D79L+S87P+A112P+D142L;-D79L+Y82F+S87P+A112P+D142L;-S38T+D79L+S87P+A112P+A126V+D142L;-D79L+Y82F+S87P+A112P+A126V+D142L;-A27K+D79L+S87P+A112P+A126V+D142L;-D79L+S87P+N98C+A112P+G135C+D142L;-D79L+S87P+A112P+D142L+T141C+M161C;-S36P+D79L+S87P+A112P+D142L;-A37P+D79L+S87P+A112P+D142L;-S49P+D79L+S87P+A112P+D142L;-S50P+D79L+S87P+A112P+D142L;-D79L+S87P+D104P+A112P+D142L;-D79L+Y82F+S87G+A112P+D142L;-S70V+D79L+Y82F+S87G+Y97W+A112P+D142L;-D79L+Y82F+S87G+Y97W+D104P+A112P+D142L;-S70V+D79L+Y82F+S87G+A112P+D142L;-D79L+Y82F+S87G+D104P+A112P+D142L;-D79L+Y82F+S87G+A112P+A126V+D142L;-Y82F+S87G+S70V+D79L+D104P+A112P+D142L;-Y82F+S87G+D79L+D104P+A112P+A126V+D142L;-A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L;-A27K+Y82F+S87G+D104P+A112P+A126V+D142L;-A27K+D79L+Y82F+D104P+A112P+A126V+D142L;-A27K+Y82F+D104P+A112P+A126V+D142L;-A27K+D79L+S87P+A112P+D142L;以及-D79L+S87P+D142L。41.如段落1-40中任一项所述的方法,其中该蛋白酶是披露为以下的金属蛋白酶的变体:WO2003/048353中披露的SEQIDNO:2的成熟部分或WO2010/008841中SEQIDNO:1的成熟部分或本文的SEQIDNO:2,具有以下突变:D79L+S87P+A112P+D142L;D79L+S87P+D142L;或A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L。42.如段落1-41中任一项所述的方法,其中该蛋白酶变体与WO2003/048353中披露的SEQIDNO:2的多肽的成熟部分或WO2010/008841中SEQIDNO:1的成熟部分或本文的SEQIDNO:2具有至少75%同一性、优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、以及甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、但小于100%同一性。43.如段落1-42中任一项所述的方法,其中显示在SEQIDNO:2中的橙色嗜热子囊菌蛋白酶的蛋白酶变体是以下中的一种:-D79L+S87P+D142L-D79L+S87P+A112P+D142L-D79L+Y82F+S87P+A112P+D142L-S38T+D79L+S87P+A112P+A126V+D142L-D79L+Y82F+S87P+A112P+A126V+D142L-A27K+D79L+S87P+A112P+A126V+D142L-S49P+D79L+S87P+A112P+D142L-S50P+D79L+S87P+A112P+D142L-D79L+S87P+D104P+A112P+D142L-D79L+Y82F+S87G+A112P+D142L-S70V+D79L+Y82F+S87G+Y97W+A112P+D142L-D79L+Y82F+S87G+Y97W+D104P+A112P+D142L-S70V+D79L+Y82F+S87G+A112P+D142L-D79L+Y82F+S87G+D104P+A112P+D142L-D79L+Y82F+S87G+A112P+A126V+D142L-Y82F+S87G+S70V+D79L+D104P+A112P+D142L-Y82F+S87G+D79L+D104P+A112P+A126V+D142L-A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L。44.如段落1-43中任一项所述的方法,其中该蛋白酶是细菌来源的。45.如段落1-44中任一项所述的方法,其中该蛋白酶是源自火球菌属菌株,优选强烈火球菌菌株。46.如段落1-45中任一项所述的方法,其中蛋白酶是在US6,358,726中的SEQIDNO:1、或在此的SEQIDNO:13中示出的蛋白酶。47.如段落1-46中任一项所述的方法,其中该蛋白酶是与US6,358,726中的SEQIDNO:1或本文的SEQIDNO:13具有至少80%、如至少85%、如至少90%、如至少95%、如至少96%、如至少97%、如至少98%、如至少99%同一性的蛋白酶。48.如段落1-47中任一项所述的方法,进一步地其中在液化步骤i)过程中存在和/或添加产碳水化合物源的酶,优选地葡糖淀粉酶。49.如段落1-48中任一项所述的方法,其中在液化步骤i)过程中存在和/或添加的该产碳水化合物源的酶是在85℃、pH5.3具有至少20%、例如至少30%,优选至少35%的热稳定性的葡糖淀粉酶。50.如段落48-49中任一项所述的方法,其中该产碳水化合物源的酶是葡糖淀粉酶,该葡糖淀粉酶在pH5.0的pH最佳值时具有至少90%,优选至少95%,优选至少97%的相对活性。51.如段落48-50中任一项所述的方法,其中该产碳水化合物源的酶是葡糖淀粉酶,该葡糖淀粉酶在pH5.0具有至少80%、至少85%、至少90%的pH稳定性。52.如段落48-51中任一项所述的方法,其中在液化步骤i)过程中存在的和/或添加的产碳水化合物源的酶是葡糖淀粉酶,优选源自青霉属菌株,尤其是披露为WO2011/127802的SEQIDNO:2或本文的SEQIDNO:14中的草酸青霉菌菌株。53.如段落48-52中所述的方法,其中该葡糖淀粉酶与WO2011/127802中的SEQIDNO:2中显示的成熟多肽或本文的SEQIDNO:14具有至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、以及甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%或100%同一性。54.如段落48-53中任一项所述的方法,其中该产碳水化合物源的酶是源自草酸青霉菌的菌株的、披露为WO2011/127802中的SEQIDNO:2的葡糖淀粉酶的变体、具有K79V取代(使用本文的SEQIDNO:14中显示的成熟序列用于编号)。55.如段落52-54中任一项所述的方法,其中该草酸青霉菌葡糖淀粉酶具有K79V取代(使用本文的SEQIDNO:14中显示的成熟序列用于编号)并进一步具有以下的一个:T65A;或Q327F;或E501V;或Y504T;或Y504*;或T65A+Q327F;或T65A+E501V;或T65A+Y504T;或T65A+Y504*;或Q327F+E501V;或Q327F+Y504T;或Q327F+Y504*;或E501V+Y504T;或E501V+Y504*;或T65A+Q327F+E501V;或T65A+Q327F+Y504T;或T65A+E501V+Y504T;或Q327F+E501V+Y504T;或T65A+Q327F+Y504*;或T65A+E501V+Y504*;或Q327F+E501V+Y504*;或T65A+Q327F+E501V+Y504T;或T65A+Q327F+E501V+Y504*;E501V+Y504T;或T65A+K161S;或T65A+Q405T;或T65A+Q327W;或T65A+Q327F;或T65A+Q327Y;或P11F+T65A+Q327F;或R1K+D3W+K5Q+G7V+N8S+T10K+P11S+T65A+Q327F;或P2N+P4S+P11F+T65A+Q327F;或P11F+D26C+K33C+T65A+Q327F;或P2N+P4S+P11F+T65A+Q327W+E501V+Y504T;或R1E+D3N+P4G+G6R+G7A+N8A+T10D+P11D+T65A+Q327F;或P11F+T65A+Q327W;或P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;或P11F+T65A+Q327W+E501V+Y504T;或T65A+Q327F+E501V+Y504T;或T65A+S105P+Q327W;或T65A+S105P+Q327F;或T65A+Q327W+S364P;或T65A+Q327F+S364P;或T65A+S103N+Q327F;或P2N+P4S+P11F+K34Y+T65A+Q327F;或P2N+P4S+P11F+T65A+Q327F+D445N+V447S;或P2N+P4S+P11F+T65A+I172V+Q327F;或P2N+P4S+P11F+T65A+Q327F+N502*;或P2N+P4S+P11F+T65A+Q327F+N502T+P563S+K571E;或P2N+P4S+P11F+R31S+K33V+T65A+Q327F+N564D+K571S;或P2N+P4S+P11F+T65A+Q327F+S377T;或P2N+P4S+P11F+T65A+V325T+Q327W;或P2N+P4S+P11F+T65A+Q327F+D445N+V447S+E501V+Y504T;或P2N+P4S+P11F+T65A+I172V+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+S377T+E501V+Y504T;或P2N+P4S+P11F+D26N+K34Y+T65A+Q327F;或P2N+P4S+P11F+T65A+Q327F+I375A+E501V+Y504T;或P2N+P4S+P11F+T65A+K218A+K221D+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+S103N+Q327F+E501V+Y504T;或P2N+P4S+T10D+T65A+Q327F+E501V+Y504T;或P2N+P4S+F12Y+T65A+Q327F+E501V+Y504T;或K5A+P11F+T65A+Q327F+E501V+Y504T;或P2N+P4S+T10E+E18N+T65A+Q327F+E501V+Y504T;或P2N+T10E+E18N+T65A+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+T568N;或P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+K524T+G526A;或P2N+P4S+P11F+K34Y+T65A+Q327F+D445N+V447S+E501V+Y504T;或P2N+P4S+P11F+R31S+K33V+T65A+Q327F+D445N+V447S+E501V+Y504T;或P2N+P4S+P11F+D26N+K34Y+T65A+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+F80*+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+K112S+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+T516P+K524T+G526A;或P2N+P4S+P11F+T65A+Q327F+E501V+N502T+Y504*;或P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+S103N+Q327F+E501V+Y504T;或K5A+P11F+T65A+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+E501V+Y504T+T516P+K524T+G526A;或P2N+P4S+P11F+T65A+K79A+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+K79G+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+K79I+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+K79L+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+K79S+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+L72V+Q327F+E501V+Y504T;或S255N+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+E74N+V79K+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+G220N+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+Y245N+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+Q253N+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+D279N+Q327F+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+S359N+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+D370N+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+V460S+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+V460T+P468T+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+T463N+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+S465N+E501V+Y504T;或P2N+P4S+P11F+T65A+Q327F+T477N+E501V+Y504T。56.如段落48-55中任一项所述的方法,进一步地其中葡糖淀粉酶是在糖化和/或发酵过程中存在的和/或添加的。57.如段落1-56中任一项所述的方法,其中在糖化和/或发酵过程中存在的和/或添加的葡糖淀粉酶是真菌来源的,优选地来自曲霉属的菌株,优选是黑曲霉、泡盛曲霉或米曲霉;或木霉属的菌株,优选里氏木霉;或篮状菌属的菌株,优选埃默森篮状菌;或密孔菌属的菌株;或粘褶菌属的菌株;或黑层孔属的菌株。58.如段落1-57中任一项所述的方法,进一步地其中在液化和/或糖化过程中存在和/或添加支链淀粉酶。59.如段落1-58中任一项所述的方法,进一步地其中在液化步骤i)过程中存在和/或添加内切葡聚糖酶。60.如段落59所述的方法,其中该内切葡聚糖酶是在WO2013/019780中的SEQIDNO:2或在本文的SEQIDNO:9中显示的内切葡聚糖酶,例如源自雷塞氏篮状菌的菌株,或者与本文的SEQIDNO:9的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性的内切葡聚糖酶。61.如段落1-59所述的方法,其中在液化和/或糖化过程中存在和/或添加植酸酶。62.根据段落1-61中任一项所述的方法,该方法包括以下步骤:i)在从70℃至100℃范围内的温度,使用以下液化含淀粉材料:-源自嗜热脂肪芽孢杆菌的α-淀粉酶;-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。63.如段落1-62所述的方法,该方法包括以下步骤:i)在高于初始糊化温度的温度,使用以下项液化该含淀粉材料:-α-淀粉酶,优选地源自嗜热脂肪芽孢杆菌,在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min);-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);-任选地,内切葡聚糖酶,特别是具有大于70℃、优选地大于75℃的熔点(DSC)的内切葡聚糖酶;ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。64.如段落1-63所述的方法,该方法包括以下步骤:i)在70℃至100℃之间的温度,使用以下项液化该含淀粉材料:-细菌α-淀粉酶,优选地源自嗜热脂肪芽孢杆菌,在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min);-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);-任选地,蛋白酶,优选地源自强烈火球菌或橙色嗜热子囊菌,具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值;-任选地,内切葡聚糖酶,特别是具有大于70℃的熔点(DSC)的内切葡聚糖酶;ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。65.如段落1-64所述的方法,该方法包括以下步骤:i)在从大于4.0-6.5之间范围内的pH在大于初始糊化温度的温度,使用以下液化含淀粉材料:-源自嗜热脂肪芽孢杆菌的α-淀粉酶,其具有双缺失I181+G182、以及任选的取代N193F;以及任选地进一步包含以下取代集合中的一种:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S;-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用本文的SEQIDNO:1用于编号);-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);特别是与本文的SEQIDNO:3、4、5、8和34中显示的任何多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%的木聚糖酶;-任选地,蛋白酶,该蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,特别地源自强烈火球菌和/或橙色嗜热子囊菌;并且任选地-任选地,本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶,具有选自下组的取代:-K79V;-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F;(使用本文的SEQIDNO:14用于编号);-任选地,内切葡聚糖酶,特别是具有大于70℃、优选地大于75℃、尤其是大于80℃的熔点(DSC)的内切葡聚糖酶;ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。66.如段落1-65所述的方法,该方法包括以下步骤:i)在70℃至100℃之间的温度,使用以下项液化该含淀粉材料:-源自嗜热脂肪芽孢杆菌的α-淀粉酶,其具有双缺失I181+G182、以及任选的取代N193F;以及任选地进一步包含以下取代集合中的一种:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;或-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用本文的SEQIDNO:1用于编号);-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶,优选地木聚糖酶;特别是与本文的SEQIDNO:3、4、5、8和34的多肽的成熟部分具有至少80%同一性的木聚糖酶;-任选地,内切葡聚糖酶,特别地具有大于70℃、优选地大于75℃、尤其是大于80℃的熔点(DSC);-任选地,蛋白酶,该蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,特别地源自强烈火球菌和/或橙色嗜热子囊菌的蛋白酶;以及-任选地,本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶,该草酸青霉菌葡糖淀粉酶包含选自下组的取代:-K79V;或-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F(使用SEQIDNO:14用于编号);ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。67.如段落1-65所述的方法,该方法包括以下步骤:i)在70℃至100℃之间的温度,使用以下项液化该含淀粉材料:-源自嗜热脂肪芽孢杆菌的α-淀粉酶,其具有双缺失I181+G182、以及任选的取代N193F;以及任选地进一步包含以下取代集合中的一种:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-V59AQ89R+E129V+K177L+R179E+Q254S+M284V;-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用在此的SEQIDNO:1进行编号);-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);特别是与本文的SEQIDNO:3、4、5、8和34中显示的任何多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%的木聚糖酶;-任选地,具有大于70℃、优选地大于75℃、尤其是大于80℃的熔点(DSC)的内切葡聚糖酶;-任选地,具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值的蛋白酶,特别地源自强烈火球菌的蛋白酶;-任选地,本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶,具有选自下组的取代:-K79V;或-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F;或-K79V+P11F+D26C+K33C+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327W+E501V+Y504T;或-K79V+P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;或-K79V+P11F+T65A+Q327W+E501V+Y504T(使用SEQIDNO:14进行编号);-任选地,内切葡聚糖酶,特别是具有大于70℃、优选地大于75℃、尤其是大于80℃的熔点(DSC)的内切葡聚糖酶;ii)使用葡糖淀粉酶进行糖化;iii)使用发酵生物进行发酵。68.如段落62-67中任一项所述的方法,其中该嗜热脂肪芽孢杆菌α-淀粉酶(本文的SEQIDNO:1)是成熟α-淀粉酶或与本文的SEQIDNO:1具有至少60%、如至少70%、如至少80%同一性、如至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少99%同一性的相应的成熟α-淀粉酶。69.如段落64-68中任一项所述的方法,其中该强烈火球菌蛋白酶(本文的SEQIDNO:13)或橙色嗜热子囊菌蛋白酶(SEQIDNO:3)是成熟蛋白酶或分别与本文的SEQIDNO:13或本文的SEQIDNO:3具有至少80%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少99%同一性的相应的成熟蛋白酶。70.如段落65-69中任一项所述的方法,其中该草酸青霉菌葡糖淀粉酶(本文的SEQIDNO:14)或其变体是成熟葡糖淀粉酶或与本文的SEQIDNO:14具有至少80%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少99%同一性的相应的成熟葡糖淀粉酶。71.如段落1-70中任一项所述的方法,其中在发酵或同时糖化和发酵过程中存在或添加纤维素酶或纤维素分解酶组合物。72.如段落1-71中任一项所述的方法,其中在发酵或同时糖化和发酵过程中存在或添加纤维素酶或纤维素分解酶组合物和葡糖淀粉酶。73.如段落1-72中任一项所述的方法,其中在发酵或同时糖化和发酵过程中存在或添加纤维素酶或纤维素分解酶组合物和葡糖淀粉酶。74.如段落71-73中任一项所述的方法,其中纤维素酶或纤维素分解酶组合物源自里氏木霉、特异腐质霉、卢克诺文思金孢子菌或斜卧青霉。75.如段落71-74中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含β-葡糖苷酶、纤维二塘水解酶、和内切葡聚糖酶。76.如段落71-75中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含β-葡糖苷酶,优选源自曲霉属的菌株如米曲霉的β-葡糖苷酶,如WO2002/095014中披露的β-葡糖苷酶或WO2008/057637中披露的具有β-葡糖苷酶活性的融合蛋白,或如烟曲霉的β-葡糖苷酶,如在WO2005/047499中的SEQIDNO:2或本文的SEQIDNO:29中披露的β-葡糖苷酶,或WO2012/044915中披露的烟曲霉β-葡糖苷酶变体;或源自青霉属(Penicillium)的菌株,如WO2007/019442中披露的巴西青霉(Penicilliumbrasilianum)的菌株,或木霉属的菌株,如里氏木霉的菌株。77.如段落71-76中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含具有纤维素分解增强活性的GH61多肽,如源自嗜热子囊菌属如桔色嗜热子囊菌的菌株的多肽,如在WO2005/074656中或本文的SEQIDNO:30描述的多肽;或源自梭孢壳属,如土生梭孢霉的菌株的多肽,如WO2005/074647中作为SEQIDNO:7描述的多肽;或源自曲霉属的菌株,如烟曲霉的菌株的多肽,如WO2010/138754中作为SEQIDNO:1描述的多肽;或源自青霉属的菌株如埃默森青霉的菌株的多肽,如WO2011/041397中作为SEQIDNO:2或本文的SEQIDNO:31披露的多肽。78.如段落71-77中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含纤维二糖水解酶I(CBHI),如源自曲霉属的菌株如烟曲霉的菌株的纤维二糖水解酶I,如WO2011/057140中的SEQIDNO:6或本文的SEQIDNO:32中披露的Cel7aCBHI,或源自木霉属的菌株,例如里氏木霉的菌株的纤维二糖水解酶I。79.如段落71-78中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含纤维二糖水解酶II(CBHII),如源自曲霉属的菌株例如烟曲霉的菌株的CBHII;如披露为本文的SEQIDNO:33的纤维二糖水解酶II,或源自木霉属,如里氏木霉的菌株,或源自梭孢壳属的菌株,如土生梭孢霉的菌株,如是来自土生梭孢霉的纤维二糖水解酶IICEL6A。80.如段落71-79中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包具有纤维分解增强活性的GH61多肽和β-葡糖苷酶。81.如段落71-80中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包具有纤维分解增强活性的GH61多肽和β-葡糖苷酶。82.如段落71-81中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含具有纤维分解增强活性的GH61多肽、β-葡糖苷酶、和CBHI。83.如段落71-82中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含具有纤维分解增强活性的GH61多肽、β-葡糖苷酶、CBHI、和CBHII。84.如段落71-83中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,该里氏木霉纤维素分解酶组合物进一步包含具有纤维素分解增强活性的桔色嗜热子囊菌GH61A多肽(WO2005/074656中的SEQIDNO:2或本文的SEQIDNO:30)、以及米曲霉β-葡糖苷酶融合蛋白(WO2008/057637)。85.如段落71-84中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,该里氏木霉纤维素分解酶组合物进一步包含具有纤维素分解增强活性的橙色嗜热子囊菌GH61A多肽(WO2005/074656中的SEQIDNO:2或本文的SEQIDNO:30)、以及烟曲霉β-葡糖苷酶(WO2005/047499的SEQIDNO:2或本文的SEQIDNO:29)。86.如段落71-85中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物是里氏木霉纤维素分解酶组合物,该里氏木霉纤维素分解酶组合物进一步包含WO2011/041397中作为SEQIDNO:2或本文的SEQIDNO:31披露的、具有纤维素分解增强活性的埃默森青霉GH61A多肽;以及烟曲霉β-葡糖苷酶(WO2005/047499的SEQIDNO:2)或本文的SEQIDNO:29或其具有以下取代中的一个或多个如所有的变体:F100D、S283G、N456E、F512Y。87.如段落71-86中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物包含以下组分中的一种或多种:(i)烟曲霉纤维二糖水解酶I;(ii)烟曲霉纤维二糖水解酶II;(iii)烟曲霉β-葡糖苷酶或其变体;和(iv)具有纤维素分解增强活性的青霉属物种GH61多肽;或其同系物。88.如段落71-87中任一项所述的方法,其中该纤维素酶或纤维素分解酶组合物是SPIRIZYMEACHIEVETM、CELLICCTECTM、CELLICCTEC2TM、CELLICCTEC3TM、ACCELLERASE1000TM、ACCELLERASE1500TM、ACCELLERASEDUETTM、ACCELLERASETRIOTM。89.如段落71-88中任一项所述的方法,其中在糖化或同时糖化和发酵过程中存在或添加的葡糖淀粉酶真菌来源的,优选地来自曲霉属的菌株,优选是黑曲霉、泡盛曲霉或米曲霉;或木霉属的菌株,优选里氏木霉;或篮状菌属的菌株,优选埃默森篮状菌;或密孔菌属的菌株;或粘褶菌属的菌株;或黑层孔属的菌株。90.如段落72-89中任一项所述的方法,其中该葡糖淀粉酶是源自披露在WO99/28448中或本文的SEQIDNO:28的埃默森篮状菌的葡糖淀粉酶、披露为WO06/69289中SEQIDNO:2或本文的SEQIDNO:26的瓣环栓菌葡糖淀粉酶、以及微小根毛霉α-淀粉酶与黑曲霉葡糖淀粉酶接头和披露为WO2006/069290中的表5中的V039或本文的SEQIDNO:27的SBD共混物。91.如段落72-90中任一项所述的方法,其中该α-淀粉酶是具有黑曲霉葡糖淀粉酶接头和淀粉结合结构域(SBD)(本文的SEQIDNO:27)的微小根毛霉α-淀粉酶,该α-淀粉酶进一步包含以下取代中至少一种或取代的组合:D165M;Y141W;Y141R;K136F;K192R;P224A;P224R;S123H+Y141W;G20S+Y141W;A76G+Y141W;G128D+Y141W;G128D+D143N;P219C+Y141W;N142D+D143N;Y141W+K192R;Y141W+D143N;Y141W+N383R;Y141W+P219C+A265C;Y141W+N142D+D143N;Y141W+K192RV410A;G128D+Y141W+D143N;Y141W+D143N+P219C;Y141W+D143N+K192R;G128D+D143N+K192R;Y141W+D143N+K192R+P219C;G128D+Y141W+D143N+K192R;或G128D+Y141W+D143N+K192R+P219C(使用本文的SEQIDNO:27用于编号)。92.一种组合物,该组合物包括:-α-淀粉酶;具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);-任选地,内切葡聚糖酶;-任选地,蛋白酶;-任选地,产碳水化合物源的酶。93.如段落92所述的组合物,其中该α-淀粉酶是细菌或真菌α-淀粉酶。94.如段落92-93中任一项所述的组合物,其中该α-淀粉酶是细菌α-淀粉酶,特别地来自芽孢杆菌属,如嗜热脂肪芽孢杆菌的菌株,特别是嗜热脂肪芽孢杆菌α-淀粉酶的变体,如在WO99/019467中的SEQIDNO:3或本文的SEQIDNO:1中显示的α-淀粉酶。95.如段落94所述的组合物,其中该嗜热脂肪芽孢杆菌α-淀粉酶或其变体是截短的,优选为约491个氨基酸长,如从约480个-495个氨基酸长。96.如段落92-95中任一项所述的组合物,其中该嗜热脂肪芽孢杆菌α-淀粉酶具有在位置I181+G182的双缺失、以及任选地N193F取代、或在位置R179+G180的双缺失(使用本文的SEQIDNO:1进行编号)。97.如段落92-96中任一项所述的组合物,其中该嗜热脂肪芽孢杆菌α-淀粉酶在位置S242具有取代,优选S242Q取代(使用本文的SEQIDNO:1进行编号)。98.如段落92-97中任一项所述的组合物,其中该嗜热脂肪芽孢杆菌α-淀粉酶在位置E188具有取代、优选地E188P取代(使用本文的SEQIDNO:1用于编号)。99.如段落92-98中任一项所述的组合物,其中该α-淀粉酶在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min),例如至少15,例如至少20,例如至少25,例如至少30,例如至少40,例如至少50,例如至少60,例如在10至70之间,例如在15至70之间,例如在20至70之间,例如在25至70之间,例如在30至70之间,例如在40至70之间,例如在50至70之间,例如在60至70之间。100.如段落92-99中任一项所述的组合物,其中该α-淀粉酶选自下组:显示在本文的SEQIDNO:1中的,具有在I181*+G182*的双缺失、以及任选地在N193F的取代、特别是进一步具有以下取代集合的一种的嗜热脂肪芽孢杆菌α-淀粉酶变体:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-V59AQ89R+E129V+K177L+R179E+Q254S+M284V;以及-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用本申请中的SEQIDNO:1用于编号)。101.如段落92-100中任一项所述的组合物,其中该半纤维素酶,特别是木聚糖酶,如GH10木聚糖酶或GH11木聚糖酶具有大于82℃、如大于84℃、如大于86℃、如大于88℃、如大于90℃、如大于92℃、如大于94℃、如大于96℃、如大于98℃、如大于100℃的熔点(DSC)。102.如段落92-101中任一项所述的组合物,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10或GH11木聚糖酶与本文的SEQIDNO:3(GH10木聚糖酶)或SEQIDNO:34(GH11木聚糖酶)的多肽的成熟部分具有至少60%、如至少70%、如至少75%、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自网团菌属的菌株、如嗜热网团菌的菌株。103.如段落92-101中任一项所述的组合物,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:4的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自Rasamsonia属的菌株,如Rasomsoniabyssochlamydoides的菌株。104.如段落92-101中任一项所述的组合物,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:5的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自篮状菌属的菌株,如雷塞氏篮状菌的菌株。105.如段落92-101中任一项所述的组合物,其中该半纤维素酶,特别是木聚糖酶,尤其是GH10木聚糖酶与本文的SEQIDNO:8的多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%、如100%同一性,优选地源自曲霉属的菌株,如烟曲霉的菌株。106.如段落92-105中任一项所述的组合物,包括-α-淀粉酶;-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶;-具有大于70℃、优选地大于75℃、尤其是大于80℃、特别是大于85℃的熔点(DSC)的内切葡聚糖酶。107.如段落92-106中任一项所述的组合物,其中该蛋白酶具有确定为在80℃/70℃的相对活性的,超过20%、如超过25%的热稳定性值。108.如段落92-107中任一项所述的组合物,其中该蛋白酶具有确定为在80℃/70℃的相对活性的,超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%、超过100%、如超过105%、如超过110%、如超过115%、如超过120%的热稳定性。109.如段落92-108中任一项所述的组合物,其中该蛋白酶具有确定为在80℃/70℃的相对活性的,在20%和50%之间、如在20%和40%之间、如在20%和30%之间的热稳定性。110.如段落92-109中任一项所述的组合物,其中该蛋白酶具有确定为在80℃/70℃的相对活性的,在50%与115%之间、如在50%与70%之间、如在50%与60%之间、如在100%与120%之间、如在105%与115%之间的热稳定性。111.如段落92-110中任一项所述的组合物,其中该蛋白酶具有确定为在85℃/70℃的相对活性的,超过10%、如超过12%、超过14%、超过16%、超过18%、超过20%、超过30%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%、超过100%、超过110%的热稳定性。112.如段落92-111中任一项所述的组合物,其中该蛋白酶具有确定为在85℃/70℃的相对活性的,在10%和50%之间、如在10%和30%之间、如在10%和25%之间的热稳定性。113.如段落92-112中任一项所述的组合物,其中该蛋白酶在85℃具有高于60%、如高于90%、如高于100%、如高于110%的热稳定性,如使用Zein-BCA测定法确定的。114.如段落92-113中任一项所述的组合物,其中该蛋白酶在85℃具有在60%至120%之间、如在70%至120%之间、如在80%至120%之间、如在90%至120%之间、如在100%至120%之间、如110%至120%的热稳定性,如使用Zein-BCA测定法确定的。115.如段落92-114中任一项所述的组合物,其中该蛋白酶是真菌起源的。116.如段落92-115中任一项所述的组合物,其中该蛋白酶是源自嗜热子囊菌属的菌株、优选地橙色嗜热子囊菌的菌株、尤其是橙色嗜热子囊菌CGMCCNo.0670的金属蛋白酶、特别是本文的SEQIDNO:2中显示的菌株的变体。117.如段落92-116中任一项所述的组合物,其中该蛋白酶是披露为以下的蛋白酶的变体:WO2003/048353中披露的SEQIDNO:2的成熟部分或WO2010/008841中SEQIDNO:1的成熟部分或本文的SEQIDNO:2,具有以下突变:D79L+S87P+A112P+D142L;D79L+S87P+D142L;或A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L(使用本文的SEQIDNO:2用于编号)。118.如段落92-118中任一项所述的组合物,其中该蛋白酶变体与WO2003/048353中披露的SEQIDNO:2的多肽的成熟部分或WO2010/008841中SEQIDNO:1的成熟部分或本文的SEQIDNO:2具有至少75%同一性、优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、以及甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、但小于100%同一性。119.如段落92-118中任一项所述的组合物,其中显示在本文的SEQIDNO:2中的橙色嗜热子囊菌蛋白酶的蛋白酶变体是以下中的一种:-D79L+S87P+D142L-D79L+S87P+A112P+D142L-D79L+Y82F+S87P+A112P+D142L-S38T+D79L+S87P+A112P+A126V+D142L-D79L+Y82F+S87P+A112P+A126V+D142L-A27K+D79L+S87P+A112P+A126V+D142L-S49P+D79L+S87P+A112P+D142L-S50P+D79L+S87P+A112P+D142L-D79L+S87P+D104P+A112P+D142L-D79L+Y82F+S87G+A112P+D142L-S70V+D79L+Y82F+S87G+Y97W+A112P+D142L-D79L+Y82F+S87G+Y97W+D104P+A112P+D142L-S70V+D79L+Y82F+S87G+A112P+D142L-D79L+Y82F+S87G+D104P+A112P+D142L-D79L+Y82F+S87G+A112P+A126V+D142L-Y82F+S87G+S70V+D79L+D104P+A112P+D142L-Y82F+S87G+D79L+D104P+A112P+A126V+D142L-A27K+D79L+Y82F+S87G+D104P+A112P+A126V+D142L。120.如段落92-119中任一项所述的组合物,其中该蛋白酶是细菌起源的。121.如段落92-120中任一项所述的组合物,其中该蛋白酶是来源于热球菌属菌株,优选地强烈火球菌菌株。122.如段落92-121中任一项所述的组合物,其中蛋白酶是在US6,358,726中的SEQIDNO:1、或在此的SEQIDNO:13中显示的蛋白酶。123.如段落92-122中任一项所述的组合物,其中该蛋白酶是与US6,358,726中的SEQIDNO:1或本文的SEQIDNO:13具有至少80%、如至少85%、如至少90%、如至少95%、如至少96%、如至少97%、如至少98%、如至少99%同一性的蛋白酶。124.如段落92-123中任一项所述的组合物,其中产碳水化合物源的酶是葡糖淀粉酶。125.如段落92-124中任一项所述的组合物,其中该产碳水化合物源的酶是在85℃、pH5.3具有至少20%、例如至少30%,优选至少35%的热稳定性的葡糖淀粉酶。126.如段落92-125中任一项所述的组合物,其中该产碳水化合物源的酶是葡糖淀粉酶,该葡糖淀粉酶在pH5.0的pH最佳值时具有至少90%,优选至少95%,优选至少97%的相对活性。127.如段落92-126中任一项所述的组合物,其中该产碳水化合物源的酶是葡糖淀粉酶,该葡糖淀粉酶在pH5.0具有至少80%、至少85%、至少90%的pH稳定性。128.如段落92-127中任一项所述的组合物,其中该产碳水化合物源的酶是葡糖淀粉酶,优选源自青霉属菌株,尤其是披露为WO2011/127802的SEQIDNO:2或本文的SEQIDNO:14中的草酸青霉菌菌株。129.如段落92-128中所述的组合物,其中该葡糖淀粉酶与WO2011/127802中的SEQIDNO:2中显示的成熟多肽或本文的SEQIDNO:14具有至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、以及甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%或100%同一性。130.如段落92-129中所述的组合物,其中该产碳水化合物源的酶是来源于草酸青霉菌菌株的、在WO2011/127802中披露为SEQIDNO:2的葡糖淀粉酶的一种变体,具有K79V取代(使用SEQIDNO:14中所示的成熟序列用于编号)。131.如段落92-130中任一项所述的组合物,该组合物进一步包含支链淀粉酶、特别是家族GH57的支链淀粉酶,其中该支链淀粉酶优选地包括如在WO2011/087836中披露的X47结构域。132.如段落92-131中任一项所述的组合物,该组合物进一步包含植酸酶。133.如段落132所述的组合物,其中该植酸酶衍生自布丘氏菌属,如披露在WO2008/092901中的布伽瓦尼布丘氏菌、乡间布丘菌、或Buttiauxellanoackies,或布氏柠檬酸杆菌,如披露在WO2006/037328中的。134.如段落92-136中任一项所述的组合物,包括-源自嗜热脂肪芽孢杆菌的α-淀粉酶;-具有大于80℃、优选地大于85℃、尤其是大于90℃、特别是大于95℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);-任选地,蛋白酶,该蛋白酶具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值,源自强烈火球菌或橙色嗜热子囊菌;以及-任选地,内切葡聚糖酶,特别是具有大于70℃、优选地大于75℃、尤其是大于80℃、特别是大于85℃的熔点(DSC)的内切葡聚糖酶;特别是与本文的SEQIDNO:9、35、36、37和38中显示的任何多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%的木聚糖酶;-任选地,葡糖淀粉酶,如源自草酸青霉菌的葡糖淀粉酶。135.如段落92-134中任一项所述的组合物,包括-α-淀粉酶,优选地源自嗜热脂肪芽孢杆菌,在pH4.5、85℃、0.12mMCaCl2下具有至少10的T1/2(min);-具有大于80℃、优选地大于75℃、尤其是大于80℃、特别是大于85℃的熔点(DSC)的半纤维素酶(特别是木聚糖酶);-任选地,内切葡聚糖酶,特别是具有大于70℃、优选地大于75℃、尤其是大于80℃、特别是大于85℃的熔点(DSC)的内切葡聚糖酶;特别是与本文的SEQIDNO:9、35、36、37或38中显示的任何多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%的木聚糖酶;-任选地,蛋白酶,优选地源自强烈火球菌或橙色嗜热子囊菌,具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值;以及-任选地,葡糖淀粉酶,例如源自草酸青霉菌。136.如段落92-135中任一项所述的组合物,包括-源自嗜热脂肪芽孢杆菌的α-淀粉酶,其具有双缺失I181+G182、以及任选地具有取代N193F;以及任选地以下取代集合中的另一种:-E129V+K177L+R179E;-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V;以及-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用在此的SEQIDNO:1进行编号);-具有大于70℃、优选地大于75℃、特别是大于80℃、尤其是大于85℃的熔点(DSC)的半纤维素酶,特别是木聚糖酶;特别是与本文的SEQIDNO:3、4、5、8和34中显示的任何多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%的木聚糖酶;-任选地,内切葡聚糖酶,特别是具有大于70℃、优选地大于75℃、尤其是大于80℃、特别是大于85℃的熔点(DSC)的内切葡聚糖酶;特别是与本文的SEQIDNO:9、35、36、37和38中显示的任何多肽的成熟部分具有至少60%、如至少70%、如至少75%同一性、优选地至少80%、更优选地至少85%、更优选地至少90%、更优选地至少91%、更优选地至少92%、甚至更优选地至少93%、最优选地至少94%、以及甚至最优选地至少95%、如甚至至少96%、至少97%、至少98%、至少99%的木聚糖酶;-任选地,蛋白酶,优选地源自强烈火球菌和/或橙色嗜热子囊菌,具有确定为在80℃/70℃的相对活性的、超过20%的热稳定性值;以及-任选地,本文的SEQIDNO:14中的草酸青霉菌葡糖淀粉酶,具有选自下组的取代:-K79V;-K79V+P11F+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327F;或-K79V+P11F+D26C+K33C+T65A+Q327F;或-K79V+P2N+P4S+P11F+T65A+Q327W+E501V+Y504T;或-K79V+P2N+P4S+P11F+T65A+Q327F+E501V+Y504T;或-K79V+P11F+T65A+Q327W+E501V+Y504T(使用本文的SEQIDNO:14用于编号)。137.如段落92-136中任一项所述的组合物,其中特别是源自嗜热脂肪芽孢杆菌(本文的SEQIDNO:1)的该α-淀粉酶是细菌α-淀粉酶或其变体是成熟α-淀粉酶或与本文的SEQIDNO:1具有至少80%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少99%同一性的相应的成熟α-淀粉酶。138.如段落92-137中所述的组合物用于液化含淀粉材料的用途。在发酵产物生产方法中的液化中的半纤维素酶,特别是木聚糖酶。在此描述并要求保护的发明并不局限于在此所披露的具体实施例的范围,因为这些实施例意欲作为本发明几个方面的说明。任何等价的实施例都旨在处于本发明的范围之内。实际上,除在此所示和描述的那些之外,本发明的不同修改对于本领域普通技术人员而言从前述描述将变得清楚。这样的修改也旨在落入所附权利要求的范围内。在冲突的情况下,以包括定义的本披露为准。在此引用了不同的参考,其披露通过引用以其全部内部结合在此。以下实例进一步描述本发明,这些实例不应当解释为限制本发明的范围。材料与方法材料:α-淀粉酶369(AA369):具有以下突变的嗜热脂肪芽孢杆菌α-淀粉酶:I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+Q254S+M284V截短至491个氨基酸(本文的SEQIDNO:1)。内切葡聚糖酶TL(EGTL):来自雷塞氏篮状菌的内切葡聚糖酶GH5在WO2013/019780中披露为SEQIDNO:2以及本文的SEQIDNO:9。(P23YSQ)。木聚糖酶TL(TlXyl):来自雷塞氏篮状菌的家族GH10木聚糖酶显示在本文的SEQIDNO:5中。木聚糖酶DT(DtXyl):来自嗜热网团菌的家族GH11木聚糖酶显示在本文的SEQIDNO:34中。内切葡聚糖酶PC(EGPC):来自胶囊青霉的内切葡聚糖酶GH5披露为本文的SEQIDNO:35。(P244HZ)内切葡聚糖酶TS(EGTS):来自褐孢长毛盘菌的内切葡聚糖酶GH5披露为本文的SEQIDNO:36。(P2PJ)内切葡聚糖酶TT(EGTT):来自土生梭孢壳酶的内切葡聚糖酶GH45披露在本文的SEQIDNO:37中。(P24PYU)内切葡聚糖酶SF(EGSF):来自粪生粪壳菌的内切葡聚糖酶GH45在共同未决申请PCT/CN2012/080220中作为SEQIDNO:2披露并且在本文中作为SEQIDNO:38(P2CF)披露。蛋白酶Pfu:购买自日本宝酒造生物公司(TakaraBio(Japan))的、来源于激烈热球菌的蛋白酶,为Pfu蛋白酶S(活性10.5mg/mL)并且还示于在此的SEQIDNO:13中。葡糖淀粉酶Po:草酸青霉菌葡糖淀粉酶的成熟部分披露为WO2011/127802中的SEQIDNO:2以及本文中显示的SEQIDNO:14。葡糖淀粉酶PE001:使用SEQIDNO:14中所示的成熟序列对具有K79V取代的草酸青霉菌葡糖淀粉酶的变体进行编号。蛋白酶Pfu:源自强烈火球菌的蛋白酶,示于在此的SEQIDNO:13中。葡糖淀粉酶Po498(GA498):草酸青霉菌葡糖淀粉酶的变体具有以下突变:K79V+P2N+P4S+P11F+T65A+Q327F(使用SEQIDNO:14用于编号)。葡糖淀粉酶SA(GSA):包含以下的共混物:WO99/28448中披露为SEQIDNO:34或本文中披露为SEQIDNO:28的埃默森篮状菌葡糖淀粉酶、WO06/69289中披露为SEQIDNO:2或本文中披露为SEQIDNO:26的瓣环栓菌葡糖淀粉酶、以及本文的SEQIDNO:27中披露的具有黑曲霉葡糖淀粉酶接头和淀粉结合结构域(SBD)的微小根毛霉α-淀粉酶,其具有以下取代:G128D+D143N(以AGU:AGU:FAU-F表示的活性比为约20:5:1)。蛋白酶X:源自橙色嗜热子囊菌CGMCCNo.0670的、披露为本文的SEQIDNO:2中的氨基酸1-177以及WO2003/048353的SEQIDNO:2中的氨基酸1至177的金属蛋白酶。酵母:从美国的红星/乐斯福公司(RedStar/Lesaffre)可得的ETHANOLREDTM。方法通过差示扫描量热法确定内切葡聚糖酶和半纤维素酶的Td。使用VP-毛细管差示扫描量热仪(微量热公司(MicroCalInc.),皮斯卡塔韦,新泽西州,美国)通过差示扫描热量测定(DSC)测定酶的热稳定性。在200K/小时的恒定的程序化加热速率下,加热在缓冲液(50mM乙酸盐,pH5.0)中的酶溶液(大约0.5mg/ml)后获得的热分析图(Cp对比T)中,将热变性温度Td(℃)当作变性峰(主要的吸热峰)的顶端。将样品溶液和参比溶液(大约0.2ml)从10℃的储存条件下装载到量热仪中(参比溶液:不具有酶的缓冲液),并且在20℃热预平衡20分钟,随后从20℃至120℃进行DSC扫描。以大约+/-1℃的精确度确定变性温度。同一性:两个氨基酸序列之间或两个核苷酸序列之间的相关性由参数“同一性”描述。出于本发明的目的,可以通过程序“比对”确定两个氨基酸序列之间的同一性程度以及两个核苷酸序列之间的同一性程度,所述程序是尼德尔曼-翁施比对(Needleman-Wunschalignment)(即总体对比)。使用该程序进行多肽以及核苷酸序列的比对。使用缺省评分矩阵BLOSUM50进行多肽比对,使用缺省同一性矩阵进行核苷酸比对。对多肽而言,缺口的第一个残基的罚分为-12,对核苷酸而言该罚分为-16。对多肽而言,缺口另外残基的罚分为-2,对核苷酸而言该罚分为-4。“比对”是FASTA包版本v20u6的一部分(参见W.R.Pearson和D.J.Lipman(1988),“ImprovedToolsforBiologicalSequenceAnalysis[用于生物序列分析的改进的工具]”,PNAS85:2444-2448,和W.R.Pearson(1990)“RapidandSensitiveSequenceComparisonwithFASTPandFASTA[使用FASTP和FASTA进行的快速且灵敏的序列比较]”MethodsinEnzymology[酶学方法]183:63-98)。FASTA蛋白比对使用史密斯-沃特曼算法(Smith-Watermanalgorithm)进行,对缺口大小没有限制(参见“Smith-Watermanalgorithm[史密斯-沃特曼算法]”,T.F.Smith和M.S.Waterman(1981)J.Mol.Biol.[分子与生物学杂志]147:195-197)。蛋白酶测定AZCL-酪蛋白测定边搅拌边将蓝色底物AZCL-酪蛋白的0.2%溶液悬浮于pH9的Borax/NaH2PO4缓冲液中。边搅拌边将该溶液分散在微量滴定板(每孔100微升)上,添加30微升酶样品并且将这些板在艾本德热混器(EppendorfThermomixer)中在45℃和600rpm孵育30分钟。使用变性的酶样品(100℃煮沸20min)用作空白对照。孵育之后通过将微量滴定板转移到冰上来终止该反应并且通过在4℃以3000rpm离心5分钟将着色的溶液与固体分离。将60微升的上清液转移到微量滴定板并且使用伯乐酶标仪(BioRadMicroplateReader)测量在595nm处的吸光度。pNA测定将50微升含蛋白酶的样品添加到微量滴定板并通过添加100微升1mMpNA底物(5mg溶解于100微升DMSO中并进一步用Borax/NaH2PO4缓冲液pH9.0稀释至10mL)开始该测定。监测OD405在室温的增加作为蛋白酶活性的量度。葡糖淀粉酶活性(AGU)能以葡糖淀粉酶单位(AGU)来测量葡糖淀粉酶活性。Novo葡糖淀粉酶单位(AGU)定义为在以下标准条件下每分钟水解1微摩尔麦芽糖的酶量:37℃,pH4.3,底物:麦芽糖23.2mM,缓冲液:乙酸盐0.1M,反应时间5分钟。可使用自动分析仪系统。将变旋酶添加到葡萄糖脱氢酶试剂中,使得存在的任何α-D-葡萄糖变为β-D-葡萄糖。葡萄糖脱氢酶在以上提到的反应中与β-D-葡萄糖特异性地反应,形成NADH,使用光度计在340nm测定该NADH作为原始葡萄糖浓度的量度。颜色反应:GlucDH:430U/L变旋酶:9U/LNAD:0.21mM缓冲液:磷酸盐0.12M;0.15MNaClpH:7.60±0.05孵育温度:37℃±1反应时间:5分钟波长:340nm更详细描述这种分析方法的文件夹(EB-SM-0131.02/01)可以从丹麦的诺维信公司(NovozymesA/S)索取得到,通过引用将该文件夹特此包括。α-淀粉酶活性(KNU)可以使用马铃薯淀粉作为底物确定α-淀粉酶活性。此方法是基于由酶分解改性的马铃薯淀粉,并且该反应通过将淀粉/酶溶液的样品与碘溶液混合来追踪。最初形成黑蓝色,但淀粉分解过程中蓝色变弱并且逐渐变为红褐色,将其与有色玻璃标准品比较。一千Novoα淀粉酶单位(KNU)定义为在标准条件下(即,在37℃+/-0.05;0.0003MCa2+;和pH5.6)将5260mg可溶的淀粉干物质MerckAmylum糊精化的酶量。更详细地描述了这种分析方法的文件夹EB-SM-0009.02/01可从丹麦诺维信公司应要求获得,所述文件夹通过提述由此包括。α-淀粉酶活性(KNU-A)相对于所声明强度的酶标准,以KNU(A)KiloNovozymes单位(A)测量α淀粉酶活性。样品中的α淀粉酶和试剂盒中的α-葡糖苷酶将底物(4,6-亚乙基(G7)-对硝基苯基(G1)-α、D-麦芽七糖苷(亚乙基-G7PNP))水解成葡萄糖和黄色的对硝基苯酚。通过Konelab30观察对硝基苯酚的形成速率。这是反应速率及由此为酶活性的表达。该酶是具有酶分类号EC3.2.1.1的α-淀粉酶。关于确定KNU-A活性的文件夹EB-SM-5091.02-D可从丹麦诺维信公司应要求得到,该文件夹通过提述由此包括。α-淀粉酶活性KNU(S)样品中的BS-淀粉酶和试剂盒中的酶α-葡糖苷酶将底物(4,6-亚乙基(G7)-对硝基苯基(G1)-α-D-麦芽七糖苷(亚乙基-G7PNP))水解成葡萄糖和黄色对硝基苯酚。通过Konelab30观察对硝基苯酚的形成速率。这是反应速率及由此为酶活性的表达。反应条件反应:pH:7.15温度:37℃反应时间:180秒检测波长:405nm测量时间:120秒单位定义:相对于具有声明强度的酶标准品,以KNU(S)KiloNovo单位(嗜热脂肪(sterarothermophilus))测量嗜热脂肪芽孢杆菌淀粉酶(BS-淀粉酶)活性。这种分析方法更详细的描述于可从丹麦的诺维信公司索取得到的EB-SM-0221.02(通过引用结合)中。FAU活性的测定一个真菌α-淀粉酶单位(FAU)定义为基于下列标准条件下每小时分解5.26g淀粉(MerckAmylum的可溶性Erg.B.6,批号9947275)所需要的酶的量:酸性α-淀粉酶活性(AFAU)的确定按AFAU(酸性真菌α-淀粉酶单位)测量酸性α-淀粉酶活性,相对于酶标准品而确定AFAU。使用的标准品是AMG300L(来自诺维信公司(NovozymesA/S),葡糖淀粉酶野生型黑曲霉G1,还披露于Boel等人(1984),EMBOJ.[欧洲分子生物学学会杂志]3(5),第1097-1102页和WO92/00381中)。在室温存储3周后,此AMG中的中性α-淀粉酶从大约1FAU/mL降至低于0.05FAU/mL。根据以下描述确定此AMG标准品中的酸性α-淀粉酶活性。在此方法中,1AFAU被定义为在标准条件下每小时降解5.260mg淀粉干物质的酶量。碘与淀粉形成蓝色复合物,但不与其降解产物形成蓝色复合物。颜色的强度因此与淀粉的浓度成正比。使用反向比色法在指定分析条件下确定淀粉酶活性为淀粉浓度的减少。标准条件/反应条件:(每分钟)底物:淀粉,大约0.17g/L缓冲液:柠檬酸盐,大约0.03M碘(I2):0.03g/LCaCl2:1.85mMpH:2.50±0.05孵育温度:40℃反应时间:23秒波长:λ=590nm酶浓度:0.025AFAU/mL酶工作范围:0.01至0.04AFAU/mL如果优选其他细节,那么这些可以在从诺维信公司(NovozymesA/S)索取得到的EB-SM-0259.02/01中发现,并且通过引用并入。支链淀粉酶活性(NPUN)的确定相对于诺维信支链淀粉酶标准品测量NPUN中的内切-支链淀粉酶活性。一个支链淀粉酶单位(NPUN)定义为在标准条件下(0.7%红色支链淀粉(redpullulan)(Megazyme),pH5,40℃,20分钟)每分钟释放1微摩尔葡萄糖的酶量。使用红色支链淀粉以NPUN/ml测量活性。将1mL稀释的样品或标准品在40℃孵育2分钟。添加0.5mL2%红色支链淀粉、0.5MKCl、50mM柠檬酸,pH5并混合。将这些管在40℃孵育20分钟并且通过添加2.5ml80%乙醇终止。将管在室温静置10至60分钟,随后以4000rpm离心10分钟。然后在510nm测量上清液的OD并使用标准曲线计算活性。实例实例1α-淀粉酶变体的稳定性通过将参比α-淀粉酶(具有突变I181*+G182*+N193F的、截短至491个氨基酸的嗜热脂肪芽孢杆菌α-淀粉酶(以本文的SEQIDNO:1进行编号))及其α-淀粉酶变体在pH4.5和5.5下以及在温度75℃和85℃用0.12mMCaCl2进行孵育,随后使用底物(超级淀粉酶测定试剂盒(UltraAmylaseassaykit),E33651,分子探针公司(MolecularProbes))进行残余活性测量来测量该参比α-淀粉酶及变体的稳定性。使纯化的酶样品在酶稀释缓冲液(10mM乙酸盐、0.01%TritonX100、0.12mMCaCl2,pH5.0)中稀释至0.5和1或5和10ppm(微克/毫升)的工作浓度。将二十微升酶样品转移至48孔PCRMTP并且将180微升稳定性缓冲液(150mM乙酸盐、150mMMES、0.01%TritonX100、0.12mMCaCl2,pH4.5或5.5)添加至每个孔并且混合。测定使用两种浓度的酶来重复两次执行。在75℃或85℃孵育之前,取出20微升并且储存在冰上作为对照样品。在PCR仪(在75℃和85℃)中进行孵育。孵育之后,将样品在残余活性缓冲液(100mM乙酸盐、0.01%TritonX100、0.12mMCaCl2,pH5.5)中稀释至15ng/mL并且将25微升稀释酶转移至黑色384-MTP。使用EnzChek底物通过将25微升底物溶液(100微克/毫升)添加至每个孔来测量残余活性。使用485-Pnm的激发滤光器以及555nm的发射滤光器(荧光读取器是Polarstar,BMG)每分钟测量荧光持续15分钟。对于每个设置,将残余活性相对于对照样品标准化。假定对数式衰减,那么使用方程T1/2(min)=T(min)*LN(0.5)/LN(%RA/100)来计算半衰期时间(T1/2(min)),其中T是以分钟为单位的测定孵育时间,并且%RA是在测定中确定的%残余活性。使用此测定设置,针对参比α-淀粉酶及其变体确定半衰期时间,如表1中所示。表1ND未检测到这些结果证明α-淀粉酶变体比参比α-淀粉酶具有显著更高的半衰期和稳定性。实例2蛋白酶变体的制备以及热稳定性测试菌株与质粒使用大肠杆菌DH12S(可获得自吉博科公司(GibcoBRL))用于酵母质粒拯救。pJTP000是一种在TPI启动子的控制之下的酿酒酵母和大肠杆菌穿梭载体,构建自描述于WO01/92502中的pJC039,在其中已经插入了橙色嗜热子囊菌M35蛋白酶基因(WO03/048353)。将酿酒酵母YNG318感受态细胞:MATaDpep4[cir+]ura3-52、leu2-D2、his4-539用于蛋白酶变体表达。这被描述于J.Biol.Chem.[生物化学杂志]272(15),第9720-9727页,1997中。培养基与底物10X基础溶液:酵母氮基w/o氨基酸(DIFCO)66.8g/l,琥珀酸盐100g/l,NaOH60g/l。SC-葡萄糖:20%葡萄糖(即,终浓度为2%=2g/100ml)100ml/l,5%苏氨酸4ml/l,1%色氨酸10ml/l,20%酪蛋氨基酸25ml/l,10X基础溶液100ml/l。使用孔径大小为0.20微米的过滤器将溶液灭菌。将琼脂(2%)和H2O(大约761ml)一起热压处理,并且向琼脂溶液中添加分开灭菌的SC-葡萄糖溶液。YPD:细菌蛋白胨20g/l,酵母提取物10g/l,20%葡萄糖100ml/l。YPD+Zn:YPD+0.25mMZnSO4。PEG/LiAc溶液:40%PEG400050ml,5M乙酸锂1ml。96孔玉米素微滴度板:每个孔包含200微升的0.05%至0.1%的玉米素(西格玛公司(Sigma)),0.25mMZnSO4以及1%的琼脂于20mM乙酸钠缓冲液中,pH4.5。DNA操纵除非另外说明,否则使用如以下所述的分子生物学标准方法来进行DNA操纵和转化:Sambrook等人(1989),Molecularcloning:Alaboratorymanual[分子克隆:实验室手册],冷泉港实验室,冷泉港,纽约;Ausubel,F.M.等人(编辑)“CurrentprotocolsinMolecularBiology[分子生物学实验指南]”,约翰威立父子公司,1995;Harwood,C.R.和Cutting,S.M.(编辑)。酵母转化使用乙酸锂法进行酵母转化。混合0.5微升载体(由限制性内切核酸酶消化)以及1微升的PCR片段。将DNA混合物、100微升的YNG318感受态细胞、以及10微升的酵母标记载体DNA(YEASTMAKERcarrierDNA)(克罗泰克公司(Clontech))添加到12ml聚丙烯管(猎鹰(Falcon)2059)中。添加0.6mlPEG/LiAc溶液并温和混合。在30℃并且200rpm孵育30min,并随后在42℃孵育30min(热休克)。转移至埃彭道夫管中并且离心5秒。移去上清液并且溶解于3ml的YPD中。在30℃以200rpm孵育该细胞悬浮液45min。将悬浮液倾倒在SC-葡萄糖板上并在30℃孵育3天以生长菌落。通过Zymoprep酵母质粒小提试剂盒提取酵母总DNA(ZYMO研究公司(ZYMOresearch))。DNA测序通过电穿孔(伯乐基因脉冲发生器(BIO-RADGenePulser))进行用于DNA测序的大肠杆菌转化。通过碱法(分子克隆,冷泉港)或使用质粒试剂盒制备DNA质粒。通过凯杰(Qiagen)凝胶提取试剂盒从琼脂糖凝胶中回收DNA片段。使用PTC-200DNA引擎(PTC-200DNAEngine)进行PCR。使用ABIPRISMTM310基因分析器来测定所有的DNA序列。蛋白酶表达载体的构建使用引物对ProtF(本文的SEQIDNO:15)和ProtR(本文的SEQIDNO:16)扩增嗜热子囊菌属M35蛋白酶基因。将所得PCR片段连同pJC039载体引入酿酒酵母YNG318(描述于WO2001/92502中),用限制性内切酶消化以去除特异腐质霉角质酶基因。回收在SC-葡萄糖板上的酵母克隆中的质粒以确认内部序列并称作pJTP001。酵母文库和定点变体的构建通过SOEPCR法(SplicingbyOverlapExtension[重叠延伸剪接],参见“PCR:Apracticalapproach[PCR:一种实用方法]”,第207-209页,牛津大学出版社(OxfordUniversitypress),编辑McPherson、Quirke、Taylor)构建酵母文库和定点变体,随后进行酵母体内重组。用于扩增和测序的通用引物使用引物AM34(本文的SEQIDNO:17)和AM35(本文的SEQIDNO:18)通过SOE法与简并引物(AM34+反向引物和AM35+正向引物)一起制备包含任何突变的片段的DNA片段或仅仅扩增整个蛋白酶基因(AM34+AM35)。通过凯杰凝胶提取试剂盒从琼脂糖凝胶中回收DNA片段。将所得纯化的片段与载体消化物混合。将混合溶液引入酿酒酵母中,以通过体内重组构建文库或定点变体。相对活性测定将SC-葡萄糖上的酵母克隆接种进包含YPD+Zn培养基的96孔微滴度板的孔中并在28℃培养3天。将培养物上清液施加到96孔玉米素微滴定板并在至少2种温度(例如,60℃和65℃、70℃和75℃、70℃和80℃)孵育超过4小时或过夜。玉米素在板中的浊度被测量为A630并且相对活性(较高/较低温度)被确定为热稳定性改进的一个指示。选择比亲本变体具有更高相对活性的克隆并确定这些序列。残余活性测定将SC-葡萄糖上的酵母克隆接种进96孔微滴度板的孔中并在28℃培养3天。将培养物上清液在某一温度(80℃或84℃,用4℃作为参考)下于20mM乙酸钠缓冲液(pH4.5)中孵育10min之后,使用偶氮-酪蛋白(麦格酶公司(Megazyme))在65℃测量蛋白酶活性,从而确定残余活性。选择比亲本变体具有更高残余活性的克隆并确定该序列。偶氮-酪蛋白测定将20微升样品与150微升底物溶液(4ml的在乙醇中的12.5%偶氮-酪蛋白,在96ml的20mM乙酸钠(pH4.5)中,包含0.01%triton-100和0.25mMZnSO4)混合并孵育4小时或更久。添加20微升/孔的100%三氯乙酸(TCA)溶液之后,将该板离心并且吸取100微升的上清液以测量A440。蛋白酶变体在米曲霉中的表达使用包括蛋白酶变体基因的构建体来构建用于曲霉属的表达载体。曲霉属表达载体由以下表达盒组成,该表达盒是基于融合至构巢曲霉磷酸丙糖异构酶的非翻译前导序列的黑曲霉中性淀粉酶II启动子(Pna2/tpi)和黑曲霉淀粉糖苷酶终止子(Tamg)。质粒上还存在使得可以在作为唯一氮源的乙酰胺上生长的来自构巢曲霉的曲霉属选择性标记amdS。如描述于Lassen等人(2001),AppliedandEnvironmentalMicorbiology[应用与环境微生物学],67,4701-4707中,将蛋白酶变体的表达质粒转化进曲霉属中。用于每个构建体,分离、纯化并在摇瓶中培养10个至20个菌株。所表达的变体的纯化1.调节0.22μm经过滤的发酵样品的pH至4.0。2.将样品置于冰浴中,伴随磁力搅拌。以小量的等分部分添加(NH4)2SO4(对应于大约2.0M至2.2M(NH4)2SO4,当添加该化合物时未考虑体积增加)。3.(NH4)2SO4的最终添加之后,将该样品于冰浴中伴随轻柔的磁力搅拌孵育min.45min。4.离心:日立(Hitachi)himacCR20G高速冷冻离心机,配备有R20A2转头,5℃,20,000rpm,30min。5.将形成的沉淀溶解于200ml50mM乙酸钠(pH4.0)中。6.通过真空吸引器(易威奇公司(IWAKI))使用0.22μmPESPLUS膜过滤该样品。7.在冷室中,使用超滤法(来自赛多利斯公司(Vivascience)的Vivacell250,配备有5kDaMWCOPES膜)将样品脱盐/缓冲液-过夜交换到50mM乙酸钠(pH4.0)中。使用50mM乙酸钠(pH4.0)将残余样品稀释至200ml。样品的导电性优选地小于5mS/cm。8.将样品加载到用50mM乙酸钠(pH4.0)平衡的阳离子交换柱上。使用3倍柱体积的结合缓冲液(50mM乙酸钠pH4.0)将未结合样品从该柱洗出,并且使用线性梯度(0-100%洗脱缓冲液(50mM乙酸钠+1MNaCl,pH4.0)),以10倍柱体积对样品进行洗脱。9.通过内切-蛋白酶测定(参见下文)测定所收集的级分,随后对所选择的级分进行标准SDS-PAGE(还原条件)。基于内切-蛋白酶测定和SDS-PAGE汇集多个级分。内切-蛋白酶测定1.通过磁力搅拌溶解ProtazymeOL片/5ml250mM乙酸钠(pH5.0)(底物:来自麦格酶公司(Megazyme)的、目录号PRAK11/08的内切-蛋白酶ProtazymeAK片)。2.边搅拌边将250微升的底物溶液转移到1.5ml的艾本德管。3.向每个管中添加25微升的样品(空白对照是样品缓冲液)。4.将这些管在50℃在热混器中振荡(1000rpm)孵育15分钟。5.向每个管中添加250微升的1MNaOH,随后进行涡旋。6.以16,100×G并且在25℃离心3min。7.将200微升的上清液转移到MTP,并且记录590nm处的吸光度。结果实例3使用纯化的酶,所选择变体的温度特征曲线纯化所选择的显示良好热稳定性的变体并且将经纯化的酶用于如下所述的玉米素-BCA测定中。将该酶在如所指出的升高的温度孵育60min之后,在60℃确定残余蛋白酶活性。玉米素-BCA测定:在不同温度通过变体蛋白酶进行玉米素-BCA测定以检测释放自玉米素的可溶性蛋白的定量。方案:1)混合10微升的10微克/ml酶溶液和100ul的0.025%玉米素溶液于微滴定板(MTP)中。2)在不同温度孵育60min。3)添加10微升的100%三氯乙酸(TCA)溶液。4)在3500rpm离心MTP持续5min。5)取15微升至新的包含100微升的BCA测定溶液的MTP中(皮尔斯公司(Pierce)目录号;23225,BCA蛋白测定试剂盒)。6)在60℃孵育30min。7)测量A562。结果示于表7中。与野生型蛋白酶相比较,所有的经测试的变体均显示改进的热稳定性。表7.玉米素-BCA测定实例4草酸青霉菌葡糖淀粉酶的表征该草酸青霉菌葡糖淀粉酶披露于本文的SEQIDNO:14(成熟)中。底物。底物:含1%可溶性淀粉(西格玛(Sigma)S-9765)的去离子水反应缓冲液:0.1M乙酸盐缓冲液,pH5.3葡萄糖浓度测定试剂盒:和光葡萄糖检验试剂盒(LabAssay葡萄糖,和光株式会社,目录号298-65701)。反应条件。将20微升的可溶性淀粉与50微升的乙酸盐缓冲液(pH5.3)混合。添加30微升的酶溶液(50μg酶蛋白质/ml)达到100微升最终体积,随后在37℃孵育15分钟。葡萄糖浓度是通过和光试剂盒(Wakokits)测定。所有这些工作都平行进行。最适温度。为了评估草酸青霉菌葡糖淀粉酶的最适温度,以上描述的“反应条件”-测定是在20℃、30℃、40℃、50℃、60℃、70℃、80℃、85℃、90℃以及95℃进行的。结果示于表8中。表8最适温度温度(℃)20304050607080859095相对活性(%)63.671.786.499.494.6100.092.992.582.782.8从这些结果可知草酸青霉菌葡糖淀粉酶在给定条件下的最适温度是在50℃与70℃之间并且该葡糖淀粉酶在95℃维持超过80%活性。热稳定性。为了评估草酸青霉菌葡糖淀粉酶的热稳定性,对反应条件测定进行修改,其中将酶溶液和乙酸缓冲液在20℃、30℃、40℃、50℃、60℃、70℃、75℃、80℃、85℃、90℃和95℃预孵育15min。孵育之后,向该溶液中添加20微升淀粉并且如上所述进行该测定。结果示于表9中。表9热稳定性从这些结果可知草酸青霉菌葡糖淀粉酶在预孵育15min后在高达70℃是稳定的,因为它维持超过80%活性。最适pH。为了评估草酸青霉菌葡糖淀粉酶的pH最佳值,在如下pH进行上述反应条件测定:pH2.0、3.0、3.5、4.0、4.5、5.0、6.07.0、8.0、9.0、10.0和11.0。使用以下缓冲液来代替在该反应条件测定中所描述的乙酸盐缓冲液:100mM的琥珀酸、HEPES、CHES、CAPSO、1mMCaCl2、150mMKCl、0.01%TritonX-100,pH用HCl或NaOH调整到2.0、3.0、3.5、4.0、4.5、5.0、6.0、7.0、8.0、9.0、10.0或11.0。结果示于表10中。表10pH最佳值从这些结果可知在给定条件下草酸青霉菌葡糖淀粉酶在pH5.0具有最高活性。该草酸青霉菌葡糖淀粉酶在宽泛的pH范围内是有活性的,因为它在从pH2至7维持超过50%活性。pH稳定性。为了评估草酸青霉菌葡糖淀粉酶的热稳定性,将反应条件测定进行修改,其中使用上述pH最佳值时的缓冲液,在具有pH2.0、3.0、3.5、4.0、4.5、5.0、6.07.0、8.0、9.0、10.0和11.0的缓冲液中将酶溶液(50微克/mL)预孵育20小时。预孵育之后,向该溶液中添加20微升可溶性淀粉至100微升的最终体积并且如上所述进行该测定。结果示于表11中。表11pH稳定性从这些结果可知草酸青霉菌葡糖淀粉酶在预孵育20小时后从pH3至pH7是稳定的并且其在pH8降低活性。实例5蛋白酶Pfu的热稳定性。购买自日本宝酒造生物公司的激烈热球菌蛋白酶(PfuS)的热稳定性使用如与实例2中相同的方法进行检测。发现热稳定性(相对活性)在pH4.5时是110%(80℃/70℃)和103%(90℃/70℃)。实例6草酸青霉菌菌株的葡糖淀粉酶基因的克隆草酸青霉菌菌株cDNA的制备。通过按照cDNA末端系统(美国加利福尼亚州卡尔斯巴德市的英杰公司(InvitrogenCorp.))的3’快速扩增技术的说明来合成cDNA。草酸青霉菌菌株葡糖淀粉酶基因的克隆。使用下文所示的、被设计成用来从5’端放大葡糖淀粉酶基因的寡核苷酸引物来克隆草酸青霉菌葡糖淀粉酶基因。正义引物:5’-ATGCGTCTCACTCTATTATCAGGTG-3’(SEQIDNO:19)通过PCR用正义引物和AUAP(由cDNA末端系统的3’快速扩增技术提供)、通过使用PlatinumHIFITaqDNA聚合酶(美国加利福尼亚州卡尔斯巴市的英杰公司)来扩增全长基因。扩增反应是由5μl的10xPCR缓冲液、2μl的25mMMgCl2、1μl的10mMdNTP、1μl的10uM正义引物、1μl的10uMAUAP、2μl的第一链cDNA、0.5μl的HIFITaq、以及37.5μl的去离子水构成的。PCR程序是:94℃,3min;10个循环:94℃持续40sec,60℃40sec、每循环降低1℃,68℃持续2min;25个循环:94℃持续40sec,50℃40sec,68℃持续2min;在68℃进行最终延伸持续10分钟。使用一个pGEM-T载体系统(美国威斯康星州麦迪逊市的普洛麦格公司(PromegaCorporation))将获得的PCR片段克隆到pGEM-T载体(美国威斯康星州麦迪的逊市普洛麦格公司)中以产生质粒AMG1。对插入到质粒AMG1中的葡糖淀粉酶基因进行测序确认。将含有质粒AMG1(表示为NN059173)的大肠杆菌菌株TOP10于2009年11月23日保藏在德国微生物与菌种保藏中心(DeutscheSammlungvonMikroorganismenundZellkulturenGmbH,DSMZ)并且指定保藏号为DSM23123。实例7克隆的草酸青霉菌葡糖淀粉酶的表达通过PCR使用以下所示的两种克隆引物F和引物R将草酸青霉菌葡糖淀粉酶基因重新从质粒AMG1克隆到曲霉菌表达载体中,这两种克隆引物是基于已知的序列和添加的标志来设计以用于通过IN-FUSIONTM策略直接克隆。引物F:5’ACACAACTGGGGATCCACCATGCGTCTCACTCTATTATC(SEQIDNO:20)引物R:5’AGATCTCGAGAAGCTTAAAACTGCCACACGTCGTTGG(SEQIDNO:21)用质粒AMG1来进行PCR反应以便扩增全长基因。PCR反应是由40μg的质粒AMG1DNA、1μl的每种引物(100μM)、12.5μl的2x扩展剂高保真主体混合物(ExtensorHi-FidelityMasterMix,英国拜力公司(ABgene))、以及9.5μl的PCR级水组成。使用DYADPCR仪(美国加利福尼亚州赫拉克勒斯的伯乐实验室有限公司(Bio-RadLaboratories,Inc.))进行PCR反应,该仪器的程序为:在94℃持续2分钟,随后进行94℃持续15秒、50℃持续30秒、以及72℃持续1分钟的25次循环;并且然后在72℃10分钟。通过1.0%琼脂糖凝胶电泳使用1×TAE缓冲液来分离反应产物,其中将约1.9kb的PCR产物带从该凝胶中切除并根据制造商的说明使用PCRDNA和凝胶带纯化试剂盒(通用电气医疗集团(GEHealthcare),英国)进行纯化。根据制造商的说明,使用IN-FUSIONTMDry-DownPCR克隆试剂盒(美国加利福尼亚州帕洛阿尔托(PaloAlto)的BD生物科学公司(BDBiosciences))将与草酸青霉菌葡糖淀粉酶基因对应的DNA克隆到用BamHI和HindIII线性化的曲霉菌表达载体中。这一线性化的载体构建是如WO2005/042735A1所述的。将2μl体积的连接混合物用于转化25μl的融合蓝色(FusionBlue)大肠杆菌细胞(包括在IN-FUSIONTMDry-DownPCR克隆试剂盒中)。在42℃热休克45秒并在冰中冷却之后,添加250μl的SOC培养基,并且将这些细胞在225rpm、在37℃孵育90分钟,随后铺在每ml含50μg氨苄西林的LB琼脂板上,并在37℃培养过夜。在每毫升补充有50μg氨苄西林的3mlLB培养基中接种所选择的菌落,并在225rpm、在37℃孵育过夜。根据制造商的说明使用微型JETSTAR(德国Genomed公司)纯化来自所选择的菌落的质粒DNA。在异源表达之前通过桑格测序(Sangersequencing)来验证草酸青霉菌葡糖淀粉酶基因序列。选择这些质粒之一用于进一步表达,并将其命名为XYZXYZ1471-4。如WO95/02043所述地制备黑曲霉MBin118的原生质体。将一百μl的原生质体悬浮液与2.5μg的XYZ1471-4质粒相混合,并且添加250微升的60%PEG4000(艾普利公司(Applichem))(聚乙二醇,分子量4,000)、10mMCaCl2、以及10mMTris-HCl(pH7.5)并轻轻混合。在37℃孵育该混合物30分钟并且在补充有10mM乙酰胺和15mMCsCl的COVE蔗糖(Cove,1996,Biochim.Biophys.Acta[生物化学与生物物理学报]133:51-56)(1M)板上将原生质体与6%的低熔琼脂糖(惠泰克生物分子应用公司(BiowhittakerMolecularApplications))相混合,并将其作为一个顶层添加在补充有10mM乙酰胺和15mMCsCl的COVE蔗糖(1M)板以用于转化株选择(每板4ml顶层琼脂)。在37℃孵育5天之后,挑取十六个转化株的孢子并将其接种在96深孔MT板中的750μlYP-2%麦芽糖培养基上。在30℃静止培养5天之后,在SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)凝胶,即GritonXTPrecast凝胶(伯乐公司(BioRad),美国加利福尼亚州)上分析来自每个孔的10μl培养液,以便基于产生大量葡糖淀粉酶的能力鉴别最好的转化株。在原始转化板上鉴别所选择的转化株并将其作为孢子保存在20%甘油贮备物中并冷冻保存(-80℃)。培养。在100ml的MLC培养基中接种所选择的转化株并在30℃在旋转振荡器上的500ml摇瓶中培养2天。将3ml的培养液接种到100ml的M410培养基中并在30℃培养3天。将培养液离心并使用0.2μm的膜滤器过滤上清液。α-环糊精亲和凝胶。使十克环氧基活化的琼脂糖6B(英国查尔方特圣吉尔斯(ChalfontSt.Giles)的通用电气医疗集团)粉末悬浮在蒸馏水中并在烧结玻璃过滤器上用蒸馏水进行洗涤。使凝胶悬浮于偶合溶液(100ml的12.5mg/mlα-环糊精,0.5MNaOH)并在室温孵育一天,同时轻轻振荡。在烧结玻璃过滤器上使用蒸馏水洗涤该凝胶,并使其悬浮在pH10的100ml的1M乙醇胺中,并在50℃孵育4小时以进行封闭。随后使用pH8的50mMTris-HCl和可替代地pH4.0的50mMNaOAc洗涤该凝胶若干次。最后使用平衡缓冲液(50mMNaOAc,150mMNaCl,pH4.5)将该凝胶装填在35ml至40ml的柱中。从培养液纯化葡糖淀粉酶。通过0.22μmPES过滤器过滤来自具有葡糖淀粉酶基因的黑曲霉MBin118的发酵的培养液,并施加在之前在50mMNaOAc、150mMNaCl、pH4.5缓冲液中平衡的α-环糊精亲和凝胶柱上。使用平衡缓冲液将未结合的材料从该柱中洗出,并且使用3倍柱体积以上的含有10mMβ-环糊精的相同缓冲液洗脱葡糖淀粉酶。检查洗脱液的葡糖淀粉酶活性以查看葡糖淀粉酶是否已结合至α-环糊精亲和凝胶。然后相对于pH5.0的20mMNaOAc透析纯化的葡糖淀粉酶样品。最后通过SDS-PAGE检查纯度并且仅发现一条单独的带。实例8草酸青霉菌葡糖淀粉酶(PE001)的定点变体的构建和表达用实例9所述的质粒XYZ1471-4、使用以下所示的引物K79VF和K79VR(这些引物被设计成用于将成熟序列的位置79处的赖氨酸(K)取代为缬氨酸V)以及以下所示的引物F-NP003940和R-NP003940(这两个引物基于已知的序列和添加的标志来设计以用于通过IN-FUSIONTM策略直接克隆)进行两个PCR反应。引物K79VF18merGCAGTCTTTCCAATTGAC(SEQIDNO:22)引物K79VR18merAATTGGAAAGACTGCCCG(SEQIDNO:23)引物F-NP003940:5’ACACAACTGGGGATCCACCATGCGTCTCACTCTATTATC(SEQIDNO:24)引物R-NP003940:5’AGATCTCGAGAAGCTTAAAACTGCCACACGTCGTTGG(SEQIDNO:25)在以下所述的条件下使用PTC-200DNA引擎进行PCR。根据制造商的说明通过凯杰凝胶提取试剂盒从琼脂糖凝胶中回收DNA片段。根据制造商的说明,使用IN-FUSIONTMDry-DownPCR克隆试剂盒(美国加利福尼亚州帕洛阿尔托的BD生物科学公司)将所得的纯化的两个片段克隆到用BamHI和HindIII线性化的曲霉菌表达载体中。这一线性化的载体构建是如WO2005/042735A1所述的。使用连接混合物来转化大肠杆菌DH5α细胞(东洋公司(TOYOBO))。在每毫升补充有50μg氨苄西林的3mlLB培养基中接种所选择的菌落,并在225rpm、在37℃孵育过夜。根据制造商的说明使用凯杰质粒微型试剂盒(凯杰公司)从所选择的菌落纯化质粒DNA。在异源表达之前验证草酸青霉菌葡糖淀粉酶定点变体基因序列的序列,并选择这些质粒之一来用于进一步表达并且将其命名为pPoPE001。如WO95/02043所述地制备黑曲霉MBin118的原生质体。将一百微升的原生质体悬浮液与2.5μg的pPoPE001质粒相混合,并且添加250微升的60%PEG4000(艾普利公司(Applichem))(聚乙二醇,分子量4,000)、10mMCaCl2、以及10mMTris-HCl(pH7.5)并轻轻混合。在37℃孵育该混合物30分钟,并且在补充有10mM乙酰胺和15mMCsCl的COVE蔗糖(Cove,1996,Biochim.Biophys.Acta[生物化学与生物物理学报]133:51-56)中将原生质体与1%的琼脂糖L(日本基因公司(NipponGene))相混合,并将其作为一个顶层添加在补充有10mM乙酰胺和15mMCsCl的COVE蔗糖板上以用于转化株选择(每板4ml顶层琼脂)。在37℃孵育5天之后,挑取十六个转化株的孢子并将其接种在96深孔MT板中的750μlYP-2%麦芽糖培养基上。在30℃静止培养5天之后,在SDS-PAGE凝胶上分析来自每个孔的10μl培养液以便基于产生大量葡糖淀粉酶的能力来鉴别最好的转化株。实例9定点PoAMG变体PE001的纯化将所选择的变体转化株和表达实例8所述的野生型草酸青霉菌葡糖淀粉酶的菌株培养在100ml的YP-2%麦芽糖培养基中,并且培养物通过0.22μmPES过滤器过滤,并施加在之前于50mMNaOAc、150mMNaCl、pH4.5缓冲液中平衡的α-环糊精亲和凝胶柱上。使用平衡缓冲液将未结合的材料从该柱中洗出,并且使用3倍柱体积以上的含有10mMβ-环糊精的相同缓冲液洗脱葡糖淀粉酶。检查洗脱液的葡糖淀粉酶活性以查看葡糖淀粉酶是否已结合至α-环糊精亲和凝胶。随后相对于pH5.0的20mMNaOAc透析纯化的葡糖淀粉酶样品。实例10PE001蛋白酶稳定性的表征将40μl在50mM乙酸钠缓冲液(pH4.5)中的酶溶液(1mg/ml)与1/10体积的1mg/ml蛋白酶溶液相混合,该蛋白酶是例如在BiochemJ.[生物化学杂志]1975年4月;147(1):45-53中所述的曲霉酸性蛋白酶I(aspergillopepsinI)、或从西格玛公司(Sigma)可商购的产品以及在Biochemicaljournal[生物化学杂志][0264-6021]八幡町市岛(Ichishima)2003,371(2):541中所述的奥瑞素(aorsin),并且在4℃或32℃孵育过夜。作为对照实验,将H2O而不是蛋白酶添加到样品之中。将样品装载在SDS-PAGE上以查看葡糖淀粉酶是否被蛋白酶切割。在SDS-PAGE中,PE001仅示出与完整分子相对应的一条带,而野生型葡糖淀粉酶被蛋白酶降解并且示出60kCa的更低分子大小的一条带。表12蛋白酶处理之后的SDS-PAGE结果N.D.:未检测到。实例11培养过程中更少切割在32℃将变体(PE001)和野生型草酸青霉菌葡糖淀粉酶的曲霉菌转化株在含有4X稀释的、补充有10mM乙酸钠缓冲液的YP-2%麦芽糖培养基(pH4.5)的6孔MT板中培养1周。将培养物上清液装载在SDS-PAGE上。表13培养物上清液的SDS-PAGE结果N.D.:未检测到。在发酵过程中野生型葡糖淀粉酶被宿主蛋白酶切割,而变体则仅产生完整的分子。实例12变体PE001与亲本相比的葡糖淀粉酶活性针对野生型草酸青霉菌的纯化的酶和变体葡糖淀粉酶检查如上文所述作为AGU测量的葡糖淀粉酶活性。葡糖淀粉酶单位(AGU)被定义为在标准条件下(37℃,pH4.3,底物:100mM麦芽糖,缓冲液:0.1M醋酸盐,反应时间:6分钟)每分钟水解1微摩尔麦芽糖的酶的量。表14实例13具有增强的热稳定性的葡糖淀粉酶变体的纯化可以类似于实例8中描述的程序构建并表达显示出增加的热稳定性的变体。所有变体菌来源于PE001。在YPM培养基中表达以后,将包含T65A或Q327F(SEQIDNO:14编号)取代的变体如下进行微纯化:通过经由0.22μm过滤器过滤除去菌丝体。向滤板(Whatman,UNI过滤器(Unifilter)800μl,25μm至30μmMBPP)的孔中添加50μl柱材料(根据制造商的推荐,与Mini-Leak二乙烯砜-活化的琼脂糖培养基偶联的α-环糊精)。通过两次添加200μl缓冲液用结合缓冲液(200mM乙酸钠,pH4.5)平衡该柱材料,剧烈震荡10min(海道夫(Heidolph),Titramax101摇床,1000rpm)并且通过真空除去缓冲液(华特曼,UniVac3)。随后,添加400μl培养上清液和100μl结合缓冲液,并且在剧烈振荡下将板孵育30min。通过真空除去未结合的材料并且重复结合步骤。通常地,每个变体使用4个孔。然后通过添加200μl具有减少的离子强度的缓冲液(50/10/5mM乙酸钠,pH4.5)进行三个洗涤步骤,振荡15min并且通过真空除去缓冲液。通过两次添加100μl洗脱缓冲液(250mM乙酸钠,0.1%α-环糊精,pH6.0)洗脱结合的AMG,振荡15min并且通过真空收集在微量滴定板中的洗脱材料。将合并的洗脱物浓缩并且使用具有10kDa截留单位的离心过滤器(MilliporeMicroconUltracelYM-10)将缓冲液变为50mM乙酸钠,pH4.5。将微纯化的样品保存在-18℃直到热稳定性测试。实例14蛋白质热解折叠分析(TSA,热转变测定(Thermalshiftassay))使用宝石橙(SyproOrange)(英杰公司,S-6650)监测T65A和Q327F变体的蛋白质热解折叠并且使用实时PCR仪(应用生物系统公司(AppliedBiosystems);一步一加(Step-One-Plus))进行。在96孔板中,将25微升微纯化的、处于约100微克/ml的50mM乙酸盐(pH4,5)中的样品与宝石橙(5:1)相混合(所得浓度=5X;来自供应商的母液=5000X)。用光学PCR密封件密封该平板。将PCR仪的扫描速率设置为每小时76℃,起始于25℃并且结束于96℃。使用宝石橙(SyproOrange)(英杰公司,S-6650)监测E501V+Y504T变体的蛋白质热解折叠并且使用实时PCR仪(应用生物系统公司(AppliedBiosystems);一步一加(Step-One-Plus))进行。在96孔板中,在具有或不具有200ppm阿卡波糖(Acarbose)(西格玛公司A8980)的情况下,将15微升纯化的、处于约50微克/ml的50mM乙酸盐(pH4,5)中的样品与宝石橙(1:1)相混合(所得浓度=5X;来自供应商的母液=5000X)。用光学PCR密封件密封该平板。将PCR仪的扫描速率设置为每小时76℃,起始于25℃并且结束于96℃。使用用于激发的内置(in-built)LED蓝光和ROX-滤波器(610nm,发射)每20秒监测荧光。将Tm值计算为第一衍生物的最大值(dF/dK)(参考:Gregory等人,2009,JBiomolScreen[生物分子筛选杂志]14:700)。表15a.表15b.实例15通过差示扫描量热法(DSC)分析热稳定性基本如在实例8中所描述构建在特定位置处具有取代和/或缺失的额外的位点特异性变体并且如在实例9中所描述进行纯化。使用VP-毛细管差示扫描量热器(美国新泽西州的皮斯卡塔韦的米克罗卡公司(MicroCalInc.)),通过差示扫描量热法(DSC)在pH4.0或4.8处(50mM乙酸钠)测定纯化的Po-AMGPE001衍生的变体的热稳定性。在以200K/hr的恒定的程序化加热速率下,在选择的缓冲液(50mM乙酸钠,pH4.0或4.8)中加热酶溶液后获得的热分析图(Cp对T)中,将热变性温度Td(℃)当作变性峰(主要的吸热峰)的顶端。将样品溶液和参比溶液(大约0.3ml)从10℃的储存条件下装载到量热仪中(参比溶液:不具有酶的缓冲液),并且在10℃热预平衡20分钟,随后从20℃至110℃进行DSC扫描。以约+/-1℃的精确度测定变性温度。分离的变体以及DSC数据披露于下表16中。表16.实例16通过热应激测试和pNPG测定分析热稳定性从来自实例10的经鉴别的取代变体之一(被鉴别为PE008)开始,通过热应激测定测试额外的变体,在该热应激测定中在83℃热休克5min后,测定来自生长培养物的上清液的葡糖淀粉酶(AMG)活性。在热休克以后,测量变体连同在非应激样品中的变体的残余活性。Po-AMGpNPG活性测定的说明:草酸青霉菌葡糖淀粉酶pNPG活性测定是一种光谱端点测定(spectrometricendpointassay),其中将样品一分为二并且进行热应激地和非热应激地测量。所以,数据输出是应激样品中的残余活性的量度。生长:向无菌微量滴定板(MTP)的每个孔中添加200微升富生长培养基(没有Dowfax的FTX-14)。将来自冻存物的感兴趣的菌株一式三份地直接接种在MTP中。在20个孔中接种基准物。将具有培养基的未接种的孔用作测定空白。将MTP放在包含湿巾的塑料箱中,以阻止孵育过程中这些孔的蒸发。将塑料箱在34℃放置4天。测定;将50微升上清液转移至50微升0.5MNaAc(pH4.8)中,以获得的准确的样品pH。将50微升稀释物转移至PCR板上并且在PCR仪中在83℃热应激5分钟。将剩余的一半稀释物保持在室温。将20微升的应激的和非应激的样品转移至标准MTP中。添加20微升pNPG-底物,以起始该反应。将该板在室温孵育1h。终止该反应并且通过添加50微升0.5MNa2CO3进行显色。在405nm处,在酶标仪(分子设备公司(MolecularDevices))上测量黄色。缓冲液:0.5mMNaAc,pH4.80.25mMNaAc,pH4.8底物,6mMpNPG:15mg在10mL0.25NaAc(pH4.8)中的4-硝基苯基D-吡喃葡萄糖苷终止/显色溶液:0.5MNa2CO3数据处理:在Excel中,来自应激和非应激样品两者的原始Abs405数据是用其对应的空白进行空白消减的。计算残余活性(%残余活性=(Abs非应激-(Abs非应激-Abs应激))/Abs非应激*100%)并且相对于基准Po-amg0008绘图。表17表18实例17根据本发明的热稳定性变体的葡糖淀粉酶活性测试已经使用在实例16中描述的pNPG测定证实了在表16、17和18中披露的所有以上描述的变体在培养上清液上的葡糖淀粉酶活性。实例18通过差示扫描量热法(DSC)测定内切-β-葡聚糖酶(EG)的热稳定性EG的热稳定性可以如“材料与方法”部分在“通过差示扫描量热法测定Td对内切葡聚糖酶和半纤维素酶的测定”下所述测定。表19实例19在液化中添加热稳定的木聚糖酶-对乙醇产量和玉米纤维降解的影响通过100g小规模液化评价所有处理。将从工业玉米乙醇植物获得的玉米粉用于实验。通过Mettler-ToledoHB43卤素水分天平测定玉米粉的干固体(DS)为85.12%。为了液化,添加38.77g玉米粉和61.23g自来水以达到Lab-O-Mat的每个罐中33%的DS和100g的质量。发现玉米浆料的pH值约为5.9,无需调整。向每个罐中添加40%H2SO4以将pH调节至5.0以液化。如下表21所示,给每个罐加入适量的稀释的酶。使用α-淀粉酶(AA369)和内切-葡聚糖酶(TlEG)。如表20所示评估两种热稳定的木聚糖酶。全部添加之后和液化前的玉米浆料的最终DS为31.4%。然后用盖子密封罐,并装入Lab-O-Mat。在恒定旋转的情况下在85℃发生液化两小时。液化完成后,将罐从Lab-O-Mat中取下并放在冰上以快速冷却。然后将冷却的玉米醪从罐中取出放入烧杯中,并准备用于同时糖化和发酵(SSF)。每个SSF处理重复五次。在SSF开始之前补充3ppm青霉素和800ppm尿素。将大约5g每种玉米醪(以上液化)添加至15ml聚丙烯管中。通过钻1/32英寸(1.5mm)孔制备管,然后称重空管,之后添加玉米浆料。在添加醪液后再次称重管以确定每管中醪液的精确重量。用0.6AGU/gDS的葡糖淀粉酶SA(GSA)加入每个管。实际酶剂量是基于每个管中玉米浆料的准确重量。在酶剂量之后,向每个管中添加100ul的ETHANOLREDTM酵母繁殖体,并然后在32℃水浴中孵育54小时。在发酵结束时取样用于HPLC分析。HPLC制备由以下组成:通过添加50微升的40%H2SO4来终止反应、离心,并且通过0.45微米过滤器过滤。将样品在4℃储存直至分析。使用与RI检测器偶联的AgilentTM1100HPLC系统确定乙醇和寡糖浓度。该分离柱是来自BioRadTM的aminexHPX-87H离子排阻柱(300mm×7.8mm)。表20在液化中测试的木聚糖酶表21.液化中的酶剂量结果:来自每种处理的乙醇产量总结于下表22中。Tl木聚糖酶本身具有良好的性能并且在EG之上。通过相同的100ug/gDS的酶剂量,木聚糖酶和EG的组合给出比EG本身更高的乙醇产量。根据液化后的GPC数据,发现用Tl木聚糖酶和TlEG的组合处理产生的小片段比单独用TlEG处理小,表明Tl木聚糖酶能够将玉米纤维切成更小的片段,因此有助于释放更多结合的淀粉。实例20在用α-淀粉酶的玉米液化中添加热稳定的半纤维素酶–对乙醇产量的影响通过18g液化评价所有处理。将从工业玉米乙醇工厂获得磨碎的玉米粉用于实验。通过Mettler-ToledoHB43卤素水分天平一式两份测定玉米粉的干固体(DS)为86.5%。为了液化玉米粉,将6.4±0.1g玉米粉称入40mlOakRidge管中。添加自来水以达到32.2%的%DS和17.2±0.2g玉米浆料的质量。发现玉米浆料的pH值约为6.0;向每个管中添加23μl的40%H2SO4以将pH降至5.0用于液化。使用α-淀粉酶(AA369)。除了仅AA对照之外,如表23所示评估了六种热稳定的半纤维素酶。如下表24所示,给每个管加入适量的稀释的酶。每个液化处理一式四份进行测试,连同六个对照没有添加半纤维素酶。根据每管中玉米浆料的质量计算实际酶剂量;添加自来水以使所有管的计算的%DS至31.0%。全部添加和液化之前玉米浆料的最终体积为18.1±0.4g。添加酶和水后,将试管密封严密,充分振摇,然后放入带有机架的BoekelBigSHOTIII杂交烘箱模型230402中,该杂交烘箱固定并围绕固定轴线垂直旋转试管。通过连接到烤箱架上的校准温度计测定,将烘箱预热至80.0℃±0.5℃。当门打开装载时,培养箱温度下降;监测温度计上的温度直至其达到75℃,此时启动计时器并伴随着转速设定为20rpm的旋转孵育两小时。将管在80℃孵育两小时后,将管从杂交箱中取出并浸入冷水中,偶尔混合约30分钟,直到它们冷却到触摸。取下盖子,用小刮刀将粘在管子两侧的材料刮下。将内部制备的尿素和青霉素溶液添加至每个管中以分别达到700ppm和3ppm的最终浓度。给每个试管加入适量的稀释的葡糖淀粉酶SA(GSA)。基于每管中液化的玉米醪的平均重量,实际酶剂量为0.77AGU/gDS;根据需要添加自来水,使每个管的DS达到31%。所有管中均添加400μL在自来水中再水化的酵母;体积基于每个管中的平均浆料重量,并且20μl/g玉米醪的酵母剂量四舍五入到最接近的100μl。然后用带隔膜的盖子覆盖管,通过插入22号针头排气,并置于InforsHTMultitronPro湿度控制的培养箱中进行同时糖化和发酵(SSF)。温度为32℃,并且湿度设置为80%;在整个发酵过程的一天中用手混合管子两次。在65小时的发酵后收集样品用于HPLC分析。该过程从停止酶和酵母反应开始,通过添加200μL的40%H2SO4(10μl/g玉米醪,四舍五入最接近的100μl)并混合以分配酸;最终计算的DS在SSF结束时为29.7%。HPLC样品制备由组成:将约5g发酵的玉米醪转移至15mlFalcon管中,以3000rpm离心8分钟,并使上清液通过0.45μm过滤器进入HPLC小瓶中。将样品贮存在4℃直到分析。用于测定乙醇和寡糖浓度的系统是与RI检测器偶联的AgilentTM100HPLC系统。分离柱为BioRadTMAminexHPX-87H离子排阻柱(300mmx7.8mm)。结果通过添加半纤维素酶增加的最终乙醇和乙醇的百分比总结在以下表25中。实例21在玉米的液化中添加热稳定的半纤维素酶-对乙醇产量的影响通过18g液化评价所有处理。将从工业玉米乙醇工厂获得磨碎的玉米粉用于实验。通过Mettler-ToledoHB43卤素水分天平一式两份测定玉米粉的干固体(DS)为86.5%。为了液化玉米粉,将6.4±0.1g玉米粉称入40mlOakRidge管中。添加自来水以达到31.5%的%DS和17.6±0.2g玉米浆料的质量。发现玉米浆料的pH值约为6.0;向每个管中添加23μl的40%H2SO4以将pH降至5.0用于液化。如表26所示评估来自雷塞氏篮状菌(TlXyl)的热稳定的半纤维素酶。将该半纤维素酶与如以下表26中所示的α-淀粉酶(AA369)、热稳定的葡糖淀粉酶(Po498),热稳定的蛋白酶(蛋白酶Pfu)组合以评估热稳定的半纤维素酶在液化中的影响。如下表26所示,给每个管加入适量的稀释的酶。每个液化处理一式三份进行测试,连同三个对照没有添加半纤维素酶。根据每管中玉米浆料的质量计算实际酶剂量;添加自来水以使所有管的计算的%DS至31.0%。全部添加和液化之前玉米浆料的最终体积为18.1±0.4g。添加酶和水后,将试管密封严密,充分振摇,然后放入带有机架的BoekelBigSHOTIII杂交烘箱模型230402中,该杂交烘箱固定并围绕固定轴线垂直旋转试管。通过连接到烤箱架上的校准温度计测定,将烘箱预热至80.0℃±0.5℃。当门打开装载时,培养箱温度下降;监测温度计上的温度直至其达到75℃,此时启动计时器并伴随着转速设定为20rpm的旋转孵育两小时。酶的来源家族行动序列ID雷塞氏篮状菌GH10木聚糖酶(本文的SEQIDNO:5)*EP是酶蛋白将管在80℃孵育两小时后,将管从杂交箱中取出并浸入冷水中,偶尔混合约30分钟,直到它们冷却到触摸。取下盖子,用小刮刀将粘在管子两侧的材料刮下。将尿素和青霉素溶液添加至每个管中以分别达到700ppm和3ppm的最终浓度。给每个试管加入适量的稀释的葡糖淀粉酶(GSA)。基于每管中液化的玉米醪的平均重量,实际酶剂量为0.6AGU/gDS;根据需要添加自来水,使每个管的DS达到31.2%±0.1%。所有管中均添加400μL在自来水中再水化的酵母;体积基于每个管中的平均浆料重量,并且20μl/g玉米醪的酵母剂量四舍五入到最接近的100μl。然后用带隔膜的盖子覆盖管,通过插入22号针头排气,并置于InforsHTMultitronPro湿度控制的培养箱中进行同时糖化和发酵(SSF)。温度为32℃,并且湿度设置为80%;在整个发酵过程的一天中用手混合管子两次。在65小时的发酵后收集样品用于HPLC分析。该过程涉及停止酶和酵母反应,通过添加200μL的40%H2SO4(10μl/g玉米醪,四舍五入最接近的100μl)并混合以分配酸;最终计算的DS在SSF结束时为30%±0.1%。HPLC样品制备由组成:将约5g发酵的玉米醪转移至15mlFalcon管中,以3000rpm离心8分钟,并使上清液通过0.45μm过滤器进入HPLC小瓶中。将样品贮存在4℃直到分析。用于测定乙醇和寡糖浓度的系统是与RI检测器偶联的AgilentTM100HPLC系统。分离柱为BioRadTMAminexHPX-87H离子排阻柱(300mmx7.8mm)。另外,分析样品中溶解的阿魏酰阿拉伯木聚糖(SFA)作为玉米中木聚糖水解的指示。使用TecanSafireV2.2008/02读板器使用XFLUOR4BETA版本:E4.22d完成分析。为了制备用于分析的样品,将0.45μm过滤的上清液的一部分在去离子水中稀释八倍。将200μl的所得溶液转移至UV兼容的96孔微量滴定板中并测量A320;包含200μl去离子水的若干个孔用于空白。结果通过将半纤维素酶添加至热稳定的GA、热稳定的蛋白酶和液化中的配制的产品中,最终的乙醇和乙醇的百分比增加总结于以下表27中。含有半纤维素酶的处理全部显示与没有半纤维素酶的相同处理相比乙醇产量增加至少1%。当将半纤维素酶添加至液化中时,仅用AA和AA+蛋白酶+GA处理的乙醇产量分别为2.0%和2.1%。使用Dunnett's测试完成统计分析用于均值比较(使用统计程序为SASJMP)。通过在各种活性和液化中的配制产品的之上添加半纤维素酶而增加的SFA和SFA百分比总结于以下表27中。在所有情况下,在不使用半纤维素酶的同样处理下,液化中的热稳定半纤维素酶增加上清液中的SFA。*校正八倍稀释值减去空白的值。实例22研磨粒度和在液化中添加热稳定性木聚糖酶的影响-对乙醇产量的影响通过100g小规模液化评价所有处理。将从工业玉米乙醇厂获得的玉米粉用于实验。为了获得“土耳其式研磨(Turkishground)”玉米,使用CoffeeMill将工业玉米粉在实验室中研磨。对工业玉米粉和土耳其式研磨玉米粉进行筛分分析。为了进行筛分分析,将30g玉米粉样品称重并放入AdvantechSonicSifter中。使用筛选/脉冲设置在8的幅度运行筛分器2分钟。表28显示了玉米粉的研磨粒度分布。由Mettler-ToledoHB43卤素水分天平测定工业研磨玉米的干固体(DS)为86.48%,土耳其式研磨玉米为86.58%。三种液化处理中的每一种都在Lab-O-Mat(总计九个罐)中一式三份地运行。将玉米和自来水添加到每个罐中,使得每种玉米浆料具有32%的DS。用于每种处理的罐中添加的玉米粉类型、玉米重量和自来水重量如表29所示。使用40%H2SO4将每种玉米浆料的pH调节至5.0。如表29所示,给每个罐加入适量的稀释的酶。玉米、自来水和稀释酶的总重量等于100克。使用α-淀粉酶(AA369)和嗜热网团菌GH11木聚糖酶(来自表20的Dt木聚糖酶)。然后用盖子密封罐,并装入Lab-O-Mat。在恒定旋转的情况下在80℃发生液化两小时。液化完成后,将罐从Lab-O-Mat中取下并放在冰上以快速冷却。然后将冷却的玉米醪从罐中取出放入烧杯中,并准备用于同时糖化和发酵(SSF)。对每个罐运行五个SSF重复,因此每个液化处理提供15个总SSF重复。向所有SSF玉米醪中添加3ppm的青霉素和1000ppm的尿素。将大约5g每种玉米醪(以上液化)添加至15ml聚丙烯管中。通过钻1/32英寸(1.5mm)孔制备管,然后在添加玉米醪之前称重空管。在添加醪液后再次称重管以确定每管中醪液的精确重量。用0.6AGU/gDS的SPIRIZYMEEXCELXHS加入每个管。实际酶剂量是基于每个管中玉米醪的准确重量。在酶剂量之后,将100μl的ETHANOLREDTM酵母增殖物添加至每个管中,然后将管在32℃水浴中孵育54小时。在发酵结束时取样用于HPLC分析。HPLC制备由以下组成:通过添加50μl的40%H2SO4来终止反应、离心,并且通过0.45μm过滤器过滤。将样品在4℃储存直至分析。使用与RI检测器偶联的AgilentTM1100HPLC系统来测定乙醇和低聚糖的浓度。该分离柱是来自BioRadTM的aminexHPX-87H离子排阻柱(300mmX7.8mm)。结果:来自每种处理的乙醇产量总结于下表30中。当添加到两种玉米粉中时,Dt木聚糖酶提供了乙醇的提高。Dt木聚糖酶与工业玉米粉组合的乙醇产量增加表明Dt木聚糖酶能够分解玉米纤维并因此帮助释放纤维结合淀粉。Dt木聚糖酶与土耳其式研磨工业玉米粉相结合,可提供最高的乙醇性能,表明当纤维结合淀粉释放和玉米粉进一步机械研磨时,表现出最佳性能。序列表<110>诺维信公司(NovozymesA/S)Kang,ZhengfangKrogh,KristianBertelRxmerMxrkebergStrahler,ChristieHuffman,Ron<120>用于生产发酵产物的方法<130>13053-WO-PCT<160>38<170>PatentIn版本3.5<210>1<211>515<212>PRT<213>嗜热脂肪芽孢杆菌<220><221>成熟多肽<222>(1)..(515)<400>1AlaAlaProPheAsnGlyThrMetMetGlnTyrPheGluTrpTyrLeu151015ProAspAspGlyThrLeuTrpThrLysValAlaAsnGluAlaAsnAsn202530LeuSerSerLeuGlyIleThrAlaLeuTrpLeuProProAlaTyrLys354045GlyThrSerArgSerAspValGlyTyrGlyValTyrAspLeuTyrAsp505560LeuGlyGluPheAsnGlnLysGlyThrValArgThrLysTyrGlyThr65707580LysAlaGlnTyrLeuGlnAlaIleGlnAlaAlaHisAlaAlaGlyMet859095GlnValTyrAlaAspValValPheAspHisLysGlyGlyAlaAspGly100105110ThrGluTrpValAspAlaValGluValAsnProSerAspArgAsnGln115120125GluIleSerGlyThrTyrGlnIleGlnAlaTrpThrLysPheAspPhe130135140ProGlyArgGlyAsnThrTyrSerSerPheLysTrpArgTrpTyrHis145150155160PheAspGlyValAspTrpAspGluSerArgLysLeuSerArgIleTyr165170175LysPheArgGlyIleGlyLysAlaTrpAspTrpGluValAspThrGlu180185190AsnGlyAsnTyrAspTyrLeuMetTyrAlaAspLeuAspMetAspHis195200205ProGluValValThrGluLeuLysAsnTrpGlyLysTrpTyrValAsn210215220ThrThrAsnIleAspGlyPheArgLeuAspAlaValLysHisIleLys225230235240PheSerPhePheProAspTrpLeuSerTyrValArgSerGlnThrGly245250255LysProLeuPheThrValGlyGluTyrTrpSerTyrAspIleAsnLys260265270LeuHisAsnTyrIleThrLysThrAsnGlyThrMetSerLeuPheAsp275280285AlaProLeuHisAsnLysPheTyrThrAlaSerLysSerGlyGlyAla290295300PheAspMetArgThrLeuMetThrAsnThrLeuMetLysAspGlnPro305310315320ThrLeuAlaValThrPheValAspAsnHisAspThrGluProGlyGln325330335AlaLeuGlnSerTrpValAspProTrpPheLysProLeuAlaTyrAla340345350PheIleLeuThrArgGlnGluGlyTyrProCysValPheTyrGlyAsp355360365TyrTyrGlyIleProGlnTyrAsnIleProSerLeuLysSerLysIle370375380AspProLeuLeuIleAlaArgArgAspTyrAlaTyrGlyThrGlnHis385390395400AspTyrLeuAspHisSerAspIleIleGlyTrpThrArgGluGlyVal405410415ThrGluLysProGlySerGlyLeuAlaAlaLeuIleThrAspGlyPro420425430GlyGlySerLysTrpMetTyrValGlyLysGlnHisAlaGlyLysVal435440445PheTyrAspLeuThrGlyAsnArgSerAspThrValThrIleAsnSer450455460AspGlyTrpGlyGluPheLysValAsnGlyGlySerValSerValTrp465470475480ValProArgLysThrThrValSerThrIleAlaArgProIleThrThr485490495ArgProTrpThrGlyGluPheValArgTrpThrGluProArgLeuVal500505510AlaTrpPro515<210>2<211>177<212>PRT<213>橙色嗜热子囊菌<220><221>成熟多肽<222>(1)..(177)<400>2ThrArgIleSerSerCysSerGlySerArgGlnSerAlaLeuThrThr151015AlaLeuArgAsnAlaAlaSerLeuAlaAsnAlaAlaAlaAspAlaAla202530GlnSerGlySerAlaSerLysPheSerGluTyrPheLysThrThrSer354045SerSerThrArgGlnThrValAlaAlaArgLeuArgAlaValAlaArg505560GluAlaSerSerSerSerSerGlyAlaThrThrTyrTyrCysAspAsp65707580ProTyrGlyTyrCysSerSerAsnValLeuAlaTyrThrLeuProSer859095TyrAsnIleIleAlaAsnCysAspIlePheTyrThrTyrLeuProAla100105110LeuThrSerThrCysHisAlaGlnAspGlnAlaThrThrAlaLeuHis115120125GluPheThrHisAlaProGlyValTyrSerProGlyThrAspAspLeu130135140AlaTyrGlyTyrGlnAlaAlaMetGlyLeuSerSerSerGlnAlaVal145150155160MetAsnAlaAspThrTyrAlaLeuTyrAlaAsnAlaIleTyrLeuGly165170175Cys<210>3<211>356<212>PRT<213>嗜热网团菌<220><221>信号<222>(1)..(27)<400>3MetLysLysProLeuGlyLysIleValAlaSerThrAlaLeuLeuIle151015SerValAlaPheSerSerSerIleAlaSerAlaLysGluGluAlaLys202530GlyMetGluIleProSerLeuLysGluValTyrLysAspTyrPheThr354045IleGlyAlaAlaValSerHisLeuAsnIleTyrHisTyrGluAsnLeu505560LeuLysLysHisPheAsnSerLeuThrProGluAsnGlnMetLysTrp65707580GluValIleHisProLysProTyrValTyrAspPheGlyProAlaAsp859095GluIleValAspPheAlaMetLysAsnGlyMetLysValArgGlyHis100105110ThrLeuValTrpHisAsnGlnThrProGlyTrpValTyrAlaGlyThr115120125LysAspGluIleLeuAlaArgLeuLysGluHisIleLysGluValVal130135140GlyHisTyrLysGlyLysValTyrAlaTrpAspValValAsnGluAla145150155160LeuSerAspAsnProAsnGluPheLeuArgArgAlaProTrpTyrAsp165170175IleCysGlyGluGluValIleGluLysAlaPheIleTrpAlaHisGlu180185190ValAspProAspAlaLysLeuPheTyrAsnAspTyrAsnLeuGluAsp195200205ProIleLysArgGluLysAlaTyrLysLeuValLysLysLeuLysAsp210215220LysGlyValProIleHisGlyIleGlyIleGlnGlyHisTrpThrLeu225230235240AlaTrpProThrProLysMetLeuGluAspSerIleLysArgPheAla245250255GluLeuGlyValGluValGlnValThrGluPheAspIleSerIleTyr260265270TyrAspArgAsnGluAsnAsnAsnPheLysValProProGluAspArg275280285LeuGluArgGlnAlaGlnLeuTyrLysGluAlaPheGluIleLeuArg290295300LysTyrLysGlyIleValThrGlyValThrPheTrpGlyValAlaAsp305310315320AspTyrThrTrpLeuTyrPheTrpProValArgGlyArgGluAspTyr325330335ProLeuLeuPheAspLysAsnHisAsnProLysLysAlaPheTrpGlu340345350IleValLysPhe355<210>4<211>383<212>PRT<213>Rasamsoniabyssochlamydoides<220><221>成熟多肽<222>(1)..(383)<400>4AspGlyLeuAsnThrAlaAlaLysAlaIleGlyLysLeuTyrPheGly151015ThrAlaThrAspAsnProGluLeuSerAspValAlaTyrGluThrGln202530LeuAsnAsnThrGlnAspPheGlyGlnIleThrProAlaAsnSerMet354045LysTrpAspAlaThrGluProGluGlnAsnThrPheThrPheAlaAla505560GlyAspGlnIleAlaAspLeuAlaGluAlaAsnGlyGlnIleLeuArg65707580CysHisAsnLeuValTrpTyrAsnGlnLeuProSerTrpValThrSer859095GlySerTrpThrAsnGluThrLeuLeuAlaAlaMetLysAsnHisIle100105110ThrAsnValValThrHisTyrLysGlyArgCysTyrAlaTrpAspVal115120125ValAsnGluAlaLeuAsnAspAspGlyThrTyrArgAspAsnValPhe130135140TyrGlnTyrIleGlyGluAlaTyrIleProIleAlaPheGluThrAla145150155160AlaAlaAlaAspProAsnValLysLeuTyrTyrAsnAspTyrAsnIle165170175GluTyrAlaGlyValLysAlaThrAlaAlaGlnAsnIleValLysLeu180185190ValGlnSerTyrGlyAlaArgIleAspGlyValGlyLeuGlnSerHis195200205PheIleValGlyGluThrProSerThrSerThrGlnAlaSerAsnMet210215220AlaSerPheThrAlaLeuGlyValGluValAlaIleThrGluLeuAsp225230235240IleArgMetGlnLeuProGluThrThrAlaLeuLeuThrGlnGlnSer245250255ThrAspTyrGlnSerThrValGlnAlaCysValAsnThrProGlyCys260265270ValGlyIleThrLeuTrpAspTrpThrAspLysTyrSerTrpValPro275280285SerThrPheSerGlyTyrGlyAspAlaCysProTrpAspAspAsnTyr290295300GlnLysLysProAlaTyrTyrGlyIleLeuThrAlaLeuGlyGlySer305310315320AlaSerThrThrThrValGlyThrGlyThrThrThrThrSerThrAla325330335ThrThrSerSerThrGlySerSerGlyThrGlyValAlaGlnHisTrp340345350GlyGlnCysGlyGlyIleGlyTrpThrGlyProThrValCysAlaSer355360365GlyTyrThrCysThrValValAsnProTyrTyrSerGlnCysLeu370375380<210>5<211>385<212>PRT<213>雷塞氏篮状菌<220><221>成熟多肽<222>(1)..(385)<400>5AlaGlyLeuAsnThrAlaAlaLysAlaIleGlyLysLeuTyrPheGly151015ThrAlaThrAspAsnProGluLeuSerAspSerThrTyrMetGlnGlu202530ThrAspAsnThrAspAspPheGlyGlnLeuThrProAlaAsnSerMet354045LysTrpAspAlaThrGluProSerGlnAsnThrPheThrPheThrAsn505560GlyAspGlnIleAlaAsnLeuAlaLysSerAsnGlyGlnMetLeuArg65707580CysHisAsnLeuValTrpTyrAsnGlnLeuProSerTrpValThrSer859095GlySerTrpThrAsnAlaThrLeuLeuAlaAlaMetLysAsnHisIle100105110ThrAsnValValThrHisTyrLysGlyGlnCysTyrAlaTrpAspVal115120125ValAsnGluAlaLeuAsnAspAspGlyThrTyrArgSerAsnValPhe130135140TyrGlnTyrIleGlyGluAlaTyrIleProIleAlaPheAlaThrAla145150155160AlaAlaAlaAspProAsnAlaLysLeuTyrTyrAsnAspTyrAsnIle165170175GluTyrProGlyAlaLysAlaThrAlaAlaGlnAsnIleValLysMet180185190ValLysAlaTyrGlyAlaLysIleAspGlyValGlyLeuGlnSerHis195200205PheIleValGlySerThrProSerGlnSerSerGlnGlnSerAsnMet210215220AlaAlaPheThrAlaLeuGlyValGluValAlaIleThrGluLeuAsp225230235240IleArgMetThrLeuProSerThrSerAlaLeuLeuAlaGlnGlnSer245250255ThrAspTyrGlnSerThrValSerAlaCysValAsnThrProLysCys260265270IleGlyIleThrLeuTrpAspTrpThrAspLysTyrSerTrpValPro275280285AsnThrPheSerGlyGlnGlyAspAlaCysProTrpAspSerAsnTyr290295300GlnLysLysProAlaTyrTyrGlyIleLeuThrAlaLeuGlyGlySer305310315320AlaSerThrSerThrThrThrThrLeuValThrSerThrArgThrSer325330335ThrThrThrSerThrSerAlaThrSerThrSerThrGlyValAlaGln340345350HisTrpGlyGlnCysGlyGlyIleGlyTrpThrGlyProThrThrCys355360365AlaSerProTyrThrCysGlnGluLeuAsnProTyrTyrTyrGlnCys370375380Leu385<210>6<211>775<212>PRT<213>埃默森篮状菌<220><221>成熟多肽<222>(1)..(775)<400>6GlnAspAsnGlnThrTyrAlaAsnTyrSerSerGlnSerGlnProAsp151015LeuPheProArgThrValAlaThrIleAspLeuSerPheProAspCys202530GluAsnGlyProLeuSerThrAsnLeuValCysAsnLysSerAlaAsp354045ProTrpAlaArgAlaGluAlaLeuIleSerLeuPheThrLeuGluGlu505560LeuIleAsnAsnThrGlnAsnThrAlaProGlyValProArgLeuGly65707580LeuProGlnTyrGlnValTrpAsnGluAlaLeuHisGlyLeuAspArg859095AlaAsnPheSerHisSerGlyGluTyrSerTrpAlaThrSerPhePro100105110MetProIleLeuSerMetAlaSerPheAsnArgThrLeuIleAsnGln115120125IleAlaSerIleIleAlaThrGlnAlaArgAlaPheAsnAsnAlaGly130135140ArgTyrGlyLeuAspSerTyrAlaProAsnIleAsnGlyPheArgSer145150155160ProLeuTrpGlyArgGlyGlnGluThrProGlyGluAspAlaPhePhe165170175LeuSerSerThrTyrAlaTyrGluTyrIleThrGlyLeuGlnGlyGly180185190ValAspProGluHisValLysIleValAlaThrAlaLysHisPheAla195200205GlyTyrAspLeuGluAsnTrpGlyAsnValSerArgLeuGlyPheAsn210215220AlaIleIleThrGlnGlnAspLeuSerGluTyrTyrThrProGlnPhe225230235240LeuAlaSerAlaArgTyrAlaLysThrArgSerIleMetCysSerTyr245250255AsnAlaValAsnGlyValProSerCysAlaAsnSerPhePheLeuGln260265270ThrLeuLeuArgGluAsnPheAspPheValAspAspGlyTyrValSer275280285SerAspCysAspAlaValTyrAsnValPheAsnProHisGlyTyrAla290295300LeuAsnGlnSerGlyAlaAlaAlaAspSerLeuLeuAlaGlyThrAsp305310315320IleAspCysGlyGlnThrLeuProTrpHisLeuAsnGluSerPheVal325330335GluGlyTyrValSerArgGlyAspIleGluLysSerLeuThrArgLeu340345350TyrSerAsnLeuValArgLeuGlyTyrPheAspGlyAsnAsnSerGlu355360365TyrArgAsnLeuAsnTrpAsnAspValValThrThrAspAlaTrpAsn370375380IleSerTyrGluAlaAlaValGluGlyIleThrLeuLeuLysAsnAsp385390395400GlyThrLeuProLeuSerLysLysValArgSerIleAlaLeuIleGly405410415ProTrpAlaAsnAlaThrValGlnMetGlnGlyAsnTyrTyrGlyThr420425430ProProTyrLeuIleSerProLeuGluAlaAlaLysAlaSerGlyPhe435440445ThrValAsnTyrAlaPheGlyThrAsnIleSerThrAspSerThrGln450455460TrpPheAlaGluAlaIleAlaAlaAlaLysLysSerAspValIleIle465470475480TyrAlaGlyGlyIleAspAsnThrIleGluAlaGluGlyGlnAspArg485490495ThrAspLeuLysTrpProGlyAsnGlnLeuAspLeuIleGluGlnLeu500505510SerGlnValGlyLysProLeuValValLeuGlnMetGlyGlyGlyGln515520525ValAspSerSerSerLeuLysAlaAsnLysAsnValAsnAlaLeuVal530535540TrpGlyGlyTyrProGlyGlnSerGlyGlyAlaAlaLeuPheAspIle545550555560LeuThrGlyLysArgAlaProAlaGlyArgLeuValSerThrGlnTyr565570575ProAlaGluTyrAlaThrGlnPheProAlaAsnAspMetAsnLeuArg580585590ProAsnGlySerAsnProGlyGlnThrTyrIleTrpTyrThrGlyThr595600605ProValTyrGluPheGlyHisGlyLeuPheTyrThrGluPheGlnGlu610615620SerAlaAlaAlaGlyThrAsnLysThrSerThrPheAspIleLeuAsp625630635640LeuPheSerThrProHisProGlyTyrGluTyrIleGluGlnValPro645650655PheIleAsnValThrValAspValLysAsnValGlyHisThrProSer660665670ProTyrThrGlyLeuLeuPheAlaAsnThrThrAlaGlyProLysPro675680685TyrProAsnLysTrpLeuValGlyPheAspTrpLeuProThrIleGln690695700ProGlyGluThrAlaLysLeuThrIleProValProLeuGlyAlaIle705710715720AlaTrpAlaAspGluAsnGlyAsnLysValValPheProGlyAsnTyr725730735GluLeuAlaLeuAsnAsnGluArgSerValValValSerPheThrLeu740745750ThrGlyAspAlaAlaThrLeuGluLysTrpProLeuTrpGluGlnAla755760765ValProGlyValLeuGlnGln770775<210>7<211>282<212>PRT<213>里氏木霉<220><221>成熟多肽<222>(1)..(282)<400>7SerProValAspGlyGluThrValValLysArgGlnCysProAlaIle151015HisValPheGlyAlaArgGluThrThrValSerGlnGlyTyrGlySer202530SerAlaThrValValAsnLeuValIleGlnAlaHisProGlyThrThr354045SerGluAlaIleValTyrProAlaCysGlyGlyGlnAlaSerCysGly505560GlyIleSerTyrAlaAsnSerValValAsnGlyThrAsnAlaAlaAla65707580AlaAlaIleAsnAsnPheHisAsnSerCysProAspThrGlnLeuVal859095LeuValGlyTyrSerGlnGlyAlaGlnIlePheAspAsnAlaLeuCys100105110GlyGlyGlyAspProGlyGluGlyIleThrAsnThrAlaValProLeu115120125ThrAlaGlyAlaValSerAlaValLysAlaAlaIlePheMetGlyAsp130135140ProArgAsnIleHisGlyLeuProTyrAsnValGlyThrCysThrThr145150155160GlnGlyPheAspAlaArgProAlaGlyPheValCysProSerAlaSer165170175LysIleLysSerTyrCysAspAlaAlaAspProTyrCysCysThrGly180185190AsnAspProAsnValHisGlnGlyTyrGlyGlnGluTyrGlyGlnGln195200205AlaLeuAlaPheIleAsnSerGlnLeuSerSerGlyGlySerGlnPro210215220ProGlyGlyGlyProThrSerThrSerArgProThrSerThrArgThr225230235240GlySerSerProGlyProThrGlnThrHisTrpGlyGlnCysGlyGly245250255GlnGlyTrpThrGlyProThrGlnCysGluSerGlyThrThrCysGln260265270ValIleSerGlnTrpTyrSerGlnCysLeu275280<210>8<211>378<212>PRT<213>烟曲霉<220><221>成熟多肽<222>(1)..(378)<400>8AlaGlyLeuAsnThrAlaAlaLysAlaLysGlyLeuLysTyrPheGly151015SerAlaThrAspAsnProGluLeuThrAspSerAlaTyrValAlaGln202530LeuSerAsnThrAspAspPheGlyGlnIleThrProGlyAsnSerMet354045LysTrpAspAlaThrGluProSerGlnAsnSerPheSerPheAlaAsn505560GlyAspAlaValValAsnLeuAlaAsnLysAsnGlyGlnLeuMetArg65707580CysHisThrLeuValTrpHisSerGlnLeuProAsnTrpValSerSer859095GlySerTrpThrAsnAlaThrLeuLeuAlaAlaMetLysAsnHisIle100105110ThrAsnValValThrHisTyrLysGlyLysCysTyrAlaTrpAspVal115120125ValAsnGluAlaLeuAsnGluAspGlyThrPheArgAsnSerValPhe130135140TyrGlnIleIleGlyProAlaTyrIleProIleAlaPheAlaThrAla145150155160AlaAlaAlaAspProAspValLysLeuTyrTyrAsnAspTyrAsnIle165170175GluTyrSerGlyAlaLysAlaThrAlaAlaGlnAsnIleValLysMet180185190IleLysAlaTyrGlyAlaLysIleAspGlyValGlyLeuGlnAlaHis195200205PheIleValGlySerThrProSerGlnSerAspLeuThrThrValLeu210215220LysGlyTyrThrAlaLeuGlyValGluValAlaTyrThrGluLeuAsp225230235240IleArgMetGlnLeuProSerThrAlaAlaLysLeuAlaGlnGlnSer245250255ThrAspPheGlnGlyValAlaAlaAlaCysValSerThrThrGlyCys260265270ValGlyValThrIleTrpAspTrpThrAspLysTyrSerTrpValPro275280285SerValPheGlnGlyTyrGlyAlaProLeuProTrpAspGluAsnTyr290295300ValLysLysProAlaTyrAspGlyLeuMetAlaGlyLeuGlyAlaSer305310315320GlySerGlyThrThrThrThrThrThrThrThrSerThrThrThrGly325330335GlyThrAspProThrGlyValAlaGlnLysTrpGlyGlnCysGlyGly340345350IleGlyTrpThrGlyProThrThrCysValSerGlyThrThrCysGln355360365LysLeuAsnAspTrpTyrSerGlnCysLeu370375<210>9<211>409<212>PRT<213>雷塞氏篮状菌<220><221>信号<222>(1)..(18)<220><221>成熟多肽<222>(19)..(409)<400>9MetLysPheSerAsnValIleLeuAlaAlaSerAlaSerSerLeuVal-15-10-5LeuAlaAlaProLysSerLysThrLysArgThrSerAlaPheGlnTrp-11510PheGlyAlaAsnGluSerGlyAlaGluPheGlyAsnGlnAsnIlePro15202530GlyThrLeuGlyThrAspTyrThrTrpProAspThrSerThrIleGln354045ThrLeuArgAsnAlaGlyMetAsnIlePheArgValProPheLeuMet505560GluArgLeuValProAsnGlnMetThrGlySerProAspProThrTyr657075LeuAlaAspLeuLysSerThrValAsnPheIleThrGlyThrGlyAla808590TyrAlaValValAspProHisAsnTyrGlyArgTyrTyrAsnAsnIle95100105110IleThrSerThrSerAspPheAlaAlaPheTrpThrThrValAlaSer115120125GlnPheAlaSerAsnProArgValIlePheAspThrAsnAsnGluTyr130135140AsnAsnMetAspGlnThrLeuValLeuAsnLeuAsnGlnAlaAlaIle145150155AsnAlaIleArgAlaAlaGlyAlaThrSerGlnTyrIlePheAlaGlu160165170GlyAsnSerTrpThrGlyAlaTrpThrTrpThrSerValAsnAspAsn175180185190MetLysGlnLeuThrAspProSerAsnLysLeuValTyrGluMetHis195200205GlnTyrLeuAspSerAspGlySerGlyThrSerAspGlnCysValAsn210215220SerThrIleGlyTyrAspArgIleValSerAlaThrGlnTrpLeuGln225230235AlaAsnGlyLysValAlaPheLeuGlyGluPheAlaGlyGlySerAsn240245250SerValCysGluAlaAlaValThrGlyMetLeuAspTyrMetGluGln255260265270AsnSerAspValTrpLeuGlyAlaGluTrpTrpAlaAlaGlyProTrp275280285TrpGlyAsnTyrIleTyrSerMetGluProProSerGlyIleAlaTyr290295300GlnAsnTyrLeuSerIleLeuGluProTyrPheProGlyGlySerTyr305310315SerGlyGlyThrGlySerGlySerGlySerThrThrThrThrAlaThr320325330ThrThrThrThrLysValProProThrSerThrThrSerSerAlaSer335340345350SerThrGlyThrGlyValAlaGlnHisTrpGlyGlnCysGlyGlyGln355360365GlyTrpThrGlyProThrThrCysValSerProTyrThrCysGlnGlu370375380LeuAsnProTyrTyrTyrGlnCysLeu385390<210>10<211>4014<212>DNA<213>热水高温球菌<220><221>CDS<222>(1)..(4011)<220><221>未知的信号<222>(1)..(81)<220><221>成熟多肽<222>(82)..(4014)<400>10atgaggcgggtggttgccctcttcattgcaattttgatgcttggaagc48MetArgArgValValAlaLeuPheIleAlaIleLeuMetLeuGlySer-25-20-15atcgttggagcgaacgttaagagcgttggcgcggcggagccgaagccg96IleValGlyAlaAsnValLysSerValGlyAlaAlaGluProLysPro-10-5-11ctcaacgtcataatagtctggcaccagcaccagccctactactacgac144LeuAsnValIleIleValTrpHisGlnHisGlnProTyrTyrTyrAsp101520cctgtccaggacgtctacaccaggccctgggtcaggctccacgcggcg192ProValGlnAspValTyrThrArgProTrpValArgLeuHisAlaAla253035aacaactactggaagatggcccactacctgagccagtacccggaggtt240AsnAsnTyrTrpLysMetAlaHisTyrLeuSerGlnTyrProGluVal404550cacgccaccattgacctctcgggttcgctgatagcccagcttgccgac288HisAlaThrIleAspLeuSerGlySerLeuIleAlaGlnLeuAlaAsp556065tacatgaacggcaagaaggacacctaccagataatcaccgagaagata336TyrMetAsnGlyLysLysAspThrTyrGlnIleIleThrGluLysIle70758085gccaacggggaacccctcaccgtcgacgagaagtggttcatgctccag384AlaAsnGlyGluProLeuThrValAspGluLysTrpPheMetLeuGln9095100gcaccgggagggttcttcgacaacaccatcccctggaacggtgaaccg432AlaProGlyGlyPhePheAspAsnThrIleProTrpAsnGlyGluPro105110115ataaccgaccccaacggcaacccgataagggacttctgggaccgctac480IleThrAspProAsnGlyAsnProIleArgAspPheTrpAspArgTyr120125130acggagctgaagaacaagatgctcagcgcaaaggccaagtacgcaaac528ThrGluLeuLysAsnLysMetLeuSerAlaLysAlaLysTyrAlaAsn135140145ttcgtgactgagagccagaaggtcgctgtgacgaacgagttcacagag576PheValThrGluSerGlnLysValAlaValThrAsnGluPheThrGlu150155160165caggactacatagacctagcggttctcttcaatctcgcttggattgac624GlnAspTyrIleAspLeuAlaValLeuPheAsnLeuAlaTrpIleAsp170175180tacaattacatcacgagcacgccggagttcaaggccctctacgacaag672TyrAsnTyrIleThrSerThrProGluPheLysAlaLeuTyrAspLys185190195gttgacgagggcggctatacaagggcggacgtcaaaaccgttctcgac720ValAspGluGlyGlyTyrThrArgAlaAspValLysThrValLeuAsp200205210gcccagatctggcttctcaaccacaccttcgaggagcacgagaagata768AlaGlnIleTrpLeuLeuAsnHisThrPheGluGluHisGluLysIle215220225aacctcctcctcggaaacggcaacgtcgaggtcacggtcgttccctac816AsnLeuLeuLeuGlyAsnGlyAsnValGluValThrValValProTyr230235240245gcccacccgataggcccgatactcaacgacttcggctgggacagcgac864AlaHisProIleGlyProIleLeuAsnAspPheGlyTrpAspSerAsp250255260ttcaacgaccaggtcaagaaggccgacgaactgtacaagccgtacctc912PheAsnAspGlnValLysLysAlaAspGluLeuTyrLysProTyrLeu265270275ggcggcggcaccgcggttccaaaaggcggatgggcggctgagagcgcc960GlyGlyGlyThrAlaValProLysGlyGlyTrpAlaAlaGluSerAla280285290ctcaacgacaaaactctggagatcctcgccgagaacggctgggagtgg1008LeuAsnAspLysThrLeuGluIleLeuAlaGluAsnGlyTrpGluTrp295300305gtcatgaccgaccagatggttctcggaaagctcggcattgagggaacc1056ValMetThrAspGlnMetValLeuGlyLysLeuGlyIleGluGlyThr310315320325gtcgagaactaccacaagccctgggtggccgagttcaacggaaagaag1104ValGluAsnTyrHisLysProTrpValAlaGluPheAsnGlyLysLys330335340atatacctcttcccaagaaatcacgatctaagtgacagagttggcttt1152IleTyrLeuPheProArgAsnHisAspLeuSerAspArgValGlyPhe345350355acctacagcggaatgaaccagcagcaggccgttgaggacttcgtcaac1200ThrTyrSerGlyMetAsnGlnGlnGlnAlaValGluAspPheValAsn360365370gagctcctcaagctccagaagcagaactacgatggctcgctggtttac1248GluLeuLeuLysLeuGlnLysGlnAsnTyrAspGlySerLeuValTyr375380385gtggtcacgctcgacggcgagaaccccgtggagaactacccctacgac1296ValValThrLeuAspGlyGluAsnProValGluAsnTyrProTyrAsp390395400405ggggagctcttcctcaccgaactctacaagaagctgaccgaactccag1344GlyGluLeuPheLeuThrGluLeuTyrLysLysLeuThrGluLeuGln410415420gagcagggtctcataagaaccctcaccccgagcgagtacatccagctc1392GluGlnGlyLeuIleArgThrLeuThrProSerGluTyrIleGlnLeu425430435tacggcgacaaggccaacaagctcacacctcggatgatggagcgcctt1440TyrGlyAspLysAlaAsnLysLeuThrProArgMetMetGluArgLeu440445450gacctcaccggagacaacgttaacgccctcctcaaggcccagagcctc1488AspLeuThrGlyAspAsnValAsnAlaLeuLeuLysAlaGlnSerLeu455460465ggcgaactctacgacatgaccggcgttaaggaggagatgcagtggccc1536GlyGluLeuTyrAspMetThrGlyValLysGluGluMetGlnTrpPro470475480485gagagcagctggatagacggaaccctctccacgtggataggcgagccc1584GluSerSerTrpIleAspGlyThrLeuSerThrTrpIleGlyGluPro490495500caggagaactacggctggtactggctctacatggccaggaaggccctt1632GlnGluAsnTyrGlyTrpTyrTrpLeuTyrMetAlaArgLysAlaLeu505510515atggagaacaaggataaaatgagccaggcggactgggagaaggcctac1680MetGluAsnLysAspLysMetSerGlnAlaAspTrpGluLysAlaTyr520525530gagtacctgctccgcgccgaggcaagcgactggttctggtggtacgga1728GluTyrLeuLeuArgAlaGluAlaSerAspTrpPheTrpTrpTyrGly535540545agcgaccaggacagcggccaggactacaccttcgaccgctacctgaag1776SerAspGlnAspSerGlyGlnAspTyrThrPheAspArgTyrLeuLys550555560565acctacctctacgagatgtacaagctggcaggagtcgagccgccgagc1824ThrTyrLeuTyrGluMetTyrLysLeuAlaGlyValGluProProSer570575580tacctcttcggcaactacttcccggacggagagccctacaccacgagg1872TyrLeuPheGlyAsnTyrPheProAspGlyGluProTyrThrThrArg585590595ggcctggtcggactcaaggacggcgagatgaagaacttctccagcatg1920GlyLeuValGlyLeuLysAspGlyGluMetLysAsnPheSerSerMet600605610tccccgctggcaaagggcgtgagcgtctatttcgacggcgaggggata1968SerProLeuAlaLysGlyValSerValTyrPheAspGlyGluGlyIle615620625cacttcatagtgaaagggaacctggacaggttcgaggtgagcatctgg2016HisPheIleValLysGlyAsnLeuAspArgPheGluValSerIleTrp630635640645gagaaggatgagcgcgttggcaacacgttcacccgcctccaagagaag2064GluLysAspGluArgValGlyAsnThrPheThrArgLeuGlnGluLys650655660ccggacgagttgagctatttcatgttcccattctcaagggacagcgtt2112ProAspGluLeuSerTyrPheMetPheProPheSerArgAspSerVal665670675ggtctcctcataaccaagcacgtcgtgtacgagaacggaaaggccgag2160GlyLeuLeuIleThrLysHisValValTyrGluAsnGlyLysAlaGlu680685690atatacggcgccaccgactacgagaagagcgagaagcttggggaagcc2208IleTyrGlyAlaThrAspTyrGluLysSerGluLysLeuGlyGluAla695700705accgtcaagaacacgagcgaaggaatcgaagtcgtccttccctttgac2256ThrValLysAsnThrSerGluGlyIleGluValValLeuProPheAsp710715720725tacatagaaaacccctccgacttctacttcgctgtctcgacggtcaaa2304TyrIleGluAsnProSerAspPheTyrPheAlaValSerThrValLys730735740gatggagaccttgaggtgataagcactcctgtggagctcaagctcccg2352AspGlyAspLeuGluValIleSerThrProValGluLeuLysLeuPro745750755accgaggtcaagggagtcgtcatagccgatataaccgacccagaaggc2400ThrGluValLysGlyValValIleAlaAspIleThrAspProGluGly760765770gacgaccatgggcccggaaactacacttatcccacggacaaggtcttc2448AspAspHisGlyProGlyAsnTyrThrTyrProThrAspLysValPhe775780785aagccaggtgttttcgacctcctccgcttcaggatgctcgaacagacg2496LysProGlyValPheAspLeuLeuArgPheArgMetLeuGluGlnThr790795800805gagagctacgtcatggagttctacttcaaggacctaggtggtaacccg2544GluSerTyrValMetGluPheTyrPheLysAspLeuGlyGlyAsnPro810815820tggaacggacccaacggcttcagcctccagataatcgaggtctacctc2592TrpAsnGlyProAsnGlyPheSerLeuGlnIleIleGluValTyrLeu825830835gacttcaaggacggtggaaacagttcggccattaagatgttccccgac2640AspPheLysAspGlyGlyAsnSerSerAlaIleLysMetPheProAsp840845850ggaccgggagccaacgtcaacctcgaccccgagcatccatgggacgtt2688GlyProGlyAlaAsnValAsnLeuAspProGluHisProTrpAspVal855860865gccttcaggatagcgggctgggactacggaaacctcatcatcctgccg2736AlaPheArgIleAlaGlyTrpAspTyrGlyAsnLeuIleIleLeuPro870875880885aacggaacggccatccagggcgagatgcagatttccgcagatccggtt2784AsnGlyThrAlaIleGlnGlyGluMetGlnIleSerAlaAspProVal890895900aagaacgccataatagtcaaggttccaaagaagtacatcgccataaac2832LysAsnAlaIleIleValLysValProLysLysTyrIleAlaIleAsn905910915gaggactacggcctctggggagacgtcctcgtcggctcgcaggacggc2880GluAspTyrGlyLeuTrpGlyAspValLeuValGlySerGlnAspGly920925930tacggcccggacaagtggagaacggcggcagtggatgcggagcagtgg2928TyrGlyProAspLysTrpArgThrAlaAlaValAspAlaGluGlnTrp935940945aagcttggaggtgcggacccgcaggcagtcataaacggcgtggccccg2976LysLeuGlyGlyAlaAspProGlnAlaValIleAsnGlyValAlaPro950955960965cgcgtcattgatgagctggttccgcagggctttgaaccgacccaggag3024ArgValIleAspGluLeuValProGlnGlyPheGluProThrGlnGlu970975980gagcagctgagcagctacgatgcaaacgacatgaagctcgccactgtc3072GluGlnLeuSerSerTyrAspAlaAsnAspMetLysLeuAlaThrVal985990995aaggcgctgctactcctcaagcagggcatcgttgtgaccgacccg3117LysAlaLeuLeuLeuLeuLysGlnGlyIleValValThrAspPro100010051010gagggagacgaccacgggccgggaacgtacacctatccgacggac3162GluGlyAspAspHisGlyProGlyThrTyrThrTyrProThrAsp101510201025aaagttttcaagcccggtgttttcgacctcctcaagttcaaggtg3207LysValPheLysProGlyValPheAspLeuLeuLysPheLysVal103010351040accgagggaagcgacgactggacgctggagttccacttcaaagac3252ThrGluGlySerAspAspTrpThrLeuGluPheHisPheLysAsp104510501055ctcggtggaaacccgtggaacgggccgaacggcttcagcctgcag3297LeuGlyGlyAsnProTrpAsnGlyProAsnGlyPheSerLeuGln106010651070ataatcgaggtatacttcgacttcaaggagggcgggaacgtctcg3342IleIleGluValTyrPheAspPheLysGluGlyGlyAsnValSer107510801085gccattaagatgttcccggatgggcccggaagcaacgtccgtctt3387AlaIleLysMetPheProAspGlyProGlySerAsnValArgLeu109010951100gatccaaatcacccatgggacctggcgcttaggatagccggctgg3432AspProAsnHisProTrpAspLeuAlaLeuArgIleAlaGlyTrp110511101115gactacggaaacctgataattctgcccgacggaaccgcctaccaa3477AspTyrGlyAsnLeuIleIleLeuProAspGlyThrAlaTyrGln112011251130ggcgagatgcagatttccgcagatccggttaagaacgccataata3522GlyGluMetGlnIleSerAlaAspProValLysAsnAlaIleIle113511401145gtcaaggttccaaagaagtacctgaacatatccgactacggactc3567ValLysValProLysLysTyrLeuAsnIleSerAspTyrGlyLeu115011551160tacaccgccgtcatcgtgggttcccaagacgggtacggcccggac3612TyrThrAlaValIleValGlySerGlnAspGlyTyrGlyProAsp116511701175aagtggaggcccgtggccgctgaggccgagcagtggaagctcgga3657LysTrpArgProValAlaAlaGluAlaGluGlnTrpLysLeuGly118011851190ggcgcagacccccaggcggtcatagacaacctcgtaccaagggtc3702GlyAlaAspProGlnAlaValIleAspAsnLeuValProArgVal119512001205gttgatgaactcgtgccggagggcttcaagccaacgcaggaggag3747ValAspGluLeuValProGluGlyPheLysProThrGlnGluGlu121012151220cagctgagcagctacgaccttgagaagaagaccctggcgacggtg3792GlnLeuSerSerTyrAspLeuGluLysLysThrLeuAlaThrVal122512301235ctcatggtaccgctcgtcaatgggactggcggcgaggaaccaacg3837LeuMetValProLeuValAsnGlyThrGlyGlyGluGluProThr124012451250ccgacggagagcccaacggaaacgacgacaaccacacccagcgaa3882ProThrGluSerProThrGluThrThrThrThrThrProSerGlu125512601265acaaccaccacaacttcaacgaccaccggcccaagctcaacgacc3927ThrThrThrThrThrSerThrThrThrGlyProSerSerThrThr127012751280accagcacacccggcggaggaatctgcggcccaggcattatagcg3972ThrSerThrProGlyGlyGlyIleCysGlyProGlyIleIleAla128512901295ggcctggccctgataccgctcctcctcaagaggaggaactga4014GlyLeuAlaLeuIleProLeuLeuLeuLysArgArgAsn130013051310<210>11<211>1337<212>PRT<213>热水高温球菌<400>11MetArgArgValValAlaLeuPheIleAlaIleLeuMetLeuGlySer-25-20-15IleValGlyAlaAsnValLysSerValGlyAlaAlaGluProLysPro-10-5-115LeuAsnValIleIleValTrpHisGlnHisGlnProTyrTyrTyrAsp101520ProValGlnAspValTyrThrArgProTrpValArgLeuHisAlaAla253035AsnAsnTyrTrpLysMetAlaHisTyrLeuSerGlnTyrProGluVal404550HisAlaThrIleAspLeuSerGlySerLeuIleAlaGlnLeuAlaAsp556065TyrMetAsnGlyLysLysAspThrTyrGlnIleIleThrGluLysIle70758085AlaAsnGlyGluProLeuThrValAspGluLysTrpPheMetLeuGln9095100AlaProGlyGlyPhePheAspAsnThrIleProTrpAsnGlyGluPro105110115IleThrAspProAsnGlyAsnProIleArgAspPheTrpAspArgTyr120125130ThrGluLeuLysAsnLysMetLeuSerAlaLysAlaLysTyrAlaAsn135140145PheValThrGluSerGlnLysValAlaValThrAsnGluPheThrGlu150155160165GlnAspTyrIleAspLeuAlaValLeuPheAsnLeuAlaTrpIleAsp170175180TyrAsnTyrIleThrSerThrProGluPheLysAlaLeuTyrAspLys185190195ValAspGluGlyGlyTyrThrArgAlaAspValLysThrValLeuAsp200205210AlaGlnIleTrpLeuLeuAsnHisThrPheGluGluHisGluLysIle215220225AsnLeuLeuLeuGlyAsnGlyAsnValGluValThrValValProTyr230235240245AlaHisProIleGlyProIleLeuAsnAspPheGlyTrpAspSerAsp250255260PheAsnAspGlnValLysLysAlaAspGluLeuTyrLysProTyrLeu265270275GlyGlyGlyThrAlaValProLysGlyGlyTrpAlaAlaGluSerAla280285290LeuAsnAspLysThrLeuGluIleLeuAlaGluAsnGlyTrpGluTrp295300305ValMetThrAspGlnMetValLeuGlyLysLeuGlyIleGluGlyThr310315320325ValGluAsnTyrHisLysProTrpValAlaGluPheAsnGlyLysLys330335340IleTyrLeuPheProArgAsnHisAspLeuSerAspArgValGlyPhe345350355ThrTyrSerGlyMetAsnGlnGlnGlnAlaValGluAspPheValAsn360365370GluLeuLeuLysLeuGlnLysGlnAsnTyrAspGlySerLeuValTyr375380385ValValThrLeuAspGlyGluAsnProValGluAsnTyrProTyrAsp390395400405GlyGluLeuPheLeuThrGluLeuTyrLysLysLeuThrGluLeuGln410415420GluGlnGlyLeuIleArgThrLeuThrProSerGluTyrIleGlnLeu425430435TyrGlyAspLysAlaAsnLysLeuThrProArgMetMetGluArgLeu440445450AspLeuThrGlyAspAsnValAsnAlaLeuLeuLysAlaGlnSerLeu455460465GlyGluLeuTyrAspMetThrGlyValLysGluGluMetGlnTrpPro470475480485GluSerSerTrpIleAspGlyThrLeuSerThrTrpIleGlyGluPro490495500GlnGluAsnTyrGlyTrpTyrTrpLeuTyrMetAlaArgLysAlaLeu505510515MetGluAsnLysAspLysMetSerGlnAlaAspTrpGluLysAlaTyr520525530GluTyrLeuLeuArgAlaGluAlaSerAspTrpPheTrpTrpTyrGly535540545SerAspGlnAspSerGlyGlnAspTyrThrPheAspArgTyrLeuLys550555560565ThrTyrLeuTyrGluMetTyrLysLeuAlaGlyValGluProProSer570575580TyrLeuPheGlyAsnTyrPheProAspGlyGluProTyrThrThrArg585590595GlyLeuValGlyLeuLysAspGlyGluMetLysAsnPheSerSerMet600605610SerProLeuAlaLysGlyValSerValTyrPheAspGlyGluGlyIle615620625HisPheIleValLysGlyAsnLeuAspArgPheGluValSerIleTrp630635640645GluLysAspGluArgValGlyAsnThrPheThrArgLeuGlnGluLys650655660ProAspGluLeuSerTyrPheMetPheProPheSerArgAspSerVal665670675GlyLeuLeuIleThrLysHisValValTyrGluAsnGlyLysAlaGlu680685690IleTyrGlyAlaThrAspTyrGluLysSerGluLysLeuGlyGluAla695700705ThrValLysAsnThrSerGluGlyIleGluValValLeuProPheAsp710715720725TyrIleGluAsnProSerAspPheTyrPheAlaValSerThrValLys730735740AspGlyAspLeuGluValIleSerThrProValGluLeuLysLeuPro745750755ThrGluValLysGlyValValIleAlaAspIleThrAspProGluGly760765770AspAspHisGlyProGlyAsnTyrThrTyrProThrAspLysValPhe775780785LysProGlyValPheAspLeuLeuArgPheArgMetLeuGluGlnThr790795800805GluSerTyrValMetGluPheTyrPheLysAspLeuGlyGlyAsnPro810815820TrpAsnGlyProAsnGlyPheSerLeuGlnIleIleGluValTyrLeu825830835AspPheLysAspGlyGlyAsnSerSerAlaIleLysMetPheProAsp840845850GlyProGlyAlaAsnValAsnLeuAspProGluHisProTrpAspVal855860865AlaPheArgIleAlaGlyTrpAspTyrGlyAsnLeuIleIleLeuPro870875880885AsnGlyThrAlaIleGlnGlyGluMetGlnIleSerAlaAspProVal890895900LysAsnAlaIleIleValLysValProLysLysTyrIleAlaIleAsn905910915GluAspTyrGlyLeuTrpGlyAspValLeuValGlySerGlnAspGly920925930TyrGlyProAspLysTrpArgThrAlaAlaValAspAlaGluGlnTrp935940945LysLeuGlyGlyAlaAspProGlnAlaValIleAsnGlyValAlaPro950955960965ArgValIleAspGluLeuValProGlnGlyPheGluProThrGlnGlu970975980GluGlnLeuSerSerTyrAspAlaAsnAspMetLysLeuAlaThrVal985990995LysAlaLeuLeuLeuLeuLysGlnGlyIleValValThrAspPro100010051010GluGlyAspAspHisGlyProGlyThrTyrThrTyrProThrAsp101510201025LysValPheLysProGlyValPheAspLeuLeuLysPheLysVal103010351040ThrGluGlySerAspAspTrpThrLeuGluPheHisPheLysAsp104510501055LeuGlyGlyAsnProTrpAsnGlyProAsnGlyPheSerLeuGln106010651070IleIleGluValTyrPheAspPheLysGluGlyGlyAsnValSer107510801085AlaIleLysMetPheProAspGlyProGlySerAsnValArgLeu109010951100AspProAsnHisProTrpAspLeuAlaLeuArgIleAlaGlyTrp110511101115AspTyrGlyAsnLeuIleIleLeuProAspGlyThrAlaTyrGln112011251130GlyGluMetGlnIleSerAlaAspProValLysAsnAlaIleIle113511401145ValLysValProLysLysTyrLeuAsnIleSerAspTyrGlyLeu115011551160TyrThrAlaValIleValGlySerGlnAspGlyTyrGlyProAsp116511701175LysTrpArgProValAlaAlaGluAlaGluGlnTrpLysLeuGly118011851190GlyAlaAspProGlnAlaValIleAspAsnLeuValProArgVal119512001205ValAspGluLeuValProGluGlyPheLysProThrGlnGluGlu121012151220GlnLeuSerSerTyrAspLeuGluLysLysThrLeuAlaThrVal122512301235LeuMetValProLeuValAsnGlyThrGlyGlyGluGluProThr124012451250ProThrGluSerProThrGluThrThrThrThrThrProSerGlu125512601265ThrThrThrThrThrSerThrThrThrGlyProSerSerThrThr127012751280ThrSerThrProGlyGlyGlyIleCysGlyProGlyIleIleAla128512901295GlyLeuAlaLeuIleProLeuLeuLeuLysArgArgAsn130013051310<210>12<211>809<212>PRT<213>人工序列<220><223>热水高温球菌和嗜热高温球菌的杂合的支链淀粉酶<220><221>信号<222>(1)..(27)<220><221>成熟多肽<222>(28)..(809)<400>12MetLysLysProLeuGlyLysIleValAlaSerThrAlaLeuLeuIle-25-20-15SerValAlaPheSerSerSerIleAlaSerAlaGluGluProLysPro-10-5-115LeuAsnValIleIleValTrpHisGlnHisGlnProTyrTyrTyrAsp101520ProIleGlnAspIleTyrThrArgProTrpValArgLeuHisAlaAla253035AsnAsnTyrTrpLysMetAlaAsnTyrLeuSerLysTyrProAspVal404550HisValAlaIleAspLeuSerGlySerLeuIleAlaGlnLeuAlaAsp556065TyrMetAsnGlyLysLysAspThrTyrGlnIleValThrGluLysIle70758085AlaAsnGlyGluProLeuThrLeuGluAspLysTrpPheMetLeuGln9095100AlaProGlyGlyPhePheAspHisThrIleProTrpAsnGlyGluPro105110115ValAlaAspGluAsnGlyAsnProTyrArgGluGlnTrpAspArgTyr120125130AlaGluLeuLysAspLysArgAsnAsnAlaPheLysLysTyrAlaAsn135140145LeuProLeuAsnGluGlnLysValLysIleThrAlaGluPheThrGlu150155160165GlnAspTyrIleAspLeuAlaValLeuPheAsnLeuAlaTrpIleAsp170175180TyrAsnTyrIleIleAsnThrProGluLeuLysAlaLeuTyrAspLys185190195ValAspValGlyGlyTyrThrLysGluAspValAlaThrValLeuLys200205210HisGlnMetTrpLeuLeuAsnHisThrPheGluGluHisGluLysIle215220225AsnTyrLeuLeuGlyAsnGlyAsnValGluValThrValValProTyr230235240245AlaHisProIleGlyProLeuLeuAsnAspPheGlyTrpTyrGluAsp250255260PheAspAlaHisValLysLysAlaHisGluLeuTyrLysLysTyrLeu265270275GlyAspAsnArgValGluProGlnGlyGlyTrpAlaAlaGluSerAla280285290LeuAsnAspLysThrLeuGluIleLeuThrAsnAsnGlyTrpLysTrp295300305ValMetThrAspGlnMetValLeuAspIleLeuGlyIleProAsnThr310315320325ValGluAsnTyrTyrLysProTrpValAlaGluPheAsnGlyLysLys330335340IleTyrLeuPheProArgAsnHisAspLeuSerAspArgValGlyPhe345350355ArgTyrSerGlyMetAsnGlnTyrGlnAlaValGluAspPheValAsn360365370GluLeuLeuLysValGlnLysGluAsnTyrAspGlySerLeuValTyr375380385ValValThrLeuAspGlyGluAsnProTrpGluHisTyrProPheAsp390395400405GlyLysIlePheLeuGluGluLeuTyrLysLysLeuThrGluLeuGln410415420LysGlnGlyLeuIleArgThrValThrProSerGluTyrIleGlnMet425430435TyrGlyAspLysAlaAsnLysLeuThrProArgMetMetGluArgLeu440445450AspLeuThrGlyAspAsnValAsnAlaLeuLeuLysAlaGlnSerLeu455460465GlyGluLeuTyrAspMetThrGlyValLysGluGluMetGlnTrpPro470475480485GluSerSerTrpIleAspGlyThrLeuSerThrTrpIleGlyGluPro490495500GlnGluAsnTyrGlyTrpTyrTrpLeuTyrMetAlaArgLysAlaLeu505510515MetGluAsnLysAspLysMetSerGlnAlaAspTrpGluLysAlaTyr520525530GluTyrLeuLeuArgAlaGluAlaSerAspTrpPheTrpTrpTyrGly535540545SerAspGlnAspSerGlyGlnAspTyrThrPheAspArgTyrLeuLys550555560565ThrTyrLeuTyrGluMetTyrLysLeuAlaGlyValGluProProSer570575580TyrLeuPheGlyAsnTyrPheProAspGlyGluProTyrThrThrArg585590595GlyLeuValGlyLeuLysAspGlyGluMetLysAsnPheSerSerMet600605610SerProLeuAlaLysGlyValSerValTyrPheAspGlyGluGlyIle615620625HisPheIleValLysGlyAsnLeuAspArgPheGluValSerIleTrp630635640645GluLysAspGluArgValGlyAsnThrPheThrArgLeuGlnGluLys650655660ProAspGluLeuSerTyrPheMetPheProPheSerArgAspSerVal665670675GlyLeuLeuIleThrLysHisValValTyrGluAsnGlyLysAlaGlu680685690IleTyrGlyAlaThrAspTyrGluLysSerGluLysLeuGlyGluAla695700705ThrValLysAsnThrSerGluGlyIleGluValValLeuProPheAsp710715720725TyrIleGluAsnProSerAspPheTyrPheAlaValSerThrValLys730735740AspGlyAspLeuGluValIleSerThrProValGluLeuLysLeuPro745750755ThrGluValLysGlyValValIleAlaAspIleThrAspProGluGly760765770AspAspHisGlyProGlyAsnTyrThr775780<210>13<211>412<212>PRT<213>强烈火球菌<220><221>成熟多肽<222>(1)..(412)<223>强烈火球菌蛋白酶(Pfu)<400>13AlaGluLeuGluGlyLeuAspGluSerAlaAlaGlnValMetAlaThr151015TyrValTrpAsnLeuGlyTyrAspGlySerGlyIleThrIleGlyIle202530IleAspThrGlyIleAspAlaSerHisProAspLeuGlnGlyLysVal354045IleGlyTrpValAspPheValAsnGlyArgSerTyrProTyrAspAsp505560HisGlyHisGlyThrHisValAlaSerIleAlaAlaGlyThrGlyAla65707580AlaSerAsnGlyLysTyrLysGlyMetAlaProGlyAlaLysLeuAla859095GlyIleLysValLeuGlyAlaAspGlySerGlySerIleSerThrIle100105110IleLysGlyValGluTrpAlaValAspAsnLysAspLysTyrGlyIle115120125LysValIleAsnLeuSerLeuGlySerSerGlnSerSerAspGlyThr130135140AspAlaLeuSerGlnAlaValAsnAlaAlaTrpAspAlaGlyLeuVal145150155160ValValValAlaAlaGlyAsnSerGlyProAsnLysTyrThrIleGly165170175SerProAlaAlaAlaSerLysValIleThrValGlyAlaValAspLys180185190TyrAspValIleThrSerPheSerSerArgGlyProThrAlaAspGly195200205ArgLeuLysProGluValValAlaProGlyAsnTrpIleIleAlaAla210215220ArgAlaSerGlyThrSerMetGlyGlnProIleAsnAspTyrTyrThr225230235240AlaAlaProGlyThrSerMetAlaThrProHisValAlaGlyIleAla245250255AlaLeuLeuLeuGlnAlaHisProSerTrpThrProAspLysValLys260265270ThrAlaLeuIleGluThrAlaAspIleValLysProAspGluIleAla275280285AspIleAlaTyrGlyAlaGlyArgValAsnAlaTyrLysAlaIleAsn290295300TyrAspAsnTyrAlaLysLeuValPheThrGlyTyrValAlaAsnLys305310315320GlySerGlnThrHisGlnPheValIleSerGlyAlaSerPheValThr325330335AlaThrLeuTyrTrpAspAsnAlaAsnSerAspLeuAspLeuTyrLeu340345350TyrAspProAsnGlyAsnGlnValAspTyrSerTyrThrAlaTyrTyr355360365GlyPheGluLysValGlyTyrTyrAsnProThrAspGlyThrTrpThr370375380IleLysValValSerTyrSerGlySerAlaAsnTyrGlnValAspVal385390395400ValSerAspGlySerLeuSerGlnProGlySerSer405410<210>14<211>595<212>PRT<213>草酸青霉菌<220><221>成熟多肽<222>(1)..(595)<223>成熟草酸青霉菌葡糖淀粉酶序列<400>14ArgProAspProLysGlyGlyAsnLeuThrProPheIleHisLysGlu151015GlyGluArgSerLeuGlnGlyIleLeuAspAsnLeuGlyGlyArgGly202530LysLysThrProGlyThrAlaAlaGlyLeuPheIleAlaSerProAsn354045ThrGluAsnProAsnTyrTyrTyrThrTrpThrArgAspSerAlaLeu505560ThrAlaLysCysLeuIleAspLeuPheGluAspSerArgAlaLysPhe65707580ProIleAspArgLysTyrLeuGluThrGlyIleArgAspTyrLysSer859095SerGlnAlaIleLeuGlnSerValSerAsnProSerGlyThrLeuLys100105110AspGlySerGlyLeuGlyGluProLysPheGluIleAspLeuAsnPro115120125PheSerGlyAlaTrpGlyArgProGlnArgAspGlyProAlaLeuArg130135140AlaThrAlaMetIleThrTyrAlaAsnTyrLeuIleSerHisGlyGln145150155160LysSerAspValSerGlnValMetTrpProIleIleAlaAsnAspLeu165170175AlaTyrValGlyGlnTyrTrpAsnAsnThrGlyPheAspLeuTrpGlu180185190GluValAspGlySerSerPhePheThrIleAlaValGlnHisArgAla195200205LeuValGluGlySerGlnLeuAlaLysLysLeuGlyLysSerCysAsp210215220AlaCysAspSerGlnProProGlnIleLeuCysPheLeuGlnSerPhe225230235240TrpAsnGlyLysTyrIleThrSerAsnIleAsnThrGlnAlaSerArg245250255SerGlyIleAspLeuAspSerValLeuGlySerIleHisThrPheAsp260265270ProGluAlaAlaCysAspAspAlaThrPheGlnProCysSerAlaArg275280285AlaLeuAlaAsnHisLysValTyrValAspSerPheArgSerIleTyr290295300LysIleAsnAlaGlyLeuAlaGluGlySerAlaAlaAsnValGlyArg305310315320TyrProGluAspValTyrGlnGlyGlyAsnProTrpTyrLeuAlaThr325330335LeuGlyAlaSerGluLeuLeuTyrAspAlaLeuTyrGlnTrpAspArg340345350LeuGlyLysLeuGluValSerGluThrSerLeuSerPhePheLysAsp355360365PheAspAlaThrValLysIleGlySerTyrSerArgAsnSerLysThr370375380TyrLysLysLeuThrGlnSerIleLysSerTyrAlaAspGlyPheIle385390395400GlnLeuValGlnGlnTyrThrProSerAsnGlySerLeuAlaGluGln405410415TyrAspArgAsnThrAlaAlaProLeuSerAlaAsnAspLeuThrTrp420425430SerPheAlaSerPheLeuThrAlaThrGlnArgArgAspAlaValVal435440445ProProSerTrpGlyAlaLysSerAlaAsnLysValProThrThrCys450455460SerAlaSerProValValGlyThrTyrLysAlaProThrAlaThrPhe465470475480SerSerLysThrLysCysValProAlaLysAspIleValProIleThr485490495PheTyrLeuIleGluAsnThrTyrTyrGlyGluAsnValPheMetSer500505510GlyAsnIleThrAlaLeuGlyAsnTrpAspAlaLysLysGlyPhePro515520525LeuThrAlaAsnLeuTyrThrGlnAspGlnAsnLeuTrpPheAlaSer530535540ValGluPheIleProAlaGlyThrProPheGluTyrLysTyrTyrLys545550555560ValGluProAsnGlyAspIleThrTrpGluLysGlyProAsnArgVal565570575PheValAlaProThrGlyCysProValGlnProHisSerAsnAspVal580585590TrpGlnPhe595<210>15<211>49<212>DNA<213>人工序列<220><223>ProtF引物<400>15aacgacggtacccggggatcggatccatgcggctcgttgcttccctaac49<210>16<211>48<212>DNA<213>人工序列<220><223>ProtR引物<400>16ctaattacatgatgcggcccttaattaattagcaaccaaggtatatgg48<210>17<211>20<212>DNA<213>人工序列<220><223>AM34引物<400>17taggagtttagtgaacttgc20<210>18<211>18<212>DNA<213>人工序列<220><223>AM35引物<400>18ttcgagcgtcccaaaacc18<210>19<211>25<212>DNA<213>人工引物<220><223>上游引物<400>19atgcgtctcactctattatcaggtg25<210>20<211>39<212>DNA<213>人工序列<220><223>引物F<400>20acacaactggggatccaccatgcgtctcactctattatc39<210>21<211>37<212>DNA<213>人工引物<220><223>引物R<400>21agatctcgagaagcttaaaactgccacacgtcgttgg37<210>22<211>18<212>DNA<213>人工序列<220><223>引物<400>22gcagtctttccaattgac18<210>23<211>18<212>DNA<213>人工序列<220><223>引物<400>23aattggaaagactgcccg18<210>24<211>39<212>DNA<213>人工序列<220><223>引物<400>24acacaactggggatccaccatgcgtctcactctattatc39<210>25<211>37<212>DNA<213>人工序列<220><223>引物<400>25agatctcgagaagcttaaaactgccacacgtcgttgg37<210>26<211>574<212>PRT<213>瓣环栓菌<400>26MetArgPheThrLeuLeuThrSerLeuLeuGlyLeuAlaLeuGlyAla151015PheAlaGlnSerSerAlaAlaAspAlaTyrValAlaSerGluSerPro202530IleAlaLysAlaGlyValLeuAlaAsnIleGlyProSerGlySerLys354045SerAsnGlyAlaLysAlaGlyIleValIleAlaSerProSerThrSer505560AsnProAsnTyrLeuTyrThrTrpThrArgAspSerSerLeuValPhe65707580LysAlaLeuIleAspGlnPheThrThrGlyGluAspThrSerLeuArg859095ThrLeuIleAspGluPheThrSerAlaGluAlaIleLeuGlnGlnVal100105110ProAsnProSerGlyThrValSerThrGlyGlyLeuGlyGluProLys115120125PheAsnIleAspGluThrAlaPheThrAspAlaTrpGlyArgProGln130135140ArgAspGlyProAlaLeuArgAlaThrAlaIleIleThrTyrAlaAsn145150155160TrpLeuLeuAspAsnLysAsnThrThrTyrValThrAsnThrLeuTrp165170175ProIleIleLysLeuAspLeuAspTyrValAlaSerAsnTrpAsnGln180185190SerThrPheAspLeuTrpGluGluIleAsnSerSerSerPhePheThr195200205ThrAlaValGlnHisArgAlaLeuArgGluGlyAlaThrPheAlaAsn210215220ArgIleGlyGlnThrSerValValSerGlyTyrThrThrGlnAlaAsn225230235240AsnLeuLeuCysPheLeuGlnSerTyrTrpAsnProThrGlyGlyTyr245250255IleThrAlaAsnThrGlyGlyGlyArgSerGlyLysAspAlaAsnThr260265270ValLeuThrSerIleHisThrPheAspProAlaAlaGlyCysAspAla275280285ValThrPheGlnProCysSerAspLysAlaLeuSerAsnLeuLysVal290295300TyrValAspAlaPheArgSerIleTyrSerIleAsnSerGlyIleAla305310315320SerAsnAlaAlaValAlaThrGlyArgTyrProGluAspSerTyrMet325330335GlyGlyAsnProTrpTyrLeuThrThrSerAlaValAlaGluGlnLeu340345350TyrAspAlaLeuIleValTrpAsnLysLeuGlyAlaLeuAsnValThr355360365SerThrSerLeuProPhePheGlnGlnPheSerSerGlyValThrVal370375380GlyThrTyrAlaSerSerSerSerThrPheLysThrLeuThrSerAla385390395400IleLysThrPheAlaAspGlyPheLeuAlaValAsnAlaLysTyrThr405410415ProSerAsnGlyGlyLeuAlaGluGlnTyrSerArgSerAsnGlySer420425430ProValSerAlaValAspLeuThrTrpSerTyrAlaAlaAlaLeuThr435440445SerPheAlaAlaArgSerGlyLysThrTyrAlaSerTrpGlyAlaAla450455460GlyLeuThrValProThrThrCysSerGlySerGlyGlyAlaGlyThr465470475480ValAlaValThrPheAsnValGlnAlaThrThrValPheGlyGluAsn485490495IleTyrIleThrGlySerValProAlaLeuGlnAsnTrpSerProAsp500505510AsnAlaLeuIleLeuSerAlaAlaAsnTyrProThrTrpSerIleThr515520525ValAsnLeuProAlaSerThrThrIleGluTyrLysTyrIleArgLys530535540PheAsnGlyAlaValThrTrpGluSerAspProAsnAsnSerIleThr545550555560ThrProAlaSerGlyThrPheThrGlnAsnAspThrTrpArg565570<210>27<211>583<212>PRT<213>微小根毛菌<400>27AlaThrSerAspAspTrpLysGlyLysAlaIleTyrGlnLeuLeuThr151015AspArgPheGlyArgAlaAspAspSerThrSerAsnCysSerAsnLeu202530SerAsnTyrCysGlyGlyThrTyrGluGlyIleThrLysHisLeuAsp354045TyrIleSerGlyMetGlyPheAspAlaIleTrpIleSerProIlePro505560LysAsnSerAspGlyGlyTyrHisGlyTyrTrpAlaThrAspPheTyr65707580GlnLeuAsnSerAsnPheGlyAspGluSerGlnLeuLysAlaLeuIle859095GlnAlaAlaHisGluArgAspMetTyrValMetLeuAspValValAla100105110AsnHisAlaGlyProThrSerAsnGlyTyrSerGlyTyrThrPheGly115120125AspAlaSerLeuTyrHisProLysCysThrIleAspTyrAsnAspGln130135140ThrSerIleGluGlnCysTrpValAlaAspGluLeuProAspIleAsp145150155160ThrGluAsnSerAspAsnValAlaIleLeuAsnAspIleValSerGly165170175TrpValGlyAsnTyrSerPheAspGlyIleArgIleAspThrValLys180185190HisIleArgLysAspPheTrpThrGlyTyrAlaGluAlaAlaGlyVal195200205PheAlaThrGlyGluValPheAsnGlyAspProAlaTyrValGlyPro210215220TyrGlnLysTyrLeuProSerLeuIleAsnTyrProMetTyrTyrAla225230235240LeuAsnAspValPheValSerLysSerLysGlyPheSerArgIleSer245250255GluMetLeuGlySerAsnArgAsnAlaPheGluAspThrSerValLeu260265270ThrThrPheValAspAsnHisAspAsnProArgPheLeuAsnSerGln275280285SerAspLysAlaLeuPheLysAsnAlaLeuThrTyrValLeuLeuGly290295300GluGlyIleProIleValTyrTyrGlySerGluGlnGlyPheSerGly305310315320GlyAlaAspProAlaAsnArgGluValLeuTrpThrThrAsnTyrAsp325330335ThrSerSerAspLeuTyrGlnPheIleLysThrValAsnSerValArg340345350MetLysSerAsnLysAlaValTyrMetAspIleTyrValGlyAspAsn355360365AlaTyrAlaPheLysHisGlyAspAlaLeuValValLeuAsnAsnTyr370375380GlySerGlySerThrAsnGlnValSerPheSerValSerGlyLysPhe385390395400AspSerGlyAlaSerLeuMetAspIleValSerAsnIleThrThrThr405410415ValSerSerAspGlyThrValThrPheAsnLeuLysAspGlyLeuPro420425430AlaIlePheThrSerAlaThrGlyGlyThrThrThrThrAlaThrPro435440445ThrGlySerGlySerValThrSerThrSerLysThrThrAlaThrAla450455460SerLysThrSerThrSerThrSerSerThrSerCysThrThrProThr465470475480AlaValAlaValThrPheAspLeuThrAlaThrThrThrTyrGlyGlu485490495AsnIleTyrLeuValGlySerIleSerGlnLeuGlyAspTrpGluThr500505510SerAspGlyIleAlaLeuSerAlaAspLysTyrThrSerSerAspPro515520525LeuTrpTyrValThrValThrLeuProAlaGlyGluSerPheGluTyr530535540LysPheIleArgIleGluSerAspAspSerValGluTrpGluSerAsp545550555560ProAsnArgGluTyrThrValProGlnAlaCysGlyThrSerThrAla565570575ThrValThrAspThrTrpArg580<210>28<211>618<212>PRT<213>埃默森篮状菌<400>28MetAlaSerLeuValAlaGlyAlaLeuCysIleLeuGlyLeuThrPro151015AlaAlaPheAlaArgAlaProValAlaAlaArgAlaThrGlySerLeu202530AspSerPheLeuAlaThrGluThrProIleAlaLeuGlnGlyValLeu354045AsnAsnIleGlyProAsnGlyAlaAspValAlaGlyAlaSerAlaGly505560IleValValAlaSerProSerArgSerAspProAsnTyrPheTyrSer65707580TrpThrArgAspAlaAlaLeuThrAlaLysTyrLeuValAspAlaPhe859095IleAlaGlyAsnLysAspLeuGluGlnThrIleGlnGlnTyrIleSer100105110AlaGlnAlaLysValGlnThrIleSerAsnProSerGlyAspLeuSer115120125ThrGlyGlyLeuGlyGluProLysPheAsnValAsnGluThrAlaPhe130135140ThrGlyProTrpGlyArgProGlnArgAspGlyProAlaLeuArgAla145150155160ThrAlaLeuIleAlaTyrAlaAsnTyrLeuIleAspAsnGlyGluAla165170175SerThrAlaAspGluIleIleTrpProIleValGlnAsnAspLeuSer180185190TyrIleThrGlnTyrTrpAsnSerSerThrPheAspLeuTrpGluGlu195200205ValGluGlySerSerPhePheThrThrAlaValGlnHisArgAlaLeu210215220ValGluGlyAsnAlaLeuAlaThrArgLeuAsnHisThrCysSerAsn225230235240CysValSerGlnAlaProGlnValLeuCysPheLeuGlnSerTyrTrp245250255ThrGlySerTyrValLeuAlaAsnPheGlyGlySerGlyArgSerGly260265270LysAspValAsnSerIleLeuGlySerIleHisThrPheAspProAla275280285GlyGlyCysAspAspSerThrPheGlnProCysSerAlaArgAlaLeu290295300AlaAsnHisLysValValThrAspSerPheArgSerIleTyrAlaIle305310315320AsnSerGlyIleAlaGluGlySerAlaValAlaValGlyArgTyrPro325330335GluAspValTyrGlnGlyGlyAsnProTrpTyrLeuAlaThrAlaAla340345350AlaAlaGluGlnLeuTyrAspAlaIleTyrGlnTrpLysLysIleGly355360365SerIleSerIleThrAspValSerLeuProPhePheGlnAspIleTyr370375380ProSerAlaAlaValGlyThrTyrAsnSerGlySerThrThrPheAsn385390395400AspIleIleSerAlaValGlnThrTyrGlyAspGlyTyrLeuSerIle405410415ValGluLysTyrThrProSerAspGlySerLeuThrGluGlnPheSer420425430ArgThrAspGlyThrProLeuSerAlaSerAlaLeuThrTrpSerTyr435440445AlaSerLeuLeuThrAlaSerAlaArgArgGlnSerValValProAla450455460SerTrpGlyGluSerSerAlaSerSerValProAlaValCysSerAla465470475480ThrSerAlaThrGlyProTyrSerThrAlaThrAsnThrValTrpPro485490495SerSerGlySerGlySerSerThrThrThrSerSerAlaProCysThr500505510ThrProThrSerValAlaValThrPheAspGluIleValSerThrSer515520525TyrGlyGluThrIleTyrLeuAlaGlySerIleProGluLeuGlyAsn530535540TrpSerThrAlaSerAlaIleProLeuArgAlaAspAlaTyrThrAsn545550555560SerAsnProLeuTrpTyrValThrValAsnLeuProProGlyThrSer565570575PheGluTyrLysPhePheLysAsnGlnThrAspGlyThrIleValTrp580585590GluAspAspProAsnArgSerTyrThrValProAlaTyrCysGlyGln595600605ThrThrAlaIleLeuAspAspSerTrpGln610615<210>29<211>863<212>PRT<213>烟曲霉<400>29MetArgPheGlyTrpLeuGluValAlaAlaLeuThrAlaAlaSerVal151015AlaAsnAlaGlnGluLeuAlaPheSerProProPheTyrProSerPro202530TrpAlaAspGlyGlnGlyGluTrpAlaAspAlaHisArgArgAlaVal354045GluIleValSerGlnMetThrLeuAlaGluLysValAsnLeuThrThr505560GlyThrGlyTrpGluMetAspArgCysValGlyGlnThrGlySerVal65707580ProArgLeuGlyIleAsnTrpGlyLeuCysGlyGlnAspSerProLeu859095GlyIleArgPheSerAspLeuAsnSerAlaPheProAlaGlyThrAsn100105110ValAlaAlaThrTrpAspLysThrLeuAlaTyrLeuArgGlyLysAla115120125MetGlyGluGluPheAsnAspLysGlyValAspIleLeuLeuGlyPro130135140AlaAlaGlyProLeuGlyLysTyrProAspGlyGlyArgIleTrpGlu145150155160GlyPheSerProAspProValLeuThrGlyValLeuPheAlaGluThr165170175IleLysGlyIleGlnAspAlaGlyValIleAlaThrAlaLysHisTyr180185190IleLeuAsnGluGlnGluHisPheArgGlnValGlyGluAlaGlnGly195200205TyrGlyTyrAsnIleThrGluThrIleSerSerAsnValAspAspLys210215220ThrMetHisGluLeuTyrLeuTrpProPheAlaAspAlaValArgAla225230235240GlyValGlyAlaValMetCysSerTyrAsnGlnIleAsnAsnSerTyr245250255GlyCysGlnAsnSerGlnThrLeuAsnLysLeuLeuLysAlaGluLeu260265270GlyPheGlnGlyPheValMetSerAspTrpSerAlaHisHisSerGly275280285ValGlyAlaAlaLeuAlaGlyLeuAspMetSerMetProGlyAspIle290295300SerPheAspAspGlyLeuSerPheTrpGlyThrAsnLeuThrValSer305310315320ValLeuAsnGlyThrValProAlaTrpArgValAspAspMetAlaVal325330335ArgIleMetThrAlaTyrTyrLysValGlyArgAspArgLeuArgIle340345350ProProAsnPheSerSerTrpThrArgAspGluTyrGlyTrpGluHis355360365SerAlaValSerGluGlyAlaTrpThrLysValAsnAspPheValAsn370375380ValGlnArgSerHisSerGlnIleIleArgGluIleGlyAlaAlaSer385390395400ThrValLeuLeuLysAsnThrGlyAlaLeuProLeuThrGlyLysGlu405410415ValLysValGlyValLeuGlyGluAspAlaGlySerAsnProTrpGly420425430AlaAsnGlyCysProAspArgGlyCysAspAsnGlyThrLeuAlaMet435440445AlaTrpGlySerGlyThrAlaAsnPheProTyrLeuValThrProGlu450455460GlnAlaIleGlnArgGluValIleSerAsnGlyGlyAsnValPheAla465470475480ValThrAspAsnGlyAlaLeuSerGlnMetAlaAspValAlaSerGln485490495SerSerValSerLeuValPheValAsnAlaAspSerGlyGluGlyPhe500505510IleSerValAspGlyAsnGluGlyAspArgLysAsnLeuThrLeuTrp515520525LysAsnGlyGluAlaValIleAspThrValValSerHisCysAsnAsn530535540ThrIleValValIleHisSerValGlyProValLeuIleAspArgTrp545550555560TyrAspAsnProAsnValThrAlaIleIleTrpAlaGlyLeuProGly565570575GlnGluSerGlyAsnSerLeuValAspValLeuTyrGlyArgValAsn580585590ProSerAlaLysThrProPheThrTrpGlyLysThrArgGluSerTyr595600605GlyAlaProLeuLeuThrGluProAsnAsnGlyAsnGlyAlaProGln610615620AspAspPheAsnGluGlyValPheIleAspTyrArgHisPheAspLys625630635640ArgAsnGluThrProIleTyrGluPheGlyHisGlyLeuSerTyrThr645650655ThrPheGlyTyrSerHisLeuArgValGlnAlaLeuAsnSerSerSer660665670SerAlaTyrValProThrSerGlyGluThrLysProAlaProThrTyr675680685GlyGluIleGlySerAlaAlaAspTyrLeuTyrProGluGlyLeuLys690695700ArgIleThrLysPheIleTyrProTrpLeuAsnSerThrAspLeuGlu705710715720AspSerSerAspAspProAsnTyrGlyTrpGluAspSerGluTyrIle725730735ProGluGlyAlaArgAspGlySerProGlnProLeuLeuLysAlaGly740745750GlyAlaProGlyGlyAsnProThrLeuTyrGlnAspLeuValArgVal755760765SerAlaThrIleThrAsnThrGlyAsnValAlaGlyTyrGluValPro770775780GlnLeuTyrValSerLeuGlyGlyProAsnGluProArgValValLeu785790795800ArgLysPheAspArgIlePheLeuAlaProGlyGluGlnLysValTrp805810815ThrThrThrLeuAsnArgArgAspLeuAlaAsnTrpAspValGluAla820825830GlnAspTrpValIleThrLysTyrProLysLysValHisValGlySer835840845SerSerArgLysLeuProLeuArgAlaProLeuProArgValTyr850855860<210>30<211>250<212>PRT<213>橙色嗜热子囊菌<400>30MetSerPheSerLysIleIleAlaThrAlaGlyValLeuAlaSerAla151015SerLeuValAlaGlyHisGlyPheValGlnAsnIleValIleAspGly202530LysLysTyrTyrGlyGlyTyrLeuValAsnGlnTyrProTyrMetSer354045AsnProProGluValIleAlaTrpSerThrThrAlaThrAspLeuGly505560PheValAspGlyThrGlyTyrGlnThrProAspIleIleCysHisArg65707580GlyAlaLysProGlyAlaLeuThrAlaProValSerProGlyGlyThr859095ValGluLeuGlnTrpThrProTrpProAspSerHisHisGlyProVal100105110IleAsnTyrLeuAlaProCysAsnGlyAspCysSerThrValAspLys115120125ThrGlnLeuGluPhePheLysIleAlaGluSerGlyLeuIleAsnAsp130135140AspAsnProProGlyIleTrpAlaSerAspAsnLeuIleAlaAlaAsn145150155160AsnSerTrpThrValThrIleProThrThrIleAlaProGlyAsnTyr165170175ValLeuArgHisGluIleIleAlaLeuHisSerAlaGlnAsnGlnAsp180185190GlyAlaGlnAsnTyrProGlnCysIleAsnLeuGlnValThrGlyGly195200205GlySerAspAsnProAlaGlyThrLeuGlyThrAlaLeuTyrHisAsp210215220ThrAspProGlyIleLeuIleAsnIleTyrGlnLysLeuSerSerTyr225230235240IleIleProGlyProProLeuTyrThrGly245250<210>31<211>253<212>PRT<213>埃默森青霉菌<400>31MetLeuSerSerThrThrArgThrLeuAlaPheThrGlyLeuAlaGly151015LeuLeuSerAlaProLeuValLysAlaHisGlyPheValGlnGlyIle202530ValIleGlyAspGlnPheTyrSerGlyTyrIleValAsnSerPhePro354045TyrGluSerAsnProProProValIleGlyTrpAlaThrThrAlaThr505560AspLeuGlyPheValAspGlyThrGlyTyrGlnGlyProAspIleIle65707580CysHisArgAsnAlaThrProAlaProLeuThrAlaProValAlaAla859095GlyGlyThrValGluLeuGlnTrpThrProTrpProAspSerHisHis100105110GlyProValIleThrTyrLeuAlaProCysAsnGlyAsnCysSerThr115120125ValAspLysThrThrLeuGluPhePheLysIleAspGlnGlnGlyLeu130135140IleAspAspThrSerProProGlyThrTrpAlaSerAspAsnLeuIle145150155160AlaAsnAsnAsnSerTrpThrValThrIleProAsnSerValAlaPro165170175GlyAsnTyrValLeuArgHisGluIleIleAlaLeuHisSerAlaAsn180185190AsnLysAspGlyAlaGlnAsnTyrProGlnCysIleAsnIleGluVal195200205ThrGlyGlyGlySerAspAlaProGluGlyThrLeuGlyGluAspLeu210215220TyrHisAspThrAspProGlyIleLeuValAspIleTyrGluProIle225230235240AlaThrTyrThrIleProGlyProProGluProThrPhe245250<210>32<211>532<212>PRT<213>烟曲霉<400>32MetLeuAlaSerThrPheSerTyrArgMetTyrLysThrAlaLeuIle151015LeuAlaAlaLeuLeuGlySerGlyGlnAlaGlnGlnValGlyThrSer202530GlnAlaGluValHisProSerMetThrTrpGlnSerCysThrAlaGly354045GlySerCysThrThrAsnAsnGlyLysValValIleAspAlaAsnTrp505560ArgTrpValHisLysValGlyAspTyrThrAsnCysTyrThrGlyAsn65707580ThrTrpAspThrThrIleCysProAspAspAlaThrCysAlaSerAsn859095CysAlaLeuGluGlyAlaAsnTyrGluSerThrTyrGlyValThrAla100105110SerGlyAsnSerLeuArgLeuAsnPheValThrThrSerGlnGlnLys115120125AsnIleGlySerArgLeuTyrMetMetLysAspAspSerThrTyrGlu130135140MetPheLysLeuLeuAsnGlnGluPheThrPheAspValAspValSer145150155160AsnLeuProCysGlyLeuAsnGlyAlaLeuTyrPheValAlaMetAsp165170175AlaAspGlyGlyMetSerLysTyrProThrAsnLysAlaGlyAlaLys180185190TyrGlyThrGlyTyrCysAspSerGlnCysProArgAspLeuLysPhe195200205IleAsnGlyGlnAlaAsnValGluGlyTrpGlnProSerSerAsnAsp210215220AlaAsnAlaGlyThrGlyAsnHisGlySerCysCysAlaGluMetAsp225230235240IleTrpGluAlaAsnSerIleSerThrAlaPheThrProHisProCys245250255AspThrProGlyGlnValMetCysThrGlyAspAlaCysGlyGlyThr260265270TyrSerSerAspArgTyrGlyGlyThrCysAspProAspGlyCysAsp275280285PheAsnSerPheArgGlnGlyAsnLysThrPheTyrGlyProGlyMet290295300ThrValAspThrLysSerLysPheThrValValThrGlnPheIleThr305310315320AspAspGlyThrSerSerGlyThrLeuLysGluIleLysArgPheTyr325330335ValGlnAsnGlyLysValIleProAsnSerGluSerThrTrpThrGly340345350ValSerGlyAsnSerIleThrThrGluTyrCysThrAlaGlnLysSer355360365LeuPheGlnAspGlnAsnValPheGluLysHisGlyGlyLeuGluGly370375380MetGlyAlaAlaLeuAlaGlnGlyMetValLeuValMetSerLeuTrp385390395400AspAspHisSerAlaAsnMetLeuTrpLeuAspSerAsnTyrProThr405410415ThrAlaSerSerThrThrProGlyValAlaArgGlyThrCysAspIle420425430SerSerGlyValProAlaAspValGluAlaAsnHisProAspAlaTyr435440445ValValTyrSerAsnIleLysValGlyProIleGlySerThrPheAsn450455460SerGlyGlySerAsnProGlyGlyGlyThrThrThrThrThrThrThr465470475480GlnProThrThrThrThrThrThrAlaGlyAsnProGlyGlyThrGly485490495ValAlaGlnHisTyrGlyGlnCysGlyGlyIleGlyTrpThrGlyPro500505510ThrThrCysAlaSerProTyrThrCysGlnLysLeuAsnAspTyrTyr515520525SerGlnCysLeu530<210>33<211>454<212>PRT<213>烟曲霉<400>33MetLysHisLeuAlaSerSerIleAlaLeuThrLeuLeuLeuProAla151015ValGlnAlaGlnGlnThrValTrpGlyGlnCysGlyGlyGlnGlyTrp202530SerGlyProThrSerCysValAlaGlyAlaAlaCysSerThrLeuAsn354045ProTyrTyrAlaGlnCysIleProGlyAlaThrAlaThrSerThrThr505560LeuThrThrThrThrAlaAlaThrThrThrSerGlnThrThrThrLys65707580ProThrThrThrGlyProThrThrSerAlaProThrValThrAlaSer859095GlyAsnProPheSerGlyTyrGlnLeuTyrAlaAsnProTyrTyrSer100105110SerGluValHisThrLeuAlaMetProSerLeuProSerSerLeuGln115120125ProLysAlaSerAlaValAlaGluValProSerPheValTrpLeuAsp130135140ValAlaAlaLysValProThrMetGlyThrTyrLeuAlaAspIleGln145150155160AlaLysAsnLysAlaGlyAlaAsnProProIleAlaGlyIlePheVal165170175ValTyrAspLeuProAspArgAspCysAlaAlaLeuAlaSerAsnGly180185190GluTyrSerIleAlaAsnAsnGlyValAlaAsnTyrLysAlaTyrIle195200205AspAlaIleArgAlaGlnLeuValLysTyrSerAspValHisThrIle210215220LeuValIleGluProAspSerLeuAlaAsnLeuValThrAsnLeuAsn225230235240ValAlaLysCysAlaAsnAlaGlnSerAlaTyrLeuGluCysValAsp245250255TyrAlaLeuLysGlnLeuAsnLeuProAsnValAlaMetTyrLeuAsp260265270AlaGlyHisAlaGlyTrpLeuGlyTrpProAlaAsnLeuGlyProAla275280285AlaThrLeuPheAlaLysValTyrThrAspAlaGlySerProAlaAla290295300ValArgGlyLeuAlaThrAsnValAlaAsnTyrAsnAlaTrpSerLeu305310315320SerThrCysProSerTyrThrGlnGlyAspProAsnCysAspGluLys325330335LysTyrIleAsnAlaMetAlaProLeuLeuLysGluAlaGlyPheAsp340345350AlaHisPheIleMetAspThrSerArgAsnGlyValGlnProThrLys355360365GlnAsnAlaTrpGlyAspTrpCysAsnValIleGlyThrGlyPheGly370375380ValArgProSerThrAsnThrGlyAspProLeuGlnAspAlaPheVal385390395400TrpIleLysProGlyGlyGluSerAspGlyThrSerAsnSerThrSer405410415ProArgTyrAspAlaHisCysGlyTyrSerAspAlaLeuGlnProAla420425430ProGluAlaGlyThrTrpPheGlnAlaTyrPheGluGlnLeuLeuThr435440445AsnAlaAsnProSerPhe450<210>34<211>203<212>PRT<213>嗜热网团菌<220><221>成熟多肽<222>(1)..(203)<400>34GlnThrSerIleThrLeuThrSerAsnAlaSerGlyThrPheAspGly151015TyrTyrTyrGluLeuTrpLysAspThrGlyAsnThrThrMetThrVal202530TyrThrGlnGlyArgPheSerCysGlnTrpSerAsnIleAsnAsnAla354045LeuPheArgThrGlyLysLysTyrAsnGlnAsnTrpGlnSerLeuGly505560ThrIleArgIleThrTyrSerAlaThrTyrAsnProAsnGlyAsnSer65707580TyrLeuCysIleTyrGlyTrpSerThrAsnProLeuValGluPheTyr859095IleValGluSerTrpGlyAsnTrpArgProProGlyAlaThrSerLeu100105110GlyGlnValThrIleAspGlyGlyThrTyrAspIleTyrArgThrThr115120125ArgValAsnGlnProSerIleValGlyThrAlaThrPheAspGlnTyr130135140TrpSerValArgThrSerLysArgThrSerGlyThrValThrValThr145150155160AspHisPheArgAlaTrpAlaAsnArgGlyLeuAsnLeuGlyThrIle165170175AspGlnIleThrLeuCysValGluGlyTyrGlnSerSerGlySerAla180185190AsnIleThrGlnAsnThrPheSerGlnGlySer195200<210>35<211>334<212>PRT<213>孢青霉<220><221>信号<222>(1)..(18)<220><221>成熟多肽<222>(19)..(334)<400>35MetLysPheSerAsnLeuValAlaLeuAlaAlaAlaAlaSerSerAla-15-10-5MetAlaLeuProLeuThrLysLysHisAlaLysArgAlaSerSerPhe-11510GluTrpPheGlySerAsnGluSerGlyAlaGluPheGlySerGlyAsn15202530IleProGlyValTyrGlyThrAspTyrIlePheProSerThrSerAla354045IleGlnThrLeuIleAsnAsnGlyMetAsnIlePheArgValThrPhe505560MetMetGluArgLeuValProAsnThrMetThrGlySerPheAspAla657075GluTyrLeuSerAsnLeuThrSerValValAsnTyrIleThrGluAla808590GlyAlaHisAlaValIleAspProHisAsnTyrGlyArgTyrTyrGly95100105110SerIleIleSerSerThrSerAspPheGlnThrPheTrpLysAsnVal115120125AlaGlyGlnPheLysSerAsnSerLeuValIlePheAspThrAsnAsn130135140GluTyrHisAspMetAspGlnThrLeuValLeuAsnLeuAsnGlnAla145150155AlaIleAsnGlyIleArgAlaAlaGlyAlaThrSerGlnTyrIlePhe160165170ValGluGlyAsnSerTyrThrGlyAlaTrpThrTrpAlaAspValAsn175180185190AspAsnLeuLysAsnLeuThrAspProGlnAsnLysIleValTyrGlu195200205MetHisGlnTyrLeuAspSerAspGlySerGlyThrSerAlaThrCys210215220ValSerThrThrIleGlyLysGluArgValThrSerAlaThrGlnTrp225230235LeuGlnLysAsnGlyLysValGlyIleLeuGlyGluPheAlaGlyGly240245250ValAsnAspGlnCysLysThrAlaIleThrGlyMetLeuSerTyrLeu255260265270GluAspAsnSerAspValTrpArgGlyAlaMetTrpTrpAlaAlaGly275280285ProTrpTrpGlyAspTyrIlePheSerLeuGluProProSerGlyThr290295300AlaTyrThrGlyMetTrpSerThrLeuLysSerTyrLeuAla305310315<210>36<211>394<212>PRT<213>褐孢长毛盘菌<220><221>信号<222>(1)..(20)<220><221>成熟多肽<222>(21)..(394)<400>36MetHisSerPhePheSerLeuAlaLeuAlaValAlaGlyLeuProAla-20-15-10-5LeuIleAsnAlaGlnGlnSerAlaTrpGlyGlnCysGlyGlyValGly-11510TrpThrGlyAlaThrThrCysValSerGlyTyrTyrCysSerLysLeu152025AsnAspTyrTyrSerGlnCysIleProGlyThrAlaSerThrThrThr303540SerAlaValSerThrThrThrThrAlaThrSerProThrGlySerVal45505560CysSerGlyAsnArgThrLysPheLysTyrPheGlyValAsnGluSer657075GlyAlaGluPheGlyAsnAsnValValProGlyThrLeuGlyLysAsp808590TyrThrTrpProThrThrAspSerValAspPhePheLeuGlyLysGly95100105MetAsnThrPheArgIleAlaPheLeuMetGluArgLeuSerProPro110115120AlaGlyGlyLeuThrGlyThrPheAspProThrTyrLeuAlaSerLeu125130135140LysAsnIleAlaSerTyrIleThrGlyLysGlyGlyTyrAlaIleIle145150155AspProHisAsnTyrGlyArgTyrAsnGlyAsnIleIleThrAspTyr160165170ThrSerPheGlyThrTrpCysLysAsnLeuAlaSerGlnPheLysSer175180185AspSerHisIleIlePheAspThrAsnAsnGluTyrHisAspMetAsp190195200GluThrLeuValPheAsnLeuAsnGlnAlaCysIleAsnGlyIleArg205210215220AlaAlaGlyAlaThrSerGlnLeuIleLeuIleGluGlyAsnSerTrp225230235ThrGlyAlaTrpThrTrpIleSerSerGlyAsnAlaAlaSerLeuIle240245250AsnLeuThrAspProAsnAsnAsnIleAlaTyrGluMetHisGlnTyr255260265LeuAspSerAspGlySerGlyThrSerProThrCysValSerSerThr270275280IleGlyAlaGluArgLeuAlaAlaAlaThrAlaTrpLeuGlnAlaAsn285290295300AsnLysLysGlyPheLeuGlyGluIleGlyAlaGlySerAsnAspAsp305310315CysIleAlaAlaValLysGlyAlaLeuCysSerMetGlnGluAlaGly320325330GlyValTrpLeuGlyAlaLeuTrpTrpAlaAlaGlyProTrpTrpGly335340345AspTyrTyrGlnSerIleGluProProAspGlyAlaAlaIleAlaArg350355360IleLeuProGluAlaLeuLeuProPheLeu365370<210>37<211>278<212>PRT<213>梭孢壳酶<220><221>成熟多肽<222>(1)..(278)<400>37AlaSerGlySerGlyGlnSerThrArgTyrTrpAspCysCysLysPro151015SerCysAlaTrpProGlyLysAlaAlaValSerGlnProValTyrAla202530CysAspAlaAsnPheGlnArgLeuSerAspPheAsnValGlnSerGly354045CysAsnGlyGlySerAlaTyrSerCysAlaAspGlnThrProTrpAla505560ValAsnAspAsnLeuAlaTyrGlyPheAlaAlaThrSerIleAlaGly65707580GlySerGluSerSerTrpCysCysAlaCysTyrAlaLeuThrPheThr859095SerGlyProValAlaGlyLysThrMetValValGlnSerThrSerThr100105110GlyGlyAspLeuGlySerAsnHisPheAspIleAlaMetProGlyGly115120125GlyValGlyIlePheAsnGlyCysSerSerGlnPheGlyGlyLeuPro130135140GlyAlaGlnTyrGlyGlyIleSerSerArgAspGlnCysAspSerPhe145150155160ProAlaProLeuLysProGlyCysGlnTrpArgPheAspTrpPheGln165170175AsnAlaAspAsnProThrPheThrPheGlnGlnValGlnCysProAla180185190GluIleValAlaArgSerGlyCysLysArgAsnAspAspSerSerPhe195200205ProValPheThrProProSerGlyGlyAsnGlyGlyThrGlyThrPro210215220ThrSerThrAlaProGlySerGlyGlnThrSerProGlyGlyGlySer225230235240GlyCysThrSerGlnLysTrpAlaGlnCysGlyGlyIleGlyPheSer245250255GlyCysThrThrCysValSerGlyThrThrCysGlnLysLeuAsnAsp260265270TyrTyrSerGlnCysLeu275<210>38<211>294<212>PRT<213>粪生粪壳菌<220><221>信号<222>(1)..(21)<220><221>成熟多肽<222>(22)..(294)<400>38MetArgSerSerThrIleLeuGlnThrGlyLeuValAlaValLeuPro-20-15-10PheAlaValGlnAlaAlaSerGlySerGlyLysSerThrArgTyrTrp-5-11510AspCysCysLysProSerCysAlaTrpSerGlyLysAlaSerValAsn152025ArgProValLeuAlaCysAspAlaAsnAsnAsnProLeuAsnAspAla303540AsnValLysSerGlyCysAspGlyGlySerAlaTyrThrCysAlaAsn455055AsnSerProTrpAlaValAsnAspAsnLeuAlaTyrGlyPheAlaAla60657075ThrLysLeuSerGlyGlyThrGluSerSerTrpCysCysAlaCysTyr808590AlaLeuThrPheThrSerGlyProValSerGlyLysThrLeuValVal95100105GlnSerThrSerThrGlyGlyAspLeuGlySerAsnHisPheAspLeu110115120AsnMetProGlyGlyGlyValGlyLeuPheAspGlyCysLysArgGlu125130135PheGlyGlyLeuProGlyAlaGlnTyrGlyGlyIleSerSerArgSer140145150155GluCysAspSerPheProAlaAlaLeuLysProGlyCysGlnTrpArg160165170PheAspTrpPheLysAsnAlaAspAsnProGluPheThrPheLysGln175180185ValGlnCysProSerGluLeuThrSerArgThrGlyCysLysArgAsn190195200AspAspSerGlnPheProAlaPheThrProProSerGlyGlyGlySer205210215AsnProSerThrProThrThrProProSerSerGlyGlyGlyGlySer220225230235GlyCysAlaAlaAlaMetTyrAlaGlnCysGlyGlySerGlyPheSer240245250GlyCysThrAsnCysProSerGlySerThrCysLysAlaIleAsnAsp255260265TyrTyrHisGlnCysAla270当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1