使用磷脂酶C增加发酵产物得率的方法与流程
本披露涉及用于由含淀粉材料生产发酵产物,尤其是乙醇的方法。本披露还涉及热稳定性磷脂酶C在本披露的发酵产物生产过程中的液化期间用于增加发酵产物得率,尤其是增加乙醇得率的用途。
序列表的引用
本申请含有一个计算机可读形式的序列表。将该计算机可读形式通过引用结合在此。
发明背景
从含淀粉材料生产发酵产物,例如,乙醇,是本领域中熟知的。目前在工业上使用两种不同种类的方法。最常使用的方法通常被称作“传统方法”,包括在高温下典型地使用细菌α-淀粉酶液化经糊化的淀粉,随后在葡糖淀粉酶和发酵生物体的存在下进行同时糖化和发酵。另一种众所周知的方法通常被称作“生淀粉水解”-方法(RSH法),包括典型地在至少一种葡糖淀粉酶的存在下在低于初始糊化温度进行颗粒淀粉的同时糖化和发酵。
尽管在过去几十年中发酵产物生产发生了显著改善,但是显著量的残余淀粉材料未被转化为所希望的发酵产物,例如乙醇。
因此,仍然存在对于提供用于从含淀粉材料生产发酵产物,例如,乙醇的方法的希望和需求,这些方法可以提供更高的发酵产物得率,或与传统方法相比的其他优点。
技术实现要素:
本披露的目的是提供用于从含淀粉材料生产发酵产物,例如,乙醇的方法,这些方法可以提供更高的发酵产物得率,或与传统方法相比的其他优点。
在第一个方面,本披露涉及在发酵产物生产过程期间增加发酵产物得率的方法,其中在发酵产物生产过程的液化步骤期间存在和/或添加磷脂酶C。
在另一个方面中,本披露涉及生产发酵产物的方法,所述方法包括:
(a)在磷脂酶C存在下使用α-淀粉酶,使含淀粉材料液化;
(b)使用碳水化合物源产生酶糖化所液化的含淀粉材料,以形成可发酵糖;和
(c)使用发酵生物体发酵所述可发酵糖以生产所述发酵产物。
在优选的实施例中,与没有使用磷脂酶C的方法的性能相比,发酵生产产物是乙醇并且乙醇得率增加。
在一个优选的实施例中,磷脂酶C是热稳定性磷脂酶,优选地具有高于80℃的熔点(DSC),例如高于82℃、例如高于84℃、例如高于86℃、例如高于88℃、例如高于88℃、例如高于90℃、例如高于92℃、例如高于94℃、例如高于96℃、例如高于98℃、例如高于100℃、例如在80℃与110℃之间、例如在82℃与110℃之间、例如在87℃与110℃之间。
本文使用的热稳定性磷脂酶C的实例包括本文SEQ ID NO:2中示出的、衍生自埃默森青霉菌(Penicillium emersonii)菌株的磷脂酶C;或者具有磷酯酶活性的多肽,优选具有磷脂酶C活性,与本文中的SEQ ID NO:2的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性;衍生自哈茨木霉(Trichoderma harzanium)菌株的、SEQ ID NO:7中示出的磷脂酶C;或者具有磷酯酶活性的多肽,优选具有磷脂酶C活性,与本文中的SEQ ID NO:7的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性;衍生自哈茨木霉(Trichoderma harzanium)菌株的、SEQ ID NO:8中示出的磷脂酶C;或者具有磷酯酶活性的多肽,优选具有磷脂酶C活性,与本文中的SEQ ID NO:8的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性;和衍生自Rasamsonia eburnea的菌株的、SEQ ID NO:9中示出的磷脂酶C或者具有磷酯酶活性的多肽,优选具有磷脂酶C活性,与本文中的SEQ ID NO:9的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性。
其他酶例如内切葡聚糖酶、半纤维素酶(例如木聚糖酶,优选热稳定性木聚糖酶)、碳水化合物源产生酶(例如葡糖淀粉酶,优选热稳定性葡糖淀粉酶)、蛋白酶、支链淀粉酶和植酸酶也可以用于本披露的方法中。
附图说明
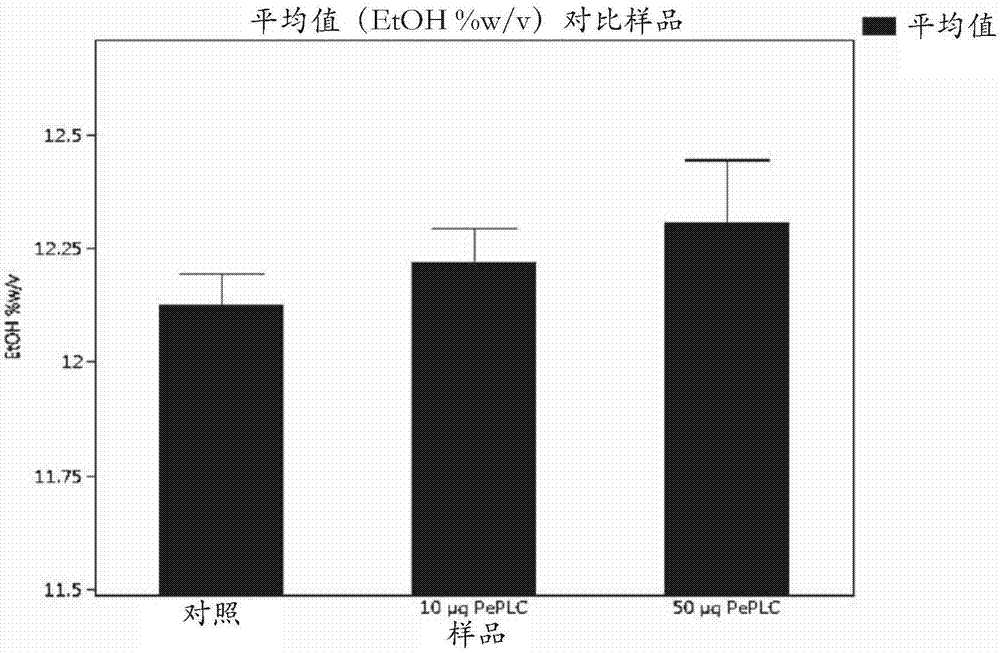
图1示出了在液化中添加Pe PLC(SEQ ID NO:2)和在SSF中添加葡糖淀粉酶SA(GSA)的乙醇得率。
具体实施方式
本披露的目的是提供用于从含淀粉材料生产发酵产物,例如,乙醇的方法,这些方法可以提供更高的发酵产物得率,或与传统方法相比的其他优点。
本披露涉及磷脂酶C在发酵产物生产过程的液化步骤中的用途。磷脂酶C的使用提供了更高的发酵产物得率,例如尤其是乙醇。
I.增加发酵产物得率的方法
诸位发明人已经发现,当在热稳定性磷脂酶C存在下使用α-淀粉酶液化含淀粉材料时,发酵产物得率增加,例如尤其是乙醇得率增加(参见实例)。
因此,在第一个方面本披露涉及在发酵产物生产过程期间增加发酵产物得率的方法,其中在发酵产物生产过程的液化步骤期间存在和/或添加磷脂酶C。
如本文所使用的,短语在发酵产物生产过程的具体步骤“期间存在和/或添加”意指在发酵产物生产过程的具体步骤之前或过程中添加一定量的酶(例如,磷脂酶C)。
在一个优选的实施例中,所述发酵产物是乙醇并且所述方法增加了乙醇的得率。
在一个优选的实施例中,磷脂酶C,例如衍生自青霉属(Penicillium)菌株(例如埃默森青霉菌)的磷脂酶C是SEQ ID NO:2示出的序列或与其具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的序列的成熟部分。
在一个实施例中,SEQ ID NO:2中示出的磷脂酶C在液化期间存在和/或添加。
在一个优选的实施例中,磷脂酶C,例如来自木霉属(Trichoderma)(例如哈茨木霉)的菌株的磷脂酶C是SEQ ID NO:7示出的序列,或与其具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的序列,或SEQ ID NO:8中示出的序列的成熟部分,或与其具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的序列的成熟部分。
在一个实施例中,SEQ ID NO:7中示出的磷脂酶C在液化期间存在和/或添加。在一个实施例中,SEQ ID NO:8中示出的磷脂酶C在液化期间存在和/或添加。
在一个优选的实施例中,磷脂酶C,例如衍生自Rasamsonia属的菌株(例如,Rasamsonia eburnean)的磷脂酶C是SEQ ID NO:9示出的序列或与其具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的序列的成熟部分。
在一个实施例中,SEQ ID NO:9中示出的磷脂酶C在液化期间存在和/或添加。
液化通过使用α-淀粉酶,例如细菌α-淀粉酶和磷脂酶C,在高于初始糊化温度的温度下液化含淀粉材料来进行。
在一个实施例中,磷脂酶C具有至少约80℃的熔点(DSC)。
合适的和优选的酶的实例可以在下面找到。
II.生产发酵产物的方法
在另一个方面中,本披露涉及生产发酵产物的方法,所述方法包括:
(a)在磷脂酶C存在下使用α-淀粉酶,使含淀粉材料液化;
(b)使用碳水化合物源产生酶糖化所液化的含淀粉材料,以形成可发酵糖;和
(c)使用发酵生物体发酵所述可发酵糖以生产所述发酵产物。
尽管糖化步骤(b)和发酵步骤(c)可以同时进行(SSF),但液化步骤(a)、糖化步骤(b)和发酵步骤(c)连续进行。
A.液化步骤(a)
通常,步骤(a)中的含淀粉材料可以包含20-55wt.-%干固体(DS),优选25-40wt.-%干固体,更优选30-35%干固体。
可以在液化步骤(a)之前和/或期间添加α-淀粉酶和/或磷脂酶C。
在一个实施例中,步骤(a)中的pH是在4-7之间,优选地在pH 4.5-6之间。
步骤(a)可以在高于初始糊化温度的温度下作为液化步骤进行。
术语“初始糊化温度”意指该淀粉糊化开始的最低温度。在水中加热的淀粉在50℃与75℃之间开始糊化;糊化的准确温度依赖于具体的淀粉,并能够由本领域的技术人员容易地确定。因此,起始糊化温度可根据植物物种、植物物种的具体品种、以及生长条件而变化。在本披露的背景下,一种给定的含淀粉材料的初始糊化温度是使用由Gorinstein.S.和Lii.C,淀粉(Starch/Starke),第44卷(12)第461-466页(1992)所述的方法使得5%的淀粉颗粒的双折射丧失的温度。
在一个实施例中,步骤(a)是在70℃和100℃之间的温度下进行的。在一个实施例中,步骤(a)是在80℃和90℃之间的温度下进行的。在一个实施例中,步骤(a)是在约82℃的温度下进行的。在一个实施例中,步骤(a)是在约83℃的温度下进行的。在一个实施例中,步骤(a)是在约84℃的温度下进行的。在一个实施例中,步骤(a)是在约86℃的温度下进行的。在一个实施例中,步骤(a)是在约87℃的温度下进行的。在一个实施例中,步骤(a)是在约88℃的温度下进行的。
在一个实施例中,可以在步骤(a)之前进行喷射蒸煮步骤。喷射蒸煮可以在95℃-140℃之间的温度下进行约1-15分钟,优选进行约3-10分钟,尤其是约5分钟左右。
在一个实施例中,本披露的方法在步骤(a)和任选的喷射蒸煮步骤之前进一步包含以下步骤:
i)优选地通过干磨来减小所述含淀粉材料的粒度;和
ii)形成包含所述含淀粉材料和水的浆料。
该含淀粉起始材料(如全谷物)可以例如,经过碾磨减少粒度,以便展开结构、增大表面积并且允许进一步加工。通常存在两种类型的方法:湿磨和干磨。在干磨中,将整个谷粒磨制并使用。湿磨给出胚和粗粉(淀粉颗粒和蛋白质)的良好分离。湿磨常常应用于使用淀粉水解物产生例如糖浆的场合(location)。干磨和湿磨两者都是淀粉加工领域中熟知的。根据本披露,优选的是干磨。在一个实施例中,将粒度减小至在0.05至3.0mm之间、优选地0.1-0.5mm,或使得至少30%、优选至少50%、更优选至少70%、甚至更优选至少90%的含淀粉材料适合通过具有0.05至3.0mm筛网、优选地0.1-0.5mm筛网的筛子。在另一个实施例中,至少50%,优选至少70%,更优选至少80%,尤其是至少90%的含淀粉材料适合通过具有#6筛网的筛子。
该水性浆料可以包含含淀粉材料的从10-55w/w-%干固体(DS),优选25-45w/w-%干固体(DS),更优选30-40w/w-%干固体(DS)。
该浆料可以加热至超过初始糊化温度,优选地在70℃-95℃之间,例如在80℃-90℃之间,pH在5.0-7.0之间,优选地在5.0和6.0之间,持续30分钟至5小时,例如约2小时。
在一个实施例中,液化步骤a)在温度从70℃-95℃、pH从4-6进行0.5小时-5小时。
在一个优选的实施例中,液化步骤a)在温度从80℃-90℃、pH从4-6进行0.5小时-3小时。
可以首先将α-淀粉酶和/或磷脂酶C添加到含水浆料中以开始液化(稀释)。在一个实施例中,这些酶中仅有一部分被添加到所述的含水浆料中,而这些酶中的剩余部分在液化步骤a)过程中添加。
在一个实施例中,所述含水浆料在经受步骤a)中的液化之前可以喷射蒸煮以进一步使该浆料糊化。所述的喷射蒸煮可在95℃-160℃之间进行,例如在110℃-145℃之间,优选120℃-140℃,例如125℃-135℃,优选约130℃进行约1分钟-15分钟,优选地进行约3分钟-10分钟,尤其是约5分钟左右。
步骤(a)中使用的α-淀粉酶可以是任何α-淀粉酶,但优选地是细菌α-淀粉酶。在一个优选的实施例中,细菌α-淀粉酶衍生自芽孢杆菌属(genus Bacillus)。优选的细菌α-淀粉酶可以衍生自嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)的菌株,并且可以是嗜热脂肪芽孢杆菌α-淀粉酶的变体,例如SEQ ID NO:1示出的变体。在生产过程中,嗜热脂肪芽孢杆菌α-淀粉酶被典型地自然地截短。具体地α-淀粉酶可以是具有从485-495个氨基酸的截短的嗜热脂肪芽孢杆菌α-淀粉酶,例如长约491个氨基酸的α-淀粉酶(SEQ ID NO:1)。
根据本披露,嗜热脂肪芽孢杆菌α-淀粉酶可以是示出于SEQ ID NO:1的α-淀粉酶,或可以是与其具有至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的α-淀粉酶。
在一个实施例中,细菌α-淀粉酶可以选自如下嗜热脂肪芽孢杆菌α-淀粉酶变体的组,所述变体包含在位置R179、G180、I181和/或G182中任何位置处的一个或两个氨基酸的缺失,优选地是披露于WO 96/23873的双缺失-参见例如,第20页第1-10行(通过引用特此结合),优选地是与WO 99/19467中披露的SEQ ID NO:3或本文中的SEQ ID NO:1所述的嗜热脂肪芽孢杆菌α-淀粉酶的氨基酸序列相比对应于位置I181+G182的缺失或氨基酸R179+G180的缺失(本文中使用SEQ ID NO:1用于编号)。
在一个优选的实施例中,所述嗜热脂肪芽孢杆菌α-淀粉酶变体包括以下突变集合中的一种:
-R179*+G180*;
-I181*+G182*;
-I181*+G182*+N193F;优选
-I181*+G182*+N193F+E129V+K177L+R179E;
-I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;
-I181*+G182*+N193F+V59A Q89R+E129V+K177L+R179E+Q254S+M284V;以及
-
I181*+G182*+N193F+E129V+K177L+R179E+K220P+N224L+S242Q+Q254S(使用SEQ ID NO:1进行编号)。
在一个实施例中,嗜热脂肪芽孢杆菌α-淀粉酶变体与SEQ ID NO:1具有至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、但少于100%的序列同一性。
在一个实施例中,与亲本α-淀粉酶,尤其是示出于SEQ ID NO:1的α-淀粉酶相比,嗜热脂肪芽孢杆菌α-淀粉酶具有从1-12个突变,例如1、2、3、4、5、6、7、8、9、10、11、12个突变。
可商购的细菌α-淀粉酶产品和含α-淀粉酶的产品包括TERMAMYLTM SC、LIQUOZYMETM SC、LIQUOZYMETM LpH、AVANTECTM 、AVANTECTM AMP、BAN(诺维信公司,丹麦)DEX-LOTM 、SPEZYMETM XTRA、SPEZYMETM AA、SPEZYMETM FRED-L、SPEZYMETM ALPHA、GC358TM、SPEZYMETM RSL、SPEZYMETM HPA和SPEZYMETM DELTA AA(来自杜邦公司(DuPont),美国)、FUELZYMETM(范恩尼姆公司(Verenium),美国)。
在步骤(a)中,细菌α-淀粉酶可以按本领域熟知的量添加。
在一个实施例中,将该细菌α-淀粉酶,例如,芽胞杆菌属α-淀粉酶,例如尤其是嗜热脂肪芽孢杆菌α-淀粉酶、或其变体,以在0.01-10KNU-A/g DS之间的浓度提供到液化中,例如,浓度在0.02和5KNU-A/g DS之间、如0.03和3KNU-A、优选地是0.04和2KNU-A/g DS、例如尤其是0.01和2KNU-A/g DS。在一个实施例中,将该细菌α-淀粉酶,例如,芽孢杆菌属α-淀粉酶,例如尤其是嗜热脂肪芽孢杆菌α-淀粉酶,或其变体,以在0.0001-1mg EP(酶蛋白)/g DS之间的浓度提供到液化中,例如,浓度是0.0005-0.5mg EP/g DS、如0.001-0.1mg EP/g DS。
根据本披露,磷脂酶C,优选具有至少约80℃熔点(DSC)的热稳定性磷脂酶C,与α-淀粉酶组合,存在于和/或添加到液化步骤a)中,所述α-淀粉酶是例如细菌α-淀粉酶(如上所述)。
磷脂酶C的热稳定性可以如WO 2014/090161的实例2中所描述的(通过引用结合在此)确定。
在一个实施例中,磷脂酶C具有高于82℃的熔点(DSC),例如高于84℃、例如高于86℃、例如高于88℃、例如高于88℃、例如高于90℃、例如高于92℃、例如高于94℃、例如高于96℃、例如高于98℃、例如高于100℃、例如在80℃与110℃之间、例如在82℃与110℃之间、例如在87℃与110℃之间。
在一个优选的实施例中,磷脂酶C与本文中的SEQ ID NO:2的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%、优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%的同一性,优选地衍生自青霉属(Penicillium)的菌株,例如埃默森青霉菌(Penicillium emersonii)的菌株。
在一个实施例中,磷脂酶C包含SEQ ID NO:2的氨基酸序列或其等位基因变体,或由其组成;或为其具有磷脂酶C活性的片段。在另一个实施例中,磷脂酶C包含SEQ ID NO:2的成熟多肽、或SEQ ID NO:2的在一个或多个位置上包含取代、缺失和/或插入的成熟多肽的变体,或由其组成。在另一个实施例中,磷脂酶C包含SEQ ID NO:2的1至594位氨基酸或由其组成。
在一个优选的实施例中,磷脂酶C与本文中的SEQ ID NO:7的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%、优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%的同一性,优选地衍生自木霉属(Trichoderma)的菌株,例如哈茨木霉(Trichoderma harzianum)的菌株。
在一个实施例中,磷脂酶C包含SEQ ID NO:7的氨基酸序列或其等位基因变体,或由其组成;或为其具有磷脂酶C活性的片段。在另一个实施例中,磷脂酶C包含SEQ ID NO:7的成熟多肽(例如,SEQ ID NO:7的19-643位氨基酸残基),或SEQ ID NO:7的在一个或多个位置上包含取代、缺失和/或插入的成熟多肽的变体,或由其组成。在另一个实施例中,磷脂酶C包含SEQ ID NO:7的1至594位氨基酸或由其组成。
在一个优选的实施例中,磷脂酶C与本文中的SEQ ID NO:8的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%、优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%的同一性,优选地衍生自木霉属(Trichoderma)的菌株,例如哈茨木霉(Trichoderma harzianum)的菌株。
在一个实施例中,磷脂酶C包含SEQ ID NO:8的氨基酸序列或其等位基因变体,或由其组成;或为其具有磷脂酶C活性的片段。在另一个实施例中,磷脂酶C包含SEQ ID NO:8的成熟多肽(例如,SEQ ID NO:8的19-645位氨基酸残基),或SEQ ID NO:8的在一个或多个位置上包含取代、缺失和/或插入的成熟多肽的变体,或由其组成。在另一个实施例中,磷脂酶C包含SEQ ID NO:8的1至594位氨基酸或由其组成。
在一个优选的实施例中,磷脂酶C与本文中的SEQ ID NO:9的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%、优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%的同一性,优选地衍生自Rasamsonia属的菌株,例如Rasamsonia eburnea的菌株。
在一个实施例中,磷脂酶C包含SEQ ID NO:9的氨基酸序列或其等位基因变体,或由其组成;或为其具有磷脂酶C活性的片段。在另一个实施例中,磷脂酶C包含SEQ ID NO:9的成熟多肽(例如,SEQ ID NO:9的19-611位氨基酸残基),或SEQ ID NO:9的在一个或多个位置上包含取代、缺失和/或插入的成熟多肽的变体,或由其组成。在另一个实施例中,磷脂酶C包含SEQ ID NO:9的1至594位氨基酸或由其组成。
术语“等位基因变体”意思指占据同一染色体基因座的一个基因的两种或更多种替代形式中的任一种。等位基因变异通过突变天然地产生,并且可能导致群体内的多态性。基因突变可以是沉默的(所编码的多肽没有改变)或可编码具有改变的氨基酸序列的多肽。多肽的等位基因变体是由基因的等位基因变体编码的多肽。
术语“片段”意指在成熟多肽的氨基和/或羧基末端缺失一个或多个(例如,若干个)氨基酸的多肽;其中该片段具有磷脂酸C活性。
术语“磷脂酶C活性”意指催化如下反应的活性:磷脂酰胆碱+H20=1,2-sn-二酰基甘油+磷酸胆碱。磷脂酶C活性可以使用磷脂酶C活性测定来确定(参见,例如WO 2014/090161的实例1中所描述的程序,将其通过引用结合在此)。具有“磷脂酶C活性”的酶应属于EC 3.1.4.3。
术语“成熟多肽”意指在翻译和任何翻译后修饰如N末端加工、C末端截短、糖基化作用、磷酸化作用等之后处于其最终形式的多肽。在一个实施例中,成熟多肽是SEQ ID NO:2的1至594位氨基酸。SEQ ID NO:2的-16至-1位氨基酸是信号肽。在本领域中已知的是,宿主细胞可以产生由相同多核苷酸表达的两种或更多种不同的成熟多肽(即,具有不同的C-末端和/或N-末端氨基酸)的混合物。
出于本披露的目的,使用如在EMBOSS包(The European Molecular Biology Open Software Suite[EMBOSS:欧洲分子生物学开放软件套件],Rice等人,2000,Trends Genet.[遗传学趋势]16:276-277)(优选5.0.0版本或更新版本)的Needle程序中所实施的Needleman-Wunsch算法(Needleman和Wunsch,1970,J.Mol.Biol.[分子生物学杂志]48:443-453)来确定两个氨基酸序列之间的序列同一性。使用的参数是缺口开放罚分10、缺口延伸罚分0.5、以及EBLOSUM62(BLOSUM62的EMBOSS版本)取代矩阵。使用Needle标记的“最长同一性”的输出(使用-nobrief选项获得)作为同一性百分比并且计算如下:
(同一的残基X 100)/(比对长度-比对中的空位总数)。
术语“变体”意指在一个或多个(例如,若干个)位置处包括改变(即,取代、插入、和/或缺失)的具有磷脂酶C活性的多肽。取代意指用不同的氨基酸替代占用某一位置的氨基酸;缺失意指去除占用某一位置的氨基酸;并且插入意指在邻接并且紧随占用某一位置的氨基酸之后添加氨基酸。
可以在步骤(a)中以有效增加SSF步骤(b)和(c)或发酵步骤(c)期间发酵产物得率,例如尤其是增加乙醇得率的量添加和/或存在磷脂酶C。
在一个实施例中,将磷脂酶C(例如尤其是埃默森青霉菌磷脂酶C,或其变体)以约0.1-50,000μg EP(酶蛋白)/g DS(例如,10,000μg EP(酶蛋白)/g DS,或者尤其是例如5-1000μg EP/g DS)的浓度提供到液化中。
在一个实施例中,将磷脂酶C(例如尤其是哈茨木霉磷脂酶C,或其变体)以约0.1-50,000μg EP(酶蛋白)/g DS(例如,10,000μg EP(酶蛋白)/g DS,或者尤其是例如5-1000μg EP/g DS)的浓度提供到液化中。
在一个实施例中,将磷脂酶C(例如尤其是Rasamsonia eburnea磷脂酶C,或其变体)以约0.1-50,000μg EP(酶蛋白)/g DS(例如,10,000μg EP(酶蛋白)/g DS,或者尤其是例如5-1000μg EP/g DS)的浓度提供到液化中。
任选地,可以将内切葡聚糖酶(例如,热稳定性内切葡聚糖酶)、半纤维素酶(例如,木聚糖酶,优选热稳定性木聚糖酶)、蛋白酶、碳水化合物源产生酶(例如,葡糖淀粉酶,优选热稳定性葡糖淀粉酶)、支链淀粉酶,和/或植酸酶,在液化步骤(a)期间存在和/或添加。酶可以单独地添加或作为一种或多种共混组合物添加。在一些实施例中,液化步骤(a)在不存在蛋白酶的情况下进行。
在一些实施例中,葡糖淀粉酶包含具有以下突变的草酸青霉菌(Penicillium oxalicum)葡糖淀粉酶的变体:K79V+P2N+P4S+P11F+T65A+Q327F(使用本文中的SEQ ID NO:3进行编号)。
B.糖化步骤(b)
液化步骤(a)之后是步骤(b)中的糊精的糖化。
在一个实施例中,本披露的方法可以包含预糖化步骤,即在步骤(a)之后,但是在糖化步骤(b)之前,在30℃-65℃之间的温度下进行40分钟-90分钟。
根据本披露,糖化步骤(b)可以在从20℃-75℃之间,优选地从40℃-70℃之间,例如60℃左右的温度下,并且在4和5之间的pH下进行。
在一个优选的实施例中,发酵步骤(c)或同时糖化和发酵(SSF)(即组合的步骤(b)和(c))可以在20℃-60℃之间,优选地25℃-40℃之间,例如约32℃的温度下进行。在一个实施例中,发酵步骤(c)或同时糖化和发酵(SSF)持续6小时至120小时,具体地是24小时至96小时。
根据本披露,在糖化步骤(b)和/或发酵步骤(c)或同时糖化步骤(b)和发酵步骤(c)(SSF)期间存在和/或添加碳水化合物源产生酶,优选地葡糖淀粉酶。
术语“碳水化合物源产生酶”包括产生可发酵糖的任何酶。碳水化合物源产生酶能够产生可以被讨论中的一种或多种发酵生物体用作能源的碳水化合物,例如,当用于本披露的用于生产乙醇的方法中时。产生的碳水化合物可以直接或间接地转化成希望的发酵产物,优选乙醇。根据本披露,可以使用碳水化合物源产生酶的混合物。
碳水化合物源产生酶活性的具体实例包括葡糖淀粉酶(其为葡萄糖生产者)、β-淀粉酶和产麦芽糖淀粉酶(其为麦芽糖生产者)。“产麦芽糖α-淀粉酶”(葡聚糖1,4-α-麦芽糖水解酶,E.C.3.2.1.133)能将直链淀粉和支链淀粉水解成α-构型的麦芽糖。来自嗜热脂肪芽孢杆菌菌株NCIB 11837的产麦芽糖淀粉酶可商购自诺维信公司。产麦芽糖α-淀粉酶描述于美国专利号4,598,048、4,604,355和6,162,628中,将其通过引用而特此结合。在一个优选的实施例中,能以0.05-5mg总蛋白/克DS或0.05-5MANU/g DS的量添加产麦芽糖淀粉酶。
在一个优选实施例中,碳水化合物源产生酶是葡糖淀粉酶。
可以使用任何合适的葡糖淀粉酶进行本披露的方法,包括步骤(b)和/或(c)。葡糖淀粉酶可以具有任何来源,特别的是真菌来源。
考虑的葡糖淀粉酶包括选自下组的那些,该组由以下组成:曲霉属(Aspergillus)葡糖淀粉酶,特别是黑曲霉(A.niger)G1或G2葡糖淀粉酶(Boel等人(1984),欧洲分子生物学学会杂志(EMBO J.)3(5),第1097-1102页),或其变体,例如披露于WO 92/00381、WO 00/04136和WO 01/04273中的那些(来自诺维信公司,丹麦);披露于WO 84/02921中的泡盛曲霉(A.awamori)葡糖淀粉酶,米曲霉(A.oryzae)葡糖淀粉酶(农业、生物学与化学(Agric.Biol.Chem.)(1991),55(4),第941-949页),或其变体或片段。其他曲霉属葡糖淀粉酶变体包括具有增强的热稳定性的变体:G137A和G139A(Chen等人,(1996),蛋白质工程(Prot.Eng.)9:499-505);D257E和D293E/Q(陈等人,(1995),蛋白质工程8:575-582);N182(陈等人,(1994),生物化学杂志(Biochem.J.)301:275-281);二硫键,A246C(Fierobe等人,(1996),生物化学(Biochemistry)35:8698-8704);以及在位置A435和S436中引入Pro残基(Li等人,(1997),蛋白质工程(Protein Eng.)10:1199-1204)。
其他考虑的葡糖淀粉酶包括衍生自阿太菌属(Athelia)的菌株,优选是衍生自罗耳阿太菌(Athelia rolfsii)(以前命名为罗尔伏革菌(Corticium rolfsii))的菌株的葡糖淀粉酶(参见美国专利号4,727,026和Nagasaka等人,(1998),“来自罗尔伏革菌的生淀粉降解葡糖淀粉酶的纯化和特性”(“Purification and properties of the raw-starch-degrading glucoamylases from Corticium rolfsii”)应用微生物学与生物技术(Appl.Microbiol.Biotechnol.)50:323-330),篮状菌属(Talaromyces)葡糖淀粉酶,特别是衍生自埃默森篮状菌(Talaromyces emersonii)(WO 99/28448)、Talaromyces leycettanus(美国专利登记号32,153)、Talaromyces duponti、以及嗜热篮状菌(Talaromyces thermophilus)(美国专利号4,587,215)的葡糖淀粉酶。还考虑的是里氏木霉(Trichoderma reesei)葡糖淀粉酶,包括披露于WO 2006/060062中的SEQ ID NO:4的葡糖淀粉酶,和与其至少80%或至少90%同一性的葡糖淀粉酶(通过引用特此结合)。
在一个实施例中,葡糖淀粉酶衍生自曲霉属的菌株,优选黑曲霉、泡盛曲霉、或米曲霉;或衍生自木霉属的菌株,优选地里氏木霉;或衍生自篮状菌属的菌株,优选地埃默森篮状菌。
在一个实施例中,在糖化步骤(b)和/或发酵步骤(c)期间存在和/或添加的葡糖淀粉酶具有真菌来源,例如来自密孔菌属(Pycnoporus)的菌株,或褐褶菌属(Gloephyllum)的菌株。在一个实施例中,葡糖淀粉酶是衍生自密孔菌属的菌株,特别是描述于WO 2011/066576中的血红密孔菌(Pycnoporus sanguineus)的菌株(SEQ ID NO 2、4或6),例如示出为WO2011/066576中的SEQ ID NO:4的菌株。
在一个优选的实施例中,葡糖淀粉酶是衍生自粘褶菌属(Gloeophyllum)的菌株,如篱边粘褶菌(Gloeophyllum sepiarium)或密粘褶菌(Gloeophyllum trabeum)的菌株,特别是如在WO 2011/068803中描述的粘褶菌属的菌株(SEQ ID NO:2、4、6、8、10、12、14或16)。在一个优选的实施例中,葡糖淀粉酶是示出于WO 2011/068803中的SEQ ID NO:2中的篱边粘褶菌。
其他考虑的葡糖淀粉酶包括衍生自栓菌属(Trametes)的菌株,优选地是披露于WO 2006/069289(将其通过引用而结合在此)中的SEQ ID NO:34中的瓣环栓菌(Trametes cingulata)的菌株的葡糖淀粉酶。
考虑的细菌葡糖淀粉酶包括来自梭菌属(Clostridium),特别是热解淀粉梭菌(C.thermoamylolyticum)(EP 135,138)、和热硫化氢梭菌(C.thermohydrosulfuricum)(WO 86/01831)的葡糖淀粉酶。
可商购的包含葡糖淀粉酶的组合物包括AMG 200L;AMG 300L;SANTM SUPER、SANTMEXTRA L、SPIRIZYMETM PLUS、SPIRIZYMETM FUEL、SPIRIZYMETM ULTRA、SPIRIZYMETM EXCEL、SPIRIZYMETM ACHIEVE、SPIRIZYMETM B4U和AMGTM E(来自诺维信公司);OPTIDEXTM 300(来自杰能科国际公司);AMIGASETM 和AMIGASETM PLUS(来自帝斯曼公司);G-ZYMETM G900、G-ZYMETM 和G990ZR(来自杰能科公司)。
在一个实施例中,可以按0.02-20AGU/g DS,优选0.05-5AGU/g DS(在全酒糟中),尤其是0.1-2AGU/g DS之间的量添加葡糖淀粉酶。
可以按有效量,优选在从0.001mg-1mg酶蛋白/g DS,优选0.01mg-0.5mg酶蛋白/g干固体(DS)的范围内,添加葡糖淀粉酶。
任选地,可以在糖化步骤(b)和/或发酵步骤(c)期间添加α-淀粉酶(EC 3.2.1.1)。α-淀粉酶可以具有任何来源,但是典型地是丝状真菌来源的。根据本披露,在糖化和/或发酵期间添加的α-淀粉酶典型地是真菌酸性α-淀粉酶。
真菌酸性α-淀粉酶可以是衍生自曲霉属(Aspergillus)菌株的酸性真菌α-淀粉酶,例如米曲霉(Aspergillus oryzae)和黑曲霉(Aspergillus niger)。
合适的真菌酸性α-淀粉酶是衍生自黑曲霉菌株的α-淀粉酶。在一个优选的实施例中,真菌酸性α-淀粉酶是来自在Swiss-prot/TeEMBL数据库中在主入藏号P56271下披露为“AMYA_ASPNG”并且在WO 89/01969(实例3)中进行更详细描述的黑曲霉的α-淀粉酶。酸性黑曲霉酸性α-淀粉酶还在WO 2004/080923(诺维信)中示出为SEQ ID NO:1,将其通过引用结合在此。还考虑了与WO 2004/080923中的SEQ ID NO:1具有至少70%同一性、例如至少80%或甚至至少90%同一性、例如至少95%、至少96%、至少97%、至少98%、或至少99%同一性的所述酸性真菌淀粉酶的变体。合适的可商购的衍生自黑曲霉的酸性真菌α-淀粉酶是SP288(可获得自诺维信公司,丹麦)。
真菌酸性α-淀粉酶还可以是野生型酶,其包含碳水化合物结合模块(CBM)和α-淀粉酶催化结构域(即,非杂合体),或其变体。在一个实施例中,野生型真菌酸性α-淀粉酶衍生自一种白曲霉(Aspergillus kawachii)的菌株。
考虑的杂合α-淀粉酶的具体实例包括具有黑曲霉葡糖淀粉酶接头和淀粉结合结构域(SBD)的微小根毛酶(Rhizomucor pusillus)α-淀粉酶(其在美国申请号11/316,535中作为氨基酸序列SEQ ID NO:20、SEQ ID NO:72和SEQ ID NO:96的组合披露于表5)(通过引用特此结合)。在另一个实施例中,杂合真菌酸性α-淀粉酶是具有罗耳阿太菌葡糖淀粉酶接头和SBD(US 60/638,614中的SEQ ID NO:102)(通过引用特此结合)的大型亚灰树花菌(Meripilus giganteus)α-淀粉酶。考虑的杂合α-淀粉酶的其他具体实例包括披露于美国专利申请号2005/0054071中的那些,包括披露于15页表3中的那些,例如具有白曲霉接头和淀粉结合域的黑曲霉α-淀粉酶。
在一个优选的实施例中,真菌酸性α-淀粉酶是在WO 2013/006756中披露的包括以下变体的真菌酸性α-淀粉酶:具有黑曲霉葡糖淀粉酶接头和淀粉结合结构域(SBD)的微小根毛霉α-淀粉酶变体,所述α-淀粉酶进一步包含以下取代或取代组合中的至少一个:D165M;Y141W;Y141R;K136F;K192R;P224A;P224R;S123H+Y141W;G20S+Y141W;A76G+Y141W;G128D+Y141W;G128D+D143N;P219C+Y141W;N142D+D143N;Y141W+K192R;Y141W+D143N;Y141W+N383R;Y141W+P219C+A265C;Y141W+N142D+D143N;Y141W+K192R V410A;G128D+Y141W+D143N;Y141W+D143N+P219C;Y141W+D143N+K192R;G128D+D143N+K192R;Y141W+D143N+K192R+P219C;G128D+Y141W+D143N+K192R;或G128D+Y141W+D143N+K192R+P219C。
酸性α-淀粉酶可以根据本披露以0.1到10AFAU/g DS、优选0.10到5AFAU/g DS、尤其是0.3到2AFAU/g DS的量添加。
C.发酵生物体
术语“发酵生物体”是指适合用于发酵过程中并且能够生产所希望的发酵产物的任何生物体,包括细菌和真菌生物体,尤其是酵母。
用于发酵步骤(c)或同时糖化和发酵(即,SSF)中的、将发酵培养基中的可发酵糖转化成发酵产物(例如尤其是乙醇)的发酵生物体的实例包括真菌生物体,例如尤其是酵母。优选的酵母包括酵母属的菌株,特别是酿酒酵母(Saccharomyces cerevisiae)。
在发酵(如SSF)过程中,有活力的发酵生物体的合适的浓度在本领域是众所周知的,或可以由本领域的技术人员容易地确定。在一个实施例中,将发酵生物体(如乙醇发酵酵母(例如,酿酒酵母))添加至发酵培养基中,使得每mL的发酵培养基的有活力的发酵生物体(如酵母)计数在从105至1012,优选从107至1010的范围内,尤其是约5x 107个。
“发酵培养基”(Fermentation media)是指于其中进行发酵的环境。发酵培养基包括发酵底物,即被发酵生物体代谢的碳水化合物源。根据本披露,发酵培养基可以包含用于一种或多种发酵生物体的营养素和一种或多种生长刺激剂。营养素和生长刺激剂是发酵领域中广泛使用的,且包括氮源例如氨;尿素、维生素和矿物质或其组合。
可商购的酵母的实例包括,例如,RED START 和ETHANOL REDTM酵母(可获得自富酶泰斯公司/乐斯福公司(Fermentis/Lesaffre),美国)、FALI(可获得自弗莱希曼酵母公司(Fleischmann’s Yeast),美国)、SUPERSTART和THERMOSACCTM新鲜酵母(可获得自乙醇技术公司(Ethanol Technology),威斯康星州,美国)、BIOFERM AFT和XR(可获得自NABC-北美生物制品公司(North American Bioproducts Corporation),佐治亚州,美国)、GERT STRAND(可获得自格特·斯特兰德公司(Gert Strand AB),瑞典)以及FERMIOL(可获得自帝斯曼特殊产品公司(DSM Specialties))。
D.含淀粉材料
根据本披露,任何适合的含淀粉材料可以作为起始材料使用。适合在本披露的方法中使用的含淀粉材料的实例包括全谷粒、玉米、小麦、大麦、黑麦、蜀黍、西米、木薯、木薯粉、高粱、稻、豌豆、豆类、或甜薯、或其混合物、或者由其衍生的淀粉、或谷类。还考虑了糯型与非糯型的玉米与大麦。
在一个优选的实施例中,用于发酵产物生产的,例如尤其是乙醇生产的含淀粉材料是玉米或小麦。
E.发酵产物
术语“发酵产物”意指通过包括使用发酵生物体进行的发酵步骤在内的方法生产的产物。根据本发明考虑的发酵产物包括醇(例如,乙醇、甲醇、丁醇;多元醇如甘油、山梨醇和肌醇);有机酸(例如,柠檬酸、乙酸、衣康酸、乳酸、丁二酸、葡糖酸);酮(例如,丙酮);氨基酸(例如,谷氨酸);气体(例如,H2和CO2);抗生素(例如,青霉素和四环素);酶;维生素(例如,核黄素、B12、β-胡萝卜素);和激素。在一个优选的实施例中,所述发酵产物是乙醇,例如,燃料乙醇;饮用乙醇,即中性饮用酒精;或用于消费性醇工业(例如,啤酒和酒)、乳品工业(例如,发酵的乳制品)、皮革工业和烟草工业的工业乙醇或产物。优选的啤酒类型包含爱尔啤酒(ale)、烈性黑啤酒(stout)、波特啤酒(porter)、拉格啤酒(lager)、苦啤酒(bitter)、麦芽酒(malt liquor)、低麦芽啤酒(happoushu)、高醇啤酒、低醇啤酒、低热量啤酒或清淡啤酒。优选地,本披露的方法是用于生产醇,例如乙醇。根据本披露获得的发酵产物(例如乙醇)可以用作典型地与汽油共混的燃料。然而,在乙醇的情况中,它还可以用作饮用乙醇。
F.回收
发酵、或SSF之后,可以将发酵产物与发酵培养基分开。可以蒸馏浆料以提取所希望的发酵产物(例如,乙醇)。可替代地,可以通过微滤或膜过滤技术从发酵培养基中提取所希望的发酵产物。还可以通过汽提或本领域熟知的其他方法来回收发酵产物。
III.在液化期间使用磷脂酶C以增加发酵产物得率。
在又一个方面,本披露涉及在发酵产物生产过程的液化期间使用磷脂酶C以增加发酵产物得率(例如,乙醇得率)的用途。
任何磷脂酶C,例如上文描述的磷脂酶C,都可用于乙醇生产方法的液化步骤中以增加乙醇得率。在优选的实施例中,用于液化步骤的磷脂酶C与本文中的SEQ ID NO:2的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%、优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%的同一性,优选地衍生自青霉属的菌株,例如埃默森青霉菌的菌株。
IV.本披露优选的实施例的实例
在一个优选的实施例中,本披露涉及用于从含淀粉材料生产乙醇的方法,所述方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在70℃-100℃之间范围内的温度下,使用以下来液化含淀粉材料:
-衍生自嗜热脂肪芽孢杆菌的α-淀粉酶;
-磷脂酶C,优选地具有至少约80℃的熔点(DSC);
(b)使用葡糖淀粉酶进行糖化;和
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.5-6.2之间范围内的pH下,在高于初始糊化温度的温度下,使用以下来液化含淀粉材料:
-α-淀粉酶,优选衍生自嗜热脂肪芽孢杆菌,在pH 4.5、85℃、0.12mM CaCl2下具有至少10的T1/2(min);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC);
(b)使用葡糖淀粉酶进行糖化;和
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在70℃-100℃之间的温度下,使用以下来液化含淀粉材料:
-细菌α-淀粉酶,优选地衍生自嗜热脂肪芽孢杆菌,在pH 4.5、85℃、0.12mM CaCl2下具有至少10的T1/2(min);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC);
(b)使用葡糖淀粉酶进行糖化;和
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在高于初始糊化温度的温度下,使用以下来液化含淀粉材料:
-SEQ ID NO:1示出的α-淀粉酶,具有在位置R179+G180或I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-E129V+K177L+R179E;
-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;
-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S;
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC),例如与本文的SEQ ID NO:2的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在高于初始糊化温度的温度下,使用以下来液化含淀粉材料:
-SEQ ID NO:1示出的α-淀粉酶,具有在位置R179+G180或I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-E129V+K177L+R179E;
-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;
-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S;
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC),例如与本文的SEQ ID NO:7的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在高于初始糊化温度的温度下,使用以下来液化含淀粉材料:
-SEQ ID NO:1示出的α-淀粉酶,具有在位置R179+G180或I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-E129V+K177L+R179E;
-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;
-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S;
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC),例如与本文的SEQ ID NO:8的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在高于初始糊化温度的温度下,使用以下来液化含淀粉材料:
-SEQ ID NO:1示出的α-淀粉酶,具有在位置R179+G180或I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-E129V+K177L+R179E;
-V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;
-E129V+K177L+R179E+K220P+N224L+S242Q+Q254S;
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC),例如与本文的SEQ ID NO:9的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在70℃-100℃之间的温度下,使用以下来液化含淀粉材料:
-衍生自嗜热脂肪芽孢杆菌的α-淀粉酶,具有在位置I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-
V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;或者
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC);例如与本文中的SEQ ID NO:2的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;和
-任选地本文的SEQ ID NO:3的草酸青霉菌葡糖淀粉酶,优选地具有选自下组的取代:
-K79V;或者
-K79V+P11F+T65A+Q327F;或者
-K79V+P2N+P4S+P11F+T65A+Q327F(使用本文的SEQ ID NO:3进行编号);
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在70℃-100℃之间的温度下,使用以下来液化含淀粉材料:
-衍生自嗜热脂肪芽孢杆菌的α-淀粉酶,具有在位置I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-
V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;或者
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC);例如与本文中的SEQ ID NO:7的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;和
-任选地本文的SEQ ID NO:3的草酸青霉菌葡糖淀粉酶,优选地具有选自下组的取代:
-K79V;或者
-K79V+P11F+T65A+Q327F;或者
-K79V+P2N+P4S+P11F+T65A+Q327F(使用本文的SEQ ID NO:3进行编号);
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在70℃-100℃之间的温度下,使用以下来液化含淀粉材料:
-衍生自嗜热脂肪芽孢杆菌的α-淀粉酶,具有在位置I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-
V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;或者
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC);例如与本文中的SEQ ID NO:8的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;和
-任选地本文的SEQ ID NO:3的草酸青霉菌葡糖淀粉酶,优选地具有选自下组的取代:
-K79V;或者
-K79V+P11F+T65A+Q327F;或者
-K79V+P2N+P4S+P11F+T65A+Q327F(使用本文的SEQ ID NO:3进行编号);
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在一个优选的实施例中,本披露的方法包含以下步骤:
(a)在4.0-6.5之间范围内的pH下,在70℃-100℃之间的温度下,使用以下来液化含淀粉材料:
-衍生自嗜热脂肪芽孢杆菌的α-淀粉酶,具有在位置I181+G182处的双缺失、和任选的取代N193F、以及任选地以下取代集合中的另一种取代:
-
V59A+Q89R+E129V+K177L+R179E+H208Y+K220P+N224L+Q254S;或者
-V59A+Q89R+E129V+K177L+R179E+Q254S+M284V(使用SEQ ID NO:1进行编号);
-磷脂酶C,优选地具有至少约80℃的熔点(DSC);例如与本文中的SEQ ID NO:9的多肽的成熟部分具有至少60%,例如至少70%、例如至少75%同一性,优选至少80%、更优选至少85%、更优选至少90%、更优选至少91%、更优选至少92%、甚至更优选至少93%、最优选至少94%、并且甚至最优选至少95%、例如甚至至少96%、至少97%、至少98%、至少99%、例如100%同一性的磷脂酶C;和
-任选地本文的SEQ ID NO:3的草酸青霉菌葡糖淀粉酶,优选地具有选自下组的取代:
-K79V;或者
-K79V+P11F+T65A+Q327F;或者
-K79V+P2N+P4S+P11F+T65A+Q327F(使用本文的SEQ ID NO:3进行编号);
(b)使用葡糖淀粉酶进行糖化;
(c)使用发酵生物体进行发酵。
在另一个优选的实施例中,本披露涉及生产乙醇的方法,所述方法包括:
(a)使用如SEQ ID NO:1示出的α-淀粉酶或与SEQ ID NO:1具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的α-淀粉酶将含淀粉材料液化;
(b)使用碳水化合物源产生酶,特别是葡糖淀粉酶,糖化所液化的含淀粉材料以形成可发酵糖;
(c)使用发酵生物体将可发酵糖发酵成乙醇;
其中在步骤(a)期间存在和/或添加如SEQ ID NO:2示出的磷脂酶C或与SEQ ID NO:2具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的磷脂酶C。
在另一个优选的实施例中,本披露涉及生产乙醇的方法,所述方法包括:
(a)使用如SEQ ID NO:1示出的α-淀粉酶或与SEQ ID NO:1具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的α-淀粉酶将含淀粉材料液化;
(b)使用碳水化合物源产生酶,特别是葡糖淀粉酶,糖化所液化的含淀粉材料以形成可发酵糖;
(c)使用发酵生物体将可发酵糖发酵成乙醇;
其中在步骤(a)期间存在和/或添加如SEQ ID NO:7示出的磷脂酶C或与SEQ ID NO:7具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的磷脂酶C。
在另一个优选的实施例中,本披露涉及生产乙醇的方法,所述方法包括:
(a)使用如SEQ ID NO:1示出的α-淀粉酶或与SEQ ID NO:1具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的α-淀粉酶将含淀粉材料液化;
(b)使用碳水化合物源产生酶,特别是葡糖淀粉酶,糖化所液化的含淀粉材料以形成可发酵糖;
(c)使用发酵生物体将可发酵糖发酵成乙醇;
其中在步骤(a)期间存在和/或添加如SEQ ID NO:8示出的磷脂酶C或与SEQ ID NO:8具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的磷脂酶C。
在另一个优选的实施例中,本披露涉及生产乙醇的方法,所述方法包括:
(a)使用如SEQ ID NO:1示出的α-淀粉酶或与SEQ ID NO:1具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的α-淀粉酶将含淀粉材料液化;
(b)使用碳水化合物源产生酶,特别是葡糖淀粉酶,糖化所液化的含淀粉材料以形成可发酵糖;
(c)使用发酵生物体将可发酵糖发酵成乙醇;
其中在步骤(a)期间存在和/或添加如SEQ ID NO:9示出的磷脂酶C或与SEQ ID NO:9具有至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%的序列同一性的磷脂酶C。
在一个优选的实施例中,在发酵或同时糖化和发酵期间存在和/或添加纤维素酶或纤维素分解酶组合物。
在一个优选的实施例中,在发酵或同时糖化和发酵(SSF)期间存在和/或添加衍生自里氏木霉的纤维素酶或纤维素分解酶组合物。
在一个优选的实施例中,在发酵或同时糖化和发酵期间存在和/或添加纤维素酶或纤维素分解酶组合物和葡糖淀粉酶。
在一个实施例中,纤维素酶或纤维素分解酶组合物衍生自里氏木霉、特异腐质霉(Humicola insolens)、拉克淖金孢子菌(Chrysosporium lucknowense)、或斜卧青霉(Penicillium decumbens)。
在此描述并要求保护的披露并不局限于本文所披露的具体实施例的范围,因为这些实施例都旨在作为本披露几个方面的说明。任何等同的实施例都旨在处于本披露的范围之内。实际上,除了本文示出的和描述的那些之外,对于本领域的技术人员而言本披露的各种修改将从前述的说明书变得显而易见。此类修改也旨在落入所附权利要求书的范围内。在冲突的情况下,以包括定义的本披露为准。在此引用了不同的参考,其披露通过引用以其全部内部结合在此。进一步通过以下实例来描述本披露,所述实例不应理解为限制了本披露的范围。
材料和方法
α-淀粉酶369(AA369):嗜热脂肪芽孢杆菌α-淀粉酶,具有突变:I181*+G182*+N193F+V59A+Q89R+E129V+K177L+R179E+Q254S+M284V,截短至491个氨基酸(本文的SEQ ID NO:1)。
磷脂酶C(PePLC):埃默森青霉菌磷脂酶C(本文的SEQ ID NO:2)。
葡糖淀粉酶SA(GSA):包含如下的共混物:在WO 99/28448中披露为SEQ ID NO:34或在本文中披露为SEQ ID NO:4的埃默森篮状菌葡糖淀粉酶、在WO 06/69289中披露为SEQ ID NO:2或在本文中披露为SEQ ID NO:5的瓣环栓菌葡糖淀粉酶、以及在本文中披露为SEQ ID NO:6的具有黑曲霉葡糖淀粉酶接头和淀粉结合结构域(SBD)的具有以下取代G128D+D143N的微小根毛霉α-淀粉酶(AGU:AGU:FAU-F中活度比为约20:5:1)。
酵母:ETHANOL REDTM,商购自美国红星/乐斯福公司(Red Star/Lesaffre,USA)。
通过差示扫描量热法确定Td。
使用VP-毛细管差示扫描量热仪(微量热公司(MicroCal Inc.),皮斯卡塔韦,新泽西州,美国),在大约0.5mg/ml蛋白质浓度下,在pH 4.0、pH 5.5、和pH 7.0通过差示扫描量热法(DSC)确定磷脂酶C(PePLC)的热稳定性。在200K/小时的恒定的程序化加热速率下,在加热缓冲液中的酶溶液后获得的热分析图(Cp对比T)中,热变性温度Td(℃)取自变性峰(主要的吸热峰)的顶端。将样品溶液和参比溶液(大约0.2ml)从10℃下的储存条件下装载到量热仪中(参比溶液:不具有酶的缓冲液),并且在20℃下热预平衡20分钟,随后从20℃至100℃进行DSC扫描。以大约+/-1℃的精确度确定变性温度(Td)。在PePLC的这些条件下获得的Td是90(pH 4.0)、88(pH 5.5)、和83(pH 7.0)。
使用VP-毛细管差示扫描量热仪(微量热公司(MicroCal Inc.),皮斯卡塔韦,新泽西州,美国)通过差示扫描量热法(DSC)确定Harzianum(U49A3)的热稳定性。在200K/小时的恒定的程序化加热速率下,在加热缓冲液(50mM乙酸盐缓冲液,pH 5.0)中的酶溶液(大约0.5mg/ml)后获得的热分析图(Cp对比T)中,热变性温度Td(℃)取自变性峰(主要的吸热峰)的顶端。
将样品溶液和参比溶液(大约0.2ml)从10℃下的储存条件下装载到量热仪中(参比溶液:不具有酶的缓冲液),并且在20℃下热预平衡20分钟,随后从20℃至100℃进行DSC扫描。以大约+/-1℃的精确度确定变性温度。在这些条件下所获得的U49A3的Td为79℃。
使用VP-毛细管差示扫描量热仪(微量热公司(MicroCal Inc.),皮斯卡塔韦,新泽西州,美国)通过差示扫描量热法(DSC)确定Rasamsonia(U4BCJ)的热稳定性。在200K/小时的恒定的程序化加热速率下,在加热缓冲液(50mM乙酸盐缓冲液,pH 5.5)中的酶溶液(大约0.5mg/ml)后获得的热分析图(Cp对T)中,热变性温度Td(℃)取自变性峰(主要的吸热峰)的顶端。
将样品溶液和参比溶液(大约0.2ml)从10℃下的储存条件下装载到量热仪中(参比溶液:不具有酶的缓冲液),并且在20℃下热预平衡20分钟,随后从20℃至100℃进行DSC扫描。以大约+/-1℃的精确度确定变性温度。在这些条件下所获得的U4BCJ的Td为82℃。
实例-热稳定性磷脂酶C在液化中增加乙醇得率的用途
在100g规模上使用磨碎的玉米和从不同的工业玉米乙醇设备获得的回流进行液化以用于实验。所述的玉米粉的干固体(%DS)为85.70%,并且回流的干固体为8.67%,均由Mettler-Toledo HB43卤素水分天平(halogen moisture balance)确定。为了液化玉米粉,将34.89g玉米粉与30g回流和35.11g自来水一起称量到200mL Lab-O-Mat罐中以达到32.5%的%DS。将玉米浆料的pH调节至5.0,用于液化。
将α-淀粉酶(AA369)用于液化。另外,来自埃默森青霉菌的热稳定性磷脂酶C(PLC)以两个剂量,10μg EP/g DS和50μg EP/g DS进行评估。向每个罐加入适当量的下表1示出的稀释的酶。α-淀粉酶基于研磨玉米的重量加入,并且PLC基于玉米浆料和%DS的总重量加入。添加酶后,关闭并密封罐,充分振荡,然后放入Mathis Lab-O-Mat中。使用的程序从室温开始,以6℃/min的速度升温12分钟,直至达到80℃。然后将温度控制在85℃持续105分钟,总共运行1小时57分钟。在程序期间,将罐以45rpm来回旋转。
表1:液化中的酶剂量
Lab-O-Mat孵育后,取出罐并在室温水浴中冷却15分钟。一旦罐被冷却,使用刮刀将尽可能多的材料移除到相应的标记的烧杯中。获得液化物(liquefact)重量以制备每种醪液至200ppm尿素和3ppm青霉素,并且如果需要,使用40%H2SO4将pH调节至5。在33.90%DS的Mettler-Toledo水分天平上测量仅α-淀粉酶液化物的%DS。这个%DS被用来计算所有处理的剂量,一式三份运行。为了准备发酵,将大约5克液化物等分到适当数量的15mL能肯公司(Nunc)掀盖式管中。通过在添加醪液之前和之后对管进行称重来计算添加的醪液的精确重量。给每个管添加适当量的稀释葡糖淀粉酶SA(GSA)。实际的葡糖淀粉酶剂量为0.6AGU/g DS,并添加去离子水以使所有管的%DS标准化以进行直接比较。每个管添加100μl乙醇红再水合酵母(用自来水再水合),通过在盖上钻一个1/64”孔排气,然后涡旋。将管放置在32℃的水浴中52小时,但每天取出两次用于涡旋。
发酵52小时后,收集样品用于HPLC分析。通过添加50μL 40%H2SO4(10μL/g玉米醪液)并涡旋以分配酸,该过程从停止酶和酵母反应开始。然后将样品在1430xg下离心10分钟,并将上清液通过0.45μm过滤器过滤到HPLC小瓶中。将样品在4℃储存直至分析。用于确定乙醇和寡糖浓度的系统是与RI检测器偶联的Agilent 1100/1200 HPLC系统。分离柱是BioRad Aminex HPX-87H离子排阻柱(300mm x 7.8mm)。
结果
通过添加磷脂酶C,将最终乙醇和乙醇增加百分比总结在下表2中。
表2:总结的乙醇得率和百分比变化结果
序列表
<110> 诺维信公司(Novozymes A/S)
Kreel, Nathaniel E.
<120> 使用磷脂酶C增加发酵产物得率的方法
<130> 14249-WO-PCT
<160> 9
<170> PatentIn 版本 3.5
<210> 1
<211> 515
<212> PRT
<213> 嗜热脂肪芽孢杆菌
<400> 1
Ala Ala Pro Phe Asn Gly Thr Met Met Gln Tyr Phe Glu Trp Tyr Leu
1 5 10 15
Pro Asp Asp Gly Thr Leu Trp Thr Lys Val Ala Asn Glu Ala Asn Asn
20 25 30
Leu Ser Ser Leu Gly Ile Thr Ala Leu Trp Leu Pro Pro Ala Tyr Lys
35 40 45
Gly Thr Ser Arg Ser Asp Val Gly Tyr Gly Val Tyr Asp Leu Tyr Asp
50 55 60
Leu Gly Glu Phe Asn Gln Lys Gly Thr Val Arg Thr Lys Tyr Gly Thr
65 70 75 80
Lys Ala Gln Tyr Leu Gln Ala Ile Gln Ala Ala His Ala Ala Gly Met
85 90 95
Gln Val Tyr Ala Asp Val Val Phe Asp His Lys Gly Gly Ala Asp Gly
100 105 110
Thr Glu Trp Val Asp Ala Val Glu Val Asn Pro Ser Asp Arg Asn Gln
115 120 125
Glu Ile Ser Gly Thr Tyr Gln Ile Gln Ala Trp Thr Lys Phe Asp Phe
130 135 140
Pro Gly Arg Gly Asn Thr Tyr Ser Ser Phe Lys Trp Arg Trp Tyr His
145 150 155 160
Phe Asp Gly Val Asp Trp Asp Glu Ser Arg Lys Leu Ser Arg Ile Tyr
165 170 175
Lys Phe Arg Gly Ile Gly Lys Ala Trp Asp Trp Glu Val Asp Thr Glu
180 185 190
Asn Gly Asn Tyr Asp Tyr Leu Met Tyr Ala Asp Leu Asp Met Asp His
195 200 205
Pro Glu Val Val Thr Glu Leu Lys Asn Trp Gly Lys Trp Tyr Val Asn
210 215 220
Thr Thr Asn Ile Asp Gly Phe Arg Leu Asp Ala Val Lys His Ile Lys
225 230 235 240
Phe Ser Phe Phe Pro Asp Trp Leu Ser Tyr Val Arg Ser Gln Thr Gly
245 250 255
Lys Pro Leu Phe Thr Val Gly Glu Tyr Trp Ser Tyr Asp Ile Asn Lys
260 265 270
Leu His Asn Tyr Ile Thr Lys Thr Asn Gly Thr Met Ser Leu Phe Asp
275 280 285
Ala Pro Leu His Asn Lys Phe Tyr Thr Ala Ser Lys Ser Gly Gly Ala
290 295 300
Phe Asp Met Arg Thr Leu Met Thr Asn Thr Leu Met Lys Asp Gln Pro
305 310 315 320
Thr Leu Ala Val Thr Phe Val Asp Asn His Asp Thr Glu Pro Gly Gln
325 330 335
Ala Leu Gln Ser Trp Val Asp Pro Trp Phe Lys Pro Leu Ala Tyr Ala
340 345 350
Phe Ile Leu Thr Arg Gln Glu Gly Tyr Pro Cys Val Phe Tyr Gly Asp
355 360 365
Tyr Tyr Gly Ile Pro Gln Tyr Asn Ile Pro Ser Leu Lys Ser Lys Ile
370 375 380
Asp Pro Leu Leu Ile Ala Arg Arg Asp Tyr Ala Tyr Gly Thr Gln His
385 390 395 400
Asp Tyr Leu Asp His Ser Asp Ile Ile Gly Trp Thr Arg Glu Gly Val
405 410 415
Thr Glu Lys Pro Gly Ser Gly Leu Ala Ala Leu Ile Thr Asp Gly Pro
420 425 430
Gly Gly Ser Lys Trp Met Tyr Val Gly Lys Gln His Ala Gly Lys Val
435 440 445
Phe Tyr Asp Leu Thr Gly Asn Arg Ser Asp Thr Val Thr Ile Asn Ser
450 455 460
Asp Gly Trp Gly Glu Phe Lys Val Asn Gly Gly Ser Val Ser Val Trp
465 470 475 480
Val Pro Arg Lys Thr Thr Val Ser Thr Ile Ala Arg Pro Ile Thr Thr
485 490 495
Arg Pro Trp Thr Gly Glu Phe Val Arg Trp Thr Glu Pro Arg Leu Val
500 505 510
Ala Trp Pro
515
<210> 2
<211> 610
<212> PRT
<213> 埃默森青霉菌
<220>
<221> 信号
<222> (1)..(16)
<220>
<221> 成熟肽
<222> (17)..(610)
<400> 2
Met Arg Val Leu Ala Leu Ile Ala Ala Leu Ala Thr Val Ala Thr Ala
-15 -10 -5 -1
Ser Ala Pro Tyr Asp Lys Arg Asp Leu Ala Gln Glu Ile Trp Asp Asp
1 5 10 15
Ile Lys Asn Ala Val Asp Cys Ala Gly Cys Gln Val Val Leu Thr Ala
20 25 30
Leu Lys Gly Val Ala Asp Leu Gly Thr Thr Ala Leu Val Asp Val Leu
35 40 45
Thr Glu Val Cys Asn Ile Ser Gly Lys Glu Asp Ser Asp Val Cys Ser
50 55 60
Gly Ile Ile Ser Arg Glu Gly Pro Val Leu Asp Tyr Val Leu Gln His
65 70 75 80
Leu Asp Ile Gly Ser His Thr Ser Gln Val Ile Cys Ala Ser Ala Phe
85 90 95
Gly Leu Cys Gln Tyr Pro Glu Val Arg Pro Tyr Asn Leu Thr Phe Pro
100 105 110
Lys Pro Lys Pro Asn Thr Thr Arg Pro Glu Pro Ser Gly Glu Ser Pro
115 120 125
Ile Gln Val Val His Phe Ser Asp Thr His Val Asp Leu Ser Tyr Glu
130 135 140
Thr Gly Ser Asn Tyr Asn Cys Thr Lys Pro Ile Cys Cys Arg Pro Tyr
145 150 155 160
Thr Ala Glu Asp Ala Pro Gly Asn Thr Thr Thr Pro Cys Gly Pro Tyr
165 170 175
Gly Asn Thr Lys Cys Asp Ala Pro Leu Ser Leu Glu Glu Ser Met Phe
180 185 190
Ala Ala Ile Lys Ala Leu Asn Pro Gln Pro Ala Phe Ser Ile Tyr Thr
195 200 205
Gly Asp Val Val Ala His Asp Ile Trp Leu Val Asp Gln Asn Glu Val
210 215 220
Ile Glu Asp Leu Asn Ala Thr Tyr Asp Arg Met Ala Gly Leu Gly Leu
225 230 235 240
Val Tyr Ala Ala Ile Gly Asn His Asp Thr Ala Pro Val Asn Asp Leu
245 250 255
Pro Thr Ser Asn Ile Pro Ser Glu Tyr Ser Ala Asn Trp Thr Tyr Glu
260 265 270
Ala Leu Ser Tyr Asp Phe Thr Met Leu Thr Gln Ser Ala Ser Ala Gln
275 280 285
Thr Ala Ala Asn Tyr Gly Ser Tyr Ser Ala Ile Tyr Pro Gly Ser Tyr
290 295 300
Gly Thr Asp Leu Arg Val Ile Ser Tyr Asn Ser Ile Phe Tyr Tyr Val
305 310 315 320
Asp Asn Phe Trp Ala Tyr Gln Asp Pro Met Glu Phe Asp Pro Asp Gly
325 330 335
Gln Leu Ala Trp Leu Ile Asn Glu Leu Gln Glu Ala Glu Thr Ala Gly
340 345 350
Gln Arg Val Trp Ile Ile Ala His Val Pro Thr Gly Thr Ser Asp His
355 360 365
Phe His Asp Tyr Ser His Tyr Phe Asp Gln Ile Val Gln Arg Tyr Glu
370 375 380
Ala Thr Ile Ala Ala Leu Phe Tyr Gly His Thr His Ile Asp Gln Phe
385 390 395 400
Gln Ile Ser Tyr Ser Asn Tyr Ser Asn Arg Ala Phe Asp Thr Ala Thr
405 410 415
Ala Ile Gly Tyr Ile Met Pro Ser Leu Thr Pro Thr Ser Gly Pro Pro
420 425 430
Thr Phe Arg Val Tyr Asp Val Asp Pro Lys Thr Phe Ala Val Leu Asp
435 440 445
Phe Thr Asn Tyr Ile Ala Asn Ile Ser Asp Pro Ala Phe Gln Ser Gly
450 455 460
Pro Ser Trp Gln Lys Tyr Tyr Ser Ala Lys Glu Thr Tyr Gly Ser Leu
465 470 475 480
Leu Ser Pro Pro Val Thr Asp Pro Thr Ala Glu Leu Thr Pro Ala Phe
485 490 495
Trp His Asn Val Thr Val Ala Phe Glu Gln Asp Asn Ala Thr Phe Gln
500 505 510
Glu Tyr Trp Ala Arg Gln Thr Arg Gly Tyr Asp Val Ser Ser Cys Thr
515 520 525
Gly Ser Cys Ile Thr Gln Ala Ile Cys Gly Leu Arg Ala Gly Asp Ala
530 535 540
Gln Tyr Asn Cys Val Thr Pro Thr Pro Gly Phe Asn Phe Ala Lys Arg
545 550 555 560
Asp Thr Ser Asn Pro Lys Gln Ala Leu Ser His Val Glu Lys Cys Glu
565 570 575
Gly Ser Gly Leu Leu Gly Leu Leu Arg Arg Met Val Ala Asp Ser Lys
580 585 590
Ser Ser
<210> 3
<211> 595
<212> PRT
<213> 草酸青霉菌
<400> 3
Arg Pro Asp Pro Lys Gly Gly Asn Leu Thr Pro Phe Ile His Lys Glu
1 5 10 15
Gly Glu Arg Ser Leu Gln Gly Ile Leu Asp Asn Leu Gly Gly Arg Gly
20 25 30
Lys Lys Thr Pro Gly Thr Ala Ala Gly Leu Phe Ile Ala Ser Pro Asn
35 40 45
Thr Glu Asn Pro Asn Tyr Tyr Tyr Thr Trp Thr Arg Asp Ser Ala Leu
50 55 60
Thr Ala Lys Cys Leu Ile Asp Leu Phe Glu Asp Ser Arg Ala Lys Phe
65 70 75 80
Pro Ile Asp Arg Lys Tyr Leu Glu Thr Gly Ile Arg Asp Tyr Lys Ser
85 90 95
Ser Gln Ala Ile Leu Gln Ser Val Ser Asn Pro Ser Gly Thr Leu Lys
100 105 110
Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Ile Asp Leu Asn Pro
115 120 125
Phe Ser Gly Ala Trp Gly Arg Pro Gln Arg Asp Gly Pro Ala Leu Arg
130 135 140
Ala Thr Ala Met Ile Thr Tyr Ala Asn Tyr Leu Ile Ser His Gly Gln
145 150 155 160
Lys Ser Asp Val Ser Gln Val Met Trp Pro Ile Ile Ala Asn Asp Leu
165 170 175
Ala Tyr Val Gly Gln Tyr Trp Asn Asn Thr Gly Phe Asp Leu Trp Glu
180 185 190
Glu Val Asp Gly Ser Ser Phe Phe Thr Ile Ala Val Gln His Arg Ala
195 200 205
Leu Val Glu Gly Ser Gln Leu Ala Lys Lys Leu Gly Lys Ser Cys Asp
210 215 220
Ala Cys Asp Ser Gln Pro Pro Gln Ile Leu Cys Phe Leu Gln Ser Phe
225 230 235 240
Trp Asn Gly Lys Tyr Ile Thr Ser Asn Ile Asn Thr Gln Ala Ser Arg
245 250 255
Ser Gly Ile Asp Leu Asp Ser Val Leu Gly Ser Ile His Thr Phe Asp
260 265 270
Pro Glu Ala Ala Cys Asp Asp Ala Thr Phe Gln Pro Cys Ser Ala Arg
275 280 285
Ala Leu Ala Asn His Lys Val Tyr Val Asp Ser Phe Arg Ser Ile Tyr
290 295 300
Lys Ile Asn Ala Gly Leu Ala Glu Gly Ser Ala Ala Asn Val Gly Arg
305 310 315 320
Tyr Pro Glu Asp Val Tyr Gln Gly Gly Asn Pro Trp Tyr Leu Ala Thr
325 330 335
Leu Gly Ala Ser Glu Leu Leu Tyr Asp Ala Leu Tyr Gln Trp Asp Arg
340 345 350
Leu Gly Lys Leu Glu Val Ser Glu Thr Ser Leu Ser Phe Phe Lys Asp
355 360 365
Phe Asp Ala Thr Val Lys Ile Gly Ser Tyr Ser Arg Asn Ser Lys Thr
370 375 380
Tyr Lys Lys Leu Thr Gln Ser Ile Lys Ser Tyr Ala Asp Gly Phe Ile
385 390 395 400
Gln Leu Val Gln Gln Tyr Thr Pro Ser Asn Gly Ser Leu Ala Glu Gln
405 410 415
Tyr Asp Arg Asn Thr Ala Ala Pro Leu Ser Ala Asn Asp Leu Thr Trp
420 425 430
Ser Phe Ala Ser Phe Leu Thr Ala Thr Gln Arg Arg Asp Ala Val Val
435 440 445
Pro Pro Ser Trp Gly Ala Lys Ser Ala Asn Lys Val Pro Thr Thr Cys
450 455 460
Ser Ala Ser Pro Val Val Gly Thr Tyr Lys Ala Pro Thr Ala Thr Phe
465 470 475 480
Ser Ser Lys Thr Lys Cys Val Pro Ala Lys Asp Ile Val Pro Ile Thr
485 490 495
Phe Tyr Leu Ile Glu Asn Thr Tyr Tyr Gly Glu Asn Val Phe Met Ser
500 505 510
Gly Asn Ile Thr Ala Leu Gly Asn Trp Asp Ala Lys Lys Gly Phe Pro
515 520 525
Leu Thr Ala Asn Leu Tyr Thr Gln Asp Gln Asn Leu Trp Phe Ala Ser
530 535 540
Val Glu Phe Ile Pro Ala Gly Thr Pro Phe Glu Tyr Lys Tyr Tyr Lys
545 550 555 560
Val Glu Pro Asn Gly Asp Ile Thr Trp Glu Lys Gly Pro Asn Arg Val
565 570 575
Phe Val Ala Pro Thr Gly Cys Pro Val Gln Pro His Ser Asn Asp Val
580 585 590
Trp Gln Phe
595
<210> 4
<211> 618
<212> PRT
<213> 埃默森篮状菌
<400> 4
Met Ala Ser Leu Val Ala Gly Ala Leu Cys Ile Leu Gly Leu Thr Pro
1 5 10 15
Ala Ala Phe Ala Arg Ala Pro Val Ala Ala Arg Ala Thr Gly Ser Leu
20 25 30
Asp Ser Phe Leu Ala Thr Glu Thr Pro Ile Ala Leu Gln Gly Val Leu
35 40 45
Asn Asn Ile Gly Pro Asn Gly Ala Asp Val Ala Gly Ala Ser Ala Gly
50 55 60
Ile Val Val Ala Ser Pro Ser Arg Ser Asp Pro Asn Tyr Phe Tyr Ser
65 70 75 80
Trp Thr Arg Asp Ala Ala Leu Thr Ala Lys Tyr Leu Val Asp Ala Phe
85 90 95
Ile Ala Gly Asn Lys Asp Leu Glu Gln Thr Ile Gln Gln Tyr Ile Ser
100 105 110
Ala Gln Ala Lys Val Gln Thr Ile Ser Asn Pro Ser Gly Asp Leu Ser
115 120 125
Thr Gly Gly Leu Gly Glu Pro Lys Phe Asn Val Asn Glu Thr Ala Phe
130 135 140
Thr Gly Pro Trp Gly Arg Pro Gln Arg Asp Gly Pro Ala Leu Arg Ala
145 150 155 160
Thr Ala Leu Ile Ala Tyr Ala Asn Tyr Leu Ile Asp Asn Gly Glu Ala
165 170 175
Ser Thr Ala Asp Glu Ile Ile Trp Pro Ile Val Gln Asn Asp Leu Ser
180 185 190
Tyr Ile Thr Gln Tyr Trp Asn Ser Ser Thr Phe Asp Leu Trp Glu Glu
195 200 205
Val Glu Gly Ser Ser Phe Phe Thr Thr Ala Val Gln His Arg Ala Leu
210 215 220
Val Glu Gly Asn Ala Leu Ala Thr Arg Leu Asn His Thr Cys Ser Asn
225 230 235 240
Cys Val Ser Gln Ala Pro Gln Val Leu Cys Phe Leu Gln Ser Tyr Trp
245 250 255
Thr Gly Ser Tyr Val Leu Ala Asn Phe Gly Gly Ser Gly Arg Ser Gly
260 265 270
Lys Asp Val Asn Ser Ile Leu Gly Ser Ile His Thr Phe Asp Pro Ala
275 280 285
Gly Gly Cys Asp Asp Ser Thr Phe Gln Pro Cys Ser Ala Arg Ala Leu
290 295 300
Ala Asn His Lys Val Val Thr Asp Ser Phe Arg Ser Ile Tyr Ala Ile
305 310 315 320
Asn Ser Gly Ile Ala Glu Gly Ser Ala Val Ala Val Gly Arg Tyr Pro
325 330 335
Glu Asp Val Tyr Gln Gly Gly Asn Pro Trp Tyr Leu Ala Thr Ala Ala
340 345 350
Ala Ala Glu Gln Leu Tyr Asp Ala Ile Tyr Gln Trp Lys Lys Ile Gly
355 360 365
Ser Ile Ser Ile Thr Asp Val Ser Leu Pro Phe Phe Gln Asp Ile Tyr
370 375 380
Pro Ser Ala Ala Val Gly Thr Tyr Asn Ser Gly Ser Thr Thr Phe Asn
385 390 395 400
Asp Ile Ile Ser Ala Val Gln Thr Tyr Gly Asp Gly Tyr Leu Ser Ile
405 410 415
Val Glu Lys Tyr Thr Pro Ser Asp Gly Ser Leu Thr Glu Gln Phe Ser
420 425 430
Arg Thr Asp Gly Thr Pro Leu Ser Ala Ser Ala Leu Thr Trp Ser Tyr
435 440 445
Ala Ser Leu Leu Thr Ala Ser Ala Arg Arg Gln Ser Val Val Pro Ala
450 455 460
Ser Trp Gly Glu Ser Ser Ala Ser Ser Val Pro Ala Val Cys Ser Ala
465 470 475 480
Thr Ser Ala Thr Gly Pro Tyr Ser Thr Ala Thr Asn Thr Val Trp Pro
485 490 495
Ser Ser Gly Ser Gly Ser Ser Thr Thr Thr Ser Ser Ala Pro Cys Thr
500 505 510
Thr Pro Thr Ser Val Ala Val Thr Phe Asp Glu Ile Val Ser Thr Ser
515 520 525
Tyr Gly Glu Thr Ile Tyr Leu Ala Gly Ser Ile Pro Glu Leu Gly Asn
530 535 540
Trp Ser Thr Ala Ser Ala Ile Pro Leu Arg Ala Asp Ala Tyr Thr Asn
545 550 555 560
Ser Asn Pro Leu Trp Tyr Val Thr Val Asn Leu Pro Pro Gly Thr Ser
565 570 575
Phe Glu Tyr Lys Phe Phe Lys Asn Gln Thr Asp Gly Thr Ile Val Trp
580 585 590
Glu Asp Asp Pro Asn Arg Ser Tyr Thr Val Pro Ala Tyr Cys Gly Gln
595 600 605
Thr Thr Ala Ile Leu Asp Asp Ser Trp Gln
610 615
<210> 5
<211> 574
<212> PRT
<213> 瓣环栓菌
<400> 5
Met Arg Phe Thr Leu Leu Thr Ser Leu Leu Gly Leu Ala Leu Gly Ala
1 5 10 15
Phe Ala Gln Ser Ser Ala Ala Asp Ala Tyr Val Ala Ser Glu Ser Pro
20 25 30
Ile Ala Lys Ala Gly Val Leu Ala Asn Ile Gly Pro Ser Gly Ser Lys
35 40 45
Ser Asn Gly Ala Lys Ala Gly Ile Val Ile Ala Ser Pro Ser Thr Ser
50 55 60
Asn Pro Asn Tyr Leu Tyr Thr Trp Thr Arg Asp Ser Ser Leu Val Phe
65 70 75 80
Lys Ala Leu Ile Asp Gln Phe Thr Thr Gly Glu Asp Thr Ser Leu Arg
85 90 95
Thr Leu Ile Asp Glu Phe Thr Ser Ala Glu Ala Ile Leu Gln Gln Val
100 105 110
Pro Asn Pro Ser Gly Thr Val Ser Thr Gly Gly Leu Gly Glu Pro Lys
115 120 125
Phe Asn Ile Asp Glu Thr Ala Phe Thr Asp Ala Trp Gly Arg Pro Gln
130 135 140
Arg Asp Gly Pro Ala Leu Arg Ala Thr Ala Ile Ile Thr Tyr Ala Asn
145 150 155 160
Trp Leu Leu Asp Asn Lys Asn Thr Thr Tyr Val Thr Asn Thr Leu Trp
165 170 175
Pro Ile Ile Lys Leu Asp Leu Asp Tyr Val Ala Ser Asn Trp Asn Gln
180 185 190
Ser Thr Phe Asp Leu Trp Glu Glu Ile Asn Ser Ser Ser Phe Phe Thr
195 200 205
Thr Ala Val Gln His Arg Ala Leu Arg Glu Gly Ala Thr Phe Ala Asn
210 215 220
Arg Ile Gly Gln Thr Ser Val Val Ser Gly Tyr Thr Thr Gln Ala Asn
225 230 235 240
Asn Leu Leu Cys Phe Leu Gln Ser Tyr Trp Asn Pro Thr Gly Gly Tyr
245 250 255
Ile Thr Ala Asn Thr Gly Gly Gly Arg Ser Gly Lys Asp Ala Asn Thr
260 265 270
Val Leu Thr Ser Ile His Thr Phe Asp Pro Ala Ala Gly Cys Asp Ala
275 280 285
Val Thr Phe Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val
290 295 300
Tyr Val Asp Ala Phe Arg Ser Ile Tyr Ser Ile Asn Ser Gly Ile Ala
305 310 315 320
Ser Asn Ala Ala Val Ala Thr Gly Arg Tyr Pro Glu Asp Ser Tyr Met
325 330 335
Gly Gly Asn Pro Trp Tyr Leu Thr Thr Ser Ala Val Ala Glu Gln Leu
340 345 350
Tyr Asp Ala Leu Ile Val Trp Asn Lys Leu Gly Ala Leu Asn Val Thr
355 360 365
Ser Thr Ser Leu Pro Phe Phe Gln Gln Phe Ser Ser Gly Val Thr Val
370 375 380
Gly Thr Tyr Ala Ser Ser Ser Ser Thr Phe Lys Thr Leu Thr Ser Ala
385 390 395 400
Ile Lys Thr Phe Ala Asp Gly Phe Leu Ala Val Asn Ala Lys Tyr Thr
405 410 415
Pro Ser Asn Gly Gly Leu Ala Glu Gln Tyr Ser Arg Ser Asn Gly Ser
420 425 430
Pro Val Ser Ala Val Asp Leu Thr Trp Ser Tyr Ala Ala Ala Leu Thr
435 440 445
Ser Phe Ala Ala Arg Ser Gly Lys Thr Tyr Ala Ser Trp Gly Ala Ala
450 455 460
Gly Leu Thr Val Pro Thr Thr Cys Ser Gly Ser Gly Gly Ala Gly Thr
465 470 475 480
Val Ala Val Thr Phe Asn Val Gln Ala Thr Thr Val Phe Gly Glu Asn
485 490 495
Ile Tyr Ile Thr Gly Ser Val Pro Ala Leu Gln Asn Trp Ser Pro Asp
500 505 510
Asn Ala Leu Ile Leu Ser Ala Ala Asn Tyr Pro Thr Trp Ser Ile Thr
515 520 525
Val Asn Leu Pro Ala Ser Thr Thr Ile Glu Tyr Lys Tyr Ile Arg Lys
530 535 540
Phe Asn Gly Ala Val Thr Trp Glu Ser Asp Pro Asn Asn Ser Ile Thr
545 550 555 560
Thr Pro Ala Ser Gly Thr Phe Thr Gln Asn Asp Thr Trp Arg
565 570
<210> 6
<211> 583
<212> PRT
<213> 微小根毛酶
<400> 6
Ala Thr Ser Asp Asp Trp Lys Gly Lys Ala Ile Tyr Gln Leu Leu Thr
1 5 10 15
Asp Arg Phe Gly Arg Ala Asp Asp Ser Thr Ser Asn Cys Ser Asn Leu
20 25 30
Ser Asn Tyr Cys Gly Gly Thr Tyr Glu Gly Ile Thr Lys His Leu Asp
35 40 45
Tyr Ile Ser Gly Met Gly Phe Asp Ala Ile Trp Ile Ser Pro Ile Pro
50 55 60
Lys Asn Ser Asp Gly Gly Tyr His Gly Tyr Trp Ala Thr Asp Phe Tyr
65 70 75 80
Gln Leu Asn Ser Asn Phe Gly Asp Glu Ser Gln Leu Lys Ala Leu Ile
85 90 95
Gln Ala Ala His Glu Arg Asp Met Tyr Val Met Leu Asp Val Val Ala
100 105 110
Asn His Ala Gly Pro Thr Ser Asn Gly Tyr Ser Gly Tyr Thr Phe Gly
115 120 125
Asp Ala Ser Leu Tyr His Pro Lys Cys Thr Ile Asp Tyr Asn Asp Gln
130 135 140
Thr Ser Ile Glu Gln Cys Trp Val Ala Asp Glu Leu Pro Asp Ile Asp
145 150 155 160
Thr Glu Asn Ser Asp Asn Val Ala Ile Leu Asn Asp Ile Val Ser Gly
165 170 175
Trp Val Gly Asn Tyr Ser Phe Asp Gly Ile Arg Ile Asp Thr Val Lys
180 185 190
His Ile Arg Lys Asp Phe Trp Thr Gly Tyr Ala Glu Ala Ala Gly Val
195 200 205
Phe Ala Thr Gly Glu Val Phe Asn Gly Asp Pro Ala Tyr Val Gly Pro
210 215 220
Tyr Gln Lys Tyr Leu Pro Ser Leu Ile Asn Tyr Pro Met Tyr Tyr Ala
225 230 235 240
Leu Asn Asp Val Phe Val Ser Lys Ser Lys Gly Phe Ser Arg Ile Ser
245 250 255
Glu Met Leu Gly Ser Asn Arg Asn Ala Phe Glu Asp Thr Ser Val Leu
260 265 270
Thr Thr Phe Val Asp Asn His Asp Asn Pro Arg Phe Leu Asn Ser Gln
275 280 285
Ser Asp Lys Ala Leu Phe Lys Asn Ala Leu Thr Tyr Val Leu Leu Gly
290 295 300
Glu Gly Ile Pro Ile Val Tyr Tyr Gly Ser Glu Gln Gly Phe Ser Gly
305 310 315 320
Gly Ala Asp Pro Ala Asn Arg Glu Val Leu Trp Thr Thr Asn Tyr Asp
325 330 335
Thr Ser Ser Asp Leu Tyr Gln Phe Ile Lys Thr Val Asn Ser Val Arg
340 345 350
Met Lys Ser Asn Lys Ala Val Tyr Met Asp Ile Tyr Val Gly Asp Asn
355 360 365
Ala Tyr Ala Phe Lys His Gly Asp Ala Leu Val Val Leu Asn Asn Tyr
370 375 380
Gly Ser Gly Ser Thr Asn Gln Val Ser Phe Ser Val Ser Gly Lys Phe
385 390 395 400
Asp Ser Gly Ala Ser Leu Met Asp Ile Val Ser Asn Ile Thr Thr Thr
405 410 415
Val Ser Ser Asp Gly Thr Val Thr Phe Asn Leu Lys Asp Gly Leu Pro
420 425 430
Ala Ile Phe Thr Ser Ala Thr Gly Gly Thr Thr Thr Thr Ala Thr Pro
435 440 445
Thr Gly Ser Gly Ser Val Thr Ser Thr Ser Lys Thr Thr Ala Thr Ala
450 455 460
Ser Lys Thr Ser Thr Ser Thr Ser Ser Thr Ser Cys Thr Thr Pro Thr
465 470 475 480
Ala Val Ala Val Thr Phe Asp Leu Thr Ala Thr Thr Thr Tyr Gly Glu
485 490 495
Asn Ile Tyr Leu Val Gly Ser Ile Ser Gln Leu Gly Asp Trp Glu Thr
500 505 510
Ser Asp Gly Ile Ala Leu Ser Ala Asp Lys Tyr Thr Ser Ser Asp Pro
515 520 525
Leu Trp Tyr Val Thr Val Thr Leu Pro Ala Gly Glu Ser Phe Glu Tyr
530 535 540
Lys Phe Ile Arg Ile Glu Ser Asp Asp Ser Val Glu Trp Glu Ser Asp
545 550 555 560
Pro Asn Arg Glu Tyr Thr Val Pro Gln Ala Cys Gly Thr Ser Thr Ala
565 570 575
Thr Val Thr Asp Thr Trp Arg
580
<210> 7
<211> 643
<212> PRT
<213> 哈茨木霉
<400> 7
Met Arg Pro Ser Ser Thr Leu Ser Leu Leu Ala Leu Gly Ser Val Ala
1 5 10 15
Gln Ala Ala Val Ser Leu Glu Asp Ser Ser Leu Ser Pro Arg Glu Ile
20 25 30
Glu Asn Ile Glu Arg Ala Ile Glu Ala Arg Ser Leu Ala Asp Asp Ile
35 40 45
Trp Asn Asp Ile Lys Asn Ala Ala Thr Cys Thr Ala Cys Gln Gly Ile
50 55 60
Leu Val Leu Leu Lys Gly Ile Ala Val Phe Gly Asp Gly Ala Phe Val
65 70 75 80
Ser Val Ala Thr Glu Leu Cys Lys Leu Ala Lys Val Glu Asp Asp Asp
85 90 95
Val Cys Glu Gly Thr Val Gly Leu Glu Gly Pro Ile Ile Ala Asp Ala
100 105 110
Ile Arg Asn Met Asp Leu Gly Ser Asp Thr Ser Lys Leu Phe Cys Gly
115 120 125
Ser Phe Leu Gly Leu Cys Pro Glu Pro Ser Val Pro Gln Trp Lys Ile
130 135 140
Pro Phe Pro Ser Pro Lys Pro Gln Thr Gly Arg Pro Ala Pro Ser Gly
145 150 155 160
Lys Thr Pro Leu Lys Val Val Gln Tyr Ser Asp Ile His Ile Asp Pro
165 170 175
Leu Tyr Val Ser Gly Ser Ser Ser Asn Cys Thr Lys Pro Ile Cys Cys
180 185 190
Arg Pro Tyr Thr Ala Ala Asp Glu Pro Gly Lys Ser Thr Ser Pro Ala
195 200 205
Gly Pro Asn Gly Asp His Lys Cys Asp Thr Pro Val Gly Leu Glu Ile
210 215 220
Ser Met Tyr Gln Ala Ile Lys Asn Ile Val Pro Asp Ala Ala Leu Thr
225 230 235 240
Leu Phe Thr Gly Asp Ile Val Asp His Ala Ile Trp Asn Thr Ser Gln
245 250 255
Pro Tyr Asn Gln Lys Gln Ile Ser Asp Ala Tyr Thr Tyr Met Ser Gln
260 265 270
Tyr Leu Gly Ile Val Tyr Gly Thr Ala Gly Asn His Glu Ser Asn Pro
275 280 285
Thr Asn Ala Phe Pro Pro Arg Ser Ile Ser Asn Ser Ser Gln Trp Val
290 295 300
Tyr Asp Ala Leu Ser Asp Gln Trp Thr Arg Trp Val Gly Ala Ser Ala
305 310 315 320
Glu Ser Glu Ile Glu Ser Ile Gly Ala Tyr Ser Thr Lys Tyr Pro Asn
325 330 335
Gly Asn Leu Arg Val Ile Ser Leu Asn Thr Asn Phe Tyr Tyr Arg Met
340 345 350
Asn Phe Trp Leu Tyr Gln Glu Asp Ile Glu Gln Asp Pro Asp Gly Gln
355 360 365
Ile Gln Trp Leu Val Asn Glu Leu Asp Ala Ala Glu Lys Ala Gly Glu
370 375 380
Arg Val Tyr Ile Ile Gly His Met Pro Leu Gly Glu Gly Asp Ala Phe
385 390 395 400
His Ala Gly Ser Asn Tyr Leu Asp Gln Val Val Asn Arg Tyr Ser Ser
405 410 415
Thr Ile Ala Ala Met Phe Phe Gly His Thr His Val Asp His Phe Glu
420 425 430
Val Ser Tyr Ser Asp Tyr Asn Ser Arg Asp Ala Ser His Ala Val Met
435 440 445
Ala Ser Tyr Ile Cys Pro Ser Leu Thr Pro Thr Ser Gly Met Pro Ser
450 455 460
Phe Arg Val Tyr Asp Val Asp Pro Glu Thr Phe Ala Val Leu Asp Thr
465 470 475 480
Thr Thr Tyr Ile Ala Asp Met Thr Asn Ala Asp Phe Gln Thr Thr Gly
485 490 495
Pro Val Trp Thr Lys Leu Tyr Ser Ala Lys Glu Thr Tyr Gly Ser Lys
500 505 510
Leu Asn Pro Pro Val Thr Asp Ala Ser Val Glu Leu Thr Pro Ala Phe
515 520 525
Trp His Asn Val Thr Ala Leu Phe Glu Ser Asn Ser Asp Val Phe Asn
530 535 540
Glu Tyr Ile Ser Leu Lys Ser Arg Gly Trp Asn Val Ala Ser Cys Thr
545 550 555 560
Gly Asp Cys Lys Thr Gln Glu Leu Cys Gln Leu Arg Ala Gly Arg Ser
565 570 575
Glu Asn Asn Cys Val Val Pro Ser Ile Gly Leu His Leu Asn Lys Arg
580 585 590
Ser Asp Glu Leu His Gly His Ser His His Arg Ser His Asp His Gln
595 600 605
Glu Cys Gly Met Ser Ala Gly Met Lys Thr Leu Gly Ser Leu Ala Val
610 615 620
Arg Lys Asp Leu Leu Asp Glu Leu Glu Ser Arg Ala Asn Glu Leu Lys
625 630 635 640
Ala Lys Ala
<210> 8
<211> 645
<212> PRT
<213> 哈茨木霉
<400> 8
Met Arg Pro Ser Ser Thr Leu Ser Leu Leu Ala Leu Gly Ser Val Ala
1 5 10 15
Gln Ala Ala Val Ser Leu Glu Asn Ser Ser Leu Pro Pro Arg Asp Ile
20 25 30
Glu Asn Ile Glu Arg Ala Ile Glu Ala Arg Ser Leu Ala Asp Asp Ile
35 40 45
Trp Asn Asp Ile Lys Asn Ala Ala Thr Cys Thr Ala Cys Gln Gly Ile
50 55 60
Leu Val Leu Leu Lys Gly Ile Ala Val Phe Gly Asp Gly Ala Phe Val
65 70 75 80
Ser Val Ala Thr Glu Leu Cys Lys Leu Ala Lys Val Glu Asp Asp Asp
85 90 95
Val Cys Glu Gly Thr Val Gly Leu Glu Gly Pro Ile Ile Ala Asp Ala
100 105 110
Ile Arg Asn Met Asp Leu Gly Ser Asp Thr Ser Lys Leu Phe Cys Gly
115 120 125
Ser Phe Leu Gly Leu Cys Pro Glu Pro Ser Val Pro Gln Trp Lys Ile
130 135 140
Pro Phe Pro Ser Pro Lys Pro Gln Thr Gly Arg Pro Ala Pro Ser Gly
145 150 155 160
Lys Thr Pro Leu Lys Val Val Gln Tyr Ser Asp Ile His Ile Asp Pro
165 170 175
Leu Tyr Val Ser Gly Ser Ser Ser Asn Cys Thr Lys Pro Ile Cys Cys
180 185 190
Arg Pro Tyr Thr Ala Ala Asp Glu Pro Gly Lys Ser Thr Ser Pro Ala
195 200 205
Gly Pro Asn Gly Asp His Lys Cys Asp Thr Pro Val Gly Leu Glu Ile
210 215 220
Ser Met Tyr Gln Ala Ile Lys Asn Ile Val Pro Asp Ala Ala Leu Thr
225 230 235 240
Leu Phe Thr Gly Asp Ile Val Asp His Ala Ile Trp Asn Thr Ser Gln
245 250 255
Pro Tyr Asn Gln Lys Gln Ile Ser Asp Ala Tyr Thr Tyr Met Ser Gln
260 265 270
Tyr Leu Gly Ile Val Tyr Gly Thr Ala Gly Asn His Glu Ser Asn Pro
275 280 285
Thr Asn Ala Phe Pro Pro Arg Ser Ile Ser Asn Ser Ser Gln Trp Val
290 295 300
Tyr Asp Ala Leu Ser Asp Gln Trp Thr Arg Trp Val Gly Ala Ser Ala
305 310 315 320
Glu Ser Glu Ile Glu Ser Ile Gly Ala Tyr Ser Thr Lys Tyr Pro Asn
325 330 335
Gly Asn Leu Arg Val Ile Ser Leu Asn Thr Asn Phe Tyr Tyr Arg Met
340 345 350
Asn Phe Trp Leu Tyr Gln Glu Gly Ile Glu Gln Asp Pro Asp Gly Gln
355 360 365
Ile Gln Trp Leu Val Ser Glu Leu Asp Ala Ala Glu Lys Ala Gly Glu
370 375 380
Arg Val Tyr Ile Ile Gly His Met Pro Leu Gly Glu Gly Asp Ala Phe
385 390 395 400
His Ala Gly Ser Asn Tyr Leu Asp Gln Val Val Asn Arg Tyr Ser Ser
405 410 415
Thr Ile Ala Ala Met Phe Phe Gly His Thr His Val Asp His Phe Glu
420 425 430
Val Ser Tyr Ser Asp Tyr Asn Ser Arg Asp Ala Ser His Ala Val Met
435 440 445
Ala Ser Tyr Ile Cys Pro Ser Leu Thr Pro Thr Ser Gly Met Pro Ser
450 455 460
Phe Arg Val Tyr Asp Val Asp Pro Glu Thr Phe Ala Val Leu Asp Thr
465 470 475 480
Thr Thr Tyr Ile Ala Asp Met Thr Asn Ala Asp Phe Gln Thr Thr Gly
485 490 495
Pro Val Trp Thr Lys Leu Tyr Ser Ala Lys Glu Thr Tyr Gly Ser Lys
500 505 510
Leu Asn Pro Pro Val Thr Asp Ala Ser Val Glu Leu Thr Pro Ala Phe
515 520 525
Trp His Asn Val Thr Ala Leu Phe Asp Ser Asn Ser Asp Val Phe Asn
530 535 540
Glu Tyr Ile Ser Leu Lys Ser Arg Gly Trp Asn Val Ala Ser Cys Thr
545 550 555 560
Gly Asp Cys Lys Thr Gln Glu Leu Cys Gln Leu Arg Ala Gly Arg Ser
565 570 575
Glu Asn Asn Cys Val Val Pro Ser Ile Gly Leu His Leu Asn Lys Arg
580 585 590
Ser Asp Glu Leu His Glu His Asp His Ser His His Gly Ser His Asp
595 600 605
His Gln Glu Cys Gly Met Ser Ala Gly Met Lys Thr Leu Gly Ser Leu
610 615 620
Ala Val Arg Lys Asp Leu Leu Asp Glu Leu Glu Thr Arg Ala Asn Glu
625 630 635 640
Leu Lys Ala Lys Ala
645
<210> 9
<211> 611
<212> PRT
<213> Rasamsonia eburnea
<400> 9
Met Arg Ala Phe Leu Ile Thr Ala Leu Ala Ser Leu Ala Thr Ala Ala
1 5 10 15
Gly Ala Thr Tyr Asp Lys Arg Gly Leu Ala Gln Asp Ile Trp Asn Asp
20 25 30
Ile Lys Asn Ala Val Asp Cys Ala Gly Cys Gln Gly Ile Leu Thr Ala
35 40 45
Leu Lys Gly Leu Ser Tyr Leu Gly Thr Thr Ala Phe Val Asp Val Leu
50 55 60
Thr Glu Val Cys Asp Ile Ser Gly Val Glu Asp Ser Asp Val Cys Ser
65 70 75 80
Gly Ile Ile Ser Ser Glu Gly Pro Ala Leu Val Tyr Ile Leu Lys His
85 90 95
Leu Asp Ile Gly Ser His Thr Ser Gln Val Ile Cys Ala Ser Val Phe
100 105 110
Gly Leu Cys Gln Tyr Pro Ala Val Arg Ala Tyr Asn Leu Thr Phe Pro
115 120 125
Ser Pro Lys Pro Asp Lys Thr Cys Pro Glu Pro Ser Gly Glu Ser Pro
130 135 140
Val Gln Ile Val His Phe Ser Asp Thr His Ala Asp Leu Ser Tyr Glu
145 150 155 160
Thr Gly Ser Asn Tyr Asn Cys Thr Lys Pro Ile Cys Cys Arg Ser Tyr
165 170 175
Thr Ala Glu Asp Ala Pro Gly Asn Thr Thr Thr Pro Cys Gly Pro Tyr
180 185 190
Gly Asn Pro Lys Cys Asp Ala Pro Met Ser Leu Glu Glu Ser Met Phe
195 200 205
Ala Ala Ile Lys Ala Leu Ser Pro Gln Pro Ala Phe Ser Ile Tyr Thr
210 215 220
Gly Asp Val Val Ala His Asp Ile Trp Leu Val Asp Gln Asn Glu Val
225 230 235 240
Val Glu Asp Leu Asn Ala Thr Tyr Asp Arg Met Ala Gly Leu Gly Leu
245 250 255
Val Tyr Ala Ala Ile Gly Asn His Asp Thr Ala Pro Val Asn Asn Leu
260 265 270
Pro Thr Ser Asn Ile Pro Ser Gln Tyr Ser Ala Asn Trp Thr Tyr Glu
275 280 285
Ala Leu Glu Tyr His Phe Ser Leu Leu Thr Lys Ser Ala Ser Ala Gln
290 295 300
Thr Ala Glu Asn Tyr Gly Ser Tyr Ser Ser Val Tyr Arg Gly Arg Tyr
305 310 315 320
Gly Thr Asp Leu Arg Val Ile Ser Tyr Asn Ser Ile Phe Tyr Tyr Ile
325 330 335
Ala Asp Phe Trp Ala Tyr Gln Asp Pro Met Leu Tyr Asp Pro Asp Gly
340 345 350
Gln Leu Ala Trp Leu Ile Asn Glu Leu Gln Glu Ala Glu Thr Ala Gly
355 360 365
Gln Arg Val Trp Leu Ile Ala His Val Pro Ser Gly Thr Ala Asp His
370 375 380
Phe His Asp Tyr Ser His Tyr Phe Asp Gln Ile Val Gln Arg Tyr Glu
385 390 395 400
Ala Thr Ile Ala Ala Leu Phe Tyr Gly His Thr His Ile Asp Gln Phe
405 410 415
Gln Ile Ser Tyr Ser Asp Tyr Ser Asn Arg Ala Phe Asp Thr Ala Thr
420 425 430
Ala Ile Gly Tyr Ile Met Pro Ser Met Thr Pro Thr Ser Gly Pro Pro
435 440 445
Thr Phe Arg Val Tyr Asp Val Asp Pro Lys Thr Phe Ala Val Leu Asp
450 455 460
Phe Thr Asn Tyr Ile Ala Asn Ile Ser Asp Pro Ala Tyr Gln Ser Gly
465 470 475 480
Pro Thr Trp Gln Lys Tyr Tyr Ser Ala Lys Glu Ala Tyr Gly Ser Leu
485 490 495
Leu Ser Pro Pro Val Thr Asp Ala Thr Ala Glu Leu Thr Pro Ala Phe
500 505 510
Trp His Asn Val Thr Val Ala Phe Glu Asn Asp Asp Thr Ala Phe Gln
515 520 525
Glu Tyr Trp Ala Arg Gln Thr Arg Gly Tyr Ala Val Ser Ser Cys Thr
530 535 540
Gly Asp Cys Ile Thr Gln Ala Ile Cys Gly Leu Arg Ala Gly Glu Ser
545 550 555 560
Gln His Asn Cys Val Thr Pro Thr Pro Gly Phe Asn Phe Ala Lys Arg
565 570 575
Asp Val Ser Thr Asp Gly Gln Ala Leu Pro His Ile Glu Lys Cys Glu
580 585 590
Gly Ser Gly Leu Met Ala Leu Leu Ala Lys Met Val Ala Ser Asn Arg
595 600 605
Gln Ser Ser
610
- 还没有人留言评论。精彩留言会获得点赞!