用于区分细菌和病毒感染的RNA决定子的制作方法
在本发明的一些实施方案中,本发明涉及与细菌和病毒感染相关的识别标志(signature)和决定子(determinant)的鉴定。更具体地,发现某些RNA决定子在具有细菌和病毒感染的受试者中以统计学显著的方式差异表达。抗生素是世界上最常开处方的药物类型,具有250至300亿美元的全球市场。抗生素也是世界上最滥用的药物,所有药物中的相当大部分(40-70%)被错误地开处方(Linder和Stafford2001;Scott和Cohen2001;Davey,P.和E.Brown等人,2006;Cadieux,G.和R.Tamblyn等人,2007;Pulcini,C.和E.Cua等人2007),(“CDC-GetSmart:FastFactsAboutAntibioticResistance”2011)。一种类型的抗生素滥用是在非细菌性疾病例如病毒感染的情况下施用药物,抗生素对其是无效的。例如,根据美国疾病控制和预防中心CDC,美国每年有超过6000万错误的抗生素处方用于治疗流感。抗生素过量处方(over-prescription)的保健和经济后果包括:(i)全球不必要开处方的抗生素成本,估计每年>100亿美元;(ii)因不必要的抗生素治疗而产生的副作用正在降低保健质量、引起并发症和延长的住院(例如,变态反应、抗生素相关性腹泻、肠内酵母等);和(iii)由于过度使用出现细菌的抗性菌株。微生物病原体对抗生素的抗性在世界范围内以加速的速度增加(“CDC-GetSmart:FastFactsAboutAntibioticResistance”2013;“EuropeanSurveillanceofAntimicrobialConsumptionNetwork(ESAC-Net)”2014;“CDC-AboutAntimicrobialResistance”2013;“ThreatReport2013|AntimicrobialResistance|CDC”2013),伴随着与抗生素抗性病原体引起的感染相关的发病率和死亡率的增加(“ThreatReport2013|AntimicrobialResistance|CDC”2013)。仅在美国,每年至少有200万人感染抗生素抗性细菌,并且至少有23,000人作为这些感染的直接结果而死亡(“ThreatReport2013|AntimicrobialResistance|CDC”2013)。在欧盟,估计每年有400,000名患者表现出抗性细菌菌株,其中25,000名患者死亡(“WHOEurope-DataandStatistics”2014)。因此,世界卫生组织(WorldHealthOrganization)已警告,治疗覆盖率将在10年内不足,从而使世界面临进入“抗生素后时代”的风险,其中抗生素将不再有效对抗感染性疾病(“WHO|AntimicrobialResistance”2013)。CDC认为这一现象是“21世纪世界上最紧迫的健康问题之一”(“CDC-AboutAntimicrobialResistance”2013;Arias和Murray2009)。抗生素处方不足(under-prescription)也不罕见。例如,在美国,高达15%的成年细菌性肺炎住院患者接受延迟的或无Abx治疗,即使在这些情况下,早期治疗可以挽救生命并减少并发症(Houck,P.M.和D.W.Bratzler等人,2002)。用于感染性疾病诊断的技术有可能减少与抗生素滥用相关的相关健康和财务负担。理想地,这种技术应该:(i)准确区分细菌和病毒感染;(ii)迅速(在几分钟内);(iii)能够区分病原菌和作为身体天然菌群一部分的非病原菌;(iv)区分混合性共感染和纯病毒感染;和(v)适用于病原体不可接近的情况(例如,鼻窦炎、肺炎、中耳炎、支气管炎等)。目前的解决方案(例如培养、PCR和免疫测定)不满足所有这些要求:(i)一些测定产生较差的诊断准确性(例如低灵敏度或特异性)(Uyeki等人,2009),并限于有限组的细菌或病毒株;(ii)它们经常需要数小时至数天;(iii)它们不区分病原菌和非病原菌(DelMar,C1992),从而导致假阳性;(iv)它们经常无法区分混合的和纯的病毒感染;和(v)它们需要感染部位的直接取样,其中寻找致病剂的痕迹,从而阻止在病原体位于不可接近组织中的情况下的诊断,所述情况是通常的情况。而且,目前可用的诊断方法经常遭受降低的临床效用,这是因为它们不区分微生物的致病菌株和潜在的定居者(colonizers),其可以作为天然小型生物群的一部分存在而不引起感染(Kim,Shin,和Kim2009;Shin,Han,和Kim2009;Jung,Lee,和Chung2010;Rhedin等人,2014)。例如,Rhedin及同事最近测试了qPCR对急性呼吸道疾病中常见病毒的临床功用(Rhedin等人,2014)。作者断定,由于无症状儿童中的高检出率,应谨慎解释包括鼻病毒、肠道病毒和冠状病毒的几种呼吸道病毒的qPCR检测。在分析了无症状患者中不同细菌菌株的检出率后,其它研究得出了类似的结论(Bogaert,DeGroot和Hermans2004;Spuesens等人,2013)。因此,仍然存在诊断缺口,这进而常常导致医生或是过量处方Abx(“以防万一方法(Just-in-case-approach)”),或是Abx处方不足(“观望方法(Wait-and-see-approach)”)(Little,P.S.和I.Williamson1994;Little,P.2005;Spiro,D.M.和K.Y.Tay等人,2006),这两者都具有影响深远的健康和财务后果。因此,需要一种解决这些挑战的快速方法,其准确地区分细菌、病毒、混合和非感染性疾病患者。一种有可能解决这些挑战的方法依赖于监控宿主对感染的免疫应答,而不是直接的病原体检测(Cohen等人,2015)。细菌诱导的宿主蛋白如降钙素原、C-反应蛋白(CRP)和白细胞介素-6通常用于支持感染的诊断。但是,它们的表现受到患者间变异性的负面影响,包括自症状发作以来的时间、临床综合征和病原体物种(Tang等人,2007;Limper等人,2010;Engel等人,2012;Quenot等人,2013;vanderMeer等人,2005;Falk和Fahey2009)。Oved等人,2015已开发出一种免疫识别标志,其组合了细菌和病毒诱导的循环宿主蛋白,其可以有助于正确诊断具有急性感染的患者。其它
背景技术:
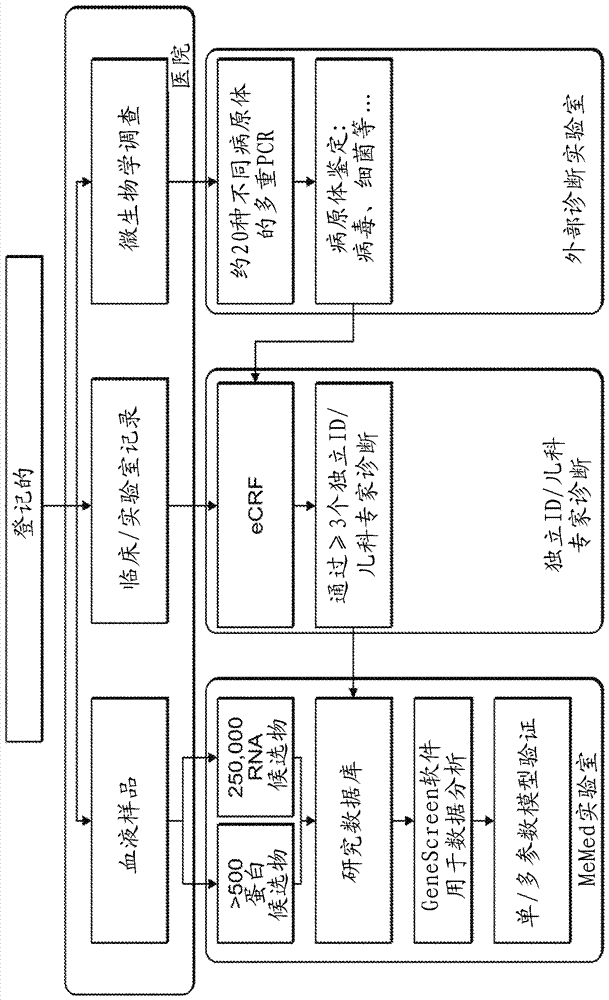
:包括Ramilo等人,Blood,2007年3月1日,Vol109,No.5,第2066-2077页,Zaas等人,SciTranslMed.2013年9月18日;5(203)203ra126.doi:10.1126/scitranslmed.3006280;美国专利申请号20080171323,WO2011/132086和WO2013/117746。发明概述根据本发明的一个方面,提供了一种确定受试者中感染类型的方法,包括测量来自受试者的样品中表1或2中列出的决定子的量,其中所述量指示感染类型。根据本发明的一个方面,提供了一种区分感染性和非感染性受试者的方法,包括测量来自受试者的样品中表16E中列出的决定子的量,其中所述量指示受试者是感染性的还是非感染性的。根据本发明的一个方面,提供了一种确定受试者是具有细菌感染还是具有非细菌感染的方法,包括测量来自受试者的样品中表16D中列出的决定子的量,其中所述量指示受试者是具有细菌感染还是具有非细菌感染。根据本发明的一个方面,提供了一种确定受试者中感染类型的方法,包括测量来自受试者的样品中的至少两种RNA,其中所述至少两种RNA的对在表9、11、12、17或18中列出,其中所述至少两种RNA的量指示感染类型。根据本发明的一个方面,提供了一种确定受试者中感染类型的方法,包括测量来自受试者的样品中的至少三种RNA,其中所述至少三种RNA的三联体在表13、14、19或20中列出,其中所述至少三种RNA的量指示感染类型。根据本发明的一个方面,提供了一种确定受试者中感染类型的方法,包括测量来自受试者的样品中表3或表4中列出的至少一种RNA的量,其中测量不超过20种RNA,其中至少一种RNA的量指示感染类型。根据本发明的一个方面,提供了一种确定受试者中感染类型的方法,包括测量来自受试者的样品中表5或表6A中列出的至少一种RNA的量,其中测量不超过5种RNA,其中至少一种RNA的量指示感染类型。根据本发明的一个方面,提供了用于诊断感染类型的试剂盒,其包含至少两种决定子检测试剂,其中所述至少两种决定子检测试剂中的第一种特异性地检测表1或表2中列出的第一决定子,且所述至少两种决定子检测试剂中的第二种特异性地检测表1-6A或表15A-B中任一个中列出的第二决定子。根据本发明的一个方面,提供了用于诊断感染类型的试剂盒,其包含至少两种决定子检测试剂,其中所述至少两种RNA检测试剂中的第一种特异性地检测表3或表4中列出的第一RNA,且所述至少两种RNA检测试剂中的第二种特异性地检测表1-6A或表15A-B中任一个中列出的第二RNA,其中所述试剂盒包含特异性地检测不超过20种RNA的检测试剂。根据本发明的一个方面,提供了用于诊断感染类型的试剂盒,其包含至少两种决定子检测试剂,其中所述至少两种决定子检测试剂中的第一种特异性地检测表1-6A或表15A-B中任一个中列出的第一决定子,且所述至少两种决定子检测试剂中的第二种特异性地检测表1-6A或表15A-B中任一个中列出的第二决定子,其中所述试剂盒包含特异性地检测不超过5种决定子的检测试剂。根据本发明的一个方面,提供了一种物质组合物,其包含源自怀疑具有感染的受试者的样品和特异性地结合至表1或表2中列出的样品的至少一种决定子的第一试剂。根据本发明的实施方案,表1中列出的决定子的量高于预定水平,感染是病毒感染。根据本发明的实施方案,当表2中列出的决定子的量高于预定水平时,感染是细菌感染。根据本发明的实施方案,决定子是RNA。根据本发明的实施方案,RNA是蛋白质编码RNA。根据本发明的实施方案,RNA是非蛋白质编码RNA。根据本发明的实施方案,决定子是多肽。根据本发明的实施方案,所述方法还包括测量至少一种另外的RNA的量以测量至少两种RNA,其中所述至少一种另外的RNA在表1-6A或15A-B中任一个中列出,其中至少两种RNA的量指示感染类型。根据本发明的实施方案,所述至少一种另外的RNA在表1、表2、表3、表5或表16A-C中列出,其中至少两种RNA的量指示感染类型。根据本发明的实施方案,所述至少两种RNA的对在表9、11、17或18中列出。根据本发明的实施方案,决定子选自OTOF、PI3、CYBRD1、EIF2AK2、CMPK2、CR1、CYP1B1、DDX60、DGAT2、PARP12、PNPT1、PYGL、SULT1B1、TRIB2、USP41、ZCCHC2和uc003hrl.1。根据本发明的实施方案,决定子选自TCONS_00003184-XLOC_001966、TCONS_00013664-XLOC_006324、TCONS_l2_00028242-XLOC_l2_014551、TCONS_l2_00001926-XLOC_l2_000004、TCONS_l2_00002386-XLOC_l2_00072、TCONS_l2_00002811-XLOC_l2_001398、TCONS_l2_00003949-XLOC_l2_001561、TCONS_00019559-XLOC_009354、TCONS_l2_00010440-XLOC_l2_005352、TCONS_l2_00016828-XLOC_l2_008724、TCONS_l2_00021682-XLOC_l2_010810和TCONS_l2_00002367-XLOC_l2_000720。根据本发明的实施方案,所述方法还包括分析至少两种另外的RNA以测量至少三种RNA的量,其中所述至少两种另外的RNA在表1-6A或15A-B中任一个中列出,其中至少三种RNA的量指示感染类型。根据本发明的实施方案,所述至少两种另外的RNA在表1、表2、表3、表5或表16A-C中列出。根据本发明的实施方案,至少三种RNA的三联体在表13、表19或表20中列出。根据本发明的实施方案,感染是病毒感染、细菌感染或混合感染。根据本发明的实施方案,所述方法还包括分析样品中CRP多肽或TRAIL多肽的表达水平。根据本发明的实施方案,决定子在表21中列出。根据本发明的实施方案,测量不超过20种RNA。根据本发明的实施方案,测量不超过5种RNA。根据本发明的实施方案,至少一种RNA在表3中列出。根据本发明的实施方案,当表3中列出的RNA高于预定水平时,感染是病毒感染。根据本发明的实施方案,所述方法还包括测量至少一种另外的RNA以测量至少两种RNA,其中所述至少一种另外的RNA在表1-6A或15A-B中任一个中列出,其中至少两种RNA的量指示感染类型。根据本发明的实施方案,所述至少一种另外的RNA在表1、表2、表3、表5或表16A-C中列出。根据本发明的实施方案,表1中列出的至少一种另外的RNA是OTOF、PI3、EIF2AK2、CMPK2、PARP12、PNPT1、TRIB2、uc003hrl.1、USP41、ZCCHC2或TCONS_00003184-XLOC_001966。根据本发明的实施方案,表2中列出的至少一种另外的RNA是CYBRD1、CR1、DGAT2、PYGL、SULT1B1、TCONS_00013664-XLOC_006324、TCONS_l2_00028242-XLOC_l2_014551、TCONS_l2_00001926-XLOC_l2_000004、TCONS_l2_00002386-XLOC_l2_000726、TCONS_l2_00002811-XLOC_l2_001398、TCONS_l2_00003949-XLOC_l2_001561、TCONS_00019559-XLOC_009354、TCONS_l2_00010440-XLOC_l2_005352、TCONS_l2_00016828-XLOC_l2_008724、TCONS_l2_00021682-XLOC_l2_010810或TCONS_l2_00002367-XLOC_l2_000720。根据本发明的实施方案,所述至少一种RNA在表5中列出。根据本发明的实施方案,当表5中列出的至少一种RNA高于预定水平时,感染是病毒感染。根据本发明的实施方案,所述方法还包括测量至少一种另外的RNA以测量至少两种RNA,其中所述至少一种另外的RNA在表1-6A或表15A-B中任一个中列出,其中至少两种RNA的量指示感染类型。根据本发明的实施方案,所述至少一种另外的RNA在表1、表2、表3、表5或表16A-C中列出。根据本发明的实施方案,表1中列出的至少一种另外的RNA选自OTOF、PI3、EIF2AK2、CMPK2、PARP12、PNPT1、TRIB2、uc003hrl.1、USP41、ZCCHC2和TCONS_00003184-XLOC_001966。根据本发明的实施方案,表2中列出的至少一种另外的RNA是CYBRD1、CR1、DGAT2、PYGL、SULT1B1、TCONS_00013664-XLOC_006324、TCONS_l2_00028242-XLOC_l2_014551、TCONS_l2_00001926-XLOC_l2_000004、TCONS_l2_00002386-XLOC_l2_000726、TCONS_l2_00002811-XLOC_l2_001398、TCONS_l2_00003949-XLOC_l2_001561、TCONS_00019559-XLOC_009354、TCONS_l2_00010440-XLOC_l2_005352、TCONS_l2_00016828-XLOC_l2_008724、TCONS_l2_00021682-XLOC_l2_010810或TCONS_l2_00002367-XLOC_l2_000720。根据本发明的实施方案,样品是全血或其级分。根据本发明的实施方案,感染是病毒感染、细菌感染或混合感染。根据本发明的实施方案,血液级分样品包含选自淋巴细胞、单核细胞和粒细胞的细胞。根据本发明的实施方案,血液级分样品包含血清或血浆。根据本发明的实施方案,所述至少两种决定子检测试剂包含RNA检测试剂。根据本发明的实施方案,所述至少两种RNA检测试剂附着至可检测部分。根据本发明的实施方案,第一RNA检测试剂包含与第一RNA杂交的第一多核苷酸,且第二RNA检测试剂包含与第二RNA杂交的多核苷酸。根据本发明的实施方案,试剂盒包含特异性地检测不超过20种RNA的检测试剂。根据本发明的实施方案,试剂盒包含特异性地检测不超过10种RNA的检测试剂。根据本发明的实施方案,试剂盒包含特异性地检测不超过5种RNA的检测试剂。根据本发明的实施方案,其中5种RNA中的每一种在表1-6A或表15A-B中任一个中列出。根据本发明的实施方案,试剂盒包含特异性地检测不超过5种RNA的检测试剂。根据本发明的实施方案,试剂盒包含特异性地检测不超过3种RNA的检测试剂。根据本发明的实施方案,决定子是RNA。根据本发明的实施方案,决定子是多肽。根据本发明的实施方案,组合物还包含另外的试剂,其特异性地结合表1-6A或表15A-B中任一个中列出的另外的决定子。根据本发明的实施方案,感染性受试者具有脓毒症,并且非感染性受试者具有没有脓毒症的SIRS。除非另外定义,否则本文使用的所有技术和/或科学术语都具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些类似或等同的方法和材料可用于实践或测试本发明的实施方案,但下文描述了示例性方法和/或材料。在有冲突的情况下,将以专利说明书包括定义为准。另外,材料、方法和实施例仅是说明性的,且不意图必然为限制性的。附图的几个视图的简要描述仅通过举例的方式,本文中参考附图描述了本发明的一些实施方案。现在详细地具体参考附图,要强调的是,所示的细节是作为示例并且为了说明性地讨论本发明实施方案的。在这方面,连同附图进行的描述使得本领域技术人员明白可以如何实践本发明的实施方案。在附图中:图1是临床研究设计的流程图。图2说明6名细菌和9名病毒患者的独特基因表达谱。利用欧氏距离度量和平均连锁(Euclideandistancemetricandaveragelinkage)对65个基因进行等级聚类(hierarchicalclustering)。转化的表达水平用色标表示,红色代表高表达且绿色表示低表达。图3A是热图(heatmap),其说明使用逻辑回归模型,对于表8中描述的65种RNA决定子的对(根据系列号)获得的9个病毒对6个细菌感染患者在MCC方面的分类准确性。图3B是说明表8中描述的65种RNA决定子(根据系列号)的分类准确性中的变化(dMCC)的热图。变化计算如下:MCCi,j–max(MCCi,MCCj),其中MCCi和MCCj对应于个别地为决定子i和j获得的MCC,并且对于所述对获得MCCi,j。热色和冷色表示RNA决定子对,其组合分类准确性与个别决定子准确性相比更高及更低。图4A是热图,其说明使用逻辑回归模型,对于表8中描述的65种RNA决定子的对(根据系列号)获得的9个病毒对6个细菌感染患者在AUC方面的分类准确性。图4B是说明表8中描述的65种RNA决定子(根据系列号)的分类准确性中的变化(dAUC)的热图,其计算如下:AUCi,j–max(AUCi,AUCj),其中AUCi和AUCj对应于个别地为决定子i和j获得的AUC,并且对于所述对获得AUCi,j。热色和冷色表示RNA决定子对,其组合分类准确性与个别决定子准确性相比更高及更低。图5A-K.表16A-C中描述的RNA决定子在细菌、病毒和非感染性(包括健康)患者中的差异表达水平。红线和圆圈分别对应于组中位数和平均值;描绘了细菌和病毒组之间以及感染性(细菌和病毒)与非感染性(包括健康受试者)之间的Wilcoxon秩和(RS)p-值。包括了基因符号(对于编码RNA)或mRNA登录号(对于非编码RNA)。图6.火山图(散点图),其呈现变化倍数以及评估的RNA决定子的t-检验p-值。表16A-C中描述的病毒和细菌诱导的RNA以红色和蓝色“x”(分别地)标记。图7A-I.非感染性(包括健康)患者以及所示具有细菌或各种病毒感染的患者中所选RNA的表达水平(任意单位)。RSV-呼吸道合胞病毒;hMPV-人偏肺病毒(humanMetapneumovirus)。红线对应于组中位数。本发明具体实施方案的描述在一些实施方案中,本发明涉及与细菌和病毒感染相关的识别标志和决定子的鉴定。更具体地,发现某些RNA决定子在具有细菌和病毒感染的受试者中以统计学显著的方式差异表达。在详细解释本发明的至少一个实施方案之前,应理解本发明不必定限于其对于以下描述中阐述的或通过实施例举例说明的细节的应用。本发明能够具有其它实施方案或者能够以各种方式实践或实施。通过分析蛋白质决定子来区分细菌和病毒感染的方法已在本发明人的国际专利申请WO2013/117746中公开。为了设法扩大可以帮助准确诊断的决定子的数目和类型,本发明人现在已经进行了另外的临床实验并且已经鉴定了可以用于该目的的其它决定子。细菌患者的正确诊断具有重要意义,这是因为这些患者需要抗生素治疗,并且在一些情况下需要更积极的管理(住院、另外的诊断测试等)。细菌患者的错误分类增加发病率和死亡率的机会。因此,即使特异性可能降低,也可能期望增加区分细菌和病毒感染的生物标志或诊断测试的灵敏度。在将本发明付诸实施的同时,本发明人研究了从具有急性感染的患者获得的血液白细胞的基因表达谱。结果表明,免疫系统对细菌和病毒感染存在差异应答,其可以潜在地用于对具有急性感染的患者进行分类。最初,本发明人鉴定了65种RNA决定子,其在测试的细菌和病毒患者中差异表达(表8)。图2呈现了应用使用欧氏距离度量和平均连锁的等级聚类后所鉴定基因的独特基因表达谱。基于这些结果,本发明人开发了一种用于使用逻辑回归来区分细菌和病毒患者的分类器(classifier)。还发现了与单RNA决定子相比呈现高准确性改善的对和三联体(表9、11、12、13和14)。在随后证实了这些结果的同时,本发明人发现了可用作区分细菌和病毒感染的决定子的另外的RNA标志(表15A-B)。进一步分析鉴定了这些RNA中哪些是细菌和病毒患者之间最大差异表达的(表16A-C)。特定RNA在疾病发作时诊断感染类型时显示出高度准确性(表24)。显示另外的RNA在指示病毒株的具体类型时是准确的(表25)。因此,根据本发明的第一方面,提供了一种确定受试者中感染类型的方法,包括测量来自受试者的样品中表1和2中列出的决定子的量,其中所述量指示感染类型。如本文所用的,术语“决定子”是指多肽或多核苷酸(例如,RNA)。感染类型可为细菌感染、病毒感染或混合感染(细菌和病毒感染的组合)。细菌感染可为革兰氏阳性、革兰氏阴性细菌或非典型细菌的结果。术语“革兰氏阳性细菌”是指通过革兰氏染色染成深蓝色的细菌。革兰氏阳性生物能够保留结晶紫染料,这是因为细胞壁中的大量的肽聚糖。术语“革兰氏阴性细菌”是指在革兰氏染色规程中不保留结晶紫染料的细菌。术语“非典型细菌”是不落入经典“革兰氏”组之一的细菌。它们通常(尽管不总是)是细胞内细菌病原体。它们包括但不限于枝原体属物种(Mycoplasmasspp.)、军团菌属物种(Legionellaspp.)、立克次氏体属物种(Rickettsiaespp.)和衣原体属物种(Chlamydiaespp.)。感染可为急性或慢性感染。慢性感染是缓慢发展并持续长时间的感染。可导致慢性感染的病毒包括丙型肝炎和HIV。急性和慢性感染之间的一个区别在于,在急性感染期间,免疫系统经常产生针对传染因子的IgM+抗体,而感染的慢性期通常特征是IgM-/IgG+抗体。此外,急性感染引起免疫介导的坏死过程,而慢性感染经常引起炎症介导的纤维变性过程和瘢痕形成(例如,肝脏中的丙型肝炎)。因此,急性和慢性感染可引发不同的潜在免疫学机制。在一个实施方案中,决定子的水平可用于划入(rulein)感染类型。在另一个实施方案中,决定子的水平可用于排除感染类型。“划入”感染意味着受试者具有该类型的感染。“排除”感染意味着受试者没有该类型的感染。“测量(Measuring)”或“测量(measurement)”、或者可选地“检测(detecting)”或“检测(detection)”是指,评估临床或受试者衍生的样品中的决定子的存在、不存在、数量或量(其可以是有效量),包括推导出这种决定子的定性或定量浓度水平。在本发明的上下文中的“样品”是从受试者分离的生物样品,并且可以包括,例如但不限于,全血、血清、血浆、唾液、粘液、呼出的气体、尿、CSF、痰、汗、粪便、毛发、精液、活组织检查、鼻漏、组织活检、细胞学样品、血小板、网织红细胞、白细胞、上皮细胞或全血细胞。为了测量蛋白质决定子,优选地,样品是血液样品-例如血清或含有白细胞的样品(其排除了红细胞)。为了测量RNA决定子,优选地,样品是血液样品,其包含白细胞例如淋巴细胞、单核细胞和粒细胞(其排除了红细胞)。在一个实施方案中,样品不是血清样品。排除红细胞的方法是本领域已知的,并且包括例如溶血、离心、沉降、过滤或其组合。将理解的是,当待测量的决定子是蛋白质时,产生蛋白质样品。当测量的决定子是RNA时,产生RNA样品。RNA样品可包含来自异质细胞群或来自单个细胞群的RNA。RNA可包含总RNA、mRNA、线粒体RNA、叶绿体RNA、DNA-RNA杂交体、病毒RNA、无细胞RNA及其混合物。在一个实施方案中,RNA样品不含DNA。样品可为新鲜的或冷冻的。RNA的分离、提取或衍生可通过任何合适的方法进行。从生物样品中分离RNA通常包括以这样的方式处理生物样品,从而提取样品中存在的RNA并使其可用于分析。产生提取的RNA的任何分离方法均可用于本发明的实践中。将理解的是,用于提取RNA的特定方法将取决于来源的性质。RNA提取的方法是本领域熟知的,并在下文中进一步描述。基于苯酚的提取方法:基于异硫氰酸胍(GITC)/苯酚/氯仿提取的这些单步RNA分离方法比传统方法(例如,CsCl2超速离心)需要少得多的时间。许多商业试剂(例如Trizol、RNAzol、RNAWIZ)基于这一原理。整个程序可在一小时内完成,以产生高得率的总RNA。基于硅胶的纯化方法:RNeasy是由Qiagen销售的纯化试剂盒。它在旋转柱(spin-column)中使用基于硅胶的膜来选择性地结合大于200个碱基的RNA。所述方法快速且不涉及苯酚的使用。基于寡脱氧胸苷酸的mRNA亲和纯化:由于细胞RNA总库中mRNA的低丰度,减少总RNA制剂中rRNA和tRNA的量大大增加mRNA的相对量。使用寡脱氧胸苷酸亲和层析以选择性富集聚腺苷酸+RNA已经实践了超过20年。制备的结果是富集的mRNA群,其具有最小的rRNA或其它小RNA污染。mRNA富集对于构建cDNA文库和高度期望完整mRNA的其它应用是必需的。最初的方法使用寡脱氧胸苷酸缀合的树脂柱层析并且可以是耗时的。最近,更方便的形式例如旋转柱和基于磁珠的试剂盒变得可用。也可在进行本发明的诊断方法之前处理样品。处理样品可涉及以下中的一种或多种:过滤、蒸馏、离心、提取、浓缩、稀释、纯化、干扰组分的灭活、试剂的添加等。获得RNA样品后,可从中产生cDNA。对于cDNA的合成,模板mRNA可直接从裂解的细胞获得,或者可从总RNA或mRNA样品纯化。可对总RNA样品施加力以促进RNA分子的剪切,从而使得每个RNA分子的平均大小在100-300个核苷酸之间,例如大约200个核苷酸。为了将异质mRNA群与细胞中发现的大多数RNA分离,可使用各种技术,所述技术基于使用附着于固体支持体的寡脱氧胸苷酸寡核苷酸。这种寡脱氧胸苷酸寡核苷酸的实例包括:寡脱氧胸苷酸纤维素/旋转柱、寡脱氧胸苷酸/磁珠和寡脱氧胸苷酸寡核苷酸包被的板。从RNA产生单链DNA需要合成中间RNA-DNA杂交体。为此,需要与RNA的3'末端杂交的引物。退火温度和时间控制由引物预期与模板退火的效率和要耐受的错配程度两者确定。退火温度通常选择为提供最佳效率和特异性,且通常在约50℃和约80℃之间、通常在约55℃和约70℃之间、且更通常在约60℃和约68℃之间变化。退火条件通常保持一段时间,所述时间在约15秒和约30分钟之间、通常在约30秒和约5分钟之间变化。根据具体实施方案,引物包含polydT寡核苷酸序列。优选地,polydT序列包含至少5个核苷酸。根据另一实施方案,是约5至50个核苷酸,更优选约5-25个核苷酸,并且甚至更优选约12至14个核苷酸。在将引物(例如polydT引物)与RNA样品退火后,使用依赖于RNA的DNA聚合酶通过逆转录合成RNA-DNA杂交体。用于本发明方法和组合物的合适依赖于RNA的DNA聚合酶包括逆转录酶(RT)。RT的实例包括但不限于:莫洛尼鼠类白血病病毒(M-MLV)逆转录酶、人免疫缺陷病毒(HIV)逆转录酶、劳斯肉瘤病毒(RSV)逆转录酶、禽类成髓细胞瘤病毒(AMV)逆转录酶、劳斯相关病毒(RAV)逆转录酶和成髓细胞瘤相关病毒(MAV)逆转录酶或其它禽类肉瘤-白血病病毒(ASLV)逆转录酶,以及由它们衍生的修饰的RT。参见例如,美国专利号7,056,716。许多逆转录酶,例如来自禽类成髓细胞瘤病毒(AMV-RT)和莫洛尼鼠类白血病病毒(MMLV-RT)的那些包含多于一种活性(例如,聚合酶活性和核糖核酸酶活性)并且可以在形成双链cDNA分子中起作用。逆转录反应中所需的其它组分包括dNTPS(dATP、dCTP、dGTP和dTTP)和任选地还原剂如二硫苏糖醇(DTT)和MnCl2。如所述的,为了确定感染的类型,测量表1或表2的至少一种决定子(例如,RNA决定子)。在一个实施方案中,RNA决定子是编码蛋白质的RNA。在另一个实施方案中,RNA决定子不编码蛋白质(非编码RNA)。表1。表2。根据具体实施方案,当表1中的决定子水平高于预定水平时(例如,高于源自非感染性,优选健康受试者的样品中存在的水平;或高于源自已知被细菌感染感染的受试者的样品中存在的水平,如本文下文进一步描述的),其指示受试者具有病毒感染(即,可划入病毒感染)。可选地或另外地,当表1中的决定子水平高于预定水平时,其指示受试者不具有细菌感染(即,排除细菌感染)。根据其它实施方案,当表2中的决定子水平高于预定水平时(例如,高于源自非感染性,优选健康受试者的样品中存在的水平;或高于源自已知被病毒感染感染的受试者的样品中存在的水平,如本文下文进一步描述的),其指示受试者具有细菌感染(即,划入细菌感染)。可选地或另外地,当表2中的决定子水平高于预定水平时,其指示受试者不具有病毒感染(即,排除病毒感染)。本发明任何方面的预定水平可为源自群体研究的参考值,包括但不限于具有已知感染的受试者,具有相同或相似年龄范围的受试者,处于相同或相似人种群中的受试者,或相对于正在接受感染治疗的受试者的起始样品。这些参考值可以从统计学分析和/或从数学算法和计算的感染指数获得的群体的风险预测数据导出。还可以使用算法和统计学和结构分类的其它方法来构建和使用参考决定子指数。在本发明的一个实施方案中,预定水平是来自一个或多个不具有感染的受试者(即,健康和或非感染个体)的对照样品中决定子的量(即,水平)。在另一个实施方案中,在这种测试之后,对这种受试者进行监控和/或定期重复测试诊断相关的时间段(“纵向研究”),以验证感染持续的不存在。这一时间段可为距用于确定参考值的初始测试日期一天、两天、两天到五天、五天、五天到十天、十天、或十天或更多天。此外,对适当存储的历史受试者样品中的决定子的回顾性测量可用于确立这些参考值,从而缩短所需的研究时间。参考值还可以包括源自受试者的决定子的量,所述受试者作为用于感染的治疗和/或疗法的结果而显示出改善。参考值还可以包括源自已通过已知技术确认感染的受试者的决定子的量。细菌感染的参考值的实例是在已被诊断为具有细菌感染的统计学上显著数目的受试者中该决定子的平均浓度或中位数浓度。病毒感染的参考值的实例是在已被诊断为具有病毒感染的统计学上显著数目的受试者中该决定子的平均浓度或中位数浓度。将理解的是,对照样品是与被分析样品相同的血液样品类型。除了测量表1或2中的至少一种决定子之外,本发明人预期测量至少一种另外的(不相同的)决定子(以便测量至少两种决定子),其中至少一种另外的决定子在表1-6A或15A-B中任一个中列出,其中至少两种决定子的量指示感染类型。在一个实施方案中,测量至少两种不相同的RNA,第一种来自表1或2,且第二种来自表1-6A或16A-C中任一个。优选地,第二RNA在表1、2、3或5中列出,并且甚至更优选地,第二RNA在表1或2中列出。根据又一实施方案,除了测量表1或2中的至少一种决定子之外,本发明人预期测量至少一种另外的(不相同的)决定子(以便测量至少两种决定子),其中至少一种另外的决定子在表6B中列出。根据特定实施方案,RNA决定子的至少一种是编码RNA,例如OTOF、PI3、CYBRD1、EIF2AK2或CMPK2、PARP12、PNPT1、TRIB2、uc003hrl.1、USP41、ZCCHC2。根据特定实施方案,RNA决定子的至少一种是非编码RNA,例如,TCONS_00003184-XLOC_001966。本发明人预期的示例性对在下文实施例部分中的表9、11、17和18中列出。其它示例性对在下文中提供:。在另一个实施方案中,测量至少三种决定子,其中至少两种另外的决定子在表1-6A或15A-B中任一个中列出,其中所述至少三种决定子的量指示感染类型。在一个实施方案中,测量至少三种不相同的RNA,第一种来自表1或2,且第二种和第三种来自表1-6A或16A-C中任一个。优选地,第二和第三RNA在表1、2、3、5或16A-C中列出,并且甚至更优选地,第二RNA在表1或2中列出。本发明人预期的示例性三联体在本文下面实施例部分的表13、19或20中列出。可根据本发明的这一方面测量的其它示例性三联体在本文下面提供:。根据本发明的这一方面,为了区分不同的感染类型,测量不超过30种决定子,测量不超过25种决定子,测量不超过20种决定子,测量不超过15种决定子,测量不超过10种决定子,测量不超过5种决定子,测量不超过4种决定子,测量不超过3种决定子或甚至测量不超过2种决定子。表3。表4。表5。表6A。表6B。根据本发明的另一个方面,提供了一种确定受试者中的感染类型的方法,包括测量来自受试者的样品中的至少两种RNA,其中所述至少两种RNA的对在表9、11、12、18或19中列出,其中至少两种RNA的量指示感染类型。根据本发明的这个方面,为了区分不同的感染类型,测量不超过30种决定子,测量不超过25种决定子,测量不超过20种决定子,测量不超过15种决定子,测量不超过10种决定子,测量不超过5种决定子,测量不超过4种决定子,测量不超过3种决定子或甚至测量不超过2种决定子。根据本发明的另一个方面,提供了一种确定受试者中的感染类型的方法,包括测量来自受试者的样品中的至少三种RNA,其中所述至少三种RNA的三联体在表13、14、19或20中列出,其中至少三种RNA的量指示感染类型。根据本发明的这个方面,为了区分不同的感染类型,测量不超过30种决定子,测量不超过25种决定子,测量不超过20种决定子,测量不超过15种决定子,测量不超过10种决定子,测量不超过5种决定子,测量不超过4种决定子,或甚至测量不超过3种决定子。根据本发明的另一个方面,提供了一种确定受试者中的感染类型的方法,包括测量来自受试者的样品中表3或表4中列出的至少一种RNA的量,其中测量不超过20种RNA,其中至少一种RNA的量指示感染类型。在一个实施方案中,测量不超过15种决定子,测量不超过10种决定子,测量不超过5种决定子,测量不超过4种决定子,测量不超过3种决定子或甚至测量不超过2种决定子。根据本发明的这个方面,优选地,至少一种RNA在表3中列出。当表3中列出的RNA水平高于预定水平时,其指示病毒感染。当根据这个方面测量另外的决定子时,优选地,在表1-6A或表15A-B中任一个中列出另外的决定子。可根据本发明的方面测量的其它决定子包括病原体(细菌或病毒)特异性RNA决定子。例如,可以区分流感和副流感的RNA决定子描述于下文实施例部分的表25中。这可以进行以帮助鉴定具体病原体。测量可以与上述测量同时发生或接连发生。可以对用于确定患者免疫应答的生物样品(如上文所述)或对不同的患者衍生的生物样品(例如,血液样品;血清样品;唾液;鼻咽样品等)进行测量。在一个实施方案中,在患者衍生的血清样品中测量宿主免疫RNA决定子,并在鼻咽样品上进行病原体特异性RNA决定子的分析。根据特定实施方案,另外的RNA在表1(例如,OTOF、PI3、EIF2AK2和CMPK2)、表2(例如,CYBRD1)、表3、表5或表16A-C(蛋白质编码RNA,例如CR1、CYP1B1、DDX60、DGAT2、PARP12、PNPT1、PYGL、SULT1B1、TRIB2、USP41、ZCCHC2或uc003hrl.1;非蛋白质编码RNA,例如TCONS_00003184-XLOC_001966、TCONS_00013664-XLOC_006324、TCONS_l2_00028242-XLOC_l2_014551、TCONS_l2_00001926-XLOC_l2_000004、TCONS_l2_00002386-XLOC_l2_00072、TCONS_l2_00002811-XLOC_l2_001398、TCONS_l2_00003949-XLOC_l2_001561、TCONS_00019559-XLOC_009354、TCONS_l2_00010440-XLOC_l2_005352、TCONS_l2_00016828-XLOC_l2_008724、TCONS_l2_00021682-XLOC_l2_010810和TCONS_l2_00002367-XLOC_l2_000720)中列出。根据本发明的另一个方面,提供了一种确定受试者中的感染类型的方法,包括测量来自受试者的样品中表5或表6A中列出的至少一种RNA的量,其中测量不超过5种RNA,其中至少一种RNA的量指示感染类型。根据本发明这个方面的特定实施方案,所述至少一种RNA在表5中列出。当表5的RNA高于预定水平时,感染可归类为病毒感染。根据这个方面,可以测量另外的RNA以便测量至少两种RNA,其中至少一种另外的RNA在表1-6中任一个中列出,其中至少两种RNA的量指示感染类型。优选地,至少一种另外的RNA在表1(例如,PI3、EIF2AK2和CMPK2)、表2(例如,CYBRD1)、表3、表5或表16A-C(例如,编码RNA,例如CR1、CYP1B1、DDX60、DGAT2、PARP12、PNPT1、PYGL、SULT1B1、TRIB2、USP41、ZCCHC2、uc003hrl.1;或非编码RNA,例如TCONS_00003184-XLOC_001966、TCONS_00013664-XLOC_006324、TCONS_l2_00028242-XLOC_l2_014551、TCONS_l2_00001926-XLOC_l2_000004、TCONS_l2_00002386-XLOC_l2_000726、TCONS_l2_00002811-XLOC_l2_001398、TCONS_l2_00003949-XLOC_l2_001561、TCONS_00019559-XLOC_009354、TCONS_l2_00010440-XLOC_l2_005352、TCONS_l2_00016828-XLOC_l2_008724、TCONS_l2_00021682-XLOC_l2_010810和TCONS_l2_00002367-XLOC_l2_000720)中列出。分析RNA的量的方法是本领域已知的,并在下文中概述:RNA印迹分析:这一方法涉及检测RNA的混合物中的特定RNA。通过用防止碱基对之间的氢键键合的试剂(例如甲醛)处理使RNA样品变性,从而确保所有RNA分子都具有未折叠的线性构象。然后通过凝胶电泳根据大小分离个别RNA分子,并将其转移到硝化纤维素或基于尼龙的膜上,变性的RNA粘粘附于所述膜上。然后将膜暴露于标记的DNA探针。可使用放射性同位素或酶联核苷酸标记探针。检测可使用放射自显影、比色反应或化学发光。这一方法允许定量一定量的特定RNA分子并通过膜上的相对位置确定其身份,所述相对位置指示电泳期间凝胶中的迁移距离。RT-PCR分析:这一方法使用相对稀有的RNA分子的PCR扩增。首先,从细胞中纯化RNA分子,并使用逆转录酶(例如,MMLV-RT)和引物如寡脱氧胸苷酸、随机六聚体或基因特异性引物将其转化成互补DNA(cDNA)。然后通过应用基因特异性引物和TaqDNA聚合酶,在PCR设备中进行PCR扩增反应。本领域技术人员能够选择适合于检测具体RNA分子的基因特异性引物的长度和序列以及PCR条件(即,退火温度、循环数等)。将理解的是,可以通过调节PCR循环的数目并将扩增产物与已知对照进行比较来采用半定量RT-PCR反应。RNA原位杂交染色:在这一方法中,DNA或RNA探针附着至细胞中存在的RNA分子。通常,首先将细胞固定到显微镜载玻片上以保持细胞结构并防止RNA分子降解,且然后使其经受含有标记的探针的杂交缓冲液。杂交缓冲液包括诸如甲酰胺和盐(例如,氯化钠和柠檬酸钠)的试剂,其能够使DNA或RNA探针与其靶mRNA分子原位特异性杂交,同时避免探针的非特异性结合。本领域技术人员能够调节对具体探针和细胞类型的杂交条件(即,温度、盐和甲酰胺的浓度等)。杂交后,洗掉任何未结合的探针,并使用已知方法检测结合的探针。例如,如果使用放射性标记的探针,则载玻片经受照相乳胶,其显示使用放射性标记的探针产生的信号;如果探针用酶进行标记,则加入酶特异性底物以形成比色反应;如果使用荧光标记来标记探针,则使用荧光显微镜显示结合的探针;如果使用标签(例如,洋地黄毒苷、生物素等)来标记探针,则可以在与标签特异性抗体相互作用后检测结合的探针,所述标签特异性抗体可以使用已知方法检测。原位RT-PCR染色:这一方法描述于NuovoGJ等人[Intracellularlocalizationofpolymerasechainreaction(PCR)-amplifiedhepatitisCcDNA.AmJSurgPathol.1993,17:683-90]和KomminothP等人[EvaluationofmethodsforhepatitisCvirusdetectioninarchivalliverbiopsies.Comparisonofhistology,immunohistochemistry,insituhybridization,reversetranscriptasepolymerasechainreaction(RT-PCR)andinsituRT-PCR.PatholResPract.1994,190:1017-25]中。简而言之,通过将标记的核苷酸参入PCR反应,在固定的细胞上进行RT-PCR反应。使用特定的原位RT-PCR装置进行反应,例如可从ArcturusEngineering(Mountainview,CA)获得的激光捕获显微解剖PixCellILCM系统。DNA微阵列/DNA芯片:可以使用DNA微阵列同时分析数千个基因的表达,从而允许在特定的发育过程或生理反应期间分析生物的完整转录程序。DNA微阵列由数千个个别基因序列组成,所述基因序列附着于支持体例如玻璃显微镜载玻片表面上的紧密叠集区域(closelypackedareas)。已经开发了各种方法用于制备DNA微阵列。在一种方法中,用于分析的每个基因的编码区的约1千碱基区段被个别地PCR扩增。使用机器人装置将每个扩增的DNA样品应用于玻璃显微镜载玻片表面上的紧密间隔区(closelyspacedzones),随后通过热处理和化学处理将其进行加工以将DNA序列结合到支持体的表面并使它们变性。一般,这些阵列约为2×2cm,且含有约6000个个别的核酸点。在所述技术的变形中,通常长度为20个核苷酸的多个DNA寡核苷酸由与支持体表面共价结合的初始核苷酸合成,从而使得在支持体表面上的小正方形区中合成数以万计的相同的寡核苷酸。来自单个基因的多个寡核苷酸序列在载玻片的相邻区域中合成以用于分析该基因的表达。因此,可以在一个载玻片上表示数千个基因。如上所述,这种合成寡核苷酸的阵列在本领域中可称为“DNA芯片”,与“DNA微阵列”形成对照[Lodish等人(eds.).第7.8章:DNAMicroarrays:AnalyzingGenome-WideExpression.In:MolecularCellBiology,第4版,W.H.Freeman,NewYork.(2000)]。寡核苷酸微阵列-在这一方法中,能够与本发明的一些实施方案的多核苷酸特异性杂交的寡核苷酸探针附着于固体表面(例如,玻璃晶片)。每个寡核苷酸探针的长度为约20-25个核酸。为了检测特定细胞样品(例如,血细胞)中本发明一些实施方案的多核苷酸的表达模式,使用本领域已知的方法从细胞样品中提取RNA(使用例如,TRIZOL溶液,GibcoBRL,美国)。可以使用标记的寡核苷酸探针(例如,5'-生物素化的探针)或互补DNA(cDNA)或RNA(cRNA)的标记的片段进行杂交。简而言之,使用逆转录酶(RT)(例如,SuperscriptIIRT)、DNA连接酶和DNA聚合酶I从RNA制备双链cDNA,均根据制造商的说明书(InvitrogenLifeTechnologies,Frederick,MD,USA)。为了制备标记的cRNA,使用例如BioArrayHighYieldRNATranscriptLabelingKit(Enzo,Diagnostics,AffymetixSantaClaraCA)在生物素化的核苷酸存在下对双链cDNA进行体外转录反应。为了有效杂交,可以通过将RNA在40mMTris乙酸盐(Acetate)(pH8.1)、100mM乙酸钾和30mM乙酸镁中于94℃温育35分钟来片段化标记的cRNA。杂交后,洗涤微阵列并使用共焦激光荧光扫描仪扫描杂交信号,所述扫描仪测量与探针阵列结合的标记的cRNA发射的荧光强度。例如,在Affymetrix微阵列(Affymetrix®,SantaClara,CA)中,阵列上的每个基因都由一系列不同的寡核苷酸探针表示,其中每个探针对由完美匹配寡核苷酸和错配寡核苷酸组成。虽然完美匹配探针具有与特定基因完全互补的序列,因此使得能够测量特定基因的表达水平,但错配探针与完美匹配探针的不同之处在于中心碱基位置处的单碱基取代。使用Agilent扫描仪扫描杂交信号,并且MicroarraySuite软件从由完美匹配探针产生的信号中减去由错配探针产生的非特异性信号。RNA测序:用于RNA序列测定的方法是本领域技术人员通常已知的。优选的测序方法是下一代测序方法(nextgenerationsequencingmethod)或并行高通量测序方法(parallelhighthroughputsequencingmethod)。设想的序列方法的一个例子是焦磷酸测序(pyrosequencing),特别是454焦磷酸测序,例如,基于Roche454基因组测序仪。这一方法在油溶液中的水滴内扩增DNA,每个液滴含有单个DNA模板,所述DNA模板附着于单个引物包被的珠上,其然后形成克隆集落。焦磷酸测序使用萤光素酶以产生光以检测添加到新生DNA的个别核苷酸,并且组合的数据用于产生序列读数(read-outs)。另一个设想的例子是Illumina或Solexa测序,例如,通过使用Illumina基因组分析仪技术,所述技术基于可逆染料终止剂。DNA分子一般附着于载玻片上的引物并扩增,从而形成局部克隆集落。随后可每次添加一种类型的核苷酸,并且洗掉未参入的核苷酸。随后,可采取荧光标记的核苷酸的图像,并且从DNA中化学除去染料,从而允许下一个循环。另一个例子是AppliedBiosystems的SOLiD技术的使用,所述技术采用边连接边测序(sequencingbyligation)。这一方法基于使用固定长度的所有可能寡核苷酸的库(pool),其根据测序的位置进行标记。将这些寡核苷酸退火并连接。随后,DNA连接酶对匹配序列的优先连接一般导致提供该位置核苷酸信息的信号。由于一般通过乳剂PCR扩增DNA,所以可以将得到的珠(每个仅包含相同DNA分子的拷贝)沉积在载玻片上,从而产生与Illumina测序相当的量和长度的序列。另一种方法基于Helicos的Heliscope技术,其中片段被栓系于阵列的聚胸苷酸(polyT)寡聚体捕获。在每个测序循环中,加入聚合酶和单荧光标记的核苷酸,并对阵列进行成像。随后移除荧光标签并重复循环。包括在本发明方法内的测序技术的其它实例是通过杂交测序、通过使用纳米孔测序、基于显微镜的测序技术、微观流体Sanger测序或基于微芯片的测序方法。本发明还设想了这些技术的进一步开发,例如,进一步提高序列测定的准确性,或确定生物基因组序列所需的时间等。根据一个实施方案,测序方法包括深度测序(deepsequencing)。如本文所用的,术语“深度测序”是指测序方法,其中在单次测试中多次读取靶序列。单个深度测序运行由在相同靶序列上运行的多个测序反应组成,并且每个测序反应产生独立的序列读数。将理解的是,为了分析RNA的量,可使用能够与其或由其产生的cDNA杂交的寡核苷酸。根据一个实施方案,单种寡核苷酸用于确定特定决定子的存在,至少两种寡核苷酸用于确定特定决定子的存在,至少五种寡核苷酸用于确定特定决定子的存在,至少四种寡核苷酸用于确定特定决定子的存在,至少五种或更多种寡核苷酸用于确定特定决定子的存在。当使用多于一种寡核苷酸时,可选择寡核苷酸的序列,从而使得它们与RNA决定子的相同外显子或RNA决定子的不同外显子杂交。在一个实施方案中,寡核苷酸中的至少一种与RNA决定子的3'外显子杂交。在另一个实施方案中,寡核苷酸中的至少一种与RNA决定子的5'外显子杂交。在一个实施方案中,本发明这一方面的方法使用分离的寡核苷酸进行,所述分离的寡核苷酸以序列特异性方式通过互补碱基配对与表1-6中列出的任何决定子的RNA或cDNA杂交,且区分决定子序列与样品中的其它核酸序列。寡核苷酸(例如,DNA或RNA寡核苷酸)一般包含互补核苷酸序列的区域,其在严格条件下与靶核酸分子中的至少约8、10、13、16、18、20、22、25、30、40、50、55、60、65、70、80、90、100、120(或中间的任何其它数目)或更多个连续核苷酸杂交。取决于特定测定,连续核苷酸包括决定子核酸序列。如本文提及寡核苷酸所用的,术语“分离的”是指寡核苷酸,其根据其起源或操作与至少一些与其天然缔合或最初获得时与其缔合的组分分离。“分离的”可选地或另外地意指目的寡核苷酸由人工产生或合成。为了鉴定对任何决定子序列特异的寡核苷酸,一般使用从核苷酸序列的5'或3'末端开始的计算机算法检查目的基因/转录物。然后,一般的算法将鉴定限定长度的寡核苷酸,其对于基因是独特的、具有适合于杂交的范围内的GC含量、缺乏可能干扰杂交的预测的二级结构和/或具有其它期望的特征或缺乏其它不期望的特征。在鉴定寡核苷酸后,可在湿或干条件下测试对决定子的特异性。因此,例如,在寡核苷酸是引物的情况下,可测试引物使用PCR扩增决定子序列以产生可检测产物的能力,以及其不能扩增样品中其它决定子的能力。可在凝胶上分析PCR反应的产物,并根据存在和/或大小进行验证。另外或可替代地,可通过计算机分析来分析寡核苷酸的序列,以查看它是否与其它已知序列同源(或能够与其杂交)。可对所选择的寡核苷酸进行BLAST2.2.10(基本局部比对搜索工具(BasicLocalAlignmentSearchTool))分析(worldwidewebdotncbidotnlmdotnihdotgov/blast/)。BLAST程序找到序列之间的局部相似性区域。它将核苷酸或蛋白质序列与序列数据库进行比较,并计算匹配的统计学显著性,从而提供有关“查询”序列的可能身份和完整性的有价值信息。根据一个实施方案,寡核苷酸是探针。如本文所用的,术语“探针”是指在实验条件下与决定子特异性核酸序列杂交以提供可检测信号、并且不在相同实验条件下与另外的决定子序列杂交以提供可检测信号的寡核苷酸。本发明这一方面的这一实施方案的探针可例如固定于固体支持体(例如,阵列或珠)。固体支持体是固态基质或支持体,本发明的核酸分子可在其上缔合。核酸可直接或间接缔合。用于固体支持体的固态基质可以包括任何固体材料,组分可直接或间接地与其缔合。这包括诸如下述的材料:丙烯酰胺、琼脂糖、纤维素、硝化纤维素、玻璃、金、聚苯乙烯、聚乙烯乙酸乙烯酯、聚丙烯、聚甲基丙烯酸酯、聚乙烯、聚环氧乙烷、聚硅酸盐、聚碳酸酯、聚四氟乙烯,碳氟化合物、尼龙、硅橡胶、聚酐、聚乙醇酸、聚乳酸、聚原酸酯、官能化硅烷、聚富马酸丙酯(polypropylfumerate)、胶原、糖胺聚糖和聚氨基酸。固态基质可以具有任何有用的形式,包括薄膜、膜、瓶、皿、纤维、编织纤维、成型聚合物、颗粒、珠、微粒或其组合。固态基质和固体支持体可以是多孔的或无孔的。芯片是矩形或正方形的小片材料。固态基质的优选形式是薄膜、珠或芯片。用于固态基质的有用形式是微量滴定皿。在一些实施方案中,可以使用多孔载玻片。在一个实施方案中,固体支持体是阵列,其包含固定在固体支持体上的确定或预先确定位置的多个本发明核酸。固体支持体上的每个预先确定位置通常具有一种类型的组分(即,该位置处的所有组分都相同)。可选地,可以将多种类型的组分固定在固体支持体上的相同预先确定位置。每个位置都将具有给定组分的多个拷贝。固体支持体上不同组分的空间分离允许分开检测和鉴定。根据特定实施方案,阵列不包含特异性结合超过50种决定子、超过40种决定子、30种决定子、20种决定子、15种决定子、10种决定子、5种决定子或甚至3种决定子的核酸。用于将寡核苷酸固定于固态基质的方法已经充分确立。可以使用已确立的偶联方法将寡核苷酸(包括地址探针(addressprobes)和检测探针)偶联至基质。例如,合适的附着方法由Pease等人,Proc.Natl.Acad.Sci.USA91(11):5022-5026(1994)和Khrapko等人,MolBiol(Mosk)(USSR)25:718-730(1991)描述。用于在酪蛋白包被的载玻片上固定3'-胺寡核苷酸的方法由Stimpson等人,Proc.Natl.Acad.Sci.USA92:6379-6383(1995)描述。将寡核苷酸附着于固态基质的有用方法由Guo等人,NucleicAcidsRes.22:5456-5465(1994)描述。根据另一个实施方案,寡核苷酸是引物对的引物。如本文所用的,术语“引物”是指在适当条件下(例如,在四种不同的核苷三磷酸和聚合剂,如DNA聚合酶、RNA聚合酶或逆转录酶、DNA连接酶等的存在下,在含有任何必需的辅因子的适当的缓冲溶液中和在合适的一个或多个温度下),使用方法如PCR(聚合酶链反应)或LCR(连接酶链反应),充当模板指导的合成的起始点的寡核苷酸。这种模板指导的合成也称为“引物延伸”。例如,可设计引物对以使用PCR扩增DNA的区域。这样的对将包括“正向引物”和“反向引物”,其与DNA分子的互补链杂交并限定待合成/扩增的区域。本发明这一方面的引物在实验条件下能够连同其对(例如,通过PCR)扩增决定子特异性核酸序列以提供可检测信号,并且在相同的实验条件下不扩增其它决定子核酸序列以提供可检测信号。根据另外的实施方案,寡核苷酸的长度为约8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。尽管探针的最大长度可以与待检测的靶序列一样长,但取决于其使用的测定类型,其长度一般小于约50、60、65或70个核苷酸。在引物的情况下,其长度一般小于约30个核苷酸。在本发明的具体优选实施方案中,引物或探针在约18至约28个核苷酸的长度内。将理解的是,当附着于固体支持体时,探针的长度可为约30-70、75、80、90、100或更多个核苷酸。本发明这一方面的寡核苷酸不需要反映决定子核酸序列的确切序列(即,不需要完全互补),但必须足够互补以在特定实验条件下与决定子核酸序列杂交。因此,寡核苷酸的序列与靶决定子核酸序列一般具有至少70%同源性,优选至少80%、90%、95%、97%、99%或100%同源性,例如在至少13个或更多个邻接核苷酸的区域上。选择条件从而使得寡核苷酸与决定子核酸序列杂交是有利的,并且使与其它决定子核酸序列的杂交最小化。作为例子,短核酸(长度低于200bp,例如,长度为13-50bp)的杂交取决于所期望的严格性可以通过以下杂交规程实现;(i)6×SSC和1%SDS或3MTMACl,0.01M磷酸钠(pH6.8),1mMEDTA(pH7.6),0.5%SDS,100μg/ml变性鲑精DNA和0.1%的脱脂奶粉的杂交溶液,比Tm低1-1.5℃的杂交温度,于比Tm低1-1.5℃的3MTMACl,0.01M磷酸钠(pH6.8),1mMEDTA(pH7.6),0.5%SDS的最终洗涤溶液(严格杂交条件);(ii)6×SSC和0.1%SDS或3MTMACI,0.01M磷酸钠(pH6.8),1mMEDTA(pH7.6),0.5%SDS,100μg/ml变性鲑精DNA和0.1%脱脂奶粉的杂交溶液,比Tm低2-2.5℃的杂交温度,于比Tm低1-1.5℃的3MTMACl,0.01M磷酸钠(pH6.8),1mMEDTA(pH7.6),0.5%SDS的最终洗涤溶液,6×SSC的最终洗涤溶液,和在22℃的最终洗涤(严格至中等杂交条件);和(iii)6×SSC和1%SDS或3MTMACI,0.01M磷酸钠(pH6.8),1mMEDTA(pH7.6),0.5%SDS,100μg/ml变性鲑精DNA和0.1%脱脂奶粉的杂交溶液,比Tm低2.5-3℃的杂交温度,和在22℃6×SSC的最终洗涤溶液(中等杂交溶液)。本发明的寡核苷酸可通过多种方法中的任一种制备(参见,例如,J.Sambrook等人,"MolecularCloning:ALaboratoryManual",1989,第2版,ColdSpringHarbourLaboratoryPress:NewYork,N.Y.;"PCRProtocols:AGuidetoMethodsandApplications",1990,M.A.Innis(Ed.),AcademicPress:NewYork,N.Y.;P.Tijssen"HybridizationwithNucleicAcidProbes--LaboratoryTechniquesinBiochemistryandMolecularBiology(PartsIandII)",1993,ElsevierScience;"PCRStrategies",1995,M.A.Innis(Ed.),AcademicPress:NewYork,N.Y.;和"ShortProtocolsinMolecularBiology",2002,F.M.Ausubel(Ed.),第5版,JohnWiley&Sons:Secaucus,N.J.)。例如,可使用本领域众所周知的多种化学技术中的任一种制备寡核苷酸,包括例如化学合成和基于模板的聚合,如例如在S.A.Narang等人,Meth.Enzymol.1979,68:90-98;E.L.Brown等人,Meth.Enzymol.1979,68:109-151;E.S.Belousov等人,NucleicAcidsRes.1997,25:3440-3444;D.Guschin等人,Anal.Biochem.1997,250:203-211;M.J.Blommers等人,Biochemistry,1994,33:7886-7896;和K.Frenkel等人,FreeRadic.Biol.Med.1995,19:373-380;和美国专利号4,458,066中描述的。例如,可使用基于亚磷酰胺方法的自动化固相程序制备寡核苷酸。在这一方法中,将每个核苷酸个别添加到生长中的寡核苷酸链的5'-末端,其在3'末端附着到固体支持体上。添加的核苷酸是三价3'-亚磷酰胺的形式,其在5'-位被二甲氧三苯甲基(dimethoxytriyl)(或DMT)基团保护免于聚合。在碱诱导的亚磷酰胺偶联后,温和氧化以产生五价磷酸三酯中间体,且DMT去除为寡核苷酸延伸提供新位点。然后将寡核苷酸从固体支持体上切下,并用氢氧化铵将磷酸二酯和环外氨基脱保护。这些合成可在寡核苷酸合成仪上进行,例如可从PerkinElmer/AppliedBiosystems,Inc.(FosterCity,Calif.)、DuPont(Wilmington,Del.)或Milligen(Bedford,Mass.)商购的那些。可选地,寡核苷酸可从本领域众所周知的多种商业来源定制和订购,包括,例如MidlandCertifiedReagentCompany(Midland,Tex.)、ExpressGen,Inc.(Chicago,Ill.)、OperonTechnologies,Inc.(Huntsville,Ala.)和许多其它来源。必要或期望时,本发明的寡核苷酸的纯化可通过本领域众所周知的多种方法中的任一种进行。寡核苷酸的纯化一般通过天然丙烯酰胺凝胶电泳、通过阴离子交换HPLC进行,如例如J.D.Pearson和F.E.Regnier(J.Chrom.,1983,255:137-149)所述的,或通过反相HPLC(G.D.McFarland和P.N.Borer,NucleicAcidsRes.,1979,7:1067-1080)进行。寡核苷酸的序列可以使用任何合适的测序方法来验证,包括但不限于化学降解(A.M.Maxam和W.Gilbert,MethodsofEnzymology,1980,65:499-560)、基质辅助激光解吸电离飞行时间(MALDI-TOF)质谱分析法(U.Pieles等人,NucleicAcidsRes.,1993,21:3191-3196)、碱性磷酸酶和外切核酸酶消化组合后的质谱分析法(H.Wu和H.Aboleneen,Anal.Biochem.,2001,290:347-352)等。如上文已经提及的,可使用本领域已知的几种方法中的任一种制备修饰的寡核苷酸。此类修饰的非限制性实例包括甲基化、“帽”、用类似物取代一个或多个天然存在的核苷酸和核苷酸间修饰,如,例如,具有不带电荷的键(例如,甲基膦酸酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等),或带电荷的键(例如,硫代磷酸酯、二硫代磷酸酯等)的那些。寡核苷酸可含有一个或多个另外的共价连接的部分,如,例如蛋白质(例如,核酸酶、毒素、抗体、信号肽、聚-L-赖氨酸等)、嵌入剂(例如,吖啶、补骨脂素等)、螯合剂(例如,金属、放射性金属、铁、氧化性金属等)和烷化剂。寡核苷酸也可通过形成甲基或乙基磷酸三酯或烷基氨基磷酸酯键来衍生化。此外,本发明的寡核苷酸序列也可用标记修饰。在某些实施方案中,在用于扩增/检测测定之前,用可检测的试剂或部分标记检测探针或扩增引物或探针和引物两者。在某些实施方案中,用可检测试剂标记检测探针。优选地,选择可检测试剂,从而使得其产生信号,所述信号可以被测量,并且其强度与被分析样品中的扩增产物的量相关(例如,成比例)。寡核苷酸和可检测试剂之间的缔合可以是共价的或非共价的。标记的检测探针可以通过参入或缀合可检测部分来制备。标记可以直接附着于核酸序列或间接附着(例如,通过接头)。各种长度的接头或间隔臂在本领域中是已知的并且是可商购的,并且可以进行选择以减少空间位阻,或赋予所得标记的分子其它有用或所期望的性质(参见,例如,E.S.Mansfield等人,Mol.Cell.Probes,1995,9:145-156)。用于标记核酸分子的方法是本领域众所周知的。关于标记规程、标记检测技术和该领域中的最新发展的综述,参见,例如,L.J.Kricka,Ann.Clin.Biochem.2002,39:114-129;R.P.vanGijlswijk等人,ExpertRev.Mol.Diagn.2001,1:81-91;和S.Joos等人,J.Biotechnol.1994,35:135-153。标准核酸标记方法包括:参入放射性试剂,荧光染料(L.M.Smith等人,Nucl.AcidsRes.,1985,13:2399-2412)或酶(B.A.Connoly和O.Rider,Nucl.Acids.Res.,1985,13:4485-4502)的直接附着;使其可免疫化学或通过其它亲和反应检测的核酸分子的化学修饰(T.R.Broker等人,Nucl.AcidsRes.1978,5:363-384;E.A.Bayer等人,MethodsofBiochem.Analysis,1980,26:1-45;R.Langer等人,Proc.Natl.Acad.Sci.USA,1981,78:6633-6637;R.W.Richardson等人,Nucl.AcidsRes.1983,11:6167-6184;D.J.Brigati等人.,Virol.1983,126:32-50;P.Tchen等人,Proc.Natl.Acad.Sci.USA,1984,81:3466-3470;J.E.Landegent等人,Exp.CellRes.1984,15:61-72;和A.H.Hopman等人,Exp.CellRes.1987,169:357-368);和酶介导的标记方法,例如随机引发、切口平移、PCR和用末端转移酶加尾(关于酶促标记的综述,参见,例如,J.Temsamani和S.Agrawal,Mol.Biotechnol.1996,5:223-232)。更近开发的核酸标记系统包括但不限于:ULS(UniversalLinkageSystem),其基于单反应性顺式铂氨衍生物与DNA中鸟嘌呤部分的N7位的反应(R.J.Heetebrij等人,Cytogenet.Cell.Genet.1999,87:47-52),补骨脂素-生物素,其嵌入核酸中并在紫外线照射时与核苷酸碱基共价键合(C.Levenson等人,MethodsEnzymol.1990,184:577-583;和C.Pfannschmidt等人,NucleicAcidsRes.1996,24:1702-1709),光反应性叠氮衍生物(C.Neves等人,BioconjugateChem.2000,11:51-55)和DNA烷化剂(M.G.Sebestyen等人,Nat.Biotechnol.1998,16:568-576)。多种可检测试剂中的任一种都可以用于本发明的实践中。合适的可检测试剂包括但不限于各种配体,放射性核素(例如,32P、35S、3H、14C、125I、131I等);荧光染料(对于特定示例性荧光染料,见下文);化学发光剂(如,例如,吖啶酯(acridiniumester)、稳定的1,2-二氧杂环丁烷等);光谱可分辨的无机荧光半导体纳米晶体(nanocrystals)(即,量子点(quantumdots)),金属纳米颗粒(metalnanoparticles)(例如金、银、铜和铂)或纳米簇(nanoclusters);酶(如,例如,用于ELISA的那些酶,即,辣根过氧化物酶、β-半乳糖苷酶、萤光素酶、碱性磷酸酶);比色标记(如,例如,染料,胶体金等);磁性标记(如,例如,DynabeadsTM);和生物素,dioxigenin或其它可获得抗血清或单克隆抗体的半抗原和蛋白质。在某些实施方案中,本发明的检测探针是荧光标记的。众多已知的具有多种化学结构和物理特征的荧光标记部分适合用于本发明的实践。合适的荧光染料包括但不限于荧光素和荧光素染料(例如,异硫氰酸荧光素(fluoresceinisothiocyanine)或FITC、萘并荧光素(naphthofluorescein)、4',5'-二氯-2',7'-二甲氧基荧光素、6羧基荧光素或FAM),羰花青,部花青,苯乙烯基染料,氧杂菁染料,藻红蛋白,赤藓红,伊红,罗丹明染料(例如,羧基四甲基罗丹明或TAMRA、羧基罗丹明6G、羧基-X-罗丹明(ROX)、丽丝胺罗丹明B、罗丹明6G、罗丹明绿、罗丹明红、四甲基罗丹明或TMR),香豆素和香豆素染料(例如,甲氧基香豆素、二烷基氨基香豆素、羟基香豆素和氨甲基香豆素或AMCA),OregonGreenDyes(例如,OregonGreen488、OregonGreen500、OregonGreen514),德克萨斯红,德克萨斯红-X,SpectrumRed.TM.,SpectrumGreen.TM.,花菁染料(例如,Cy-3TM、Cy-5TM、Cy-3.5TM、Cy-5.5TM),AlexaFluor染料(例如,AlexaFluor350、AlexaFluor488、AlexaFluor532、AlexaFluor546、AlexaFluor568、AlexaFluor594、AlexaFluor633、AlexaFluor660和AlexaFluor680),BODIPY染料(例如,BODIPYFL、BODIPYR6G、BODIPYTMR、BODIPYTR、BODIPY530/550、BODIPY558/568、BODIPY564/570、BODIPY576/589、BODIPY581/591、BODIPY630/650、BODIPY650/665),IRDyes(例如,IRD40、IRD700、IRD800)等。对于合适的荧光染料的更多实例和将荧光染料连接于或参入核酸分子的方法,参见,例如,"TheHandbookofFluorescentProbesandResearchProducts",第9版,MolecularProbes,Inc.,Eugene,Oreg。荧光染料以及标记试剂盒可从例如AmershamBiosciences,Inc.(Piscataway,N.J.)、MolecularProbesInc.(Eugene,Oreg.)和NewEnglandBiolabsInc.(Berverly,Mass.)商购获得。如上所述,可使用扩增反应进行决定子的鉴定。如本文所用的,术语“扩增”是指通过产生所期望序列的多个(即,至少2个)拷贝来增加样品中具体核酸序列群的表现的过程。用于核酸扩增的方法是本领域已知的,并且包括但不限于聚合酶链反应(PCR)和连接酶链反应(LCR)。在一般的PCR扩增反应中,目标核酸序列的量经常比起始样品中的其量放大至少五万倍。“拷贝”或“扩增子”不一定意味着与模板序列的完美序列互补性或同一性。例如,拷贝可以包括核苷酸类似物,例如脱氧肌苷、有意的序列改变(例如通过引物引入的序列改变,所述引物包含可与模板杂交但不互补的序列)和/或在扩增过程中发生的序列错误。一般的扩增反应通过使正向和反向引物(引物对)与样品DNA连同任何另外的扩增反应试剂在允许扩增靶序列的条件下接触来进行。术语“正向引物”和“正向扩增引物”在本文中可互换使用,并且是指与靶(模板链)杂交(或退火)的引物。术语“反向引物”和“反向扩增引物”在本文中可互换使用,并且是指与互补靶链杂交(或退火)的引物。正向引物相对于反向引物与靶序列5'杂交。如本文所用的,术语“扩增条件”是指促进引物序列退火和/或延伸的条件。这些条件在本领域中是众所周知的并且取决于所选择的扩增方法。因此,例如,在PCR反应中,扩增条件通常包括热循环,即,反应混合物在两个或更多个温度之间的循环。在等温扩增反应中,尽管可能需要初始温度升高来起始反应,但在没有热循环的情况下发生扩增。扩增条件包括所有反应条件,包括但不限于温度和温度循环、缓冲液、盐、离子强度和pH等。如本文所用的,术语“扩增反应试剂”是指用于核酸扩增反应的试剂,并且可包括但不限于缓冲液,试剂,具有逆转录酶和/或聚合酶活性或外切核酸酶活性的酶,酶辅因子例如镁或锰,盐,烟酰胺腺嘌呤二核酸酶(NAD)和脱氧核苷三磷酸(dNTP),例如脱氧腺苷三磷酸、脱氧鸟苷三磷酸、脱氧胞苷三磷酸和胸苷三磷酸。本领域技术人员可根据所用的扩增方法容易地选择扩增反应试剂。根据本发明的这一方面,扩增可使用诸如聚合酶链反应(PCR)的技术实现,其包括但不限于等位基因特异性PCR,装配PCR或聚合酶循环装配(PolymeraseCyclingAssembly)(PCA),不对称PCR,解旋酶依赖性扩增,热启动PCR,序列间特异性PCR(Intersequence-specificPCR)(ISSR),反向PCR,连接介导PCR,甲基化特异性PCR(MSP),小引物PCR(MiniprimerPCR),多重连接依赖性探针扩增,多重PCR,嵌套式PCR,重叠序列延伸PCR,定量PCR(Q-PCR),逆转录PCR(RT-PCR),固相PCR:包括多种含义,包括聚合酶集落扩增(PolonyAmplification)(例如,其中PCR集落在凝胶基质中衍生),桥式PCR(引物与固体支持体表面共价连接),常规固相PCR(其中不对称PCR在带有引物的固体支持体存在下应用,所述引物的序列与水性引物之一匹配)和增强的固相PCR(其中通过使用高Tm和嵌套式固体支持体引物,任选应用热‘步骤’以有利于固体支持体引发,可以改善常规固相PCR),交错式热不对称PCR(ThermalasymmetricinterlacedPCR)(TAIL-PCR),递降PCR(逐步下降PCR(Step-downPCR)),PAN-AC和通用快速步移(UniversalFastWalking)。PCR(或聚合酶链反应)技术是本领域众所周知的,并且已公开于例如K.B.Mullis和F.A.Faloona,MethodsEnzymol.,1987,155:350-355和美国专利号4,683,202、4,683,195和4,800,159(其各自整体引入本文作为参考)。在其最简单的形式中,PCR是用于酶促合成具体DNA序列的体外方法,其使用两个寡核苷酸引物,所述引物与相对的链杂交并侧接靶DNA中的目标区域。多个反应循环导致具体DNA片段的指数积累,每个循环包括:变性步骤、退火步骤和聚合步骤("PCRProtocols:AGuidetoMethodsandApplications",M.A.Innis(Ed.),1990,AcademicPress:NewYork;"PCRStrategies",M.A.Innis(Ed.),1995,AcademicPress:NewYork;"Polymerasechainreaction:basicprinciplesandautomationinPCR:APracticalApproach",McPherson等人(Eds.),1991,IRLPress:Oxford;R.K.Saiki等人,Nature,1986,324:163-166)。扩增片段的末端定义为引物的5'末端。能够在PCR反应中产生扩增产物的DNA聚合酶的实例包括但不限于:大肠杆菌(E.coli)DNA聚合酶I,DNA聚合酶I的克列诺片段,T4DNA聚合酶,热稳定DNA聚合酶,其分离自水生栖热菌(Thermusaquaticus)(Taq)(可得自多种来源(例如,PerkinElmer))、嗜热栖热菌(Thermusthermophilus)(UnitedStatesBiochemicals)、嗜热脂肪芽孢杆菌(Bacillusstereothermophilus)(Bio-Rad)或海滨热球菌(Thermococcuslitoralis)(“Vent”聚合酶,NewEnglandBiolabs)。如上所述,可通过将mRNA逆转录成cDNA,并然后进行PCR(RT-PCR)来扩增RNA靶序列。可选地,可将单一酶用于两个步骤,如美国专利号5,322,770中所述的。PCR循环的每个步骤的持续时间和温度以及循环数通常根据实际上的严格性要求进行调整。退火温度和时间控制由预期引物与模板退火的效率和要耐受的错配程度两者确定。最优化反应循环条件的能力完全在本领域普通技术人员的知识范围内。尽管反应循环数可根据所进行的检测分析而变化,但它通常为至少15,更通常至少20,并且可最高达60或更高。然而,在许多情况下,反应循环数一般在约20与约40之间变化。PCR循环的变性步骤通常包括将反应混合物加热至升高的温度并将混合物在升高的温度下保持足以使反应混合物中存在的任何双链或杂交的核酸解离的时间段。为了变性,通常将反应混合物的温度升至并在约85℃至约100℃、通常约90℃至约98℃、并且更通常约93℃至约96℃的温度保持约3至约120秒、通常约5至约30秒的时间段。变性后,使反应混合物经受足以使引物退火至混合物中存在的模板DNA的条件。通常选择降低反应混合物以达到这些条件的温度以提供最佳效率和特异性,并且通常为约50℃至约℃、通常约55℃至约70℃、且更通常约60℃至约68℃。退火条件通常保持约15秒至约30分钟、通常约30秒至约5分钟的时间段。在将引物退火至模板DNA之后或在引物与模板DNA退火期间,使反应混合物经受足以提供用于核苷酸以这样的方式聚合到引物末端的条件,所述方式为,使用与其杂交的DNA作为模板,引物以5'至3'方向延伸(即,足以酶促产生引物延伸产物的条件)。为了实现引物延伸条件,一般将反应混合物的温度升高至约65℃至约75℃、通常约67℃至约73℃的温度,并在该温度保持约15秒至约20分钟、通常约30秒至约5分钟的时间段。上述变性、退火和聚合循环可使用一般称为热循环仪或循环变温器的自动化设备进行。可采用的热循环仪描述于美国专利号5,612,473、5,602,756、5,538,871和5,475,610(各自整体引入本文作为参考)中。热循环仪可从例如PerkinElmer-AppliedBiosystems(Norwalk,Conn.)、BioRad(Hercules,Calif.)、RocheAppliedScience(Indianapolis,Ind.)和Stratagene(LaJolla,Calif.)商购获得。使用本发明的引物获得的扩增产物可使用琼脂糖凝胶电泳和通过溴化乙锭染色和暴露于紫外(UV)光显色、或通过扩增产物的序列分析而检测。根据一个实施方案,可实时实现扩增产物的扩增和定量(qRT-PCR)。一般,QRT-PCR方法使用双链DNA检测分子来实时测量扩增的产物的量。如本文所用的,短语“双链DNA检测分子”是指产生可定量的信号(例如,荧光信号)的双链DNA相互作用分子。例如,这种双链DNA检测分子可以是荧光染料,其(1)与DNA片段或扩增子相互作用,和(2)在存在双链体形成中的扩增子的情况下,以不同于存在分离的扩增子的情况下的波长发射。双链DNA检测分子可以是双链DNA嵌入检测分子或基于引物的双链DNA检测分子。双链DNA嵌入检测分子不与引物、扩增子或核酸模板共价连接。检测分子在双链DNA存在下增加其发射,并在双链体DNA解开时减少其发射。实例包括但不限于溴化乙锭、YO-PRO-1、Hoechst33258、SYBRGold和SYBRGreenI。溴化乙锭是一种荧光化学药品,其嵌入双链DNA片段中的碱基对之间并且通常用于在凝胶电泳后检测DNA。当被254nm至366nm的紫外光激发时,它于590nm发射荧光。DNA-溴化乙锭复合体产生的荧光是在单链DNA存在下的溴化乙锭的约50倍。SYBRGreenI在497nm处激发并在520nm处发射。相对于单链DNA,在结合双链DNA时,SYBRGreenI的荧光强度增加超过100倍。SYBRGreenI的替换物是MolecularProbesInc.提出的SYBRGold。与SYBRGreenI类似,SYBRGold的荧光发射在双链体中DNA存在下增强,并且当双链DNA解开时减少。然而,SYBRGold的激发峰在495nm,且发射峰在537nm。据报道,SYBRGold似乎比SYBRGreenI更稳定。Hoechst33258是一种已知的双苯酰亚胺(bisbenzimide)双链DNA检测分子,其与双链体中DNA的富含AT区域结合。Hoechst33258在350nm处激发并在450nm处发射。据报道,在450nm激发并在550nm发射的YO-PRO-1是双链DNA特异性检测分子。在本发明的特定实施方案中,双链DNA检测分子是SYBRGreenI。基于引物的双链DNA检测分子与引物共价连接,并且当扩增子形成双链体结构时增加或减少荧光发射。当基于引物的双链DNA检测分子靠近引物的3'末端附着并且引物末端碱基是dG或dC时,观察到增加的荧光发射。检测分子在末端dC-dG和dG-dC碱基对附近猝灭,并且当检测分子远离引物末端至少6个核苷酸在内部定位时,由于扩增子的双链体形成的结果而去猝灭(dequench)。去猝灭导致荧光发射的相当大增加。这些类型的检测分子的实例包括但不限于荧光素(在488nm激发并在530nm发射)、FAM(在494nm激发并在518nm发射)、JOE(在527激发并在548发射)、HEX(在535nm激发并在556nm发射)、TET(在521nm激发并在536nm发射)、AlexaFluor594(在590nm激发并在615nm发射)、ROX(在575nm激发并在602nm发射)和TAMRA(在555nm激发并在580nm发射)。相对照而言,相对于单链DNA,一些基于引物的双链DNA检测分子在存在双链DNA的情况下减少它们的发射。实例包括但不限于罗丹明和BODIPY-FI(在504nm激发并在513nm发射)。这些检测分子通常与引物在5'末端dC或dG处共价缀合,并且当扩增子处于双链体时发出较少的荧光。据信,双链体形成时荧光的减少是由于密切接近检测分子的互补链中鸟苷的猝灭或末端dC-dG碱基对的猝灭。根据一个实施方案,基于引物的双链DNA检测分子是5'核酸酶探针。这种探针在寡核苷酸的5'或3'末端参入荧光报道分子,且在相对末端参入猝灭剂。扩增过程的第一步涉及加热以使双链DNA靶分子变性为单链DNA。在第二步期间,正向引物与DNA的靶链退火并通过Taq聚合酶延伸。然后将反向引物和5'核酸酶探针与这一新复制的链退火。在这一实施方案中,引物对或5'核酸酶探针中的至少一个应与独特的决定子序列杂交。聚合酶从靶链延伸并切割探针。在切割时,报道分子不再因其接近猝灭剂而猝灭,并且荧光被释放。每次复制都将导致探针的切割。结果,荧光信号将与扩增产物的量成比例地增加。除了区分病毒和细菌感染之外,本申请中描述的决定子可用于区分感染性(细菌或病毒)和非感染性受试者。在一个实施方案中,决定子是出现在表16E中的决定子。对于表征为在感染期间增加的表16E中的决定子,当该决定子高于预定阈值时,其指示受试者具有感染。对于表征为不由于感染而增加的表16E中的决定子,那么当决定子高于预定阈值时,其指示受试者不具有感染。在一个实施方案中,本发明这一方面的非感染性受试者具有SIRS并且感染性受试者具有脓毒症。SIRS是与全身性炎症、器官功能异常和器官衰竭相关的严重疾病。它定义为以下变量中的2个或更多:发热超过38℃(100.4°F)或低于36℃(96.8°F);心搏率超过每分钟90次跳动;呼吸频率超过每分钟20次呼吸或动脉二氧化碳张力(PaCO2)低于32mmHg;异常白细胞计数(>12,000/μL或<4,000/μL或>10%未成熟[带]形式(immature[band]forms))。SIRS是非特异性的,并且可由局部缺血、炎症、创伤、感染或几种联合损伤引起。因此,SIRS并不总是与感染有关。脓毒症是一种威胁生命的状况,其由对感染的炎症反应引起。它目前被诊断为在存在已知感染的情况下存在SIRS标准。在疾病快速进展到超过初始阶段到更严重的阶段例如与高死亡率相关的严重脓毒症或脓毒性休克之前,脓毒症的早期诊断对于临床干预是必要的。然而,与急性组织损伤和先天免疫激活相关的非感染性SIRS可以诱导类似于脓毒症的临床综合征,包括多发性创伤、胰腺炎、烧伤和自身免疫病。目前的诊断在其区分SIRS和脓毒症的能力方面有限。因此,对能够在脓毒症的准确和及时诊断中提供附加值的新的生物标志或生物标志的组合存在需求。因此,本发明这一方面的方法可用于区分具有SIRS(且无感染)的受试者和具有脓毒症的受试者。如果受试者具有脓毒症,那么来自表16E的RNA中的至少一种高于预定水平(例如,高于不具有感染的受试者,例如健康受试者中的量)。可用于区分非感染性SIRS和感染性脓毒症的所考虑的RNA决定子对或三联体包括表16E中出现的任何决定子对或三联体。可用于区分非感染性SIRS和感染性脓毒症的示例性RNA决定子对包括但不限于:FCGR1C+SGK1、FCGR1A+SGK1、FCGR1B+SGK1、AIM2+SGK1、TIFA+SGK1、LMNB1+SGK1、SGK1+MYBL1、SGK1+ZNF438、SGK1+KLRB1、TLR5+SGK1、SGK1+CD274、SGK1+ANKRD22、SGK1+CARD17、SGK1+LILRA5、SGK1+CLEC4D、SGK1+KLRG1、SGK1+MAP2K6、SGK1+PSTPIP2、KLRB1+CASS4、DDX60L+SGK1、SGK1+TNFSF13B、SGK1+C19orf59、ZNF438+CASS4、OR56B1+CD177P1、OAS1+KLRB1、OAS1+MAP2K6、AIM2+CASS4、CHI3L1+CARD17、TLR5+CASS4和PLSCR1+SGK1。此外,本申请中描述的决定子可用于区分细菌感染和非细菌感染。在一个实施方案中,决定子是出现在表16D中的一个。对于表16D中表征为在细菌感染期间增加的决定子,当该决定子高于预定阈值时,其指示受试者具有细菌感染。对于表16D中表征为由于非细菌感染而增加的决定子,那么当决定子高于预定阈值时,其指示受试者不具有细菌感染。mRNA是蛋白质的生物前体,并且预期其表达水平的变化先于其蛋白质对应物的变化。因此,蛋白质和RNA生物标志在它们的时间动力学模式中可能不同,并且可以在症状发作之前或恢复期之后相互补充以检测感染。因此,将理解的是,除了确定本文所述的RNA决定子的水平之外,本发明人还预期将这些测量与已知指示感染类型的多肽决定子的测量相结合。本发明预期的多肽决定子的实例包括WO2013/117746、WO2011/132086、PCT申请IL2015/051024和PCT申请IL2015/051201中描述的那些,其各自的内容引入本文作为参考。本发明人预期的其它多肽决定子是本文所述RNA决定子的多肽对应物。本发明人预期的多肽的实例是下文表15中列出的那些多肽。其它实例包括但不限于:TRAIL、CRP、IP-10、MX1、RSAD2、PCT、OTOF、PI3、CYBRD1、EIF2AK2和CMPK2。表15。本发明人预期的多肽组合的实例包括但不限于:TRAIL+CRP+IP-10;MX1+CRP;MX1+RSAD2;CRP+RSAD2;MX1+CRP+RSAD2;MX1+CRP+PCT;MX1+CRP+TRAIL;TRAIL+CRP+RSAD2;和OTOF、PI3、CYBRD1、EIF2AK2和CMPK2。RNA决定子和多肽决定子的特定组合包括但不限于:TRAIL多肽+RSAD2RNA;TRAIL多肽+MX1RNA;TRAIL多肽+IFI44RNA;TRAIL多肽+IFI44LRNA;TRAIL多肽+IFI27RNA;CRP多肽+RSAD2RNA;CRP多肽+MX1RNA;CRP多肽+IFI44RNA;CRP多肽+IFI44LRNA;CRP多肽+IFI27RNA;TRAIL多肽+CRP多肽+RSAD2RNA;TRAIL多肽+CRP多肽+MX1RNA;TRAIL多肽+CRP多肽+IFI44RNA;TRAIL多肽+CRP多肽+IFI44LRNA;TRAIL多肽+CRP多肽+IFI27RNA。因此,在本发明的另一方面,提供了区分细菌和病毒感染的患者的方法,所述方法包括分析选自表1-6或15A-B的多种RNA决定子之一并分析指示感染类型的多肽决定子例如CRP或TRAIL。多肽决定子和RNA决定子的示例性预期组合提供于下文实施例部分的表21中。可组合RNA和蛋白质决定子的测量结果以提供单个预测评分。在另一个实施方案中,多肽决定子的水平用于初步筛选具有怀疑的感染的受试者,并且RNA决定子的水平仅在多肽测试不确定的情况下用作随后测试(例如,高于/低于预定的阈值)。可选地,RNA决定子的水平用于初步筛选具有怀疑的感染的受试者,并且多肽决定子的水平仅在多肽测试不确定的情况下用作随后测试(例如,高于/低于预定的阈值)。在本发明的另一个不同的实施方案中,将由表1-6中列出的RNA决定子组成的RNA识别标志与它们的蛋白质对应物组合,以提高诊断准确性。测量多肽水平的方法是本领域众所周知的,并且包括例如基于对蛋白质、适体或分子印记的抗体的免疫测定。多肽决定子可以以任何合适的方式检测,但一般通过使来自受试者的样品与结合决定子的抗体接触、然后检测反应产物的存在或不存在而检测。抗体可为单克隆的、多克隆的、嵌合的或前述的片段,如上面详细讨论的,并且检测反应产物的步骤可用任何合适的免疫测定进行。来自受试者的样品一般是如上所述的生物样品,并且可为与用于进行上述方法的生物样品相同的样品。在一个实施方案中,特异性结合决定子的抗体(直接或间接地)附着至产生信号的标记,包括但不限于放射性标记、酶标记、半抗原、报道染料或荧光标记。根据本发明的一些实施方案进行的免疫测定可为均相测定或多相测定。在均相测定中,免疫反应通常涉及特异性抗体(例如,抗决定子抗体)、标记的分析物和目标样品。在抗体与标记的分析物结合时,直接或间接地修饰由标记产生的信号。免疫反应和其程度的检测都可以在均相溶液中进行。可使用的免疫化学标记包括自由基、放射性同位素、荧光染料、酶、噬菌体或辅酶。在多相测定方法中,试剂通常是样品、抗体和产生可检测信号的工具。可使用如上所述的样品。可以将抗体固定在支持体例如珠(例如A蛋白和G蛋白琼脂糖珠)、板或载玻片上,并与在液相中怀疑含有抗原的样品接触。然后将支持体与液相分离,并使用产生可检测信号的工具检查支持体相或液相的这种信号。信号与样品中分析物的存在有关。产生可检测信号的工具包括使用放射性标记、荧光标记或酶标记。例如,如果待检测的抗原含有第二结合位点,则与该位点结合的抗体可以与可检测基团缀合,并在分离步骤之前加入到液相反应溶液中。固体支持体上可检测基团的存在表明测试样品中存在抗原。合适的免疫测定的实例是寡核苷酸、免疫印迹、免疫荧光方法、免疫沉淀法、化学发光方法、电化学发光(ECL)或酶联免疫测定。本领域技术人员将熟悉众多具体免疫测定形式及其变形,其可用于实施本文公开的方法。通常参见E.Maggio,Enzyme-Immunoassay,(1980)(CRCPress,Inc.,BocaRaton,Fla.);也参见授予Skold等人的美国专利号4,727,022,名称为“MethodsforModulatingLigand-ReceptorInteractionsandtheirApplication”,授予Forrest等人的美国专利号4,659,678,名称为“ImmunoassayofAntigens”,授予David等人的美国专利号4,376,110,名称为“ImmunometricAssaysUsingMonoclonalAntibodies”,授予Litman等人的美国专利号4,275,149,名称为“MacromolecularEnvironmentControlinSpecificReceptorAssays”,授予Maggio等人的美国专利号4,233,402,名称为“ReagentsandMethodEmployingChanneling”,和授予Boguslaski等人的美国专利号4,230,767,名称为“HeterogenousSpecificBindingAssayEmployingaCoenzymeasLabel”。也可以使用流式细胞术用抗体检测决定子。本领域技术人员将熟悉可用于实施本文公开的方法的流式细胞术技术(Shapiro2005)。这些包括但不限于CytokineBeadArray(BectonDickinson)和Luminex技术。可以根据已知技术将抗体缀合至适合诊断测定的固体支持体(例如珠,例如A蛋白或G蛋白琼脂糖,小球体,板,载玻片或由诸如乳胶或聚苯乙烯的材料形成的孔),例如被动结合。如本文所述的抗体同样可根据已知技术缀合至可检测的标记或基团,例如放射性标记(例如,35S、125I、131I)、酶标记(例如,辣根过氧化物酶、碱性磷酸酶)和荧光标记(例如,荧光素、Alexa、绿色荧光蛋白、罗丹明)。抗体还可用于检测决定子蛋白质、多肽、突变和多态性的翻译后修饰,例如酪氨酸磷酸化、苏氨酸磷酸化、丝氨酸磷酸化、糖基化(例如,O-GlcNAc)。这种抗体特异性地检测一个或多个目的蛋白质中的磷酸化氨基酸,并且可用于本文所述的免疫印迹、免疫荧光和ELISA测定。这些抗体是本领域技术人员众所周知的,并且可商购获得。也可以使用反射(reflector)基质辅助激光解吸电离-飞行时间质谱分析法(MALDI-TOF)中的亚稳离子来确定翻译后修饰(WirthU.和MullerD.2002)。对于已知具有酶活性的决定子-蛋白质、多肽、突变和多态性,可以使用本领域已知的酶测定在体外确定活性。这种测定除了其他之外包括但不限于激酶测定、磷酸酶测定、还原酶测定。酶活性动力学的调节可以通过使用已知算法测量速率常数KM来确定,例如希尔图、米-曼方程、线性回归图如Lineweaver-Burk分析和Scatchard图。用于检测决定子的抗体的合适来源包括商业上可获得的来源,如,例如,Abazyme、Abnova、AssayPro、AffinityBiologicals、AntibodyShop、Avivabioscience、Biogenesis、BiosenseLaboratories、Calbiochem、CellSciences、ChemiconInternational、Chemokine、Clontech、Cytolab、DAKO、DiagnosticBioSystems、eBioscience、EndocrineTechnologies、EnzoBiochem、Eurogentec、FusionAntibodies、GenesisBiotech、GloboZymes、HaematologicTechnologies、Immunodetect、Immunodiagnostik、Immunometrics、Immunostar、Immunovision、Biogenex、Invitrogen、JacksonImmunoResearchLaboratory、KMIDiagnostics、KomaBiotech、LabFrontierLifeScienceInstitute、LeeLaboratories、Lifescreen、MaineBiotechnologyServices、Mediclone、MicroPharmLtd.、ModiQuest、MolecularInnovations、MolecularProbes、Neoclone、Neuromics、NewEnglandBiolabs、Novocastra、NovusBiologicals、OncogeneResearchProducts、Orbigen、OxfordBiotechnology、Panvera、PerkinElmerLifeSciences、Pharmingen、PhoenixPharmaceuticals、PierceChemicalCompany、PolymunScientific、Polysiences,Inc.、PromegaCorporation、Proteogenix、ProtosImmunoresearch、QEDBiosciences,Inc.、R&DSystems、Repligen、ResearchDiagnostics、Roboscreen、SantaCruzBiotechnology、SeikagakuAmerica、SerologicalCorporation、Serotec、SigmaAldrich、StemCellTechnologies、SynapticSystemsGmbH、Technopharm、TerraNovaBiotechnology、TiterMax、TrilliumDiagnostics、UpstateBiotechnology、USBiological、VectorLaboratories、WakoPureChemicalIndustries和Zeptometrix。但是,技术人员可以常规地制备针对本文所述的任何多肽决定子的抗体。在本发明的上下文中,“受试者”可为哺乳动物(例如,人、狗、猫、马、牛、绵羊、猪、山羊)。根据另一个实施方案,受试者是鸟(例如,鸡、火鸡、鸭或鹅)。根据特定实施方案,受试者是人。受试者可为雄性或雌性。受试者可为成年人(例如,大于18、21或22岁或儿童(例如,小于18、21或22岁)。在另一个实施方案中,受试者是青少年(12至21岁)、婴儿(29天至小于2岁)或新生儿(出生至生命的前28天)。受试者可以是先前已经被诊断或被鉴定为具有感染的受试者,并且任选地已经经历或正在经历用于感染的治疗性干预。可选地,受试者也可以是先前未被诊断为具有感染的受试者。例如,受试者可以是表现出一种或多种具有感染的危险因子的受试者。将理解的是,可根据特定受试者选择用于诊断感染的标志。用于划入儿童(例如,低于21岁或低于18岁)中感染类型的特别准确的RNA决定子包括但不限于SIGLEC1、IFI27、n334829、LY6E、USP41、USP18、uc003hrl.1、n332456、n332510、GAS7、TCONS_00003184-XLOC_001966、OAS1、n333319、OASL、IFI44L、SULT1B1。用于划入成年人中感染类型的特别准确的RNA决定子包括但不限于IFI44、DGAT2、PYGL、n407780、ZCCHC2、PARP12、TRIB2。用于划入男性受试者中感染类型的特别准确的RNA决定子包括但不限于DDX60、ZCCHC2、LY6E、IFI44、n332510、IFIT1、OAS1、TCONS_00003184-XLOC_001966、PNPT1。用于划入女性受试者中感染类型的特别准确的RNA决定子包括但不限于n407780、CYP1B1、IMPA2、KREMEN1、n332456、CR1、GAS7、PARP12、n333319、PPM1K、n334829、IFI27、uc003hrl.1、SULT1B1、LTA4H。在特定实施方案中,受试者表现出肺炎症状并进行测试以确定肺炎来源是来自细菌感染还是来自病毒感染。对于这一用途特别推荐的决定子是下文实施例部分的表23中列出的那些中的至少一种。在另一个实施方案中,所述受试者表现出流感或副流感的症状。用于划入流感的特定RNA决定子包括SIGLEC1、n332456、DDX60、HER6和TCONS_00003184-XLOC_001966。用于划入副流感的特定RNA决定子包括CYP1B1、GAS7和TCONS_00003184-XLOC_001966。当CYP1B1、GAS7低于预定水平(例如,低于在健康或未感染受试者的相同样品类型中发现的水平)时,划入副流感感染。当TCONS_00003184-XLOC_001966高于预定水平(例如,高于在健康或未感染受试者的相同样品类型中发现的水平)时,划入副流感感染。当SIGLEC1、n332456、DDX60、HER6或TCONS_00003184-XLOC_001966高于预定水平时,划入流感感染。在另一个实施方案中,RNA决定子用于划入CMV、EBV或博卡病毒(Bocavirus)。因此,例如,当SLUT1B1的水平低于预定水平(例如,低于在健康或未感染受试者的相同样品类型中发现的水平)时,划入CMV、EBV或博卡病毒感染。特定的RNA决定子也显示在区分病毒感染和革兰氏阴性细菌的细菌感染方面高度准确。这种RNA决定子列于下文实施例部分的表22中。试剂盒本发明的一些方面还包括决定子检测试剂,例如以试剂盒形式包装在一起的寡核苷酸或抗体。试剂盒可在分开的容器中包含:寡核苷酸或抗体(或者已经与固体基质结合,或者与用于将它们结合到基质的试剂分开包装),对照制剂(阳性和/或阴性),和/或可检测标记,如荧光素、绿色荧光蛋白、罗丹明、花菁染料、Alexa染料、萤光素酶、放射性标记等。可检测标记可附着于第二抗体,所述第二抗体结合识别决定子的抗体的Fc部分。可检测标记也可附着于寡核苷酸。用于进行测定的说明书(例如,书面的、磁带、VCR、CD-ROM等)可包括在试剂盒中。本发明这一方面的试剂盒可包含有助于检测决定子的另外组分,例如酶、盐、缓冲液等,它们是进行检测反应所必需的。因此,根据本发明的另一个方面,提供了用于诊断感染类型的试剂盒,其包含至少两种决定子检测试剂,其中所述至少两种决定子检测试剂中的第一种特异性地检测表1或表2中列出的第一决定子,且所述至少两种决定子检测试剂中的第二种特异性地检测表1-6或表15A-B中任一个中列出的第二决定子。根据本发明的这一方面,所述至少两种决定子检测试剂包括RNA检测试剂(例如,寡核苷酸,如上文所述的)或蛋白质检测试剂(抗体,如上文所述的)。检测试剂可附着于如上所述的可检测部分。优选地,试剂盒含有许多检测试剂,从而使得可以检测不超过20种决定子(例如,RNA)。优选地,试剂盒含有许多检测试剂,从而使得可以检测不超过10种决定子(例如,RNA)。优选地,试剂盒含有许多检测试剂,从而使得可以检测不超过5种决定子(例如,RNA)。优选地,试剂盒含有许多检测试剂,从而使得可以检测不超过3种决定子(例如,RNA)。优选地,试剂盒含有许多检测试剂,从而使得可以检测不超过2种决定子(例如,RNA)。在一个实施方案中,试剂盒中的检测试剂仅能够检测出现在表1-6或表15A-B中的决定子。在另一个实施方案中,试剂盒中的检测试剂仅能够检测出现在表1-6或表16A中的决定子。在另一个实施方案中,试剂盒中的检测试剂仅能够检测出现在表1-2中的决定子。根据进一步的实施方案,本发明的试剂盒包含检测试剂,从而使得可以分析表9、11、12、17或18中列出的决定子对。根据进一步的实施方案,本发明的试剂盒包含检测试剂,从而使得可以分析表13、14、19或20中列出的决定子三联体。根据本发明的另一个方面,提供了用于诊断感染类型的试剂盒,其包含至少两种决定子检测试剂,其中所述至少两种RNA检测试剂中的第一种特异性地检测表3或表4中列出的第一RNA,且所述至少两种RNA检测试剂中的第二种特异性地检测表1-6或表15A-B中任一个中列出的第二RNA,其中所述试剂盒包含特异性地检测不超过20种RNA的检测试剂。优选地,本发明这一方面的试剂盒含有许多检测试剂,从而使得可以检测不超过10种决定子(例如,RNA)。优选地,本发明这一方面的试剂盒含有许多检测试剂,从而使得可以检测不超过5种决定子(例如,RNA)。优选地,本发明这一方面的试剂盒含有许多检测试剂,从而使得可以检测不超过3种决定子(例如,RNA)。优选地,本发明这一方面的试剂盒含有许多检测试剂,从而使得可以检测不超过2种决定子(例如,RNA)。根据另一方面,提供了用于诊断感染类型的试剂盒,其包含至少两种决定子检测试剂,其中所述至少两种决定子检测试剂中的第一种特异性地检测表1-6或16A中任一个中列出的第一决定子,且所述至少两种决定子检测试剂中的第二种特异性地检测表1-6或16A中任一个中列出的第二决定子,其中所述试剂盒包含特异性地检测不超过5种决定子的检测试剂。本发明的一些方面还可用于在许多环境中筛选患者或受试者群体。例如,健康维护组织(healthmaintenanceorganization)、公共卫生实体(publichealthentity)或学校健康计划(schoolhealthprogram)可以筛选一组受试者以鉴定需要干预的那些,如上所述,或用于收集流行病学数据。保险公司(例如,健康、人寿或伤残)可在确定承保范围或定价的过程中筛选申请人,或者筛选现有客户用于可能的干预。在这种群体筛选中收集的数据,特别是当被诸如感染的状况的任何临床进展限制时,将在例如健康维护组织、公共卫生计划和保险公司的操作中具有价值。这种数据阵列或数据集可以存储在机器可读介质中并且用于许多健康相关的数据管理系统中以提供改进的保健服务、成本有效的保健、改进的保险操作等。参见,例如,美国专利申请号2002/0038227;美国专利申请号US2004/0122296;美国专利申请号US2004/0122297;和美国专利号5,018,067。这种系统可以直接从内部数据存储器访问数据或者从一个或多个数据存储站点远程访问数据,如本文进一步详述的。机器可读存储介质可以包括用机器可读数据或数据阵列编码的数据存储材料,当使用编程有用于使用数据的指令的机器时,所述数据存储材料能够用于多种目的。可以在可编程计算机上执行的计算机程序中实现对本发明的生物标志的有效量的测量和/或由那些生物标志得到的风险评价,所述计算机尤其包括处理器、数据存储系统(包括易失性和非易失性存储器和/或存储元件)、至少一个输入设备和至少一个输出设备。程序代码可以应用于输入数据以执行上述功能并生成输出信息。根据本领域已知的方法,输出信息可以应用于一个或多个输出设备。计算机可为例如传统设计的个人计算机、微型计算机或工作站。每个程序都可以以高级过程式或面向对象的编程语言实现,以与计算机系统通信。但是,如果期望,程序可以以汇编语言或机器语言实现。语言可以是编译或解释语言。每个这样的计算机程序都可以存储在可由通用或专用可编程计算机读取的存储介质或设备(例如,ROM或磁盘或本公开内容中其它地方定义的其它)上,用于在由计算机读取存储介质或设备时配置和操作计算机以执行本文所述的过程。在本发明的一些方面中使用的健康相关的数据管理系统还可被认为实现为配置有计算机程序的计算机可读存储介质,其中如此配置的存储介质使得计算机以特定的和预先确定的方式操作以执行本文描述的各种功能。在其一些实施方案中,本发明的决定子可以用于产生那些没有感染的受试者的“参考决定子谱”。本文公开的决定子还可以用于产生取自具有感染的受试者的“受试者决定子谱”。可以将受试者决定子谱与参考决定子谱进行比较,以诊断或鉴定具有感染的受试者。可以比较不同感染类型的受试者决定子谱以诊断或鉴定感染类型。在本发明的一些实施方案中,本发明的参考和受试者决定子谱可以包含在机器可读介质中,例如但不限于,诸如可由VCR读取的那些的模拟磁带、CD-ROM、DVD-ROM、USB闪存介质(flashmedia)等。这种机器可读介质还可以包含另外的测试结果,例如但不限于临床参数和传统实验室危险因子的测量结果。可选地或另外地,机器可读介质还可以包含诸如病史和任何相关家族史的受试者信息。机器可读介质还可以含有与其它疾病风险算法和计算的指数有关的信息,例如本文所述的那些。治疗方案的有效性可以通过随着时间的过去检测从受试者获得的样品的有效量(可为一种或多种)的决定子并比较检测的决定子的量来监控。例如,可以在受试者接受治疗之前获得第一样品,并且在受试者治疗之后或期间采取一个或多个后续样品。例如,本发明的方法可用于区分细菌、病毒和混合感染(即,细菌和病毒共感染)。这将允许患者得到相应地分层和治疗。在本发明的具体实施方案中,如下提供对于受试者的治疗推荐(即,选择治疗方案):根据公开的方法中的任何一种的方法鉴定受试者中的感染类型(即,细菌、病毒、混合感染或无感染),并且如果受试者被鉴定为具有细菌感染或混合感染,则推荐受试者接受抗生素治疗;或者如果受试者被鉴定为具有病毒感染,则推荐抗病毒治疗。在另一个实施方案中,本发明的方法可用于推动另外的靶向诊断,例如病原体特异性PCR、胸X-射线、培养等。例如,根据本发明的实施方案指示病毒感染的诊断可推动使用另外的病毒特异性多重PCR,而根据本发明的实施方案指示细菌感染的诊断可推动使用细菌特异性多重PCR。因此,人们可以降低不必要的昂贵诊断学的成本。在具体实施方案中,如下提供对于受试者的诊断测试推荐:根据任何公开的方法鉴定受试者中的感染类型(即,细菌、病毒、混合感染或无感染),并且如果受试者被鉴定为具有细菌感染或混合感染,则推荐测试以确定细菌感染的来源;或者如果受试者被鉴定为具有病毒感染,则推荐测试以确定病毒感染的来源。本发明的性能和准确性度量如上文所指出的,可以多种方式评估本发明的性能以及因此绝对和相对临床有用性。在各种性能评估中,本发明的一些方面意图是提供临床诊断和预后的准确性。诊断或预后测试、测定或方法的准确性涉及测试、测定或方法区分具有感染的受试者的能力,基于受试者是否具有决定子水平的“显著改变”(例如,临床上显著的和诊断上显著的)。“有效量”是指测量适当数目的决定子(其可为一种或多种)以产生与对于该一种或多种决定子的预定截止点(或阈值)不同的“显著改变”(例如,决定子的表达或活性水平),并且因此表明受试者具有该一种或多种决定子是其指示的感染。决定子水平的差异优选是统计学上显著的。如下文所指出的,并且不受本发明的任何限制,实现统计学显著性,并且因此优选的分析、诊断和临床准确性,可能需要在小组(panel)中一起使用几种决定子的组合并与数学算法组合以实现统计学上显著的决定子指数。在疾病状态的分类诊断中,改变测试(或测定)的截止点(cutpoint)或阈值通常改变灵敏度和特异性,但是是以定性反比关系的。因此,在评估建议的评估受试者状况的医学测试、测定或方法的准确性和有用性中,人们应始终考虑灵敏度和特异性两者,并注意在报告灵敏度和特异性处的截止点是什么,这是因为灵敏度和特异性在截止点范围内可显著变化。实现这一点的一种方式是通过使用Matthews相关系数(MCC)度量标准,所述度量标准取决于灵敏度和特异性两者。当使用本发明的一些方面时,对于大多数分类风险度量,优选使用诸如ROC曲线下面积(AUC)的统计量,包括所有潜在的截止点值,而对于连续风险度量,优选使用拟合优度和对观察结果或其它黄金标准的校准的统计量。预定水平的可预测性是指所述方法提供可接受水平的临床或诊断准确性。使用这样的统计量,“可接受的诊断准确性程度”在本文中定义为测试或测定(例如,在本发明的一些方面中用于确定临床上显著的决定子存在的测试,其因此表明存在感染类型),其中AUC(用于测试或测定的ROC曲线下面积)为至少0.60,期望地为至少0.65,更期望地为至少0.70,优选为至少0.75,更优选为至少0.80,且最优选为至少0.85。“非常高的诊断准确性程度”是指测试或测定,其中AUC(用于测试或测定的ROC曲线下面积)为至少0.75,0.80,期望地为至少0.85,更期望地为至少0.875,优选至少0.90,更优选至少0.925,且最优选至少0.95。可选地,所述方法预测感染或对治疗的反应的存在或不存在,总准确性为至少75%,更优选80%、85%、90%、95%、97%、98%、99%或更高的总准确性。可选地,所述方法预测细菌感染或对治疗的反应的存在,灵敏度为至少75%,更优选80%、85%、90%、95%、97%、98%、99%或更高的灵敏度。可选地,所述方法预测病毒感染或对治疗的反应的存在,特异性为至少75%,更优选80%、85%、90%、95%、97%、98%、99%或更高的特异性。可选地,所述方法以大于0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9或1.0的MCC预测感染或对治疗的反应的存在或不存在。一般而言,当相关医学学会和医学实践尚未明确定义疾病类别时,在治疗用途的阈值尚未确定,或者不存在用于诊断未病(pre-disease)的黄金标准的情况下,确定诊断准确性的可选方法通常用于连续度量。对于连续的风险度量,计算的指数的诊断准确性度量一般基于曲线拟合和预测的连续值与实际观测值(或历史指数计算值)之间的校准,并利用诸如R平方、Hosmer-LemeshowP-值统计量和置信区间的度量。基于历史观察群的预测报告使用这种算法的预测值并不罕见,包括置信区间(通常为90%或95%CI),如在通过GenomicHealth,Inc.(RedwoodCity,California)商业化的未来乳腺癌复发风险的测试中。通常,通过定义诊断准确性程度,即ROC曲线上的截止点,定义可接受的AUC值以及确定构成本发明的决定子的有效量的相对浓度的可接受范围允许本领域技术人员以预定水平的可预测性和性能使用决定子来鉴定、诊断或预测受试者。此外,其它未列出的生物标志将与决定子非常高度相关(对本申请来说,当它们具有0.5或更高的测定系数(R2)时,任何两个变量将被认为是“非常高度相关的”)。本发明的一些方面包括上述决定子的这种功能和统计学等价物。此外,这种另外的决定子的统计学效用基本上取决于多种生物标志之间的互相关联,并且将经常需要任何新的生物标志在小组内操作以阐明潜在生物学的含义。在本发明的一些实施方案中,可以在本发明的实践中检测列出的决定子中的一种或多种。例如,可以检测二(2)、三(3)、四(4)、五(5)、十(10)、十五(15)、二十(20)、四十(40)或更多种决定子。在一些方面,可以检测本文列出的所有决定子。可以从中检测决定子的数目的优选范围包括由选自1,和特别是2、3、4、5、6、7、8、910、20或40之间的任何最小值定界的范围。特别优选的范围包括2至5(2-5)、2至10(2-10)、2至20(2-20)或2至40(2-40)。决定子小组的构建决定子的分组可以包括在“小组”中,也称为“决定子-识别标志”、“决定子识别标志”或“多决定子识别标志”。在本发明的上下文中的“小组”是指包括一种或多种决定子的一组生物标志(无论它们是决定子、临床参数还是传统实验室危险因子)。小组还可以包含另外的生物标志,例如临床参数,传统实验室危险因子,已知存在或与感染相关,结合本文列出的选定组的决定子。如上文所指出的,当单独且不作为决定子的多生物标志小组的成员使用时,列出的许多个别决定子、临床参数和传统实验室危险因子在可靠区分个别正常受试者、处于具有感染的危险中的受试者(例如,细菌、病毒或共感染)中几乎没有或没有临床用途,且因此不能可靠地单独用于在这三种状态之间对任何受试者进行分类。即使在这些群体的每一个中它们的平均测量结果中存在统计学上显著的差异的情况下,如通常在充分给予动力的(sufficientlypowered)研究中发生的,这种生物标志可能仍然将其适用性限于个别受试者,并且对该受试者的诊断或预后预测几乎没有贡献。统计学显著性的一个常用度量是p-值,其表明观察单独偶然产生的概率;优选地,这样的p-值为0.05或更小,表示目标观察偶然产生的概率为5%或更小。这样的p-值显著地取决于所进行的研究的实力。尽管存在这种个别决定子性能,以及仅结合传统临床参数和很少的传统实验室危险因子的公式的一般性能,但本发明人已经注意到,两种或更多种决定子的某些特定组合也可以用作多生物标志小组,其包含已知涉及一种或多种生理学或生物学途径的决定子的组合,并且这种信息可以通过使用各种公式组合并在临床上有用,包括统计学分类算法和其它,结合并在许多情况下扩展组合的性能特征超出个别决定子的那种。这些具体组合显示出可接受的诊断准确性水平,并且当来自多种决定子的足够信息在训练的公式中组合时,它们经常可靠地实现可从一个群体移动到另一个群体的高水平诊断准确性。如何将两个较不特异或较低性能的决定子组合成用于预期适应症的新颖和更有用的组合的一般概念是本发明的一些实施方案的关键方面。当使用正确的数学和临床算法时,与个别组分相比,多个生物标志可以产生显著的性能改善;这在灵敏度和特异性两者中经常是明显的,并且导致更大的AUC或MCC。性能的显著改善可意味着在不同的准确性度量例如总准确性、AUC、MCC、灵敏度、特异性、PPV或NPV中1%、2%、3%、4%、5%、8%、10%或高于10%的增加。其次,在现有的生物标志中经常存在新的未被察觉的信息,这是因为其是通过新的公式实现提高的灵敏度或特异性水平所必需的。即使对于通常被认为自身具有次优临床性能的生物标志,这种隐藏的信息也可能适用。实际上,单独测量的单个生物标志的高假阳性率方面的次优性能可能非常好地作为生物标志结果中含有一些重要的另外信息的指示物–在没有与第二个生物标志的组合和数学公式的情况下,将无法阐明的信息。另一方面,限制测量的诊断决定子(例如,RNA或蛋白质生物标志)的数目经常是有用的,这是因为这允许显著的成本降低并减少所需的样品体积和测定复杂性。因此,即使当两个识别标志具有相似的诊断性能(例如,相似的AUC或灵敏度)时,包含较少RNA的一个可具有显著的实用性和能力以付诸实施。例如,与10个基因相比包括5个基因并且表现相似的识别标志在现实生活临床环境中具有许多优点,并且因此是期望的。因此,在保持相似水平的准确性的同时能够减少识别标志中包含的基因数目是有价值的和发明。在此上下文下,类似的准确性水平可意味着,在不同的准确性度量例如总准确性、AUC、MCC、灵敏度、特异性、PPV或NPV中,正或负1%、2%、3%、4%、5%、8%或10%;识别标志基因数目的显著减少包括将基因数目减少2、3、4、5、6、7、8、9、10或超过10个基因。本领域已知的若干统计学和建模算法可用于辅助决定子选择的选择方案并最优化组合这些选择方案的算法。统计学工具如因子和交叉生物标志(cross-biomarker)相关/协方差分析允许对小组构建的更多原理方法。可以有利地使用数学聚类和分类树,其示出了决定子之间的欧氏标准化距离。也可采用这种统计学分类技术的途径知情接种(pathwayinformedseeding),如基于根据个别决定子在特定途径或生理功能中的参与选择所述个别决定子的许多合理方法。最终,诸如统计学分类算法的公式可以直接用于选择决定子并生成和训练将来自多种决定子的结果组合成单个指数所必需的最佳公式。经常使用技术,如前向(根据零潜在解释参数)和后向选择(根据所有可用的潜在解释参数),并且使用信息标准如AIC或BIC来定量小组性能和诊断准确性与使用的决定子数目之间的权衡。在前向或后向选择的小组上的个别决定子的位置可以与其为算法提供增量信息内容密切相关,因此贡献的顺序高度依赖于小组中的其它组成决定子。临床算法的构建可以使用任何公式将决定子结果组合成可用于本发明实践的指数。如上所述,但不限于此,除了各种其它指标之外,这种指数可指示概率、可能性、绝对或相对风险、从一种疾病状态转变到另一种疾病状态的时间或速率,或对感染的未来生物标志测量进行预测。这可以针对特定时间段或范围,或针对剩余终生风险(remaininglifetimerisk),或者仅作为相对于另一参考受试者群体的指数提供。尽管这里描述了各种优选的公式,但是除了本文和上述定义中提到的那些之外的若干其它模型和公式类型是本领域技术人员众所周知的。所使用的实际模型类型或公式本身可以基于其在训练群体中的结果的性能和诊断准确性特征从潜在模型的范围内选择。公式本身的细节通常可来自相关训练群体中的决定子结果。除了其它用途之外,这种公式可意图将从一种或多种决定子输入导出的特征空间映射到一组受试者类(例如,用于预测受试者的类成员资格为正常、具有感染),以使用贝叶斯方法得出对风险概率函数的估计,或估计类-条件概率,然后使用贝叶斯规则产生类概率函数,如在前一种情况中那样。优选的公式包括广泛种类的统计学分类算法,且特别是判别式分析的使用。判别式分析的目标是从先前鉴定的一组特征中预测类成员资格。在线性判别式分析(LDA)的情况下,鉴定特征的线性组合,其通过一些标准最大化组间的分离。可以使用具有不同阈值的基于本征基因(eigengene)的方法(ELDA)或基于多变量方差分析(MANOVA)的步进算法鉴定LDA的特征。可以执行前向、后向和步进算法,其基于Hotelling-Lawley统计量最小化不分离的概率。基于本征基因的线性判别式分析(ELDA)是Shen等人(2006)开发的一种特征选择技术。所述公式使用修改的本征分析在多变量框架中选择特征(例如,生物标志),以鉴定与最重要的本征向量相关联的特征。“重要的”被定义为那些本征向量,其解释了试图相对于某个阈值进行分类的样本之间差异的最大方差。支持向量机(supportvectormachine)(SVM)是一种分类公式,其试图找到一个分开两个类的超平面。这一超平面含有支持向量(supportvector),恰好离开超平面边界距离的数据点。在数据当前维度中不存在分开超平面的可能情况下,通过采取始变量的非线性函数将数据投影到更大的维度,极大地扩展维度(Venables和Ripley,2002)。虽然不是必需的,但SVM的特征的过滤经常改进预测。可以使用非参数Kruskal-Wallis(KW)检验鉴定支持向量机的特征(例如,生物标志),以选择最佳单变量特征。随机森林(randomforest)(RF,Breiman,2001)或递归分区(recursivepartitioning)(RPART,Breiman等人,1984)也可以单独使用或组合使用,以鉴定最重要的生物标志组合。KW和RF都要求从总数中选择许多特征。RPART使用可用生物标志的子集创建单个分类树。可使用其它公式,以在将个别决定子测量的结果呈现给预测公式之前将它们预处理成更有价值的信息形式。最值得注意的是,根据群体的平均值使用常见的数学变换如对数或逻辑函数将生物标志结果标准化为正态或其它分布情况等都是本领域技术人员众所周知的。特别重要的是基于临床决定子的一组标准化,例如自症状以来的时间、性别、种族或性别,其中具体公式仅用于一类中的受试者或连续组合临床决定子作为输入。在其它情况下,基于分析物的生物标志可以组合成计算的变量,随后将其呈现给公式。除了可能标准化的一个受试者的个别参数值之外,根据D'Agostino等人,(2001)JAMA286:180-187中概述的技术,或其它类似的标准化和再校准技术,对所有受试者或任何已知受试者类别的总体预测公式本身可基于对群体预期的流行和平均生物标志参数值的调整来再校准或以其它方式调整。这种流行病学调整统计学可通过提供给模型的过去数据的记录连续捕获、确认、改进和更新,所述数据可为机器可读的或其它方式,或偶尔通过对存储的样品的回顾性查询或参考这些参数和统计学的历史研究。可为公式再校准或其它调整的对象的另外的实例包括关于优势比的局限性的Pepe,M.S.等人,2004、与ROC曲线有关的Cook,N.R.,2007的研究中使用的统计学。最后,分类器公式本身的数值结果可通过其对实际临床群体和研究结果以及观察到的终点的参考进行转化后处理,以校准绝对风险并为分类器的不同数值结果或风险公式提供置信区间。一些决定子可表现出取决于患者年龄的趋势(例如,群体基线可随年龄而上升或下降)。人们可以使用‘年龄依赖性标准化或分层(Agedependentnormalizationorstratification)’方案以对年龄相关的差异进行调整。执行年龄依赖性标准化、分层或不同的数学公式可以用于改善区分不同类型感染的决定子的准确性。例如,本领域技术人员可以产生拟合随年龄而变的每种决定子的群体平均水平的函数,并使用它来标准化不同年龄的个别受试者水平的决定子。另一个例子是根据他们的年龄对受试者分层,并独立确定每个年龄组的年龄特异性阈值或指数值。将理解的是,如果用于诊断感染类型的决定子是位于性染色体上的RNA,则患者性别可影响基于RNA的诊断识别标志的诊断准确性。因此提出,当使用RNA决定子EIF1AY和UTY(其位于Y染色体上)或RNA决定子BMX(其位于X染色体上)时,考虑受试者的性别。例如,在一个实施方案中,RNA决定子EIF1AY和UTY用于诊断男性受试者。在本发明的上下文中,可使用以下统计学术语:“TP”是真阳性,意味着准确反映所测试的活性(tested-foractivity)的阳性测试结果。例如,在本发明的上下文中,TP为例如但不限于正确地对细菌感染进行分类本身。“TN”是真阴性,意味着准确反映所测试的活性的阴性测试结果。例如,在本发明的上下文中,TN为例如但不限于正确地对病毒感染进行分类本身。“FN”是假阴性,意味着看起来阴性、但未能揭示情况的结果。例如,在本发明的上下文中,FN为例如但不限于将细菌感染错误地分类为病毒感染。“FP”是假阳性,意味着错误地分类于阳性类别的测试结果。例如,在本发明的上下文中,FP为例如但不限于将病毒感染错误地分类为细菌感染。“灵敏度”通过TP/(TP+FN)或疾病受试者的真阳性分数计算。“特异性”通过TN/(TN+FP)或非疾病或正常受试者的真阴性分数计算。“总准确性”通过(TN+TP)/(TN+FP+TP+FN)计算。“阳性预测值”或“PPV”通过TP/(TP+FP)或所有阳性测试结果的真阳性分数计算。它固有地受到疾病的流行和意图测试的群体的测试前概率(pre-testprobability)的影响。“阴性预测值”或“NPV”通过TN/(TN+FN)或所有阴性测试结果的真阴性分数计算。它也固有地受到疾病的流行和意图测试的群体的测试前概率的影响。参见,例如,O’MarcaighAS,JacobsonRM,“EstimatingThePredictiveValueOfADiagnosticTest,HowToPreventMisleadingOrConfusingResults,”Clin.Ped.1993,32(8):485-491,其讨论了测试的特异性、灵敏度和阳性和阴性预测值,所述测试例如临床诊断测试。“MCC”(Mathews相关系数)计算如下:MCC=(TP*TN–FP*FN)/{(TP+FN)*(TP+FP)*(TN+FP)*(TN+FN)}^0.5,其中TP、FP、TN、FN分别是真阳性、假阳性、真阴性和假阴性。注意,MCC值在-1和+1之间变化,分别表示完全错误和完美分类。MCC为0表示随机分类。已经显示MCC对于将灵敏度和特异性结合到单个度量标准中是有用的(Baldi,Brunak等人,2000)。在不平衡的类大小的情况下,它也可用于测量和最优化分类准确性(Baldi,Brunak等人,2000)。经常,对于使用连续诊断测试测量的二元疾病状态分类方法,灵敏度和特异性根据Pepe等人,“LimitationsoftheOddsRatioinGaugingthePerformanceofaDiagnostic,Prognostic,orScreeningMarker,”Am.J.Epidemiol2004,159(9):882-890通过接收者操作特征(ROC)曲线总结,并且由曲线下面积(AUC)或c-统计量总结,一种允许只用单个值在测试(或测定)截止点的整个范围内表现测试、测定或方法的灵敏度和特异性的指示物。还参见,例如,Shultz,“ClinicalInterpretationOfLaboratoryProcedures,”第14章,Teitz,FundamentalsofClinicalChemistry,Burtis和Ashwood(eds.),第4版1996,W.B.SaundersCompany,第192-199页;和Zweig等人,“ROCCurveAnalysis:AnExampleShowingTheRelationshipsAmongSerumLipidAndApolipoproteinConcentrationsInIdentifyingSubjectsWithCoronoryArteryDisease,”Clin.Chem.,1992,38(8):1425-1428。使用似然函数、优势比、信息理论、预测值、校准(包括拟合优度)和重新分类测量的可选方法根据Cook,“UseandMisuseoftheReceiverOperatingCharacteristicCurveinRiskPrediction,”Circulation2007,115:928-935总结。“准确性”是指测量或计算的量(测试报告值)与其实际(或真实)值的一致程度。临床准确性与真实结果(真阳性(TP)或真阴性(TN)与错误分类结果(假阳性(FP)或假阴性(FN))相比的比例有关,且可表示为灵敏度、特异性、阳性预测值(PPV)或阴性预测值(NPV)、Mathews相关系数(MCC),或似然、优势比、接收者操作特征(ROC)曲线、曲线下面积(AUC)以及其它度量。“公式”、“算法”或“模型”是采用一个或多个连续或分类输入(此处称为“参数”)并计算输出值的任何数学方程、算法、分析或程序化过程或统计学技术,有时被称为“指数”或“指数值”。“公式”的非限制性实例包括总和、比率和回归算子,例如系数或指数、生物标志值转化和标准化(包括但不限于基于临床决定子的那些标准化方案,例如性别、年龄或种族特点)、规则和指南、统计学分类模型以及对历史群体训练的神经网络。在组合决定子中特别有用的是线性和非线性方程和统计学分类分析,以确定在受试者样品中检测到的决定子水平与受试者具有感染或某种类型感染的概率之间的关联。在小组和组合构建中,特别重要的是结构和语法统计学分类算法,以及指数构建方法,其利用模式识别特征,包括已确立的技术,如互相关联,主成分分析(PrincipalComponentsAnalysis)(PCA),因素转动(factorrotation),逻辑回归(LogReg),线性判别式分析(LDA),本征基因线性判别式分析(ELDA),支持向量机(SVM),随机森林(RF),递归分区树(RPART),以及其它相关的决策树(decisiontree)分类技术,ShrunkenCentroids(SC),StepAIC,Kth-NearestNeighbor,Boosting,决策树,神经网络,贝叶斯网络和隐马尔可夫模型等。其它技术可用于存活和事件发生所需的时间危害分析,包括本领域技术人员众所周知的Cox、Weibull、Kaplan-Meier和Greenwood模型。这些技术中的许多或者与决定子选择技术结合是有用的,例如前向选择、后向选择或逐步选择、给定大小的所有潜在小组的完整列举、遗传算法,或者它们本身在它们自己的技术中可包括生物标志选择方法。这些可以与信息标准相结合,例如Akaike的信息标准(AIC)或Bayes信息标准(BIC),以定量另外的生物标志和模型改进之间的权衡,并有助于最小化过度拟合(overfit)。使用这样的技术如Bootstrap、Leave-One-Out(LOO)和10-倍交叉验证(10-倍CV),得到的预测模型可在其它研究中验证,或者在它们最初被训练的研究中交叉验证。在各个步骤,可以根据本领域已知的技术通过值置换(valuepermutation)来估计错误发现率。“健康经济效用函数”是一种公式,它得自在诊断或治疗干预引入护理标准之前和之后,理想化适用患者群体中一系列临床结果的预期概率的组合。它包括对这种干预的准确性、有效性和性能特征,以及与每种结果相关的成本和/或价值测量(效用)的估计,其可得自护理的实际健康系统成本(服务、供应品、设备和药物等)和/或作为导致每一结果的每个质量调整寿命年(qualityadjustedlifeyear)(QALY)的估计可接受值得出。跨越所有预测结果,对一个结果预测的群体大小乘以各自结果的预期效用的乘积的总和是给定护理标准的总健康经济效用。(i)对具有干预的护理标准计算的总健康经济效用与(ii)对没有干预的护理标准的总健康经济效用相比之间的差异导致干预的健康经济成本或价值的总体度量。这本身可在被分析的整个患者组间(或仅在干预组间)分配,以获得每单位干预的成本,并指导诸如市场定位、定价和卫生系统接受度假设的决策。这种健康经济效用函数通常用于比较干预的成本-效益,但也可被转化以估计卫生保健系统愿意支付的每QALY的可接受值,或者新的干预所需的可接受的成本效益临床性能特征。对于本发明的诊断(或预后)干预,由于每个结果(在疾病分类诊断测试中可为TP、FP、TN或FN)具有不同的成本,所以健康经济效用函数基于临床情况和个体结果成本和价值可优先支持灵敏度超过特异性、或PPV超过NPV,并且因此提供了另一种健康经济性能和价值的度量,其可与更直接的临床或分析性能度量不同。这些不同的测量和相对权衡通常将仅在完美测试的情况下汇合,具有零错误率(也就是说,零预测的受试者结果错误分类或FP和FN),其所有性能度量将优先于不完美,但是程度不同。“分析准确性”指测量过程本身的可再现性和可预测性,并且可在诸如变异系数(CV)、Pearson相关以及相同样品或对照用不同时间、用户、设备和/或试剂的一致和校准检验的测量中总结。Vasan,2006中也总结了评价新生物标志中的这些和其它考虑因素。“性能”是与诊断或预后测试的总体有用性和质量相关的术语,除了其他之外包括临床和分析准确性、其它分析和过程特征,例如使用特征(例如,稳定性,易用性)、健康经济价值以及测试组分的相对成本。这些因素中的任何一个都可为优良性能并因此测试的有用性的来源,并且可通过相关的适当“性能度量标准”例如AUC和MCC、结果发生所需的时间、贮存期限等来测量。“统计学上显著的”意味着改变大于可能预期单独偶然发生的改变(其可为“假阳性”)。统计学显著性可以通过本领域已知的任何方法确定。常用的显著性度量包括p-值,其表示假设数据点仅是偶然的结果,获得至少与给定数据点一样极端的结果的概率。在p-值为0.05或更小时,结果经常被认为是高度显著的。在本发明的上下文中,可使用以下缩写:抗生素(Abx)、不利事件(AE)、任意单位(A.U.)、全血细胞计数(CBC)、病例报告表(CRF)、胸X-射线(CXR)、电子病例报告表(eCRF)、美国食品药品监督管理局(FDA)、良好临床实践(GCP)、胃肠道(GI)、胃肠炎(GE)、国际协调会议(InternationalConferenceonHarmonization)(ICH)、感染性疾病(ID)、体外诊断(IVD)、下呼吸道感染(LRTI)、心肌梗死(MI)、聚合酶链反应(PCR)、口服(Per-oss)(P.O)、经直肠(P.R)、护理标准(SoC)、标准操作程序(SOP)、尿道感染(UTI)、上呼吸道感染(URTI)。如本文所用的,术语“约”指±10%。术语“包含(comprises)”、“包含(comprising)”、“包括(includes)”、“包括(including)”、“具有(having)”和它们的词形变化指“包括但不限于”。术语“由……组成”指“包括且限于”。术语“基本上由……组成”指组合物、方法或结构可包括另外的成分、步骤和/或部件,但只有当另外的成分、步骤和/或部件不实质上改变请求保护的组合物、方法或结构的基本和新颖特征时。如本文所用的,单数形式“一(a)”、“一个(an)”和“所述(the)”包括复数参考,除非上下文另有明确说明。例如,术语“化合物”或“至少一种化合物”可包括多种化合物,包括其混合物。在整个申请中,本发明的各种实施方案可以范围形式呈现。应理解的是,范围形式的描述仅仅是为了方便和简洁,且不应该被解释为对本发明范围的硬性限制。因此,应该认为范围的描述具体公开了该范围内的所有可能的子范围以及个别数值。例如,应该认为,对诸如1至6的范围的描述具有具体公开的子范围,例如从1到3、从1到4、从1到5、从2到4、从2到6、从3到6等,以及在该范围内的个别数字,例如,1、2、3、4、5和6。无论范围的宽度如何,这都适用。无论何时在本文中指示数值范围,其都意图包括在所指示的范围内的任何引用的数字(分数或整数)。短语在第一指示数字至第二指示数字之间“变化/变化(ranging/rangesbetween)”和“从”第一指示数字“到”第二指示数字在本文中可互换使用,并且意味着包括第一和第二指示数字以及它们之间的所有分数和整数数字。如本文所用的,术语“方法”是指用于完成给定任务的方式、手段、技术和程序,包括但不限于化学、药理学、生物学、生物化学和医学领域的从业者已知的那些方式、手段、技术和程序,或化学、药理学、生物学、生物化学和医学领域的从业者易于从已知的方式、手段、技术和程序开发的那些方式、手段、技术和程序。如本文所用的,术语“治疗”包括消除、基本上抑制、减缓或逆转状况的进展,基本上改善状况的临床或美学症状,或基本上防止状况的临床或美学症状的出现。要理解的是,为了清楚起见,在分开的实施方案的上下文中描述的本发明的某些特征也可在单个实施方案中组合提供。相反,为了简洁起见,在单个实施方案的上下文中描述的本发明的各种特征也可分开提供或以任何合适的子组合提供或者适当时在本发明的任何其它描述的实施方案中提供。在各种实施方案的上下文中描述的某些特征不被认为是那些实施方案的必要特征,除非所述实施方案在没有那些要素的情况下不起作用。尽管已经结合其具体实施方案描述了本发明,但显然许多替代、修改和变化对于本领域技术人员来说将是显而易见的。因此,意图包含落入所附权利要求的精神和广泛范围内的所有这些替代、修改和变化。本说明书中提及的所有出版物、专利和专利申请均整体引入本说明书中作为参考,其程度如同每个个别的出版物、专利或专利申请被具体和个别地指出引入本文作为参考一样。另外,本申请中任何参考文献的引用或确定不应被解释为承认这样的参考文献可用作本发明的现有技术。在使用章节标题的范围内,它们不应被解释为必定是限制性的。如上所述和如下面的权利要求部分所请求保护的本发明的各种实施方案和方面在以下实施例中找到实验支持。实施例现在参考以下实施例,其与以上描述一起以非限制性方式说明本发明的一些实施方案。通常,本文使用的命名法和本发明中使用的实验室程序包括分子、生物化学、微生物学和重组DNA技术。这种技术在文献中有详尽的解释。参见,例如,"MolecularCloning:AlaboratoryManual"Sambrook等人,(1989);"CurrentProtocolsinMolecularBiology"VolumesI-IIIAusubel,R.M.,ed.(1994);Ausubel等人,"CurrentProtocolsinMolecularBiology",JohnWileyandSons,Baltimore,Maryland(1989);Perbal,"APracticalGuidetoMolecularCloning",JohnWiley&Sons,NewYork(1988);Watson等人,"RecombinantDNA",ScientificAmericanBooks,NewYork;Birren等人(eds)"GenomeAnalysis:ALaboratoryManualSeries",Vols.1-4,ColdSpringHarborLaboratoryPress,NewYork(1998);如列于美国专利号4,666,828;4,683,202;4,801,531;5,192,659和5,272,057中的方法;"CellBiology:ALaboratoryHandbook",VolumesI-IIICellis,J.E.,ed.(1994);"CultureofAnimalCells-AManualofBasicTechnique"byFreshney,Wiley-Liss,N.Y.(1994),ThirdEdition;"CurrentProtocolsinImmunology"VolumesI-IIIColiganJ.E.,ed.(1994);Stites等人(eds),"BasicandClinicalImmunology"(8thEdition),Appleton&Lange,Norwalk,CT(1994);Mishell和Shiigi(eds),"SelectedMethodsinCellularImmunology",W.H.FreemanandCo.,NewYork(1980);在专利和科学文献中广泛描述了可用的免疫测定,参见,例如,美国专利号3,791,932;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;4,098,876;4,879,219;5,011,771和5,281,521;"OligonucleotideSynthesis"Gait,M.J.,ed.(1984);“NucleicAcidHybridization"Hames,B.D.和HigginsS.J.,eds.(1985);"TranscriptionandTranslation"Hames,B.D.和HigginsS.J.,eds.(1984);"AnimalCellCulture"Freshney,R.I.,ed.(1986);"ImmobilizedCellsandEnzymes"IRLPress,(1986);"APracticalGuidetoMolecularCloning"Perbal,B.,(1984)和"MethodsinEnzymology"Vol.1-317,AcademicPress;"PCRProtocols:AGuideToMethodsAndApplications",AcademicPress,SanDiego,CA(1990);Marshak等人,"StrategiesforProteinPurificationandCharacterization-ALaboratoryCourseManual"CSHLPress(1996);所有这些都引入本文作为参考,如同在此完全阐述一样。贯穿本文件自始至终提供了其它一般参考。其中的程序被认为是本领域众所周知的,并且是为了方便读者而提供的。其中包含的所有信息都引入本文作为参考。实施例1基因表达谱区分具有细菌和病毒感染的患者材料和方法患者募集作为‘好奇心(Curiosity)’临床研究的一部分,前瞻性地募集患者(NCT01917461;(Oved等人,2015))。适用时,从每个参与者或法定监护人处获得知情同意。感染性疾病群的算入标准包括:临床怀疑急性感染性疾病,自症状发作的峰值发热>37.5℃,且症状持续时间≤12天。对照组的算入标准包括:非感染性疾病(例如创伤、中风和心肌梗死)的临床印象或健康受试者。排除标准包括:登记前两周内任何急性感染性疾病发作的证据;诊断为先天性免疫缺陷;目前采用免疫抑制或免疫调谐疗法治疗;活动性恶性肿瘤,已证实或疑似的人免疫缺陷病毒(HIV)-1、乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)感染。重要的是,为了使得能够广泛的一般化,登记时的抗生素治疗不导致从研究排除。研究工作流程概述在图1中描绘。登记过程和数据收集:对于每位患者,记录以下基线变量:人口统计学,体格检查,病史(例如,主诉、隐晦的疾病、长期施用的药疗法、合并症(comorbidities)、症状发作时间和峰值温度),在登记时获得的全血细胞计数(CBC),和化学小组(例如,肌酸酐、尿素、电解质和肝酶)。从每位患者获得鼻拭子用于进一步的微生物学调查,并获得血液样品用于蛋白质筛选和验证。在医生认为合适的情况下获得另外的样品(例如,分别在疑似尿道感染[UTI]和胃肠炎[GI]的情况下的尿和粪便样品)。放射性测试随医生的意思获得(例如,胸X-射线用于疑似下呼吸道感染[LRTI])。登记后30天,记录疾病过程和对治疗的反应。所有信息均记录在定制电子病例报告表(eCRF)中。微生物学调查:患者经历来自鼻拭子样品的两个多重-PCR诊断测定:(i)Seeplex®RV15,用于检测副流感病毒1、2、3和4,冠状病毒229E/NL63,腺病毒A/B/C/D/E,博卡病毒1/2/3/4,甲型和乙型流感病毒,偏肺病毒,冠状病毒OC43,鼻病毒A/B/C,呼吸道合胞病毒A和B,以及肠道病毒,和(ii)Seeplex®PB6,用于检测肺炎链球菌(Streptococcuspneumoniae)、流感嗜血菌(Haemophilusinfluenzae)、肺炎嗜衣原体(Chlamydophilapneumoniae)、侵肺军团菌(Legionellapneumophila)、百日咳博德特氏菌(Bordetellapertussis)和肺炎枝原体(Mycoplasmapneumoniae)。多重-PCR测定由合格的服务实验室进行。还根据患者的疑似临床综合征测试了患者的另外的病原体,包括:血培养、尿培养和粪便培养,用于志贺氏菌属物种(Shigellaspp.)、弯曲杆菌属物种(Campylobacterspp.)和沙门氏菌属物种(Salmonellaspp.);血清学测试(IgM和/或IgG),用于巨细胞病毒(CMV)、EB病毒(EBV)、肺炎枝原体(MycoplasmaPneumonia)和伯氏考克斯氏体(Coxiellaburnetii)(Q-热)。确立参考标准:目前,不存在单一的参考标准用于确定广泛的临床综合征中的细菌和病毒感染。因此,遵从诊断准确性报告标准(StandardsforReportingofDiagnosticAccuracy)(STARD)的推荐创建了严格的参考标准(Bossuyt等人,2003)。首先,如上所述对每位患者进行彻底的临床和微生物学调查。然后,整个疾病过程中收集的所有数据都由三位医生(主治儿科医生、感染性疾病专家和资深主治儿科医生)组成的小组审查。每个小组成员为每位患者分配以下诊断标记之一:(i)细菌;(ii)病毒;(iii)没有明显的感染性疾病或健康(对照);和(iv)不确定。最终诊断由所有三名小组成员的一致同意确定。重要的是,小组成员对其同伴的标记和识别标志的结果不知情。样品、程序和RNA纯化:将鼻拭子和粪便样品在4℃储存最长达72小时,并且随后运送到合格的服务实验室进行基于多重-PCR的测定。将静脉血样品收集在含有EDTA的CBC管中,并在4℃就地储存最长达5小时,并且随后分级分离成血浆和细胞沉淀(pellet)。使用红细胞裂解缓冲液(RedCellLysisBuffer)(RCLB)在室温(RT)裂解红细胞,并使用RNeasyplusMiniKit(QIAGEN,Cat.74134)根据制造商推荐的规程纯化总RNA。微阵列实验将总共10μl的200ng/3μl(66.67ng/μl)RNA转移至微阵列芯片杂交。使用WTcDNA合成和WTcDNA扩增试剂盒(900672,Affymetrix)从200ng总RNA制备扩增的cRNA。按照制造商的规程,从扩增的cRNA产生生物素化的单链cDNA,并且然后用WT末端标记试剂盒(Affymetrix)片段化并标记。将样品与HumanGene1.0STArrays(Affymetrix)杂交,其中探针分布在基因的整个长度上,从而提供更完整和准确的总体基因表达图。这一阵列用764,885个不同的探针访问28,869个良好注释的基因。此外,它包含来自Exon1.0STArray的探针子集,其侧重于良好注释的内容。使用AffymetrixGeneChipScanner30007G扫描阵列。然后使用PartekGenomicSuite软件提取原始数据,执行平均探针合计、RMA和五分位数标准化(quintilenormalization)以及GC含量校正(Downey2006)。统计学分析初步分析基于接受者操作曲线下面积(AUC)、Matthews相关系数(MCC)、灵敏度、特异性和总准确性。这些度量如下定义:P、N、TP、FP、TN、FN分别为阳性、阴性、真阳性、假阳性、真阴性和假阴性。除非另有说明,否则阳性和阴性分别指具有细菌和病毒感染的患者。结果患者特征研究的儿科患者组包括7名女性(47%)和8名男性(53%),年龄为7个月至16岁。患者表现出影响不同生理系统(例如,呼吸系统、泌尿(urinal)系统、中枢神经系统、全身性的)的多种临床综合征。表7中描述了研究的患者的详细表征。表7.研究的患者的详细描述。UTI-尿道感染;URTI-上呼吸道感染;WBC-白细胞计数(whitebloodcount)。单RNA决定子和RNA决定子的组合可以区分细菌和病毒患者。研究了使用HumanGene1.0STArray(Affymetrix)从所述急性感染患者获得的血液白细胞的基因表达谱。结果暗示免疫系统对细菌和病毒感染的不同反应,其可潜在地用于对急性感染患者进行分类。鉴定在测试的细菌和病毒患者中差异表达的65种RNA决定子(表8;与细菌患者基线相比计算log2-变化倍数(foldchange))。图2呈现应用使用欧氏距离度量和平均连锁的等级聚类后所鉴定基因的独特基因表达谱。基于这些结果,开发了一种分类器,用于使用逻辑回归来区分细菌和病毒患者。本发明人进一步计算了这些RNA决定子在区分细菌和病毒患者中的准确性的度量,包括AUC、MCC、总准确性、灵敏度、特异性和Wilcoxon秩和P-值(表8)。表8.差异表达的RNA决定子及它们在区分细菌或混合与病毒感染的受试者中的准确性的度量。表达水平的变化计算为log2(变化倍数细菌)-log2(变化倍数病毒)。接下来,使用逻辑回归来开发对于每种基因对的分类器(2080种组合),以测试组合两种RNA决定子是否可以改善诊断准确性。表9总结了50种RNA对,其显示了最高的准确性改善,如通过所述对的AUC与具有最高AUC的单个RNA(在同一对中)的AUC相比的差异(ΔAUC)计算的。使用RNA决定子对改善诊断准确性最高达53%(当比较单RNA决定子与RNA决定子对的AUC时),以产生高度有辨别力的组合(AUC在0.83-1.0之间,平均AUC0.95,当以最高准确性测试50对时;表9,图3-4)。表9.与单RNA决定子相比呈现最高准确性改善的RNA对。AUC_1和AUC_2分别是RNA#1和RNA#2的AUC。组合RNA#1和RNA#2的准确性在AUC对列中描述,并且组合比起个别RNA来的改善在AUCΔ中捕获(AUC_Δ=AUC对-max(AUC_1,AUC2)。如图3A-B的热图所示的,与相应的个别决定子相比,一些RNA决定子组合表现出改善的诊断准确性,而其它组合表现出降低的准确性。接下来,本发明人使用由91名儿科患者的群产生的外部集进行了RNA决定子的严格生物信息学分析,所述患者具有由甲型流感病毒、大肠杆菌、金黄色葡萄球菌(Staphylococcusaureus)或肺炎链球菌引起的急性感染性疾病,其使用AffymetrixHGU133AGeneChips(Ramilo等人2007)进行测试。对于每种RNA决定子,他们计算了细菌和病毒患者之间的log2变化倍数,并创建了逻辑回归分类器来计算其AUC、MCC、总准确性、灵敏度和特异性。他们还为RNA决定子对创建了逻辑回归分类器,并计算了相同的准确性度量(表10-12)。表10.使用外部数据集区分细菌与病毒感染的受试者的单RNA决定子(使用AffymetrixHGU133AGeneChips在73名细菌和18名病毒患者上测量的)。表11.RNA决定子对和它们在区分细菌与病毒感染的受试者中的准确性的度量,如使用外部数据集测试的(使用AffymetrixHGU133AGeneChips在73名细菌和18名病毒患者上测量的)。表12.另外的RNA决定子对和它们在区分细菌与病毒感染的受试者中的准确性的度量,如使用外部数据集测试的(使用AffymetrixHGU133AGeneChips在73名细菌和18名病毒患者上测量的)。使用更大的患者群提供了准确评价RNA决定子三联体所需的统计学能力。为每种基因三联体(14190种组合)开发了线性逻辑回归分类器,并评价了它们的诊断准确性。表13和14呈现了具有非常高的准确性水平的不同RNA三联体(AUC在0.929-1.0之间;灵敏度在0.836-1.0之间)。表13.在73名细菌和18名病毒患者上测试时,显示非常高的准确性水平的不同RNA三联体的准确性度量。表14.在73名细菌和18名病毒患者上测试时,显示非常高的准确性水平的不同RNA三联体的准确性度量。实施例2全转录组表达分析以鉴定基于RNA的决定子和识别标志,用于区分具有细菌和病毒感染的患者材料和方法患者募集作为‘好奇心’和‘定制治疗(Tailored-Treatment)’临床研究的一部分,前瞻性地募集患者(NCT01917461和NCT02025699)。适用时,从每个参与者或法定监护人处获得知情同意。感染性疾病群的算入标准包括:临床怀疑急性感染性疾病,自症状发作的峰值发热>37.5℃,且症状持续时间≤12天。对照组的算入标准包括:非感染性疾病(例如创伤、中风和心肌梗死)的临床印象或健康受试者。排除标准包括:登记前两周内任何急性感染性疾病发作的证据;诊断为先天性免疫缺陷;目前采用免疫抑制或免疫调谐疗法治疗;活动性恶性肿瘤,已证实或疑似的人免疫缺陷病毒(HIV)-1、乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)感染。重要的是,为了使得能够广泛的一般化,登记时的抗生素治疗不导致从研究排除。研究工作流程概述在图1中描绘。登记过程和数据收集:如实施例1那样。微生物学调查:如实施例1那样。确立参考标准:如实施例1那样。样品、程序和RNA纯化:将静脉血样品收集在含EDTA的CBC管中,并在4℃就地储存最长达5小时,并且随后分级分离成血浆和细胞沉淀。使用EL缓冲液(QIAGEN,Cat79217)在室温(RT)裂解红细胞。将白细胞在RLT缓冲液(QIAGEN,Cat79216)中裂解,并通过QIAshredder匀浆器(QIAGEN,Cat79654)匀浆。根据制造商推荐的规程,使用RNeasy™MicroKit(QIAGEN,Cat.74004)从400μl裂解的白细胞纯化总RNA。微阵列实验:转移总共3μl的255ng/3μl(85ng/μl)RNA,并对用GeneChip™WholeTranscript(WT)ExpressionArrays的全转录组表达分析作好准备。使用GeneChip™WTPLUSReagentKit(902310,Affymetrix),遵从制造商的规程,从255ng总RNA制备扩增的ss-cDNA。将样品与GeneChipHumanTranscriptomeArrays2.0(HTA-Affymetrix)杂交,其为用于所有转录物同种型的基因表达谱分析的最高分辨率微阵列。HTA每个外显子展示约10个探针,并且每个外显子-外显子剪接点展示4个探针。这一阵列访问>245,000个编码转录物、>40,000个非编码转录物和>339,000个覆盖外显子-外显子接界的探针集。使用AffymetrixGeneChipScanner30007G扫描阵列。统计学分析:如实施例1那样进行初步分析。结果患者特征研究的患者组包括71名儿童和59名成年人,并且性别平衡(65名女性和65名男性)。所述群包括51名具有细菌感染的患者和79名具有病毒感染的患者,如上所述由专家小组确定的。此外,我们研究了13名非感染性患者(作为对照)。患者表现出影响不同生理系统(例如,呼吸系统、泌尿系统、中枢神经系统、全身性的)的多种临床综合征。单RNA决定子和RNA决定子的组合可以区分细菌和病毒患者。研究了使用GeneChipHumanTranscriptomeArrays2.0(HTA-Affymetrix)从所述急性感染患者获得的血液白细胞的基因表达谱。结果暗示免疫系统对细菌和病毒感染的不同反应,其可潜在用于对急性感染患者进行分类。1089种RNA决定子(其中828种是编码决定子(表15A)且261种是非编码决定子(表15B))被鉴定为在测试的细菌和病毒患者中差异表达。本发明人进一步鉴定了41种RNA决定子,其中34种是编码决定子(表16A-B),且7种是非编码决定子(表16C),具有根据以下标准区分细菌和病毒患者的最高能力:t检验p-值<10-14并且绝对线性变化倍数>3.5。本发明人进一步计算了这些RNA决定子在区分细菌和病毒患者中的准确性的度量,包括AUC、灵敏度、特异性和t检验P-值(表15-16)。本发明人进一步评价了选择的RNA在区分呈现细菌(n=51)感染和非细菌感染(n=92;表16D)的患者、以及感染性(细菌和病毒;n=130)和非感染性(n=13)患者(表16E)中的准确性。表15A-差异表达的编码RNA决定子及它们在区分细菌(“B”)与病毒(“V”)感染的受试者中的准确性的度量。表15B-差异表达的非编码RNA决定子及它们在区分细菌(“B”)与病毒(“V”)感染的受试者中的准确性的度量,其满足以下标准:(t检验p-值<10-15)或(绝对线性变化倍数>4)或(t检验p-值<10-6且绝对线性变化倍数>1.7)。表16A-差异表达的编码RNA决定子及它们在区分细菌(“B”)与病毒(“V”)感染的受试者中的准确性的度量,其满足以下标准:t检验p-值<10-14且绝对线性变化倍数>3.5。表16B-差异表达的编码RNA决定子及它们在区分细菌(“B”)与病毒(“V”)感染的受试者中的准确性的度量,其满足以下标准:t检验p-值<10-14且绝对线性变化倍数>3.5。表16C-差异表达的非编码RNA决定子及它们在区分细菌(“B”)与病毒(“V”)感染的受试者中的准确性的度量,其满足以下标准:t检验p-值<10-14且绝对线性变化倍数>3.5。表16D-选择的RNA在区分呈现细菌感染(“B”;n=51)或非细菌感染(“NB”;n=92)的患者中的准确性度量。表16E-选择的RNA在区分感染性(“I”;细菌和病毒;n=130)和非感染性(“NI”;n=13)患者中的准确性度量。接下来,使用逻辑回归来开发对于每种RNA对的分类器(在表16A-C中包括的RNA中;861种组合),以测试组合两种RNA决定子是否可以改善诊断准确性。表17总结了50种RNA对,它们在区分具有细菌和病毒感染的患者中具有最高的灵敏度。表18呈现了50种RNA对,其显示了最高的准确性改善,如通过所述对的AUC与具有最高AUC的单个RNA(在同一对中)的AUC相比的差异(ΔAUC)计算的。实际上,使用RNA决定子对改善了诊断准确性以产生高度有辨别力的组合(AUC在0.93-0.96之间,平均AUC0.94,灵敏度在0.92-0.96之间,灵敏度0.93,表17-18)。表17-50种RNA对,其在区分具有细菌或病毒感染的患者中呈现最高的灵敏度。特征#1和特征#2的列包括探针集ID和括号中的基因符号(对于编码RNA)或mRNA登录号(对于非编码RNA)。描绘了逻辑回归模型参数(恒定和单个RNA系数)。表18-与单RNA决定子相比呈现最高准确性改善的50种RNA对。AUC_1和AUC_2是RNA#1和RNA#2的各自AUC。组合RNA#1和RNA#2的准确性在AUC对列中描述,并且组合比起个别RNA来的改善在AUCΔ中捕获(AUC_Δ=AUC对-max(AUC_1,AUC_2)。特征#1和特征#2的列包括探针集ID和括号中的基因符号(对于编码RNA)或mRNA登录号(对于非编码RNA)。评价的患者群提供了准确评价RNA决定子三联体所需的统计学能力。为每种基因三联体(在表16A-C中包括的RNA中;11480种组合)开发了线性逻辑回归分类器,并评价了它们的诊断准确性。表18和19分别呈现具有最佳灵敏度和最高准确性改善的不同RNA三联体。表19-50种RNA三联体,其在区分具有细菌或病毒感染的患者中呈现最高的灵敏度。特征#1、特征#2和特征#3的列包括探针集ID和括号中的基因符号(对于编码RNA)或mRNA登录号(对于非编码RNA)。描绘了逻辑回归模型参数(恒定和单个RNA系数)。表20-50种RNA三联体,其与单RNA决定子相比呈现最高的准确性改善。AUC_1、AUC_2和AUC_3是RNA#1、RNA#2和RNA#3的各自AUC。组合RNA#1、RNA#2和RNA#3的准确性在AUC三联体列中描述,并且组合比起个别RNA来的改善在AUCΔ中捕获(AUC_Δ=AUC三联体-max(AUC_1,AUC_2,AUC_3)。特征#1和特征#2的列包括探针集ID和括号中的基因符号(对于编码RNA)或mRNA登录号(对于非编码RNA)。C-反应蛋白(CRP)和TNF相关凋亡诱导配体(TRAIL)已知是区分具有细菌与病毒感染的患者的潜在有用生物标志(参见例如,WO2013/117746,其内容引入本文作为参考)。本发明人进一步将CRP或TRAIL蛋白质与各种RNA(包括在表16A-C中)组合以产生协同效应并使用逻辑回归模型改善它们的诊断准确性。表21中描述了表现最佳组合的准确性度量。表21-呈现最佳灵敏度的CRP或TRAIL蛋白质和RNA对。特征#1和特征#2的列包括探针集ID和括号中的基因符号(对于编码RNA)或mRNA登录号(对于非编码RNA)。描绘了逻辑回归模型参数(恒定和单个RNA系数)。亚组分析本发明人评价了各种RNA在区分呈现病毒和革兰氏阴性细菌感染的患者(表22)、和由病毒或细菌感染引起的肺炎(表23)中的准确性度量。表22-选择的RNA在区分病毒(n=79)和革兰氏阴性细菌(n=16)中的准确性度量表23-选择的RNA在区分呈现由病毒(n=7)或细菌(n=16)感染引起的肺炎的患者中的准确性度量诊断早期细菌感染在细菌性疾病的情况下延迟的或无抗生素治疗是非常常见的(所有细菌感染中的24%-40%),并且可以导致与疾病相关的并发症,从而导致增加的发病率和死亡率比率。因此,及时鉴定具有细菌感染的患者对指导正确的患者管理具有重要意义。实际上,本发明人鉴定了在疾病发作时高度准确、并且因此可以用作细菌感染的早期诊断的生物标志的具体RNA(例如CYP1B1和HERC6;表24)。表24-在疾病发作时高度准确的RNA评价了与具有细菌感染的患者或非感染性患者相比呈现不同病毒株的患者中选择的RNA的表达水平(包括健康;图7A-I)。有趣的是,具体RNA/基因在某些类型的病毒中表达更为不同,并且因此可能作为诊断测定的一部分充当此类病毒的具体指示物。表25中包括具体RNA和它在其中大多差异表达的病毒株的实例。表25-可充当具体类型病毒株的潜在指示物的RNA。基因符号/mRNA登录号病毒类型区分CYP1B1副流感SIGLEC1流感GAS7副流感、流感n332456流感DDX60流感SLUT1B1CMV/EBVHER6流感TCONS_00003184-XLOC_001966副流感、流感、RSV发现对区分病毒和细菌感染有辨别力的另外的RNA决定子总结于下文表26中。表26尽管已经结合其具体实施方案描述了本发明,但显然许多替代、修改和变化对于本领域技术人员来说将是显而易见的。因此,意图包含落入所附权利要求的精神和广泛范围内的所有这些替代、修改和变化。本说明书中提及的所有出版物、专利和专利申请均整体引入本说明书中作为参考,其程度如同每个个别的出版物、专利或专利申请被具体和个别地指出引入本文作为参考一样。另外,本申请中任何参考文献的引用或确定不应被解释为承认这样的参考文献可用作本发明的现有技术。在使用章节标题的范围内,它们不应被解释为必定是限制性的。参考文献当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1