用于提供3,4-二羟基苯基化合物及其甲基化变体的生物技术方法与流程
本发明涉及生物技术方法、通过合理优化用于羟基化4-羟基苯基化合物以产生3,4-二羟基苯基化合物的原型酶4-羟基苯乙酸3-羟化酶(4HPA3H)的活性位点结合口袋而获得的具有优化的底物耐受性和高区域特异性和产物特异性的经遗传修饰的酶或其催化活性片段。进一步提供了使用合适的氧化酶或羟化酶的与上述方法联合的方法,所述方法进一步通过提供合适的O-甲基转移酶使3,4-二羟基苯基化合物能够在偶联酶促反应中进行随后的位点特异性甲基化。提供了用于实施上述方法的合适的核酸和氨基酸序列、载体和重组宿主细胞。最后,提供了可以根据本文中提供的一种方法获得的组合物。
背景技术:
3,4-二羟基苯基化合物(例如咖啡酸、白皮杉醇、圣草酚、3,4-二羟基苯甲酸和七叶亭(esculetin))是特别具有抗氧化性质(例如,通过清除有害的氧簇)的珍贵天然产物。包括涵盖抗炎或抗癌活性的多种健康益处的其他有利特性归因于所述类别的化合物。然而,所述物质仅以非常低的浓度存在于适用于食品产品的植物中。这特别适用于存在于柑橘属植物中的圣草酚或其糖苷圣草次苷和新圣草次苷(neoeriocitrin)。圣草酚(参见图1和图13)是一种公知的调味物质,其适用于有效地减少和掩盖各种苦味成分的苦味印象或味道。从现有技术来看,圣草酚的这种性质从EP 1 258 200 B1获知。来源于圣草酚的几种类黄酮在食品和健康工业中也受到极大关注,包括橙皮素、橙皮苷、新橙皮苷、圣草次苷、新圣草次苷和高圣草酚(参见图13)。
与来自天然来源的圣草酚的可用性相比,相关物质柚皮素(参见图1和图13)或其糖苷柚皮苷和柚皮芸香苷可在多种柑橘类物种如葡萄柚或酸橙(枳(Poncirus trifoliata))中以足够的量获得。因此,柚皮素及其相关物质将基本上代表用于获得圣草酚的合适且成本敏感的可替选起始材料。
然而,鉴于化学氧化将仅产生包含圣芳酚的不同氧化产物的混合物,而不是作为唯一的产物,化学氧化不是用于使类黄酮环氧化而没有另外使环体系中的其他位置氧化的副作用的合适的方法。此外,目前还不知晓用于在特定的类黄酮环位置处引入氧化的单步化学氧化方法。另一个问题是所获得的产物的进一步氧化,分别产生圣草酚的醌(chinon)样或更高分子的氧化产物。
因此,对于用于生物技术以产生类似于在通过羟基化作用从柚皮素到圣草酚的典型类黄酮生物合成途径期间发生的天然过程的圣草酚的酶促氧化领域的进步存在持续需求,而这种需求总是涵盖希望提高相应的目标化合物的产率和纯度。
羟基化是使有机分子官能化的一类氧转移反应。羟基通过氢原子的取代或较不常见的另一官能团的取代而引入。尽管这些反应是许多天然产物合成途径的必需部分,但将羟基选择性地引入烷基或特别是芳基部分是合成中最具挑战性的领域之一。因此,直接(芳族)羟基化方法的数量仍是有限的。与这些化学合成方法相比,酶介导的羟基化常常由于高的区域选择性和/或立体选择性而被证明是更有效的,并且越来越受欢迎,同时更环境相容(由于省略了反应性化学物质并且潜在减少有机溶剂)。事实上,生物催化氧化转化已被用于结构不同的化合物的羟基化,包括类固醇、生物碱、萜类化合物或脂肪酸。这些酶促过程几乎仅依赖于细胞色素P450型酶,当然是因为已经重组地产生了大量这些蛋白质。此外,很多细胞色素酶关于底物范围已被充分表征,例如来自巨大芽孢杆菌(Bacillus megaterium)及其变体的酶。
在这方面与建立合适的酶促过程有关的主要问题是通过分子生物学分离或稳定表达异源氧化酶。细胞色素P450氧化酶是在所有生命领域中存在的普遍存在的酶。它们的功能和由所述酶催化的最常见的反应是单加氧酶反应,例如,将一个氧原子插入有机底物的脂族位置,同时将另一个氧原子还原成水。目前,众所周知难以以异源方式表达P450氧化酶并获得具有其固有酶促功能的稳定的酶,尽管有几种合适的变体已在考虑中,而目前的研究重点仅集中在这类酶的分离和表征上,而不是关于其在生物技术方法中使用的表征,所述生物技术方法通过代谢工程、途径和合适的宿主细胞和底物来限定以将这些P450氧化酶用于复杂的体内和体外方法以在工业规模上生产3,4-二羟基苯酚化合物。
或者,黄素依赖性单加氧酶是在生物技术中催化羟基化反应的令人感兴趣的目标。这些单加氧酶属于参与原核细胞和真核细胞两者中的关键代谢过程(例如聚酮化合物、胆固醇或抗生素的生物合成)的酶超家族。黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)依赖性单加氧酶的分类是基于结构特征以及电子供体和氧转移的类型。原型酶4-羟基苯乙酸3-羟化酶(4HPA3H或HpaB,EC 1.14.14.9)催化4-羟基苯基乙酸酯与氧反应成3,4-二羟基苯基乙酸酯。在反应期间,通过消耗由FAD通过另外的黄素还原酶组分(HpaC,E.C.1.5.1.36)产生的辅因子FADH2形成水。由于其高度特异性反应不限于天然底物4-羟基苯基乙酸酯,因此4HPA3H是单酚到邻二酚(儿茶酚)的具有挑战性的氧化的有吸引力的生物催化剂,但迄今为止尚未进行所述酶的具体合理设计以使其成为在工业规模上关于酶的稳定性、特异性和转化率的高标准所需的多用途生物技术应用的合适工具。值得注意的是,4HPA3H-介导的羟基化在没有导致不期望副产物的副反应情况下进行。然而,无论其效率和反应特异性如何,4HPA3H在生物技术中的适用性仍受到限制,因为尚没有可用的具有扩展底物范围(即包括除简单单酚以外的天然产物(例如类黄酮或生物碱))的酶的工具箱。
EP 14187583.1描述了将突变插入到细菌P450氧化酶的基因组中以提供能够由起始材料柚皮素产生圣草酚的重组微生物,然而,对于所公开的方法,针对该特定底物获得的催化速率是极低的,并且随后分离所得产物是费力的。
US 2014/0363858A1公开了使用天然野生型酶(即来自大肠杆菌(E.coli)的催化4-羟基乙酸酯(4HPA)羟基化成3,4-二羟基苯基乙酸酯(大肠杆菌中4HPA降解的第一步)的双组分非P450羟化酶HpaBC)使柚皮素氧化为圣草酚的生物技术方法。这种双组分酶的多数组分HpaB代表利用FADH2的单加氧酶,而少数组分HpaC是NAD(P)H-黄素氧化还原酶,其充当用于将FADH2供应给HpaB的偶联或辅因子再循环因子。从图2C中显而易见的和如本美国申请的第[0093]段中公开的,所获得的对柚皮素的活性极低,并且柚皮素向圣草酚转化的反应速率极低且仅进行不完全(<10%),鉴于此这样的方法不适用于以如在化学、食品和制药工业中进一步使用所述化合物所需的足够的量和纯度产生圣草酚。未提出关于遗传工程改造负责催化柚皮素向圣草酚反应的酶亚基HpaB的可能性。此外,US 2014/0363858A1公开了必须补充催化从柚皮素到圣草酚反应的酶的活性所必需的昂贵的辅因子NADH和FAD。
因此,长期以来需要建立包括使用全细胞方法的体内酶促方法和无细胞体系中的体外酶促方法两者或其组合的生物技术方法,以催化不同的4-羟基苯基化合物的氧化以及还(在偶联的酶促反应中)对所得的3,4-二羟基苯基化合物的进一步甲基化。具体地,需要具有增强的底物谱且同时具有高催化活性和区域特异性和产物特异性的经遗传修饰的酶。因此,特别需要合适的遗传工程化酶,其可以用于必须通过费力的合理设计来设计以产生酶的所述反应中,所述酶可以稳定且功能性地产生,其相对于其底物提供高产量和严格的区域特异性和产物特异性,并且其可以应用于体内和体外系统,包括其在工业规模上广泛的适用性所需的全细胞方法和无细胞方法。关于酶促反应,总是另外需要优化成本。因而,需要合适的辅因子再循环系统,关于待催化的具体反应和其所使用的酶对所述辅因子再循环系统进行微调以实现需要较少辅因子补充且因此是成本节约的生物技术方法。
技术实现要素:
因此,本发明的一个目的是提供通过合理的蛋白质设计获得的经遗传修饰的酶和编码其的核酸,所述酶属于来源于大肠杆菌的酶4-羟基苯乙酸3-羟化酶(4HPA3H)家族,具有优化的底物谱,并且同时具有良好的稳定性、功能性和活性以及优异的区域特异性和产物特异性;或者提供经遗传修饰的酶和编码其的核酸,所述酶属于P450氧化酶家族,其可以以高的量异源表达并且适用于在基于全细胞和无细胞的方法中将4-羟基苯基化合物转化为3,4-羟基苯基化合物。另一个目的是将作为氧化/羟基化催化酶的所述酶整合到适用于工业规模的可靠生产的生物技术方法中并限定合适的辅因子再循环系统。
该目的通过如下实现:提供在其活性位点中包含至少一个突变的经遗传修饰的大肠杆菌来源的4-羟基苯乙酸3-羟化酶或其催化活性片段,和提供在全细胞方法和无细胞体系中均具有功能的用于转化至少一种4-羟基苯基化合物以产生至少一种3,4-二羟基苯酚化合物的生物技术方法。此外,该方法已被整合到复杂的生物技术方法中,所述生物技术方法包括在另一个步骤中随后甲基化3,4-二羟基苯酚化合物。还提供了其他合适的核酸和氨基酸序列、载体和重组宿主细胞。最后,建议了优化的辅因子再循环系统,其可以与根据本发明的方法组合使用。
在第一方面,本发明提供了催化至少一种4-羟基苯基化合物的生物技术转化以用于产生至少一种3,4-二羟基苯酚化合物的方法,所述方法包括以下步骤:(i)提供至少一种氨基酸序列,所述氨基酸序列包含以下或由以下组成:在其活性位点中包含至少一个突变的经遗传修饰的大肠杆菌来源的4-羟基苯乙酸3-羟化酶或其催化活性片段;(ii)提供至少一种4-羟基苯基化合物;(iii)使所述至少一种4-羟基苯基化合物与所述至少一种包含4-羟基苯乙酸3-羟化酶或其催化活性片段或由4-羟基苯乙酸3-羟化酶或其催化活性片段组成的氨基酸序列在合适的反应条件下反应,以允许所述至少一种4-羟基苯基化合物通过所述至少一种包含4-羟基苯乙酸3-羟化酶或其催化活性片段或由4-羟基苯乙酸3-羟化酶或其催化活性片段组成的氨基酸序列进行羟基化以产生至少一种3,4-二羟基苯酚化合物;以及任选地分离和/或纯化所得的至少一种3,4-二羟基苯酚化合物。
在一个实施方案中,所述方法作为全细胞方法进行。在另一个实施方案中,所述方法在无细胞体外系统中进行。
在一个实施方案中,根据本发明的方法作为连续流工艺(continuous flow process)进行,优选其中至少一种氨基酸序列或其催化活性片段被提供为固定在合适的载体上。在另一个实施方案中,根据本发明的方法作为分批工艺进行。
根据本发明的任何方面的方法任选地提供合适的辅因子再循环系统,其包含以下或由以下组成:至少一种包含辅因子再循环酶或其催化活性片段的氨基酸序列。
根据一个实施方案,本发明的方法使用至少一种经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段,或它们使用编码所述至少一种经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段的至少一种重组核酸分子,所述至少一种经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段或者编码所述至少一种经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段的至少一种重组核酸分子选自SEQ ID NO:2至79和99至175,或与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的SEQ ID NO的活性位点的遗传修饰仍存在于所述同源序列中,并且前提条件是所述同源序列任选地在表达后仍提供4-羟基苯乙酸3-羟化酶活性;和/或它们使用至少一种辅因子再循环酶或其催化活性片段,或它们使用编码所述至少一种辅因子再循环酶或其催化活性片段的至少一种重组核酸分子,所述至少一种辅因子再循环酶或其催化活性片段或者编码所述至少一种辅因子再循环酶或其催化活性片段的至少一种重组核酸分子选自SEQ ID NO:80至86和176至182,或与其具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是所述同源序列任选地在表达后仍提供辅因子再循环活性。
在一个实施方案中,根据本发明的方法使用4-羟基苯乙酸3-羟化酶或其催化活性片段用于底物的羟基化,所述酶或其催化活性片段在合适的反应条件下提供合适的区域特异性和产物特异性,使得基本上不发生所得的至少一种3,4-二羟基苯酚化合物的进一步转化。
在本发明方法的一个实施方案中,至少一种4-羟基苯基化合物独立地选自柚皮素、根皮素、对香豆酸、阿魏酸、白藜芦醇、对羟基苯甲酸、2-羟基咔唑、伞形酮、大黄明(rheosmin),或前述分子的对映体、前体或衍生物,包括糖苷,包括樱桃苷、根皮苷、柚皮苷或柚皮芸香苷,但不限于此,但还包括可以与根据本发明的4-羟基苯乙酸3-羟化酶或其催化活性片段结合并通过其转化的结构类似的化合物。
在第二方面,本发明涉及催化至少一种4-羟基苯基化合物的生物技术转化以用于产生至少一种在3’和/或4’位上进一步甲基化的3,4-二羟基苯酚化合物的方法,所述方法包括以下步骤:(i)执行如权利要求1至8中任一项所限定的方法,以通过使用经遗传修饰的羟化酶或氧化酶或其催化活性片段来提供至少一种3,4-二羟基苯酚化合物,其中所述羟化酶或氧化酶或其催化活性片段催化至少一种4-羟基苯基化合物在3’位上的羟基化;(ii)提供包含至少一种O-甲基转移酶或其催化活性片段的至少一种氨基酸序列,或者编码所述至少一种O-甲基转移酶或其催化活性片段的至少一种重组核酸分子,并任选地提供辅因子,优选S-腺苷甲硫氨酸;和/或任选地提供S-腺苷甲硫氨酸合成酶或其催化活性片段,或编码至少一种S-腺苷甲硫氨酸合成酶或其催化活性片段的至少一种重组核酸分子;(iii)使至少一种3,4-二羟基苯酚化合物和至少一种包含O-甲基转移酶或其催化活性片段的氨基酸序列在合适的反应条件下反应,以允许通过所述至少一种包含O-甲基转移酶或其催化活性片段的氨基酸序列引入所述至少一种3,4-二羟基苯酚化合物的至少一种甲基化以产生至少一种在3’和/或4’位上甲基化的3,4-二羟基苯酚化合物;以及(iv)任选地分离和/或纯化所得的至少一种在3’和/或4’位上甲基化的3,4-二羟基苯酚化合物。
在该另一个方面的一个实施方案中,至少一种O-甲基转移酶或其催化活性片段或者至少一种编码所述O-甲基转移酶或其催化活性片段的重组核酸分子选自:SEQ ID NO:87至89和193至197和183至185和198至202,或与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列任选地在表达后仍提供O-甲基转移酶活性;并且任选地,至少一种S-腺苷甲硫氨酸合成酶或其催化活性片段或者至少一种编码所述S-腺苷甲硫氨酸合成酶或其催化活性片段的重组核酸分子选自SEQ ID NO:90至94和186至190,或与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列任选地在表达后仍提供S-腺苷甲硫氨酸合成酶活性。
作为本发明的一个方面,还提供了重组核酸分子,其包含选自以下的序列或由以下序列组成:SEQ ID NO:2至79、95和96,或与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列在表达后仍提供4-羟基苯乙酸3-羟化酶或氧化酶活性,并且前提条件是与适用于执行根据本发明的方法的相应SEQ ID NO相比,所述同源序列仍包含活性位点的至少一个遗传修饰。
此外,作为本发明的一个方面,提供了重组氨基酸分子,其包含选自以下的序列或由以下序列组成:SEQ ID NO:99至175、191和192,或与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列仍提供4-羟基苯乙酸3-羟化酶或氧化酶活性,并且前提条件是与适用于执行根据本发明的方法的相应SEQ ID NO相比,所述同源序列仍包含活性位点的至少一个遗传修饰。
作为一个方面,本发明另外提供了载体系统,其包含至少一种载体或由至少一种载体组成,其中所述至少一种载体包含:(i)至少一种重组核酸分子;和(ii)任选地:编码至少一种辅因子再循环酶或其催化活性片段的至少一种重组核酸分子;和/或(iv)任选地:编码至少一种O-甲基转移酶或其催化活性片段的至少一种重组核酸分子;和/或(v)任选地:编码至少一种S-腺苷甲硫氨酸合成酶或其催化活性片段的至少一种重组核酸分子,其中根据(i)的至少一种重组核酸分子,和任选地根据(ii)的至少一种重组核酸分子,和/或任选地根据(iv)的至少一种重组核酸分子,和/或任选地根据(v)的至少一种重组核酸分子提供在相同或不同的载体上并且对应于如上文对于本发明的其他方面和实施方案所呈现的重组核酸分子。
此外,作为一个方面,本发明另外提供了重组宿主细胞,其包含至少一种如上文对于根据本发明的一些具体方面和实施方案所限定的重组核酸分子或由其组成,和/或包含至少一种如上文对于根据本发明的一些具体方面和实施方案所限定的重组氨基酸或由其组成,和/或包含至少一种如上文对于根据本发明的一些具体方面和实施方案所限定的载体系统或由其组成,优选地其中所述宿主细胞选自:原核细胞,包括大肠杆菌(Escherichia coli spp.)属,特别是大肠杆菌BL21、大肠杆菌BL21(DE3)、大肠杆菌MG1655或大肠杆菌W3110及其衍生物,芽孢杆菌属(Bacillus spp.),特别是地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subitilis)或解淀粉芽孢杆菌(Bacillus amyloliquefaciens)及其衍生物,酵母细胞,包括酵母属(Saccharomyces spp.),特别是酿酒酵母(S.cerevesiae)及其衍生物,汉逊酵母属(Hansenula)或毕赤酵母属(Pichia spp.),特别是巴斯德毕赤酵母(P.pastoris)和多形汉逊酵母(H.polymorpha)及其衍生物,克鲁维酵母属(Kluyveromyces spp),特别是乳酸克鲁维酵母(K.lactis)及其衍生物,真菌,包括曲霉属(Aspergillus spp.),特别是米曲霉(A.oryzae)、构巢曲霉(A.nidulans)或黑曲霉(A.niger)及其衍生物,或木霉属(Trichoderma spp.),特别是里氏木霉(T.reesei)或哈茨木霉(T.harzianum)及其衍生物,昆虫细胞或哺乳动物细胞系。
在另一方面,本公开内容提供了可通过根据上文详述的任一个方面和实施方案的方法获得的组合物,其包含按wt.%计1∶100至100∶1的比例,优选按wt.%计1∶10至10∶1的比例,更优选按wt.%计1∶5至5∶1的比例的柚皮素和优选作为中间体或作为离析物(educt)的圣草酚或高圣草酚;或者包含按wt.%计1∶100至100∶1的比例,优选按wt.%计1∶10至10∶1的比例,更优选按wt.%计1∶5至5∶1的比例的根皮素和3-羟基根皮素,其中权利要求的步骤(ii)中提供的至少一种4-羟基苯基化合物选自柚皮素或根皮素,包括其前体、对映体或衍生物。
由于本公开内容涵盖的多种实施方案和方面均涉及本发明的可能性,因此它们可以单独使用或彼此组合使用,所有这些形成根据本公开内容的各个方面的单独实施方案,只要其对于具有本公开内容知识的技术人员是合理的即可。特别是,对于根据本发明的第一方面公开的所有实施方案同样适用于本申请的第二方面,因为由所述方面描述的两种方法是建立在彼此之上的。
本发明的另一些方面和实施方案可以从随后的具体实施方式、附图、序列表以及所附的权利要求组中得出。
附图说明
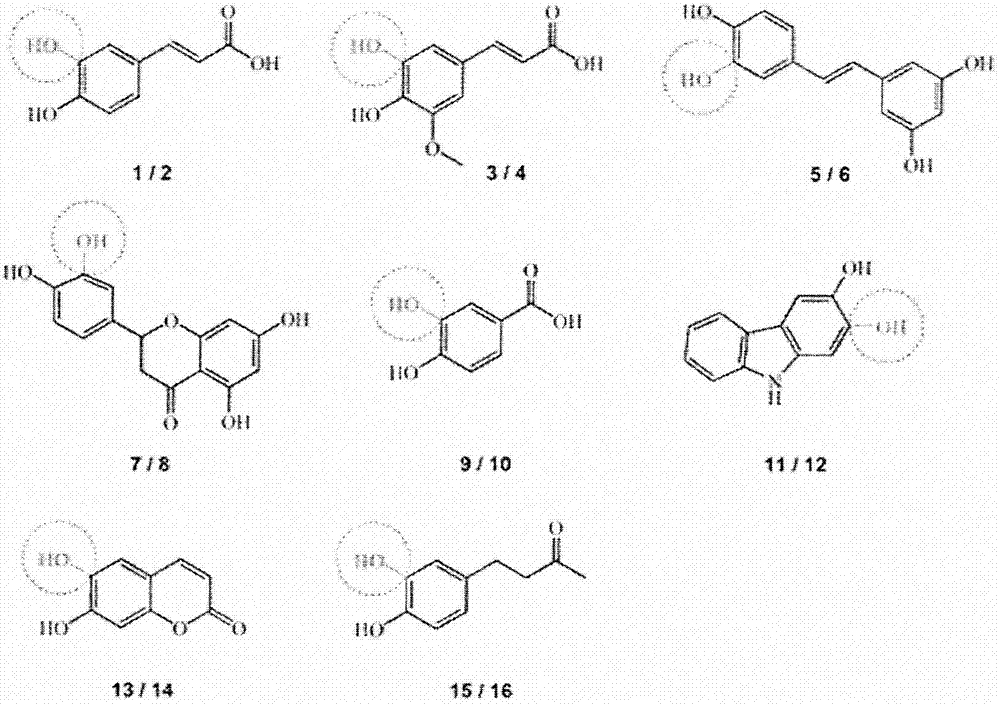
图1(图1)示出了在羟基化反应中使用的底物(奇数)和相应的儿茶酚产物(偶数)。通过4HPA3H-介导的氧化作用引入单酚中的羟基用灰色表示并用虚线圆标出。1对香豆酸,2咖啡酸,3阿魏酸,4 5-羟基阿魏酸,5白藜芦醇,6白皮杉醇(piceatannol),7柚皮素,8圣草酚,9对羟基苯甲酸,10 3,4-二羟基苯甲酸,11 2-羟基咔唑,12 2,3-二羟基咔唑,13伞形酮,14七叶亭,15大黄明,16 4-(3,4-二羟基苯基)-丁-2-酮。
图2(图2)示出了使用4HPA3H的体外羟基化的酶级联的一般方案。为了氢化物转移辅因子的再循环,在此应用来自博伊丁假丝酵母(Candida boidinii)的示例性甲酸脱氢酶(FDH)和来自防御假单胞菌(Pseudomonas protegens)的黄素还原酶PrnF。
图3(图3)示出了用生活全细胞生物催化剂(life whole-cell biocatalyst)的羟基化。将如图1所示的底物(200μM)添加到表达4HPA3H或其单变体(A)和双变体(B)的细菌细胞的悬浮液中。在孵育16小时之后,提取儿茶酚和残余底物并通过HPLC分析。
图4(图4)示出了(A)用于体外羟基化的纯化酶的SDS-PAGE。等量的蛋白质(5μg)用于具有10%(w/v)交联的聚丙烯酰胺凝胶中的分离。泳道1:野生型4HPA3H,泳道2:4HPA3H-Y301I,泳道3:4HPA3H-Y301F/S462A,泳道4:PrnF,M:分子标记物,以及(B)用于体外羟基化研究的纯化酶的SDS-PAGE,在14%凝胶上示出了数种酶,包括用作辅因子再循环酶的酶。
图5(图5)示出了表达4HPA3H(泳道1)、变体Y301F(泳道2)、S462A(泳道3)、M293P(泳道4)、I157V(泳道5)、Y301L(泳道6)、Y301I(泳道7)、Y301F/S462A(泳道8)、Y301L/S462A(泳道9)、Y301I/S462A(泳道10)、Y301F/I157V(泳道11)和I157V/S462A(泳道12)或携带空载体pET28a(+)(泳道13)的细胞的SDS-PAGE。将来自等量细胞的裂解物施加到具有10%(w/v)交联的聚丙烯酰胺凝胶上。M:分子标记物。
图6(图6)示出了用于确定4HPA3H活性的儿茶酚络合物形成测定。(A)用于咖啡酸(参见图1的2)测定的标准曲线。将咖啡酸和对香豆酸(1)的混合物与FeCl3一起孵育并如实验部分中所述在595nm处进行分析。(B)通过野生型4HPA3H的对香豆酸(参见图1的1)氧化的时间进程。酶促反应在优化的条件下进行,并且所产生的咖啡酸(参见图1的2)被检测为Fe3+络合物。数据是由三次测量获得的平均值±标准偏差。
图7(图7)示出了对香豆酸的体外转化对FAD(实心圆)和NADH浓度(空心圆)的依赖性。使用4HPA3H/PrnF/FDH体系进行反应。
图8(图8)示出了通过4HPA3H/PrnF/FDH体系的体外羟基化。在优化的条件下使用纯化的4HPA3H(A)或变体(B)(用白色表示的Y301I和用黑色表示的Y301F/S462A)转化底物(1mM)。这些数字对应于如上述图1的图例中所说明的底物。
图9(图9)示出了柚皮素和圣草酚的结构以及在辅因子和任选的辅因子再循环酶PrnF和FDH的存在下催化柚皮素羟基化的一个示例性酶4HPA3H Y301F/S462A。
图10(图10)示出了如通过使用固定在载体(Talon Co2+柱)上的酶的无细胞生物催化方法获得的随时间通过4HPA3H变体Y301F/S462A(9mU)酶的柚皮素向圣草酚的转化。
图11(图11)示出了如通过使用固定在载体(Talon Co2+柱)上的酶的无细胞生物催化方法获得的随时间通过4HPA3H变体Y301F/S462A(35mU)酶的柚皮素向圣草酚的转化。
图12(图12)示出了(A)如实施例12中详述的基于固相的级联反应在时间点“0”分钟处的HPLC色谱图。在开始生物催化转化之前仅可以检测到柚皮素离析物峰。图12(B)示出了如实施例12中详述的基于固相的级联反应在时间点“30”分钟处的HPLC色谱图。除了柚皮素峰以外,现在可以检测到圣草酚峰。图12(C)示出了如实施例12中详述的基于固相的级联反应在时间点“240”分钟处的HPLC色谱图。从该色谱图可以明显看出,在4小时反应时间之后,除了剩余的柚皮素峰以外还存在显著的圣草酚峰。值得注意的是,未检测到属于除圣草酚或柚皮素以外的其他物质的副产物。该色谱图中的所有小峰在时间点“0”处已经存在(参见图12(A))并且因此属于存在于初始溶液中的分子。
图13(图13)示出了几种类黄酮化合物,包括圣草酚、橙皮素及其糖苷和高圣草酚。
定义
如本文中使用的术语“生物技术”或“生物技术的”是指依赖于使用活的物质(例如宿主细胞)或依赖于生物催化步骤的方法和分子工具,所述生物催化步骤包括在至少一个制造步骤期间使用介导化学反应的酶或其催化活性片段或变体。因此该术语用作术语“化学过程”或“化学合成”的对立词。因此,在本公开内容的意义上,生物技术方法包括全细胞即体内方法,其中在活细胞内产生至少一种氨基酸和/或其中目的反应在活的或死的重组宿主细胞的存在下发生,包括在体内在细胞中或在包含细胞的悬浮液中或在包含细胞的培养基的上清液中或在不经进一步纯化的细胞裂解物中发生。此外,术语“生物技术”包括可以在不存在重组宿主细胞的情况下发生的生物催化体内和体外酶促反应。前述生物技术方法的组合也包括在本公开内容中。
如本文在根据本申请的重组宿主细胞的上下文中使用的术语“衍生物”或“后代”涉及由包括有性繁殖和无性繁殖的自然生殖繁殖产生的这样的重组宿主细胞的后代。本领域技术人员公知,所述繁殖可以导致由自然现象引起的将突变引入到生物体的基因组中,这产生这样的后代或子代,其与亲本重组宿主细胞在基因组上不同,然而,仍属于相同的属/种并且具有与亲本重组宿主细胞相同的特征。因此,在繁殖期间由自然现象产生的这样的衍生物或后代包括在根据本公开内容的术语重组宿主细胞内。
如本文中使用的术语载体系统定义了包含至少一种适用于重组宿主细胞的转化、转染或转导的载体(优选质粒载体)的系统。因此,载体本身表示用于将生物分子递送到目的宿主细胞中的载荷(cargo)。因此,载体系统可以包含一种载体,所述载体编码至少一种待引入到宿主细胞中的靶分子,优选核酸分子。载体系统的载体也可以包含多于一种待引入的靶分子。或者,载体系统可以由携带至少一种待引入的靶分子的几种单独的载体构建。
术语蛋白质、多肽和酶在本文中可互换使用。术语“氨基酸”或“氨基酸序列”或“氨基酸分子”包括任何天然或化学合成的蛋白质、肽、多肽和酶或经修饰的蛋白质、肽、多肽和酶,其中术语“经修饰的”包括蛋白质、肽、多肽和酶的任何化学或酶促修饰。
当提及核酸或氨基酸序列/分子时,术语“序列”和“分子”在本文中可互换使用。
如本文中与酶或其催化活性片段结合使用的“活性位点”表示酶的结合其底物分子并经历化学反应的区域。
如本文中使用的术语“经遗传修饰的”或“重组”或“经基因工程的”/“经遗传工程化的”是指意味着通过分子生物学或蛋白质工程,例如通过将异源序列引入另一个宿主细胞中实现了靶向的和有目的的操纵和/或修饰的核酸分子或氨基酸分子或宿主细胞。另外的修饰包括但不限于一个或更多个点突变,例如用于靶向蛋白质工程或用于密码子优化的一个或更多个点突变,一个或更多个缺失,和至少一种核酸或氨基酸分子的一个或更多个插入,氨基酸序列的修饰,或其组合。
如本文中提及氨基酸序列使用的术语“催化活性片段”是指来源于给定模板氨基酸序列的包含模板序列的全部或部分活性位点的核心序列,前提条件是所得的催化活性片段仍具有表征模板序列的活性,即在本文中模板序列的底物结合和酶促活性,其是由天然酶或其变体的活性位点导致的。所述修饰适用于产生仍具有与模板序列相同活性的较小体积氨基酸序列,使得催化活性片段成为更通用或更稳定的工具。
每当本公开内容涉及核酸或氨基酸序列的同源性或同一性的百分比时,这些值限定了如通过使用用于核酸的EMBOSS Water成对序列比对(核苷酸)程序(http://www.ebi.ac.uk/Tools/psa/embosswater/nucleotide.html)或用于氨基酸序列的EMBOSS Water成对序列比对(蛋白质)程序(http://www.ebi.ac.uk/Tools/psa/emboss water/)获得的那些值。由欧洲分子生物学实验室(European Molecular Biology Laboratory,EMBL)欧洲生物信息学研究所(European Bioinformatics Institute,EBI)提供的用于局部序列比对的那些工具使用改进的Smith-Waterman算法(参见http://www.ebi.ac.uk Tools/psa/和Smith,T.F.& Waterman,M.S.″Identification of common molecular subsequences″Journal of Molecular Biology,1981 147(1):195-197)。当进行比对时,使用由EMBL-EBI定义的缺省参数。那些参数是(i)对于氨基酸序列:矩阵=BLOSUM62,缺口开放罚分=10,缺口延伸罚分=0.5,或(ii)对于核酸序列:矩阵=DNAfull,缺口开放罚分=10,缺口延伸罚分=0.5。
具体实施方式
根据本发明的第一方面,提供了催化至少一种4-羟基苯基化合物的生物技术转化用于产生至少一种3,4-二羟基苯酚化合物的方法,所述方法包括以下步骤:(i)提供至少一种氨基酸序列,所述氨基酸序列包含以下或由以下组成:在其活性位点中包含至少一个突变的经遗传修饰的大肠杆菌来源的4-羟基苯乙酸3-羟化酶(4HPA3H)或其催化活性片段;(ii)提供至少一种4-羟基苯基化合物;(iii)使所述至少一种4-羟基苯基化合物与所述至少一种包含4-羟基苯乙酸3-羟化酶或其催化活性片段或由4-羟基苯乙酸3-羟化酶或其催化活性片段组成的氨基酸序列在合适的反应条件下反应,以允许所述至少一种4-羟基苯基化合物通过所述至少一种包含4-羟基苯乙酸3-羟化酶或其催化活性片段或由4-羟基苯乙酸3-羟化酶或其催化活性片段组成的氨基酸序列羟基化以产生至少一种3,4-二羟基苯酚化合物;以及(iv)任选地分离和/或纯化所得的至少一种3,4-二羟基苯酚化合物。
作为对本发明进行的分析的基础的野生型4HPA3H不具有如来自铜绿假单胞菌(Pseudomonas aeruginosa)的同源蛋白质一样羟基化阿魏酸的能力。为了出于本发明的目的优化4HPA3H和深入了解各个活性位点的结构,基于来自嗜热栖热菌(Thermus thermophilus)(PDB登录2YYJ)的相关酶的晶体学数据对44HPA3H和相应的铜绿假单胞菌酶的三维结构进行建模(参见以下实施例1)。
根据本发明的一个实施方案,经遗传修饰的大肠杆菌来源的4-羟基苯乙酸3-羟化酶(4HPA3H)或其催化活性片段因此包含活性位点中的至少一个突变或由其组成,所述活性位点包含残基I157、M293、Y301和S462,其中命名参照根据SEQ ID NO:98的相应野生型酶。在一个优选的实施方案中,所得的氨基酸序列包含I157V、M239P、Y301I、Y301L或S462A突变中的至少一个或其组合。在一些实施例中详述了SEQ ID NO:98的另外的优选变体。优选的经遗传修饰的大肠杆菌来源的4-羟基苯乙酸3-羟化酶(4HPA3H)或其催化活性片段包含突变Y301I/S462A、I157V/Y301F、I157V/S462A、Y301L/S462A或Y301I/S462A。本公开内容已经揭示了大肠杆菌来源的4-羟基苯乙酸3-羟化酶(4HPA3H)的上述非常重要的活性位点并提供了用于评估底物特异性的测试,了解本公开内容的本领域技术人员可以使用相应位置的定点诱变容易地设计其他合适的变体。因此,在I157、M239、Y301或S462处包含一个或更多个突变的大肠杆菌来源的4-羟基苯乙酸3-羟化酶(4HPA3H/HpaB)的所有其他变体均包括在本发明中,包括如分别对于相应的核酸和氨基酸序列的SEQ ID NO:2至77和99至174中所示的针对丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸或缬氨酸的突变。因此,这些变体包括在本申请的公开内容中,提供了公开位于大肠杆菌来源的4HPA3H的活性位点中的相关氨基酸位置的贡献。
因此,术语“大肠杆菌来源的”意味着各序列在大肠杆菌中具有其天然来源。
在根据本发明的一个实施方案中,提供了一种方法,其中所述方法作为全细胞方法执行,并且其中根据第一方面的步骤(i)如下进行:(a1)提供至少一种重组宿主细胞,所述重组宿主细胞包含以下或由以下组成:经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段;或者包含以下或由以下组成:至少一种编码所述经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段的重组核酸分子;(b1)任选地:提供至少一种重组宿主细胞,所述重组宿主细胞包含以下或由以下组成:至少一种包含辅因子再循环酶或其催化活性片段的氨基酸序列,其中至少一种辅因子再循环酶选自黄素还原酶或其催化活性片段,优选黄素还原酶,或至少一种编码黄素还原酶或其催化活性片段的重组核酸分子;和/或甲酸脱氢酶或其催化活性片段,或编码至少一种甲酸脱氢酶或其催化活性片段的至少一种重组核酸分子,其中根据步骤(a1)和(b1)的至少一种重组宿主细胞是相同或不同的重组宿主细胞,以及(c1)在合适的反应条件下培养所述至少一种重组宿主细胞,允许至少一种经遗传修饰的4-羟基苯乙酸3-羟化酶的功能性表达和/或催化活性,以及任选地还允许至少一种包含辅因子再循环酶或其催化活性片段的氨基酸序列的功能性表达和/或催化活性。
也如上文定义的全细胞方法在宿主细胞的存在下进行并且因此包括通过使用分泌标签将目的蛋白质分泌到培养物上清液中,使用宿主细胞的悬浮液和使用宿主细胞的裂解物的在体内(发酵的)进行的生物技术方法。
在根据本发明提供的方法的一个实施方案中,使用至少一种辅因子再循环酶或其催化活性片段并将其作为核酸或作为氨基酸分子提供。作为本申请基础的发现之一是,本文中公开的方法与合适的辅因子再循环系统的组合,特别地使在根据本申请的4HPA3H的反应期间形成的强制但昂贵的辅因子NADH:NAD+进行再循环和再生,以提供必需的辅因子FADH2(参见图2)。待与根据本发明的方法组合的级联生物催化的优选的辅因子再循环酶或编码其的核酸序列可以是独立地选自以下的一者或更多者:来自博伊丁假丝酵母的甲酸脱氢酶(FDH)(参见SEQ ID NO:81和177)或来自防御假单胞菌的黄素还原酶(PrnF)(参见SEQ ID NO:80和176)或来自大肠杆菌的黄素还原酶HpaC(SEQ ID NO:82和178)、来自巨大芽孢杆菌的葡萄糖脱氢酶(GDH)(SEQ ID NO:83和179)、例如来自施氏假单胞菌(Pseudomonas stutzeri)的磷酸酯脱氢酶(PTDH)(SEQ ID NO:84和180)、来自肠膜明串珠菌(Leuconostoc mesenteroides)的葡萄糖-6-磷酸脱氢酶(G6PDH)(SEQ ID NO:85和181)、或来自酿酒酵母的醇脱氢酶,优选醇脱氢酶2(ADH2)(SEQ ID NO:86和182)(参见例如Riva,S.& Fessner,W.-D.;23-42;Wiley-VCH,2014;doi:10.1002/9783527682492)。限定可用于提供根据本发明的辅因子再循环系统目的的其他合适的酶和在如图2中详述的机理知识下将其以合适的方式组合是在代谢工程领域的技术人员的能力范围之内的。
在根据本发明方法的全细胞方法的情况下,重组宿主细胞的内源酶可适合于充当辅因子再循环系统,例如来自大肠杆菌的酶HpaC或根据SEQ ID NO:82或178的编码其的序列,其单独或与待另外引入的重组辅因子再循环系统组合。
在根据本发明提供的方法的另一个实施方案中,提供了根据第一方面的方法,其中所述方法在无细胞体外系统中进行,并且其中步骤(i)如下进行:(a2)提供至少一种分离的氨基酸序列,所述氨基酸序列包含以下或由以下组成:在其活性位点中包含至少一个突变的经遗传修饰的大肠杆菌来源的4-羟基苯乙酸3-羟化酶或其催化活性片段;以及(b2)任选地提供至少一种氨基酸序列,所述氨基酸序列包含以下或由以下组成:至少一种辅因子再循环酶或其催化活性片段,其中所述至少一种辅因子再循环酶选自黄素还原酶或其催化活性片段和/或甲酸脱氢酶或其催化活性片段。
术语“分离的”意味着氨基酸序列独立于重组宿主细胞被提供并且因此包含在产生和排出所述序列的分泌方式的情况下从其表达宿主分离、任选地从上清液中纯化或分离的氨基酸序列,或者还包括化学合成的氨基酸序列,特别是在根据本公开内容的催化活性片段的情况下。
本领域技术人员很清楚这一事实:在反应中不存在或存在少量的辅因子再循环酶或其催化活性片段的情况下,对于体外途径必须补充根据本发明的该方面所催化的反应的必需辅因子(参见例如图2),甚至以较高的量补充。此外,在期望酶辅因子再循环的情况下,技术人员可以容易地限定一种或更多种在如图2中公开的反应机理知识下适合作为辅因子再循环酶的其他酶或其催化活性片段。
在根据本发明方法的一个实施方案中,用于产生至少一种3,4-二羟基苯酚化合物的至少一种4-羟基苯基化合物的生物技术转化作为连续流工艺进行,优选地其中至少一种具有根据本公开内容的羟化酶活性的氨基酸序列或其催化活性片段被提供为固定在合适的载体上。这样的连续流工艺在工业生物技术领域中是公知的并且因此可以容易地适合于执行根据本公开内容的方法。
在本公开内容的意义上,“固定”意指非共价的,包括静电相互作用、范德华力、π-效应或疏水相互作用以及共价固定。因此该术语意味着将目的酶或其催化活性片段固定到载体上。这可以意味着通过连接于酶或其催化活性片段的标签、氢键合、离子键合等的相互作用,而且还意味着通过交联以在目的酶和载体之间建立共价键的永久固定。包含任选地偶联的多种柱材料或包含反应性基团的合适载体是本领域技术人员已知的,其中所述反应性基团可以与待永久或可逆固定的酶相互作用。
在根据本公开内容的另一个实施方案中,用于产生至少一种3,4-二羟基苯酚化合物的至少一种4-羟基苯基化合物的生物技术转化的方法作为分批工艺进行。这可以意味着体内和体外分批工艺。分批工艺在工业生物技术领域中是公知的并且因此可以容易地适合于由技术人员执行根据本公开内容的方法。
在根据本公开内容的另一个实施方案中,所述方法使用特定的酶进行,其中至少一种经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段或者编码所述至少一种经遗传修饰的4-羟基苯乙酸3-羟化酶或其催化活性片段的至少一种重组核酸分子选自SEQ ID NO:2至79和99至175或者与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应SEQ ID NO的活性位点的遗传修饰仍然存在于同源序列中并且前提条件是同源序列任选地在表达之后仍然提供4-羟基苯乙酸3-羟化酶活性;和/或其中至少一种辅因子再循环酶或其催化活性片段或者编码所述至少一种辅因子再循环酶或其催化活性片段的至少一种重组核酸分子选自SEQ ID NO:80至86和176至182或者与其具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是同源序列任选地在表达之后仍然提供辅因子再循环活性。
如上所详述地,使用至少一种辅因子再循环酶或其催化活性片段用于实施本发明的方法是合适的且成本节约的过程,因为可以再循环进行4-羟基苯酚化合物的氧化/羟基化所需的昂贵的辅因子,而不是补充大量被鉴定为强制性的相应辅因子(参见图2)。对于体内应用,在所述辅因子再循环酶已经存在于所使用的重组宿主细胞中的情况下,可能不需要使用辅因子再循环酶。对于体外应用,将需要单独或组合使用一种或更多种辅因子再循环酶或其催化活性片段和/或使用辅因子,以允许用于生物转化的主要酶或其催化活性片段的活性来产生3,4-二羟基苯酚化合物。
在根据本发明的另一个实施方案中,提供了一种方法,其中根据本发明的第一方面的步骤(iii)中的羟基化由包含4-羟基苯乙酸3-羟化酶或其催化活性片段或由4-羟基苯乙酸3-羟化酶或其催化活性片段组成的至少一个氨基酸序列在合适的反应条件下催化,提供了合适的区域和产物特异性,从而基本上不会进行所得到的至少一种3,4-二羟基苯酚化合物的进一步转化。发现独立地选自活性位点中的I157、M293、Y301和S462的SEQ ID NO:1至少一个位置的突变使得体积较小且空间要求较低的基团对于酶的底物耐受性具有有利的效果,所述酶仍然提供高的区域和产物特异性使得不会进行除了在4′位处的期望羟基化之外的起始物质的另外转化。蛋白质化学领域的技术人员可以容易地推导出所述特征适用于几种可能的突变体,其全部在活性位点的特定位置之一处携带较小体积的氨基酸。同时,本领域技术人员已知,即使在活性位点的特定位置处保留体积较大的(voluminous)氨基酸,但同时修饰由酶的活性位点所包含的另一位置,该位置可容易地被突变以获得另外有利的酶特征,如例如增强的催化速率。与引入所述突变相关的是如本文参考SEQ ID NO:98如分别编码大肠杆菌4HPA3H/HpaB的核酸和氨基酸序列所定义的酶的活性位点的知识。
在涉及根据本发明的任何公开的方法的一个实施方案中,至少一种4-羟基苯基化合物独立地选自柚皮素、根皮素、对香豆酸、阿魏酸、白藜芦醇、对羟基苯甲酸、2-羟基咔唑、伞形酮、大黄明,或前述分子的对映体、前体或衍生物,包括糖苷,包括樱桃苷、根皮苷、柚皮苷或柚皮芸香苷,其中上述分子的黄烷酮包括其(2S)-和/或(2R)-对映体,但不限于此。
本公开内容中使用的术语“前体”旨在描述代表在天然生物合成途径期间发现的在先化合物,或者代表产生根据本公开内容的化合物的化学合成中的在先步骤的那些化合物。例如,柚皮素是圣草酚的前体,因此圣草酚是化合物高圣草酚的前体。在根据本公开内容使用的化合物的上下文中的“衍生物”描述了核心化合物的变体,其已经被化学或酶促修饰,即通过甲基化、羟基化、糖基化、与另一种化合物的偶联等,而非衍生化合物的核心序列仍然存在于所述衍生物中。
根据本公开内容的所有核酸分子可以任选地被密码子优化。这意味着给定核酸序列的密码子使用可以被修改为可与目的重组宿主细胞的密码子使用相容,以允许更好的转录速率和功能性氨基酸序列在目的重组宿主细胞中的表达。本领域技术人员在了解靶标重组宿主细胞的遗传密码和密码子使用的情况下,可容易地调适根据本公开内容的核酸分子,而不导致翻译后所得的氨基酸序列改变。因此,根据本发明的核酸分子的密码子优化的序列也包含在本公开内容中。此外,本发明明确包含具体公开之外的4HPA3H的经遗传修饰酶或其催化活性片段,前提条件是它们在相对于SEQ ID NO:98的活性位点中在独立选自I157、M293、Y301和S462的位置处包含至少一个或更多个突变以使得了解本发明贡献的蛋白质化学领域技术人员可容易地推衍出另外的规范氨基酸序列,其中本发明定义了所述具体位置的重要性及其突变对另一残基的影响。
在根据本发明的第二方面中,提供了用于催化至少一种4-羟基苯基化合物的生物技术转化以生产至少一种在3′和/或4′位处进一步甲基化的3,4-二羟基苯酚化合物的方法,其包括以下步骤:(i)进行如权利要求1至8中任一项所定义的方法,以通过使用经遗传修饰的羟化酶或氧化酶或其催化活性片段提供至少一种3,4-二羟基苯酚化合物,其中所述羟化酶或氧化酶或其催化活性片段在3′位处催化至少一种4-羟基苯基化合物的羟基化;(ii)提供包含至少一种O-甲基转移酶或其催化活性片段的至少一种氨基酸序列或者编码所述至少一种O-甲基转移酶或其催化活性片段的至少一种重组核酸分子,并且任选地提供辅因子,优选S-腺苷甲硫氨酸;和/或任选地提供S-腺苷甲硫氨酸合成酶或其催化活性片段或者编码所述至少一种S-腺苷甲硫氨酸合成酶或其催化活性片段的至少一种重组核酸分子;(iii)使至少一种3,4-二羟基苯酚化合物与包含O-甲基转移酶或其催化活性片段的至少一种氨基酸序列在合适的反应条件下反应,以允许通过包含O-甲基转移酶或其催化活性片段的至少一种氨基酸序列引入至少一种3,4-二羟基苯酚化合物的至少一种甲基化,以产生在3′和/或4′位处甲基化的至少一种3,4-二羟基苯酚化合物;以及(iv)任选地分离和/或纯化所得的在3′和/或4′位置处甲基化的至少一种3,4-二羟基苯酚化合物。
在根据本发明的第二方面的一个实施方案中,提供了一种方法,其中至少一种O-甲基转移酶或其催化活性片段或者编码所述O-甲基转移酶或其催化活性片段的至少一种重组核酸分子选自SEQ ID NO:87至89和193至197和183至185和198至202或者与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列任选地在表达后仍提供O-甲基转移酶活性;并且任选地,其中至少一种S-腺苷甲硫氨酸合成酶或其催化活性片段或者编码S-腺苷甲硫氨酸合成酶或其催化活性片段的至少一种重组核酸分子选自SEQ ID NO:90至94和186至190或者与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列任选地在表达后仍提供S-腺苷甲硫氨酸合成酶活性。
提供了一个实施方案,其中根据本发明的第二方面的方法包括取决于待甲基化的化合物和取决于打算实现的产物而使用3′-O-甲基转移酶或其催化活性片段,或者使用4′-O-甲基转移酶或其催化活性片段,或者两者的组合。因此,在第二方面的一个实施方案中,可以引入第3′位或第4′位处的一个甲基化,或者在另一个实施方案中,两个位置可以同时或连续地进行甲基化。
由于该第二方面实施并进一步利用了上文对于本发明的第一方面所公开的知识,所以根据第一方面的所有实施方案同样代表根据本发明的第二方面的实施方案。
根据涉及本发明第二方面的一个实施方案,提供S-腺苷甲硫氨酸作为用于体外或体内方法的辅因子。在体内方法的情况下,在由重组宿主细胞提供的环境和用于其繁殖的培养基可能已经提供了足够的S-腺苷甲硫氨酸的情况下,使用S-腺苷甲硫氨酸可以是任选的,然而,额外供应这种辅因子在存在大量待甲基化的底物的情况下可能仍然是有益的。在体外方法的情况下,有必要提供S-腺苷甲硫氨酸或提供可比较的甲基供体来源。
对于包含至少一个体内步骤的方法而言,S-腺苷甲硫氨酸可以替代地由S-腺苷甲硫氨酸合成酶或其催化活性片段的活性提供。
在第二方面的另一个实施方案中,因此提供了S-腺苷甲硫氨酸合成酶或其催化活性片段,其可用于提供辅因子S-腺苷甲硫氨酸作为根据本公开内容的O-甲基转移酶或其催化活性片段的辅因子。
根据本公开内容的优选的S-腺苷甲硫氨酸合成酶或编码其的序列独立地选自SEG ID NO:90至94和186至190或者与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列任选地在表达后仍提供S-腺苷甲硫氨酸活性。
此外,在根据本发明的第二方面的另一个实施方案中,在步骤(i)的3′位处催化至少一种4-羟基苯基化合物的羟基化的氧化酶或其催化活性片段或者编码所述氧化酶或其催化活性片段的核酸序列可独立地选自SEQ ID NO:95至97、191和192或者与其具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是同源序列任选在表达之后仍然提供辅因子再循环活性。根据该实施方案的优选氧化酶或其催化活性片段源自保藏为ATCC 14581的巨大芽孢杆菌并且包括参考SEQ ID NO:97中所示的序列在独立地选自A75、F88、L189A331和R472的位置处的至少一个突变。
如上所详述地,使用至少一种辅因子再循环酶或其催化活性片段用于实施本发明的方法是合适的且节约成本的过程,因为进行4-羟基苯酚化合物的氧化/羟基化所需的昂贵的辅因子可以被再循环,而不是补充大量被鉴定为强制性的相应辅因子(参见图2)。因此,根据本发明的第二方面的一个实施方案,根据该第二方面的方法隐含使用至少一种辅因子再循环酶或其催化活性片段。
对于体内应用,在所述辅因子再循环酶已经存在于所使用的重组宿主细胞中的情况,可能不必需使用辅因子再循环酶。对于体外应用,将需要单独或组合使用一种或更多种辅因子再循环酶或其催化活性片段和/或使用辅因子,以允许用于生物转化的主要酶或其催化活性片段的活性,产生3,4-二羟基苯酚化合物,以借助O-甲基转移酶进一步转化为其中的甲基化衍生物。
根据可以与本发明的前述方面相组合的根据本发明的另一个方面,提供包含选自以下的序列或由以下序列组成的重组核酸分子:SEQ ID NO:2至79、95和96,或者与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应的同源序列在表达后仍然提供4-羟基苯乙酸3-羟化酶或氧化酶活性并且前提条件是与相应SEQ ID NO相比,同源序列仍然包括至少一个活性位点的遗传修饰。
根据该方面的重组核酸分子是对所编码的酶4HPA3H的活性位点进行详细研究的结果,产生了关于表达之后得到的酶中那些氨基酸位置的信息,其中(i)限定活性位点并且因此也可以作为核心酶(即催化活性片段)的基础;(ii)哪些位置对于底物结合和转化是必需的;以及(iii)哪些位置可以通过定点诱变进行交换以产生具有增强的底物谱并且同时提供高催化速率、稳定性以及区域和底物特异性的酶或其催化活性片段。
根据本公开内容的所有重组核酸分子可以任选地被密码子优化。这意味着给定核酸序列的密码子使用可以被修改为与目的重组宿主细胞的密码子使用相容,以允许更好的转录速率和功能性氨基酸序列在目的重组宿主细胞中的表达。本领域技术人员在了解靶标重组宿主细胞的遗传密码和密码子使用的情况下,可容易地调适根据本公开内容的核酸分子,而不导致翻译后所得的氨基酸序列改变。因此,根据本公开内容的核酸分子的密码子优化的序列也包含在本公开内容中,并且是限定如在核酸序列的上下文中定义的序列同源性程度的一个理由。
在另一个方面中,提供了包含选自以下的序列或由其组成的重组氨基酸分子:SEQ ID NO:99至175、191和192或者与所述SEQ ID NO具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同源性的同源序列,前提条件是相应同源序列仍然提供4-羟基苯乙酸3-羟化酶或氧化酶活性,并且前提条件是与相应的SEQ ID NO相比,同源序列仍然包括至少一个活性位点的遗传修饰,其中该方面以如上详述的公开了根据本发明的重组核酸分子的方面的那些发现为基础。
在根据本发明的另一个方面中,提供了载体系统,其包含至少一种载体或由至少一种载体组成,其中所述至少一种载体包含(i)至少一种重组核酸分子;和(ii)任选地:编码至少一种辅因子再循环酶或其催化活性片段的至少一种重组核酸分子,和/或(iv)任选地:编码至少一种O-甲基转移酶或其催化活性片段的至少一种重组核酸分子,和/或(v)任选地:编码至少一种S-腺苷甲硫氨酸合成酶或其催化活性片段的至少一种重组核酸分子,其中根据(i)的至少一种重组核酸分子和任选地根据(ii)的至少一种重组核酸分子和/或任选地根据(iv)的至少一种重组核酸分子和/或任选地根据(v)的至少一种重组核酸分子提供在相同或不同载体上,并且对应于上文针对本发明的其他方面和实施方案所呈现的重组核酸分子。
取决于所选择的目的重组宿主细胞,构建本发明的载体系统支架(scaffold)的合适单一载体的选择完全在本领域技术人员的能力范围内。所述载体是市售可得的并且可以容易地调适用于将它们用作根据本公开内容的核酸序列的载荷。
根据本申请的多种实施方案的所有氨基酸序列可以使用重组DNA技术产生,包括使用存在于重组宿主细胞中的合适表达载体。这些方法是本领域常规和已知的,并且技术人员能够限定载体及其必需和任选的组分以获得表达载体或整合载体,其能够(i)在宿主细胞中复制并构建模板用于转录和随后表达连接到所述表达载体中的根据本公开内容的核酸分子,或(ii)能够将编码根据本发明的酶或其催化性片段的连接核酸分子整合到宿主细胞的基因组中。此外,尤其是在根据本公开内容的催化活性片段的上下文中,所述片段可以通过化学合成获得,并且可以任选连接在一起以产生根据本公开内容的功能性催化活性片段。
多肽(尤其是催化活性片段)也可以在体外合成,例如通过固相肽合成方法。固相肽合成方法是本领域常规和已知的。使用重组技术或通过固相肽合成方法产生的多肽可通过常规方法进一步纯化,例如在免疫亲和或离子交换柱上分级分离、乙醇沉淀、反相HPLC、在二氧化硅上或在阴离子交换树脂上的层析例如DEAE、层析聚焦、SDS-PAGE、硫酸铵沉淀、使用例如Sephadex G-75的凝胶过滤或配体亲和力。
根据本发明的一个实施方案,根据本发明或公开内容的所有核酸或氨基酸序列可另外地包含标签序列。标签序列是核酸或氨基酸序列部分,其可以位于目的序列的前面、中间或末端,编码或表示允许更好地分析目的序列的序列,其中分析包括但不限于纯化、可视化或进一步处理目的序列。合适的标签可选自多组氨酸(His)标签,谷胱甘肽-S-转移酶(GST)标签,硫氧还蛋白标签,FLAG标签,具有荧光性质的标签,选自(E)GFP((增强的)绿色荧光蛋白)标签、DsRed标签、mCherry标签等,或链霉亲和素或strep标签,麦芽糖结合蛋白(MBP)标签,允许靶向亚细胞区室的转运肽,包括线粒体或细胞核,允许分泌与其连接的氨基酸序列的捕捉标签和/或分泌标签,通常不天然存在的非天然氨基酸,或前述标签的组合。
如上所述,根据本公开内容的催化活性片段限定了包含酶的全部或部分活性位点并仍然满足其来源的酶的酶功能的最小序列。通过缀合其他效应物或催化活性片段,可以进一步微调根据本公开的催化活性片段的功能,并适用于其中将利用所述分子的方法。所述另外的修饰可以在核酸水平上或在氨基酸水平上引入。本领域技术人员容易获得的这些修饰的序列也包括在本公开内容中。
包含至少一种载体或由至少一种载体组成的载体系统适用于根据本发明第一和第二方面的体内和体外方法两者,因为它可用于提供期望的酶或其催化活性片段。此外,包含至少一种载体或由至少一种载体组成的载体系统适于提供独立于上述公开第一或第二方面的编码的至少一种酶或其催化活性片段,并且也可用于提供编码的用于其他测定或方法的至少一种酶或催化活性片段或作为用于进一步遗传修饰系统中至少一种载体所包含的序列的基础。
在本发明的另一个方面中,提供了重组宿主细胞,所述重组宿主细胞包含如上述方面中关于本发明的重组核酸分子所限定的至少一种重组核酸分子或由其组成,和/或包含如上述方面中关于本发明的重组核酸分子所定义的至少一种重组氨基酸或由其组成,和/或包含如上述方面中关于本发明的载体系统所定义的至少一种载体系统或由其组成,包含至少一种载体或由其组成,优选地其中宿主细胞选自原核细胞,包括大肠杆菌属,特别是大肠杆菌BL21、大肠杆菌BL21(DE3)、大肠杆菌MG1655或大肠杆菌W3110及其衍生物;芽孢杆菌属,特别是地衣芽孢杆菌、枯草芽孢杆菌或解淀粉芽孢杆菌及其衍生物;酵母细胞,包括酵母属,特别是酿酒酵母及其衍生物;汉逊酵母属或毕赤酵母属,特别是巴斯德毕赤酵母和多形汉逊酵母及其衍生物;克鲁维酵母属,特别是乳酸克鲁维酵母及其衍生物;真菌,包括曲霉属,特别是米曲霉,构巢曲霉或黑曲霉及其衍生物;或者木霉属,特别是里氏木霉或哈茨木霉及其衍生物;昆虫细胞或哺乳动物细胞系。
培养根据本公开内容的重组宿主细胞的方法和手段(允许相应宿主细胞的生存力并且允许本文公开的载体、核酸和氨基酸分子的引入、维持和转录、翻译和可能的分泌)是本领域技术人员公知的。
重组宿主细胞“包含/包括”根据本发明的至少一种重组核酸分子作为插入物因此暗示宿主细胞在染色体外复制载体上携带所述插入物或使所述插入物稳定整合到其基因组中。同样,术语重组宿主细胞“包含”表示提供有至少一个任选经修饰的核酸序列和/或至少一个任选经修饰的氨基酸序列或其融合分子的宿主细胞,其中所述序列已经发酵性地(在另一宿主细胞或生物体中)和/或化学性地相对于所述重组宿主细胞在体外或体内,但是在外部(即离体地)产生。
根据本发明的合适宿主细胞,例如选自适合并针对重组蛋白表达进行优化的原核细胞,包括大肠杆菌属,特别是大肠杆菌BL21、大肠杆菌BL21(DE3)、大肠杆菌MG1655或大肠杆菌W3110及其衍生物;芽孢杆菌属,特别是地衣芽孢杆菌、枯草芽孢杆菌或解淀粉芽孢杆菌及其衍生物;酵母细胞,包括酵母属,特别是酿酒酵母及其衍生物;汉逊酵母属或毕赤酵母属,特别是巴斯德毕赤酵母和多形汉逊酵母及其衍生物;克鲁维酵母属,特别是乳酸克鲁维酵母及其衍生物;真菌,包括曲霉属,特别是米曲霉,构巢曲霉或黑曲霉及其衍生物;或者木霉属,特别是里氏木霉或哈茨木霉及其衍生物;昆虫细胞或哺乳动物细胞系。
本领域技术人员在了解本文所提供的本公开内容,尤其是了解关于酶和底物的性质及其催化活性,包括可能需要的辅因子的情况下,可以容易地确定本文提到的合适的反应条件,尤其包括缓冲液,包括缓冲液组合物和pH、添加剂、温度和pH-条件、反应时间等。
在本发明的另一个方面中,提供了包含比率为按wt.%计1∶100至100∶1、优选比率为按wt.%计1∶10至10∶1、更优选比率为按wt.%计1∶5至5∶1的柚皮素和圣草酚或高圣草酚(优选作为中间体或作为离析物)的组合物,或者包含比率为按wt.%计1∶100至100∶1,优选比率为按wt.%计1∶10至10∶1,更优选比率为按wt.%计1∶5至5∶1的根皮素和3-羟基根皮素的组合物,其可通过根据上文关于根据本申请的方法详述的任何一个方面和实施方案的方法获得,其中权利要求的步骤(ii)中提供的至少一种4-羟基苯基化合物选自柚皮素或根皮素,包括其前体、对映体或衍生物。
在该方面的一个实施方案中,通过使用柚皮素作为起始材料通过根据本发明方法公开的体内或体外方法获得组合物。由于高区域和底物特异性,本文公开的生物技术方法提供了高底物转化率并且同时不会导致不期望的副产物(参见图12)。在一个实施方案中,在进行根据本发明的第一方面的一步生物催化方法的情况下,离析物是圣草酚。在另一个实施方案中,在进行根据本发明的第二方面的两步生物催化方法的情况下,离析物是高圣草酚。在另一个实施方案中,根据本发明的方法公开的通过体内或体外方法的起始材料是根皮素而作为体内或体外方法进行的根据本发明的第一方面一步生物催化方法的离析物是3-羟基根皮素。
参照以下非限制性实例进一步描述本发明。
实施例
通过以下非限制性实例进一步说明本发明。
实施例1:蛋白质建模、鉴定4HPA3H活性位点中的相关位置和蛋白质表达
作为本发明进行分析的基础的野生型4HPA3H不像来自铜绿假单胞菌的同源蛋白质那样具有羟基化阿魏酸的能力。为了优化4HPA3H以达到本发明的目的并深入了解各个活性位点的结构,基于嗜热栖热菌(PDB登录2YYJ)的相关酶的结晶学数据模拟4HPA3H和相应的铜绿假单胞菌酶的三维结构。将两种模型都与还包含底物4-羟基苯基乙酸酯和FAD的模板进行比对,以检测出酶4HPA3H的活性位点,其与出于本申请的目的进行靶向诱变的活性位点中结合的4-羟基苯基乙酸酯的芳环紧邻。值得注意地,只鉴定到三个位置在来自大肠杆菌(M293、Y301、S462)和铜绿假单胞菌(P293、F301、A462)的酶中不同。显著地,所有这些位置都被后一种酶中较小体积的残基占据,导致更宽敞的活性位点。因此,那些残基取代了来自大肠杆菌的酶以改变底物范围,有利于更大体积的底物,产生变体M293P、Y301F和S462A。由于类似的原因,似乎直接与4-羟基苯基乙酸酯的酚部分相互作用的异亮氨酸157与缬氨酸交换。进行了位置157、293、301和462的几个其他突变,证明所述位置对于酶促活性,尤其是对于所得突变变体的底物特异性和区域选择性而言确实是关键的。
表达和任选纯化根据本发明的所选4HPA3H变体的实例分别在图4和图5中说明,在大肠杆菌BL21(DE3)中产生。在密码子优化和通过使用不同的市售表达载体之后,使用酵母和真菌作为重组表达宿主进行另外的表达研究,所述重组表达宿主也产生了良好的产率和功能性表达酶(数据未示出)。此外,从通过使位置157、293、301和462的每一个针对任何可能的典型氨基酸进行突变来产生另外单点突变变体开始,产生4HPA3H的另外单、双、三和四突变体的文库。除了详细描述和测试的突变体之外,在第301位具有至少一个突变的突变体,即Y301S,尤其是与第462位的突变组合,特别是S462A和S462G提供了有前途的结果。此外,将M293突变为半胱氨酸、丝氨酸、缬氨酸、异亮氨酸和丙氨酸以及另外突变为赖氨酸提供了具有有利增强特征的突变体,或者涉及它们的稳定性,活性位点中的底物耐受性或者关于起始材料的催化速率,如图1所示。在第I157位引入了增强底物特异性的另外有利突变,其中引入了针对丝氨酸、半胱氨酸、苏氨酸、天冬酰胺和谷氨酰胺的突变,其证明与野生型酶相比具有优越的特征。显著地,上述鉴定的属于4HPA3H活性位点的氨基酸中的突变的靶向组合因此提供了用于酶的靶向和定点诱变的工具箱(其还允许针对目的底物产生具有另外优化的独特优异性能的酶)。
实施例2:4HPA3H的体内羟基化反应和影响
为了探测来自大肠杆菌的4HPa3H的底物需求,使用全细胞生物催化剂,其被证明非常适合进行羟基化反应。使用表达菌株BL21(DE3)在自动诱导条件下产生高水平的重组单加氧酶(高达246mg l-1的培养物),但是细胞没有与携带黄素还原酶组分的基因的质粒共转化,因为证明内源活性足以实现底物的体内转化。测试细胞悬浮液的8种酚化合物组的羟基化(图1),其属于不同种类的天然产物:我们包含(I)酚酸类和酮类如对香豆酸(1)、阿魏酸(3)、大黄明(15)和对羟基苯甲酸(9),(II)多环化合物如羟基香豆素伞形酮(13)、白藜芦醇(5)和类黄酮柚皮素(7)。此外,还包括2-羟基咔唑(11),一种容易获得的生物碱样底物,类似于来自植物的咔唑(clauralia生物碱)或细菌来源的咔唑(卡拉佐他汀(carazostatin)、咔唑马杜林(carbazomadurins))。与其已知的底物1类似,细胞也以高效率(100%)转化化合物13和15(图3A)。显著地,生物催化剂也能够羟基化5、9和11,尽管获得较低产率的儿茶酚产物(78%、39%和9%)。其他内源性单加氧酶在这些转化中的潜在参与通过对照反应(即应用携带空载体的细胞)排除,所述对照反应没有显示转化。与上面提到的底物相比,阿魏酸(3)和柚皮素(7)不被接受,很可能是由于野生型酶的庞大的甲氧基(3)或色满酮(chromanone)取代基(7)。还测试了4HPA3H的4-甲氧基肉桂酸和4-氨基肉桂酸的转化率。这两种对香豆酸(1)的类似物不是所述酶的底物(数据未示出)。因此,根据先前的研究(其显示4HPA3H酶不能羟基化肉桂酸),底物中酚羟基的存在对于酶促转化而言似乎是强制性的。
显著地,酶4HPA3H-Y301F和-S462A对野生型酶也很好地接受的底物具有相当的活性(图1中的1、13、15),而变体M293P并且特别地,I157V显示活性降低(参见图3)。这种降低的活性仅对天然底物观察到。即使说M293和I157位置被证明是产生在活性位点具有多于一个突变以调节底物特异性和催化速率的突变体的有价值的靶标。
变体的特征在于底物特异性的改变:酶Y301F被证明在底物5、9和11的转化方面优越(参见图1)。显著地,大多数变体还能够氧化柚皮素(7)以及少数的阿魏酸(3)。这种效应在一些双变体中甚至更明显,其由大体积底物2-羟基咔唑(11)和柚皮素(7)产生高达26%(I157V/Y301F)和30%(Y301F/S462A)的儿茶酚(图3B)。尤其是取代Y301F似乎对接受具有挑战化合物具有最大的影响,因此我们决定在该位置引入亮氨酸或异亮氨酸。就疏水性而言,两种氨基酸与苯丙氨酸类似,但尺寸较小。显著地,所得到的突变酶的优选底物是阿魏酸(3)(特别是通过4HPA3H-Y301I转化多至45%),优于众所周知的底物,例如对香豆酸(1)(图3A)。显然地,活性位点的尺寸和疏水性的细微变化(例如,仅用变体Y301F和S462A中的氢原子正确取代羟基)足以改变4HPA3H酶的底物范围。通过易错聚合酶链反应获得的几种变体能够转化缺乏天然底物的羧基的酚。这种改变的底物偏好性归因于影响活性位点残基定位的第二壳位置的微小变化。
用在活性位点残基157、293、301和462中包含三个或四个突变的变体进行另外的实验,其全部产生具有改善的结合和催化特征的酶,表明这些残基对于4HPA3H的靶向合理设计的重要性。
通过SDS-PAGE确认合适的表达之后,将变体和野生型酶应用于体内羟基化反应(参见图4和图5)。
实施例3:4HPA3H和变体的产物特异性
为了获得羟基化产物的结构信息,我们进行了大规模的全细胞生物转化(500mL的细胞悬浮液)。每种底物都被在体内分析反应中显示最高转化的酶变体转化(见上文)。与那些转化类似,孵育16小时之后从反应混合物中提取儿茶酚产物。通过制备型反相HPLC纯化的化合物通过1H-NMR、MS和MS2测量鉴定为图1中所示的儿茶酚。值得注意的是,4HPA3H及其变体显示出严格的区域和产物特异性。与进行连续羟基化的来自铜绿假单胞菌的酶相反,野生型酶及其变体均未观察到儿茶酚进一步转化为焦棓酚(pyrogallol)样多酚。
实施例4:体外4HPA3H和变体的活性以及合适的辅因子再循环酶的表征
为了表征4HPA3H及其变体的比活性,需要开发方便的体外测定法。由于酶依赖于提供辅因子FADH2的还原酶组分(参见图2),因此本发明人关注于在第一步中筛选合适的还原酶。由于在多种表达条件下形成主要不溶性蛋白,因此来自大肠杆菌的黄素还原酶HpaC-4HPA3H的内源性伴侣不可接近(数据未示出)。在寻找同源蛋白质中,来自为假单胞菌双组分芳香胺加氧酶系统的一部分的假单胞菌属蛋白质Pf-5(NCBI登录AAY91318.1)的PrnF显示与菌株假单胞菌属蛋白质CHA0具有高度序列同一性(99%)。证明重组PrnF在大肠杆菌中得到很好的表达(产率为175mg l-1的培养物)。纯化的蛋白质对于用NADH(16,660±1,600nmol分钟-1mg-1)还原FAD具有高活性。
为了以微孔板规模测定4HPA3H,将4HPA3H与PrnF、底物对香豆酸(参见图1的1)和来自博伊丁假丝酵母的甲酸脱氢酶(FDH)孵育。与我们先前的公开报道相似,这种酶被引入用于再生在反应期间形成的昂贵的辅因子NADH:NAD+与甲酸钠一起再循环,产生氢化物转移的连续三酶级联(图2)。通过先前建立的儿茶酚络合方法(M.Dippe,B.Weigel,R.Heinke,T.Vogt,L.A.Wessjohann,2014)以分光光度法测量对香豆酸(参见图1的1)的转化率,其可用于定量测定产物咖啡酸(参见图6)。发明人然后在优化的条件下(参见下一部分)测定4HPA3H,产生与文献(Y.Lin,Y.Yan,Microb.Cell Fact.2012,11:42.)相当的比活性(6.2±0.5nmol分钟-1mg-1)。两种变体Y301F/S462A和Y301I(它们也是经重组产生(产率分别为147和112mg l-1的培养物)并应用作为纯化酶)对对香豆酸(参见图1的1)显示出还原活性(1.6±0.3nmol分钟-1mg-1和1.3±0.6nmol分钟-1mg-1)。然而,与从全细胞生物转化获得的数据(参见实施例2)相似,这些变体在阿魏酸(参见图1的3)的转化中是有益的,这也反映为相当高的转化率(4HPA3H-Y301F/S462A:1.06±0.31nmol分钟-1mg-1,4HPA3H-Y301I:4.49±0.20nmol分钟-1mg-1)。
实施例5:通过4HPA3H/PrnF体外产生儿茶酚
在大量的生物催化转化中,无细胞(体外)体系被证明是合适的,尤其是强调通过所用微生物的底物耗尽和对所用微生物的毒性、副反应和容易的产物纯化时。为了开发用于体外羟基化的有效和低成本的酶系统,优化了4HPA3H反应相对于最大反应速率的几个参数。通过分光光度测定法(上述实施例4),本发明人筛选了不同的缓冲液体系并优化了组分对香豆酸(参见图1的1)、FAD、NADH和甲醇的浓度、孵育温度和氧转移(即通过改变振动频率)(最佳条件在实验部分给出)。特别地,这种微调产生(I)NADH含量从200μM(根据参照的标准条件)降低至25μM而没有活性损失(参见支持信息中的图S4),(II)高浓度的底物的耐受性(1mM),以及(III)助溶剂甲醇(10%体积/体积)的耐受性(其由于增强的底物溶解度而有利)。相比之下,氧化还原系统易受到高浓度的FAD(其为抑制性)的影响(参见图7)。与辅因子相反,伴随的辅因子再循环氧化还原酶PrnF和FDH由于其高的比活性而被过量使用。
随后,将优化的反应条件应用于图1所示的底物的体外氧化。根据全细胞转化实验(图3),野生型4HPA3H转化的产物产率(图8A)从高(参见图1的1、13、15)或中等(参见图1的5)至低(参见图1的9、11),而阿魏酸3未被氧化。一致地,突变酶Y301F/S462A和Y301I(图8B)证明对于挑战性底物3和7的转化是最佳的。然而,与使用生活生物催化剂的实验相反,观察到野生型4HPA3H(25%产率)对柚皮素的低转化率(参见图1的7)(这可以通过增加底物可用性来说明)。双变体Y301F/S462A不接受羟基咔唑(11),可能是因为高的底物浓度,这似乎反映了强烈的产物抑制作用一这种效应先前在其他4HPA3H酶中已经观察到。值得注意的是,反应产物的HPLC分析证实了产物的特异性。
实施例6:使用基于固相的级联系统将柚皮素羟基化成圣草酚
制备柚皮苷和圣草酚(每种10mM)在甲醇中的储备溶液(对于化合物的结构,参见图9)。使用乙腈稀释它们以获得期望的浓度(70、110、140、210和280μM)。将10μl的每种样品注入HPLC机器中,并对两种底物产生校准曲线(数据未示出)。
首先使用9mU氧化酶4HPA3H在包含1ml 1M Tris/HCl,pH 7.5;25μl的10mM NADH溶液、20μl的5mM FAD溶液和1ml甲酸溶液的10ml反应中使用9mU 4HPA3H-Y301F/S462A(SEQ ID NO:175)和0.57mU PrnF-还原酶(SEQ ID NO:176)和640mU FDH(SEQ ID NO:177)进行催化作用。随后将酶混合,添加100μl 1M Tris/HCl溶液,pH 7.5,并加入ddH2O(去离子,反渗透)至2ml。酶溶液至少5次通过1ml Talon柱,流量为0.1ml/分钟-1,以使蛋白质以均匀的方式结合到柱上。通过Bradford测定法来评估蛋白质与柱材料的完全结合。然后,柱用50mM Tris/HCl,pH 7.5(=基础缓冲液)洗涤一次,并连接到蠕动泵上。图4B显示了用于体外生物催化方法的纯化酶。
将每种反应混合物的组分转移至合适的无菌烧瓶中,然后将其连接至蠕动泵。在反应期间,借助磁力搅拌器轻微搅拌反应混合物。使用1ml/分钟的流量,将系统用基础缓冲液洗涤2分钟并取对照样品。仅在接下来添加底物,此处添加200μM柚皮素(来自10mM甲醇储备溶液)。将底物以最大1ml/分钟的流量泵入具有与其结合的酶的Talon柱上。在0至1310分钟的时间范围内,以每份35μl的样品进行样品提取。所述样品与等体积的乙腈混合并立即注入HPLC装置(每个20μl)中。借助在实验开始时完成的校准曲线进行评估,由此测量和计算峰面积(参见图10)。在1290分钟之后使用9mU 4HPA3H-Y301F/S462A(SEQ ID NO:175),21.5小时之后使用9mU/l ml柱体积的催化剂可以证实生物催化形成42.4μM圣草酚和剩余浓度为29.3μM的柚皮素,其对应于产率>12.2mg(>21.2%)。
使用35mU羟化酶/1ml柱体积进行相同的测定,并且用于再生辅因子的辅酶浓度等同地增加。从图11还可以看出,该催化作用在已经经过240分钟之后产生了67.7μM的圣草酚和剩余浓度为33.3μM的柚皮素,这意味着在小于4小时的时间内可以获得>19.5mg(>33.8%)产物,而总产率仍然较高。
进一步观察到圣草酚可能具有黏附Talon柱反应性基团的Co2+离子的能力,其用于与例如带HIS标签的目的蛋白质/酶相互作用。因此,建议限定将酶偶联至特定柱的正确方式(并且这是在本领域技术人员的技能范围之内的),以避免离析物/产物与柱上的反应性标签或柱材料/树脂的非特异性结合,以进一步增加根据本发明的体外生物催化方法的产率。
值得注意的是,上面详细描述的浓度为9mU和35mU氧化酶的体外生物催化过程显示出明显高的区域和底物特异性,仅产生没有任何可检测副产物的期望产物(参见图12)。已经在30分钟反应时间之后,可以检测出产物圣草酚产生的峰(参见图12(B))。在240分钟之后,已经存在明显的圣草酚峰(参见图12(C)),而反应很容易延长并且反应条件(缓冲液组合物、酶浓度、流量、包括暂停/静止相互作用阶段)以达到甚至高至1∶100的更高柚皮素与圣草酚比率。显然,比较图12(A)至图12(C)时,在任一底物转化之前的反应开始时的时间点“0”处,在色谱图中仍然可以识别的小峰已经存在于溶液中,可以证明所述副产物不是所使用的氧化酶系统的结果,而是由起始缓冲液/溶液中所含分子产生的峰。这指示了高度特异性和高效的反应,除产物圣草酚以外未产生副产物,特别是没有进一步的氧化产物。
实施例7:组合的两步生物技术生成另外的甲基化3,4-二羟基苯酚化合物
为了进一步测试使用来自大肠杆菌的遗传工程改造的氧化酶的生物技术方法可靠且多用途地用于生产甲基化3,4-二羟基苯酚化合物(尤其是类黄酮)的适用性,设计包含pET28+(用于大肠杆菌)和穿梭载体pD1214(用于酿酒酵母)并携带3’或4’O-甲基转移酶编码区(参见例如SEQ ID NO:87至89和193至197)或两者以及4HPA3H酶的编码区(参见例如SEQ ID NO:1至79)的载体系统,在相同或不同的载体上进行共转化。此外,创建了几种构建体,其中将4HPA3H变体克隆到不同的表达载体中以使它们具有不同的蛋白质标签用于后续纯化和/或固定化用于体外催化方法。此外,生成无标签变体。关于体内测定,取决于宿主细胞的类型,辅酶再循环酶也与上述酶共表达。
在验证体内和(在纯化所需酶后)体外的功能蛋白表达后,进行测定(其将酶级联的两个步骤整合),即首先将4-羟基苯酚氧化成3,4-二羟基苯酚化合物,然后将由此获得的中间体进一步甲基化为在3′或4′位或两者处具有甲基化的进一步甲基化化合物。
对于体内测试,测试大肠杆菌BL21(DE3)细胞的悬浮液用于一组若干酚化合物的羟基化,如以上实施例2中详述的。特别关注使用柚皮素作为起始物质的方案的优化,所述方案当同时提供4HPA3H酶和4-O-甲基转移酶时产生橙皮素,当同时提供4HPA3H酶和3-O-甲基转移酶时产生高圣草酚(参见图13)。可以将柚皮素添加到包含携带产生4HPA3H的质粒和合适的O-甲基转移酶的转化宿主细胞的振荡培养物中。鉴于该体内系统的成功提供,将通过取代起始材料和O-甲基转移酶来进行进一步的实验,因为通过本工作阐明的机制可以容易地针对宽范围的被4HPA3H酶的活性位点接受的3-羟基苯基化合物(其可容易地转化为3,4-二羟基苯酚化合物)进行调整,随后使用合适的O-甲基转移酶在期望位置上定制甲基化。
在4HPA3H变体和相应的O-甲基转移酶纯化后,重复相同测定作为体外生物催化测定,提供这些酶以及合适的辅因子再循环酶(参见实施例6)用于底物柚皮素。此处,必须采用两步程序,而本程序的步骤1如实施例6中详述的那样进行。然后使用具有与其非共价连接的O-甲基转移酶的柱进行步骤1的离析物的另外衍生化。使用固定化酶进行另外的实验。然后将步骤1的洗脱液转移到其上结合有O-甲基转移酶的柱上。的在对于O-甲基转移酶的催化活性最佳的范围内选择用于相互作用的缓冲液体系。测试了根据表1的以下缓冲液:
表1
此外,这种离体进行的酶促生物催化方法要求将S-腺苷甲硫氨酸添加至作为O-甲基转移酶的辅因子的缓冲液中。优化的缓冲液条件可以根据目的O-甲基转移酶来确定。上述测定法产生了足够量和纯度的橙皮素和高圣草酚以基于该方法计划工业规模的应用。还设想引入第三步,在将另外的甲基化引入目的底物中的情况下,考虑到目的O-甲基转移酶所要求的特性,其可以作为步骤2进行,然而其可以容易地在常规预实验中确定。
显然,在本实验中用于体内或体外催化在4-羟基苯基化合物的3′位置引入羟基化作为底物的4HPA3H变体同样可以与另一种酶交换,这可通过使用这种不同的酶并将其应用于本工作所提供的生物技术方法中来实现,本工作阐明了生物催化步骤的对应顺序。
- 还没有人留言评论。精彩留言会获得点赞!
- 2‑甲基‑5‑(3,4‑二羟基苯基)吡啶及其提取方法和应用与流程
- 一种从咖啡豆中提取绿原酸和单宁的方法与流程
- 三元除草组合物的制造方法与工艺
- 稳定化的聚烯烃组合物的制造方法与工艺
- 合成D-联苯基丙氨酸的方法与制造工艺
- 7‑溴‑5‑(2‑氯苯基)‑1,3‑二氢噻吩并[2,3e]‑1,4‑二氮杂卓‑2‑硫酮的制备方法与制造工艺
- 一种9‑(3‑溴苯基)‑3‑(9‑苯基‑9H‑芴基)‑9H‑咔唑的合成方法与制造工艺
- 一种柳氨酚药物中间体N‑对羟基苯基水杨酰胺的合成方法与制造工艺
- 7,3’,4’-大豆异黄酮制剂的制备方法与制造工艺
- 皮革或皮革制品及其制造方法、6价铬处理剂、粗皮革或粗皮革制品中的6价铬的处理方法与制造工艺