用于抑制烟酰胺磷酸核糖转移酶的新化合物和包含它的组合物的制作方法
本发明涉及用于抑制烟酰胺磷酸核糖转移酶(nampt)的新化合物以及包含它的组合物及其各种用途。
[背景技术]
nad+(烟酰胺腺嘌呤二核苷酸)是一种在许多生理上必不可少的过程中起重要作用的辅酶(ziegkel,m.eur.j.生物化学(biochem).267,1550-1564,2000)。nad对于几种信号通路至关重要,包括免疫系统中的单adp-核糖基化和dna修复中的其他聚adp-核糖基化中的g蛋白偶联受体信号传导,并且对于sirtuin脱乙酰酶的活性也是必需的(garten,a等人,内分泌和代谢趋势(trendsinendocrinologyandmetabolism),20,130-138,2008)。
烟酰胺磷酸核糖转移酶(nicotinamidephospholibosyltransferase,nampt)是一种催化烟酰胺磷酸化的酶,并且在恢复nad的两种途径之一中是一种限速酶。
越来越多的证据表明nampt抑制剂具有抗癌作用。与正常细胞相比,癌细胞具有更高的nad基础周转率并且还需要更高的能量。此外,在结肠直肠癌中报道了nampt表达的增加(vanbeijnum,j.r.等人,int.j.癌(cancer)101,118-127,2002),并且据报道nampt参与血管生成(kim,s.r.等人,生物化学(biochem).生理(biophys).res.commun.357,150-156,2007)。nampt小分子抑制剂引起细胞内nad+水平的消耗并最终诱导肿瘤细胞死亡(hansen,cm等人,抗癌研究(anticancerres).20,42111-4220,2000),以及在异种移植模型中抑制肿瘤生长。
此外,nampt抑制剂在炎症和代谢疾病中具有作为治疗剂的潜力(galli,m.等人,抗癌研究(cancerres).70,8-11,2010)。例如,nampt在t和b淋巴细胞中是一种主要酶。在选择性抑制nampt时,淋巴细胞可以通过降低nad+来抑制自身免疫疾病的发生,但是具有其他nad+合成途径的细胞类型则不能。小分子nampt抑制剂(fk866)抑制活化t细胞的增殖并诱导细胞凋亡,并且在关节炎动物模型(胶原诱导的关节炎)中有效(busso,n.等人,plosone3,e2267,2008)。nampt活性增加人血管内皮细胞中nf-kb转录活性并诱导mmp-2和mmp-9活性,这表明nampt抑制剂在预防炎症介导的肥胖和2型糖尿病并发症中起作用(adya,r.等人,糖尿病护理(diabetescare),31,758-760,2008)。
作为一种nampt抑制剂,具体地,(e)-n-[4-(1-苯甲酰基哌啶-4-基)丁基]-3-(吡啶-3-基)-丙烯酰胺(也称为apo866、、fk866、wk175或wk22.175,以下称为“以下称为175国际非商品名])为已知一种抗癌剂。fk866被用于治疗与失调的细胞凋亡相关的疾病(例如癌症)。在现有技术中,已证实fk866阻碍烟酰胺腺苷二核苷酸(也称为nad,在下文中也称为nad)的生物合成,而没有任何dna损伤作用并诱导凋亡性细胞死亡。
此外,fk866在hepg2细胞中诱导凋亡而对细胞能量代谢没有主要影响(hasmannm,schemaindai.fk866,一种高度特异性的非竞争性烟酰胺磷酸核糖转移酶抑制剂,代表诱导肿瘤细胞凋亡的新机制.癌症研究(cancerres)2003;63:7436-7442。[pubmed:14612543])。在细胞中抑制nampt并消耗nad,而不是引起直接细胞毒性,表明fk866可能是一种有效的癌细胞活性剂,它依赖于烟酰胺合成nad。。nampt-fk866复合物的晶体结构表明该化合物与nampt的烟酰胺结合位点结合以抑制其活性。fk866在小鼠肿瘤细胞癌模型中进行了测试,并已被证明其具有抗肿瘤、抗转移和抗血管生成活性(drevsj,等,fk866/k22.175的抗血管生成能力,一种新的细胞内nad生物合成抑制剂fk866/k22.175在小鼠肾细胞癌中的抗血管生成作用.抗癌研究(anticancerres)2003;23:4853-4858.[pubmed:14981935])。
抑制nampt的药物可在除如上所述的炎性疾病或癌症之外还具有许多用途。nampt表达的缺乏可能强烈影响t和b淋巴细胞的生长。此外,nampt可以影响与高葡萄糖水平、氧化应激和衰老相关的内皮细胞,并且进一步已知nampt能够有效地使用过量的葡萄糖,从而使人体内皮细胞在增殖过程中可以承受老化和葡萄糖的高氧化应激,并且使复制的寿命和血管生成活性成为可能。
[
技术实现要素:
]
[技术问题]
本发明的一个目的是提供一种能够抑制烟酰胺磷酸核糖转移酶(nampt)的新化合物。
本发明的另一个目的是提供一种能够预防、改善或治疗nampt相关疾病的组合物,其包含能够抑制nampt的新化合物。
本发明的另一个目的是提供一种通过使用能够抑制nampt的新化合物来预防、改善或治疗nampt相关疾病的方法。
然而,本发明要解决的技术问题不限于上述问题,本领域技术人员从以下描述中可以清楚地理解未提及的其他问题。
[技术方案]
本发明的发明人发现了一种能够抑制烟酰胺磷酸核糖转移酶(以下,称为‘nampt’)活性的新型化合物,并完成了本发明。
本发明的一个实施方式提供了一种选自如下化学式1所示化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式1]
其中,x1和x2各自独立地为n或c(r3);
l1为直键或c2-c4亚烯基;
r1和r2各自独立地为氢、-(ch2)m-r4或-n=c(r5)(r6),或r1和r2相互键合形成具有5至7个核原子的杂环烷基环,具有5至14个核原子的杂芳基环或具有5至14个核原子的非芳香稠合杂多环;
r3为氢或c1-c6烷基;
r4为-l2-r7;
l2为直键、c6-c10亚芳基或具有5至14个核原子的亚杂芳基;
r5和r6可以相互键合形成具有5-14个核原子的非芳香稠合杂多环;
r7选自下组:c1-c6烷基、具有5至7个核原子的杂环烷基、c6-c14芳基、具有5至14个核原子的杂芳基、c5-c14非芳香稠合多环基、具有5-14个核原子的非芳香稠合杂多环基、-c(=o)-r8、-s(=o)(=o)-r9、-(ch2)n-n(r10)(r11)和-(ch2)n-o-(l3)-(r12);
r8选自下组:c1-c6烷基、c1-c6烷氧基、c3-c7环烷氧基、具有5至7个核原子的杂环烷基、具有5至14个核原子的杂芳基和具有5至14个核原子的非芳香稠稠合杂多环基;
r9为具有5至7个核原子的杂环烷基;
r10和r11各自独立地为氢、c1-c6烷基或-c(=o)-r13;
l3为直键或c1-c4亚烷基;
r12为c6-c14芳基或具有5至14个核原子的杂芳基;
r13为-(l4)-(r14);
l4为直键或具有5至14个核原子的亚杂芳基;
r14为c6-c14芳基或具有5至14个核原子的杂芳基;
m和n各自独立地为0至4的整数;
通过键合r1和r2一起形成的杂环烷基环、杂芳基环和非芳香稠合杂多环各自独立地为未取代的或被选自下组的至少一个取代基所取代:-(l5)-(l6)-(r15)和-nh-c(=o)-r16,当它们被多个取代基取代时,取代基彼此相同或不同;
l5为直键或c1-c4亚烷基;
l6为直键或具有5至14个核原子的亚杂芳基;
r15为c6-c14芳基或具有5至14个核原子的杂芳基;
r16为c6-c14芳基或具有5至14个核原子的杂芳基;
通过键合r5和r6一起形成的非芳香稠合杂多环被至少一个c1-c6烷基取代或为未取代的,且当它们被多个取代基取代时,取代基彼此相同或不同;
r7的烷基、杂环烷基、芳基、杂芳基、非芳香稠合多环和非芳香稠合杂多环各自独立地为未取代的或被选自下组的至少一个取代基所取代:卤素、硝基、c1-c6烷基、c1-c6烷氧基、c6-c14芳基和具有5至14个核原子的杂芳基,且当它们被多个取代基取代时,取代基彼此相同或不同;
r14的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一个取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,,且当它们被多个取代基取代时,取代基彼此相同或不同;
r15和r16的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一个取代基所取代:c1-c6烷基和c1-c6卤代烷基,且当它们被多个取代基取代时,取代基彼此相同或不同。
本发明的另一个实施方式提供了包含治疗有效量的化合物的药物组合物和药物制剂。
如本文所用,术语‘卤素’,除非另有说明,是指氟、氯、溴或碘。
如本文所用,除非另有说明,术语‘c1-c6烷基’是指具有1至6个碳原子的直链或支链的碳氢残基。例如包括甲基、乙基、丙基、异丙基、正丁基、仲丁基、叔丁基、正戊基和正己基等,但不限于此。
如本文所用,除非另有说明,术语‘c1-c6烷氧基’是指具有1至6个碳原子的直链或支链的碳氢残基。例如包括甲氧基、乙氧基、丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基、戊氧基和己氧基等,但不限于此。
如本文所用,除非另有说明,术语'c3-c7环烷氧基’是指具有连接至氧的3至6个碳原子的环碳氢残基,例如包括环丙氧基、环丁氧基、环戊氧基、环己氧基和环庚氧基等,但不限于此。
如本文所用,除非另有说明,术语'c3-c7环烷基’是指具有3至7个碳原子的环碳氢残基。其示例包括环丙基、环丁基、环戊基、环己基和环庚基等,但不限于此。
如本文所用,除非另有说明,术语'具有5至7个核原子的杂环烷基’是指含有一至三个任选地选自n、o、s、so和so2的5至7元环状残基。例如包括四氢呋喃-3-基,四氢-2h-吡喃-4-基,四氢-2h-吡喃-3-基,氧杂环庚烷-4-基,氧杂环庚烷-3-基,哌啶-1-基,哌啶-3-基,哌啶-4-基,哌嗪-1-基,吗啉-4-基,硫代吗啉-4-基,1,1-二氧代-硫代吗啉-4-基,吡咯烷-1-基,吡咯烷-3-基,氮杂环庚烷-1-基,氮杂环庚烷-3-基和氮杂环庚烷-4-基等,但不限于此。
如本文所用,除非另有说明,术语‘c6-c14芳基’是指具有6-14个碳原子的单环或多环碳环系统,具有至少一个稠合或非稠合芳环,芳基的示例包括苯基、萘基、四氢萘基、茚基和蒽基等,但不限于此。
如本文所用,除非另有说明,术语‘具有5至14个核原子的杂芳基’是指5至14元芳香基团,例如单环或双环或更多环状的芳香基团,其含有至少一个,例如,一至四个选自o、n和s的杂原子。单环杂芳基的示例包括噻唑基、恶唑基、噻吩基、呋喃基、吡咯基、咪唑基、苯并[d]恶唑基、异恶唑基、恶唑并吡啶基、吡唑基、三唑基、噻唑基、苯并[d]噻唑基、噻二唑基、四唑基、恶二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、喹啉基、萘并恶唑基以及它们的类似基团,但不限于此。二环杂芳基的示例包括吲哚基、苯并噻吩基、苯并呋喃基、苯并咪唑基、苯并恶唑基、苯并异恶唑基、苯并噻二唑、苯并三唑基、喹啉基、异喹啉基、呋喃基(furinyl)、呋喃并吡啶基、咔唑基、二苯并呋喃基、二苯并噻吩基以及它们的类似基团,但不限于此。
如本文所用,术语‘c5-c14非芳香性稠合多环’是指环中至少两个环相互缩合,且仅含有6至14个碳原子作为成环原子以及整个分子具有非芳香性。其示例包括芴基等,但不限于此。
如本文所用,术语‘具有5至14个核原子的非芳香稠合杂多环’是指环中至少两个环彼此缩合,并除碳作为成环原子外,含有至少一个,例如一至四个选自n、o和s的杂原子,且5至14元的整个分子具有非芳香性。非芳香稠合杂多环的示例包括吲哚啉基、异吲哚啉基、四氢喹啉基、四氢异喹啉基、2,3-二氢-1h-苯并[d]咪唑基、2,3-二氢苯并[d]恶唑基、2,3-二氢苯并[d]噻唑基、3,3a-二氢吡唑[1,5-a]嘧啶基、2,3,3a,7a-四氢苯并[d]噻唑基和2,3,3a,7a-四氢-1h-异吲哚基等,但不限于此。
如本文所用,术语‘c2-c4亚烯基’是衍生自含有至少一个碳-碳双键的碳氢化合物链的二价残基二价残基,例如,亚烯基为具有2至4个碳原子的亚烷基。所述亚烷基可被至少一个可聚合的官能团或其它取代基取代,所述碳氢化合物链可在链中含有诸如氮(n)或氧(o)的杂原子。其示例包括乙烯基、丙烯基和丁烯基等,但不限于此。
如本文所用,术语"稠环"是指稠合脂族环、稠合芳族环、稠合杂脂族环、稠合杂芳环,或其组合。
[有益效果]
本发明如化学式1所示的化合物具有优异的抑制烟酰胺磷酸核糖转移酶(nampt)活性,可以预防、改善或治疗多种与nampt相关的疾病,并且,进一步地,它可以特别用作预防、改善或治疗癌症的药物。
[附图说明]
图1显示了根据本发明实施例的合成实施例1中制备的n-(4-(6-甲基苯并[d]恶唑-2-基)苄基)烟酰胺(a4276)的nmr谱图。
图2显示了根据本发明实施例的合成实施例2中制备的n-(4-(6-氯苯并[d]恶唑-2-基)苄基)烟酰胺(a4266)的nmr谱图。
图3显示了根据本发明实施例的合成实施例3中制备的n-(4-(6-甲基苯并[d]恶唑-2-基)苄基)烟酰胺(a4265)的nmr谱图。
图4显示了根据本发明实施例的合成实施例4中制备的n-(4-(恶唑并[4,5-c]吡啶-2-基)苄基)烟酰胺(b1471)的nmr谱图。
图5显示了根据本发明实施例的合成实施例33中制备的n-乙基-n-(4-(烟酰氨基甲基)苄基)乙铵(药物3)的nmr谱图。
图6显示了根据针对评估实施例1中nampt的本发明实施例以不同浓度处理合成实施例1中制备的化合物(a4276)时按照处理时间测量吸光度变化的结果。
图7显示了根据针对评估实施例1中nampt的本发明实施例以不同浓度处理合成实施例2中制备的化合物(a4266)时按照处理时间测量吸光度变化的结果。
图8显示了根据针对评估实施例1中nampt的本发明实施例以不同浓度处理合成实施例3中制备的化合物(a4265)时按照处理时间测量吸光度变化的结果。
图9显示了根据针对评估实施例1中nampt的本发明实施例以不同浓度处理合成实施例4中制备的化合物(b1471)时按照处理时间测量吸光度变化的结果。
图10显示了根据针对评估实施例1中nampt的本发明实施例以不同浓度处理对比实施例1中制备的化合物(fk866)时按照处理时间测量吸光度变化的结果。
图11为显示根据评估实施例1中图6的结果按照a4276化合物处理浓度在vmax/min中变化的图。
图12为显示根据评估实施例1中图7的结果按照a4266化合物处理浓度在vmax/min中变化的图。
图13为显示根据评估实施例1中图8的结果按照a4265化合物处理浓度在vmax/min中变化的图。
图14为显示根据评估实施例1中图9的结果按照a1471化合物处理浓度在vmax/min中变化的图。
图15为显示根据评估实施例1中图10的结果按照fk866化合物处理浓度在vmax/min中变化的图。
图16显示了根据针对评估实施例2中的各种癌细胞系的本发明实施例以不同浓度处理合成实施例1中制备的化合物(a4276)后按照浓度测量癌细胞系活力变化的结果。
图17显示了根据对于评估实施例2中的各种癌细胞系的本发明实施例以不同浓度处理合成实施例2中制备的化合物(a4266)后按照浓度测量癌细胞系活力变化的结果。
图18显示了根据对于评估实施例2中的各种癌细胞系的本发明实施例以不同浓度处理合成实施例3中制备的化合物(a4265)后按照浓度测量癌细胞系活力变化的结果。
图19显示了根据对于评估实施例2中的各种癌细胞系的本发明实施例以不同浓度处理合成实施例4中制备的化合物(b1471)后按照浓度测量癌细胞系活力变化的结果。
图20为显示根据对于评估实施例4中癌细胞系h322的本发明实施例用2.5明实的合成实施例4中制备的化合物(b1471)处理后细胞内nad、atp和总蛋白含量变化的图。
图21显示了使用在培养评估实施例5中为正常细胞系的原代心肌细胞,视网膜色素上皮细胞(rpe)和肝细胞后获得的细胞裂解物通过western印迹分析来分析naprt和nampt表达水平的结果。
图22显示了根据对于评估实施例5中的原代心肌细胞的本发明实施例分别按照合成实施例1和3中制备的化合物(a4276,a4265)以及对比实施例1的化合物(fk866)的浓度测量细胞活力变化的结果。
图23显示了根据对于评估实施例5中的视网膜色素上皮细胞(rpe)的本发明实施例分别按照合成实施例1和3中制备的化合物(a4276,a4265)以及对比实施例1的化合物(fk866)的浓度测量细胞活力变化的结果。
图24显示了根据对于评估实施例5中的肝细胞(thle-2)的本发明实施例分别按照合成实施例1和3中制备的化合物(a4276,a4265)以及对比实施例1的化合物(fk866)的浓度测量细胞活力变化的结果。
图25显示了根据对于评估实施例6中的肝细胞(thle-2)的本发明实施例分别按照合成实施例4,8和13中制备的化合物(b1471,b1468,b1477)和对比实施例1和2的化合物(fk866,gne617)的浓度测量细胞活力变化的结果。
图26显示了根据对于评估实施例6中的肝细胞(thle-3)的本发明实施例分别按照合成实施例4,8和13中制备的化合物(b1471,b1468,b1477)和对比实施例1和2的化合物(fk866,gne617)的浓度测量细胞活力变化的结果。
[最佳方式]
以下,将详细阐述本发明。
本发明的一方面提供了选自如下化学式1所示化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式1]
化学式1中,
其中,x1和x2各自独立地为n或c(r3);
l1为直键或c2-c4亚烯基;
r1和r2各自独立地为氢、-(ch2)m-r4或-n=c(r5)(r6),r1和r2相互键合形成具有5至7个核原子的杂环烷基环、具有5至14个核原子的杂芳基环或具有5至14个核原子的非芳香稠合杂多环;
r3为氢或c1-c6烷基;
r4为-l2-r7;
l2为直键、c6-c10亚芳基或具有5至14个核原子的亚杂芳基;
r5和r6可以相互键合形成具有5-14个核原子的非芳香稠合杂多环;
r7选自下组:c1-c6烷基、具有5至7个核原子的杂环烷基、c6-c14芳基、具有5至14个核原子的杂芳基、c5-c14非芳香稠合多环基、具有5-14个核原子的非芳香稠合杂多环基、-c(=o)-r8、-s(=o)(=o)-r9、-(ch2)n-n(r10)(r11)和-(ch2)n-o-(l3)-(r12);
r8选自下组:c1-c6烷基、c1-c6烷氧基、c3-c7环烷氧基、具有5至7个核原子的杂环烷基、具有5至14个核原子的杂芳基和具有5至14个核原子的非芳香性稠合杂多环基;
r9为具有5至7个核原子的杂环烷基;
r10和r11各自独立地为氢、c1-c6烷基或-c(=o)-r13;
l3为直键或c1-c4亚烷基;
r12为c6-c14芳基或具有5至14个核原子的杂芳基;
r13为-(l4)-(r14);
l4为直键或具有5至14个核原子的亚杂芳基;
r14为c6-c14芳基或具有5至14个核原子的杂芳基;
m和n各自独立地为0至4的整数;
通过键合r1和r2一起形成的杂环烷基环、杂芳基环和非芳香性稠合杂多环各自独立地为未取代的或被选自下组的至少一个取代基所取代:-(l5)-(l6)-(r15)和-nh-c(=o)-r16,当它们被多个取代基取代时,取代基彼此相同或不同;
l5为直键或c1-c4亚烷基;
l6为直键或具有5至14个核原子的亚杂芳基;
r15为c6-c14芳基或具有5至14个核原子的杂芳基;
r16为c6-c14芳基或具有5至14个核原子的杂芳基;
通过键合r5和r6一起形成的非芳香性稠合杂多环被至少一个取代c1-c6烷基或为未取代的,且当它们被多个取代基取代时,取代基彼此相同或不同;
r7的烷基、杂环烷基、芳基、杂芳基、非芳香稠合多环和非芳香稠合杂多环各自独立地为未取代的或被选自下组的至少一个取代基所取代:卤素、硝基、c1-c6烷基、c1-c6烷氧基、c6-c14芳基和具有5至14个核原子的杂芳基,且当它们被多个取代基取代时,取代基彼此相同或不同;
r14的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一个取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,且当它们被多个取代基取代时,取代基彼此相同或不同;
r15和r16的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一个取代基所取代:c1-c6烷基和c1-c6卤代烷基,且当它们被多个取代基取代时,取代基彼此相同或不同。
以下,将详细阐述本发明。
本发明涉及一种具有烟酰胺磷酸核糖转移酶(以下称为‘nampt’)特异性抑制活性的新化合物,其药学上可接受的盐、光学异构体、水合物和溶剂合物,以及包含它们的用于预防或治疗多种nampt相关疾病的药物组合物。
具体地,本发明的一方面提供了一种选自如下化学式1所示化合物的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式1]
化学式1中,
x1和x2各自独立地为n或c(r3);
l1为直键或c2-c4亚烯基;
r1和r2各自独立地为氢、-(ch2)m-r4或-n=c(r5)(r6),r1和r2相互键合形成具有5至7个核原子的杂环烷基环,具有5至14个核原子的杂芳基环或具有5至14个核原子的非芳香稠合杂多环;
r3为氢或c1-c6烷基;
r4为-l2-r7;
l2为直键、c6-c10亚芳基或具有5至14个核原子的亚杂芳基;
r5和r6可以相互键合形成具有5-14个核原子的非芳香稠合杂多环;
r7选自下组:c1-c6烷基、具有5至7个核原子的杂环烷基、c6-c14芳基、具有5至14个核原子的杂芳基、c5-c14非芳香性稠合多环基、具有5-14个核原子的非芳香稠合杂多环基、-c(=o)-r8、-s(=o)(=o)-r9、-(ch2)n-n(r10)(r11)和-(ch2)n-o-(l3)-(r12);
r8选自下组:c1-c6烷基、c1-c6烷氧基、c3-c7环烷氧基、具有5至7个核原子的杂环烷基、具有5至14个核原子的杂芳基和具有5至14个核原子的非芳香性稠合杂多环基;
r9为具有5至7个核原子的杂环烷基;
r10和r11各自独立地为氢、c1-c6烷基或-c(=o)-r13;
l3为直键或c1-c4亚烷基;
r12为c6-c14芳基或具有5至14个核原子的杂芳基;
r13为-(l4)-(r14);
l4为直键或具有5至14个核原子的亚杂芳基;
r14为c6-c14芳基或具有5至14个核原子的杂芳基;
m和n各自独立地为0至4的整数;
通过键合r1和r2一起形成的杂环烷基环、杂芳基环和非芳香性稠合杂多环各自独立地为未取代的或被选自下组的至少一个取代基所取代:-(l5)-(l6)-(r15)和-nh-c(=o)-r16,当它们被多个取代基取代时,取代基彼此相同或不同;
l5为直键或c1-c4亚烷基;
l6为直键或具有5至14个核原子的亚杂芳基;
r15为c6-c14芳基或具有5至14个核原子的杂芳基;
r16为c6-c14芳基或具有5至14个核原子的杂芳基;
通过键合r5和r6一起形成的非芳香稠合杂多环被至少一个取代c1-c6烷基或为未取代的,且当它们被多个取代基取代时,取代基彼此相同或不同;
r7的烷基、杂环烷基、芳基、杂芳基、非芳香性稠合多环和非芳香性稠合杂多环各自独立地为未取代的或被选自下组的至少一个取代基所取代:卤素、硝基、c1-c6烷基、c1-c6烷氧基、c6-c14芳基和具有5至14个核原子的杂芳基,且当它们被多个取代基取代时,取代基彼此相同或不同;
r14的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一个取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基、且当它们被多个取代基取代时,取代基彼此相同或不同;
r15和r16的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一个取代基所取代:c1-c6烷基和c1-c6卤代烷基,且当它们被多个取代基取代时,取代基彼此相同或不同。
本发明的一方面提供了一种选自如下化学式2所示化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式2]
化学式2中,
p为0至3的整数;
l6为直键、羰基(*-c(=o)-*)或磺酰基(*-s(=o)(=o)-*);
r17为具有5至7个核原子的杂环烷基、具有5至14个核原子的杂芳基、-o-(ch2)q-r18或-(ch2)r-n(r19)(r20);
r18为氢、c1-c6烷基、c3-c7环烷基或具有5至14个核原子的杂芳基;
r19和r20各自独立地为氢或c1-c6烷基;
q和r各自独立地为0至2的整数;
r17的杂环烷基和杂芳基和r18的烷基、环烷基和杂芳基各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、硝基、c1-c6烷基、c1-c6烷氧基、c6-c14芳基和具有5至14个核原子的杂芳基;
x1、x2和l1各自如权利要求1中定义。
如本发明的一个优选实施方式,化学式2中,x1可为n和x2可为c(r3)。
如本发明的一个优选实施方式,化学式2中,x1和x2均可为c(r3)。
如本发明的一个优选实施方式,化学式2中,l1可为直键或c2-c3亚烯基,更优选为直键。
如本发明的一个优选实施方式,化学式2中,p可为0至2的整数,更优选为0或1的整数。
如本发明的一个优选实施方式,化学式2中,q可为0或1的整数。
如本发明的一个优选实施方式,化学式2中,r17的杂环烷基和杂芳基可各自独立地为未取代的或被选自下组的至少一个取代基所取代:卤素、硝基、c1-c6烷基、c1-c6烷氧基和c6-c14芳基。
如本发明的一个优选实施方式,化学式2中,r17可为化学式3所示的取代基:
[化学式3]
化学式3中,
*为键合位置;
y1为o或s;
y2为n或c(r21);
z1至z4各自独立地为n或c(r22);
r21为氢或c1-c6烷基;
r22为多个的情况下,它们彼此相同或不同,并且选自下组:氢、卤素、硝基、c1-c6烷基、c1-c6烷氧基、c6-c14芳基和具有5至14个核原子的杂芳基,或r22为多个的情况下,彼此相邻的r22可以通过彼此键合形成稠环。
如本发明的一个优选实施方式,化学式3中,y1可为o和y2可为n或c(r21),更优选y1可为o和y2可为n。
如本发明的一个优选实施方式,化学式3中,y1可为s和y2可为n。
如本发明的一个优选实施方式,化学式3中,z1至z4可都为c(r22),以及多个r22可彼此相同或不同。
如本发明的一个优选实施方式,化学式3中,z1至z4中的至少一个为n且其它为c(r22),且多个r22可彼此相同或不同。
如本发明的一个优选实施方式,化学式3中,z1至z4中的任何一个为n且其它为c(r22),且多个r22可彼此相同或不同。
如本发明的一个优选实施方式,化学式3中,z1至z4中的至少一个为c(r22),且多个r22可彼此相同或不同。
如本发明的一个优选实施方式,化学式3可如下化学式a1至a8中任一种所示,但不限于此:
化学式a1至a8中,
*为键合位置;
o为0至2的整数;
r23可选自下组:卤素、硝基、c1-c6烷基、c1-c6烷氧基、c6-c14芳基和具有5至14个核原子的杂芳基,在r23为多个的情况下,它们可以彼此相同或不同。
如本发明的一个优选实施方式,化学式a1至a8中,o可为0或1的整数。
如本发明的一个优选实施方式中,化学式2中,r17可为化学式4所示的取代基:
[化学式4]
化学式4中,
*为键合位置;
y3为o或s;
r24可为氢、c1-c6烷基或c6-c14芳基。
如本发明的一个优选实施方式,化学式4中,y3可为s。
如本发明的一个优选实施方式,化学式4中,r24可为氢或c1-c6烷基。
如本发明的一个优选实施方式,化学式2中,r17可为-(ch2)r-n(r19)(r20),其中,r可为0至2的整数,r19和r20可各自独立地为氢或c1-c6烷基。
如本发明的一个优选实施方式,化学式2中,r17可为-(ch2)r-n(r19)(r20),其中,r可为0或1,r19和r20可各自独立地为c1-c6烷基。
如本发明的一个优选实施方式,化学式2中,r17可为具有5至7个核原子的杂环烷基,更优选为哌啶基、哌嗪基、吗啉基或硫代吗啉基。
如本发明的一个优选实施方式,化学式2中,r17可为具有5至6个核原子的杂芳基,r17的杂芳基可为未取代的或被至少一个c1-c6烷基取代,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式2中,r17可为吡咯基、咪唑基或三唑基,且r17的吡咯基、咪唑基或三唑基可各自独立地为未取代的或被至少一个c1-c6烷基取代,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式2中,r17可为-o-(ch2)q-r18。
如本发明的一个优选实施方式,化学式2中,r17可为-o-(ch2)q-r18,q可为0至2的整数,和r18可为具有5至14个核原子的杂芳基。
如本发明的一个优选实施方式,化学式2中,r17可为-o-(ch2)q-r18,q可为1或2的整数,和r18可为吡啶基、嘧啶基或三嗪基。
如本发明的一个优选实施方式,化学式2中,l6可为氧基,r17可为-o-(ch2)q-r18或具有5至14个核原子的杂芳基,更优选的l6可为氧基,r17可为c1-c6烷氧基、c3-c6环烷氧基或具有5至10个核原子的杂芳基。
如本发明的一个优选实施方式,化学式2中,l6可为磺酰基,r17可为具有5至7个核原子的杂环烷基,更优选l6可为磺酰基,以及r17可为哌啶基、哌嗪基、吗啉基或硫代吗啉基。
如本发明的一个优选实施方式中,所述化合物可选自如下化学式5所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式5]
化学式5中,
x1、x2、r3、p、l6和r17各自如化学式2中定义。
如本发明的一个优选实施方式,化学式5中,x1和x2各自独立地为n或c(r3),
r3为氢或c1-c6烷基;
p、l6和r17各自如化学式2中定义。
如本发明的一个实施方式,化学式1中,r1和r2彼此键合形成具有5至7个核原子的杂环烷基环或具有5-14个核原子的非芳香稠合杂多环,以及通过r1和r2键合一起形成的杂环烷基环和非芳香稠合杂多环各自独立地为未取代的或被-(l5)-(l6)-(r15)或-nh-c(=o)-r16取代,且l5、l6、r15和r16各自如化学式1中定义。
如本发明的一个优选实施方式,所述化合物可选自如下化学式6所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式6]
化学式6中,
x1、x2、l5、l6和r15各自如化学式1中定义。
如本发明的一个优选实施方式中,化学式6中,x1和x2中的一个可为n以及另一个可为c(r3),更优选为,x1可为n,和x2可为c(r3)。
如本发明的一个优选实施方式,化学式6中,l5可为c1-c4亚烷基,更优选为c1-c3亚烷基。
如本发明的一个优选实施方式,化学式6中,l6可为具有5至14个核原子的亚亚杂芳基,更优选为具有5至10个核原子的亚杂芳基。
如本发明的一个优选实施方式,在化学式中,l6可为噻唑基、恶唑基或噻吩基,更优选为噻唑基,但不限于此。
如本发明的一个优选实施方式,化学式6中,r15可为具有5至14个核原子的杂芳基,更优选为具有5至10个核原子的杂芳基。
如本发明的一个优选实施方式,化学式6中,r15可为噻吩基、呋喃基或吡咯基,更优选为呋喃基,但不限于此。
如本发明的一个优选实施方式,所述化合物可选自如下化学式7所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式7]
化学式7中,
x1、x2、l5、l6和r15各自如化学式1中定义。
如本发明的一个优选实施方式,化学式7中,x1和x2中的一个可为n以及另一个可为c(r3),更优选为,x1可为n和x2可为c(r3)。
如本发明的一个优选实施方式,化学式7中,l5和l6中至少一个可为直键,更优选地,l5和l6都为直键。
如本发明的一个优选实施方式,化学式7中,r15可为具有5至14个核原子的杂芳基,r15的杂芳基可为未取代的或被选自下组的至少一种取代基所取代:c1-c6烷基和c1-c6卤代烷基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式7中,r15可为吲哚嗪基、吡唑并嘧啶基、吡咯并嘧啶基或吡唑并吡啶基,更优选为可为吡咯并嘧啶基,但不限于此。
如本发明的一个优选实施方式,所述化合物可选自如下化学式8所示的化合物,其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式8]
化学式8中,
x1、x2和r16各自如化学式1中定义。
如本发明的一个优选实施方式,化学式8中,x1和x2中的一个可为n以及另一个可为c(r3),更优选为,x1可为n和x2可为c(r3)。
如本发明的一个优选实施方式,化学式8中,r16可为c6-c14芳基或具有5至14个核原子的杂芳基,更优选为苯基、吡啶基、嘧啶基或三嗪基,但不限于此。
如本发明的一个优选实施方式,化学式8中,r16可为具有5至14个核原子的杂芳基,更优选为吡啶基、嘧啶基或三嗪基,但不限于此。
如本发明的一个实施方式,化学式1中,r1可为氢,r2可为-(ch2)m-r4。
如本发明的一个优选实施方式,化学式1中,r1可为氢,r2可为-(ch2)m-r4;
m为0至4的整数,更优选为0至3的整数;
r4为-l2-r7;
l2为直键;
r7可为c5-c14非芳香稠合多环或具有5至14个核原子的非芳香稠合杂多环基。
如本发明的一个优选实施方式,化学式1中,r2可为吲哚啉基、异吲哚啉基、四氢喹啉基或四氢异喹啉基,更优选为吲哚啉基,但不限于此。
如本发明的一个优选实施方式,所述化合物可选自如下化学式9所示的化合物,其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式9]
化学式9中,
s和t各自独立地为0至4的整数;
x1和x2各自如化学式1中定义。
如本发明的一个优选实施方式,化学式9中,x1和x2中的一个可为n,以及另一个可为c(r3),更优选为,x1可为n和x2可为c(r3)。
如本发明的一个实施方式,化学式1中,r1可为氢以及r2可为-n=c(r5)(r6)。
如本发明的一个优选实施方式,化学式1中,r1可为氢和r2可为-n=c(r5)(r6);
r5和r6彼此键合形成具有5至10个核原子的非芳香稠合杂多环;以及r5和r6彼此键合一起形成的非芳香稠合杂多环为未取代的或被至少一个c1-c6烷基取代,且当它具有多个取代基时,取代基彼此相同或不同。
如本发明的一个优选实施方式,所述化合物可选自如下化学式10所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式10]
化学式10中,
y4为n(r27)、o或s;
r25和r27各自独立地为氢、c1-c6烷基或c6-c14芳基;
u为0至2的整数;
r26为c1-c6烷基或c6-c14芳基,当r26是多个时,它们可彼此相同或不同;
x1和x2各自如权利要求1中定义。
如本发明的一个优选实施方式,化学式10中,y4可为o或s,更优选为s。
如本发明的一个优选实施方式,化学式10中,r25可为氢或c1-c6烷基。
如本发明的一个实施方式,所述化合物可选自如下化学式11所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式11]
化学式11中,
v为0至4的整数;
l7为直键或具有5至14个核原子的亚杂芳基;
r28为c6-c14芳基或具有5至14个核原子的杂芳基;
r28的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当它们被多个取代基取代时,取代基彼此相同或不同;
x1、x2和l1各自如权利要求1中定义。
如本发明的一个优选实施方式,化学式11中,x1和x2中的一个可为n以及另一个可为c(r3),更优选为,x1可为n和x2可为c(r3)。
如本发明的一个优选实施方式,化学式11中,l1可为直键。
如本发明的一个优选实施方式,化学式11中,v可为0至3的整数,更优选为1或2的整数。
如本发明的一个优选实施方式,化学式11中,l7可为直键或选自下组:呋喃基、异恶唑基、恶唑基和恶二唑基,更优选为恶二唑基。
如本发明的优选实施方式,所述化合物可选自如下化学式12所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式12]
化学式12中,
v、l7和r28各自如化学式11中定义。
如本发明的一个优选实施方式,化学式12中,v可为0至3的整数,更优选为1或2的整数。
如本发明的一个优选实施方式,化学式12中,r28可选自下组:苯基、吡啶基、嘧啶基、三嗪基、萘基、吡咯基、呋喃基、噻吩基、喹啉基、异喹啉基、噌啉基、喹唑啉基、邻苯二甲酰基、茚基、苯并咪唑基、苯并恶唑基、苯并噻唑基、吲哚基、苯并呋喃基以及苯并噻吩基,
r28的苯基、吡啶基、嘧啶基、三嗪基、萘基、吡咯基、呋喃基、噻吩基、喹啉基、异喹啉基、噌啉基、喹唑啉基、邻苯二甲酰基、茚基、苯并咪唑基、苯并恶唑基、苯并噻唑基、吲哚基、苯并呋喃基和苯并噻吩基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式12中,l7为直键,r28为具有5至14个核原子的杂芳基,r28的杂芳基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式12中,l7为直键,r28可选自下组:萘基、喹啉基、异喹啉基、噌啉基、喹唑啉基、邻苯二甲酰基、茚基、苯并咪唑基、苯并恶唑基、苯并噻唑基、吲哚基、苯并呋喃基和苯并噻吩基,r28的萘基、喹啉基、异喹啉基、噌啉基、喹唑啉基、邻苯二甲酰基、茚基、苯并咪唑基、苯并恶唑基、苯并噻唑基、吲哚基、苯并呋喃基和苯并噻吩基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式12中,l7为直键,r28可选自下组:喹啉基、异喹啉基、噌啉基、喹唑啉基、邻苯二甲酰基、苯并咪唑基、苯并恶唑基和苯并噻唑基,以及r28的喹啉基、异喹啉基、噌啉基、喹唑啉基、邻苯二甲酰基、苯并咪唑基、苯并恶唑基和苯并噻唑基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式12中,l7为具有5至14个核原子的亚亚杂芳基,r28为c6-c14芳基或具有5至14个核原子的杂芳基,r28的芳基和杂芳基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式12中,l7选自下组:呋喃基、异恶唑基、恶唑基和恶二唑基,r28为c6-c14芳基或具有5至14个核原子的杂芳基,r28的芳基和杂芳基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式12中,l7选自下组:呋喃基、异恶唑基、恶唑基和恶二唑基,r28选自下组:苯基、萘基、吡咯基、呋喃基、噻吩基、喹啉基和异喹啉基,以及r28的苯基、萘基、吡咯基、呋喃基、噻吩基、喹啉基和异喹啉基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,所述化合物可选自如下化学式13所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式13]
化学式13中,
v和r28可如化学式11中定义。
如本发明的一个优选实施方式,化学式13中,v可为0至3的整数,更优选为1或2的整数。
如本发明的一个优选实施方式,化学式13中,r28为c6-c10芳基或具有5至10个核原子的杂芳基,r28的芳基和杂芳基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,化学式13中,r28可选自下组:苯基、萘基、吡咯基、呋喃基、噻吩基、喹啉基和异喹啉基,且r28的苯基、萘基、吡咯基、呋喃基、噻吩基、喹啉基和异喹啉基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:卤素、c1-c6烷基和c1-c6烷氧基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个实施方式,所述化合物可选自如下化学式14所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式14]
化学式14中,
r29为c1-c6烷基;
x1和x2各自如化学式1中定义。
如本发明的一个优选实施方式,化学式14中,x1和x2中的一个可为n以及另一个可为c(r3),更优选为,x2可为n和x1可为c(r3)。
如本发明的一个优选实施方式,化学式14中,x1和x2均为c(r3),且同时,r3可为氢或c1-c6烷基。
如本发明的一个实施方式,所述化合物可选自如下化学式15所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式15]
化学式15中,
l8为具有5至14个核原子的亚亚杂芳基;
r30为c6-c14芳基或具有5至14个核原子的杂芳基;
r30的芳基和杂芳基各自独立地为未取代的或被选自下组的至少一种取代基所取代:c1-c6烷基,当它被多个取代基取代时,取代基彼此相同或不同;
x1、x2和l1各自如权利要求1中定义。
如本发明的一个优选实施方式,化学式15中,x1和x2中的一个可为n以及另一个可为c(r3),更优选为,x1可为n和x2可为c(r3)。
如本发明的一个优选实施方式,化学式15中,l1可为直键。
如本发明的一个优选实施方式,化学式15可为如下化学式16所示的连接:
[化学式16]
化学式16中,
*为键合位置;
y5为o或s;
z5为n或c(r31);
r31为氢或c1-c6烷基。
如本发明的一个优选实施方式,化学式15中,r30可选自下组:苯基、吡啶基、嘧啶基、三嗪基、萘基、喹啉基、异喹啉基、噌啉基、喹唑啉基和邻苯二甲酰基,
r30的苯基、吡啶基、嘧啶基、三嗪基、萘基、喹啉基、异喹啉基、噌啉基、喹唑啉基和邻苯二甲酰基可各自独立地为未取代的或被选自下组的至少一种取代基所取代:c1-c6烷基,当被多个取代基取代时,取代基彼此相同或不同。
如本发明的一个优选实施方式,所述化合物可选自如下化学式17所示的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物:
[化学式17]
化学式17中,
y5为o或s;
z5为n或c(r32);
w为0至3的整数;
r31为c1-c6烷基,当r31是多个时,它们彼此相同或不同;
r32为氢或c1-c6烷基。
本发明的一个实施方式可为如下化学式18所示的4-(2-(咪唑并[1,2-a]吡啶-6-甲酰胺基)乙基)苯甲酸甲酯:
[化学式18]
本发明化合物的优选实施例包括,但不限于:
1)n-(4-(苯并[d]恶唑-2-基)苄基)烟酰胺;
2)n-(4-(6-甲基苯并[d]恶唑-2-基)苄基)烟酰胺;
3)n-(4-(6-甲基苯并[d]恶唑-2-基)苄基)苯甲酰胺;
4)n-(4-(5-甲基苯并[d]恶唑-2-基)苄基)烟酰胺;
5)n-(4-(5-乙基苯并[d]恶唑-2-基)苄基)烟酰胺;
6)n-(4-(6-乙基苯并[d]恶唑-2-基)苄基)烟酰胺;
7)n-(4-(5-异丙基苯并[d]恶唑-2-基)苄基)烟酰胺;
8)n-(4-(6-(叔丁基)苯并[d]恶唑-2-基)苄基)烟酰胺;
9)n-(4-(5-甲氧基苯并[d]恶唑-2-基)苄基)烟酰胺;
10)n-(4-(6-氯苯并[d]恶唑-2-基)苄基)烟酰胺;
11)n-(4-(6-硝基苯并[d]恶唑-2-基)苄基)烟酰胺;
12)n-(4-(5-苯基苯并[d]恶唑-2-基)苄基)烟酰胺;
13)n-(4-(萘并[2,3-d]恶唑-2-基)苄基)烟酰胺;
14)n-(4-(恶唑并[5,4-b]吡啶-2-基)苄基)烟酰胺;
15)n-(4-(恶唑并[4,5-c]吡啶-2-基)苄基)烟酰胺;
16)n-(4-(恶唑并[4,5-b]吡啶-2-基)苄基)烟酰胺;
17)n-(4-(苯并[d]噻唑-2-基)苄基)烟酰胺;
18)n-(4-(5-异丙基苯并[d]恶唑-2-基)苯基)烟酰胺;
19)4-(烟酰胺基)苯甲酸甲酯;
20)4-(烟酰胺基)苯甲酸异丙酯;
20)4-(烟酰胺基)苯甲酸环己酯;
21)n-(4-(苯并呋喃-2-羰基)苯基)烟酰胺;
22)n-(4-(哌啶-1-基磺酰基)苄基)烟酰胺;
23)n-(4-(吗啉基磺酰基)苄基)烟酰胺;
24)n-(4-([1,2,4]三唑[3,4-b][1,3,4]噻二唑-6-基)苯基)烟酰胺;
25)n-(4-(3-甲基-[1,2,4]三唑[3,4-b][1,3,4]噻二唑-6-基)苯基)烟酰胺;
26)n-(4-(3-乙基-[1,2,4]三唑[3,4-b][1,3,4]噻二唑-6-基)苯基)烟酰胺;
27)n-(4-([1,2,4]三唑[3,4-b][1,3,4]噻二唑-6-基)苄基)烟酰胺;
28)n-(4-(3-甲基-[1,2,4]三唑[3,4-b][1,3,4]噻二唑-6-基)苄基)烟酰胺;
29)n-(4-(3-乙基-[1,2,4]三唑[3,4-b][1,3,4]噻二唑-6-基)苄基)烟酰胺;
30)n-(4-((二乙基氨基)甲基)苄基)烟酰胺;
31)n-(4-(哌啶-1-基)苄基)烟酰胺;
32)n-(4-(2-甲基-1h-咪唑-1-基)苄基)烟酰胺;
33)n-(4-(吡啶-2-基甲氧基)苄基)烟酰胺;
34)n-乙基-n-(4-(烟酰胺基甲基)苄基)乙铵;
35)(e)-n-(3-(吲哚-1-基)丙基)-3-(吡啶-3-基)丙烯酰胺;
36)(2e,n'z)-n'-(3-甲基苯并[d]噻唑-2(3h)-亚基)-3-(吡啶-3-基)丙烯酰肼;
37)(e)-1-(4-((2-(呋喃-2-基)噻唑-4-基)甲基)哌嗪-1-基)-3-(吡啶-3-基)丙基-2-烯-1-酮;
38)(e)-n-(2-(3-(吡啶-3-基)丙烯酰基)-1,2,3,4-四氢异喹啉-7-基)异烟酰胺;
39)(s,e)-1-(3-(5-异丙基-7-(三氟甲基)吡唑[1,5-a]嘧啶-2-基)吡咯烷-1-基)-3-(吡啶-3-基)丙基-2-烯-1-酮;
40)n-(2-(烟酰胺基)乙基)-3-(p-甲苯基)-1,2,4-恶二唑-5-甲酰胺;
41)3-(4-氯苯基)-n-(2-(烟酰胺基)乙基)-1,2,4-恶二唑-5-甲酰胺;
42)n-(2-(烟酰胺基)乙基)-3-(噻吩-2-基)-1,2,4-恶二唑-5-甲酰胺;
43)3-(4-甲氧基苯基)-n-(2-(烟酰胺基)乙基)-1,2,4-恶二唑-5-甲酰胺;
44)n-(2-(烟酰胺基)乙基)喹啉-7-甲酰胺;
45)n-(2-(烟酰胺基)乙基)异喹啉-3-甲酰胺;
46)n-(2-(烟酰胺基)乙基)喹啉-3-甲酰胺;
47)n-甲基异烟酰胺;
48)n,4-二甲基苯甲酰胺;
49)n-(2-(3,4-二甲基苯基)苯并[d]恶唑-5-基)烟酰胺;
50)4-(2-(咪唑并[1,2-a]吡啶-6-甲酰胺基)乙基)苯甲酸甲酯;
51)n-(2-(烟酰胺基)乙基)喹啉-2-甲酰胺;和
52)n-(2-(烟酰胺基)乙基)苯并[d]噻唑-2-甲酰胺。
在本发明中,化学式1和化学式18所示的化合物可以通过以下反应式1制备,但不限于此:
[反应式1]
反应式1中,x1、x2、l1、r1和r2各自如化学式1中定义。
如一个具体实施例,在edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐),hobt(1-羟基苯并三氮唑一水物)和dipea(n,n-二异丙基乙胺)存在下,化学式1所示的化合物通过将化学式19所示的酸和化学式20所示的胺溶解在例如dmf(二甲基甲酰胺)的溶剂中,并回流12至36小时。
在本发明中,化学式2所示化合物也可以通过如下反应式2制备,但不限于此:
[反应式2]
反应式2中,x1、x2、l1、l6、p和r17各自如化学式2中定义。
如一个具体实施例,在edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐),hobt(1-羟基苯并三氮唑一水物)和dipea(n,n-二异丙基乙胺)存在下,化学式2所示化合物通过将化学式21所示的酸和化学式22所示的胺溶解在例如dmf(二甲基甲酰胺)的溶剂中,并回流12至36小时。
在本发明中,化学式1或化学式18所示的化合物可通过有效抑制烟酰胺磷酸核糖转移酶(nampt)活性来预防、改善或治疗nampt相关疾病。
在本发明中,nampt相关疾病为下组中的至少一种:癌症、病毒感染、人类免疫缺陷病毒、肝炎病毒、疱疹病毒、单纯疱疹、炎症性疾病、肠易激综合征、炎症性肠病、类风湿性关节炎、哮喘、慢性阻塞性肺病、骨关节炎、骨质疏松症、皮炎、特应性皮炎、银屑病、系统性红斑狼疮、多发性硬化、银屑病关节炎、强直性脊柱炎、移植物抗宿主病、阿尔茨海默病、脑血管意外、动脉粥样硬化、糖尿病、肾小球肾炎和代谢综合征,优选为癌症。
在本发明中,所述癌症为下组中的至少一种:肝癌、胆管癌、胆囊癌、食道癌、胃癌、卵巢癌、乳腺癌、子宫癌、结肠癌、直肠癌、宫颈癌、前列腺癌、皮肤癌、胰腺癌、白血病、淋巴瘤、霍奇金病、肺癌、支气管癌、多发性骨髓瘤、淋巴瘤、鳞状细胞癌、肾癌、尿道癌、膀胱癌、头颈癌、脑癌和中枢神经系统癌症,优选为肺癌或胃癌。
本发明还提供了化学式1或化学式18所示的化合物药学上可接受的盐。药学上可接受的盐应对人体具有低毒性,并且不应对母体化合物的生物活性和物理化学性质产生不利影响。药学上可接受的盐包括化学式1的碱性化合物的药学上可接受的游离酸和酸加成盐,但不限于此。
本发明的化合物的优选盐包括与无机或有机酸加成的盐。无机酸可以是盐酸、硫酸、硝酸、磷酸、高氯酸、溴酸等。此外,有机酸可以是乙酸、甲磺酸、乙磺酸、对甲苯磺酸、富马酸、马来酸酸、丙二酸、邻苯二甲酸、琥珀酸、乳酸、柠檬酸、柠檬酸、葡萄糖酸、酒石酸、水杨酸、苹果酸、草酸、苯甲酸、帕莫酸、天冬氨酸、谷氨酸等。有机碱可用于制备有机碱加成盐,包括三(羟基甲基)甲胺,二环己胺等。可用于生产氨基酸加成盐的氨基酸是天然氨基酸,例如丙氨酸和甘氨酸等。对于本领域技术人员显而易见的是可以使用除了示例性无机酸、有机酸、有机碱和氨基酸之外的其他酸或碱。
盐可以通过常规方法制备。例如,盐可以通过将化学式1或化学式18的化合物溶解在可以与水混合的溶剂中制备,例如甲醇、乙醇、丙酮或1,4-二恶烷,然后加入游离酸或游离碱,然后结晶。
同时,本发明的化合物可具有不对称的碳中心,因此可以是r或s异构体或外消旋化合物,并且所有这些光学异构体和混合物可包括在本发明的范围内。
此外,化学式1化合物的水合物或溶剂合物形式可包括在本发明的范围内。
本发明提供药物组合物,其含有作为活性成分的选自化学式1或化学式18所示化合物的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物的化合物。
在本发明的药物组合物中,化学式1或化学式18表示的化合物可通过有效抑制烟酰胺磷酸核糖转移酶(nampt)的活性来预防、改善或治疗nampt相关疾病。
在本发明中,nampt相关疾病为下组中的至少一种:癌症、病毒感染、人类免疫缺陷病毒、肝炎病毒、疱疹病毒、单纯疱疹、炎症性疾病、肠易激综合征、炎症性肠病、类风湿性关节炎、哮喘、慢性阻塞性肺病、骨关节炎、骨质疏松症、皮炎、特应性皮炎、银屑病、系统性红斑狼疮、多发性硬化、银屑病关节炎、强直性脊柱炎、移植物抗宿主病、阿尔茨海默病、脑血管意外、动脉粥样硬化、糖尿病、肾小球肾炎和代谢综合征,优选为癌症。
在本发明中,所述癌症为下组中的至少一种:肝癌,胆管癌,胆囊癌,食道癌,胃癌,卵巢癌,乳腺癌,子宫癌,结肠癌,直肠癌,宫颈癌,前列腺癌,皮肤癌,胰腺癌,白血病,淋巴瘤,霍奇金病,肺癌,支气管癌,多发性骨髓瘤,淋巴瘤,鳞状细胞癌,肾癌,尿道癌,膀胱癌,头颈癌,脑癌和中枢神经系统癌症,优选为肺癌或胃癌。
本发明的药物组合物可以通过进一步包含如下化学式23所示化合物提供对nampt抑制的协同作用:
[化学式23]
化学式23中,
y6为氢或卤素;
y7为氢或羟基(-oh)。
如本发明的一个优选实施方式,化学式23中,y6可为氢以及y7可为羟基。
如本发明的一个优选实施方式,化学式23中,y6可为卤素以及y7可为氢。
如本发明的一个优选实施方式,本发明的药物组合物可包含化学式1和化学式23所示的化合物。
如本发明的一个优选实施方式,本发明的药物组合物可包含化学式14和化学式23所示的化合物。
如本发明的一个优选实施方式,本发明的药物组合物包含化学式14所示的化合物且还包含化学式23所示的化合物。化学式14中,x2可为n,x1可为c(h),r29可为c1-c3烷基,以及化学式23中,y6可为氢和y7可为羟基。
如本发明的一个优选实施方式,本发明的药物组合物包含化学式14所示的化合物且还包含化学式23所示的化合物。化学式14中,x2可为n,x1可为c(h),r29可为c1-c3烷基,以及化学式23中,y6可为卤素和y7可为氢。
如本发明的一个优选实施方式,本发明的药物组合物包含化学式14所示的化合物且还包含化学式23所示的化合物。化学式14中,x2可为c(r3),x1可为c(h),r3和r29可各自独立地为c1-c3烷基,以及化学式23中,y6可为氢和y7可为羟基。
如本发明的一个优选实施方式,本发明的药物组合物包含选自下组的至少一种化合物:n-甲基异烟酰胺、n,4-二甲基苯甲酰胺、4-氯-2-(亚氨乙基)苯酚和4-(亚氨乙基)苯-1,3-二醇。
如本发明的一个优选实施方式,本发明的药物组合物包含化学式14所示的化合物且包含选自以下的至少一种:4-氯-2-(亚氨乙基)苯酚和4-(亚氨乙基)苯-1,3-二醇。
如本发明的一个优选实施方式,本发明的药物组合物包含选自以下的至少一种:n-甲基异烟酰胺和n,4-二甲基苯甲酰胺,且还包含选自以下的至少一种:4-氯-2-(亚氨乙基)苯酚和4-(亚氨乙基)苯-1,3-二醇。
如本发明的一个优选实施方式,本发明的药物组合物包含n-甲基异烟酰胺,且还包含选自以下的至少一种:4-氯-2-(亚氨乙基)苯酚和4-(亚氨乙基)苯-1,3-二醇。
如本发明的一个优选实施方式,本发明的药物组合物包含n,4-二甲基苯甲酰胺,且还可包含选自以下的至少一种:4-氯-2-(亚氨乙基)苯酚和4-(亚氨乙基)苯-1,3-二醇,更优选为4-(亚氨乙基)苯-1,3-二醇。
如本发明的一个优选实施方式,本发明的药物组合物可包含化学式14所示的化合物和化学式23所示的化合物,重量比为1:100至100:1,更优选,重量比为40:60至60:40。在本发明中,当包含的两个化合物超出了该重量比,则nampt抑制活性显著降低。
在本发明中,“治疗”和“改善”可包括,但不限于,使用药物组合物来改善或有益于nampt相关疾病的任何行为。
在本发明中,“预防”可包括但不限于使用药物组合物阻断症状或抑制或延迟nampt相关疾病症状的任何行为。
本发明的药物组合物可以与其他抗癌药物联合给药,从而进一步增强放射疗法对癌症干细胞的作用。
本文中,抗癌剂包括下组中的至少一种:氮芥、伊马替尼、奥沙利铂、利妥昔单抗、埃罗替尼、来那替尼、拉帕替尼、吉非替尼、凡德他尼、尼洛替尼、司马沙尼、波舒替尼、阿西替尼、西地尼布、来妥替尼、曲妥单抗、吉非替尼、硼替佐米、舒尼替尼、卡铂、索拉非尼、贝伐单抗、顺铂、西妥昔单抗、白槲寄生(viscumalbum)、天冬酰胺酶、维甲酸、羟基脲、达沙替尼、雌莫司汀、吉妥珠单抗奥佐米星、替伊莫单抗、七铂(heptaplatin)、甲基氨基乙酰丙酸、安吖啶、阿来组单抗、丙卡巴肼、前列地尔、硝酸钬壳聚糖、吉西他滨、去氧氟尿苷、培美曲塞、替加氟、卡培他滨、吉美拉西、奥替拉西、阿扎胞苷、氨甲喋呤、尿嘧啶、阿糖胞苷、氟尿嘧啶、氟达拉滨、依诺他滨、氟他胺、地西他滨、巯嘌呤、硫鸟嘌呤、克拉屈滨、卡莫氟、雷替曲塞、多西他赛、紫杉醇、伊立替康、贝洛替康、拓扑替康、长春瑞滨、依托泊苷、长春新碱、长春花碱、替尼泊苷、多柔比星、伊达比星、表阿霉素、米托蒽醌、丝裂霉素、博来霉素、柔红霉素、更生霉素、吡柔比星、阿柔比星、培洛霉素、替莫唑胺、白消安、异环磷酰胺、环磷酰胺、美法仑、六甲蜜胺、达卡巴嗪、塞替派、尼莫司汀、苯丁酸氮芥、二溴卫矛醇、亚叶酸、维甲酸、依西美坦、氨鲁米特、阿那格雷、奥拉帕尼、诺维本、法倔唑、他莫昔芬、托瑞米芬、睾内酯、阿那曲唑、来曲唑、伏氯唑、比卡鲁胺、洛莫司汀、伏立诺他、恩替司他和卡莫司汀,但不限于此。
根据本发明,药物组合物可以是胶囊、片剂、颗粒、注射剂、软膏、粉末或饮料的形式,并且药物组合物可以靶向作用于人。
本发明的药物组合物可以以,但不限于,口服制剂(例如粉末、颗粒、胶囊、片剂、水悬浮液等)、外用制剂、栓剂和灭菌注射液的形式用作制剂。本发明的药物组合物可包含药学上可接受的载体。药学上可接受的载体可以是用于口服给药的粘合剂、润滑剂、崩解剂、赋形剂、增溶剂、分散剂、稳定剂、悬浮剂、颜料、香料等,以及可以将缓冲剂、防腐剂、止痛剂、增溶剂、等渗剂、稳定剂等混合并用于注射,并且可以使用碱、赋形剂、润滑剂、防腐剂等进行局部给药。本发明药物组合物的制剂可以通过与如上所述的药学上可接受的载体混合以多种方式制备。例如,在口服给药的情况下,它可以以片剂、锭剂、胶囊、酏剂、悬浮液、糖浆、糯米晶片(wafers)等形式制备。可以以单位剂量安瓿或多剂量的形式制备注射剂。它可以配制成其他溶液、悬浮液、片剂、胶囊、缓释制剂等。
同时,适用于制剂的载体、赋形剂和稀释剂的示例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁或矿物油等。此外,它还可包括填料、抗凝剂、润滑剂、润湿剂、香料、乳化剂、防腐剂等。
根据本发明的药物组合物的给药途径可以是(但不限于)口服、静脉内、肌肉内、动脉内、髓内、硬膜内、心内、透皮、皮下、腹膜内、鼻内、肠、局部、舌下或直肠。口服或肠胃外给药是优选的。
在本发明中,“肠胃外”包括皮下、皮内、静脉内、肌肉内、关节内、滑膜内、胸骨内、硬膜内、病灶内和颅内注射或输注技术。本发明的药物组合物也可以栓剂的形式给药,用于直肠给药。
本发明的药物组合物可根据多种因素改变,包括所用特定化合物的活性、年龄、体重、一般健康状况、性别、饮食、给药时间、给药途径、排泄速率、药物制剂和要预防或治疗的特定疾病的严重程度,以及药物组合物的剂量根据患者的状况、体重、疾病程度、药物种类、给药途径和时间周期而变化。但可以由本领域技术人员适当选择,优选每天0.0001至50mg/kg或0.001至50mg/kg。给药可以每天进行一次或分成几次。剂量不以任何方式限制本发明的范围。根据本发明的药物组合物可以配制成丸剂、糖衣片剂、胶囊剂、溶液剂、凝胶剂、糖浆剂、浆液剂、悬浮剂。
本发明的药物组合物可以单独使用或与使用手术、放射疗法、激素疗法、化学疗法和生物反应调节剂的方法组合使用。
本发明提供食品组合物,其包含选自化学式1或化学式18所示的化合物的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物作为活性成分。
根据本发明的食品组合物,由化学式1或化学式18表示的化合物可通过有效抑制烟酰胺磷酸核糖转移酶(nampt)的活性来预防或改善nampt相关疾病。
在本发明中,nampt相关疾病为下组中的至少一种:癌症、病毒感染、人类免疫缺陷病毒、肝炎病毒、疱疹病毒、单纯疱疹、炎症性疾病、肠易激综合征、炎症性肠病、类风湿性关节炎、哮喘、慢性阻塞性肺病、骨关节炎、骨质疏松症、皮炎、特应性皮炎、银屑病、系统性红斑狼疮、多发性硬化、银屑病关节炎、强直性脊柱炎、移植物抗宿主病、阿尔茨海默病、脑血管意外、动脉粥样硬化、糖尿病、肾小球肾炎和代谢综合征,优选为癌症。
在本发明中,所述癌症为下组中的至少一种:肝癌、胆管癌、胆囊癌、食道癌、胃癌、卵巢癌、乳腺癌、子宫癌、结肠癌、直肠癌、宫颈癌、前列腺癌、皮肤癌、胰腺癌、白血病、淋巴瘤、霍奇金病、肺癌、支气管癌、多发性骨髓瘤、淋巴瘤、鳞状细胞癌、肾癌、尿道癌、膀胱癌、头颈癌、脑癌和中枢神经系统癌症,优选为肺癌或胃癌。
通过进一步包含化学式23所示的化合物,本发明的食品组合物可以对nampt抑制提供协同效应。
然而,关于由化学式23表示的化合物的描述与药物组合物的描述相同,并且下面将省略其细节。
本发明的食品组合物可以以各种食品的形式制造,例如饮料、口香糖、茶、维生素复合物、粉末、颗粒、片剂、胶囊、点心、米饼、面包等。由于本发明的食品组合物由几乎没有毒性和副作用的植物提取物组成,因此它可以安全地用于预防目的的长期使用。
当本发明的化合物包含在食品组合物中时,其量可以为加入总重量的0.1至50%。
这里,当食品组合物以饮料形式制备时,除了以指定的比例包含食品组合物之外没有特别限制,并且可以包含各种调味剂或天然碳水化合物作为附加成分,例如一般饮料。即,作为天然碳水化合物,可包括葡萄糖等单糖、果糖等二糖类,蔗糖等多糖类,糊精和环糊精等典型糖类,木糖醇、山梨糖醇和赤藓糖醇等糖醇类。调味剂的示例包括天然调味剂(奇异果甜蛋白和甜菊提取物(例如莱鲍迪甙a和甘草甜素等)和合成调味剂(例如糖精和阿斯巴甜等)等。
此外,本发明的食物组合物可含有各种营养素、维生素、矿物质(电解质)、如合成调味剂和天然调味剂的调味剂、着色剂、果胶酸及其盐、海藻酸及其盐、有机酸、保护胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、醇、碳酸饮料中使用的碳酸化剂等。
这些成分可以单独使用或组合使用。这些添加剂的比例不是那么关键,但通常选择在每100重量份本发明组合物中0.1至约50重量份的范围内。
本发明提供化妆品组合物,其含有选自化学式1或化学式18所示化合物的化合物,其药学上可接受的盐、光学异构体、水合物和溶剂合物作为有效成分。
在本发明的化妆品组合物中,化学式1或化学式18表示的化合物可通过有效抑制烟酰胺磷酸核糖转移酶(nampt)的活性来预防或改善nampt相关疾病。
在本发明中,nampt相关疾病可能是皮炎、特应性皮炎或银屑病。
通过进一步包含化学式23所示的化合物,本发明的化妆品组合物可以对nampt抑制提供协同效应。
然而,关于由化学式23表示的化合物的描述与药物组合物的描述相同,并且下面将省略其细节。
本发明的化妆品组合物可以以调色剂、营养乳液、营养精华、按摩霜、化妆品沐浴添加剂、润体露、润肤乳、沐浴油、婴儿油、婴儿爽身粉、沐浴露、沐浴乳、防晒乳液、防晒霜、防晒膏、润肤露、护肤霜、防紫外线化妆品、洁面乳、脱发治疗剂(化妆品)、面部和身体乳液、面部和身体霜、美白霜、护手霜、洗发水、美容霜、茉莉油、沐浴皂、水皂、美容香皂、洗发水、洗手液、药用肥皂(非医疗用)、肥皂膏、洗面奶、身体清洁剂、头皮清洁剂、护发素、化妆皂、牙齿美白凝胶、牙膏等。为此,本发明的组合物可进一步包含通常用于制备化妆品组合物的溶剂,或合适的载体、赋形剂或稀释剂。
可以进一步添加到本发明的化妆品组合物中的溶剂的类型没有特别限制,例如,可以使用水、盐水、dmso或其组合。载体、赋形剂或稀释剂的示例包括纯净水、油、蜡、脂肪酸、脂肪醇、脂肪酸酯、表面活性剂、保湿剂、增稠剂、抗氧化剂、粘度稳定剂、螯合剂、缓冲剂和低级醇等,但是它们不限于此。此外,如果需要,它可含有增白剂、保湿剂、维生素、紫外线屏蔽剂、香料、染料、抗生素、抗菌剂和抗真菌剂。
作为油,可以使用氢化植物油、蓖麻油、棉籽油、橄榄油、棕榈油、霍霍巴油和鳄梨油。蜡的示例包括蜂蜡、鲸蜡、巴西棕榈蜡、小烛树蜡、褐煤蜡、地蜡、液体石蜡、羊毛脂。
作为脂肪酸,可以使用硬脂酸、亚油酸、亚麻酸和油酸。作为脂肪酸醇,可以使用鲸蜡醇、辛基十二烷醇、油醇、泛醇、羊毛脂醇、硬脂醇和十六烷醇。作为脂肪酸酯,可以使用肉豆蔻酸异丙酯、棕榈酸异丙酯和硬脂酸丁酯。作为表面活性剂,可以使用本领域已知的阳离子表面活性剂、阴离子表面活性剂和非离子表面活性剂,并且尽可能优选衍生自天然材料的表面活性剂。
另外,可以包括在化妆品领域中广为人知的吸湿剂、增稠剂、抗氧化剂等,其种类和量在本领域中是公知的
本发明还涉及预防或治疗nampt相关疾病的方法,该方法包括给予需要施用的受试者例如人施用药学上有效量的选自本发明的化学式1或化学式18所示化合物的化合物,或其药学上可接受的盐、光学异构体、水合物和溶剂合物的步骤。
在本发明中,nampt相关疾病为下组中的至少一种:癌症、病毒感染、人类免疫缺陷病毒、肝炎病毒、疱疹病毒、单纯疱疹、炎症性疾病、肠易激综合征、炎症性肠病、类风湿性关节炎、哮喘、慢性阻塞性肺病、骨关节炎、骨质疏松症、皮炎、特应性皮炎、银屑病、系统性红斑狼疮、多发性硬化、银屑病关节炎、强直性脊柱炎、移植物抗宿主病、阿尔茨海默病、脑血管意外、动脉粥样硬化、糖尿病、肾小球肾炎和代谢综合征,优选为癌症。
在本发明中,所述癌症为下组中的至少一种:肝癌、胆管癌、胆囊癌、食道癌、胃癌、卵巢癌、乳腺癌、子宫癌、结肠癌、直肠癌、宫颈癌、前列腺癌、皮肤癌、胰腺癌、白血病、淋巴瘤、霍奇金病、肺癌、支气管癌、多发性骨髓瘤、淋巴瘤、鳞状细胞癌、肾癌、尿道癌、膀胱癌、头颈癌、脑癌和中枢神经系统癌症,优选为肺癌或胃癌。
本发明中的“给药”是指以任何合适的方式向受试者提供本发明的某些化合物。
在本发明中需要给药的“受试者”可包括哺乳动物和非哺乳动物。这里,哺乳动物的示例包括人类、如黑猩猩的非人类灵长类动物,以及其他猿和猴子物种;如牛、马、绵羊、山羊、猪的牲畜;如兔子、狗和猫的饲养动物;如啮齿动物的实验动物,例如大鼠、小鼠和豚鼠等,但不限于此。此外,本发明中的非哺乳动物的示例包括鸟类和鱼类等,但不限于此。
如上所述被施用的化合物的制剂没有特别限制,可以以固体形式、液体制剂或用于抽吸的气溶胶制剂的形式给药,以及在使用前立即转化为用于口服或肠胃外给药的液体制剂的固体形式制剂,例如,口服制剂,如粉末、颗粒、胶囊、片剂、水悬浮液等,以及外用制剂、栓剂和无菌注射溶液形式的制剂,但不限于此。
此外,在本发明的给药中,药学上可接受的载体还可以与本发明的化合物一起给药。这里,药学上可接受的载体可以是用于口服给药的粘合剂、润滑剂、崩解剂、赋形剂、增溶剂、分散剂、稳定剂、悬浮剂、颜料、香料等,可以将缓冲剂、防腐剂、镇痛剂、增溶剂、等渗剂、稳定剂等混合并用于注射,并且可以使用碱、赋形剂、润滑剂、防腐剂等进行局部给药。本发明的化合物的制剂可以通过与如上所述的药学上可接受的载体混合以多种方式制备。例如,在口服给药的情况下,它可以以片剂、锭剂、胶囊、酏剂、悬浮液、糖浆、糯米纸囊剂等形式制备。可以以单位剂量安瓿或多剂量的形式制备注射剂。它可以配制成其他溶液、悬浮液、片剂、胶囊、缓释制剂等。
同时,适用于制剂的载体、赋形剂和稀释剂的示例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁或矿物油等。此外,它还可包括填料、抗凝剂、润滑剂、润湿剂、香料、乳化剂、防腐剂等。
本发明的药物组合物的给药途径可以是,但不限于,口服、静脉内、肌肉内、动脉内、髓内、硬膜内、心内、透皮、皮下、腹膜内、鼻内、肠、局部、舌下或直肠。口服或肠胃外给药是优选的。
在本发明中,“肠胃外”包括皮下、皮内、静脉内、肌肉内、关节内、滑膜内、胸骨内、硬膜内、病灶内和颅内注射或输注技术。本发明的药物组合物也可以栓剂的形式给药,用于直肠给药。
在本发明中,“药学有效量”是指足以提供所需生物学结果的试剂量。该结果可以指示疾病、症状或原因的减少和/或减轻,或生物系统中的任何其他期望的变化。例如,治疗用途的“有效量”是本发明公开的化合物的量,其需要提供临床上显著的疾病减少。在任何个别情况下,适当的“有效”量可以由本领域普通技术人员使用常规实验确定。因此,“有效量”的表达通常是指活性物质具有治疗效果的量。在本发明中,活性物质是烟酰胺磷酸核糖转移酶(nampt)形成抑制剂。
本发明的化合物可根据多种因素改变,包括所用特定化合物的活性、年龄、体重、一般健康状况、性别、饮食、给药时间、给药途径、排泄率、药物制剂和要预防或治疗的具体疾病的严重程度,化合物的剂量根据患者的状况、体重、疾病程度、药物种类、给药途径和时间周期而变化,但可以是由本领域技术人员适当选择,优选每天0.0001至50mg/kg或0.001至50mg/kg。给药可以每天进行一次或分成几次。剂量不以任何方式限制本发明的范围。本发明的药物组合物可以配制成丸剂、糖衣片剂、胶囊剂、溶液剂、凝胶剂、糖浆剂、浆液剂、悬浮剂。
本发明的化合物可单独使用或与使用手术、放射疗法、激素疗法、化学疗法和生物反应调节剂的方法组合使用。
以下,将基于如下合成实施例和实施例更详细地阐述本发明,但是本发明不限于此。
实施例
[制备实施例1]制备中间体1((4-(6-甲基苯并[d]恶唑-2-基)苯基)甲胺)
4-(氨基甲基)苯甲酸(1.99mmol)和6-氨基-m-甲酚(1.99mmol)溶于多磷酸(ppa,过量),并在200a酸下回流12小时。反应物溶于过量的蒸馏水中并将沉淀的盐过滤、真空干燥以及不经进一步纯化用于下一步。
[制备实施例2]制备中间体2((4-(6-氯苯并[d]恶唑-2-基)苯基)甲胺)
4-(氨基甲基)苯甲酸(1.32mmol)和2-氨基-5-氯苯酚(1.32mmol)溶于多磷酸(ppa,过量)并在200a酸下回流12小时。反应物溶于过量的蒸馏水中并将沉淀的盐过滤、真空干燥以及不经进一步纯化用于下一步。
[制备实施例3]制备中间体3(4-(萘并[2,3-d]恶唑-2-基)苯基)甲胺)
4-(氨基甲基)苯甲酸(1.32mmol)和3-氨基-2-萘酚(1.32mmol)溶于多磷酸(ppa,过量)并在200a酸下回流12小时。反应物溶于过量的蒸馏水中并将沉淀的盐过滤、真空干燥以及不经进一步纯化用于下一步。
[合成实施例1]制备n-(4-(6-甲基苯并[d]恶唑-2-基)苄基)烟酰胺
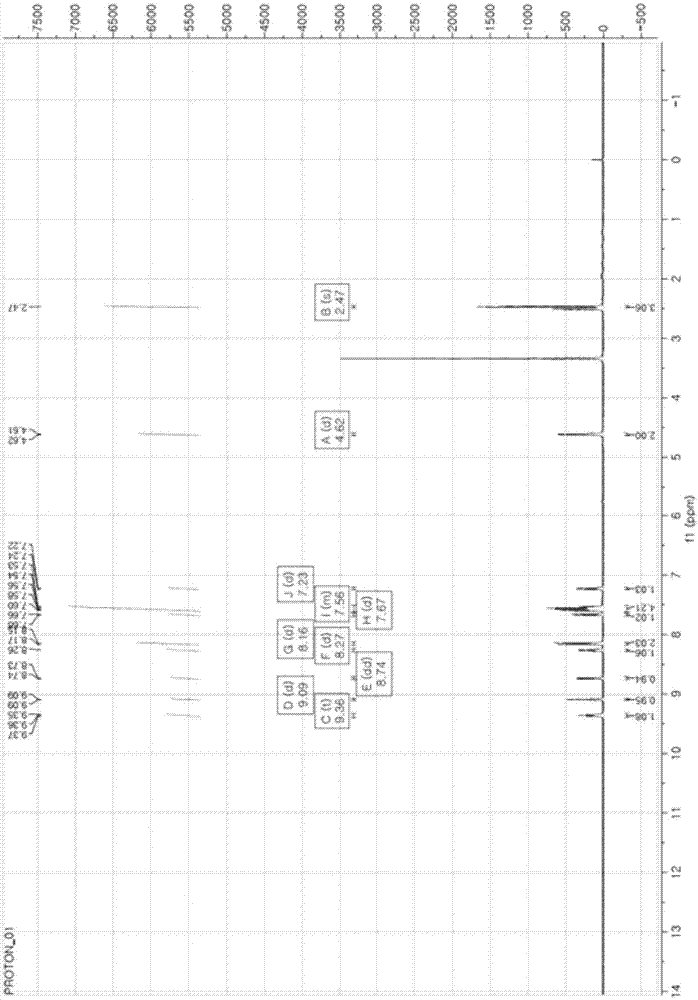
烟酸(1.06mmol),制备实施例1制备的(4-(6-甲基苯并[d]恶唑-2-基)苯基)甲氨(1.06mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,2.11mmol),hobt(1-羟基苯并三氮唑一水物,2.11mmol)和dipea(n,n-二异丙基乙胺,3.17mmol)溶于dmf(二甲基甲酰胺,4ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用二氯甲烷(mc)和环己烷(hx)处理得到白色固体。如上制备的n-(4-(6-甲基苯并[d]恶唑-2-基)苄基)烟酰胺(以下称为"a4276")的nmr谱图如图1所示。
1hnmr(400mhz,dmso-d6):δ9.36(t,j=5.6hz,1h),9.09(d,j=1.2hz,1h),8.74(dd,j=4.6,1.3hz,1h),8.27(d,j=8.0hz,1h),8.16(d,j=8.2hz,2h),7.67(d,j=8.1hz,1h),7.62-7.51(m,4h),7.23(d,j=8.0hz,1h),4.62(d,j=5.7hz,2h),2.47(s,3h).
[合成实施例2]制备n-(4-(6-氯苯并[d]恶唑-2-基)苄基)烟酰胺
烟酸(0.77mmol),制备实施例2制备的(4-(6-氯苯并[d]恶唑-2-基)苯基)-甲胺(0.77mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,1.54mmol),hobt(1-羟基苯并三氮唑一水物,1.54mmol)和dipea(n,n-二异丙基乙胺,2.31mmol)溶于dmf(二甲基甲酰胺,4ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用二氯甲烷(mc)和己烷(hx)处理得到白色固体(以下称为"a4266")。如上制备的n-(4-(6-氯苯并[d]恶唑-2-基)苄基)烟酰胺的nmr谱图如图2所示。
1hnmr(400mhz,dmso-d6):
δ9.37(t,j=5.6hz,1h),9.09(s,1h),8.74(d,j=4.0hz,1h),8.27(d,j=7.9hz,1h),8.17(d,j=8.1hz,2h),8.00(d,j=1.3hz,1h),7.82(d,j=8.5hz,1h),7.62-7.51(m,3h),7.47(d,j=8.5hz,1h),4.62(d,j=5.6hz,2h)。
[合成实施例3]制备n-(4-(萘并[2,3-d]恶唑-2-基)苄基)烟酰胺
烟酸(0.73mmol),制备实施例2制备的(4-(萘并[2,3-d]恶唑-2-基)苯基)甲胺(0.73mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,1.46mmol),hobt(1-羟基苯并三氮唑一水物,1.46mmol)和dipea(n,n-二异丙基乙胺,2.19mmol)溶于dmf(二甲基甲酰胺,4ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用二氯甲烷(mc)和己烷(hx)处理得到白色固体(以下称为"a4265")。如上制备的n-(4-(萘并[2,3-d]恶唑-2-基)苄基)烟酰胺的nmr谱图如图3所示。
1hnmr(400mhz,dmso-d6):
δ9.39(t,j=5.5hz,1h),9.10(s,1h),8.75(d,j=3.4hz,1h),8.34(s,1h),8.31-8.24(m,4h),8.09(t,j=8.6hz,2h),7.62(d,j=8.1hz,2h),7.58-7.49(m,3h),4.65(d,j=5.5hz,2h)。
[合成实施例4]制备n-(4-(恶唑并[4,5-c]吡啶-2-基)苄基)烟酰胺
烟酸(2.44mmol),(4-(萘并[2,3-d]恶唑-2-基)苯基)甲氨(2.44mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,4.87mmol),hobt(1-羟基苯并三氮唑一水物,4.87mmol)和dipea(n,n-二异丙基乙胺,7.31mmol)溶于dmf(二甲基甲酰胺,10ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用二氯甲烷(mc)和己烷(hx)处理得到白色固体(以下称为"b1471").如上制备的n-(4-(恶唑并[4,5-c]吡啶-2-基)苄基)烟酰胺的nmr谱图如图4所示。
1hnmr(400mhz,dmso-d6):δ9.39(t,1h,j=5.8hz),9.14-9.08(m,2h),8.74(dd,1h,j=4.8,1.5hz),8.60(d,1h,j=5.5hz),8.29-8.25(m,1h),8.22(d,2h,j=8.3hz),7.91(dd,1h,j=5.5,0.7hz),7.61(d,2h,j=8.3hz),7.55(dd,1h,j=7.9,4.9hz),4.63(d,2h,j=5.8hz)。
[合成实施例5至33]
[反应式3]
根据上述反应式3,如下表1的酸(2.44mmol)和胺(2.44mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,4.87mmol),hobt(1-羟基苯并三氮唑一水物,4.87mmol)和dipea(n,n-二异丙基乙胺,7.31mmol)溶于dmf(二甲基甲酰胺,10ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用快速柱层析纯化(含5%甲醇的二氯甲烷)并在真空泵中干燥得到如下表2所示的最终化合物。
[表1]
[表2]
[合成实施例33]制备n-(4-(5-乙基苯并[d]恶唑-2-基)苄基)烟酰胺
烟酸(2.44mmol),(4-(5-乙基苯并[d]恶唑-2-基)苯基)甲氨(2.44mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,4.87mmol),hobt(1-羟基苯并三氮唑一水物,4.87mmol)和dipea(n,n-二异丙基乙胺,7.31mmol)溶于dmf(二甲基甲酰胺,10ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用快速柱层析纯化(含5%甲醇的二氯甲烷)并在真空泵中干燥得到最终化合物(以下称为"药物3")。如上制备的n-(4-(5-乙基苯并[d]恶唑-2-基)苄基)烟酰胺的nmr谱图如图5所示。
[合成实施例34至39]
根据上述反应式3,如下表3的酸(2.44mmol)和胺(2.44mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,4.87mmol),hobt(1-羟基苯并三氮唑一水物,4.87mmol)和dipea(n,n-二异丙基乙胺,7.31mmol)溶于dmf(二甲基甲酰胺,10ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用快速柱层析纯化(含5%甲醇的二氯甲烷)并在真空泵中干燥得到如表4所示的最终化合物。
[表3]
[表4]
[合成实施例40至43]
[反应式4]
根据反应式4,(e)-3-(吡啶-3-基)丙烯酸(2.44mmol),下表5的胺(2.44mmol),edc(1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,4.87mmol),hobt(1-羟基苯并三氮唑一水物,4.87mmol)和dipea(n,n-二异丙基乙胺,7.31mmol)溶于dmf(二甲基甲酰胺,10ml)并室温下回流过夜。然后,将反应混合物转移至分液漏斗,接着加入nh4cl水溶液以及用ea(乙酸乙酯)萃取三次。萃取物用na2so4干燥并减压浓缩。反应残留物用快速柱层析纯化(含5%甲醇的二氯甲烷)然后在真空泵中干燥得到下表6所示的最终化合物.
[表5]
[表6]
[合成实施例44]制备b1386
如下化学式所示的n-甲基异烟酰胺和4-(亚氨基甲基)苯-1,3-二醇以重量比1:1混合.
n-甲基异烟酰胺
4-(亚氨甲基)苯-1,3-二醇
[合成实施例45]制备b1387
如下化学式所示的n-甲基异烟酰胺和4-氯-2-(亚氨基甲基)苯酚以重量比1:1混合.
n-甲基异烟酰胺
4-氯-2-(亚氨甲基)苯酚
[合成实施例46]制备b1467
如下化学式所示的n,4-二甲基苯甲酰胺和4-(亚氨基甲基)苯-1,3-二醇以重量比1:1混合.
n,4-二甲基苯酰胺
4-(亚氨基甲基)苯-1,3-二醇
[对比实施例1]制备n-[4-(1-苯甲酰-4-哌啶)丁基]-3-(3-吡啶基)-2e-丙烯酰胺
为了和本发明化合物的下列效果进行比较,制备如上化学式所示的且已知为nampt抑制剂的n-[4-(1-苯甲酰-4-哌啶)丁基]-3-(3-吡啶基)-2e-丙酰胺(以下称为"fk866").
[对比实施例2]制备n-(4-((3,5-二氟苯基)磺酰基)苄基)咪唑并[1,2-a]吡啶-6-甲酰胺
[评估实施例1]nampt抑制效果评价
测试了合成实施例1至4中制备的化合物和对比实施例1的fk866对nampt酶的底物降解速率(vmax/分)的影响。首先,在将烟酰胺合成为nad的步骤中,将nampt重组蛋白和底物prpp和烟酰胺以不同浓度加入到合成实施例1至4的化合物(a4276,a4266,a4265和b1471)和对比例1的化合物中,并在30℃下反应30分钟。利用通过生成的nad/nadh从wst-1到wst-1甲臜的转化,以5分钟的间隔测量450nm的od值,测量60分钟。使用cyclexnampt比色分析试剂盒(cy-1251)作为测量装置。结果如图6至图10所示。根据这些结果,计算vmax/分,结果如图11至图15。
如图6至图10所示,本发明合成实施例1至4的化合物显示出优异的nampt抑制活性,因此已知该化合物可有效地用于治疗由nampt引起的各种疾病,例如癌症、病毒感染、人类免疫缺陷病毒、肝炎病毒、疱疹病毒、单纯疱疹、炎症性疾病、肠易激综合征、炎症性肠病、类风湿性关节炎、哮喘、慢性阻塞性肺病、骨关节炎、骨质疏松症、皮炎、特应性皮炎、银屑病、系统性红斑狼疮、多发性硬化、银屑病关节炎、强直性脊柱炎、移植物抗宿主病、阿尔茨海默病、脑血管意外、动脉粥样硬化、糖尿病、肾小球肾炎和代谢综合征。
此外,对比例1的fk866在20nm显示出完全抑制能力,表明不可逆抑制。另一方面,证实nampt在4nm(浓度稀释5倍)时未被抑制。即发现fk866在窄浓度范围内对靶酶具有不可逆的抑制作用。相反,本发明的合成实施例1至4的化合物在宽的浓度范围内均显示出增强或增强的抑制能力,并且特别地,合成实施例1的化合物在75倍的浓度内增强或降低其抑制能力(图6),所有化合物在最大浓度下具有比fk866更高的斜率,表明可逆抑制更高。
如图11至图15所示,发现本发明的合成实施例1至4的化合物的nampt抑制的动力学性质通过诱导nad逐渐减少而有助于增加naprt表达的选择性。众所周知,这对于临床实践中安全范围的药物剂量的精确控制是有利的特征。
[评估实施例2]癌细胞系的治疗效果
用不同浓度的合成实施例1至4的化合物以不同浓度处理包括h322、h661、h1155、h1993、h1975、h2030、h1299、h2122和hbec30的各种癌细胞系,以根据浓度确定细胞系的存活能力,结果如图16至图19所示。
如图16至图19所示,合成实施例1至4的所有化合物对各种癌细胞系具有优异的治疗效果。在合成实施例1至4中,发现naprt阳性细胞系和阴性细胞系之间的ld50值差异为至少50到至多10,000倍。这表明与接近10倍差异的fk866相比,naprt阳性细胞和阴性癌细胞(包括正常细胞)之间的治疗窗口具有至少5倍到至多1,000倍更宽的宽度。
[评估实施例3]癌细胞系的治疗效果
用合成实施例1至46的化合物以各种浓度处理h322、h661、h1155、h1299、h1975、h2030、h2122和hbec30细胞系并测量ic50,结果如下表7所示。
[表7]
如表7所示,合成实施例1至46的化合物对所有癌细胞系显示出优异的治疗效果,特别是,在naprt表达为阴性的癌细胞中,治疗效果更优异。
[评价实施例4]癌细胞系中的毒性机制
为了研究本发明化合物对nampt酶的催化活性的直接影响,在用2.5化活合成实施例4的化合物处理h322细胞系后,测量细胞内nad,atp和总蛋白,结果如图20所示。
如图20所示,与阴性对照相比,本发明的合成实施例4的化合物显示出蛋白质总量的减少,特别是,作为nad和nad代谢物的atp的量显着减少。
结果,本发明的化合物抑制nampt及其生物合成产物,nad降低。
[评估实施例5]正常细胞系中的毒性评估
培养正常细胞系的原代心肌细胞(promocell#c-12810,心肌细胞),视网膜色素上皮细胞(lonza#194987,rpe),和肝细胞(thle-2),并通过蛋白质印迹使用细胞裂解物测量naprt和nampt的表达水平,结果显示在图21中。另外,用合成实施例1和2以及对比实施例例1的化合物处理心肌细胞,视网膜色素上皮细胞和肝细胞,并评价细胞活力。结果显示在图22至图24中。
如图21所示,正常细胞系通常表达naprt和nampt蛋白,因此预测它们对nampt抑制具有抗性。
如图22至图24所示,当以高浓度处理时,fk866在thle-2、心肌细胞和rpe细胞中表现出不可预测的细胞毒性,但证实本发明的合成实施例1和2的化合物不引起细胞毒性。
结果,本发明化合物仅对癌细胞显示出特异性杀伤作用,并且对正常细胞没有显示出毒性。
[评估实施例6]正常细胞系中的毒性评价
用合成实施例4,8和13以及对比实施例1和2的化合物处理正常肝细胞系thle-2和thle-3,并评价细胞活力。结果如图25和图26所示。
如图25和图26所示,fk866和gne617是有毒的,ic50值为约0.05,7,而本发明的合成实施例4,8和13的化合物即使在非常高的50合物浓度下也显示出很小的毒性。
结果发现,本发明化合物仅对癌细胞显示出特异性杀伤作用,并且对正常细胞没有显示出毒性。
[评估实施例7]微粒子稳定性评价
使用人肝微粒体和小鼠肝微粒体评估代谢稳定性。具体地,使用混合的雄性小鼠肝微粒体(按照sop的内部制备),混合的人肝微粒体(xenotech;批号no-h0630-1110189)。用1。用合成实施例1至3中制备的化合物(a4276,a4266或a4265)或对比实施例1的化合物(fk866),0.3mg/ml微粒体蛋白和辅因子在缓冲液中进行100蛋白反应,另外将混合物在不同时间点(0、15、30、45、60和90分钟)温育。加入含有相同体积内标乙腈(泰门厅(telmesartin))终止反应。通过离心除去沉淀的蛋白质,并通过lc/ms-ms方法分析上清液。反应30分钟后通过使用方程式分析量化剩余母体化合物的百分比,结果显示在下表8中。
残留%母体化合物=(时间x处的峰面积/to处的峰面积)×的峰面。
通过以下等式计算内在清除率。
[表8]
如表8所示,当本发明的合成实施例1至3的化合物被处理时,证实在人和小鼠肝微粒体的稳定性显着优于对比实施例1的fk866。
[评估实施例8]心脏毒性(herg)的评价
通过使用韩国化学技术研究所的高亲和力红色荧光herg通道配体示踪剂测量合成实施例1至3和e4031化合物(作为阳性对照)的荧光偏振来进行herg筛选。结果如下表9所示。然而,在该测试方法中,当10。然化合物的抑制率为至少50时,则它被认为是一个需要注意herg通道结合的物质。
另外,作为hergk+通道活性评价,通过使用膜片钳技术测量药物的电流抑制并评估ic50来评价根据所用剂量的logqt延长的潜在风险。结果如下表10所示。然而,通过膜片固定测试方法的hergk+通道的ic50值未在1000的最大浓度内测量。在该测试方法中,当hergk+通道的ic50值为至少10至少时,则判断其对心脏毒性是安全的。
[表9]
(然而,表9中的%抑制能力表示为平均值±标准差)
[表10]
如表9所示,确认本发明合成实施例1至3的所有化合物对由于蛋白结合引起的herg通道活性的抑制是安全的。
此外,如表10所示,本发明合成实施例1至3的所有化合物具有至少100合物的ic50,因而无心脏毒性。
[工业实用性]
本发明的化合物可用作烟酰胺磷酸核糖转移酶(nampt)抑制剂,进一步地,作为nampt疾病或癌症的治疗剂。
- 还没有人留言评论。精彩留言会获得点赞!